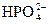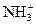Автоматическая система капиллярного электрофореза с функцией определения гликированного гемоглобина CAPILLARYS 2 FLEX PIERCING
Многофункциональная автоматизированная система капиллярного электрофореза Capillarys 2 Flex Piercing имеет 8 параллельно работающих капилляра, что обеспечивает производительность до 90 белковых фракций сыворотки в час. Входящий конвейер прибора рассчитан на 13 штативов, что с учетом рабочей зоны прибора обеспечивает одновременную загрузку до 112 пробирок и время автономной работы до 2 часов.
Capillarys 2 Flex Piercing — это новое поколение высокопроизводительных приборов серии Capillarys 2, позволяющее выполнять как рутинные электрофоретические исследования, так и количественное определение гликозилированного гемоглобина HbA1c.
Автоматизация «от и до». Работа на системе Capillarys 2 Flex Piercing полностью автоматизирована. Прибор последовательно и без помощи оператора осуществляет:
- Считывание штрих-кода с пробирки и/или штатива и отбор образца для анализа;
- Перемешивание и разведение образца;
- Аспирацию подготовленного образца в капилляры;
- Разделение и детекцию белков.
- Отображение готовой электрофореграммы, количественную оценку фракции и формирование отчета.
Калибровка, промывки и техническое обслуживание прибора максимально упрощены и также выполняются в полностью автоматическом режиме.
Автоматическое выключение прибора в конце рабочего дня, включает промывку и высушивание капилляров, что позволяет сохранить их в рабочем состоянии, даже при простое в работе до нескольких лет
Безупречное программное обеспечение. Простоту, удобство и неисчерпаемые возможности программного обеспечения Phoresis уже оценило свыше 400 пользователей по всей России.
Дружелюбный интерфейс; всесторонняя обработка, хранение и полная прослеживаемость результатов; русификация; возможность одно-/двустороннего подключения к ЛИС; неограниченный объем базы данных – это лишь малый перечень возможностей Phoresis.
Перечень тестов, доступных для анализа на приборе Capillarys 2 Flex Piercing:
- Анализ белковых фракций сыворотки крови и мочи;
- Анализ белковых фракций мочи;
- Иммунотипирование сыворотки крови;
- Иммунотипирование мочи;
- Анализ фракций гемоглобина (гемоглобинопатии);
- Оценка гликированного гемоглобина Hb A1c.
Технические характеристики
до 90 тестов в час при анализе белковых фракций; до 10 тестов в час при иммунотипировании; до 40 тестов в час при анализе Hb A1c
Идентификация пациента – считывание штрих-кода с первичной пробирки, считывание штрих-кода со штатива с пробирками
Идентификация реагентов – считывание штрих-кодов на контейнерах с реагентами/ контролями
Стартовая загрузка – до 104 пробирок, далее – постоянная дозагрузка штативов по 8 пробирок без прерывания цикла
Работа с первичной открытой или закрытой пробиркой (диаметр 13-16 мм, высота 75-100 мм)
Возможность работы с микропробиркой
Игла-пробоотборник для прокалывания крышек
Полностью автоматизирована, выполняется на борту прибора (включая разведение, инкубацию, перемешивание, лизис эритроцитов и пр.)
Шейкер для перемешивания проб цельной крови
Одновременная миграция восьми образцов в кварцевых капиллярах
Контроль температуры во время миграции – электронная система охлаждения (элемент Пельтье)
Мониторинг уровня расхода реагентов
Источник света – дейтериевая лампа
Градиентная система 200-600 нм
Ведение базы данных, содержащей неограниченное количество результатов
Вывод на экран миграционных кривых в реальном времени
Выделение нераспознанных кривых (цветом)
Отображение и просмотр кривой с широкими возможностями редактирования
Отображение состояния системы
Статистический анализ, поиск данных
Автоматическая детекция качественных и количественных аномалий
Наложение кривых (пациент/ контроль, пациент/пациент)
Формирование и печать протоколов и отчетов (неограниченные возможности)
Двунаправленное подключение к лабораторным информационным системам
Экспорт и импорт данных в удаленные лаборатории посредством модема, по электронной почте, по внутренней лабораторной компьютерной сети
База данных SQL «Клиент/ Сервер»: неограниченные возможности хранения данных по пациентам
источник
Электрофорез гемоглобина в щелочном геле позволяет определить процентное содержание основных изоформ гемоглобина и провести скрининг гемоглобинопатий. В норме в крови взрослого человека не менее 96,5 % гемоглобина представлено изоформой HbA, которая состоит из двух пар полипептидных цепей (глобинов): 2α и 2β, каждая из которых связана с гемом. Гемоглобинопатии связаны с наличием аномального варианта гемоглобина. Посредством электрофореза гемоглобина можно проводить скрининг состояний, связанных со структурными аномалиями гемоглобина. При этом метод не позволяет установить тип и характер гемоглобинопатии.
Синонимы английские
Serum Hemoglobin Electrophoresis.
Электрофорез и денситометрия.
Мг/дл (миллиграмм на децилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Электрофорез гемоглобина в щелочном геле позволяет определить процентное содержание основных изоформ гемоглобина и провести скрининг гемоглобинопатий. В норме в крови взрослого человека не менее 96,5 % гемоглобина представлено изоформой HbA, которая состоит из двух пар полипептидных цепей (глобинов) — 2α и 2β, — каждая из которых связана с гемом. HbA обеспечивает адекватный газообмен и тканевую оксигенацию. Фракция HbA2 — второстепенная форма гемоглобина, имеет формулу 2α2δ. Также у взрослого допустимо наличие следовых количеств фетального гемоглобина HbF (2α2γ), который является преобладающей фракцией в течение внутриутробного периода. В течение первых 6 месяцев жизни HbF замещается HbA.
Нарушения структуры гемоглобина обычно разделяют на две группы: гемоглобинопатии и талассемии, хотя талассемии являются формой гемоглобинопатии. Талассемии представляют собой нарушения синтеза α-, β- или обеих цепей гемоглобина. Также могут отмечаться нарушения синтеза δ-, γ- цепей. Большинство вариантов α- и β-талассемий сопровождается изменением уровня HbF и HbA2, поэтому определение этих изоформ может быть использовано для скрининга этих состояний.
Остальные гемоглобинопатии связаны с наличием аномального варианта гемоглобина. Наиболее распространённые и клинически значимые аномальные варианты гемоглобина: S, D, E, C. Варианты HbS и HbD — патологические формы гемоглобина, которые обладают идентичной миграцией в щелочном геле и являются результатом точечных мутаций гена, кодирующего β-глобин. Варианты Е и С при данном методе мигрируют в составе фракции HbA2, при их наличии фракция HbA2 достигает более 25 %. Наибольшее клиническое значение представляет HbS-вариант, который приводит к серповидноклеточной анемии.
Электрофорез гемоглобина в щелочном геле позволяет проводить скрининг состояний, связанных со структурными аномалиями гемоглобина. При этом метод не позволяет установить тип и характер гемоглобинопатии.
Электрофорез является чувствительным методом, с помощью которого можно исключить гемоглобинопатии либо определить тактику дальнейшего обследования для установления точного диагноза заболевания. Метод характеризуется высокой внутрипостановочной (SD Когда назначается исследование?
- Скрининг гемоглобинопатий;
- наличие семейного анамнеза гемоглобинопатий, планирование семьи;
- микроцитарная анемия, не связанная с дефицитом железа;
- гемолитическая анемия неустановленной этиологии;
- обнаружение изменённых эритроцитов (серповидная деформация) при микроскопическом исследовании крови.
- Тест обладает высокой достоверностью при скрининге β-талассемий, вариантов, приводящих к серповидноклеточной анемии, и синдромов персистенции фетального гемоглобина.
- При использовании данного метода может быть затруднена индентификация α+-талассемии (талассемия с одной мутацией).
источник
Принцип метода одинаков с заложенным в основу электрофоретического отделения сывороточных белков. В данном электрическом поле частицы, несущие определенную электрическую зарядку, перемещаются более или менее в зависимости от силы электрического поля, электрической зарядки, величины и формы молекулы.
Что касается гемоглобина основным фактором электрофоретического отделения является электрическая зарядка, поскольку форма и величина молекулы одинаковы для различных видов гемоглобина.
Электрофорез гемоглобина практикуется во всех используемых вариантах в отношении белков, в том числе, электрофорез на бумаге, в агаровом геле, в геле и блоке крахмала, в геле полиакриламида, на уксуснокислом целлюлозе. Каждая из этих разновидностей представляет свое преимущество, которое следует учитывать при выборе соответствующего метода.
Необходимая аппаратура — электрический источник питания и бак (ванна) для буфера; используемые материалы в качестве миграционной питательной среды почти полностью соответствуют применяемым для электрофореза сывороточных белков.
Электрофорез гемоглобина в блоке крахмала отличается рядом преимуществ, в силу которых ему отдается предпочтение при исследовании гемоглобинопатии. На этой питательной среде можно отделить почти все виды физиологического и патологического гемоглобина, даже когда он находится в малом концентрации. Не требует окраски. Промывание и количественная оценка осуществляются легко, используемый крахмал не требует специальной обработки, дешевый и побывается без затруднений.
Материалы для электрофореза гемоглобина в блоке крахмала: картофельный крахмал; аппарат для электрофореза, слагающийся из выпрямителя, бака для буфера и пластинки из плексигласса, на которую наносится крахмал; буфер веронал-мединал — 8,8 показатель водорода и 0,5 ионная мощность; веронал 1,84; мединал 10,8; лактат кальция 0,384; дистилированная вода до 1000 мл; 2% раствор цианистого натрия.
В стекляную или эмалированную посуду насыпать 150—200г крахмала и залить 300—400 мл дистилированной воды. Помешать, после осаждения крахмала слить воду и налить буфер веронал-мединал; хорошо перемешать и оставить 30—40 минут, в случае надобности можно сохранить на ночь в холодильнике. После гомогенизации приготовленный таким образом крахмал наносится на пластинку плексигласса, при этом слой его должен иметь 5 мм толщины.
Поскольку по краям пластинки имеется ободочек соответствующей толщины, крахмал не стекает с пластинки. Слой оседаемого крахмала однородный. Лишнее количество буфера удалить фильтровальной бумагой.
На одну пластинку крахмала можно нанести одновременно несколько проб для миграции, причем их число зависит от величины пластинки. Наносить их (по 2—3 капли) на расстоянии 4—5 см от края пластинки, между образцами оставлять расстояние 3—4 см.
До начала миграции гемолизаты обработать цианистым натрием в целях преобразования гемоглобина в цианметгемоглобин — весьма устойчивый вид. На 5—6 капель раствора гемоглобина добавить каплю 2% раствора цианистого натрия.
Пластинку спустить в бак, при этом пятна направляются в сторону отрицательных электродов; связь с буферным раствором наладить с помощью фильтровальной бумаги. Миграция происходит при напряжении 200 вольт, ампераж в зависимости от размеров пластинки с крахмалом и толщины слоя последнего. Время миграции 18—20 часов.
В описанных условиях проба гемоглобина от человека в норме мигрирует от отрицательного к положительному полюсу и делится на две фракции: основную (97—98%) на первом плане, представляющую собой гемоглобин А1, а позади, на расстоянии 3—4 см, вторую (2—3%), составляющую гемоглобин А2.
При таких условиях из крови пуповины также отделяются две фракции: одна из них составляет 30—40% — гемоглобин А1, вторая — гемоглобин Ф, расположенная между гемоглобином А1 и гемоглобином А2, на очень близком расстоянии от первого.
Количественное определение отделенных, путем электрофореза, фракций осуществляется промыванием а затем фотометрированием.
Отделенные пятна вырезать и каждый из них вложить в пробирку. В другой пробирке промыть участок чистого крахмала, соответствующего по величине площади, занимаемой гемоглобином А2, в качестве контрольного препарата для фотометрирования.
В каждую пробирку влить одинаковое количество буфера. Взболтать, гемоглобин переходит в раствор, в то время как крахмал оседает на дно пробирки. После оседания надосадочную массу профильтровать, процентрифугировать и прочитать результат с помощью фотометра или спектрофотометра с фильтром, соответствующим длине волны 540 нм. Значение данной фракции в процентном отношении выводится из суммы экстинкий, составляющей 100% экстинкций каждой фракции, деленной на общую экстинкцию.
Нормальные физиологические значения гемоглобина, полученные в подобных условиях, составляют 2—3% гемоглобина А2 и 97—98% гемоглобина А1.
Если подвергнуть электрофорезу раствор гемоглобина из крови больного с аномальным гемоглобином, то последняя, в зависимости от имеющейся в ней электрической зарядки, мигрирует медленнее или быстрее нормального гемоглобина, тем самым способствуя ее отделению и количественному определению.
Вливаемый в ванну буфер можно исплоьзовать несколько раз, при условии изменения направления тока после каждой миграции.
источник
Электрофорез гемоглобина (в щелочном растворе)
С ПОМОЩЬЮ РУЧНОЙ МЕТОДИКИ
Наборы Hellabio гемоглобин (в щелочи) используются для идентификации различных форм молекул гемоглобина (выделение гемоглобина в отдельные полосы HbA, HbF, HBS (HBG, HBD, Лепор) HbA2 (HBC, HBE и HBO)) и позволяют проводить лабораторную диагностику нормальных и патологических гемоглобинов, определяя состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии.
Каждый из основных типов гемоглобина имеет электрический заряд разной степени, поэтому наиболее эффективным методом разделения и измерения нормального и аномального гемоглобина является электрофорез.
В норме у взрослого человека 96.5-98.5% от общего гемоглобина приходится на HbA. Незначительную долю около 1.5-3,5% занимает HbA2. В период внутриутробного развития основным гемоглобином является HbF.
КЛИНИЧЕСКИЙ МАТЕРИАЛ, ХРАНЕНИЕ.
· Венозную кровь человека (забор производится натощак) поместить в пробирку с сахаром без антикоагулянта (оксалат, гепарин или ЭДТА, обработанная кровь);
Добавить около 100-200 мкл цельной крови в пробирку с 10 мл физиологического раствора, центрифугировать (5 минут при 3g) и удалить супернатант;
· Взять 30 мкл осадка и добавить в пробирку с 130 мкл гемолизирующего раствора, смешать (Гемолизат);
· Гемолизат стабилен в течении 5-7 дней. Хранить в холодильнике, соблюдать условия асептики, избегать попадания прямых солнечных лучей.
• Работать только в одноразовых перчатках — буфер токсичен.
• Все реагенты должны быть использованы в соответствии с инструкциями, и до истечения даты, указанной на наборе;
• Работа с уксусной кислотой требует наличия вытяжных шкафов;
• Не использовать агарозный гель, если он недостаточно просушен;
• Агарозный гель не замораживать;
• Хранить набор в горизонтальном положении;
• Не использовать гемолизированную сыворотку или плазму (фибриноген).
1. Источник питания 25-250B «Hellabio».
2. Камера для электрофореза «Hellabio».
3. Держатель геля «Hellabio».
4. Набор контейнеров для окрашивания /отмывки «Hellabio».
5. Сушительная камера геля «Hellabio».
6. Вортекс «Micro-Spin», «Minigen.
7. Компьютер, сканер, принтер.
8. Программное обеспечение HELLABIOSCAN GEL ANALYZER или денситометр (520 – 600нм).
9. Набор автоматических пипеток переменного объема.
10. Халат и одноразовые перчатки.
11. Одноразовые микропробирки на 1,5мл.
12. Штатив для микропробирок.
13. Одноразовые наконечники для пипеток переменного объема 5-40 мкм.
14. Емкость для хранения буфера объемом 1000мл.
15. Емкость для хранения окрашивающего раствора объемом 500 мл.
16. Мерный цилиндр объемом 1000 мл.
18. Емкость с дезинфицирующим раствором.
2. НЕОБХОДИМЫЕ реагенты и оборудование – содержаться в каждом наборе Hellabio.
Внимание! Для получения наилучших результатов реагенты, входящие в комплект, должны быть использованы вместе.
Содержимое наборов (необходимые реагенты):
Агарозные гели (Agarose Gels)
Электрофорезный буфер (Electrophoresis Bufffer)
Окрашивающий раствор (Staining Solution)
Фильтровальные полосы для геля (Gel Blotter Strips)
Гемолизирующий раствор (Hemolyzing Solution)
Шаблоны для образцов (Sample Templates)
Инструкция (Instruction) на русском и английском языках
Подготовка реактивов для проведения электрофореза:
Все реактивы фирмы Hellabio должны храниться при температуре 4-25°C до истечения даты, указанной на комплекте. Внимание: буфер токсичен, работать в перчатках.
1. Приготовление рабочего буфера: взять мерный цилиндр на 1000 мл.
2. Развести 40 мл концентрированного буфера(Protein Electrophoresis Buffer) в 960 мл дистиллированной воды.
3. Перелить рабочий буфер в подготовленную емкость и пометить дату, рабочий буфер хранится 3 месяца, с даты изготовления, при комнатной температуре в темном прохладном месте, в закрытой колбе.
4. Приготовление рабочего окрашивающего раствора: хорошо взболтать окрашивающий раствор (Protein Staining Solution).
5. Взять мерный цилиндр на 250 мл и смешать 210 мл 10% уксусной кислоты с 40 мл окрашивающего раствора (Protein Staining Solution).
6. Перелить рабочий раствор окрашивающего раствора в емкость для хранения. Расход окрашивающего раствора обеспечивает возможность постановки соответственно комплектации набора (10 пластинок).
7. В качестве отмывочного раствора будет использоваться 10% уксусная кислота.
· Венозную кровь человека (забор производится натощак) поместить в пробирку с сахаром без антикоагулянта (оксалат, гепарин или ЭДТА, обработанная кровь);
Добавить около 100-200 мкл цельной крови в пробирку с 10 мл физиологического раствора, центрифугировать (5 минут при 3g) и удалить супернатант;
· Взять 30 мкл осадка и добавить в пробирку с 130 мкл гемолизирующего раствора, смешать (Гемолизат);
· Гемолизат стабилен в течении 5-7 дней. Хранить в холодильнике, соблюдать условия асептики, избегать попадания прямых солнечных лучей.
1. Отобрать необходимое количество микропробирок, включая контроль. Приготовить гемолизат.
2. Заполнить электрофорезные камеры необходимым количеством рабочего буфера в зависимости от объема камеры;
3. Раскрыть упаковку агарозного геля. Используя одноразовый наконечник приподнять пластину агарозного геля (место обозначено стрелкой) и извлечь гель из упаковки. Положить в горизонтальном положении на крышку упаковки.
4. Извлечь фильтровальную полосу (Gel Blotter Strips) из упаковки. Промокнуть гель фильтровальной полосой в зоне нанесения образца (отмечено двумя точками на краях геля). Удалить фильтровальную полосу с агарозного геля.
5. Извлечь шаблон образцов из упаковки (Sample Tamplates). Установить шаблон для образцов в зоне нанесения. Провести указательным пальцем по шаблону, для усиления контакта шаблона с гелем и предотвращения попадания пузырьков воздуха в лунку для образца.
6. В каждую лунку шаблона образцов внести по 5мкл гемолизата и оставить на 20-30сек (не более!).
7. Взять фильтровальную полосу. Промокнуть шаблон образцов фильтровальной полосой. Удалить шаблон образцов и фильтровальную полосу с поверхности геля.
8. Установить гель в гелевый держатель. Опустить гелевый держатель в элекрофорезную камеру. Образцы находятся на катодной стороне.
9. Подключить камеру к источнику тока, соблюдая полярность. При использывании камеры и источника питания «Hellabio» параметры следущие : напряжение напряжение 200 В, время электрофореза 20 минут (в случае использования мини гелей, на 3 лунки — 18 мин/200 В).
10. Отключить источник питания от электрофорезной камеры. Извлечь гель из гелевого держателя.
11. Поместить гель в сушильную камеру (температура 60°С). Высушить гель полностью (отсутствуют пятна на пластине геля).
12. Заполнить один контейнер рабочим окрашивающим раствором, три контейнера 10% уксусной кислотой.
13. Поместить высушенную гелевую пленку в контейнер для окрашивания на 5 минут.
14. Извлечь окрашенную гелевую пленку. Промыть пленку по 5 минут в 3-х контейнерах для промывки.
15. Поместить гель в сушильную камеру (температура 60°С). Просушить гелевую пластину.
16. Перенести гель в сканер. Получить изображение геля и оценить результаты в программе HellabioScan или используя фильтр денситометра 580 нм.
Предполагаемые показатели нормы: HbA: 96.5-98.5%, HbA2 1.5-3.5%
Коэффициент отклонения значений не превышает 5%.
Гемолизат известного гемоглобина или коммерчески доступный гемолизат контроля качества должен быть включен в каждую процедуру электрофореза.
Качественная интерпретация результатов может быть произведена визуально путем сравнения образца с шаблоном. Для количественной интерпретации результатов используют программу HellabioScan или денситометр (580нм)
Оценку электрофореграмм при гемоглобинопатиях можно легко сделать визуально. Для количественного анализа должен быть использован денситометр (580нм).
МОДЕЛИ ЭЛЕКТРОФОРЕЗА НА АГАРОЗНЫХ ГЕЛЯХ HELLABIO
Электрофорез гемоглобина в щелочи:

Электрофорез гемоглобина в кислоте:
(Дифференциация HbS от HbG, D,Lep.) 1= HbS

Электрофорез гемоглобина в щелочи:
Примечание: чтобы определить вид нетипичного гемоглобина (HbC, HbS, HbD, HbE, Lepore), нужно использовать электрофорез гемоглобина в кислой среде.
источник
Тест на электрофорез в гемоглобине — это анализ крови, используемый для измерения и идентификации различных типов гемоглобина в вашем кровотоке. Гемоглобин — это белок внутри эритроцитов, ответственный за транспортировку кислорода в ваши ткани и органы.
Генетические мутации могут привести к тому, что ваше тело вырабатывает гемоглобин, который образуется некорректно. Этот аномальный гемоглобин может вызвать слишком мало кислорода для достижения ваших тканей и органов.
Существуют сотни различных типов гемоглобина. Они включают:
- Гемоглобин F: Это также известно как фетальный гемоглобин. Это тип, который встречается у растущих плодов и новорожденных. Он заменен гемоглобином вскоре после рождения.
- Гемоглобин A: Это также известно как взрослый гемоглобин. Это самый распространенный тип гемоглобина. Он встречается у здоровых детей и взрослых.
- Гемоглобин C, D, E, M и S: Это редкие типы аномального гемоглобина, вызванные генетическими мутациями.
Диаграмма нормальных уровней
Тест на электрофорез в гемоглобине не говорит вам о количестве гемоглобина в крови — это делается при полном анализе крови. Уровни, на которые ссылается тест на электрофорез в гемоглобине, — это проценты различных типов гемоглобина, которые могут быть найдены в вашей крови. Это различно у младенцев и взрослых:
Гемоглобин в основном состоит из гемоглобина F у плодов. Гемоглобин F по-прежнему составляет большинство гемоглобина у новорожденных.
| Возраст | Гемоглобин F% |
| новорожденный | от 60 до 80% |
| 1+ год | от 1 до 2% |
Нормальные уровни типов гемоглобина у взрослых:
| Тип гемоглобина | Процент |
| гемоглобин A | 95% до 98% |
| гемоглобин A2 | 2% до 3% |
| гемоглобин F | 1% до 2% |
| гемоглобин S | 0% |
| гемоглобин C | 0% |
Реклама
Вы приобретаете различные аномальные типы гемоглобина, наследуя мутации генов на гены, ответственные за продуцирование гемоглобина. Ваш врач может рекомендовать тест на электрофорез в гемоглобине, чтобы определить, есть ли у вас расстройство, вызывающее появление аномального гемоглобина. Причины, по которым ваш врач может захотеть провести тест на электрофорез в гемоглобине, включают:
1. В рамках обычной проверки: Ваш врач может проверить ваш гемоглобин, чтобы пройти полный анализ крови во время обычного физического состояния.
2. Чтобы диагностировать расстройства крови: Возможно, у вашего врача есть тест на электрофорез в гемоглобине, если вы проявляете симптомы анемии.Тест поможет им найти любые ненормальные типы гемоглобина в крови. Это может быть признаком расстройств, включая:
- серповидноклеточная анемия
- талассемия
- полицитемия vera
3. Чтобы контролировать лечение: Если вас лечат от состояния, вызывающего ненормальные типы гемоглобина, ваш врач будет контролировать ваши уровни различных типов гемоглобина с помощью электрофореза на гемоглобине.
4. Для скрининга на генетические условия: Люди, у которых есть семейная история унаследованных анемий, таких как талассемия или серповидноклеточная анемия, могут выбрать для скрининга этих генетических заболеваний до рождения детей. Электрофорез гемоглобина будет указывать, имеются ли какие-либо ненормальные типы гемоглобина, вызванные генетическими нарушениями. Новорожденных также регулярно скринируют на эти генетические нарушения гемоглобина. Ваш врач может также захотеть проверить вашего ребенка, если у вас есть семейная история аномального гемоглобина или у них есть анемия, которая не вызвана дефицитом железа.
Вам не нужно делать что-либо особенное для подготовки к электрофорезу гемоглобина.
Вам, как правило, нужно пойти в лабораторию, чтобы получить вашу кровь. В лаборатории поставщик медицинских услуг берет образец крови из руки или руки: сначала они очищают сайт мазкой спиртов. Затем они вставляют маленькую иглу с трубкой, прикрепленной для сбора крови. Когда набирается достаточное количество крови, они удаляют иглу и закрывают сайт марлевой подушкой. Затем они отправляют ваш образец крови в лабораторию для анализа.
В лаборатории процесс, называемый электрофорезом, пропускает электрический ток через гемоглобин в вашем образце крови. Это приводит к разложению различных типов гемоглобина в разные полосы. Затем ваш образец крови сравнивают со здоровым образцом, чтобы определить, какие типы гемоглобина присутствуют.
Как и при любом анализе крови, существуют минимальные риски. К ним относятся:
- кровоподтеки
- кровотечение
- инфекция на месте прокола
В редких случаях вены могут набухать после того, как кровь нарисована. Это состояние, известное как флебит, можно обрабатывать теплым компрессом несколько раз в день. Постоянное кровотечение может быть проблемой, если у вас расстройство кровотечения или вы принимаете кровоточащие лекарства, такие как варфарин (кумадин) или аспирин (буферин).
Результаты и следующие шаги
Если ваши результаты показывают аномальные уровни гемоглобина, они могут быть вызваны:
- заболеванием гемоглобина С, генетическим расстройством, которое приводит к тяжелая анемия
- редкая гемоглобинопатия, группа генетических нарушений, вызывающих аномальное производство или структура красных кровяных телец
- анемия серповидно-клеточной анемии
- талассемия
Ваш врач будет проводить контрольные тесты, если тесты на электрофорез в гемоглобине показывают что у вас ненормальные типы гемоглобина.
источник
Электрофорез гемоглобина — это диагностический метод, который направлен на определение различных типов гемоглобина, которые могут быть обнаружены в крови. Гемоглобин или Hb представляет собой белок, присутствующий в красных кровяных клетках, ответственных за связывание с кислородом, что позволяет переносить их в ткани. Узнайте больше о гемоглобине.
Из идентификации типа гемоглобина можно проверить, имеет ли человек какое-либо заболевание, связанное с синтезом гемоглобина, например, талассемию или серповидноклеточную анемию. Однако для подтверждения диагноза требуются другие гематологические и биохимические тесты.
Электрофорез гемоглобина необходим для выявления структурных и функциональных изменений, связанных с синтезом гемоглобина. Таким образом, врач может рекомендовать диагностировать серповидноклеточную анемию, заболевание гемоглобином С и дифференцировать талассемию, например.
Кроме того, может быть предложено генетически посоветовать пары, которые хотели иметь детей, например, сообщая, есть ли вероятность того, что у ребенка есть какой-то тип расстройства крови, связанный с синтезом гемоглобина. Электрофорез гемоглобина также может быть запрошен как обычное последующее обследование для пациентов, уже диагностированных с различными типами гемоглобина.
В случае новорожденных детей тип гемоглобина идентифицируется с помощью теста на ногу, что важно, например, для диагностики анемии серповидноклеточных клеток. Посмотрите, какие заболевания обнаруживаются при проверке стопы.
Электрофорез гемоглобина осуществляется путем сбора образца крови обученным специалистом в специализированной лаборатории, поскольку неправильный сбор может привести к гемолизу, то есть уничтожению красных кровяных телец, что может повлиять на результат. Поймите, как производится сбор крови.
Сбор должен проводиться с пациентом, голодающим в течение не менее 4 часов, и образец, указанный для лабораторного анализа, в котором идентифицируются типы гемоглобина, присутствующие в пациенте. В некоторых лабораториях нет необходимости поститься для сбора. Поэтому важно получить рекомендации от лаборатории и врача относительно поста для теста.
Тип гемоглобина идентифицируется электрофорезом при щелочном рН (около 8, 0 — 9, 0), что является методом, основанным на скорости миграции молекулы при подаче электрического тока, с визуализацией полос в зависимости от размера и веса молекулы. Согласно образцу полученных полос, проводится сравнение с нормальным стандартом и, таким образом, производится идентификация аномальных гемоглобинов.
В соответствии с моделью представленных полос можно идентифицировать тип гемоглобина пациента. Гемоглобин A1 (HbA1) имеет более высокую молекулярную массу, при этом отмечается меньшая миграция, тогда как HbA2 легче, глубже в геле. Этот образец полос интерпретируется в лаборатории и высвобождается в виде отчета для врача и пациента, информирующего о найденном типе гемоглобина.
Фетальный гемоглобин (HbF) присутствует при более высоких концентрациях у ребенка, однако, по мере развития, концентрации HbF снижаются, а HbA1 увеличивается. Таким образом, концентрации каждого типа гемоглобина изменяются в зависимости от возраста и обычно:
| Тип гемоглобина | Нормальное значение |
| HbF | |
| HbA1c | Равен или выше 95% |
| HbA2 | От 1, 5 до 3, 5% |
Тем не менее, некоторые люди имеют структурные или функциональные изменения, связанные с синтезом гемоглобина, что приводит к аномальным гемоглобинам или вариантам, таким как HbS, HbC, HbH и Bbs Hb.
Таким образом, из электрофореза гемоглобинов можно идентифицировать наличие аномальных гемоглобинов, и с помощью другого диагностического метода, называемого ВЭЖХ, можно проверить концентрацию нормальных и аномальных гемоглобинов, что может быть показателем:
| Результат гемоглобина | Диагностическая гипотеза |
| Наличие HbSS | Серповидноклеточная анемия, которая характеризуется изменением формата гемоцитов из-за мутации в бета-цепи гемоглобина. Знать симптомы серповидноклеточной анемии. |
| Наличие HbAS | Сердечная клеточная черта, в которой человек несет ген, ответственный за серповидноклеточную анемию, но не имеет симптомов, но может передавать этот ген другим поколениям: |
| Наличие HbC | Показатель заболевания гемоглобином С, в котором кристаллы HbC можно наблюдать в мазке крови, особенно когда пациент HbCC, в котором человек имеет переменную гемолитическую анемию. |
| Присутствие Hb de Barts | |
| Наличие HbH | Показатель заболеваемости гемоглобином H, который характеризуется осаждением и внесосудистым гемолизом. |
В случае диагноза анемии с серповидно-клеточной анестезией с помощью теста на ногу нормальный результат — HbFA (т.е. у ребенка есть как HbA, так и HbF, что является нормальным), тогда как результаты HbFAS и HbFS указывают на характер клеток серпа и серповидноклеточная анемия соответственно.
Дифференциальный диагноз талассемии также может быть сделан с помощью ВЭЖХ-связанного гемоглобинового электрофореза, где они проверяются в концентрациях альфа-, бета-, дельта-и гамма-цепей, проверяя отсутствие или частичное присутствие этих глобиновых цепей и, согласно определить тип талассемии. Узнайте, как определить талассемию.
Чтобы подтвердить диагноз любого заболевания, связанного с гемоглобином, необходимо заказать другие тесты, такие как дозировка железа, ферритин, трансферрин и полный анализ крови. Вот как интерпретировать счет крови.
источник
| Вид гемоглобина | Нормальные значения | Возможные изменения при серповидноклеточной анемии |
| HbA | Более 95%. | Менее 50%. |
| HbA2 | Менее 2%. | В норме или снижено. |
| HbF | 1 – 1,5 %. | В норме или слегка повышено. |
| HbS | Отсутствует. | 50% и более. |
При серповидноклеточной анемии метод УЗИ может выявить:
- увеличение селезенки и печени;
- наличие инфарктов во внутренних органах (в селезенке, печени, почках и других);
- нарушение кровообращения во внутренних органах;
- нарушение кровотока в конечностях.
Рентгенологическое исследование позволяет выявить:
- деформацию и расширение тел позвонков ;
- деформацию и истончение костей скелета
- наличие остеомиелита
Основные методы лечения серповидно-клеточной анемии направлены на снятие симптоматики (то есть, лечение является симптоматичным) и лечение сопутствующих или фоновых заболеваний. Симптоматика при острых кризах блокируется с помощью антибиотиков и гидратации (вливания жидкости). В более запущенных состояниях применяются обезболивающие препараты, кислород.
Принципами лечения серповидноклеточной анемии являются:
- правильный образ жизни;
- повышение количества эритроцитов и гемоглобина;
- кислородотерапия;
- устранение болевого синдрома;
- устранение избытка железа в организме;
- профилактика и лечение инфекционных заболеваний.
Образ жизни пациентов с серповидноклеточной анемией
Если у человека диагностирована серповидноклеточная анемия, ему следует соблюдать определенные рекомендации, которые позволят облегчить течение заболевания и минимизировать риск развития осложнений.
Пациентам с серповидноклеточной анемией рекомендуется:
- проживать на высоте не более 1500 метров над уровнем моря;
- проживать в зоне с умеренным климатом (исключающим воздействие экстремально низких или высоких температур);
- употреблять не менее 1,5 литров жидкости ежедневно;
- исключить прием алкогольных напитков и наркотиков;
- отказаться от курения (как самому больному человеку, так и членам его семьи);
- избегать тяжелых физических нагрузок;
- выбирать профессию, не связанную с тяжелой физической работой или воздействием высоких/низких температур.
Соблюдение перечисленных выше правил может предотвратить появление любых симптомов серповидноклеточной анемии у людей с гетерозиготной формой заболевания, однако пациентам с гомозиготной формой требуются и другие лечебные мероприятия.
Повышение количества эритроцитов и гемоглобина
Одним из основных факторов, определяющих тяжесть течения заболевания, является анемия (недостаток эритроцитов и гемоглобина в крови), развивающаяся на фоне усиленного разрушения красных клеток крови. Устранение анемии может предотвратить появление определенных симптомов заболевания и улучшить состояние пациента в целом.
Повышение количества эритроцитов и уровня гемоглобина
| Название препарата | Механизм леченого действия | |||||
| Эритроцитарная масса | Перелитые донорские эритроциты в течение некоторого времени (обычно не более 100 дней) могут транспортировать дыхательные газы в организме больного. Данный метод используется крайне редко, ввиду возможности развития тяжелых побочных реакций. | Критериями эффективности лечения являются:
| ||||
| Медикаментозные методы Препарат из группы цитостатиков (используется в лечении опухолей). Механизм действия данного медикамента связан с повышением уровня фетального гемоглобина (HbF) в эритроцитах. Это облегчает течение заболевания и предотвращает развитие многих осложнений. Применение гидроксимочевины в лечении серповидноклеточной анемии считается экспериментальной методикой. Широкомасштабных исследований, оценивающих эффективность препарата и возможные побочные реакции, еще не проводилось. | Начальная доза препарата составляет 15 миллиграмм на килограмм массы тела в сутки (мг/кг/сут). При отсутствии эффекта доза может быть увеличена в два раза. Во время лечения следует раз в 2 недели сдавать общий анализ крови, так как возможно развитие побочных реакций, наиболее опасной из которых является угнетение кроветворения в красном костном мозге. | Основным показателем эффективности лечения является увеличение концентрации фетального гемоглобина, определяемое методом электрофореза. Обычно доля HbF не превышает 20 – 25%, однако этого достаточно, чтобы значительно облегчить течение тяжелых форм заболевания. | ||||
Кислородотерапия
Частота и выраженность гемолитических кризов определяет тяжесть клинического течения серповидноклеточной анемии. Как уже говорилось, развитию гемолитического криза предшествуют различные состояния, сопровождающиеся гипоксией. Применение кислорода в первые минуты или часы после начала гемолиза предотвращает образование и последующее разрушение серповидных эритроцитов. Это облегчает течение заболевания, уменьшает риск развития осложнений и улучшает качество жизни пациента.
Пациент с развивающимся гемолитическим кризом должен быть госпитализирован как можно скорее. Непосредственно в машине скорой помощи ему дается кислородная маска, которая обеспечивает подачу кислорода со скоростью 4 – 6 литров в минуту. После поступления в стационар кислородотерапия продолжается на протяжении нескольких часов или дней.
Устранение болевого синдрома
Как говорилось ранее, закупорка кровеносных сосудов приводит к развитию ишемии пораженного органа, что сопровождается сильнейшей болью. С целью устранения болевого синдрома применяются наркотические анальгетики (обезболивающие средства), так как ишемические боли не купируются другими медикаментами. Вначале препараты вводятся внутривенно (быстрее наступает обезболивающий эффект). После купирования острого приступа боли переходят на таблетированные формы препаратов.
Дата добавления: 2018-04-15 ; просмотров: 794 ; ЗАКАЗАТЬ РАБОТУ
источник
Самая мощная буферная система. На ее долю приходится 75% всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислоты.
Состав гемоглобинового буфера можно выразить так:
Гемоглобиновая буферная система состоит из HHb гемоглобина, который является слабой кислотой и его калиевой соли — 
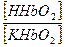
Системы гемоглобина и оксигемоглобина взаимопревращающиеся системы и работают как единое целое.
При насыщении гемоглобина кислородом гемоглобин становится более сильной кислотой – HНbО2 и увеличивает отдачу в раствор ионов водорода.
В капиллярах легких, гемоглобин присоединяет кислород и превращается в оксигемоглобин:
HHb + О2
Образование оксигемоглобина приводит к некоторому подкислению крови, вытеснению части угольной кислоты из бикарбонатов:
HНbО2 + КНСО3
Щелочной резерв крови понижается.
В периферических капиллярах большого круга кровообращения калиевая соль оксигемоглобина диссоциирует и гемоглобин эритроцитов отдает кислород тканям:
КНbО2
В результате способность гемоглобина связывать ионы водорода увеличивается. Одновременно в эритроциты поступает углекислый газ. Под влиянием фермента карбангидразы углекислый газ взаимодействует с водой с образованием угольной кислоты:
СО2 + Н2О 
За счет угольной кислоты возникает избыток ионов водорода, который связывается с калиевой солью гемоглобина, отдавшей кислород:
КbHb + Н2СО3

В результате этого процесса накапливаются анионы 

| Ткани | Легкие |
КНbO2 КHb + О2 СО2 + Н2О КHb + О2 СО2 + Н2О  Н2СО3 КНb + Н2СО3 Н2СО3 КНb + Н2СО3 ННb + КНСО3 ННb + КНСО3 плазма плазма | ННb+O2 НHbО2 ННbО2 + КНСО3 НHbО2 ННbО2 + КНСО3  КНbО2 + Н2СО3 КНbО2 + Н2СО3 |
Взаимодействие буферных систем и физиологических механизмов в регуляции КЩР.
Кислые продукты нейтрализуются бикарбонатной и гемоглобиновой системами. Буферные основания 
Роль почек в регуляции КЩР.
В клетках эпителия почечных канальцев из СО2 и Н2О под действием карбоангидразы образуется угольная кислота, которая диссоциирует на ионы Н + и


Судьба ионов Н + , попавших в мочу.
1. Н + + 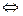
2. Н + + 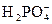
3. Н + + 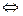
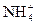

Ионы 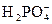
 Нарушения КЩР Нарушения КЩР  | |
| Ацидоз | Алкалоз |
Метаболический ацидоз – много кислых продуктов (кетоновые тела, лактат, пируват). Наблюдается при голодании, диабете, лихорадке, нарушении кровообращения, поражении почек.
Респираторный (газовый) ацидоз наблюдается при заболеваниях легких (бронхиты, пневмонии), недостаток кровообращения.
1. Компенсаторный, рН в N, но меняются другие показатели КЩР.
2. Декомпенсированный – ацидотическая кома.
Алкалоз – состояние дефицита ионов водорода в крови.
Метаболический алкалоз – дефицит ионов Н + в крови, сочетается со снижением содержания ионов К + в крови.
Компенсация метаболического алкалоза осуществляется дыхательным и почечным путем (снижение вентиляции с повышением СО2 и увеличением экскреции бикарбоната почками).
Причины: дефицит калия, понос, рвота, инфекции ЖКТ, длительное введение стероидных гормонов. Бывает компенсированный и реже декомпенсированный.
Дыхательный алкалоз – избыточное выведение Н2СО3. возникает при быстром удалении СО2 и сопровождается развитием гипокапнии (понижение парциального давления СО2 в артериальной крови – менее 35 мм рт. столба).дыхательный алкалоз наблюдается при вдыхании чистого кислорода, при подъеме на высоту, при компенсаторной одышке.
  Нарушения обмена белков плазмы крови Нарушения обмена белков плазмы крови   | |||
Гипопротеинемия  Уменьшение общего содержания белков в сыворотке крови Уменьшение общего содержания белков в сыворотке крови | Гиперпротеинемия  Увеличение общего содержания белков в сыворотке крови Увеличение общего содержания белков в сыворотке крови | Диспротеинемия  Изменение соотношения между отдельными фракциями Изменение соотношения между отдельными фракциями | Парапротеинемия  Появление при ряде заболеваний белков, отсутствующих в крови здоровых людей Появление при ряде заболеваний белков, отсутствующих в крови здоровых людей |
Причины гипопротеинемий
Задержка воды в организме при отеках на почве цирроза печени, потеря белков с мочой при нефритах, угнетение синтеза белков (при длительных инфекционных заболеваниях, при раковой кахексии, при голодании).
Причины гиперпротеинемий
Потеря больших количеств воды при диарее, неукротимой рвоте, тяжелых травмах ожогах. Это относительная гиперпротеинемия. Абсолютная гиперпротеинемия обусловлена резким нарастанием иммуноглобулинов и патологических белков. (миеломная болезнь).
Строение молекулы Ig.
Молекула Ig состоит из 4 полипептидных цепей: 2 тяжелых – Н-цепи и 2 легких – L-цепи. Легкие и тяжелые цепи соединены дисульфидными мостиками. Легкие цепи Ig бывают 2 видов: каппа и лямбда. Тяжелые цепи определяют специфичность Ig и различаются по аминокислотному составу. Различают 5 типов тяжелых цепей: IgG – 


Для связывания АГ на молекуле Ig имеются активные центры.
А.ц. образован V-участками легкой и тяжелой цепи. Разрыв S-S между цепями приводит к исчезновению активных центров. На молекуле Ig два активных центра, т.е. Ig бивалентны.
А.ц. – щель, которая комплементарна молекуле АГ. Комплементарность стереоспецифическая и электрохимическая.
В молекуле Ig имеется шарнирный участок – это середина Н-цепей. Шарнирный участок не имеет вторичной структуры, здесь находится пролин и молекула Ig делает изгиб, что обеспечивает приспособление Ig к взаимодействию с АГ. Вторичная структура Ig представлена 
Ig расщепляются протеолитическими ферментами: папаином и пепсином.
Папаин расщепляет молекулу Ig в шарнирной области на 3 фрагмента: 2 Fab и Fc-фрагмент. Fab-фрагмент имеет активный центр и это обеспечивает его связывание с АГ, происходит образование комплекса АГ-АТ.
Fc-фрагмент выполняет эффекторную функцию: обеспечивает прохождение через плаценту, прохождение через мембрану клеток, обеспечивает фиксацию иммуноглобулинов на поверхности собственных клеток, связывает комплемент, который способен лизировать клетку.
IgG составляет 70-75% общего количества иммуноглобулинов. Концентрация IgG в сыворотке достигает нормы к 7-летнему возрасту. Повышенная концентрация IgG наблюдается при инфекциях, при болезнях печени.
Пониженная концентрация IgG наблюдается у новорожденных, при недостаточности гуморального иммунитета.
IgG – единственный иммуноглобулин, проникающий через плаценту; благодаря этому плод получает материнские антитела.
IgM представляет собой пентамер молекулы IgG. Пять молекул, аналогичных IgG, соединены между собой полипептидной цепью J. IgM лучше, чем другие связывает комплемент. IgM синтезируется в ответ на большинство антигенов у детей первого года жизни. Обнаружение у плода антител класса М указывает на внутриматочную инфекцию.
IgA сывороточный иммуноглобулин А бывает в разных формах: обычной, димерной и трехмерной. IgA, которые выходят из кровяного русла через слизистые оболочки в просвет дыхательных путей, помимо J-цепи, имеют секреторный компонент – SC. SC-структура защищает IgA от разрушающего действия ферментов, находящихся в скретах слизистых оболочек. Содержание IgA достигает нормы к 10 годам. IgA – типичный иммуноглобулин слизистых оболочек. Функция IgA – защита слизистых оболочек от инфекций.
IgE – содержится в крови в низких концентрациях. IgE обладает высокой цитофильностью, т.е. способностью присоединяться к тучным клеткам и базофилам. Присоединение антигена к IgE, находящаяся на этих клетках, приводит к выделению гистамина и это вызывает развитие реакций гиперчувствительности немедленного типа (аллергических реакций).
IgD – не связывает комплемент, не проходит через плаценту, не связывается с тканями. Биологическая функция не ясна; вероятно, он служит рецептором В-лимфоцитов.
Динамика выработки антител.
IgM являются антителами первичного иммунного ответа. Через несколько дней происходит переключение синтеза IgM на IgG. При вторичном ответе сразу синтезируются IgG.
Материнские IgG с периодом полураспада 25 дней проникающие в кровь плода через плаценту, обеспечивают пассивный иммунитет новорожденных, к 3 месяцу из содержание уменьшается вдвое.
Синтез собственных IgM осуществляется плодом с 5 недели внутриутробного развития.
Катаболизм Ig
Период полураспада антител зависит от интенсивности обменных процессов и возраста, у новорожденных это 30-35 дней, затем этот срок сокращается.
Ig разрушаются под влиянием тканевых катепсинов на Fc и 2 Fab-фрагмента, небольшое количество около 10% IgG выводится в свободном виде, активный центр сохраняется и по мере выведения продукты катаболизма оказывает защитное действие, связывая АГ.
Патология обмена Ig
1. Гипогаммаглобулинемия – снижение уровня всех классов Ig.
Бывает 3 видов: 1. Транзитная – у детей. 2. Врожденная. 3. Приобретенная (инфекция, интоксикация, нарушение синтеза Ig, ускоренное разрушение, потеря с мочой).
2. Дисгаммаглобулинемия – снижение (изменение) соотношения между классами Ig. Виды: 1. Врожденная. 2. Приобретенная.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник