Что такое клинические исследования и зачем они нужны? Это исследования, в которых принимают участие люди (добровольцы) и в ходе которых учёные выясняют, является ли новый препарат, способ лечения или медицинский прибор более эффективным и безопасным для здоровья человека, чем уже существующие.
Главная цель клинического исследования — найти лучший способ профилактики, диагностики и лечения того или иного заболевания. Проводить клинические исследования необходимо, чтобы развивать медицину, повышать качество жизни людей и чтобы новое лечение стало доступным для каждого человека.
У каждого исследования бывает четыре этапа (фазы):
I фаза — исследователи впервые тестируют препарат или метод лечения с участием небольшой группы людей (20—80 человек). Цель этого этапа — узнать, насколько препарат или способ лечения безопасен, и выявить побочные эффекты. На этом этапе могут участвуют как здоровые люди, так и люди с подходящим заболеванием. Чтобы приступить к I фазе клинического исследования, учёные несколько лет проводили сотни других тестов, в том числе на безопасность, с участием лабораторных животных, чей обмен веществ максимально приближен к человеческому;
II фаза — исследователи назначают препарат или метод лечения большей группе людей (100—300 человек), чтобы определить его эффективность и продолжать изучать безопасность. На этом этапе участвуют люди с подходящим заболеванием;
III фаза — исследователи предоставляют препарат или метод лечения значительным группам людей (1000—3000 человек), чтобы подтвердить его эффективность, сравнить с золотым стандартом (или плацебо) и собрать дополнительную информацию, которая позволит его безопасно использовать. Иногда на этом этапе выявляют другие, редко возникающие побочные эффекты. Здесь также участвуют люди с подходящим заболеванием. Если III фаза проходит успешно, препарат регистрируют в Минздраве и врачи получают возможность назначать его;
IV фаза — исследователи продолжают отслеживать информацию о безопасности, эффективности, побочных эффектах и оптимальном использовании препарата после того, как его зарегистрировали и он стал доступен всем пациентам.
Считается, что наиболее точные результаты дает метод исследования, когда ни врач, ни участник не знают, какой препарат — новый или существующий — принимает пациент. Такое исследование называют «двойным слепым». Так делают, чтобы врачи интуитивно не влияли на распределение пациентов. Если о препарате не знает только участник, исследование называется «простым слепым».
Чтобы провести клиническое исследование (особенно это касается «слепого» исследования), врачи могут использовать такой приём, как рандомизация — случайное распределение участников исследования по группам (новый препарат и существующий или плацебо). Такой метод необходим, что минимизировать субъективность при распределении пациентов. Поэтому обычно эту процедуру проводят с помощью специальной компьютерной программы.
- бесплатный доступ к новым методам лечения прежде, чем они начнут широко применяться;
- качественный уход, который, как правило, значительно превосходит тот, что доступен в рутинной практике;
- участие в развитии медицины и поиске новых эффективных методов лечения, что может оказаться полезным не только для вас, но и для других пациентов, среди которых могут оказаться члены семьи;
- иногда врачи продолжают наблюдать и оказывать помощь и после окончания исследования.
- новый препарат или метод лечения не всегда лучше, чем уже существующий;
- даже если новый препарат или метод лечения эффективен для других участников, он может не подойти лично вам;
- новый препарат или метод лечения может иметь неожиданные побочные эффекты.
Главные отличия клинических исследований от некоторых других научных методов: добровольность и безопасность. Люди самостоятельно (в отличие от кроликов) решают вопрос об участии. Каждый потенциальный участник узнаёт о процессе клинического исследования во всех подробностях из информационного листка — документа, который описывает задачи, методологию, процедуры и другие детали исследования. Более того, в любой момент можно отказаться от участия в исследовании, вне зависимости от причин.
Обычно участники клинических исследований защищены лучше, чем обычные пациенты. Побочные эффекты могут проявиться и во время исследования, и во время стандартного лечения. Но в первом случае человек получает дополнительную страховку и, как правило, более качественные процедуры, чем в обычной практике.
Клинические исследования — это далеко не первые тестирования нового препарата или метода лечения. Перед ними идёт этап серьёзных доклинических, лабораторных испытаний. Средства, которые успешно его прошли, то есть показали высокую эффективность и безопасность, идут дальше — на проверку к людям. Но и это не всё.
Сначала компания должна пройти этическую экспертизу и получить разрешение Минздрава РФ на проведение клинических исследований. Комитет по этике — куда входят независимые эксперты — проверяет, соответствует ли протокол исследования этическим нормам, выясняет, достаточно ли защищены участники исследования, оценивает квалификацию врачей, которые будут его проводить. Во время самого исследования состояние здоровья пациентов тщательно контролируют врачи, и если оно ухудшится, человек прекратит своё участие, и ему окажут медицинскую помощь. Несмотря на важность исследований для развития медицины и поиска эффективных средств для лечения заболеваний, для врачей и организаторов состояние и безопасность пациентов — самое важное.
Потому что проверить его эффективность и безопасность по-другому, увы, нельзя. Моделирование и исследования на животных не дают полную информацию: например, препарат может влиять на животное и человека по-разному. Все использующиеся научные методы, доклинические испытания и клинические исследования направлены на то, чтобы выявить самый эффективный и самый безопасный препарат или метод. И почти все лекарства, которыми люди пользуются, особенно в течение последних 20 лет, прошли точно такие же клинические исследования.
Если человек страдает серьёзным, например, онкологическим, заболеванием, он может попасть в группу плацебо только если на момент исследования нет других, уже доказавших свою эффективность препаратов или методов лечения. При этом нет уверенности в том, что новый препарат окажется лучше и безопаснее плацебо.
Согласно Хельсинской декларации, организаторы исследований должны предпринять максимум усилий, чтобы избежать использования плацебо. Несмотря на то что сравнение нового препарата с плацебо считается одним из самых действенных и самых быстрых способов доказать эффективность первого, учёные прибегают к плацебо только в двух случаях, когда: нет другого стандартного препарата или метода лечения с уже доказанной эффективностью; есть научно обоснованные причины применения плацебо. При этом здоровье человека в обеих ситуациях не должно подвергаться риску. И перед стартом клинического исследования каждого участника проинформируют об использовании плацебо.
Обычно оплачивают участие в I фазе исследований — и только здоровым людям. Очевидно, что они не заинтересованы в новом препарате с точки зрения улучшения своего здоровья, поэтому деньги становятся для них неплохой мотивацией. Участие во II и III фазах клинического исследования не оплачивают — так делают, чтобы в этом случае деньги как раз не были мотивацией, чтобы человек смог трезво оценить всю возможную пользу и риски, связанные с участием в клиническом исследовании. Но иногда организаторы клинических исследований покрывают расходы на дорогу.
Если вы решили принять участие в исследовании, обсудите это со своим лечащим врачом. Он может рассказать, как правильно выбрать исследование и на что обратить внимание, или даже подскажет конкретное исследование.
Клинические исследования, одобренные на проведение, можно найти в реестре Минздрава РФ и на международном информационном ресурсе www.clinicaltrials.gov.
Обращайте внимание на международные многоцентровые исследования — это исследования, в ходе которых препарат тестируют не только в России, но и в других странах. Они проводятся в соответствии с международными стандартами и единым для всех протоколом.
После того как вы нашли подходящее клиническое исследование и связались с его организатором, прочитайте информационный листок и не стесняйтесь задавать вопросы. Например, вы можете спросить, какая цель у исследования, кто является спонсором исследования, какие лекарства или приборы будут задействованы, являются ли какие-либо процедуры болезненными, какие есть возможные риски и побочные эффекты, как это испытание повлияет на вашу повседневную жизнь, как долго будет длиться исследование, кто будет следить за вашим состоянием. По ходу общения вы поймёте, сможете ли довериться этим людям.
Если остались вопросы — спрашивайте в комментариях.
источник
Метод хроматографии на бумаге относится к плоскостной хроматографии, он основан на распределении анализируемых веществ между двумя несмешивающимися жидкостями.
В распределительной хроматографии разделение веществ происходит вследствие различия коэффициентов распределения компонентов между двумя несмешивающимися жидкостями. Вещество присутствует в обеих фазах в виде раствора. Неподвижная фаза удерживается в порах хроматографической бумаги, не взаимодействуя с ней, бумага выполняет функцию носителя неподвижной фазы.
Виды хроматографической бумаги:
1) гидрофильная бумага удерживает в порах до 22 % воды; неподвижная фаза – вода, подвижная – органический растворитель; такая бумага применяется для определения водорастворимых веществ.
2) гидрофобная бумага отталкивает воду, поэтому ее пропитывают неполярным органическим растворителем (неподвижная фаза); подвижная фаза – вода; такая бумага применяется для определения нерастворимых в воде соединений (жирорастворимые кислоты, витамины).
К хроматографической бумаге предъявляются следующие требования:
¨ химическая и адсорбционная нейтральность по отношению к анализируемым веществам и подвижной фазе;
¨ однородность по плотности;
¨ одинаковая направленность волокон.
Для получения хроматограммы на бумагу наносят каплю анализируемой смеси. Бумагу помещают в хроматографическую камеру, ее конец погружают в сосуд с элюентом. Растворитель продвигается по бумаге, смесь анализируемых веществ распределяется между подвижной и неподвижной фазами и разделяется на бумаге в виде пятен или полос. Положение зон компонентов определяют проявлением хроматографической бумаги соответствующими реагентами, которые с компонентами разделяемой смеси образуют окрашенные соединения.
Для количественной оценки способности разделения веществ в хроматографической системе применяют коэффициент распределения Кр – отношение концентрации вещества в неподвижной и подвижной фазах. Экспериментальное установление коэффициентов распределения в данном методе невозможно, для оценки способности разделения веществ на бумаге применяют коэффициент смещения (подвижности) Rf. Коэффициент смещения равен отношению скорости движения вещества ( 
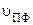

Коэффициент Rf изменяется в пределах 0 – 1,00. Величина Rf зависит от природы определяемого вещества, вида хроматографической бумаги, качества и природы растворителя, способа нанесения пробы, техники эксперимента и температуры. Коэффициент Rf не зависит от концентрации определяемого вещества и присутствия других компонентов.
Идентификацию по хроматограмме выполняют следующими способами:
¨ визуальным сравнением характерной окраски зон веществ на исследуемой и стандартной хроматограммах;
¨ измерением коэффициентов подвижности Rf для стандартного и анализируемого вещества в определенном растворителе. Хроматографирование и установление Rf для исследуемой и стандартной смесей проводят на одинаковой бумаге и в одной камере в строго идентичных условиях. Сопоставляя коэффициенты Rf, делают заключение о присутствии в анализируемой смеси тех или иных компонентов.
Количественное определениевыполняют непосредственно по хроматограмме или при вымывании (элюировании) анализируемого вещества с бумаги.
Способы количественного анализа:
¨ визуальное сравнение интенсивности окраски пятен на исследуемой и стандартной хроматограммах (полуколичественное определение, точность 15 –20 %);
¨ измерение площади пятна, образованного данным компонентом, и нахождение концентрации вещества по градуировочному графику, построенному для серии стандартных растворов в координатах: площадь пятна – концентрация вещества; точность определения 5 – 10 %;
¨ элюирование определяемого вещества с поверхности хроматограммы и спектрофотометрическое или флуориметрическое измерение оптической плотности элюата (А); концентрацию вещества в растворе рассчитывают по формуле:

где К – коэффициент пропорциональности; S – площадь пятна, измеренная предварительно, мм 2 ; точность определения 1 %.
По способу хроматографирования различают восходящую (рис. 21), нисходящую (рис. 22), круговую (рис. 23), градиентную и двухмерную хроматографии.
 | Рис. 21. Камера для восходящей хроматографии: 1 – пробка; 2 – крючок; 3 – стеклянный сосуд; 4 – полоска бумаги; 5 – растворитель |
 | Рис. 22. Хроматографическая камера для нисходящей хроматографии: 1 – растворитель; 2 – перекладина для бумаги; 3 – полоска бумаги; 4 – стеклянный сосуд; 5 – стекающий растворитель |
 | Рис. 23. Разделение веществ методом круговой хроматографии: 1– хроматографическая бумага; 2 – крышка; 3 – чашка Петри; 4 – органический растворитель |
Метод хроматографии на бумаге широко применяется для определения неорганических соединений, аминокислот, аминов, белков, углеводов, жирных кислот, фенолов, витаминов в химической, пищевой, фармацевтической промышленности, медицине, биохимии.
Метод нашел применение в анализе практически всех пищевых продуктов: в сахарном производстве – для определения углеводов; в хлебопекарном и кондитерском – аминокислот, органических кислот, углеводов, полисахаридов и карбонильных соединений; в виноделии – органических кислот и аминокислот; в производстве молока и молочных продуктов – аминокислот; в мясоперерабатывающей промышленности – фенолов, жирных и летучих кислот, аминокислот и карбонильных соединений.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше. 8982 — 

источник
Гельпроникающая хроматография на колонке используется для очистки пестицидов, а также жирорастворимых витаминов перед их определением методом ВЖХ.
Метод анализа, основанный на способности заряженных частиц к передвижению во внешнем электрическом поле называют электрофорезом (от “электро” и греческого phoresis — перенесение).
Электролиз относится к методам разделения без превращения веществ, на основе заряда частиц. По технике выполнения метод аналогичен хроматографии, поэтому и рассматривается в этой главе.
Рис 3.5.1. Схема прибора для электрофореза .
Нередко под электрофорезом понимают перемещение коллоидных частиц или макромолекул, в отличие от иовофореза — перемещения неорганических ионов малого размера.
Передвижение частиц при электрофорезе зависит от ряда факторов, основными из которых являются: напряженность электрического поля; величина электрического заряда; скорость и размер частицы; вязкость, рН и температура среды, а также продолжительность электрофореза.
Электрофорез можно проводить как в свободном растворе (фронтальный электрофорез), так и на носителях (зональный электрофорез). Последний вариант предпочтительнее, т.к. носители способствуют стабилизации электрофоретических зон. В качестве носителей используют: фильтровальную бумагу, силикагель, крахмал, оксид алюминия, поливинилхлорид, агаровый и полиакриламидный гели и др.
Аппаратура для электрофореза выполняется по единой схеме: источник тока, камера для электрофореза, два электрода, соединяющих камеру с источником тока и приспособление для сбора и идентификации разделенных веществ (последний блок в некоторых случаях отсутствует). Для электрофореза используют как готовые наборы аппаратуры (универсальный прибор для иммуноэлектрофореза и электрофореза белков на бумаге и крахмале, набор для электрофоре
На рис. 3.5.1 представлена схема прибора для электрофореза на бумаге. Электрофоретическая камера состоит из двух кювет, в которые помещают графитовые электроды и раствор проводящей жидкости (буферный раствор). Выше кювет находится подставка для носителя бумаги. Смесь веществ, подлежащих разделению, наносят на пропитанную проводящей жидкостью бумагу. Бумагу подсушивают, помещают на подставку, концы погружают в кюветы, затем камеру плотно закрывают крышкой. После пропитывания бумаги проводящей жидкостью подключают электрический ток. По окончании электрофореза бумагу подсушивают. Качественную и количественную оценку осуществляют, применяя методы, используемые в бумажной хроматографии, например, проявление белков с помощью красителей, количественную оценку — методом денситометрии.
Важной областью применения электрофореза является анализ белков сыворотки крови, аминокислот гидролизатов белков, нуклеиновых кислот и т.п. В кислотном буферном растворе аминокислота находится в виде катиона NHз + . COOH, который будет перемещаться к катоду, в то время как в щелочном буфере аминокислота превращается в анион NH2 . COO — , и будет двигаться к аноду. В изоэлектрической точке аминокислота находится в растворе в виде биполярного иона NH3 + . COO — и не будет передвигаться в электрическом поле.
Рис. 3.5.2. Электрофореграмма (а) и схемы (б) белковых фракций.
A — белковые фракции сыров: 1, 17 – российского, 2, 16 — волжского, 3, 15 – “Орбита”, 4, 14 — колбасного, 5, 13 – голландского, 6, 12 – пошехонского, 7, 11 – “сырного” казеина после осаждения при pH 4 , 6, 8, 10 – молочной сыворотки, 9 – казеина по Гаммерстену, 18 – “городского”.
Б – белковые фракции сыра (I), сырного казеина ( II)
Ввиду того, что отдельные белки и аминокислоты имеют различные изоэлектрические точки, при определенном значении рН они будут двигаться с различной скоростью. Подбирая соответствующие буферные растворы для установления определенной скорости движения и растворимости веществ, можно использовать электрофорез для их разделения. Метод позволяет разделять вещества, различие в изоэлектрической точке которых составляет до 0,02 единиц рН. Градиент рН в 0,02 единицы часто достигают прибавлением амфолитов, представляющих собой готовую смесь алифатических полиаминаполикарбоновых кислот.
Электрофоретическое разделение белков широко используется для оценки качества мяса и мясных продуктов, для дифференцирования вида мяса и рыбы. Метод также применяется для выявления немясных добавок (белков молока, сои, яиц) в мясных продуктах. С помощью электрофореза в полиакриламидном геле можно охарактеризовать изменение белков в процессе созревания сыров (рис.3.5.2).
В настоящее время используют высокоэффективный капиллярный электрофорез, например, для анализа витаминов в диетических продуктах (жирорастворимых А, Е, К, Д; водорастворимых — B1 , B2 , B6 , B12 , С, никотинамида); и для определения анионов (сульфат — хлорид-, иодид-) в молочных продуктах.
В газовой хроматографии (ГХ) в качестве ПФ используют инертный газ (азот, гелий, водород), называемый газом-носителем. Пробу подают в виде паров, неподвижной фазой служит или твердое вещество — сорбент (газо-адсорбционная хроматография) или высококипящая жидкость, нанесенная тонким слоем на твердый носитель (газожидкостная хроматография). Рассмотрим вариант газожидкостной хроматографии (ГЖХ). В качестве носителя используют кизельгур (диатомит) — разновидность гидратированного силикагеля, часто его обрабатывают реагентами, которые переводят группы Si-OH в группы Si-О-Si(CH3 )3 , что повышает инертность носителя по отношению к растворителям. Таковыми являются, например, носители “хромосорб W” и “газохромQ”. Кроме того, используют стеклянные микрошарики, тефлон и другие материалы.
Неподвижную жидкую фазу наносят на твердый носитель. Эффективность разделения в газожидкостной хроматографии зависит главным образом от правильности выбора жидкой фазы. При этом полезным оказалось старое правило: “подобное растворяется в подобном”. В соответствии с этим правилом для разделения смеси двух веществ выбирают жидкую фазу, близкую по химической природе одному из компонентов. Подготовленный носитель помещают в спиральные колонки, имеющие диаметр 2 — 6 мм и длину до 20 м (набивные колонки). С 1957 года стали применять предложенные Голеем капиллярные колонки, имеющие диаметр 0,2 — 0,3 мм и длину в несколько десятков метров. В случае капиллярных колонок жидкая фаза наносится непосредственно на стенку этого капилляра, которая выполняет роль носителя. Применение капиллярных колонок способствует повышению чувствительности и эффективности разделения многокомпонентных смесей.
Анализ методом ГХ выполняют на газовом хроматографе, принципиальная схема которого приведена на рис. 3.6.1.
Газ — носитель из баллона 1 с постоянной скоростью пропускают через хроматографическую систему. Пробу вводят микрошприцем в дозатор 2, который нагрет до температуры, необходимой для полного испарения хроматографируемого вещества. Пары анализируемой смеси захватываются потоком газа — носителя и поступают в хроматографическую колонку, температура которой поддерживается на требуемом для проведения анализа уровне (она может быть неизменной, или по необходимости меняться в заданном режиме). В колонке анализируемая смесь делится на компоненты, которые поочередно поступают в детектор. Сигнал детектора фиксируется регистратором (в виде пиков) и обрабатывается вычислительным интегратором.
В ГХ используют детекторы, которые преобразуют в электрический сигнал изменения физических или физико-химических свойств газового потока, выходящего из колонки, по сравнению с чистым газом — носителем. Существует множество детекторов, однако широкое применение находят только те из них, которые обладают высокой чувствительностью и универсальностью. К таким относятся: катарометр (детектор по теплопроводности); пламенно-ионизационный детектор (ПИД), в котором водородное пламя служит источником ионизации органического соединения; детектор электронного захвата (ЭЗД); термоионный детектор (ТИД), который обладает высокой селективностью к органическим веществам, содержащим фосфор, азот и серу. Интерес к этому детектору заметно возрос в связи с заменой хлорсодержащих пестицидов на фосфорсодержащие ядохимикаты, используемые в сельском хозяйстве и попадающие затем в пищевые продукты.
Катарометр позволяет определить концентрации веществ в пределах 0,1 — 0,01%, ПИД — 10 -3 — 10 -5 %”; ЭЗД — 10 -6 — 10 -10 %. Современные детекторы позволяют определять даже пикограммы (10 -12 г) вещества в пробе.
Качественный и количественный анализ в методе ГХ проводят так же, как и в ВЖХ.
Газожидкостная хроматография находит широкое применение для разделения, идентификации и количественного определения сложных многокомпонентных систем, таких как нефть, биологические жидкости, пищевые продукты, парфюмерно-косметические изделия и многие другие. Метод отличается высокой чувствительностью, экспрессностью; для анализа не требуется большого количества исследуемого образца.
источник
В процессе проведения биохимического анализа при клинико-лабораторных исследованиях часто возникает необходимость предварительного выделения анализируемых веществ, отделения их от других компонентов, находящихся в исследуемом биологическом материале. Для этих целей чаще всего используются такие физико-химические методы, как электрофорез и хроматография.
Электрофорез. Под электрофорезом понимают процесс разделения заряженных частиц в электрическом поле. Многие биологически важные молекулы (белки, аминокислоты, нуклеиновые кислоты и др.) имеют в своем составе ионизирующие группы. Поэтому в биологических жидкостях (крови, лимфе и др.) они существуют в виде катионов и анионов. Помимо этого молекулы имеющие примерно одинаковый заряд могут отличаться молекулярными массами и отношением заряда к массе. На этих различиях и основано разделение ионов при движении их в растворе под действием электрического поля.
Скорость перемещения зависит от величины заряда, а также в ряде случаев, от размера и формы молекул. Так как в большинстве случаев молекулы отличаются по своим физическим и химическим свойствам то очень немногие из них имеют одинаковую электрофоретическую подвижность. Скорость движения частиц (см/с) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью.
В зависимости от способа проведения электрофореза его делят на свободный или фронтальный, когда электрофоретическое разделение осуществляется в водной фазе и зональный, т.е. электрофорез на поддерживающей среде, когда разделение осуществляется на каком-либо инертном носителе (бумага, асбестовые пластины, целлюлоза, агаровый, крахмальный и полиакриламидный гели и др.).
Суть зонального электрофореза заключается в том, что раствор смеси веществ подлежащих разделению вводят на определенный участок носителя, пропитанного электролитом. Биологический материал, подлежащий электрофоретическому разделению, растворяют или суспензируют в буфере, чтобы обеспечить проведение электрического тока, этим же буфером насыщают и носитель. В растворе между электродами ток обусловлен ионами буфера и образца, в остальной части цепи — электронами. После снятия электрического поля ионы исследуемой смеси распределятся в соответствии с их электрофоретической подвижностью.
В клинико-лабораторных исследованиях чаще используется зональный электрофорез на агаре или полиакриламидном геле. При наложении электрического поля частицы подлежащей разделению смеси придут в состояние направленного движения (будут двигаться к противоположно заряженному полюсу) и распределятся на носителе в виде отчетливых зон, которые легко обнаружить соответствующим аналитическим методом.
Важными характеристиками процесса зонального электрофореза являются градиент потенциала (В/см) и сила тока, приходящаяся на 1 см поперечного сечения полосы (плотность тока — мА/см).
Под градиентом потенциала понимают падение напряжения на 1 см носителя расположенного между электродами. В зависимости от градиента потенциала различают низковольтный электрофорез (5-15 В/см) и высоковольтный (более 50 В/см). Низковольтный электрофорез используется для разделения высокомолекулярных соединений типа белков, липопротеинов, гликопротеинов и др. Высоковольтный электрофорез используется для разделения низкомолекулярных веществ, типа аминокислот, их производных и др. Так как различие в заряде и молекулярной массе у таких веществ невелико, то нужен большой градиент потенциала, чтобы произошло эффективное разделение частиц. Так как при этом происходит значительное разогревание носителя, требуются специальные устройства для его охлаждения.
В зависимости от целей исследования электрофорез делят на аналитический и препаративный. В клинико-биохимических исследованиях используют обычно аналитический электрофорез, который позволяет работать с очень небольшими количествами исследуемого вещества и вести их количественное определение. В тех случаях, когда требуется получить большое количество изучаемого вещества, необходимого для дальнейших исследований используют препаративный вариант электрофореза.
В настоящее время для анализа биологических смесей все шире используется капиллярный электрофорез, при котором электрофоретическое разделение проводится в тонких капиллярах диаметром 25-200 мкм и длинной 10-100 см, заполненных буферным раствором. Под действием электрического поля (электрофорез проводится при напряжении 10000-30000 В) в капилляре создается электроосмотический поток, направленный к отрицательному полюсу, вместе с которым перемешаются и компоненты подлежащие разделению. В зависимости от заряда и массы скорость их движения будет различной, что приводит к фракционированию смеси. В концевой точке капилляра разделенные компоненты количественно определяют, используя различные оптические детекторы Близким к электрофорезу является метод изоэлектрического фокусирования, когда разделение белков и некоторых других анализируемых веществ идет в зависимости от величины их изоэлектрических точек.
Изоэлектрической точкой называют такое состояние белковой молекулы, при котором ее суммарный заряд равен нулю. В методе изоэлектрического фокусирования вначале между электродами устанавливают градиент рН с помощью веществ особой химической природы, получивших название амфолитов-носителей. Заряженные молекулы белков в ходе опыта будут двигаться в направлении противоположно заряженного электрода в соответствии с их действительным зарядом. Так как молекулы белков амфотерны, то при перемещении в градиенте рН их суммарный заряд будет меняться до тех пор, пока он не станет равным 0. Это произойдет в том месте, где величина рН будет равна изоэлектрической точке. Поэтому молекулы с одинаковой изоэлектрической точкой сконцентрируются в одной узкой зоне.
Хроматография. Это метод разделения и анализа многокомпонентных систем, основанный на использовании явлений сорбции и десорбции в динамических условиях. В процессе хроматографии происходит многократное повторение актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента. Вещество подвижной фазы непрерывно вступает в контакт с новым участком сорбента и частью сорбируется, а сорбированное вещество контактирует со свежими порциями подвижной фазы и частично десорбируется.
Методы хроматографического анализа различаются: по агрегатному состоянию системы, в которой проводится разделение на газовую и жидкостную: по механизму разделения — на адсорбционную, распределительную, ионообменную, гель-хроматографию, аффинную и др. В ряде случаев разделение оказывается результатом нескольких одновременно протекающих процессов с различными механизмами. Это приводит к образованию хроматограммы смешанного типа, но один из процессов всегда является доминирующим (рис. 9 и 10, см. стр. 20-21).
В газовой хроматографии подвижной фазой является газ. В зависимости от состояния неподвижной фазы газовая хроматография подразделяется на газо-адсорбционную, когда неподвижной фазой является твердый адсорбент и газо-жидкостную, когда неподвижной фазой является жидкость, или точнее пленка жидкости на поверхности частиц твердого адсорбента.
Жидкостная хроматография основана на адсорбции твердым веществом, играющим роль неподвижной фазы, определяемых компонентов, находящихся в растворенном состоянии.
В основе адсорбционной хроматографии лежит различная сорбируемость разделяемых веществ на твердом сорбенте в соответствии с их сродством к адсорбенту. При этом сорбируемость растворителя должна быть незначительной по сравнению с таковой анализируемой смеси. Процесс адсорбции зависит от свойства адсорбента, адсорбируемых соединений, растворителя. В зависимости от этих свойств вещества, подлежащие хроматографическому разделению, образуют адсорбционный ряд выражающий относительное адсорбционное сродство его членов к адсорбенту. Образующееся в колонке адсорбента зональное распределение веществ соответствует их положению в адсорбционном ряду. В качестве адсорбентов в адсорбционно-жидкостной хроматографии применяются органические и неорганические вещества: сахароза, крахмал, оксид алюминия, силикагель, активированный уголь и др.
Ионообменная хроматография основана на способности некоторых твердых веществ (ионитов) обмениваться ионами с подлежащими разделению веществами. Применяемые в ионообменной хроматографии иониты могут быть как органическими, так и неорганическими. Способность к ионному обмену определяется строением ионита, представляющего собой каркас, на котором закреплены активные группы (-СООН, -SO3H, — NH3Cl, -NH2Cl и др.). В зависимости от обмена катионов или анионов иониты делят на катиониты, аниониты и амфолиты. На принципах ионообменной хроматографии основано разделение аминокислот в аминокислотных анализаторах.
Распределительная хроматография основана на распределении компонентов разделяемой смеси между несмешивающимися фазами. Образующая неподвижную фазу жидкость находится на поверхности или в порах твердого носителя, на который наносится смесь веществ, подлежащих разделению. Затем создают ток подвижного растворителя. Чем лучше вещество растворимо в жидкости, играющей роль подвижной фазы, тем дальше оно продвинется по направлению тока растворителя. Вещества, плохо растворимые в подвижной фазе, расположатся ближе к точке нанесения. В зависимости от техники выполнения распределительная хроматография выполняется как колоночная, бумажная или тонкослойная. Методика распределительной хроматографии в колонках аналогична адсорбционной или ионообменной: вначале в колонку с носителем и закрепленным на нем неподвижной фазой вводят небольшой объем раствора смеси компонентов и затем промывают колонку подвижным растворителем.
При бумажной хроматографии разделение проводят на полосах бумаги, где роль неподвижной фазы играет вода, удерживаемая гидрофильными целлюлозными волокнами бумаги, а подвижной фазой является какой-либо органический растворитель. В каждый момент имеет место определенное перераспределение разделяемых компонентов между слоем органического растворителя и водой. В результате одни вещества движутся быстрее вслед за фронтом органического растворителя, другие в той или иной степени отстают, а некоторые вообще остаются на стартовой линии.
При тонкослойном варианте разделение идет в тонком слое носителя. Чаще всего для этих целей используются пластинки из силикагеля (например, Silufol) широко используемые для фракционирования липидов, аминокислот и других биосубстратов.
Гель-хроматография основана на различии в размерах и молекулярных массах белков и других макромолекул, являющихся важнейшей характеристикой молекулы. В качестве материала-носителя в гель- хроматографии используется сшитый декстран (сефадекс), сшитый полиакриламид (биогель Р) и агароза. Они получили широкое распространение как в аналитической, так и в препаративной лабораторной работе, а также в производстве, в химической и биологической промышленности.
Колонка с сефадексом действует по принципу «молекулярного сита». Молекулы большие, чем самые крупные поры разбухшего сефадекса не могут проникать в гранулы и сравнительно быстро проходят в жидкой фазе вне частиц геля, поэтому элюируются первыми. В настоящее время имеется большое число сефадексов, позволяющих разделить белки и полипептиды в диапазоне молекулярных масс от 700 до 800000 Да.
Были разработаны также хроматографические материалы для разделения белков, путем связывания некоторых ионообменных групп с сефадексами. Полученные производные-ДЭАЭ-сефадекс, КМ-сефадекс и другие широко используются при хроматографии.
Аффинная хроматография или (биоспецифическая по сродству хроматография), основана на принципе специфического взаимодействия с особыми веществами (лигандами), закрепленными на носителе. Биологические макромолекулы обладают способностью обратимо связывать многие вещества. Например, ферменты образуют комплексы с субстратами, антитела взаимодействуют с антигенами, мРНК с комплементарной ДНК и т. д. Все эти взаимодействия строго специфичны. Образование специфических комплексов биологических макромолекул, способных в определенных условиях к диссоциации лежит в основе метода разделения получившего название аффинной хроматографии. Если закрепить один из компонентов этого комплекса на матрице, иммобилизовать его, то получится специфический сорбент для второго компонента (аффинат). Нерастворимые аффинаты готовят обычно путем ковалентного присоединения лиганда к нерастворимому носителю. Если смесь белков пропустить через колонку, заполненную таким аффинатом, то все молекулы, которые не обладают сродством к лиганду, закрепленному на носителе пройдут не задерживаясь, а белок имеющий сродство к аффинному лиганду будет адсорбироваться на колонке. Вымыть адсорбированный белок с колонки можно буферными смесями с измененной величиной рН, ионной силой, а также введением в состав элюента веществ, ослабляющих связи между белками и лигандами.
Одними из первых биоспецифических сорбентов, были антигены ковалентно связанные с нерастворимым носителем. Они были использованы для получения моноспецифических антител. Затем аналогичным путем были получены иммобилизованные ферменты. Стало возможным создание ферментных реакторов для получения различных веществ с использованием иммобилизованных ферментов.
источник
Общие сведения. Электрофорезом называют движение заряженных коллоидных частиц в постоянном электрическом поле к противоположно заряженному электроду.
Явление электрофореза было открыто профессором Московского университета Ф. Ф. Рейссом в 1807 г.
В молекулах белковых веществ возникновение электрических зарядов зависит от группировок, обладающих кислотными и основными свойствами. Кислотные свойства обусловлены карбоксильными и сульфгидрильными группами, а также фенольными гидроксилами. Основные свойства характерны для амино-, имино- и гуанидиновых групп.
Как известно, белки и аминокислоты являются биполярными ионами.
Процесс диссоциации белков во многом зависит от их изоэлектрической точки. Чем дальше будет отстоять значение pH среды от изоэлектрической точки, тем макромолекулы белка будут обладать большим зарядом и с большей скоростью передвигаться к положительному или отрицательному полюсу. Если в растворе находятся несколько белков, которые различаются своими изоэлектрическими точками, то скорость их перемещения в электрическом поле будет неодинаковой. Это явление положено в основу метода электрофоретического исследования биологических жидкостей, который находит широкое применение при анализе свойств белков и аминокислот, а также для диагностических целей.
Для практических работ используют различные варианты метода электрофореза на бумаге.
Основу аппарата составляет ванна из толстого стекла, в которую помещены две кюветы (анодная и катодная) с электродами, приспособления для размещения и закрепления полосок хроматографической бумаги (рамка, лабиринт, пружины) и некоторые вспомогательные части (рис. 5). Применяются платиновые или угольные электроды. Кюветы разделяются перегородками на два отделения — наружное и внутреннее, чтобы предотвратить попадание продуктов электролиза (что связано с изменением pH) на полоски бумаги. В наружных отделениях кювет располагаются электроды, во внутренние погружаются концы полосок бумаги, на которые наносится исследуемая
жидкость. Внутреннее и наружное отделения каждой кюветы соединяются посредством кусочков фильтровальной бумаги, которые кладутся на перегородки. Кюветы заполняются буферным раствором (боратным, фосфатным, вероналовым) с определенным значением pH и ионной силы. Одинаковый уровень жидкости в кюветах поддерживают с помощью сифона.
Рис. 5. Камера аппарата для электрофореза на бумаге (по В. И. Добрыниной и Е. Я. Свешниковой): 1 — ванна из толстого стекла; 2 — стеклянная крышка, пришлифованная к ванне; 3 — электродные кюветы (свободно вынимаются); 4 — продольная перегородка, разделяющая кювету пополам; угольные электроды; — бумажные полосы, концы их опускаются во внутреннее отделение кюветы; 7 — съемные пластинки, на которых укрепляются электроды (присоединяются К вание при помощи двух пружинок); 8 — рамка, на которой укрепляются и натягиваются бумажные полосы; Р—лабиринт для укрепления бумажных полос; 10 — пружины для натягивания бумажных полос; 11 — подставка для ванны; на подставке; 13 — установочные винты.
Для предотвращения испарения жидкости камеру (ванну) закрывают пришлифованной стеклянной крышкой.
В комплект аппарата входит также стабилизатор и выпрямитель.
В Советском Союзе аппараты для электрофореза на бумаге выпускает фрунзенский завод «Физприбор».
Разделение глютамина и глютаминовой кислоты с помощью электрофореза на бумаге (по прописи В. И. Добрыниной и Е. Я. Свешниковой).
Если на полоску фильтровальной бумаги нанести раствор смеси глютамина и глютаминовой кислоты, то после электрофореза при pH 8,0 в течение 1,5-2 ч и последующей окраски электрофореграммы можно наблюдать, что глютамин остается на месте нанесения капли раствора, а глютаминовая кислота передвигаетя к аноду на 3—4 см. Это обусловлено
тем, что молекулы глютамина при pH 8,0 электронейтральны и не передвигаются в электрическом поле, а молекулы глютаминовой кислоты при указанном pH имеют преобладающую диссоциацию карбоксильных групп, несут отрицательные заряды и поэтому передвигаются к аноду.
Реактивы: а) раствор глютаминовой кислоты: в 10 мл воды растворяют 50 мг глютаминовой кислоты; б) раствор глютамина: в 10 мл воды растворяют 50 мг глютамина; в) фосфатная буферная система. Готовят два раствора: Для получения фосфатного буфера pH 8,0 смешивают 945 мл I раствора с 55 мл II раствора; г) нингидрин, 0,2%-ный раствор в этиловом или бутиловом спирте.
В обе кюветы аппарата наливают фосфатный буфер (pH 8,0, ионная сила 0,05). На перегородки между наружным и внутренним отделениями кюветы кладут по кусочку фильтровальной бумаги для установления электрической связи. Одинаковый уровень жидкости в обеих кюветах устанавливают при помощи резинового или стеклянного сифона, наполненного тем же буферным раствором. Полоску фильтровальной бумаги (лучше брать ватман № 2 или хроматографическую ленинградскую) размером см берут двумя пинцетами (во избежание загрязнения), помещают на лист бумаги и в центре проводят карандашом поперечную линию, вдоль которой штриховыми движениями наносят из микропипетки 0,02 мл смеси растворов глютамина и глютаминовой кислоты. Каждую новую порцию наносят после того, как подсохнет предыдущая. На другую полоску наносят 0,02 мл раствора глютаминовой кислоты, на третью — столько же раствора глютамина. Полоски поочередно смачивают буферным раствором (в чашечке). Избыток влаги удаляют, раскладывая полоски на листе фильтровальной бумаги. Полоски переносят в прибор и концы их погружают в кюветы. В камеру можно уложить 6 полосок. Они должны лежать горизонтально и не провисать.
Камеру для электрофореза закрывают крышкой, и зажимы электродов фиксируют на выпрямителе — стабилизаторе тока. Выпрямитель подключают к электросети и постепенно увеличивают напряжение. Электрофорез проводят при напряжении 200—300 В и силе тока 1,5-2 мА
в течение 1,5-2 ч, после чего снижают напряжение до нуля и выключают прибор.
Полоски электрофореграмм вынимают чистыми пинцетами и с концов, погруженных в буферный раствор, удаляют избыток влаги фильтровальной бумагой. Полоски накалывают в горизонтальном положении на гвоздики рамы и помещают для фиксации в сушильный шкаф при температуре 100—105° С в течение 10—15 мин. Сухие полоски вынимают из шкафа и опрыскивают раствором нингидрина, после чего для проявления пятен снова помещают в тот же сушильный шкаф на 3—5 мин.
Кроме электрофореза на бумаге, в последнее время широкое распространение получили методы электрофоретического разделения веществ на полиакриламидном, агаровом, геле, крахмале и т. д.
источник
Гельпроникающая хроматография (ГПХ) представляет собой метод разделения молекул, основанный на различии из размеров.
В качестве НФ в ГПХ используют частицы, имеющие определенные размеры пор. Это различного рода гели (мягкие, полужесткие и жесткие). В качестве ПФ служат водные или органические элюенты. Принцип разде-ления молекул в ГПХ состоит в том, что молекулы анализируемых ве-ществ распределены между неподвижным растворителем в порах сорбента и растворителем, протекающим через слой НФ. Молекулы, которые имеют размеры, позволяющие им проникать в поры сорбента при движении вдоль колонки, часть времени теряют на пребывание в порах. Молекулы, имею-щие размеры, превышающие размеры пор, не проникают в сорбент и вы-мываются из колонки со скоростью движения элюента. Молекулы, кото-рые проникают в поры всех размеров, движутся наиболее медленно. Сни-жение скорости движения веществ вдоль колонки тем больше, чем в боль-шее число пор способны диффундировать распределяемые частицы.
Таким образом, при помощи ГПХ можно разделить смеси веществ в за-висимости от размеров их молекул. Выход веществ из колонки происходит в порядке уменьшения их молекулярной массы. Так можно разделить полипептиды, белки и другие макромолекулы.
Гельпроникающая хроматография на колонке используется для очистки пестицидов, а также жирорастворимых витаминов перед их определением методом ВЖХ.
Электрофорез
Метод анализа, основанный на способности заряженных частиц к пере-движению во внешнем электрическом поле называют электрофорезом (от “электро” и греческого phoresis — перенесение).
Электролиз относится к методам разделения без превращения веществ, на основе заряда частиц. По технике выполнения метод аналогичен хроматографии, поэтому и рассматривается в этой главе.
Рис 3.5.1. Схема прибора для электрофореза.
Нередко под электрофорезом понимают перемещение коллоидных час-тиц или макромолекул, в отличие от иовофореза — перемещения неоргани-ческих ионов малого размера.
Передвижение частиц при электрофорезе зависит от ряда факторов, ос-новными из которых являются: напряженность электрического поля; вели-чина электрического заряда; скорость и размер частицы; вязкость, рН и температура среды, а также продолжительность электрофореза.
Электрофорез можно проводить как в свободном растворе (фронталь-ный электрофорез), так и на носителях (зональный электрофорез). Послед-ний вариант предпочтительнее, т.к. носители способствуют стабилизации электрофоретических зон. В качестве носителей используют: фильтро-вальную бумагу, силикагель, крахмал, оксид алюминия, поливинилхлорид, агаровый и полиакриламидный гели и др.
Электрофоретическое разделение осуществляют на бумаге, в тонком слое сорбента, колонке или в блоке (который часто формируют из суспен-зии крахмала в подходящем электролите).
Аппаратура для электрофо-реза выполняется по единой схеме: источник тока, камера для электрофореза, два элек-трода, соединяющих камеру с источником тока и приспособ-ление для сбора и идентифика-ции разделенных веществ (по-следний блок в некоторых слу-чаях отсутствует). Для элек-трофореза используют как готовые наборы аппаратуры (универсальный прибор для иммуноэлектрофореза и электрофореза белков на бумаге и крахмале, набор для электрофоре-
за в полиакриламидном геле венгерской фирмы Реанал), так и наборы, со-ставляемые экспериментатором из отдельных приборов.
На рис. 3.5.1 представлена схема прибора для электрофореза на бумаге. Электрофоретическая камера состоит из двух кювет, в которые помещают графитовые электроды и раствор проводящей жидкости (буферный рас-твор). Выше кювет находится подставка для носителя бумаги. Смесь ве-ществ, подлежащих разделению, наносят на пропитанную проводящей жидкостью бумагу. Бумагу подсушивают, помещают на подставку, концы погружают в кюветы, затем камеру плотно закрывают крышкой. После пропитывания бумаги проводящей жидкостью подключают электрический ток. По окончании электрофореза бумагу подсушивают. Качественную и количественную оценку осуществляют, применяя методы, используемые в бумажной хроматографии, например, проявление белков с помощью кра-сителей, количественную оценку — методом денситометрии.
Важной областью применения электрофореза является анализ белков сыворотки крови, аминокислот гидролизатов белков, нуклеиновых кислот и т.п. В кислотном буферном растворе аминокислота находится в виде катиона NHз + . COOH, который будет перемещаться к катоду, в то время как в щелочном буфере аминокислота превращается в анион NH2. COO — , и будет дви-гаться к аноду. В изоэлектрической точке аминокислота находится в растворе в виде биполяр-ного иона NH3 + . COO — и не будет передвигаться в электрическом поле.
Рис. 3.5.2. Электрофореграмма (а) и схемы (б) белковых фракций.
A — белковые фракции сыров: 1, 17 — российского, 2, 16 — волжского, 3, 15 — “Орбита”, 4, 14 — колбасного, 5, 13 — голландского, 6, 12 — пошехонского, 7, 11 — “сырного” казеина после осаждения при pH 4,6, 8, 10 — молочной сыворотки, 9 — казеина по Гаммерстену, 18 — “городского”.
Б — белковые фракции сыра (I), сырного казеина (II)
Ввиду того, что отдельные белки и аминокислоты имеют различные изоэлектрические точки, при определенном значении рН они будут двигаться с различной скоро-стью. Подбирая соответствующие буферные растворы для установления определенной скорости движения и растворимости веществ, можно ис-пользовать электрофорез для их разделения. Метод позволяет разделять вещества, различие в изоэлектрической точке которых составляет до 0,02 единиц рН. Градиент рН в 0,02 единицы часто достигают прибавлением амфолитов, представляющих собой готовую смесь алифатических полиаминаполикарбоновых кислот.
Электрофоретическое разделение белков широко используется для оценки качества мяса и мясных продуктов, для дифференцирования вида мяса и рыбы. Метод также применяется для выявления немясных добавок (белков молока, сои, яиц) в мясных продуктах. С помощью электрофореза в полиакриламидном геле можно охарактеризовать изменение белков в процессе созревания сыров (рис.3.5.2).
В настоящее время используют высокоэффективный капиллярный электрофорез, например, для анализа витаминов в диетических продуктах (жирорастворимых А, Е, К, Д; водорастворимых — B1, B2, B6, B12, С, никотинамида); и для определения анионов (сульфат — хлорид-, иодид-) в мо-лочных продуктах.
Газовая хроматография
В газовой хроматографии (ГХ) в качестве ПФ используют инертный газ (азот, гелий, водород), называемый газом-носителем. Пробу подают в виде паров, неподвижной фазой служит или твердое вещество — сорбент (газо-адсорбционная хроматография) или высококипящая жидкость, нанесенная тонким слоем на твердый носитель (газожидкостная хроматография). Рас-смотрим вариант газожидкостной хроматографии (ГЖХ). В качестве носи-теля используют кизельгур (диатомит) — разновидность гидратированного силикагеля, часто его обрабатывают реагентами, которые переводят груп-пы Si-OH в группы Si-О-Si(CH3)3, что повышает инертность носителя по отношению к растворителям. Таковыми являются, например, носители “хромосорб W” и “газохромQ”. Кроме того, используют стеклянные мик-рошарики, тефлон и другие материалы.
Неподвижную жидкую фазу наносят на твердый носитель. Эффектив-ность разделения в газожидкостной хроматографии зависит главным обра-зом от правильности выбора жидкой фазы. При этом полезным оказалось старое правило: “подобное растворяется в подобном”. В соответствии с этим правилом для разделения смеси двух веществ выбирают жидкую фа-зу, близкую по химической природе одному из компонентов. Подготов-ленный носитель помещают в спиральные колонки, имеющие диаметр 2 — 6 мм и длину до 20 м (набивные колонки). С 1957 года стали применять предложенные Голеем капиллярные колонки, имеющие диаметр 0,2 — 0,3 мм и длину в несколько десятков метров. В случае капиллярных колонок жидкая фаза наносится непосредственно на стенку этого капилляра, кото-рая выполняет роль носителя. Применение капиллярных колонок способ-ствует повышению чувствительности и эффективности разделения много-компонентных смесей.
Рис.3.6.1. Блок-схема газового хроматографа.
Анализ методом ГХ выполняют на газовом хроматографе, принципи-альная схема которого приведена на рис. 3.6.1.
Газ — носитель из баллона 1 с постоянной скоростью пропускают через хроматографическую систему. Пробу вводят микрошприцем в дозатор 2, который нагрет до температуры, необходимой для полного испарения хроматографируемого вещества. Пары анализируемой смеси захватывают-ся потоком газа — носителя и поступают в хроматографическую колонку, температура которой поддерживается на требуемом для проведения анали-за уровне (она может быть неизменной, или по необходимости меняться в заданном режиме). В колонке анализируемая смесь делится на компоненты, которые поочередно поступают в детектор. Сигнал детектора фиксируется регистратором (в виде пиков) и обрабатывается вычислительным интегратором.
В ГХ используют детекторы, которые преобразуют в электрический сигнал изменения физических или физико-химических свойств газового потока, выходящего из колонки, по сравнению с чистым газом — носителем. Существует множество детекторов, однако широкое применение находят только те из них, которые обладают высокой чувствительностью и универ-сальностью. К таким относятся: катарометр (детектор по теплопроводно-сти); пламенно-ионизационный детектор (ПИД), в котором водородное пламя служит источником ионизации органического соединения; детектор электронного захвата (ЭЗД); термоионный детектор (ТИД), который обла-дает высокой селективностью к органическим веществам, содержащим фосфор, азот и серу. Интерес к этому детектору заметно возрос в связи с заменой хлорсодержащих пестицидов на фосфорсодержащие ядохимика-ты, используемые в сельском хозяйстве и попадающие затем в пищевые продукты.
Катарометр позволяет определить концентрации веществ в пределах 0,1 — 0,01%, ПИД — 10 -3 — 10 -5 %”; ЭЗД — 10 -6 — 10 -10 %. Современные детекторы позволяют определять даже пикограммы (10 -12 г) вещества в пробе.
Качественный и количественный анализ в методе ГХ проводят так же, как и в ВЖХ.
Газожидкостная хроматография находит широкое применение для раз-деления, идентификации и количественного определения сложных много-компонентных систем, таких как нефть, биологические жидкости, пище-вые продукты, парфюмерно-косметические изделия и многие другие. Ме-тод отличается высокой чувствительностью, экспрессностью; для анализа не требуется большого количества исследуемого образца.
Среди разнообразных хроматографических методов газовая и высоко-эффективная жидкостная хроматография являются самыми перспективны-ми для решения сложных задач в практике пищевого анализа.
Так, в число задач, которые могут быть разрешены в пищевом анализе с помощью этих методов, входят:
— определение химической природы веществ, обуславливающих характерный аромат свежих продуктов;
— контроль за состоянием продуктов в процессе обработки и хранения;
— объективная оценка показателей, характеризующих качество исходного сырья и готовых изделий из него;
— установление и устранение причин, вызывающих нежелательные изменения продуктов в процессе их изготовления;
установление факта фальсификации продукта и другие.
Рис.3.6.2. Хроматограмма афлотоксинов в молоке. Регистрация с помощью флуометрического детектора (возбуждающая длина волны 365 нм, возбужденная 455 нм).
Методами ГХ и ВЖХ идентифицируют и определяют летучие вещества, участвующие в формировании вкуса и аромата многих пищевых продуктов или отвечаю-щих за их порчу. Например, определяют летучие жирные кислоты, характерные для качест-венного мяса; или кислоты, образующиеся при изменении нормального процесса брожения квашеной капусты и обуславливающие посторонние оттенки ее запаха. Методы используются для определения никотина, нитрозамина (в рыбе и копченостях); пищевых добавок (красители, консер-ванты, антиокислители); загрязнителей окружающей среды (пестициды, афлатоксины, остатки лекарственных препаратов, витамины) и др. На рис. 3.6.2 представлена хроматограмма разделения афлатоксинов в молоке.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
источник
Электрофорез — метод разделения веществ, основанный на явлении миграции заряженных микрочастиц в жидкой среде под действием внешнего электрического поля.
Существует три различных электрофоретических метода. Под собственно электрофорезом обычно понимают зональный электрофорез (ЗЭ), два других называют методами изоэлектрофокусирования (ИЭФ)и изотахофореза (ИТФ).Электрофорез применяют главным образом для разделения веществ, молекулы которых различаются по электрофоретической подвижности, т. е. отношению скорости электрофореза (скорости перемещения заряженных частиц вещества) к напряженности электрического поля, которое зависит от свойств заряженных частиц окружающей их среды. Путем изменения внешних условий (например, рН среды, температуры, силы тока, состава и концентрации буферного раствора или носителя) создают подходящие условия для разделения. Вследствие того что при разделении на молекулы действуют только электростатические силы, электрофорез считают «мягким» методом и поэтому часто применяют для работы с лабильными веществами.
Электрофорез можно проводить в растворе, но из-за неизбежного выделения теплоты и возникающей в связи с этим тепловой конвекции процесс, как правило, проводят на носителе. Вследствие некоторых сопутствующих явлений (адсорбция, несоизмеримость размеров высокомолекулярных соединений и пор носителя) введение носителя ограничивает область применения метода. Однако свойства носителя иногда используют для повышения эффективности разделения: например, при электрофорезе в градиенте полиакриламидного геля фракционирование осуществляется не столько за счет различной электрофоретической подвижности веществ, сколько за счет различия в их молекулярных массах.
Зональный электрофорез (ЗЭ) — это метод разделения заряженных частиц в электрическом поле, основанный на том, что частицы с разными соотношениями заряд/масса мигрируют с различными скоростями. В зависимости от знака заряда молекулы вещества мигрируют в электрическом поле по направлению к аноду или катоду.
Результаты этого процесса регистрируются на электрофореграфе (по аналогии с хроматографией).
Ранее использовали один и тот же буфер в слое носителя электродных камерах, т. е. разделение вели в непрерывной буферной системе. В настоящее время этот прием еще применяют при электрофорезе на бумаге и пластинках. Приэлектрофорезе в прерывистой буферной системе (различные буферы в слое носите электродных камерах) быстро мигрирующие вещества образую более узкие зоны. Электрофорез в прерывистой буферной системе используют главным образом в гель-электрофорезе. ЗЭ обычно проводят на бумаге, пластинках и в гелях в водных буферных растворах.
При электрофорезе в электродных камерах происходит электролиз раствора и вследствие этого изменяется состав буфера. Поэтому электроды располагают так, чтобы они не касались носителя, а контакт между ними осуществлялся при помощи полосок фильтровальной бумаги. Электродная камера разделена на два отсека, которые соединяются дополнительным мостиком из фильтровальной бумаги. Подбирая соответствующий объем электродных камер или перекачивая буфер насосом от анода к катоду, поддерживают постоянными концентрацию и значение рН буфера в двухкамерной системе. Рекомендуется также проводить деполяризации электродов после каждого электрофоретического разделения.
Материалы-носители подразделяются на две группы:
первая — бумага, целлюлоза, ацетилированная целлюлоза, агароза и материалы для ТСХ(например, силикагель);
вторая — крахмал и полиакриламид.
Эффективность разделения зависит не только от суммарного заряда молекул анализируемых веществ, но и от размеров молекул. Определяющим параметром является соотношение заряд — масса.
Носители первой группы относительно инертны и слабо влияют на эффективность разделения. Материалы второй группы обладают пористой структурой, что существенно влияет на качество разделения. Поскольку размеры пор соизмеримы с размером макромолекул, то можно разделять вещества с одинаковыми суммарными зарядами, но с разными молекулярными массами (например, при ионообменной хроматографии).
Электрофорез на бумаге позволяет экстрагировать вещества из соответствующих зон или пятен и использовать для дальнейшей работы; обнаруживать вещества, используемые в бумажной хроматографии; проводить фракционирование в двух направлениях.
Для электрофореза на бумаге используют специальные сорта бумаги, характеризующиеся следующими свойствами: достаточной механической прочностью; удовлетворительным для удерживания достаточного количества электролита и образца.
Наряду с камерами погружного типа применяют камеры для электрофореза в тонком слое с охлаждаемыми пластинами, в которых лист бумаги помещают между двумя изолирующими пленками.
Электрофорез в тонком слое проводят на стеклянных пластинках, покрытых слоем носителя. По сравнению с полосками бумаги пластины более удобны в обращении. Электрофорез на бумаге и в тонком слое применяют для исследования фракций, полученных при колоночной хроматографии, ферментативных гидролизатов белков, метаболитов, а также для разделения аминов, аминокислот, пептидов и белков, нуклеотидов, фенолов, нафтолов, фенолкарбоновых кислот, красителей, неорганических соединений.
Гель- электрофорез. Вместо целлюлозы и силикагеля можно использовать мягкие гели. Ниже приведены основные рабочие стадии проведения электрофореза в слое геля: приготовление гелей и подготовка образца ® электрофоретическое разделение ® детектирование ® анализ результатов и оформление их в рабочем журнале. Из множества гелей на практике применяют только два — гели агарозы и полиакриламида. В зависимости от способа приготовления геля и типа буферной системы различают несколько вариантов метода:
· электрофорез в геле полиакриламида (ПААГ);
· диск-электрофорез (диск-ПААГ) в прерывистой буферной системе;
· электрофорез в геле полиакриламида в присутствии додецилсульфата натрия (ДСН-ПААГ);
· электрофорез в градиенте пористого полиакриламидного геля.
Гель окрашивают красителем. Поскольку молекулы красителя заряжены, гель можно обесцвечивать электрофоретически при напряжении 50 В. В местах, не содержащих исследуемое вещество, гель обесцвечивается. Количественную оценку проводят спектрофотометрически при помощи сканирующего денситометра.
После усадки гелей в водном этаноле или ацетоне их высушивают между двумя листами целлофана в вакууме при слабом нагреве.
Гель-электрофорез применяют для разделения всех классов заряженных веществ, например белков, ферментных комплексов, вирусов, олигонуклеотидов и нуклеиновых кислот; определения молекулярных масс биополимеров; анализа белков на микроуровне (антигенов при количественном иммуноэлектрофорезе).
При электрофорезе в свободном потоке электролит (буфер) перемещается в вертикальном направлении (перпендикулярно направлению электрического поля). Заряженные частицы под действием электрического поля мигрируют в горизонтальном направлении и одновременно увлекаются потоком буфера. В итоге разделенные вещества распределяются в потоке в соответствии с их электрофоретической подвижностью и элюируются из прибора в различных фракциях. Электрофорез в свободном потоке применяют для препаративного разделения заряженных частиц, в том числе коллоидных, субклеточных частиц и клеток.
Изоэлектрическое фокусирование (ИЭФ). С помощью изоэлектрического фокусирования по изоэлектрическим точкам (ИЭТ) разделяют амфотерные вещества, в частности белки. Сущность метода заключается в том, что молекулы белков мигрируют под действием электрического поля в среде с линейным и стабильным градиентом рН до достижения области рН, соответствующей их ИЭТ.
Изоэлектрическое фокусирование отличается от зонального электрофореза тем, что разделение осуществляется не в буфере с постоянным значением рН, а в среде с линейным градиентом рН. Значение рН минимально вблизи анода, максимально — вблизи катода. Главное условие эффективного разделения белков — наличие стабильного градиента рН среды. В связи с тем что белки обладают амфотерными свойствами, необходимо, чтобы амфолиты – носители — вещества, с помощью которых формируется градиент рН, обладали высокой буферной емкостью. Амфолиты — носители представляют собой многокомпонентную смесь изомеров и гомологов алифатических полиаминополикарбоновых кислот, сульфокислот и фосфоновых кислот, изоэлектрические точки которых располагаются в широкой области значений рН.
ИЭФ применяют для аналитического разделения пептидов, белков, нуклеотидов, органических кислот, ионов металлов и препаративного разделения белков; накопления следовых количеств веществ из больших объемов пробы; определения электрофоретической подвижности.
Необходимым условием проведения ИЭФ является наличие высокого напряжения при низкой ионной силе раствора. Однако именно в этих условиях усиливается электроосмос. Отрицательное воздействие на эффективность разделения веществ оказывают так же примеси солей, занесенные вместе с реактивами (гели для ИЭФ следует готовить из особо чистых реактивов). Для проведения ИЭФ более всего подходит полиакриламидный гель с низкими электроосмотическими свойствами. Продолжительность эксперимента зависит от напряженность поля и характера изменения рН- градиента.
Препаративное изоэлектрическое фокусирование проводят в вертикальных колонках (в градиенте плотности сахарозы, глицерина, этиленгликоля) или в слое инертного материала. В качестве таких материалов используют гранулированные гели (рН градиент формируют с помощью амфолитов).
источник