| Вид гемоглобина | Нормальные значения | Возможные изменения при серповидноклеточной анемии |
| HbA | Более 95%. | Менее 50%. |
| HbA2 | Менее 2%. | В норме или снижено. |
| HbF | 1 – 1,5 %. | В норме или слегка повышено. |
| HbS | Отсутствует. | 50% и более. |
При серповидноклеточной анемии метод УЗИ может выявить:
- увеличение селезенки и печени;
- наличие инфарктов во внутренних органах (в селезенке, печени, почках и других);
- нарушение кровообращения во внутренних органах;
- нарушение кровотока в конечностях.
Рентгенологическое исследование позволяет выявить:
- деформацию и расширение тел позвонков ;
- деформацию и истончение костей скелета
- наличие остеомиелита
Основные методы лечения серповидно-клеточной анемии направлены на снятие симптоматики (то есть, лечение является симптоматичным) и лечение сопутствующих или фоновых заболеваний. Симптоматика при острых кризах блокируется с помощью антибиотиков и гидратации (вливания жидкости). В более запущенных состояниях применяются обезболивающие препараты, кислород.
Принципами лечения серповидноклеточной анемии являются:
- правильный образ жизни;
- повышение количества эритроцитов и гемоглобина;
- кислородотерапия;
- устранение болевого синдрома;
- устранение избытка железа в организме;
- профилактика и лечение инфекционных заболеваний.
Образ жизни пациентов с серповидноклеточной анемией
Если у человека диагностирована серповидноклеточная анемия, ему следует соблюдать определенные рекомендации, которые позволят облегчить течение заболевания и минимизировать риск развития осложнений.
Пациентам с серповидноклеточной анемией рекомендуется:
- проживать на высоте не более 1500 метров над уровнем моря;
- проживать в зоне с умеренным климатом (исключающим воздействие экстремально низких или высоких температур);
- употреблять не менее 1,5 литров жидкости ежедневно;
- исключить прием алкогольных напитков и наркотиков;
- отказаться от курения (как самому больному человеку, так и членам его семьи);
- избегать тяжелых физических нагрузок;
- выбирать профессию, не связанную с тяжелой физической работой или воздействием высоких/низких температур.
Соблюдение перечисленных выше правил может предотвратить появление любых симптомов серповидноклеточной анемии у людей с гетерозиготной формой заболевания, однако пациентам с гомозиготной формой требуются и другие лечебные мероприятия.
Повышение количества эритроцитов и гемоглобина
Одним из основных факторов, определяющих тяжесть течения заболевания, является анемия (недостаток эритроцитов и гемоглобина в крови), развивающаяся на фоне усиленного разрушения красных клеток крови. Устранение анемии может предотвратить появление определенных симптомов заболевания и улучшить состояние пациента в целом.
Повышение количества эритроцитов и уровня гемоглобина
| Название препарата | Механизм леченого действия | |||||
| Эритроцитарная масса | Перелитые донорские эритроциты в течение некоторого времени (обычно не более 100 дней) могут транспортировать дыхательные газы в организме больного. Данный метод используется крайне редко, ввиду возможности развития тяжелых побочных реакций. | Критериями эффективности лечения являются:
| ||||
| Медикаментозные методы Препарат из группы цитостатиков (используется в лечении опухолей). Механизм действия данного медикамента связан с повышением уровня фетального гемоглобина (HbF) в эритроцитах. Это облегчает течение заболевания и предотвращает развитие многих осложнений. Применение гидроксимочевины в лечении серповидноклеточной анемии считается экспериментальной методикой. Широкомасштабных исследований, оценивающих эффективность препарата и возможные побочные реакции, еще не проводилось. | Начальная доза препарата составляет 15 миллиграмм на килограмм массы тела в сутки (мг/кг/сут). При отсутствии эффекта доза может быть увеличена в два раза. Во время лечения следует раз в 2 недели сдавать общий анализ крови, так как возможно развитие побочных реакций, наиболее опасной из которых является угнетение кроветворения в красном костном мозге. | Основным показателем эффективности лечения является увеличение концентрации фетального гемоглобина, определяемое методом электрофореза. Обычно доля HbF не превышает 20 – 25%, однако этого достаточно, чтобы значительно облегчить течение тяжелых форм заболевания. | ||||
Кислородотерапия
Частота и выраженность гемолитических кризов определяет тяжесть клинического течения серповидноклеточной анемии. Как уже говорилось, развитию гемолитического криза предшествуют различные состояния, сопровождающиеся гипоксией. Применение кислорода в первые минуты или часы после начала гемолиза предотвращает образование и последующее разрушение серповидных эритроцитов. Это облегчает течение заболевания, уменьшает риск развития осложнений и улучшает качество жизни пациента.
Пациент с развивающимся гемолитическим кризом должен быть госпитализирован как можно скорее. Непосредственно в машине скорой помощи ему дается кислородная маска, которая обеспечивает подачу кислорода со скоростью 4 – 6 литров в минуту. После поступления в стационар кислородотерапия продолжается на протяжении нескольких часов или дней.
Устранение болевого синдрома
Как говорилось ранее, закупорка кровеносных сосудов приводит к развитию ишемии пораженного органа, что сопровождается сильнейшей болью. С целью устранения болевого синдрома применяются наркотические анальгетики (обезболивающие средства), так как ишемические боли не купируются другими медикаментами. Вначале препараты вводятся внутривенно (быстрее наступает обезболивающий эффект). После купирования острого приступа боли переходят на таблетированные формы препаратов.
Дата добавления: 2018-04-15 ; просмотров: 788 ; ЗАКАЗАТЬ РАБОТУ
источник
Тест на электрофорез в гемоглобине — это анализ крови, используемый для измерения и идентификации различных типов гемоглобина в вашем кровотоке. Гемоглобин — это белок внутри эритроцитов, ответственный за транспортировку кислорода в ваши ткани и органы.
Генетические мутации могут привести к тому, что ваше тело вырабатывает гемоглобин, который образуется некорректно. Этот аномальный гемоглобин может вызвать слишком мало кислорода для достижения ваших тканей и органов.
Существуют сотни различных типов гемоглобина. Они включают:
- Гемоглобин F: Это также известно как фетальный гемоглобин. Это тип, который встречается у растущих плодов и новорожденных. Он заменен гемоглобином вскоре после рождения.
- Гемоглобин A: Это также известно как взрослый гемоглобин. Это самый распространенный тип гемоглобина. Он встречается у здоровых детей и взрослых.
- Гемоглобин C, D, E, M и S: Это редкие типы аномального гемоглобина, вызванные генетическими мутациями.
Диаграмма нормальных уровней
Тест на электрофорез в гемоглобине не говорит вам о количестве гемоглобина в крови — это делается при полном анализе крови. Уровни, на которые ссылается тест на электрофорез в гемоглобине, — это проценты различных типов гемоглобина, которые могут быть найдены в вашей крови. Это различно у младенцев и взрослых:
Гемоглобин в основном состоит из гемоглобина F у плодов. Гемоглобин F по-прежнему составляет большинство гемоглобина у новорожденных.
| Возраст | Гемоглобин F% |
| новорожденный | от 60 до 80% |
| 1+ год | от 1 до 2% |
Нормальные уровни типов гемоглобина у взрослых:
| Тип гемоглобина | Процент |
| гемоглобин A | 95% до 98% |
| гемоглобин A2 | 2% до 3% |
| гемоглобин F | 1% до 2% |
| гемоглобин S | 0% |
| гемоглобин C | 0% |
Реклама
Вы приобретаете различные аномальные типы гемоглобина, наследуя мутации генов на гены, ответственные за продуцирование гемоглобина. Ваш врач может рекомендовать тест на электрофорез в гемоглобине, чтобы определить, есть ли у вас расстройство, вызывающее появление аномального гемоглобина. Причины, по которым ваш врач может захотеть провести тест на электрофорез в гемоглобине, включают:
1. В рамках обычной проверки: Ваш врач может проверить ваш гемоглобин, чтобы пройти полный анализ крови во время обычного физического состояния.
2. Чтобы диагностировать расстройства крови: Возможно, у вашего врача есть тест на электрофорез в гемоглобине, если вы проявляете симптомы анемии.Тест поможет им найти любые ненормальные типы гемоглобина в крови. Это может быть признаком расстройств, включая:
- серповидноклеточная анемия
- талассемия
- полицитемия vera
3. Чтобы контролировать лечение: Если вас лечат от состояния, вызывающего ненормальные типы гемоглобина, ваш врач будет контролировать ваши уровни различных типов гемоглобина с помощью электрофореза на гемоглобине.
4. Для скрининга на генетические условия: Люди, у которых есть семейная история унаследованных анемий, таких как талассемия или серповидноклеточная анемия, могут выбрать для скрининга этих генетических заболеваний до рождения детей. Электрофорез гемоглобина будет указывать, имеются ли какие-либо ненормальные типы гемоглобина, вызванные генетическими нарушениями. Новорожденных также регулярно скринируют на эти генетические нарушения гемоглобина. Ваш врач может также захотеть проверить вашего ребенка, если у вас есть семейная история аномального гемоглобина или у них есть анемия, которая не вызвана дефицитом железа.
Вам не нужно делать что-либо особенное для подготовки к электрофорезу гемоглобина.
Вам, как правило, нужно пойти в лабораторию, чтобы получить вашу кровь. В лаборатории поставщик медицинских услуг берет образец крови из руки или руки: сначала они очищают сайт мазкой спиртов. Затем они вставляют маленькую иглу с трубкой, прикрепленной для сбора крови. Когда набирается достаточное количество крови, они удаляют иглу и закрывают сайт марлевой подушкой. Затем они отправляют ваш образец крови в лабораторию для анализа.
В лаборатории процесс, называемый электрофорезом, пропускает электрический ток через гемоглобин в вашем образце крови. Это приводит к разложению различных типов гемоглобина в разные полосы. Затем ваш образец крови сравнивают со здоровым образцом, чтобы определить, какие типы гемоглобина присутствуют.
Как и при любом анализе крови, существуют минимальные риски. К ним относятся:
- кровоподтеки
- кровотечение
- инфекция на месте прокола
В редких случаях вены могут набухать после того, как кровь нарисована. Это состояние, известное как флебит, можно обрабатывать теплым компрессом несколько раз в день. Постоянное кровотечение может быть проблемой, если у вас расстройство кровотечения или вы принимаете кровоточащие лекарства, такие как варфарин (кумадин) или аспирин (буферин).
Результаты и следующие шаги
Если ваши результаты показывают аномальные уровни гемоглобина, они могут быть вызваны:
- заболеванием гемоглобина С, генетическим расстройством, которое приводит к тяжелая анемия
- редкая гемоглобинопатия, группа генетических нарушений, вызывающих аномальное производство или структура красных кровяных телец
- анемия серповидно-клеточной анемии
- талассемия
Ваш врач будет проводить контрольные тесты, если тесты на электрофорез в гемоглобине показывают что у вас ненормальные типы гемоглобина.
источник
Электрофорез гемоглобина — это анализ крови, который измеряет различные типы белка, называемого гемоглобином, в ваших эритроцитах. Его иногда называют «оценкой гемоглобина» или «скринингом серповидных клеток».
Новорожденные автоматически проходят этот тест, потому что это закон. Есть несколько причин, по которым вы можете получить взрослую:
- У вас есть симптомы заболевания крови.
- У вас высокий риск заболевания крови из-за вашей расы.
- У вашего ребенка заболевание крови.
- Один из ваших других анализов крови показал ненормальный результат.
- У вас серповидно-клеточная анемия, и у вас было переливание крови. В этом случае тест показывает врачам, достаточно ли вы получили нормального гемоглобина из новой крови.
Вам не нужно делать ничего особенного, чтобы подготовиться к этому тесту. Но вы должны сообщить своему врачу, если у вас было переливание крови в течение последних 12 недель. Если это так, тест может дать ложный результат.
Тест включает взятие крови иглой. Риски низкие и могут включать в себя:
- Кровотечение
- Обморок или чувство легкомысленности
- Кровь накапливается под вашей кожей (гематома)
- Инфекционное заболевание
В лаборатории техник положит кровь на специальную бумагу и зарядит ее электричеством. Гемоглобины движутся вокруг и образуют линии на бумаге, которые показывают, сколько у вас каждого типа.
Тест может помочь вашему врачу выяснить, есть ли у вас заболевание крови и какое это заболевание крови. Обычно это делается вместе с другими анализами крови.
Ваш доктор может сказать вам, что он назначил этот тест для выявления гемоглобинопатии. Это универсальное слово, означающее ненормальные гемоглобины. Нормальный гемоглобин переносит кислород и выделяет его, чтобы ваши мышцы и органы могли его использовать. Ненормальный гемоглобин несет меньше кислорода. Эти клетки крови также имеют меньшую продолжительность жизни, чем нормальный гемоглобин. Это может привести к так называемой гемолитической анемии. Вот где ваши эритроциты умирают раньше, чем должны.
Аномальный гемоглобин также может быть признаком других состояний, таких как:
- Серповидноклеточная анемия. Обычно ваши клетки крови плоские, круглые и немного тоньше в центре. Они выглядят как круглый кусок теста, который вы зажали между пальцем и пальцем. Они гибкие и могут проходить через крошечные кровеносные сосуды. При серповидноклеточной анемии они имеют форму серпа или четверти луны. Они жесткие и могут застрять в маленьких кровеносных сосудах, чтобы кровь не могла пройти. Это может вызвать большую боль, когда ваши органы и мышцы не получают необходимый им кислород. Афро-американцы имеют более высокий риск развития серповидно-клеточной анемии, чем люди других рас.
- Болезнь гемоглобина С. Это может привести к легкой анемии и увеличению селезенки. Но в большинстве случаев это не доставляет особых хлопот, если у вас нет других видов аномальных гемоглобинов. Афро-американцы имеют более высокий риск заболевания гемоглобином С.
- Талассемии. Существует более одного типа этого расстройства. Если он у вас есть, ваше тело не вырабатывает достаточное количество красных кровяных клеток или в них недостаточно гемоглобина. В зависимости от того, какой гемоглобин поражен, талассемия может вызвать у вас легкую, среднюю или тяжелую анемию. Эти расстройства передаются от родителей к детям через гены. Люди итальянского, греческого, ближневосточного, южноазиатского и африканского происхождения чаще страдают талассемией.
источник
Электрофорез гемоглобина в щелочном геле позволяет определить процентное содержание основных изоформ гемоглобина и провести скрининг гемоглобинопатий. В норме в крови взрослого человека не менее 96,5 % гемоглобина представлено изоформой HbA, которая состоит из двух пар полипептидных цепей (глобинов): 2α и 2β, каждая из которых связана с гемом. Гемоглобинопатии связаны с наличием аномального варианта гемоглобина. Посредством электрофореза гемоглобина можно проводить скрининг состояний, связанных со структурными аномалиями гемоглобина. При этом метод не позволяет установить тип и характер гемоглобинопатии.
Синонимы английские
Serum Hemoglobin Electrophoresis.
Электрофорез и денситометрия.
Мг/дл (миллиграмм на децилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Электрофорез гемоглобина в щелочном геле позволяет определить процентное содержание основных изоформ гемоглобина и провести скрининг гемоглобинопатий. В норме в крови взрослого человека не менее 96,5 % гемоглобина представлено изоформой HbA, которая состоит из двух пар полипептидных цепей (глобинов) — 2α и 2β, — каждая из которых связана с гемом. HbA обеспечивает адекватный газообмен и тканевую оксигенацию. Фракция HbA2 — второстепенная форма гемоглобина, имеет формулу 2α2δ. Также у взрослого допустимо наличие следовых количеств фетального гемоглобина HbF (2α2γ), который является преобладающей фракцией в течение внутриутробного периода. В течение первых 6 месяцев жизни HbF замещается HbA.
Нарушения структуры гемоглобина обычно разделяют на две группы: гемоглобинопатии и талассемии, хотя талассемии являются формой гемоглобинопатии. Талассемии представляют собой нарушения синтеза α-, β- или обеих цепей гемоглобина. Также могут отмечаться нарушения синтеза δ-, γ- цепей. Большинство вариантов α- и β-талассемий сопровождается изменением уровня HbF и HbA2, поэтому определение этих изоформ может быть использовано для скрининга этих состояний.
Остальные гемоглобинопатии связаны с наличием аномального варианта гемоглобина. Наиболее распространённые и клинически значимые аномальные варианты гемоглобина: S, D, E, C. Варианты HbS и HbD — патологические формы гемоглобина, которые обладают идентичной миграцией в щелочном геле и являются результатом точечных мутаций гена, кодирующего β-глобин. Варианты Е и С при данном методе мигрируют в составе фракции HbA2, при их наличии фракция HbA2 достигает более 25 %. Наибольшее клиническое значение представляет HbS-вариант, который приводит к серповидноклеточной анемии.
Электрофорез гемоглобина в щелочном геле позволяет проводить скрининг состояний, связанных со структурными аномалиями гемоглобина. При этом метод не позволяет установить тип и характер гемоглобинопатии.
Электрофорез является чувствительным методом, с помощью которого можно исключить гемоглобинопатии либо определить тактику дальнейшего обследования для установления точного диагноза заболевания. Метод характеризуется высокой внутрипостановочной (SD Когда назначается исследование?
- Скрининг гемоглобинопатий;
- наличие семейного анамнеза гемоглобинопатий, планирование семьи;
- микроцитарная анемия, не связанная с дефицитом железа;
- гемолитическая анемия неустановленной этиологии;
- обнаружение изменённых эритроцитов (серповидная деформация) при микроскопическом исследовании крови.
- Тест обладает высокой достоверностью при скрининге β-талассемий, вариантов, приводящих к серповидноклеточной анемии, и синдромов персистенции фетального гемоглобина.
- При использовании данного метода может быть затруднена индентификация α+-талассемии (талассемия с одной мутацией).
источник
Электрофорез гемоглобина — это диагностический метод, который направлен на определение различных типов гемоглобина, которые могут быть обнаружены в крови. Гемоглобин или Hb представляет собой белок, присутствующий в красных кровяных клетках, ответственных за связывание с кислородом, что позволяет переносить их в ткани. Узнайте больше о гемоглобине.
Из идентификации типа гемоглобина можно проверить, имеет ли человек какое-либо заболевание, связанное с синтезом гемоглобина, например, талассемию или серповидноклеточную анемию. Однако для подтверждения диагноза требуются другие гематологические и биохимические тесты.
Электрофорез гемоглобина необходим для выявления структурных и функциональных изменений, связанных с синтезом гемоглобина. Таким образом, врач может рекомендовать диагностировать серповидноклеточную анемию, заболевание гемоглобином С и дифференцировать талассемию, например.
Кроме того, может быть предложено генетически посоветовать пары, которые хотели иметь детей, например, сообщая, есть ли вероятность того, что у ребенка есть какой-то тип расстройства крови, связанный с синтезом гемоглобина. Электрофорез гемоглобина также может быть запрошен как обычное последующее обследование для пациентов, уже диагностированных с различными типами гемоглобина.
В случае новорожденных детей тип гемоглобина идентифицируется с помощью теста на ногу, что важно, например, для диагностики анемии серповидноклеточных клеток. Посмотрите, какие заболевания обнаруживаются при проверке стопы.
Электрофорез гемоглобина осуществляется путем сбора образца крови обученным специалистом в специализированной лаборатории, поскольку неправильный сбор может привести к гемолизу, то есть уничтожению красных кровяных телец, что может повлиять на результат. Поймите, как производится сбор крови.
Сбор должен проводиться с пациентом, голодающим в течение не менее 4 часов, и образец, указанный для лабораторного анализа, в котором идентифицируются типы гемоглобина, присутствующие в пациенте. В некоторых лабораториях нет необходимости поститься для сбора. Поэтому важно получить рекомендации от лаборатории и врача относительно поста для теста.
Тип гемоглобина идентифицируется электрофорезом при щелочном рН (около 8, 0 — 9, 0), что является методом, основанным на скорости миграции молекулы при подаче электрического тока, с визуализацией полос в зависимости от размера и веса молекулы. Согласно образцу полученных полос, проводится сравнение с нормальным стандартом и, таким образом, производится идентификация аномальных гемоглобинов.
В соответствии с моделью представленных полос можно идентифицировать тип гемоглобина пациента. Гемоглобин A1 (HbA1) имеет более высокую молекулярную массу, при этом отмечается меньшая миграция, тогда как HbA2 легче, глубже в геле. Этот образец полос интерпретируется в лаборатории и высвобождается в виде отчета для врача и пациента, информирующего о найденном типе гемоглобина.
Фетальный гемоглобин (HbF) присутствует при более высоких концентрациях у ребенка, однако, по мере развития, концентрации HbF снижаются, а HbA1 увеличивается. Таким образом, концентрации каждого типа гемоглобина изменяются в зависимости от возраста и обычно:
| Тип гемоглобина | Нормальное значение |
| HbF | |
| HbA1c | Равен или выше 95% |
| HbA2 | От 1, 5 до 3, 5% |
Тем не менее, некоторые люди имеют структурные или функциональные изменения, связанные с синтезом гемоглобина, что приводит к аномальным гемоглобинам или вариантам, таким как HbS, HbC, HbH и Bbs Hb.
Таким образом, из электрофореза гемоглобинов можно идентифицировать наличие аномальных гемоглобинов, и с помощью другого диагностического метода, называемого ВЭЖХ, можно проверить концентрацию нормальных и аномальных гемоглобинов, что может быть показателем:
| Результат гемоглобина | Диагностическая гипотеза |
| Наличие HbSS | Серповидноклеточная анемия, которая характеризуется изменением формата гемоцитов из-за мутации в бета-цепи гемоглобина. Знать симптомы серповидноклеточной анемии. |
| Наличие HbAS | Сердечная клеточная черта, в которой человек несет ген, ответственный за серповидноклеточную анемию, но не имеет симптомов, но может передавать этот ген другим поколениям: |
| Наличие HbC | Показатель заболевания гемоглобином С, в котором кристаллы HbC можно наблюдать в мазке крови, особенно когда пациент HbCC, в котором человек имеет переменную гемолитическую анемию. |
| Присутствие Hb de Barts | |
| Наличие HbH | Показатель заболеваемости гемоглобином H, который характеризуется осаждением и внесосудистым гемолизом. |
В случае диагноза анемии с серповидно-клеточной анестезией с помощью теста на ногу нормальный результат — HbFA (т.е. у ребенка есть как HbA, так и HbF, что является нормальным), тогда как результаты HbFAS и HbFS указывают на характер клеток серпа и серповидноклеточная анемия соответственно.
Дифференциальный диагноз талассемии также может быть сделан с помощью ВЭЖХ-связанного гемоглобинового электрофореза, где они проверяются в концентрациях альфа-, бета-, дельта-и гамма-цепей, проверяя отсутствие или частичное присутствие этих глобиновых цепей и, согласно определить тип талассемии. Узнайте, как определить талассемию.
Чтобы подтвердить диагноз любого заболевания, связанного с гемоглобином, необходимо заказать другие тесты, такие как дозировка железа, ферритин, трансферрин и полный анализ крови. Вот как интерпретировать счет крови.
источник
Принцип метода одинаков с заложенным в основу электрофоретического отделения сывороточных белков. В данном электрическом поле частицы, несущие определенную электрическую зарядку, перемещаются более или менее в зависимости от силы электрического поля, электрической зарядки, величины и формы молекулы.
Что касается гемоглобина основным фактором электрофоретического отделения является электрическая зарядка, поскольку форма и величина молекулы одинаковы для различных видов гемоглобина.
Электрофорез гемоглобина практикуется во всех используемых вариантах в отношении белков, в том числе, электрофорез на бумаге, в агаровом геле, в геле и блоке крахмала, в геле полиакриламида, на уксуснокислом целлюлозе. Каждая из этих разновидностей представляет свое преимущество, которое следует учитывать при выборе соответствующего метода.
Необходимая аппаратура — электрический источник питания и бак (ванна) для буфера; используемые материалы в качестве миграционной питательной среды почти полностью соответствуют применяемым для электрофореза сывороточных белков.
Электрофорез гемоглобина в блоке крахмала отличается рядом преимуществ, в силу которых ему отдается предпочтение при исследовании гемоглобинопатии. На этой питательной среде можно отделить почти все виды физиологического и патологического гемоглобина, даже когда он находится в малом концентрации. Не требует окраски. Промывание и количественная оценка осуществляются легко, используемый крахмал не требует специальной обработки, дешевый и побывается без затруднений.
Материалы для электрофореза гемоглобина в блоке крахмала: картофельный крахмал; аппарат для электрофореза, слагающийся из выпрямителя, бака для буфера и пластинки из плексигласса, на которую наносится крахмал; буфер веронал-мединал — 8,8 показатель водорода и 0,5 ионная мощность; веронал 1,84; мединал 10,8; лактат кальция 0,384; дистилированная вода до 1000 мл; 2% раствор цианистого натрия.
В стекляную или эмалированную посуду насыпать 150—200г крахмала и залить 300—400 мл дистилированной воды. Помешать, после осаждения крахмала слить воду и налить буфер веронал-мединал; хорошо перемешать и оставить 30—40 минут, в случае надобности можно сохранить на ночь в холодильнике. После гомогенизации приготовленный таким образом крахмал наносится на пластинку плексигласса, при этом слой его должен иметь 5 мм толщины.
Поскольку по краям пластинки имеется ободочек соответствующей толщины, крахмал не стекает с пластинки. Слой оседаемого крахмала однородный. Лишнее количество буфера удалить фильтровальной бумагой.
На одну пластинку крахмала можно нанести одновременно несколько проб для миграции, причем их число зависит от величины пластинки. Наносить их (по 2—3 капли) на расстоянии 4—5 см от края пластинки, между образцами оставлять расстояние 3—4 см.
До начала миграции гемолизаты обработать цианистым натрием в целях преобразования гемоглобина в цианметгемоглобин — весьма устойчивый вид. На 5—6 капель раствора гемоглобина добавить каплю 2% раствора цианистого натрия.
Пластинку спустить в бак, при этом пятна направляются в сторону отрицательных электродов; связь с буферным раствором наладить с помощью фильтровальной бумаги. Миграция происходит при напряжении 200 вольт, ампераж в зависимости от размеров пластинки с крахмалом и толщины слоя последнего. Время миграции 18—20 часов.
В описанных условиях проба гемоглобина от человека в норме мигрирует от отрицательного к положительному полюсу и делится на две фракции: основную (97—98%) на первом плане, представляющую собой гемоглобин А1, а позади, на расстоянии 3—4 см, вторую (2—3%), составляющую гемоглобин А2.
При таких условиях из крови пуповины также отделяются две фракции: одна из них составляет 30—40% — гемоглобин А1, вторая — гемоглобин Ф, расположенная между гемоглобином А1 и гемоглобином А2, на очень близком расстоянии от первого.
Количественное определение отделенных, путем электрофореза, фракций осуществляется промыванием а затем фотометрированием.
Отделенные пятна вырезать и каждый из них вложить в пробирку. В другой пробирке промыть участок чистого крахмала, соответствующего по величине площади, занимаемой гемоглобином А2, в качестве контрольного препарата для фотометрирования.
В каждую пробирку влить одинаковое количество буфера. Взболтать, гемоглобин переходит в раствор, в то время как крахмал оседает на дно пробирки. После оседания надосадочную массу профильтровать, процентрифугировать и прочитать результат с помощью фотометра или спектрофотометра с фильтром, соответствующим длине волны 540 нм. Значение данной фракции в процентном отношении выводится из суммы экстинкий, составляющей 100% экстинкций каждой фракции, деленной на общую экстинкцию.
Нормальные физиологические значения гемоглобина, полученные в подобных условиях, составляют 2—3% гемоглобина А2 и 97—98% гемоглобина А1.
Если подвергнуть электрофорезу раствор гемоглобина из крови больного с аномальным гемоглобином, то последняя, в зависимости от имеющейся в ней электрической зарядки, мигрирует медленнее или быстрее нормального гемоглобина, тем самым способствуя ее отделению и количественному определению.
Вливаемый в ванну буфер можно исплоьзовать несколько раз, при условии изменения направления тока после каждой миграции.
источник
Электрофорез гемоглобина (в щелочном растворе)
С ПОМОЩЬЮ РУЧНОЙ МЕТОДИКИ
Наборы Hellabio гемоглобин (в щелочи) используются для идентификации различных форм молекул гемоглобина (выделение гемоглобина в отдельные полосы HbA, HbF, HBS (HBG, HBD, Лепор) HbA2 (HBC, HBE и HBO)) и позволяют проводить лабораторную диагностику нормальных и патологических гемоглобинов, определяя состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии.
Каждый из основных типов гемоглобина имеет электрический заряд разной степени, поэтому наиболее эффективным методом разделения и измерения нормального и аномального гемоглобина является электрофорез.
В норме у взрослого человека 96.5-98.5% от общего гемоглобина приходится на HbA. Незначительную долю около 1.5-3,5% занимает HbA2. В период внутриутробного развития основным гемоглобином является HbF.
КЛИНИЧЕСКИЙ МАТЕРИАЛ, ХРАНЕНИЕ.
· Венозную кровь человека (забор производится натощак) поместить в пробирку с сахаром без антикоагулянта (оксалат, гепарин или ЭДТА, обработанная кровь);
Добавить около 100-200 мкл цельной крови в пробирку с 10 мл физиологического раствора, центрифугировать (5 минут при 3g) и удалить супернатант;
· Взять 30 мкл осадка и добавить в пробирку с 130 мкл гемолизирующего раствора, смешать (Гемолизат);
· Гемолизат стабилен в течении 5-7 дней. Хранить в холодильнике, соблюдать условия асептики, избегать попадания прямых солнечных лучей.
• Работать только в одноразовых перчатках — буфер токсичен.
• Все реагенты должны быть использованы в соответствии с инструкциями, и до истечения даты, указанной на наборе;
• Работа с уксусной кислотой требует наличия вытяжных шкафов;
• Не использовать агарозный гель, если он недостаточно просушен;
• Агарозный гель не замораживать;
• Хранить набор в горизонтальном положении;
• Не использовать гемолизированную сыворотку или плазму (фибриноген).
1. Источник питания 25-250B «Hellabio».
2. Камера для электрофореза «Hellabio».
3. Держатель геля «Hellabio».
4. Набор контейнеров для окрашивания /отмывки «Hellabio».
5. Сушительная камера геля «Hellabio».
6. Вортекс «Micro-Spin», «Minigen.
7. Компьютер, сканер, принтер.
8. Программное обеспечение HELLABIOSCAN GEL ANALYZER или денситометр (520 – 600нм).
9. Набор автоматических пипеток переменного объема.
10. Халат и одноразовые перчатки.
11. Одноразовые микропробирки на 1,5мл.
12. Штатив для микропробирок.
13. Одноразовые наконечники для пипеток переменного объема 5-40 мкм.
14. Емкость для хранения буфера объемом 1000мл.
15. Емкость для хранения окрашивающего раствора объемом 500 мл.
16. Мерный цилиндр объемом 1000 мл.
18. Емкость с дезинфицирующим раствором.
2. НЕОБХОДИМЫЕ реагенты и оборудование – содержаться в каждом наборе Hellabio.
Внимание! Для получения наилучших результатов реагенты, входящие в комплект, должны быть использованы вместе.
Содержимое наборов (необходимые реагенты):
Агарозные гели (Agarose Gels)
Электрофорезный буфер (Electrophoresis Bufffer)
Окрашивающий раствор (Staining Solution)
Фильтровальные полосы для геля (Gel Blotter Strips)
Гемолизирующий раствор (Hemolyzing Solution)
Шаблоны для образцов (Sample Templates)
Инструкция (Instruction) на русском и английском языках
Подготовка реактивов для проведения электрофореза:
Все реактивы фирмы Hellabio должны храниться при температуре 4-25°C до истечения даты, указанной на комплекте. Внимание: буфер токсичен, работать в перчатках.
1. Приготовление рабочего буфера: взять мерный цилиндр на 1000 мл.
2. Развести 40 мл концентрированного буфера(Protein Electrophoresis Buffer) в 960 мл дистиллированной воды.
3. Перелить рабочий буфер в подготовленную емкость и пометить дату, рабочий буфер хранится 3 месяца, с даты изготовления, при комнатной температуре в темном прохладном месте, в закрытой колбе.
4. Приготовление рабочего окрашивающего раствора: хорошо взболтать окрашивающий раствор (Protein Staining Solution).
5. Взять мерный цилиндр на 250 мл и смешать 210 мл 10% уксусной кислоты с 40 мл окрашивающего раствора (Protein Staining Solution).
6. Перелить рабочий раствор окрашивающего раствора в емкость для хранения. Расход окрашивающего раствора обеспечивает возможность постановки соответственно комплектации набора (10 пластинок).
7. В качестве отмывочного раствора будет использоваться 10% уксусная кислота.
· Венозную кровь человека (забор производится натощак) поместить в пробирку с сахаром без антикоагулянта (оксалат, гепарин или ЭДТА, обработанная кровь);
Добавить около 100-200 мкл цельной крови в пробирку с 10 мл физиологического раствора, центрифугировать (5 минут при 3g) и удалить супернатант;
· Взять 30 мкл осадка и добавить в пробирку с 130 мкл гемолизирующего раствора, смешать (Гемолизат);
· Гемолизат стабилен в течении 5-7 дней. Хранить в холодильнике, соблюдать условия асептики, избегать попадания прямых солнечных лучей.
1. Отобрать необходимое количество микропробирок, включая контроль. Приготовить гемолизат.
2. Заполнить электрофорезные камеры необходимым количеством рабочего буфера в зависимости от объема камеры;
3. Раскрыть упаковку агарозного геля. Используя одноразовый наконечник приподнять пластину агарозного геля (место обозначено стрелкой) и извлечь гель из упаковки. Положить в горизонтальном положении на крышку упаковки.
4. Извлечь фильтровальную полосу (Gel Blotter Strips) из упаковки. Промокнуть гель фильтровальной полосой в зоне нанесения образца (отмечено двумя точками на краях геля). Удалить фильтровальную полосу с агарозного геля.
5. Извлечь шаблон образцов из упаковки (Sample Tamplates). Установить шаблон для образцов в зоне нанесения. Провести указательным пальцем по шаблону, для усиления контакта шаблона с гелем и предотвращения попадания пузырьков воздуха в лунку для образца.
6. В каждую лунку шаблона образцов внести по 5мкл гемолизата и оставить на 20-30сек (не более!).
7. Взять фильтровальную полосу. Промокнуть шаблон образцов фильтровальной полосой. Удалить шаблон образцов и фильтровальную полосу с поверхности геля.
8. Установить гель в гелевый держатель. Опустить гелевый держатель в элекрофорезную камеру. Образцы находятся на катодной стороне.
9. Подключить камеру к источнику тока, соблюдая полярность. При использывании камеры и источника питания «Hellabio» параметры следущие : напряжение напряжение 200 В, время электрофореза 20 минут (в случае использования мини гелей, на 3 лунки — 18 мин/200 В).
10. Отключить источник питания от электрофорезной камеры. Извлечь гель из гелевого держателя.
11. Поместить гель в сушильную камеру (температура 60°С). Высушить гель полностью (отсутствуют пятна на пластине геля).
12. Заполнить один контейнер рабочим окрашивающим раствором, три контейнера 10% уксусной кислотой.
13. Поместить высушенную гелевую пленку в контейнер для окрашивания на 5 минут.
14. Извлечь окрашенную гелевую пленку. Промыть пленку по 5 минут в 3-х контейнерах для промывки.
15. Поместить гель в сушильную камеру (температура 60°С). Просушить гелевую пластину.
16. Перенести гель в сканер. Получить изображение геля и оценить результаты в программе HellabioScan или используя фильтр денситометра 580 нм.
Предполагаемые показатели нормы: HbA: 96.5-98.5%, HbA2 1.5-3.5%
Коэффициент отклонения значений не превышает 5%.
Гемолизат известного гемоглобина или коммерчески доступный гемолизат контроля качества должен быть включен в каждую процедуру электрофореза.
Качественная интерпретация результатов может быть произведена визуально путем сравнения образца с шаблоном. Для количественной интерпретации результатов используют программу HellabioScan или денситометр (580нм)
Оценку электрофореграмм при гемоглобинопатиях можно легко сделать визуально. Для количественного анализа должен быть использован денситометр (580нм).
МОДЕЛИ ЭЛЕКТРОФОРЕЗА НА АГАРОЗНЫХ ГЕЛЯХ HELLABIO
Электрофорез гемоглобина в щелочи:

Электрофорез гемоглобина в кислоте:
(Дифференциация HbS от HbG, D,Lep.) 1= HbS

Электрофорез гемоглобина в щелочи:
Примечание: чтобы определить вид нетипичного гемоглобина (HbC, HbS, HbD, HbE, Lepore), нужно использовать электрофорез гемоглобина в кислой среде.
источник
Некоторые аномальные гемоглобины, выявляемые электрофорезом, включают гемоглобины S, С, Е. Гемоглобины S и С обнаружены в серповидных больных клетках. Это заболевание обнаружено у 50000 черных американцев. Оно возникает у 1 из 625 черных новорожденных в США. Смертность от серповидного заболевания клеток может достигать 30—35% при неправильном лечении инфекции. Основными причинами младенческой смертности является бактериальный сепсис и острая реакция печеночного отторжения.
Лица, выжившие после младенческих приступов, обычно страдают анемией и подвержены резким шокам и другим осложнениям. Совокупность симптомов серьезно изменяется в течение жизни, поскольку часть пациентов умирает в младенчестве, а часть доживает до среднего возраста. Лечение этого хронического заболевания может оказаться дорогостоящим и причинить серьезные страдания и пациенту, и ухаживающим за ним.
Более 2-х миллионов американцев страдают серповидным изменением клеток. Оно выявлено у около 8% негритянского населения. Хотя переносчики серповидных клеток сами не очень подвержены этому заболеванию, в случае, когда оба родителя являются переносчиками этой болезни, вероятность передать болезнь детям равна 25%. Одна из каждых 150 негритянских пар в США (около 3 тысяч беременностей в год) подвержена риску рождения ребенка, страдающего серповидным заболеванием клеток.
Бета-талассемия наблюдается в основном среди выходцев из Средиземноморского и Юго-Азиатского регионов. Более чем 1000 американцев поражены средиземноморской бета-талассемией, или анемией Кули. Хотя некоторые жертвы этой болезни страдают еще от разных анемий и зависят от постоянных переливаний крови, современные переливания и железохелатная терапия помогают улучшить клинический прогноз.
Некоторые пациенты доживают теперь до 30 лет. Бета-талассемийный признак является гетерозиготным и наличествует у 1,5% американских негров, 3—4% выходцев из Италии, 5% выходцев из Греции и примерно 3—9% юго-азиатов 9,11. Существует 25% вероятность, что при каждой беременности, наблюдающейся от двух гетерозиготных родителей, ребенок, будет иметь средиземноморскую талассемию.
Альфа-талассемия наблюдается в основном среди лиц азиатского, африканского или средиземноморского происхождения. Заболевание состоит из четырех различных синдромов, зависящих от числа делеций альфаглобинового гена. Новорожденные с многоводьем, наблюдающимся при четырех делециях, страдают от тяжелой анемии и умирают до или сразу после родов. Женщины в таких случаях могут страдать токсикозом в течение беременности и послеродовым кровотечением.
Заболевание гемоглобином Н, в котором отсутствует три гена альфа, наблюдается у 1% юго-азиатов. Эти лица страдают гемалитической анемией, которая может быть смягчена применением окислительных препаратов и может потребовать переливания крови. Точное распространение малой альфа-талассемии (отсутствуют один или два гена) не выяснено, но она составляет 5—30% среди негров и 15—30% среди юго-азиатов. Эти лица обычно страдают микроцитозом средней тяжести и требуют дальнейшего генетического обследования.
Аномалия гемоглобина Е — третья по распространенности гемоглобинопатия в мире и наиболее общая гемоглобинопатия в Южной Азии, где ее распространенность достигает 30%. Потомство таких лиц может болеть большой талассемией, если второй партнер также имел соответствующий признак. Такая комбинация является основной причиной возникновения тяжелых талассемий в Южной Азии. Массовая иммиграция в США 630 тысяч индокитайцев, более половины которых моложе 18 лет, может привести к удвоению или утроению числа тяжелых талассемий в США.
Электрофорез на ацетатно- или цитратно-целлюлозном агаре или изоэлектрическая фокусировка являются основными скрининговыми тестами для гемоглобиновых заболеваний. Общее тестирование всех новорожденных в отличие от тестирования новорожденных в специфических этнических группах показывает сравнительно небольшую распространенность клинически существенных гемоглобинопатии.
В предыдущем исследовании в ходе общего обследования 84663 новорожденных было обнаружено 89 детей (0,11%) с серповидно-клеточной аномалией и 20 новорожденных (0,02%) с клинически существенной талассемией (гемоглобины FE, F, Н). Хотя результат, возможно, не является существенным, электрофорез высокоспецифичен для таких гемоглобиновых заболеваний, как серповидно-клеточная аномалия.
В одном исследовании каждый из 138 детей с гемоглобином S, обнаруженных при обследовании 3976 черных младенцев, показал наличие того же заболевания через 3—5 лет. Другое исследование 131 ребенка обнаружило только 9 случаев, в которых требовалась переклассификация болезни.
Эффективность обследования беременных женщин зависит от уровня риска в обследуемой популяции. Так, электрофорез в сочетании с подсчетом кровяных телец был поставлен у 298 черных и юго-азиатских женщин. 94 женщины (31,5%) имели отклонение по гемоглобину (включая гемоглобин Е, гены альфа- и бета-талассемий, гемоглобины Н и С, или серповидно-клеточную аномалию).
При исследовании среды 6641 обычной пациентки было обнаружено 185 женщин (3%) с серповидно-клеточной анемией, 68 (1%) с гемоглобином С, 30 (0,5%) с бета-талассемией и 17 (0,3%) с другими отклонениями. Эти результаты были получены комбинацией электрофореза с проверкой красных кровяных телец. Когда применялся гематокрит как единственный тест для определения талассемии, результат был только 0,3 — 0,5%.
В предыдущие годы новая техника диагностики сделала возможным обнаружение серповидно-клеточной аномалии и других гемоглобинопатии у плода, когда у обоих родителей имеются гены заболевания. Ранние анализы включают анализы крови плода, проводимые с помощью фетоскопии или плацентарной аспирации.
Текущие генетические исследования подсказали более безопасную и практичную технику анализа, когда амниоциты наблюдаются с помощью амниоцентеза и хромосомные мутации определяются прямо через рекомбинантную DNA технологию. Эти анализы отличаются высокой точностью (уровень ошибки менее 1 %) при определении серповидно-клеточной аномалии и других форм талассемий.
Принципиальное неудобство состоит, однако, в том, что амниоцентез не может быть проведен до 16 недели беременности. Новая техника, хорионическое синовиальное тестирование может быть проведено на 8—10 неделе беременности.
Обследование на гемоглобиновые отклонения в основном применяется к двум группам населения: новорожденным и взрослым репродуктивного возраста. У новорожденных с серповидно-клеточной аномалией раннее обнаружение помогает предотвратить развитие сепсиса с помощью профилактических антибиотиков. Кроме того, семья может быть достаточно подготовлена к тому, чтобы самостоятельно следить за симптомами и поместить ребенка под медицинское наблюдение.
Серия оптимизированных контрольных опытов показала, что анализы, за которыми следовало профилактическое оральное введение пенициллина новорожденным и маленьким детям, снизило заболеваемость пневмококкальной септицемией на 84%. Продолжавшееся 7 лет изучение показало более низкую смертность у детей, у которых серповидно-клеточное заболевание было диагносцировано при рождении, чем у детей, у которых оно было диагносцировано в возрасте 3 месяцев (2% против 8%).
Но исследователи не замерили соответствующие параметры в контрольной группе. Более краткое исследование (8—20 месяцев) не обнаружило смертей среди 131 новорожденного, отобранных с помощью обследования. Обследование старших детей и подростков имеет своей целью обнаружить носителей признаков: серповидно-клеточного; бета-талассемийного и других, которые часто бывают пропущены в период первых лет жизни. Хотя неочевидно, что эти гетерозиготные лица заболеют, это может иметь важное значение для их потомства.
Идентификация носителей до брака позволяет им получить генетическую консультацию при выборе партнера и пройти диагностические тесты при известии о беременности. Лица, получающие такие формы консультаций, побуждают к этому других лиц — таких, как их партнеры. Обследование 142 пациентов показало, что 62(43%) склонили к обследованию других лиц.
При сравнении с контрольной группой лица, получившие консультацию, демонстрировали существенно лучшее понимание талассемии. Не существует, однако, прямых указаний, что индивидуальные генетические консультации сами по себе существенно определяют репродуктивное поведение или число новорожденных с различными гемоглобиновыми заболеваниями.
Определение статуса родителей особенно важно в течение беременности для выяснений необходимости исследования плода на гемоглобинопатию. Если тест положителен, у них есть время на обсуждение продолжения беременности и обеспечение наилучшего ухода за их ребенком. Исследования показывают, что беременные женщины с положительным тестом на талассемию приводят на тестирование своего партнера, и если тест отца тоже положителен, около 60% прибегают к камниоцентезу.
Если обнаружена серповидно-клеточная аномалия у плода, около 50% родителей делают аборт. Существуют данные из некоторых европейских стран с высоким распространением бета-талассемии, что число больных новорожденных существенно сократилось после введения общего пренатального обследования, аналогичные данные получены по Северной Америке.
Общее обследование новорожденных на серповидно-клеточную аномалию было рекомендовано Национальным институтом здоровья. Обследование детей из групп высокого риска рекомендовалось ВОЗ и Британским обществом гематологии. Обследование новорожденных на серповидно-клеточную аномалию рекомендуется также в многочисленной медицинской литературе. Обследование новорожденных на гемоглобинопатии обязательно во многих штатах.
Обследование детей старшего возраста и молодых взрослых, в общем, не рекомендуется. Некоторые штаты настаивают на обязательном обследовании школьников, но многие авторы возражают против этого. Канадские ученые отмечают низкую эффективность поголовного обследования на талассемию, но рекомендуют обследованию выходцев из Азии, Африки и Средиземноморья.
Британское общество гематологов рекомендует подсчет красных кровяных телец для всех беременных женщин и гемоглобиновый электрофорез для женщин из групп риска. Аналогичные рекомендации для пренатального обследования дает Американский колледж акушеров и гинекологов и другие ведущие эксперты.
Хотя гемоглобинопатии эксклюзивно проявляются среди определенных этнических и расовых групп, некоторые эксперты настаивают на поголовном обследовании новорожденных. Аргументом в защиту избирательного тестирования в группах высокого риска является высокая себестоимость анализа, проводимого среди большого числа лиц низкого риска, для определения редких больных гемоглобинопатиями.
Продолжается обсуждение масштабов обследования на гемоглобинопатии лиц репродуктивного возраста. Критики этого положения утверждают, что проводившаяся в прошлом программа по выявлению гемоглобинопатии показала большую разницу между носителями признака и больными. Кроме того, неясно, смогут ли генетические консультации серьезно сократить число рождающихся больных детей. Сторонники метода говорят, что при раннем диагносцировании врачи могут поставить индивидуальный диагноз, определить риск для пациента и для его будущего потомства.
Анализы крови из пуповины или пятки должны наблюдаться у всех новорожденных из групп риска на гемоглобинопатию. Такие дети должны быть проверены на гемоглобинопатии электрофорезом или другими анализами сравнительной точности. В географических ареалах с широким распространением лиц с риском возникновения гемоглобинопатии общее тестирование новорожденных более предпочтительно, чем выборочное.
Детям с серповидно-клеточной аномалией требуется дальнейшее тестирование, иммунологическая профилактика, профилактика антибиотиками и регулярные клинические наблюдения за ростом и питанием. Их семьи должны получать генетические консультации, касающиеся тестирования семьи и будущего потомства, информацию о болезни, ранних симптомах серьезных осложнений и методах их лечения.
Обсуждается также тестирование подростков и молодых людей с риском гемоглобинопатии. Совет должен включать описание серьезности заболевания и последствий для индивидуума и потомства. Электрофорез должен применяться во время первого пренатального визита у всех негритянок. Носители признака должны быть информированы о необходимости прохождения тестирования отцу и необходимости пренатальной диагностики, если тестирование отца показывает положительный результат.
Г. И. Гаева, И. В. Левандовского, А. И. Спирина
источник

Серповидноклеточная анемия (СКА) является наиболее тяжелой формой наследственных гемоглобинопатий (генетически обусловленных нарушений строения гемоглобина). Серповидные эритроциты быстро разрушаются в организме, а также закупоривают множество сосудов по всему организму, что может стать причиной тяжелых осложнений и даже смерти.
Данное заболевание крови широко распространено в странах Африки и является частой причиной смерти лиц негроидной расы. Это связано с широким распространением малярии в данном регионе (инфекционного заболевания, поражающего эритроциты человека). Ввиду миграции населения и смешивания этнических групп сегодня данный вид анемии может встречаться у людей любой расы в самых различных регионах мира. Мужчины и женщины болеют одинаково часто.
Интересные факты
- Первое документированное упоминание о серповидноклеточной анемии датируется 1846 годом.
- Около 0,5% населения Земли являются здоровыми носителями гена серповидноклеточной анемии.
- Как больные серповидноклеточной анемией, так и бессимптомные носители мутантного гена практически невосприимчивы к малярии. Это связано с тем, что возбудитель малярии (малярийный плазмодий) способен поражать только нормальные эритроциты.
- На сегодняшний день серповидноклеточная анемия считается неизлечимым заболеванием, однако при адекватном лечении больные люди могут доживать до глубокой старости и иметь детей.
Внутреннее пространство эритроцита почти полностью заполнено гемоглобином – особым белково-пигментным комплексом, состоящим из белка глобина и железосодержащего элемента – гема. Именно гемоглобин играет главную роль в транспорте газов в организме.
Каждый эритроцит содержит, в среднем, 30 пикограмм (пг) гемоглобина, что соответствует 300 миллионам молекул данного вещества. Молекула гемоглобина состоит из двух альфа (а1 и а2) и двух бета (b1 и b2) белковых цепей глобина, которые образуются путем соединения множества аминокислот (структурных компонентов белков) в строго определенной последовательности. В каждой цепи глобина находится молекула гема, включающая в себя атом железа.
Образование глобиновых цепей запрограммировано генетически и контролируется генами, расположенными в различных хромосомах. Всего в организме человека 23 пары хромосом, каждая из которых представляет собой длинную и компактную молекулу ДНК (дезоксирибонуклеиновой кислоты), которая включает в себя огромное число генов. Избирательная активация того или иного гена приводит к синтезу определенных внутриклеточных белков, которые в конечном итоге и определяют структуру и функцию каждой клетки организма.
За синтез а-цепей глобина ответственны четыре гена с 16 пары хромосом (ребенок получает по 2 гена от каждого из родителей, а синтез каждой цепи контролируется двумя генами). В то же время синтез b-цепей контролируется только двумя генами, расположенными в 11 паре хромосом (каждый ген отвечает за синтез одной цепи). К каждой образовавшейся цепи глобина присоединяется гем, в результате чего формируется полноценная молекула гемоглобина.
Важно отметить, что кроме альфа-цепей и бета-цепей, в эритроцитах могут образовываться и другие цепи глобина (дельта, гамма, сигма). Их комбинации приводят к образованию различных видов гемоглобина, что характерно для определенных периодов развития человека.
В организме человека определяется:
- HbA. Нормальный гемоглобин, состоящий из двух альфа и двух бета-цепей. В норме данная форма составляет более 95% гемоглобина взрослого человека.
- HbA2. Малая фракция, в норме составляющая не более 2% всего гемоглобина взрослого человека. Состоит из двух альфа и двух сигма-цепей глобина.
- HbF (фетальный гемоглобин). Данная форма состоит из двух альфа и двух гамма-цепей и преобладает в период внутриутробного развития плода. Она обладает большим сродством к кислороду, что обеспечивает тканевое дыхание ребенка в период рождения (когда доступ кислорода из организма матери ограничен). У взрослого человека доля HbF не превышает 1 – 1,5% и встречается в 1 – 5% эритроцитов.
- HbU (эмбриональный гемоглобин). Начинает образовываться в эритроцитах со 2 недели после зачатия и полностью замещается фетальным гемоглобином после начала кроветворения в печени.
Транспортная функция эритроцитов обусловлена наличием атомов железа в составе гемоглобина. При прохождении через легочные капилляры железо присоединяет к себе молекулы кислорода и транспортирует их ко всем тканям организма, где происходит отделение кислорода от гемоглобина и переход его в клетки различных органов. В живых клетках кислород принимает участие в клеточном дыхании, а побочным продуктом данного процесса является углекислый газ, который выделяется из клеток и также связывается с гемоглобином.
При повторном прохождении через легочные капилляры углекислый газ отсоединяется от гемоглобина и выделяется из организма с выдыхаемым воздухом, а к освободившемуся железу присоединяются новые молекулы кислорода.
Образование эритроцитов (эритропоэз) впервые отмечается на 19 день эмбрионального развития в желточном мешке (особом структурном компоненте эмбриона). По мере роста и развития человеческого организма кроветворение происходит в различных органах. Начиная с 6 недели внутриутробного развития основным местом образования эритроцитов являются печень и селезенка, а на 4 месяце появляются первые очаги кроветворения в красном костном мозге (ККМ).
Красный костный мозг представляет собой совокупность стволовых кроветворных клеток, расположенных в полостях костей организма. Больше всего вещества ККМ находится в губчатых костях (костях таза, черепа, тел позвонков), а также в длинных трубчатых костях (плеча и предплечья, бедра и голени). Постепенно доля кроветворения в ККМ увеличивается. После рождения ребенка кроветворная функция печени и селезенки угнетается, и костный мозг становится единственным местом образования эритроцитов и других клеток крови – тромбоцитов, обеспечивающих свертываемость крови, и лейкоцитов, выполняющих защитную функцию.
Все клетки крови образуются из так называемых стволовых клеток, которые появляются в организме плода на раннем этапе эмбрионального развития в небольшом количестве. Данные клетки считаются практически бессмертными и уникальными. Они содержат ядро, в котором располагается ДНК, а также множество других структурных компонентов (органоидов), необходимых для роста и размножения.
В скором времени после образования стволовая клетка начинает делиться (размножаться), в результате чего появляется множество ее клонов, которые дают начало другим клеткам крови.
Из стволовой клетки образуется:
- Клетка-предшественница миелопоэза. Эта клетка схожа со стволовой, но обладает меньшим потенциалом к дифференцировке (приобретению специфических функций). Под влиянием различных регуляторных факторов она может начать делиться, при этом происходит постепенная утрата ядра и большинства органоидов, а результатом описанных процессов является образование эритроцитов, тромбоцитов или лейкоцитов.
- Клетка-предшественница лимфопоэза. Данная клетка обладает еще меньшей способностью к дифференцировке. Из нее образуются лимфоциты (разновидность лейкоцитов).
Процесс дифференцировки (превращения) клетки-предшественницы миелопоэза в эритроцит стимулируется особым биологическим веществом – эритропоэтином. Он выделяется почками, если ткани организма начинают испытывать недостаток в кислороде. Эритропоэтин усиливает образование эритроцитов в красном костном мозге, их количество в крови повышается, что увеличивает доставку кислорода к тканям и органам.
Эритропоэз в красном костном мозге длится около 4 – 6 дней, после чего в кровоток выделяются ретикулоциты (молодые формы эритроцитов), которые в течение суток окончательно созревают, превращаясь в нормальные эритроциты, способные выполнять транспортную функцию.
Средняя продолжительность жизни нормального эритроцита оставляет 100 – 120 дней. Все это время они циркулируют в крови, постоянно изменяясь и деформируясь при прохождении через капилляры органов и тканей. С возрастом происходит уменьшение пластических свойств эритроцитов, они становятся более округлыми и утрачивают способность к деформации.
В норме небольшая доля красных клеток крови разрушается в красном костном мозге, в печени или непосредственно в сосудистом русле, однако абсолютное большинство стареющих эритроцитов разрушается в селезенке. Ткань данного органа представлена множеством синусоидных капилляров, имеющих в своих стенках узкие щели. Нормальные эритроциты без труда проходят через них, после чего возвращаются в кровоток. Старые эритроциты менее пластичны, в результате чего они застревают в синусоидах селезенки и разрушаются специальными клетками данного органа (макрофагами). Кроме того, изъятию из кровообращения и разрушению подвергаются эритроциты с нарушенной структурой (как при серповидноклеточной анемии) либо зараженные различными вирусами или микроорганизмами.
В результате разрушения эритроцитов, образуется и выделяется в кровоток пигмент желтого цвета – билирубин (непрямой, несвязанный). Это вещество плохо растворяется в воде. С током крови оно переносится в клетки печени, где связывается с глюкуроновой кислотой – образуется связанный, или прямой, билирубин, который включается в состав желчи и выделяется с калом. Часть его всасывается в кишечнике и выделяется с мочой, придавая ей желтоватый оттенок.
Железо, входящее в состав гема, также выделяется в кровоток при разрушении эритроцитов. В свободной форме железо токсично для организма, поэтому оно быстро связывается со специальным белком плазмы – трансферрином. Трансферрин переносит железо в красный костный мозг, где оно вновь используется для синтеза эритроцитов.
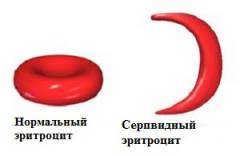
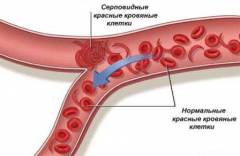
Артериальная кровь, оттекающая от легких, насыщена кислородом, поэтому никаких изменений в структуре гемоглобина не происходит. На тканевом уровне молекулы кислорода переходят в клетки различных органов, что приводит к полимеризации гемоглобина и образованию серповидных эритроцитов.
На начальных этапах заболевания данный процесс обратим — при повторном прохождении через легочные капилляры кровь насыщается кислородом, и эритроциты приобретают свою нормальную форму. Однако такие изменения повторяются каждый раз, когда эритроциты проходят через различные ткани и отдают им кислород (сотни или даже тысячи раз в день). В результате этого строение мембраны эритроцитов нарушается, повышается ее проницаемость для различных ионов (из клетки выходит калий и вода), что привод к необратимому изменению формы эритроцитов.
Пластические способности серповидного эритроцита значительно снижены, он не способен обратимо деформироваться при прохождении через капилляры и может закупоривать их. Нарушение кровоснабжения различных тканей и органов обуславливает развитие тканевой гипоксии (недостатка кислорода на тканевом уровне), что приводит к образованию еще большего количества серповидных эритроцитов (образуется так называемый порочный круг).
Мембрана серповидных эритроцитов отличается повышенной ломкостью, в результате чего продолжительность их жизни значительно укорачивается. Уменьшение общего количества эритроцитов в крови, а также местные нарушение кровообращения на уровне различных органов (в результате закупорки сосудов) стимулирует образование эритропоэтина в почках. Это усиливает эритропоэз в красном костном мозге и может частично или полностью компенсировать проявления анемии.
Важной отметить, что HbF (состоящий из альфа-цепей и гамма-цепей), концентрация которого в некоторых эритроцитах достигает 5 – 10%, не подвергается полимеризации и предотвращает серповидную трансформацию эритроцитов. Клетки с малым содержанием HbF подвергаются изменениям в первую очередь.
Половые клетки мужчины и женщины содержат в себе по 23 хромосомы. В процессе оплодотворения происходит их слияние, в результате чего образуется качественно новая клетка (зигота), из которой и начинает развиваться плод. Ядра мужских и женских половых клеток также сливаются между собой, восстанавливая, таким образом, полноценный набор хромосом (23 пары), присущий клеткам человеческого организма. При этом ребенок наследует генетический материал от обоих родителей.
Серповидноклеточная анемия наследуется по аутосомно-рецессивному типу, то есть, чтобы родился больной ребенок, он должен унаследовать мутантные гены от обоих родителей.
В зависимости от набора генов, полученных от родителей, может родиться:
- Ребенок, больной серповидноклеточной анемией. Такой вариант возможен в том и только в том случае, если и отец, и мать ребенка больны данным заболеванием либо являются его бессимптомными носителями. При этом ребенок должен унаследовать по одному дефектному гену от обоих родителей (гомозиготная форма заболевания).
- Бессимптомный носитель. Данный вариант развивается в том случае, если ребенок наследует один дефектный и один нормальный ген, который кодирует образование нормальных цепей глобина (гетерозиготная форма заболевания). В результате в эритроците будет примерно одинаковое количество как гемоглобина S, так и гемоглобина А, которого достаточно для поддержания нормальной формы и функции эритроцита в обычных условиях.
На сегодняшний день не удалось установить точную причину возникновения генных мутаций, приводящих к возникновению серповидноклеточной анемии. Однако исследованиями последних лет выявлен ряд факторов (мутагенов), воздействие которых на организм может приводить к повреждению генетического аппарата клеток, вызывая целый ряд хромосомных заболеваний.
Причиной генетических мутаций может быть:
- Малярийная инфекция. Данное заболевание вызывается малярийными плазмодиями, которые при попадании в организм человека поражают эритроциты, вызывая их массовую гибель. Это может приводить к мутациям на уровне генетического аппарата красных клеток крови, обуславливая появление различных заболеваний, в том числе серповидноклеточной анемии и других гемоглобинопатий. Некоторые исследователи склонны считать, что хромосомные мутации в эритроцитах являются своего рода защитной реакцией организма против малярии, так как серповидные эритроциты практически не поражаются малярийным плазмодием.
- Вирусная инфекция. Вирус представляет собой неклеточную форму жизни, состоящую из нуклеиновых кислот РНК (рибонуклеиновой кислоты) или ДНК (дезоксирибонуклеиновой кислоты). Данный инфекционный агент способен размножаться только внутри клеток живого организма. Поражая клетку, вирус встраивается в ее генетический аппарат, изменяя его таким образом, что клетка начинает продуцировать новые фрагменты вируса. Данный процесс может вызывать возникновение различных хромосомных мутаций. В качестве мутагена могут выступать цитомегаловирусы, вирусы краснухи и кори, гепатита и многие другие.
- Ионизирующее излучение. Представляет собой поток невидимых невооруженным глазом частиц, которые способны воздействовать на генетический аппарат абсолютно всех живых клеток, приводя к возникновению множества мутаций. Количество и выраженность мутаций зависит от дозы и длительность облучения. Помимо естественного радиационного фона Земли дополнительными источниками радиации могут стать аварии на АЭС (атомных электростанциях) и взрывы атомных бомб, частные рентгенологические исследования.
- Вредные факторы окружающей среды. В данную группу входят различные химические вещества, с которыми сталкивается человек в процессе своей жизнедеятельности. Сильнейшими мутагенами являются эпихлоргидрин, используемый в производстве множества медикаментов, стирол, использующийся при изготовлении пластмасс, соединения тяжелых металлов (свинца, цинка, ртути, хрома), табачный дым и множество других химических соединений. Все они обладают высокой мутагенной и канцерогенной (вызывающей рак) активностью.
- Лекарственные препараты. Действие некоторых медикаментов обусловлено их влиянием на генетический аппарат клеток, что связано с риском возникновения различных мутаций. Наиболее опасными лекарственными мутагенами являются большинство противоопухолевых препаратов (цитостатиков), препараты ртути, иммунодепрессанты (угнетающие деятельность иммунной системы).
На тяжесть клинического течения серповидноклеточной анемии влияют:
- Наличие гемоглобина F. Чем его больше, тем менее выражена симптоматика заболевания. Этим объясняется отсутствие симптомов СКА у новорожденных – большая часть HbF замещается на HbA к шестому месяцу жизни ребенка.
- Климатические и географические условия. Давление кислорода во вдыхаемом воздухе обратно пропорционально высоте над уровнем моря. Другими словами, чем выше находится человек, тем меньше кислорода поступает в его легкие при каждом вдохе. Симптомы серповидноклеточной анемии могут проявляться и ухудшаться уже через несколько часов после поднятия на высоту более 2000 метров над уровнем моря (даже у людей с гетерозиготной формой заболевания). Больным СКА абсолютно противопоказано проживание в условиях высокогорья (некоторые города Америки и Европы располагаются на высоте в несколько километров).
- Социально-экономические факторы. Доступность и своевременность лечения осложнений серповидноклеточной анемии также влияет на выраженность клинических проявлений заболевания.
Внешние проявления серповидноклеточной анемии обусловлены, в первую очередь, скоростью разрушения (гемолиза) серповидных эритроцитов (срок жизни которых укорачивается до 10 – 15 дней), а также различными осложнениями, возникающими в результате закупорки серповидными эритроцитами капилляров по всему организму.
Среди симптомов серповидноклеточной анемии выделяют:
- симптомы, связанные с разрушением эритроцитов;
- гемолитические кризы;
- симптомы, обусловленные закупоркой мелких сосудов;
- увеличение селезенки;
- склонность к тяжелым инфекциям.
Данная группа симптомов обычно начинает проявляться через полгода жизни ребенка, когда уменьшается количество гемоглобина F (в тяжелых случаях гомозиготной формы заболевания) либо в более поздние сроки.
Наиболее ранними проявлениями серповидноклеточной анемии являются:
- Бледность. Развивается из-за уменьшения количества красных клеток в крови. Кожа и видимые слизистые оболочки (полости рта, конъюнктивы глаза и другие) становятся бледными и сухими, кожа становится менее эластичной.
- Повышенная утомляемость. Дети с серповидноклеточной анемией характеризуются вялым и малоподвижным образом жизни. При любой физической нагрузке увеличивается потребность организма в кислороде, то есть развивается гипоксия. Это приводит к тому, что большее число эритроцитов приобретают серповидную форму и разрушается. Транспортная функция крови снижается, в результате чего быстро появляется чувство усталости.
- Частые головокружения. Обусловлены недостатком кислорода на уровне головного мозга, что является опасным для жизни состоянием.
- Одышка. Данный термин подразумевает увеличение частоты и глубины дыхательных движений, возникающее в результате ощущения нехватки воздуха. У больных серповидноклеточной анемией этот симптом обычно возникает в периоды физической активности, однако возможно его появление и в покое (при тяжелых формах заболевания, в условиях высокогорья).
- Отставание в росте и развитии. Ввиду того, что транспортная функция крови значительно снижена, ткани и органы не получают достаточного количества кислорода, необходимого для нормального роста и развития организма. Следствием этого является отставание в физическом и умственном развитии — дети позже, чем их сверстники, начинают ходить, говорить, им хуже дается школьная программа. Также отмечается задержка в половом созревании ребенка.
- Желтушность кожи. Пигмент билирубин, выделяющийся в кровоток при разрушении эритроцитов, придает коже и видимым слизистым оболочкам желтоватую окраску. В норме данное вещество довольно быстро нейтрализуется в печени и выводится из организма, однако при серповидноклеточной анемии количество разрушающихся эритроцитов настолько велико, что печень оказывается не в состоянии обезвредить весь образующийся билирубин.
- Темная моча. Цвет мочи изменяется из-за увеличения концентрации билирубина в ней.
- Избыток железа в организме. Данное состояние может развиться в результате тяжелых, часто повторяющихся гемолитических кризов, когда в кровоток выделяется слишком много свободного железа. Это может привести к возникновению гемосидероза – патологического состояния, характеризующегося отложением оксида железа в различных тканях (в ткани печени, селезенки, почек, легких и так далее), что приведет к нарушению функции пораженных органов.
Гемолитические кризы могут возникать в различные периоды жизни. Длительность ремиссии (периода без кризов) может исчисляться месяцами или годами, после чего может наступить целый ряд приступов.
Развитию гемолитического криза может предшествовать:
- тяжелая генерализованная инфекция;
- тяжелая физическая работа;
- подъем на большую высоту (более 2000 метров над уровнем моря);
- воздействие чрезмерно высоких или низких температур;
- обезвоживание (истощение запасов жидкости в организме).
Для гемолитического криза характерно быстрое образование большого числа серповидных эритроцитов, которые закупоривают мелкие сосуды и разрушаются в селезенке, печени, красном костном мозге и других органах, а также непосредственно в сосудистом русле. Это приводит к резкому уменьшению количества красных клеток крови в организме, что проявляется нарастанием одышки, частыми головокружениями (вплоть до потери сознания) и другими симптомами, описанными ранее.
Как уже говорилось, серповидные эритроциты не способны проходить через мелкие сосуды, поэтому застревают в них, что приводит к нарушению кровообращения практически в любых органах.
Симптомами серповидноклеточной анемии являются:
- Болевые кризы. Возникают в результате закупорки сосудов, питающих определенные органы. Это приводит к развитию недостатка кислорода на тканевом уровне, что сопровождается приступами сильной острой боли, которые могут длиться от нескольких часов до нескольких дней. Результатом описанных процессов является гибель участка ткани или органа, доставка кислорода к которому нарушена. Болевые кризы могут возникать внезапно на фоне полного благополучия, однако чаще всего им предшествуют вирусные и бактериальные инфекции, выраженная физическая нагрузка или другие состояния, сопровождающиеся развитием гипоксии.
- Кожные язвы. Развиваются в результате закупорки мелких сосудов и нарушения кровообращения в различных участках кожных покровов. Пораженный участок изъязвляется и довольно часто инфицируется, что может стать причиной развития тяжелых инфекционных заболеваний. Наиболее характерным расположением язв является кожа верхних и нижних конечностей, однако возможно поражение кожи туловища, шеи и головы.
- Нарушения зрения. Развиваются в результате закупорки артерии, питающей сетчатку глаза. В зависимости от диаметра пораженного сосуда могут появляться различные нарушения, начиная от снижения остроты зрения и заканчивая отслойкой сетчатки и развитием слепоты.
- Сердечная недостаточность. Причиной поражения сердца может быть закупорка серповидными эритроцитами коронарных артерий (сосудов, доставляющих кровь к сердечной мышце) и развитие острого инфаркта миокарда (гибели части сердечной мышцы, вызванной нарушением доставки кислорода). Кроме того, длительная анемия и гипоксия рефлекторно вызывают увеличение частоты сердечных сокращений. Это может привести к гипертрофии (увеличению в размерах) сердечной мышцы с последующим истощением компенсаторных механизмов и развитием сердечной недостаточности.
- Гематурия (кровь в моче). Данный симптом может появляться в результате тромбоза почечных вен и поражения нефронов (функциональных единиц почечной ткани, в которых происходит образование мочи), в результате чего они становятся проницаемыми для эритроцитов. При длительном течении заболевания может наступить гибель более 75% нефронов и развитие почечной недостаточности, что является неблагоприятным прогностическим признаком.
- Приапизм. Данный термин подразумевает спонтанное возникновение длительной и болезненной эрекции полового члена у мужчин. Этот симптом обусловлен закупоркой мелких капилляров и вен, через которые происходит отток крови от органа, что иногда может привести к развитию импотенции.
- Изменение структуры костей. Для серповидноклеточной анемии характерны частые инфаркты костной ткани, что приводит к изменению структуры костей, они становятся менее прочными. Кроме того длительная гипоксия стимулирует выделение большого количества эритропоэтина почками, что приводит к разрастанию эритроидного ростка кроветворения в красном костном мозге и деформации костей черепа позвонков, ребер.
- Поражение суставов. Отмечаются припухлость и болезненность суставов конечностей (стоп, голеней, кистей, пальцев тук и ног).
- Неврологические проявления. Являются результатом закупорки артерий, питающих различные участки головного и спинного мозга. Неврологическая симптоматика у больных серповидноклеточной анемией может проявляться нарушениями чувствительности, парезами (нарушением двигательных функции), плегиями (полной утратой двигательных функций в конечностях), а также острым ишемическим инсультом (возникающим в результате закупорки артерии головного мозга), что может привести к смерти человека.
Увеличение селезенки происходит в результате задерживания и разрушения в ней большого числа серповидных эритроцитов. Кроме того, могут развиваться инфаркты селезенки, в результате чего значительно снижаются ее функциональные способности.
На начальных этапах серповидноклеточной анемии в селезенке задерживаются и разрушаются только серповидные эритроциты. По мере прогрессирования заболевания происходит закупорка синусоидов органа, что нарушает прохождение (фильтрацию) всех остальных клеток крови и обуславливает увеличение органа в размерах (спленомегалию).
В результате застоя крови в увеличенной селезенке может развиться состояние, называемое гиперспленизмом. Оно характеризуется разрушением не только поврежденных, но и нормальных клеточных элементов (тромбоцитов, лейкоцитов, неизмененных эритроцитов). Это сопровождается быстрым уменьшением количества данных клеток в периферической крови и развитием соответствующих симптомов (частых кровотечений, нарушения защитных свойств организма). Развитие гиперспленизма особенно опасно в раннем детском возрасте, когда в увеличенной селезенке может произойти быстрое разрушение большинства эритроцитов крови, что приведет к смерти ребенка.

В диагностике серповидноклеточной анемии применяется:
- общий анализ крови;
- биохимический анализ крови;
- электрофорез гемоглобина;
- ультразвуковое исследование (УЗИ);
- рентгенологическое исследование.
Один из первых анализов, назначаемых всем пациентам при подозрении на заболевание крови. Он позволяет оценить клеточный состав периферической крови, что дает информацию о функциональном состоянии различных внутренних органов, а также о кроветворении в красном костном мозге, наличии инфекции в организме. Для общего анализа могут брать как капиллярную кровь (из пальца), так и венозную.
Техника взятия капиллярной крови
Кровь берут утром, натощак. Накануне перед сдачей анализа не рекомендуется употреблять алкогольные напитки, курить или принимать наркотические препараты. Непосредственно перед взятием крови следует согреть пальцы левой руки, что улучшит микроциркуляцию и облегчит процедуру.
Забор материала для анализа производится медицинской сестрой в процедурном кабинете поликлиники. Кожу кончика пальца обрабатывают ватным тампоном, который предварительно смачивают 70% раствором спирта (с целью предотвращения занесения инфекции). После этого специальной иглой-скарификатором производят прокол кожи на боковой поверхности пальца (обычно используется 4 палец левой руки, однако это не принципиально). Первая появившаяся капля крови удаляется ватным тампоном, после чего медсестра начинает поочередно сдавливать и отпускать кончик пальца, набирая в стерильную градуированную трубку несколько миллилитров крови.
При подозрении на серповидноклеточную анемию палец, из которого будет браться кровь, предварительно перевязывают веревкой или жгутом (на 2 – 3 минуты). Это создает условия гипоксии, в результате чего образуется большее число серповидных эритроцитов, что облегчит постановку диагноза.
Техника взятия венозной крови
Забор крови также производится медицинской сестрой. Правила подготовки к анализу такие же, как при взятии крови из пальца. Обычно кровь берут из подкожных вен локтевой области, расположение которых довольно легко определить.
Пациент присаживается и кладет руку на спинку стула, максимально разгибая ее в локтевом суставе. Медсестра накладывает резиновый жгут в плечевой области (сдавливание подкожных вен приводит к переполнению их кровью и выбуханию над поверхностью кожи) и просит пациента несколько секунд «поработать кулаком» (сжимать и разжимать кулак), что также способствует наполнению вен кровью и облегчает их определение под кожей.
Определив расположение вены, медсестра дважды обрабатывает локтевую область ватным тампоном, предварительно пропитанным 70% спиртовым раствором. После этого стерильным одноразовым шприцем прокалывается кожа и стенка вены и производится забор необходимого количества крови (обычно нескольких миллилитров). К месту прокола прижимается чистый ватный тампон (также смоченный в спирте), и игла извлекается. Пациенту рекомендуют подождать в коридоре 10 – 15 минут, так как возможно возникновение определенных побочных реакций (головокружения, потери сознания).
Микроскопическое исследование крови
Несколько капель полученной крови переносится на предметное стекло, окрашивается специальными красителями (обычно метиленовым синим) и исследуется в световом микроскопе. Данный метод позволяет примерно определить количество клеточных элементов крови, оценить их размеры и строение.
При серповидноклеточной анемии возможно выявление серповидных эритроцитов (при исследовании венозной крови), однако их отсутствие не исключает диагноза. Обычное микроскопическое исследование не всегда позволяет выявить серповидные эритроциты, поэтому применяется исследование «влажного мазка» крови. Суть исследования заключается в следующем — каплю крови переносят на предметное стекло и обрабатывают особым веществом – пиросульфитом натрия. Он «вытягивает» кислород из эритроцитов, в результате чего они приобретают серповидную форму (если человек действительно болен серповидноклеточной анемией), что обнаруживается при исследовании в обычном световом микроскопе. Данное исследование является высокоспецифичным и позволяет подтвердить диагноз в большинстве случаев.
Исследование крови в гематологическом анализаторе
Большинство современных лабораторий оборудованы гематологическими анализаторами – аппаратами, позволяющими быстро и точно определить количественный состав всех клеточных элементов, а также многие другие параметры крови.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при серповидноклеточной анемии |
| Концентрация эритроцитов (RBC) | При серповидноклеточной анемии отмечается выраженное разрушение эритроцитов (гемолиз), в результате чего их концентрация в крови будет снижена. Данное состояние особенно характерно для гемолитических кризов, когда может разрушаться более половины циркулирующих в крови эритроцитов. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Общий уровень гемоглобина (HGB) | В результате разрушения эритроцитов снижается и общий уровень гемоглобина в крови. | М: 130 – 170 г/л. | Менее 130 г/л. |
| Ж: 120 – 150 г/л. | Менее 120 г/л. | ||
| Концентрация лейкоцитов (WBC) | Лейкоциты защищают организм от различных инфекционных агентов. При серповидноклеточной анемии отмечается предрасположенность к инфекционным заболеваниям, ввиду чего данный показатель может повышаться. | 4,0 – 9,0 х 10 9 /л. | Повышение уровня лейкоцитов выше 9,0 х 10 9 /л говорит о наличии инфекционного процесса в организме. |
| Концентрация тромбоцитов (PLT) | В случае развития гиперспленизма в увеличенной селезенке разрушаются не только серповидные эритроциты, но и нормальные клетки крови. | 180 – 320 х 10 9 /л. | В норме или снижена. |
| Концентрация ретикулоцитов (RET) | Уменьшение концентрации эритроцитов стимулирует выделение эритропоэтина почками, что усиливает процессы кроветворения в красном костном мозге. Результатом этого является выделение в периферический кровоток большого количества ретикулоцитов. | М: 0,24 – 1,7%. | Повышена, особенно после гемолитических кризов. |
| Ж: 0,12 – 2,05%. | |||
| Гематокрит (Hct) | Гематокрит – лабораторный показатель, отражающий количественное соотношение между клеточными элементами крови и объемом плазмы. Выраженный гемолиз приводит к уменьшению общего количества эритроцитов и, следовательно, к уменьшению гематокрита. | М: 42 – 50%. | Ниже нормы, вплоть до 15 – 20% в периоды гемолитических кризов. |
| Ж: 38 – 47%. | |||
| Скорость оседания эритроцитов (СОЭ) | Определяется время, в течение которого произойдет оседание эритроцитов на дно пробирки. В нормальных условиях наружная поверхность мембран эритроцитов несет отрицательный заряд, в результате чего клетки отталкиваются друг от друга. Уменьшение концентрации эритроцитов, а также различные инфекционные процессы в организме способствуют более быстрому оседанию эритроцитов. | М: 3 – 10 мм/час. | Более 10 мм/час. |
| Ж: 5 – 15 мм/час. | Более 15 мм/час. |
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при серповидноклеточной анемии |
| Уровень билирубина (несвязанная фракция) | Данный показатель отображает интенсивность процессов разрушения эритроцитов как в селезенке, так и непосредственно в сосудистом русле. | 4,5 – 17,1 мкмоль/л. | Значительно выше нормы. |
| Свободный гемоглобин плазмы | Данный показатель отображает интенсивность процесса разрушения эритроцитов непосредственно внутри сосудов (внутрисосудистого гемолиза), при котором в кровь выделяется большое количество свободного гемоглобина. | Менее 220 мг/л. | Значительно выше нормы, особенно в период гемолитического криза. |
| Уровень гаптоглобина в плазме | Гаптоглобин – это белок плазмы крови, образующийся в печени. Одной из основных его функций является связывание свободного гемоглобина в крови и транспортировка его в селезенку, где он подвергается разрушению. При гемолизе эритроцитов в сосудистом русле количество выделяемого в кровь гемоглобина настолько велико, что весь гаптоглобин находится в связанном с ним состоянии, поэтому его количество уменьшается. | 0,8 – 2,7 г/л. | Значительно ниже нормы, особенно в период гемолитических кризов. |
| Концентрация свободного железа в крови | Повышение количества свободного железа в плазме крови обычно характерно для гемолитического криза. Белок трансферрин не успевает связать все железо, поступающее в кровь в результате разрушения большого количества эритроцитов, поэтому его концентрация повышается. | М: 17,9 – 22,5 мкмоль/л. | В период гемолитического криза данный показатель может быть в несколько раз выше нормы. |
| Ж: 14,3 – 17,9 мкмоль/л. | |||
| Уровень аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) | Данные вещества являются внутриклеточными ферментами, содержащимися в клетках печени в больших количествах. Увеличение их концентрации в крови является маркером разрушения ткани печени, что может быть следствием микроинфарктов (в результате закупорки печеночных сосудов серповидными эритроцитами). | М: до 41 Ед/л. | При тяжелом течении заболевания значительно превышает норму. |
| Ж: до 31 Ед/л. |
Широко распространенный научный метод исследования, позволяющий определить качественный состав гемоглобина в крови. Суть метода заключается в следующем — на бумагу, расположенную в стационарном электрическом поле между двумя электродами, помещают раствор, содержащий различные белки, которые начинают перемещаться от катода (отрицательно заряженного электрода) к аноду (положительно заряженному электроду).
Скорость перемещения белковых молекул зависит от их молекулярной массы, пространственной конфигурации и электрического заряда. Данные параметры строго специфичны для каждой отдельной цепи глобина (как нормальной, так и патологической), в результате чего их электрофоретическая подвижность будет различной. На основании контрольных маркеров определяют виды гемоглобина в исследуемой крови и количество каждого из них.
| Вид гемоглобина | Нормальные значения | Возможные изменения при серповидноклеточной анемии |
| HbA | Более 95%. | Менее 50%. |
| HbA2 | Менее 2%. | В норме или снижено. |
| HbF | 1 – 1,5 %. | В норме или слегка повышено. |
| HbS | Отсутствует. | 50% и более. |
Современный метод исследования внутренних органов, основанный на принципе эхолокации, позволяющий определить расположение и структуру объекта по скорости возвращения звуковой волны, отраженной от его поверхности.
УЗИ является одним из наиболее простых и безвредных диагностических методов. За несколько часов перед исследованием пациенту необходимо исключить прием пищи и больших объемов жидкости. Сама процедура может проводиться как в специально оборудованном кабинете, так и непосредственно у постели больного. На кожу исследуемой области наносится специальный гель (это предотвращает попадание воздуха между датчиком и кожей пациента, что могло бы исказить результаты исследования). После этого врач прикладывает к коже пациента специальный датчик, излучающий ультразвуковые волны, и начинает перемещать его над исследуемой областью. Звуковые волны отражаются от поверхностей различных органов и структур, находящихся на их пути, и улавливаются специальным приемником. После компьютерной обработки на мониторе появляется примерное изображение исследуемых тканей и органов.
Разновидностью ультразвукового исследования является допплерография – метод, позволяющий оценить характер кровотока в сосудах.
При серповидноклеточной анемии метод УЗИ может выявить:
- увеличение селезенки и печени;
- наличие инфарктов во внутренних органах (в селезенке, печени, почках и других);
- нарушение кровообращения во внутренних органах;
- нарушение кровотока в конечностях.
Это исследование основано на способности рентгеновских лучей проходить через организм человека. При этом они частично поглощаются различными тканевыми структурами, в результате чего на специальной пленке формируется теневое отображение всех органов и тканей, оказавшихся на их пути.
Наибольшей поглощающей способностью в организме человека обладает костная ткань, что позволяет использовать данный метод для определения наличия и выраженности поражений костей при серповидноклеточной анемии.
Рентгенологическое исследование позволяет выявить:
- деформацию и расширение тел позвонков (из-за множественных инфарктов);
- деформацию и истончение костей скелета (из-за избыточного разрастания костномозговой ткани);
- наличие остеомиелита (гнойного инфекционного процесса в костной ткани).
Эффективного лечения серповидноклеточной анемии, позволяющего раз и навсегда избавиться от данного недуга, на сегодняшний день не существует. Помощь больным заключаются в предотвращении образования большого количества серповидных эритроцитов, а также в устранении симптомов заболевания.
Принципами лечения серповидноклеточной анемии являются:
- правильный образ жизни;
- повышение количества эритроцитов и гемоглобина;
- кислородотерапия;
- устранение болевого синдрома;
- устранение избытка железа в организме;
- профилактика и лечение инфекционных заболеваний.
Если у человека диагностирована серповидноклеточная анемия, ему следует соблюдать определенные рекомендации, которые позволят облегчить течение заболевания и минимизировать риск развития осложнений.
Пациентам с серповидноклеточной анемией рекомендуется:
- проживать на высоте не более 1500 метров над уровнем моря;
- проживать в зоне с умеренным климатом (исключающим воздействие экстремально низких или высоких температур);
- употреблять не менее 1,5 литров жидкости ежедневно;
- исключить прием алкогольных напитков и наркотиков;
- отказаться от курения (как самому больному человеку, так и членам его семьи);
- избегать тяжелых физических нагрузок;
- выбирать профессию, не связанную с тяжелой физической работой или воздействием высоких/низких температур.
| Название препарата | Механизм леченого действия | Способ применения и дозы | Оценка эффективности лечения | |
| Немедикаментозные методы | ||||
| Эритроцитарная масса | Перелитые донорские эритроциты в течение некоторого времени (обычно не более 100 дней) могут транспортировать дыхательные газы в организме больного. Данный метод используется крайне редко, ввиду возможности развития тяжелых побочных реакций. | Основным показанием для переливания донорских эритроцитов является резкое снижение уровня гемоглобина ниже 70 г/л (например, при гемолитическом кризе). В таком случае устанавливается катетер в одну или сразу в несколько центральных вен (в яремные, расположенные на шее или в подключичные), и производится переливание эритроцитарной массы. Целевой уровень гемоглобина при этом составляет не менее 100 г/л. | ||
Перед началом переливания проводится целый ряд тестов, направленных на определение совместимости крови донора и реципиента.
- повышение уровня гемоглобина (определенное лабораторно);
- исчезновение одышки;
- нормализация цвета кожи.
Применение гидроксимочевины в лечении серповидноклеточной анемии считается экспериментальной методикой. Широкомасштабных исследований, оценивающих эффективность препарата и возможные побочные реакции, еще не проводилось.
Частота и выраженность гемолитических кризов определяет тяжесть клинического течения серповидноклеточной анемии. Как уже говорилось, развитию гемолитического криза предшествуют различные состояния, сопровождающиеся гипоксией. Применение кислорода в первые минуты или часы после начала гемолиза предотвращает образование и последующее разрушение серповидных эритроцитов. Это облегчает течение заболевания, уменьшает риск развития осложнений и улучшает качество жизни пациента.
Пациент с развивающимся гемолитическим кризом должен быть госпитализирован как можно скорее. Непосредственно в машине скорой помощи ему дается кислородная маска, которая обеспечивает подачу кислорода со скоростью 4 – 6 литров в минуту. После поступления в стационар кислородотерапия продолжается на протяжении нескольких часов или дней.
| Название медикамента | Механизм лечебного действия | Способ применения и дозы | Оценка эффективности лечения |
| Трамадол | Синтетическое наркотическое обезболивающее средство, действующее на уровне головного и спинного мозга. Активирует опиоидные рецепторы в организме, что уменьшает интенсивность болевого синдрома. | Внутривенно или внутрь, в дозе 50 – 100 мг. Максимальная суточная доза – 400 мг. Не рекомендуется принимать детям младше 1 года. | Обезболивающий эффект развивается примерно через 15 минут после приема внутрь (при внутривенном введении – через 5 – 10 минут) и длится до 6 часов. |
| Промедол | Активирует опиоидные рецепторы и нарушает передачу болевых импульсов в центральной нервной системе, чем и обусловлено его обезболивающее, противошоковое и легкое снотворное действие. | Внутрь, 3 – 4 раза в день. |
Рекомендуемые дозы:
- детям старше 2 лет – 0,1 – 0,5 мг/кг;
- взрослым – 25 – 50 мг.
Рекомендуемые дозы:
- детям – 0,2 – 0,8 мг/кг;
- взрослым – 10 – 20 мг.
| Название медикамента | Механизм лечебного действия | Способ применения и дозы | Оценка эффективности лечения |
| Десферал (Дефероксамин) | Комплексообразующий препарат, который обладает способностью связывать и выводить свободное железо из организма. | Данный медикамент назначается после гемолитических кризов, при повышении уровня сывороточного железа. Вводится внутривенно. Начальная доза составляет 20 мг/кг. При повторном возникновении кризов доза может быть увеличена до 40 мг/кг. | Лечение проводится до нормализации уровня железа в крови, подтвержденной лабораторно. |
| Эксиджад | Препарат для приема внутрь, обладающий железосвязывающей способностью. Усиливает выведение железа из организма преимущественно с калом. | Внутрь, 1 раз в день, в дозе 10 – 30 мг/кг. | Лечение проводится до нормализации уровня железа в крови. |
| Название медикамента | Механизм лечебного действия | Способ применения и дозы |
| Амоксициллин | Полусинтетический антибиотик, подавляющий образование клеточной стенки различных видов бактерий (стафилококков, стрептококков, пневмококков и других), что приводит к их гибели. | Может назначаться с профилактической целью, начиная с шестимесячного возраста (при тяжелом течении гомозиготной формы серповидноклеточной анемии). Принимается внутрь, 2 – 3 раза в сутки. |
Рекомендуемые дозы:
- детям младше 2 лет – 20 мг/кг;
- детям от 2 до 5 лет – 125 мг;
- детям от 5 до 10 лет – 250 мг;
- детям старше 10 лет и взрослым – 500 мг.
Рекомендуемые дозы:
- детям – 10 – 30 мг/кг, 3 раза в сутки;
- взрослым – 750 мг 3 раза в сутки.
Рекомендуемые дозы:
- детям – 10 – 15 мг/кг, 2 – 3 раза в сутки;
- взрослым – 250 – 500 мг 3 – 4 раза в сутки.
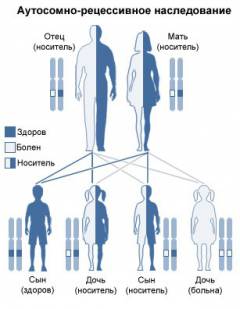
Если один или оба родителя больны серповидноклеточной анемией, то их ребенок также может унаследовать данный недуг. Одним из методов, позволяющим определить вероятность наследования гена, ответственного за развитие данного заболевания, является полимеразная цепная реакция (ПЦР). Суть метода заключается в исследовании генетического материала обоих родителей и выявлении мутантных генов. При этом определяется как их наличие (или отсутствие), так и форма заболевания (гомозиготная или гетерозиготная).
Результаты генетического исследования могут быть следующими:
- Оба родителя больны. Это подразумевает, что у обоих родителей имеется по 2 мутантных гена, кодирующих образование b-цепей глобина. Рождение здорового ребенка в таком случае практически невозможно.
- Оба родителя являются бессимптомными носителями. В данном случае вероятность рождения здорового ребенка составляет 25%, вероятность рождения больного ребенка (с гомозиготной формой заболевания) – 25%, и вероятность рождения бессимптомного носителя (с гетерозиготной формой заболевания) – 50%.
- Один из родителей болен, а второй является бессимптомным носителем. У таких родителей с одинаковой долей вероятности может родиться либо больной ребенок, либо бессимптомный носитель. Рождение абсолютно здорового ребенка в данном случае невозможно.
- Один из родителей болен, а второй здоров. В данном случае ребенок унаследует один мутантный ген от больного родителя и один нормальный ген от здорового родителя, то есть он будет бессимптомным носителем гена серповидноклеточной анемии.
С помощью ПЦР возможно выявить наличие мутантных генов у плода на ранних этапах внутриутробного развития и определить форму заболевания. Это позволяет своевременно поднять вопрос о прерывании беременности.
источник