Электорофорез белков плазмы (EPH) — распространенный диагностический метод в ветеринарии млекопитающих уже много лет. Развитие этого метода упростило процедуру анализа и сейчас требует очень небольших количеств плазмы, что позволяет использовать его в ветеринарии птиц (Cray, 2000) и рептилий (Zaias, Gray,2002).
Техника электрофореза. Основной принцип EPH включает покрытие плазмы или сыворотки тонким агарозным гелем. Прохождение электрического тока через гель заставляет мигрировать белки, в результате чего образуются полосы, зависящие от заряда и размера белковых молекул. После этого гель фиксируют, окрашивают и анализируют полосы визуально или квалифицируют с помощью лазерного сканирования в денситометре. Коммерческие системы для EPH-диагностики упрощают процесс и требуют всего 10 мкл сыворотки или плазмы. После помещения микрообразца в гель его подвергают электрофорезу в течение 40 минут при 100V, высушивают, окрашивают и сканируют в денситометре при 600 нм. Относительный и абсолютный (г/дл) размер белковых фракций можно определить на основании данных об уровне общего белка, полученных методом рефрактометрии.
Вопрос об использовании плазмы или сыворотки уже обсуждался несколькими авторами при исследовании разных видов птиц. Для птиц предпочтительнее использовать плазму. Общий белок плазмы в среднем на 1,7 г/дл, выше, чем в сыворотке из-за присутствия фибриногена. Так как фибриноген является острофазным белком, то есть индикатором острого воспаления, предпочтительнее включать эту фракцию в процесс EPH, как и при определении уровня общего белка. В остальном, сравнение результатов, полученных при EPH сыворотки или плазмы не показывает достоверных различий (Lumei and DeBruije, 1985).
Основные фракции белков, выделенные с помощью EPH включают (слева направо) альбумин, a-1 глобулин, a-2 глобулин, β-глобулин, g-глобулин. На рис. изображена электрофоретограмма здоровой зеленой игуаны. Альбумины представляют максимальную порцию белков плазмы и являются наиболее гомогенной и различимой фракцией у здоровых млекопитающих, птиц и рептилий. Альбумины работают как транспортные белки и определяют приблизительно 75% осмотической активности плазмы. Иногда у здоровых птиц можно обнаружить преальбуминовую фракцию, но у здоровых млекопитающих она встречается редко. Предварительные результаты показывают, что преальбуминовая фракция может встречаться у некоторых видов здоровых черепах (Zaias, Gray, 2002). Значение этих белков не ясно, но скорее всего эта фракция представлена белками, близкими к альбуминам по свойствам (транспортные белки). Альфа-глобулины обычно встречаются у птиц в виде двух отдельных фракций: a-1 и a-2. Эти фракции включают белки острой фазы: a-липопротеин, a-1-антитрипсин и a-2-макроглобулин (Kaneko, 1997; Cray, 2000). Бета-глобулины являются белками острой фазы воспаления и включают фибриноген, трансферрин, бета-липопротеин и комплемент. Они могут выделяться в виде одной или двух отдельных полос или пиков на электрофоретограмме. Фракция гамма-глобулинов представлена циркулирующими иммуноглобулинами. Обычно выделяется один пик, но редко – два. Продукты деградации комплемента также могут мигрировать в эту область (Kaneko, 1997).
В добавлении к оценке белковых фракций, из этих данных можно вычислить и использовать А/Г индекс для определения соотношения альбуминов и глобулинов. У птиц в норме концентрация глобулинов минимальна по сравнению с доминирующими глобулинами. У рептилий ситуация, наверно, похожа. Применяют следующую формулу подсчета А/Г индекса: (преальбумины (если имеются) + альбумины) : (a-1 + a-2 + b + g-глобулины).
Анализ и интерпретация электрофоретограммы.
Хотя нормальные значения этих фракций для рептилий пока не установлены, основы для интерпретации данных EPH можно почерпнуть из литературы о птицах и млекопитающих (Kaneko, 1997). Многие из белков плазмы, в том числе белки острой фазы и иммуноглобулины, заметно изменяются при заболевании. Фракционирование и определение индивидуальных фракций белков позволяет определить характер их повреждения. К примеру, белки острой фазы отвечают за локализацию повреждения и начало выздоровления. Концентрация многих из них повышается, что заметно по увеличению пиков альфа и бета-глобулинов, и часто это наиболее ранний симптом острого воспаления или инфекции. В дальнейшем возрастает фракция гамма-глобулинов в связи с продукцией антител к конкретному патогену.
В качетсве примера на рисунке показана электрофоретограмма от больной игуаны с симптомами слабости, анорексии, фасцикуляцией мышц и нарушением формирования скелета. Биохимия крови показывает инверсию кальция и фосфора. На электрофоретограмме заметно резкое снижение альбуминов (19% вместо 43%) и повышение бета-глобулинов (58% вместо 19%). Эти данные говорят о хронической патологии печени или почек, как потенциальной причине или наоборот, следствии метаболических расстройств. На другом рисунке изображена электрофоретограмма плазмы нескольких игуан разного возраста и общего состояния. Наши предварительные результаты показывают, что помимо увеличения фракции острофазных белков, у больных животных может отмечаться исчезновение некоторых в норме присутствующих минорных фракций.
Нарушенный А/Г индекс часто является первым симптомом диспротеинемии. Понижение этого показателя говорит о значительном повышении глобулинов, понижении альбуминов, или обоих процессах. Снижение индекса при нормальном уровне общего белка – важный симптом диспротеинемии, который без вспомогательного EPH-теста не определяется.
Изменения на электрофоретограмме охарактеризованы пока только у птиц (Cray,1999):
общий белок: Гиперпротеинемия указывает на дегидратацию; гипопротеинемия является нормой у птиц в возрасте до 8 месяцев, у взрослых это обычно указывает на гипергидратацию.
альбумины: Гиперальбуминемия редко встречается без дегидратации; гипоальбуминемия может быть обусловлена потерей почками, печенью, ЖКТ или встречается при эндопаразитарных болезнях. Пониженный синтез альбуминов отмечают при болезнях печени, истощении и при хроническом воспалении.
a1-глобулины: повышение этой фракции характерно при остром воспалении, паразитозах;
a2–глобулины: повышение встречается при остром воспалении, гепатитах, нефритах, нефротическом синдроме.
β-глобулины: повышение обычно при остром и хроническом воспалении, гепатите, нефритах, острых и хронических хламидиозах, аспергиллезе.
g-глобулины: повышение обычно при остром воспалении, инфекционных болезнях, желточном перитоните, иммунных болезнях, опухолях ретикулоэндотелиальной системы.
Физиологические влияния (возраст, гормоны, питание, стресс), не связанные с болезнью, могут изменять показания EPH, что необходимо учитывать при интерпретации. Впрочем, у птиц и млекопитающих эти факторы сами по себе влияют на результаты EPH в значительно меньшей степени, чем болезнь. Принципы, разработанные для птиц, скорее всего, подходят и для рептилий, а для амфибий таких работ пока не было выполнено.
Как и в случае других лабораторных исследований, в результатах электрофоретограмм рептилий могут иметься значительные видоспецифические и сезонные вариации. Поэтому важно накопление первичной информации и установление стандартов для каждой конкретной лаборатории.
Дата добавления: 2015-03-29 ; Просмотров: 1563 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
В плазме человеческой крови находится множество белковых компонентов. Они различны по своему составу, строению и подвижности в определенной среде, проводящей электрический ток. На этом и строится разделение общего белка, который локализуется в плазме, на различные белковые фракции. При проведении электрофореза сыворотки крови выясняют количественное отношение отдельных белковых составляющих и структур. Это необходимо для определения наличия у человека различных патологических явлений, например инфекций или онкологии. Именно электрофорез белков сыворотки крови имеет большое значение при проведении диагностики различных болезней.
Для расщепления белковых фракций применяют электрофорез сыворотки крови, принцип которого основан на разной подвижности белковых компонентов в созданном электрическом поле. Такой метод исследования является более точным и информативным, в отличие от стандартного общего анализа крови. Но при этом электрофорез показывает только количество определённой фракции белка, характер и степень патологического процесса в общей форме. Анализ проведенных исследований позволяет медицинским специалистам выяснить, какое именно соотношение белковых фракций наблюдается в организме человека, и определить специфику патологии, присущую конкретному заболеванию.
Большую часть основной биологической жидкости человека, или крови, составляют белки. В общем количестве их норма находится в пределах 60-80 г/л. Для получения точного анализа проводится электрофорез сыворотки крови на бумаге. Это исследование является самым распространенным способом анализа. Основной средой является особая фильтровальная бумага. Главная ее особенность – высокая гигроскопичность. Такая бумага может поглотить воды больше своего веса в 130-200 раз. В зависимости от применяемого оборудования электрофорез на бумаге длится 4-16 часов. Происходит подразделение белковых структур. Затем полосы бумаги обрабатывают специальными красками для получения анализа. Такая методика является самой распространенной в работе медицинских лабораторий. За счёт воздействия электрического тока белковые фракции, заряженные отрицательно, двигаются в сторону положительно заряженного электрода. Благодаря этому белковые составляющие крови подразделяются на 5 известных фракций:
Альбумины заряжены отрицательно, имеют маленькую, по сравнению с другими фракциями, молекулярную массу. За счет этого скорость их передвижения гораздо выше, чем у остальных фракций, и они дальше всех локализуются от участка старта. Первые три фракции глобулина передвигаются с более низкой скоростью из-за своей массы. Но самая маленькая скорость регистрируется у γ-глобулинов. Эти белки имеют большую массу и крупные, относительно других, размеры. Их заряд почти нейтрален, поэтому данная белковая фракция практически не сдвигается с линии старта.
В настоящее время электрофорез сыворотки крови часто проводимый анализ для постановки точного диагноза болезни. Этот анализ могут назначить как терапевты, так врачи узкого профиля. Показаниями по проведению исследований будут:
- различные воспаления;
- болезни хронической природы;
- патологические процессы в соединительной ткани;
- внутреннее кровотечение;
- злокачественные новообразования.
Для того чтобы полученные результаты поведенных исследований были верными, не менее чем за 8 часов до сдачи крови необходимо отказаться от приёма еды. Кроме того, необходимо согласовать прием лекарственных средств, если таковые имеются, с лечащим врачом.
Для того чтобы результаты не были по ошибке завышены, необходимо снизить до минимума возможность свертывания крови для определения показателя белковых фракций и общего белка. Электрофорез сыворотки крови проводится аккуратно, поскольку существует вероятность искажения полученных результатов из-за фибриногена. Он может прятать ненормальные белки или быть спутанным с ними.
В течение суток после сдачи пробы будет готов анализ на электрофорез белков сыворотки крови. Норма полученных показателей по категориям у взрослых людей:
- Общий белок – 63-82 г/л.
- Альбумины – 40-60 % от общего количества фракций.
- α1-глобулины – 2-5 %.
- α2-глобулины – 7-13 %.
- β-глобулины – 8-15 %
- γ-глобулины – 12-22 %.
Изменение количества любой белковой фракции в большую или меньшую сторону может свидетельствовать о развитии той или иной патологии. Для получения достоверной информации об этом необходим электрофорез белков сыворотки крови. Расшифровка результатов облегчит медицинским специалистам постановку диагноза и выбор лечения.
В самом начале при анализе полученных результатов определяют количество альбумина. Увеличение этой фракции может говорить об обезвоживании. Такое может произойти, если у больного отмечается затяжная рвота или нарушения в пищеварительной системе. Также увеличение альбумина происходит при ожогах большой площади кожного покрова.
Гораздо опаснее, если в организме снижается количество альбуминов, это может говорить о следующих патологиях:
- Поражения почек и печени.
- Патологии желудочно-кишечного тракта.
- Инфекционные процессы.
- Нарушения в деятельности сердечно-сосудистой системы.
- Кровотечения.
- Злокачественные новообразования.
- Сепсис.
- Ревматизм.
Незначительное уменьшение количества альбуминов может быть также:
- У будущих матерей.
- При превышении дозы лекарственных препаратов.
- При длительной лихорадке.
- У заядлых курильщиков.
Уменьшение количества a1-глобулинов регистрируется при недостатке α1-антитрипсина. Увеличение же отмечают при обострении воспалений в организме, нарушениях в работе печени, при тканевом распаде.
Регистрируют его при сахарном диабете, воспалительных процессах в поджелудочной железе, у новорожденных детей при желтухе, при гепатитах токсического происхождения. Свидетельствует оно и о неправильном, несбалансированном питании.
Происходит при наличии следующих заболеваний:
- Воспаления, особенно с присутствием гнойного экссудата (воспаление легких и другие процессы с наличием гноя).
- Поражения соединительной ткани (например, ревматизм).
- Злокачественные новообразования.
- Периоды восстановления после ожогов.
- Поражение почек.
Кроме того, такое явление характерно для гемолиза крови в пробирке во время проведения исследования.
Проявляется при гиперлипопротеидемии (увеличении количества липидов в крови), патологиях печени и почек. Можно обнаружить при открытой язве желудка, а также гипотиреозе (нарушение работы щитовидной железы). Снижение фракции регистрируют при гипобеталипопротеинемии (повышение в крови компонента беталипопротеин).
Эта фракция включает в свой состав иммуноглобулины. Поэтому увеличение γ-глобулинов регистрируется при сбоях в иммунитете. Обычно это происходит при различных инфекциях, развитии воспалительного процесса, изменениях ткани и ожоговых поражениях. Рост γ-глобулинов отмечают у больных хронической формой гепатита. Практически такая же картина характерна для цирроза печени. При запущенных случаях данного заболевания количество белковой фракции γ-глобулинов значительно выше показателя альбуминов. При определенных болезнях могут возникать сбои в образовании γ-глобулинов, и происходит развитие измененных протеинов в крови – парапротеинов. Для выяснения характера такого развития производится дополнительное исследование – иммуноэлектрофорез. Такая картина характерна для миеломного заболевания и патологии Вальденстрема.
Увеличение количества γ-глобулинов также присуще следующим патологиям:
- красной волчанке;
- эндотелиоме;
- ревматоидной форме артрита;
- остеосаркоме;
- хронической форме лимфолейкоза;
- кандидомикозу.
Снижение показателя γ-глобулинов подразделяют на 3 вида:
- Физиологический (характерен для детей в возрасте от трех до пяти месяцев).
- Врожденный (развивается с момента рождения).
- Идиопатический (когда причину развития установить не удается).
Вторичное снижение регистрируется при развитии заболеваний, которые вызывают истощение иммунной системы. В последнее время в медицинской практике все чаще проводится анализ на определение количества преальбуминов. Обычно такое исследование проводят больным, находящимся в реанимации.
Уменьшение количества преальбуминов очень важный и точный тест на определение недостаточности белковых структур в организме пациента. При проведении анализа на преальбумины выполняют коррекцию белкового метаболизма у таких пациентов.
Принцип проведения подобного анализа схож с технологией выполнения электрофореза сыворотки крови. Проводят его для более точной постановки диагноза или обнаружения других патологий. Кроме того такой анализ поможет выявить у больного наличие протеинурии.
Электрофорез сыворотки крови и мочи – важные методы в диагностике различных инфекционных заболеваний. Благодаря методике исследования и высокой точности они помогают определить вид патологии. Точный диагноз – верный путь к правильному лечению и полному выздоровлению.
источник
Этот анализ является исследованием, которое позволяет определить их количественные и качественные показатели по тому, как белки распределяются в электрическом поле. Исследование основано на том, что белковые молекулы несут заряды, положительные или отрицательные в зависимости от того, какой кислотностью будет обладать среда, в которой будет проводиться непосредственно электрофорез. Молекулы, которые окажутся положительно заряженными, будут адсорбироваться лучше, нежели чем те, которые несут отрицательный заряд.
Носителями, которые будут применяться для электрофореза, могут быть хроматографическая бумага, агаровый гель, полиакриловой гель, ацетатцеллюлозная бумага или акриловый гель. Значительно реже применяется капиллярный электрофорез.
Во время анализа белки разделяют на 5 или 6 фракций, в зависимости от применяемого метода. Это будут гамма-глобулины, которые делятся на бета-1 и бета-2, альбумины — альфа-1 и альфа-2, а также бета-глобулины.
Имеются установленные нормы белковых фракций, которые должны присутствовать в крови. Отклонение их от показателей является признаком нарушения в организме, что требует проведения обследования для выявления причины.
| Фракция | Норма в г/л |
|---|---|
| Альбумин | 35-44 |
| Глобулин альфа-1 | 1-3 |
| Глобулин альфа-2 | 5-8 |
| Бета-глобулин | 4-10 |
| Гамма-глобулин | 5-12 |
Значения показателей, в зависимости от того какие реактивы применяются в конкретной лаборатории, могут несколько изменяться. Поэтому в бланке результатов исследования в каждом медицинском учреждении обязательно указываются значения нормы, которые приняты в нем. На них будет ориентироваться врач при расшифровке анализа.
Электрофорез белков крови назначают не очень часто, так как сегодня современные лабораторные исследования позволяют провести анализ на определенный белок, что ускоряет процесс диагностики. Абсолютным показанием к электрофорезу является наличие монолокальной гаммапатии. Также иногда анализ может быть показан в таких случаях:
- чрезмерно высокая скорость оседания эритроцитов, когда она превышает 50 мм/ч;
- значительно повышенный уровень гамма-глобулинов;
- скрининговое обследование для контроля эффективности лечения миеломной болезни;
- чрезмерно высокий общий белок в крови;
- ряд аутоиммунных заболеваний, поражающих печень и почки;
- слабость, для которой нет выраженной причины;
- развитие патологических переломов костей и постоянные боли в костях;
- частые рецидивы инфекционных заболеваний;
- нарушения, обнаруженные в прочих анализах, указывающие на то, что у человека могут развиваться анемии, лейкемии, гиперкальциемия или гипоальбуминемия.
При общей диспансеризации и получении медицинских справок для трудоустройства данное исследование крови не осуществляется. Не требуется оно и в процессе подготовки человека к хирургическому вмешательству.
Для получения наиболее точных результатов рекомендуется соблюдение правил подготовки к анализу. Они включают в себя голодную диету в течение 15 часов до того как будет взята кровь, когда пациент может употреблять только чистую не газированную воду. За 90 минут до проведения исследования необходимо полностью исключить нагрузки как эмоциональные, так и физические, и курение в активной или пассивной форме. Чтобы не допустить искажение данных, забор материала не проводят сразу после того, как был осуществлен гемодиализ или проведена процедура, при которой использовались радиоконтрастные составы. Важно также, чтобы за несколько дней до исследования полностью было исключено лечение пенициллином, так как он вызывает расщепление амбулина, что исказит результат.
| Фракция | Повышение | Понижение |
|---|---|---|
| Амбулин | Злоупотребление алкоголем, период вынашивания ребёнка, дегидрация | Холецистит в острой форме, лейкоз, миелома, саркоидоз, пневмония, остеомиелит, системная красная волчанка, лимфома |
| Глобулин альфа-1 | Цирроз печени, стрессовые состояния, лимфогранулематоз, период вынашивания ребёнка, язва желудка, острое или хроническое воспаление | Гепатит вирусной природы в острой форме |
| Глобулин альфа-2 | Сахарный диабет, остеомиелит, гломерулонефрит в острой форме, стрессовые состояния, системная красная волчанка, узловатый полиартрит, цирроз | Гипертиреоз, гепатит вирусной природы в острой форме, гемолиз интраваскулярный |
| Бета-глобулин | Сахарный диабет, саркоидоз, ревматоидный артрит, беременность, гломерулонефрит, желтуха подпеченочная, нефротический синдром | Лейкоз, цирроз, склеродермия имеющая системный характер, лимфома, системная красная волчанка |
| Гамма-глобулин | Цирроз, склеродермия системного характера, ревматоидный артрит, лимфолейкоз в хронической форме, муковисцидоз, синдром Шегрена | Лейкоз, склеродермия, гепатит вирусной природы в острой форме, лимфома, гломерулонефрит |
Исказить показатели, кроме неправильной подготовки к проведению анализа, могут 2 фактора: недавно проведенная процедура гемодиализа, из-за которой произошло разрушение эритроцитов в крови, и повышенный уровень билирубина в организме. В любом из этих случаев потребуется пересдача анализа через некоторое время, которое определит врач.
источник
Электрофорез белков – вид анализа крови для оценки соотношения между различными белками крови и для выявления парапротеина.
Синонимы: serum protein electrophoresis, protein ELP, SPE, SPEP.
исследование количественых и качественных характеристик белков крови по их распределению в электрическом поле.
Из белков построены все клетки тела. Белок — сложная молекула, состоит из более простых «кирпичиков» — аминокислот. Суммарно все белки крови называют «общий белок», в свою очередь он состоит из компонентов — альбуминов, глобулинов.
Белки способны нести положительный или отрицательный заряд в зависимости от кислотности среды, в которой проводят электрофорез. Движение белков зависит от величины заряда, формы и размера молекулы, ее веса, свойств среды.
Позитивно заряженные молекулы белков лучше адсорбируются, чем отрицательно заряженные, поэтому при электрофорезе белков применяют негативные заряды. Альбумин несет наибольший отрицательный заряд, поэтому быстрее двигается к аноду.
- хроматографическая бумага
- ацетатцелюлозная бумага
- агаровый гель
- акриловый гель
- полиакриловый гель
- капиллярный электрофорез
Электрофорезом белки крови разделяются на 5-6 фракций – альбумины, альфа-1-, альфа-2-, бета- и гамма-глобулины (иногда на бета-1 и бета-2-глобулины).
- диагностика моноклональных гаммапатий (множественной миеломы)!
- повышенный общий белок крови
- повышенный уровень гамма-глобулинов
- очень высокого СОЭ – более 50 мм/час (когда нет других причин для его роста)
- скрининг, диагностика и контроль лечения моноклональных гаммапатий (миеломной болезни)
Единственное прямое показание для проведения электрофореза белков крови – выявление моноклональной гаммапатии. Сегодня врач может назначить анализ конкретного интересующего белка крови, а не электрофорез, который дает лишь ориентировочные результаты.
Моноклональная гаммапатия — появление в крови однородного по свойствам клона иммуноглобулинов — парапротеинов, синтезированных одним клоном клеток
- миеломная болезнь
- асимптоматическая миелома
- моноклональная гаммапатия неустановленной этиологии (МГУС)
- плазмоцитома
- первичный AL амилоидоз
При миеломной болезни в крови появляется значительное количество «неправильного» белка – парапротеина или М-белка. Это «моноклональный белок», поскольку синтезируется только в клетках из одного злокачественного клона В-лимфоцитов, он весь одинаков и его очень хорошо видно на кривой электрофореза белков. Количество парапротеина (затемнение, скачок вверх) указывает на наличие миеломы, позволяет оценить ее размеры, прогрессию, а изменения концентрации – ранний симптом обострения или ремиссии.
- боли в костях – особенно позвоночника и таза
- сильная головная боль
- изменения в общем анализе мочи — протеинутрия
- выраженная общая слабость, усталость
- частые инфекционные заболевания
Помните, что у каждой лаборатории, а точнее у лабораторного оборудования и реактивов есть «свои» нормы. В бланке лабораторного исследования они идут в графе – референсные значения или норма.
- общий анализ крови
- общий анализ мочи
- печеночные пробы – билирубин, АСТ, АЛТ, ГГТ, щелочная фосфатаза
- почечные пробы – креатинин, мочевина, мочевая кислота
- общий белок крови, альбумин, глобулины
- иммунофиксафия белков сыворотки крови
- моноклональные иммуноглобулины
- поликлональные иммуноглобулины
- свободные легкие цепи в крови
- бета-2-микроглобулин
- альбумин в моче
- электрофорез белков мочи
- иммунофиксация белков мочи
- свободные легкие цепи в моче
1. Преальбумин (транстиретин) — печеночный белок, расположен перед альбумином с коротким временем полувыведения, связывает гормоны щитовидной железы, транспортный белок для витамина А (предупреждает его потерю с мочой). Количество преальбумина позволяет оценить обеспеченность белками периферических тканей. Снижен при печеночных заболеваниях и дефиците питания.
2. Альбумины — наиболее крупная фракция белков крови, хорошо виден пик. Причины снижения альбуминов подробно описаны в данной статье. Редко при врожденной мутации развивается дисальбуминемия – фракция альбумина раздваивается.
3. Альфа-1-липопротеины — слабая однородно окрашенная область между альбумином и альфа-1-глобулином.
4. Размеры зоны альфа-1-глобулина определяются уровнем альфа-1-антитрипсина, орозомукоида, альфа-1-фетопротеина, альфа-1-микроглобулина. При остром воспалении — видимое затемнение.
- альфа-1-антитрипсин — генетическая вариабельность может проявиться изменением движения белков, циррозом печени, повышением печеночных проб, при беременности — снижение
- альфа-1-фетопротеин — маркер опухолей печени и врожденной патологии в пренатальной диагностике
- при снижении скорости гломерулярной фильтрации — повышение в крови альфа-1-микроглобулина
5. Альфа-2-глобулины — на формировании данной зоны влияют альфа-2-макроглобулин, церулоплазмин, гаптоглобин, пре-бета-липопротеин. Изменения не имеют клинического значения.
6. Интерзона между альфа-2- и гамма-глобулинами — окрашивается слабо, при гемолизе возникают комплексы гемоглобин-гаптоглобин, формирующие в этой области видимую полоску.
7. Бета-1-глобулины – размер затемнения определяется количеством трансферрина, фибриногена, С-реактивного белка, гемопексина. Интенсивность коррелирует с общей железосвязывающей способностью сыворотки крови. При железодефицитной анемии и при беременности повышается синтез трансферрина и усиливается контрастность зоны
8. Интерзона между бета-1- и бета-2- глобулинами образована иммуноглобулином А (IgA). Типичную полоску формирует бета-липопротеин.
9. Бета-2-глобулины — сформированы С4 компонентом комплемента, повышение — при остром воспалении, снижение — образование иммунокомплексов при аутоиммунных заболеваниях.
Комплемент — 11 белков, факторы неспецифического гуморального иммунитета.
- бета-2-микроглобулин — часть HLA системы на поверхности клеток, отображает скорость деления клеток, повышение в крови — снижение скорости фильтрации в почках, лимфопролиферативные заболевания
- фибриноген — белок системы свертывания крови, расположен между бета- и гамма-глобулинами, повышен при остром воспалении, снижен при тяжелой печеночной недостаточности, диссеминированном внутрисосудистом свертывании
10. Гамма-глобулины — характеристики зоны определяются свойствами классов иммуноглобулина G (IgG). Иммуноглобулин М (IgM) расположен ближе к старту.
Моноклональные иммуноглобулины – выявляются только при наличии заболевания, продукт одного клона клеток из В-лимфоцитов. С возрастом выявление парапротеина растет, появляется доброкачественная гипериммуноглобулинемия без каких-либо симптомов.
источник
БИОХИМИЯ КРОВИ
В плазме крови содержится 7% всех белков организма при концентрации 60 — 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
- Белки плазмы образуют важнейшую буферную систему крови и поддерживают рН крови в пределах 7,37 — 7,43.
- Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) вьшолняют транспортную функцию.
- Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
- Белки плазмы крови являются резервом аминокислот для организма.
- Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55-65%), α1-глобулины (2- 4%), α2 -глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%) (рис. 14-19).
Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16-17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций. Большинство сывороточных белков синтезируется в печени, однако некоторые образуются и в других тканях. Например, γ-глобулины синтезируются В-лимфоцитами (см. раздел 4), пептидные гормоны в основном секретируют клетки эндокринных желёз, а пептидный гормон эритропоэтин — клетки почки. Для многих белков плазмы, например альбумина, α1-антитрипсина, гаптоглобина, транс-феррина, церулоплазмина, α2-макроглобулина и иммуноглобулинов, характерен полиморфизм (см. раздел 4). Почти все белки плазмы, за исключением альбумина, являются гликопротеинами. Олигосахариды присоединяются к белкам, образуя гликозидные связи с гидроксильной группой серина или треонина, или взаимодействуя с карбоксильной группой аспарагина. Концевой остаток олигосахаридов в большинстве случаев представляет собой N-ацетилнейраминовую кислоту, соединённую с галактозой. Фермент эндотелия сосудов нейраминидаза гидролизует связь между ними, и галактоза становится доступной для специфических рецепторов гепатоцитов. Путём эвддцитоза «состарившиеся» белки поступают в клетки печени, где разрушаются. Т1/2 белков плазмы крови составляет от нескольких часов до нескольких недель. При ряде заболеваний происходит изменение соотношения распределения белковых фракций при электрофорезе по сравнению с нормой (рис. 14-20). Такие изменения называют диспротеинемиями, однако их интерпретация часто имеет относительную диагностическую ценность. Например, характерное для нефротического синдрома снижение альбуминов, α1— и γ-глобулинов и увеличение α2— и β-глобулинов отмечают и при некоторых других заболеваниях, сопровождающихся потерей белков. При снижении гуморального иммунитета уменьшение фракции γ-глобулинов свидетельствует об уменьшении содержания основного компонента иммуноглобулинов — IgG, но не отражает динамику изменений IgA и IgM. Содержание некоторых белков в плазме крови может резко увеличиваться при острых воспалительных процессах и некоторых других патологических состояниях (травмы, ожоги, инфаркт миокарда). Такие белки называют белками острой фазы, так как они принимают участие в развитии воспалительной реакции организма. Основной индуктор синтеза большинства белков острой фазы в гепатоцитах — полипептид интерлейкин-1, освобождающийся из мононуклеарных фагоцитов. К белкам острой фазы относят С-реактивный белок, называемый так, потому что он взаимодействует с С-полисахари-дом пневмококков, α1-антитрипсин, гаптоглобин, кислый гликопротеин, фибриноген. Известно, что С-реактивный белок может стимулировать
Рис. 14-19. Электрофореграмма (А) и денситограмма (Б) белков сыворотки крови.
Рис. 14-20. Протеинограммы белков сыворотки крови. а — в норме; б — при нефротическом синдроме; в — при гипогаммаглобулинемии; г — при циррозе печени; д — при недостатке α1-антитрипсина; е — при диффузной гипергаммаглобулинемии.
систему комплемента, и его концентрация в крови, например, при обострении ревматоидного артрита может возрастать в 30 раз по сравнению с нормой. Белок плазмы крови а,-антитрипсин может инактивировать некоторые протеазы, освобождающиеся в острой фазе воспаления.
Содержание некоторых белков в плазме крови и их функции представлены в таблице 14-2.
Альбумин.Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка — примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са 2+ , Cu 2+ , Zn 2+ . Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза.
Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренинангиотензинальдрстерон, обеспечивающей восстановление объёма крови (см. раздел 11). Однако при недостатке альбумина, который должен удерживать Na+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок.
Альбумин — важнейший транспортный белок. Он транспортирует свободные жирные кислоты (см. раздел 8), неконъюгированный билирубин (см. раздел 13), Са 2+ , Сu 2+ , триптофан, тироксин и трийодтиронин (см. раздел 11). Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой.
Транстиретин(преальбумин) называют тирок-синсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом — до двух молекул тироксина и трийодтиронина.
Таблица 14-2. Содержание и функции некоторых белков плазмы крови
| Группа | Белки | Концентрация в сыворотке крови, г/л | Функция |
| Альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина |
| Альбумин | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | ||
| α1-Глобулины | α1 -Антитрипсин | 2,5 | Ингибитор протеиназ |
| ЛПВП | 0,35 | Транспорт холестерола | |
| Протромбин | 0,1 | Фактор II свёртывания крови | |
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |
| Кислый α1-гликопротеин | Транспорт прогестерона | ||
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |
| α2-Глобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза |
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |
| Гаптоглобин | Связывание гемоглобина | ||
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |
| Ретинолсвязыва-ющий белок | 0,04 | Транспорт ретинола | |
| Витамин D связывающий белок | 0,4 | Транспорт кальциферола | |
| β-Глобулины | ЛПНП | 3,5 | Транспорт холестерола |
| Трансферрин | Транспорт ионов железа | ||
| Фибриноген | Фактор I свёртывания крови | ||
| Транскобаламин | 25×10 -9 | Транспорт витамина B12 | |
| Глобулин связывающий белок | 20×10 -6 | Транспорт тестостерона и эстрадиола | |
| С-реактивный белок | Не нашли то, что искали? Воспользуйтесь поиском: Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 10034 — источник Тема 1. БИОЛОГИЧЕСКАЯ РОЛЬ БЕЛКОВЫХ И НЕБЕЛКОВЫХ КОМПОНЕНТОВ ПЛАЗМЫ КРОВИ. Практическая значимость темы. Кровь является важнейшим и наиболее доступным объектом биохимического исследования. Наиболее изученные компоненты крови — это гемоглобин, альбумин, иммуноглобулины и разнообразные факторы свёртывания. При различных заболеваниях наблюдаются изменения уровня белков в плазме; эти изменения можно обнаружить при электрофорезе. Важным диагностическим признаком при некоторых патологических состояниях служит повышение активности некоторых ферментов плазмы крови. Определение содержания небелковых компонентов плазмы (глюкоза, мочевина, холестерол, билирубин и др.) также используется в диагностике заболеваний. Цель занятия. После изучения данной темы студент должен знать состав и биологическую роль различных групп белков, небелковых азотистых компонентов (остаточного азота), безазотистых органических соединений и минеральных веществ, входящих в состав плазмы крови; уметь применять полученные знания при решении теоретических и практических задач. Исходный уровень знаний.
Общая характеристика. Кровь — жидкая подвижная ткань, циркулирующая в замкнутой системе кровеносных сосудов, транспортирующая различные химические вещества к органам и тканям, и осуществляющая интеграцию метаболических процессов, протекающих в различных клетках. Кровь состоит из плазмы и форменных элементов (эритроцитов, лейкоцитов и тромбоцитов). Сыворотка крови отличается от плазмы отсутствием фибриногена. 90% плазмы крови составляет вода, 10% — сухой остаток, в состав которого входят белки, небелковые азотистые компоненты (остаточный азот), безазотистые органические компоненты и минеральные вещества. Белки плазмы крови. Плазма крови содержит сложную многокомпонентную (более 100) смесь белков, различающихся по происхождению и функциям. Большинство белков плазмы синтезируется в печени. Иммуноглобулины и ряд других защитных белков иммунокомпетентными клетками. Содержание общего белка в сыворотке крови здорового человека составляет 65 — 85 г/л (в плазме крови этот показатель на 2 – 4 г/л выше за счёт фибриногена). 1.2.1. Белковые фракции. При помощи высаливания белков плазмы можно выделить альбуминовую и глобулиновую фракции. В норме соотношение этих фракций составляет 1,5 – 2,5. Использование метода электрофореза на бумаге позволяет выявить 5 белковых фракций (в порядке убывания скорости миграции): альбумины, α1-, α2-, β- и γ-глобулины. При использовании более тонких методов фракционирования в каждой фракции, кроме альбуминовой, можно выделить целый ряд белков (содержание и состав белковых фракций сыворотки крови см. рисунок 1). Альбумины – белки с молекулярной массой около 70000 Да. Благодаря гидрофильности и высокому содержанию в плазме играют важную роль в поддержании коллоидно-осмотического (онкотического) давления крови и регуляции обмена жидкостей между кровью и тканями. Выполняют транспортную функцию: осуществляют перенос свободных жирных кислот, желчных пигментов, стероидных гормонов, ионов Са 2+ , многих лекарств. Альбумины также служат богатым и быстро реализуемым резервом аминокислот. α1-Глобулины:
α2-Глобулины:
1.2.2. Количественные и качественные изменения белкового состава плазмы крови. При различных патологических состояниях белковый состав плазмы крови может изменяться. Основными видами изменений являются:
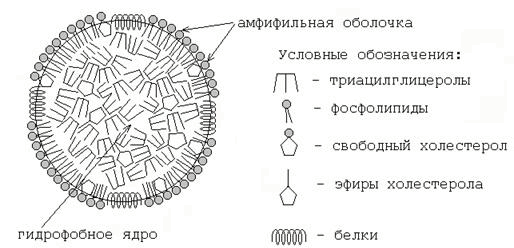
1.2.3. Липопротеиновые фракции плазмы крови. Липопротеины — сложные соединения, осуществляющие транспорт липидов в крови. В состав их входят: гидрофобное ядро, содержащее триацилглицеролы и эфиры холестерола, и амфифильная оболочка, образованная фосфолипидами, свободным холестеролом и белками-апопротеинами (рисунок 2). В плазме крови человека содержатся следующие фракции липопротеинов:
1.2.4. Белки острой фазы воспаления. Это белки, содержание которых увеличивается в плазме крови при остром воспалительном процессе. К ним относятся, например, следующие белки:
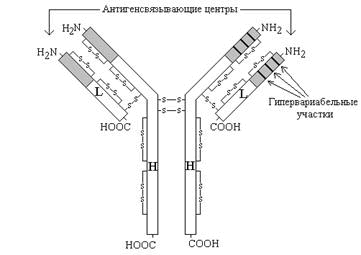
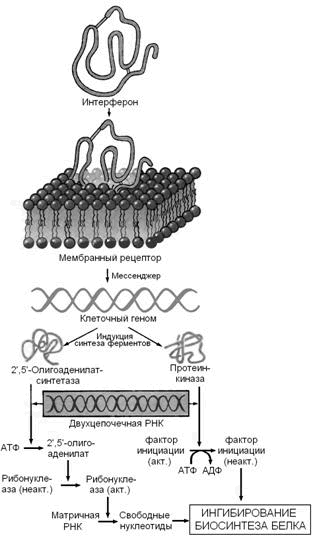
Скорость синтеза этих белков увеличивается прежде всего за счёт снижения образования альбуминов, трансферрина и альбуминов (небольшая фракция белков плазмы, обладающая наибольшей подвижностью при диск-электрофорезе, и которой соответствует полоса на электрофореграмме перед альбуминами), концентрация которых при остром воспалении снижается. Биологическая роль белков острой фазы: а) все эти белки являются ингибиторами ферментов, освобождаемых при разрушении клеток, и предупреждают вторичное повреждение тканей; б) эти белки обладают иммунодепрессорным действием (В.Л.Доценко, 1985). 1.2.5. Защитные белки плазмы крови. К белкам, выполняющим защитную функцию, относятся иммуноглобулины и интерфероны. Иммуноглобулины (антитела) — группа белков, вырабатываемых в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются в лимфоузлах и селезёнке лимфоцитами В. Выделяют 5 классов иммуноглобулинов — IgA, IgG, IgM, IgD, IgE. Молекулы иммуноглобулинов имеют единый план строения. Структурную единицу иммуноглобулина (мономер) образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями: две тяжёлые (цепи Н) и две лёгкие (цепи L) (см. рисунок 3). IgG, IgD и IgЕ по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA состоят из двух и более структурных единиц, или являются мономерами. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов. Интерфероны — семейство белков, синтезируемых клетками организма в ответ на вирусную инфекцию и обладающих противовирусным эффектом. Различают несколько типов интерферонов, обладающих специфическим спектром действия: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и& иммунный (γ-интерферон). Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам. Механизм действия интерферонов показан на рисунке 4.
Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2′,5′-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2′,5′-олигоаденилаты (из АТФ), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке (Ю.А.Овчинников, 1987). 1.2.6. Ферменты плазмы крови. Все ферменты, содержащиеся в плазме крови, можно разделить на три группы:
Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ), аспартатаминотрансферазы (ACT), изофермента лактатдегидрогеназы ЛДГ5, глутаматдегидрогеназы, орнитинкарбамоилтрансферазы. При повреждении клеток миокарда (инфаркт) в крови возрастает активность аспартатаминотрансферазы (ACT), иэофермента лактатдегидрогеназы ЛДГ1, изофермента креатинкиназы MB. При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы. источник Разделение растворенных белков под действием постоянного электрического поля носит название белкового электрофореза (ЭФ). В качестве носителя для проведения электрофореза могут быть использованы различные материалы, выбор которых зависит от поставленной задачи. В настоящее время в диагностической практике в качестве поддерживающей среды используют ацетатцеллюлозную мембрану или гель агарозы (агароза отличается большей чувствительностью и лучшим разрешением, поэтому предпочтительна). Величина пор обоих этих носителей намного больше величины исследуемых молекул, в связи с чем даже высокомолекулярные белки мигрируют в них беспрепятственно. В щелочной среде (именно в щелочном буфере проводят диагностический электрофорез) белки биологических жидкостей имеют суммарный отрицательный заряд. Под действием электрического поля они перемещаются к аноду со скоростью, зависящей главным образом от величины заряда. После окончания фореза пластину с разделенными образцами окрашивают специальными красителями, а затем полученные электрофореграм-мы оценивают визуально и с помощью приборов. Электрофоретическое разделение нормальной сыворотки человека в геле агарозы позволяет выявить следующие фракции: преальбумин, альбумин и пять глобулиновых зон: а, (формируется в основном за счет а1-антитрипсина), а2 (ее образуют гаптоглобин и а2-макроглобулин), b1 (трансферрин), b2 (С3-компонент комплемента) и у (ее формирует в основном IgG). Если исследуют плазму, в быстрой у-зоне имеется дополнительно полоса фибриногена. Другие белки в норме содержатся в количествах, не позволяющих выявить их в виде отдельных зон, но при повышении их уровня могут давать дополнительные полосы в зоне своей миграции или приводить к усилению окраски уже существующих фракций. Это прежде всего орозомукоид и а-липопротеины (а,-зона), антихимотрипсин и церулоплазмин (а2-зона), фибронектин (граница а2- и b-зон), четвертый компонент комплемента — С4 (b-зона), С-реактивный белок и лизоцим (у-зона), поликлональные IgA (b2у1-зона) и IgM (у1-зона). Поликлональные иммуноглобулины, характерной особенностью которых является гетерогенность структуры и, следовательно, заряда молекул, отличаются разной подвижностью в электрическом поле, поэтому область их миграции (у-зона) представляет собой широкое диффузное пятно без четких границ. Структурная гомогенность моноклональных иммуноглобулинов обусловливает гомогенность изоэлектрических точек молекул внутри пула. На электрофореграмме моноклональные иммуноглобулины образуют, как правило, узкую, четко ограниченную полосу, называемую М-градиентом. Интенсивность окрашивания каждой из электрофоретических фракций пропорциональна количеству образовавшего ее белка: чем больше белковых молекул мигрирует в определенной зоне, тем больше красителя они связывают. Плотность окрашивания в каждой точке электрофореграммы оценивают с помощью специального прибора — денситометра, детектор которого регистрирует степень ослабления светового луча, перемещающегося вдоль трека перпендикулярно к поверхности последнего. Данные сканирования представляют в виде графика, на котором каждая белковая зона образует пик. Высота пика отражает интенсивность окраски зоны, а ширина—степень ее гетерогенности. По площади пиков автоматически рассчитывают относительное (в процентах) и абсолютное (в весовых единицах) содержание белка в электрофоретических фракциях. Для расчета в весовых единицах необходимо предварительно ввести в прибор данные о концентрации общего белка в образце. Качественно выполненный электрофорез является высокоинформативным методом. Он позволяет без больших затрат времени, сил и средств дать предварительную характеристику белков сыворотки и других биологических жидкостей. Один из основных недостатков метода — неспецифичность, т. е. невозможность во многих случаях сделать вывод о природе белковой полосы, выявленной на электрофореграмме. Это относится прежде всего к дополнительным зонам и фракциям, отсутствующим в нормальной сыворотке. Кроме того, если электрофоретическая подвижность двух разных белков совпадает, то на электрофореграмме они образуют одну полосу. Поэтому в случаях, когда на основании клинико-лабораторного симптомокомплекса можно предполагать заболевание, характеризующееся белковой патологией, электрофоретическое исследование сыворотки недостаточно: необходимо использовать дополнительно иммунохимические методы. Например, при дефиците IgA и IgM уровень электрофоретической у-фракции остается в пределах нормы, поскольку эта зона формируется в основном за счет IgG. Только иммунохимическое определение уровня иммуноглобулинов позволяет выявить иммунодефицитное состояние. источник |

 | 7498 —
| 7498 —  или читать все.
или читать все. 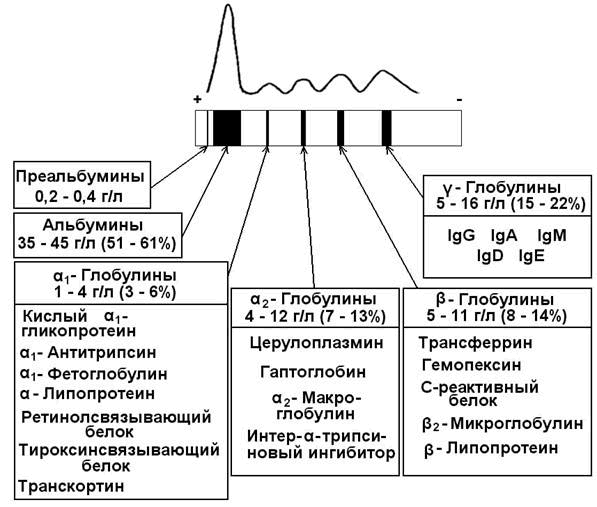
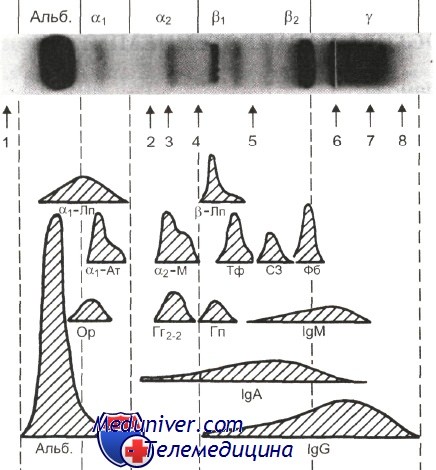 Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.
Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.