Электорофорез белков плазмы (EPH) — распространенный диагностический метод в ветеринарии млекопитающих уже много лет. Развитие этого метода упростило процедуру анализа и сейчас требует очень небольших количеств плазмы, что позволяет использовать его в ветеринарии птиц (Cray, 2000) и рептилий (Zaias, Gray,2002).
Техника электрофореза. Основной принцип EPH включает покрытие плазмы или сыворотки тонким агарозным гелем. Прохождение электрического тока через гель заставляет мигрировать белки, в результате чего образуются полосы, зависящие от заряда и размера белковых молекул. После этого гель фиксируют, окрашивают и анализируют полосы визуально или квалифицируют с помощью лазерного сканирования в денситометре. Коммерческие системы для EPH-диагностики упрощают процесс и требуют всего 10 мкл сыворотки или плазмы. После помещения микрообразца в гель его подвергают электрофорезу в течение 40 минут при 100V, высушивают, окрашивают и сканируют в денситометре при 600 нм. Относительный и абсолютный (г/дл) размер белковых фракций можно определить на основании данных об уровне общего белка, полученных методом рефрактометрии.
Вопрос об использовании плазмы или сыворотки уже обсуждался несколькими авторами при исследовании разных видов птиц. Для птиц предпочтительнее использовать плазму. Общий белок плазмы в среднем на 1,7 г/дл, выше, чем в сыворотке из-за присутствия фибриногена. Так как фибриноген является острофазным белком, то есть индикатором острого воспаления, предпочтительнее включать эту фракцию в процесс EPH, как и при определении уровня общего белка. В остальном, сравнение результатов, полученных при EPH сыворотки или плазмы не показывает достоверных различий (Lumei and DeBruije, 1985).
Основные фракции белков, выделенные с помощью EPH включают (слева направо) альбумин, a-1 глобулин, a-2 глобулин, β-глобулин, g-глобулин. На рис. изображена электрофоретограмма здоровой зеленой игуаны. Альбумины представляют максимальную порцию белков плазмы и являются наиболее гомогенной и различимой фракцией у здоровых млекопитающих, птиц и рептилий. Альбумины работают как транспортные белки и определяют приблизительно 75% осмотической активности плазмы. Иногда у здоровых птиц можно обнаружить преальбуминовую фракцию, но у здоровых млекопитающих она встречается редко. Предварительные результаты показывают, что преальбуминовая фракция может встречаться у некоторых видов здоровых черепах (Zaias, Gray, 2002). Значение этих белков не ясно, но скорее всего эта фракция представлена белками, близкими к альбуминам по свойствам (транспортные белки). Альфа-глобулины обычно встречаются у птиц в виде двух отдельных фракций: a-1 и a-2. Эти фракции включают белки острой фазы: a-липопротеин, a-1-антитрипсин и a-2-макроглобулин (Kaneko, 1997; Cray, 2000). Бета-глобулины являются белками острой фазы воспаления и включают фибриноген, трансферрин, бета-липопротеин и комплемент. Они могут выделяться в виде одной или двух отдельных полос или пиков на электрофоретограмме. Фракция гамма-глобулинов представлена циркулирующими иммуноглобулинами. Обычно выделяется один пик, но редко – два. Продукты деградации комплемента также могут мигрировать в эту область (Kaneko, 1997).
В добавлении к оценке белковых фракций, из этих данных можно вычислить и использовать А/Г индекс для определения соотношения альбуминов и глобулинов. У птиц в норме концентрация глобулинов минимальна по сравнению с доминирующими глобулинами. У рептилий ситуация, наверно, похожа. Применяют следующую формулу подсчета А/Г индекса: (преальбумины (если имеются) + альбумины) : (a-1 + a-2 + b + g-глобулины).
Анализ и интерпретация электрофоретограммы.
Хотя нормальные значения этих фракций для рептилий пока не установлены, основы для интерпретации данных EPH можно почерпнуть из литературы о птицах и млекопитающих (Kaneko, 1997). Многие из белков плазмы, в том числе белки острой фазы и иммуноглобулины, заметно изменяются при заболевании. Фракционирование и определение индивидуальных фракций белков позволяет определить характер их повреждения. К примеру, белки острой фазы отвечают за локализацию повреждения и начало выздоровления. Концентрация многих из них повышается, что заметно по увеличению пиков альфа и бета-глобулинов, и часто это наиболее ранний симптом острого воспаления или инфекции. В дальнейшем возрастает фракция гамма-глобулинов в связи с продукцией антител к конкретному патогену.
В качетсве примера на рисунке показана электрофоретограмма от больной игуаны с симптомами слабости, анорексии, фасцикуляцией мышц и нарушением формирования скелета. Биохимия крови показывает инверсию кальция и фосфора. На электрофоретограмме заметно резкое снижение альбуминов (19% вместо 43%) и повышение бета-глобулинов (58% вместо 19%). Эти данные говорят о хронической патологии печени или почек, как потенциальной причине или наоборот, следствии метаболических расстройств. На другом рисунке изображена электрофоретограмма плазмы нескольких игуан разного возраста и общего состояния. Наши предварительные результаты показывают, что помимо увеличения фракции острофазных белков, у больных животных может отмечаться исчезновение некоторых в норме присутствующих минорных фракций.
Нарушенный А/Г индекс часто является первым симптомом диспротеинемии. Понижение этого показателя говорит о значительном повышении глобулинов, понижении альбуминов, или обоих процессах. Снижение индекса при нормальном уровне общего белка – важный симптом диспротеинемии, который без вспомогательного EPH-теста не определяется.
Изменения на электрофоретограмме охарактеризованы пока только у птиц (Cray,1999):
общий белок: Гиперпротеинемия указывает на дегидратацию; гипопротеинемия является нормой у птиц в возрасте до 8 месяцев, у взрослых это обычно указывает на гипергидратацию.
альбумины: Гиперальбуминемия редко встречается без дегидратации; гипоальбуминемия может быть обусловлена потерей почками, печенью, ЖКТ или встречается при эндопаразитарных болезнях. Пониженный синтез альбуминов отмечают при болезнях печени, истощении и при хроническом воспалении.
a1-глобулины: повышение этой фракции характерно при остром воспалении, паразитозах;
a2–глобулины: повышение встречается при остром воспалении, гепатитах, нефритах, нефротическом синдроме.
β-глобулины: повышение обычно при остром и хроническом воспалении, гепатите, нефритах, острых и хронических хламидиозах, аспергиллезе.
g-глобулины: повышение обычно при остром воспалении, инфекционных болезнях, желточном перитоните, иммунных болезнях, опухолях ретикулоэндотелиальной системы.
Физиологические влияния (возраст, гормоны, питание, стресс), не связанные с болезнью, могут изменять показания EPH, что необходимо учитывать при интерпретации. Впрочем, у птиц и млекопитающих эти факторы сами по себе влияют на результаты EPH в значительно меньшей степени, чем болезнь. Принципы, разработанные для птиц, скорее всего, подходят и для рептилий, а для амфибий таких работ пока не было выполнено.
Как и в случае других лабораторных исследований, в результатах электрофоретограмм рептилий могут иметься значительные видоспецифические и сезонные вариации. Поэтому важно накопление первичной информации и установление стандартов для каждой конкретной лаборатории.
Дата добавления: 2015-03-29 ; Просмотров: 1564 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Иммунохимически идентифицировать белки на электрофореграмме без потери наглядности и четкости классической электрофоретической картины позволяет метод иммунофиксации (ИФ).
При выполнении иммунофиксации на одной и той же пластине с агарозным гелем проводят несколько электрофоретических разделений исследуемого образца, после чего один из треков окрашивают сразу после окончания фореза (он служит контролем), а на поверхность остальных наносят антисыворотки определенной специфичности.
В месте расположения белка, прореагировавшего с родственной ему антисывороткой, через некоторое время (обычно в пределах часа) образуется преципитат, который полностью сохраняет форму и положение изучаемой фракции. Предварительно отмыв несвязавшиеся белки солевым раствором, пластины окрашивают. Зону миграции белка уточняют, соотнося положение преципитата, образованного этим белком, с контрольной фореграммой.
Иммунофиксацию широко используют в диагностике моноклональной секреции. К наиболее типичным ситуациям относятся:
1) иммунохимическая идентификация небольших М-градиентов, особенно при нормальном содержании поликлональных иммуноглобулинов;
2) выявление и идентификация скрытых М-градиентов, когда моноклональный белок мигрирует в зоне а- или b-глобулинов и маскируется нормальными белками этих фракций, особенно при низком уровне продукции.
В ряде случаев иммунофиксация позволяет распознать так называемые ложные М-градиенты — электрофоретически гомогенные полосы, напоминающие М-градиент, но не относящиеся к иммуноглобулинам. Отсутствие специфического преципитата в зоне такой полосы при реакции с антисыворотками к Н- и L-цепям иммуноглобулинов позволяет отвергнуть предположение о наличии парапротеина в исследуемом образце.
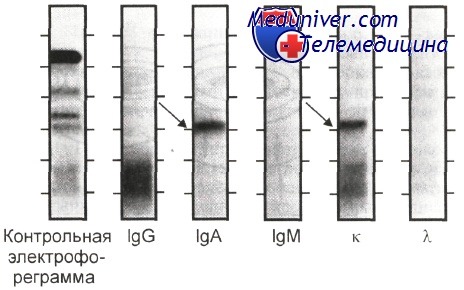
При проявлении электрофореграмм антисыворотками к а- и к-цепям иммуноглобулинов в b2-зоне выявлен М-градиент, образованный парапротеином Ак (указан стрелкой).
Иммунофиксация является методом выбора при анализе множественной секреции, если в образце присутствуют два и более М-градиентов.
Помимо высокой специфичности и разрешающей способности, достоинством метода является также его высокая чувствительность. Это объясняется двумя факторами: накоплением белка (антител) в зоне градиента при образовании специфического преципитата и минимальной диффузией антигена при реакции с антисывороткой. При иммунофиксации можно выявить следовые М-градиенты, которые не видны на окрашенной электрофореграмме.
Основная методическая трудность — подбор адекватного разведения образца для получения плотного, хорошо видимого преципитата. Если образец разведен недостаточно, то преципитат может раствориться в избытке антигена (исследуемый белок). При слишком большом разведении образца образовавшийся преципитат можно не увидеть. В обоих случаях имеет место ложноотрицательный результат.
В последние годы благодаря исключительно высокой информативности метода и появлению коммерческих диагностических наборов, укомплектованных высокоаффинными антисыворотками (что приводит к получению стабильных результатов), иммунофиксация в большинстве диагностических ситуаций оттеснила на второй план традиционный иммуноэлектрофорез (ИЭФ).
Чувствительность иммунофиксации можно значительно повысить, если использовать для разделения белков противоточный изотахофорез (ИТФ) на ацетат-целлюлозной мембране, предложенной Г. И. Абелевым и соавт.. Это метод электрофореза в неоднородной системе буферов, имеющих общий катион, но разные анионы.
При изотахофорезе (ИТФ) ионы разделяемого образца располагаются в порядке уменьшающейся электрофоретической подвижности между двумя видами анионов буфера: «ведущим» (с более высокой подвижностью) и «замыкающим» (с меньшей подвижностью). Изотахофорез (ИТФ) позволяет одновременно с разделением концентрировать в 10—100 раз белки, находящиеся в высокоразбавленных растворах.
В связи с этим метод хорошо подходит для выявления и индентификации белка Бенс-Джонса в моче, а также для исследования малобелковых биологических жидкостей, доступных в небольшом объеме, ограничивающем предварительное концентрирование (церебральная и слезная жидкости, слюна и т. д.).
источник
В плазме человеческой крови находится множество белковых компонентов. Они различны по своему составу, строению и подвижности в определенной среде, проводящей электрический ток. На этом и строится разделение общего белка, который локализуется в плазме, на различные белковые фракции. При проведении электрофореза сыворотки крови выясняют количественное отношение отдельных белковых составляющих и структур. Это необходимо для определения наличия у человека различных патологических явлений, например инфекций или онкологии. Именно электрофорез белков сыворотки крови имеет большое значение при проведении диагностики различных болезней.
Для расщепления белковых фракций применяют электрофорез сыворотки крови, принцип которого основан на разной подвижности белковых компонентов в созданном электрическом поле. Такой метод исследования является более точным и информативным, в отличие от стандартного общего анализа крови. Но при этом электрофорез показывает только количество определённой фракции белка, характер и степень патологического процесса в общей форме. Анализ проведенных исследований позволяет медицинским специалистам выяснить, какое именно соотношение белковых фракций наблюдается в организме человека, и определить специфику патологии, присущую конкретному заболеванию.
Большую часть основной биологической жидкости человека, или крови, составляют белки. В общем количестве их норма находится в пределах 60-80 г/л. Для получения точного анализа проводится электрофорез сыворотки крови на бумаге. Это исследование является самым распространенным способом анализа. Основной средой является особая фильтровальная бумага. Главная ее особенность – высокая гигроскопичность. Такая бумага может поглотить воды больше своего веса в 130-200 раз. В зависимости от применяемого оборудования электрофорез на бумаге длится 4-16 часов. Происходит подразделение белковых структур. Затем полосы бумаги обрабатывают специальными красками для получения анализа. Такая методика является самой распространенной в работе медицинских лабораторий. За счёт воздействия электрического тока белковые фракции, заряженные отрицательно, двигаются в сторону положительно заряженного электрода. Благодаря этому белковые составляющие крови подразделяются на 5 известных фракций:
Альбумины заряжены отрицательно, имеют маленькую, по сравнению с другими фракциями, молекулярную массу. За счет этого скорость их передвижения гораздо выше, чем у остальных фракций, и они дальше всех локализуются от участка старта. Первые три фракции глобулина передвигаются с более низкой скоростью из-за своей массы. Но самая маленькая скорость регистрируется у γ-глобулинов. Эти белки имеют большую массу и крупные, относительно других, размеры. Их заряд почти нейтрален, поэтому данная белковая фракция практически не сдвигается с линии старта.
В настоящее время электрофорез сыворотки крови часто проводимый анализ для постановки точного диагноза болезни. Этот анализ могут назначить как терапевты, так врачи узкого профиля. Показаниями по проведению исследований будут:
- различные воспаления;
- болезни хронической природы;
- патологические процессы в соединительной ткани;
- внутреннее кровотечение;
- злокачественные новообразования.
Для того чтобы полученные результаты поведенных исследований были верными, не менее чем за 8 часов до сдачи крови необходимо отказаться от приёма еды. Кроме того, необходимо согласовать прием лекарственных средств, если таковые имеются, с лечащим врачом.
Для того чтобы результаты не были по ошибке завышены, необходимо снизить до минимума возможность свертывания крови для определения показателя белковых фракций и общего белка. Электрофорез сыворотки крови проводится аккуратно, поскольку существует вероятность искажения полученных результатов из-за фибриногена. Он может прятать ненормальные белки или быть спутанным с ними.
В течение суток после сдачи пробы будет готов анализ на электрофорез белков сыворотки крови. Норма полученных показателей по категориям у взрослых людей:
- Общий белок – 63-82 г/л.
- Альбумины – 40-60 % от общего количества фракций.
- α1-глобулины – 2-5 %.
- α2-глобулины – 7-13 %.
- β-глобулины – 8-15 %
- γ-глобулины – 12-22 %.
Изменение количества любой белковой фракции в большую или меньшую сторону может свидетельствовать о развитии той или иной патологии. Для получения достоверной информации об этом необходим электрофорез белков сыворотки крови. Расшифровка результатов облегчит медицинским специалистам постановку диагноза и выбор лечения.
В самом начале при анализе полученных результатов определяют количество альбумина. Увеличение этой фракции может говорить об обезвоживании. Такое может произойти, если у больного отмечается затяжная рвота или нарушения в пищеварительной системе. Также увеличение альбумина происходит при ожогах большой площади кожного покрова.
Гораздо опаснее, если в организме снижается количество альбуминов, это может говорить о следующих патологиях:
- Поражения почек и печени.
- Патологии желудочно-кишечного тракта.
- Инфекционные процессы.
- Нарушения в деятельности сердечно-сосудистой системы.
- Кровотечения.
- Злокачественные новообразования.
- Сепсис.
- Ревматизм.
Незначительное уменьшение количества альбуминов может быть также:
- У будущих матерей.
- При превышении дозы лекарственных препаратов.
- При длительной лихорадке.
- У заядлых курильщиков.
Уменьшение количества a1-глобулинов регистрируется при недостатке α1-антитрипсина. Увеличение же отмечают при обострении воспалений в организме, нарушениях в работе печени, при тканевом распаде.
Регистрируют его при сахарном диабете, воспалительных процессах в поджелудочной железе, у новорожденных детей при желтухе, при гепатитах токсического происхождения. Свидетельствует оно и о неправильном, несбалансированном питании.
Происходит при наличии следующих заболеваний:
- Воспаления, особенно с присутствием гнойного экссудата (воспаление легких и другие процессы с наличием гноя).
- Поражения соединительной ткани (например, ревматизм).
- Злокачественные новообразования.
- Периоды восстановления после ожогов.
- Поражение почек.
Кроме того, такое явление характерно для гемолиза крови в пробирке во время проведения исследования.
Проявляется при гиперлипопротеидемии (увеличении количества липидов в крови), патологиях печени и почек. Можно обнаружить при открытой язве желудка, а также гипотиреозе (нарушение работы щитовидной железы). Снижение фракции регистрируют при гипобеталипопротеинемии (повышение в крови компонента беталипопротеин).
Эта фракция включает в свой состав иммуноглобулины. Поэтому увеличение γ-глобулинов регистрируется при сбоях в иммунитете. Обычно это происходит при различных инфекциях, развитии воспалительного процесса, изменениях ткани и ожоговых поражениях. Рост γ-глобулинов отмечают у больных хронической формой гепатита. Практически такая же картина характерна для цирроза печени. При запущенных случаях данного заболевания количество белковой фракции γ-глобулинов значительно выше показателя альбуминов. При определенных болезнях могут возникать сбои в образовании γ-глобулинов, и происходит развитие измененных протеинов в крови – парапротеинов. Для выяснения характера такого развития производится дополнительное исследование – иммуноэлектрофорез. Такая картина характерна для миеломного заболевания и патологии Вальденстрема.
Увеличение количества γ-глобулинов также присуще следующим патологиям:
- красной волчанке;
- эндотелиоме;
- ревматоидной форме артрита;
- остеосаркоме;
- хронической форме лимфолейкоза;
- кандидомикозу.
Снижение показателя γ-глобулинов подразделяют на 3 вида:
- Физиологический (характерен для детей в возрасте от трех до пяти месяцев).
- Врожденный (развивается с момента рождения).
- Идиопатический (когда причину развития установить не удается).
Вторичное снижение регистрируется при развитии заболеваний, которые вызывают истощение иммунной системы. В последнее время в медицинской практике все чаще проводится анализ на определение количества преальбуминов. Обычно такое исследование проводят больным, находящимся в реанимации.
Уменьшение количества преальбуминов очень важный и точный тест на определение недостаточности белковых структур в организме пациента. При проведении анализа на преальбумины выполняют коррекцию белкового метаболизма у таких пациентов.
Принцип проведения подобного анализа схож с технологией выполнения электрофореза сыворотки крови. Проводят его для более точной постановки диагноза или обнаружения других патологий. Кроме того такой анализ поможет выявить у больного наличие протеинурии.
Электрофорез сыворотки крови и мочи – важные методы в диагностике различных инфекционных заболеваний. Благодаря методике исследования и высокой точности они помогают определить вид патологии. Точный диагноз – верный путь к правильному лечению и полному выздоровлению.
источник
Уважаемые пациенты! В ноябре детская медицинская сестра принимает 8, 9, 11, 12, 13, 14, 15, 16, 23 и 30 числа.
Лабораторная диагностика парапротеинемий.
Для клинического исследования парапротеина (ПП) целесообразно использовать электрофорез в агарозном геле или капиллярный электрофорез. В зависимости от условий электрофореза и состава буфера может формироваться 5 или 6 фракций белков. В последнем случае бета-фракция разделяется на бета-1 и бета-2 (минорную) фракции. В каждой фракции в норме присутствует определенный набор белков, поэтому результат электрофореза белков сыворотки дает комплексное представление об изменении синтеза и катаболизма многих белков организма (рис. 1). Клиническая интерпретация результатов электрофореза белковых фракций изложена в ряде руководств по клинической лабораторной диагностике.
Рис. 1. Основные фракции белка сыворотки крови и их компоненты
Для выявления ПП методы электрофореза и иммунофиксации должны использоваться совместно. Электрофорез с денситометрической оценкой белковых фракций позволяет предположить наличие ПП, а иммунофиксация – подтвердить его наличие в той или иной фракции. Денситометрия является предпочтительным методом оценки содержания белка в составе белковых фракций и позволяет оценить концентрацию ПП. Предел чувствительности метода электрофореза, ассоциированного с иммунофиксацией, позволяет определять 0,5 г/л моноклонального ПП в составе иммуноглобулина.
Классический результат обнаружения ПП с помощью электрофореза представляет выраженную полосу (М-пик) в зоне гамма-глобулинов. Интенсивная фракция ПП выявляется на бледном фоне, который указывает на подавление синтеза поликлональных иммуноглобулинов. Только в этой ситуации с большой уверенностью можно интерпретировать полученный результат как ПП и определить его концентрацию. Здесь иммунофиксация позволяет типировать ПП, т. е. описать его состав. В большинстве же случаев выявление моноклонального ПП в образце не так однозначно (рис. 2), т. к. ПП происходит из поликлональных молекул иммуноглобулинов, которые обладают разными физико-химическими свойствами и могут мигрировать в составе различных фракций белков сыворотки.
Рис. 2. Детекция парапротеина с помощью электрофореза белков сыворотки и основные феномены, затрудняющие его выявление.
Чаще всего ПП класса IgG и IgM обнаруживаются в гамма-фракции, а ПП классов IgA и свободные легкие цепи мигрируют в составе альфа2- и бета-фракций. Нарушение синтеза иммуноглобулинов затрудняет выявление ПП при поликлональной гипергаммаглобулинемии (рис. 2.7), увеличение продукции IgA при циррозе (рис. 2.5), олигоклональный синтез иммуноглобулинов при хронических воспалительных заболеваниях. Гипоглобулинемия может быть проявлением миеломы Бенс-Джонса с угнетением синтеза собственных иммуноглобулинов (рис. 2.8). В последнем случае свободные легкие цепи обычно мигрируют в составе бета- или альфа2-фракции глобулинов. Изменения альфа2- и бета-фракций могут имитировать присутствие ПП. Дополнительные яркие полосы отмечаются в гамма-фракции при высоком содержании фибриногена в сыворотке (рис. 2.4), гемолизе с образованием комплексов “гемоглобин – гаптоглобин” в альфа2-фракции (рис. 2.3). Увеличение и изменение бета-фракции происходит при повышении трансферрина при железодефицитной анемии, выявлении генетических вариантов трансферрина, высокого С-реактивного белка или С3-фактора комплемента при воспалении. Подозрения на ПП могут возникать при нарушениях метаболизма при нефротическом синдроме (рис. 2.6) или индукции синтеза белков, например альфа-фетопротеина при раке печени.
Стандартного алгоритма для проведения иммунофиксации по результатам электрофореза белков сыворотки крови нет, поэтому решение о проведении дообследования клиницист и врач клинической лабораторной диагностики должны принимать совместно в зависимости от клинических находок и результатов лабораторных показателей. Обнаружение даже небольшого содержания ПП может указывать на тяжелое онкогематологическое заболевание, такое как лимфома или миелома. Определение свободных легких цепей иммуноглобулинов и их соотношения может использоваться в качестве дополнительного метода в постановке диагноза, однако такая оценка неточна при биклональной миеломе и небольшом содержании ПП (менее 5 г/л). Поэтому увеличение глобулиновых фракций сыворотки крови (альфа2, бета, гамма) требует проведения иммунофиксации. Гипогаммаглобулинемия, особенно в сочетании с протеинурией, является основным признаком миеломы Бенс-Джонса. В случае гипогаммаглобулинемии должен быть выполнен электрофорез 24-часовой мочи для обнаружения белка Бенс-Джонса.
Иммунофиксация является двустадийным процессом, который объединяет горизонтальный электрофорез в агарозном геле и детекцию иммуноглобулинов с помощью специфических антисывороток. Моноспецифические антисыворотки к тяжелым и легким цепям иммуноглобулинов наносятся на гель и проникают в его структуру за счет пассивной диффузии. Благодаря малой толщине геля линии преципитации антисыворотки иммуноглобулина образуются сравнительно быстро (через 20–30 мин), однако эффективность преципитации зависит от ряда факторов, включая концентрацию антигена, ионную силу и рН раствора, а также температуру. Образовавшиеся иммунные комплексы являются нерастворимыми и фиксируются в порах геля. Отмывка позволяет удалить несвязавшиеся белки, а иммунные комплексы окрашиваются белковым красителем.
Иммунофиксация производится одновременно на 6 дорожках, из которых в одну вносится фиксатор белков, в пять остальных – антисыворотки к тяжелым цепям IgG, IgA, IgM и легким цепям каппа и лямбда. Обнаружение характерной фракции белка, которая реагирует с антисыворотками против тяжелых и легких цепей, указывает на обнаружение ПП, представленного целой молекулой одного из основных классов иммуноглобулинов. Если фракция реагирует только с антисывороткой против легкой цепи, то рекомендуется повторное исследование с антисыворотками к IgD и IgE. Отсутствие реакции с антисыворотками к IgD и IgE указывает на то, что ПП представлен свободной легкой цепью иммуноглобулина. Болезнь тяжелых цепей представляет редкий лабораторный диагноз, который должен устанавливаться только при очевидном выявлении изолированного синтеза тяжелой цепи иммуноглобулина. Следует учитывать, что миелома класса IgA может походить на болезнь тяжелых цепей, т. к. структура ПП IgA может затруднять распознавание легких цепей соответствующими антисыворотками. Примеры обнаружения ПП с помощью иммунофиксации приведены на рис. 3. При выявлении ПП необходимо сопоставить результат иммунофиксации с электрофорезом белковых фракций, провести денситометрическое выделение моноклональной фракции и ее измерение.
Рис. 3. Варианты выявления парапротеина методом иммунофиксации на системе SAS1/SAS2 фирмы Helena Biosciences Europe (Великобритания).
Высокое содержание ПП в патологических образцах часто приводит к феномену “прозоны”, который заключается в растворении иммунных комплексов при высокой концентрации антигена. Феномен прозоны может приводить к ложноотрицательным результатам тестирования. Для устранения этого явления может потребоваться повторное исследование с многократным разведением тестируемой сыворотки для снижения концентрации ПП в образце. Высокая концентрация иммунных комплексов, ревматоидного фактора, криоглобулинов может привести к преципитации в месте нанесения сыворотки на всех дорожках. В этом случае может потребоваться использование восстанавливающих веществ, например 2-меркаптоэтанола, для растворения агрегатов и повтора исследования.
Удобным вариантом сочетания методов электрофореза белков сыворотки и иммунофиксации является исследование с пентавалентной антисывороткой. Это скрининговый метод, представляющий разновидность иммунофиксации с использованием одной антисыворотки, направленной против IgG, IgM, IgA, каппа и лямбда цепей. Окраска амидо-черным красителем позволяет проводить прямую денситометрию белковых фракций и одновременную количественную оценку ПП на основании выявленных моноклональных фракций. Этот метод не только позволяет проводить скрининговое обследование, но и сравнительно дешевле развернутого теста, т. к. вместо 6 используются только 2 дорожки.
Для выполнения клинического электрофореза и проведения иммунофиксации в нашей лаборатории с 2008 г. мы пользуемся системой клинического электрофореза SAS-1plus/SAS-2 и готовыми наборами реактивов фирмы Helena Biosciences Europe (Великобритания). Все реактивы для электрофореза объединены в системе “гель – буфер”, что исключает необходимость работы с буфером для электрофореза. На один гель может быть нанесено до 24 образцов, причем система нанесения образцов позволяет комбинировать образцы различного биологического материала, что целесообразно при одновременном проведении иммунофиксации образцов сыворотки крови и мочи. Заслуживает отдельного внимания уникальная система автоматического нанесения образцов на гель, которая может сконцентрировать биоматериал непосредственно на геле. За счет этого метод имеет высокую аналитическую чувствительность, составляющую 0,25 г/л белка на белковую фракцию сыворотки и до 10 мг/л на фракцию белков мочи. Электрофорез проводится в реакционной камере при постоянной температуре и влажности. Вся процедура фиксации, окрашивания и сушки геля стандартизована, выполняется в автоматическом режиме и не требует вмешательства персонала. Для обработки, редактирования, анализа и архивирования данных, а также ведения карт внутрилабораторного контроля качества используется русифицированный пакет программного обеспечения Platinum III. Его дополнительным преимуществом является возможность создания удобной формы заключения по результатам исследования, а также интегрирование в лабораторную информационную систему.
источник
Th. X. O’Connell, T. J. Horita, B. Kasravi
Am Fam Physician 2005;71:105-12
Анализ белков сыворотки крови (протеинограмма) с помощью электрофореза часто используется для выявления больных с множественной миеломой и другой патологией белков крови. Многие узкие специалисты включают данный тест в план первичного обследования по поводу многих заболеваний. Однако иногда результаты протеинограммы интерпретировать тяжело.
В данной статье подробно рассматривается методика электрофорезографии, показания, интерпретация протеинограммы и приведены рекомендации относительно дальнейшего обследования пациентов с патологическими результатами теста.
Электрофорез — метод разделения белков в зависимости от их физических свойств (размера, формы и полярности электрического заряда молекулы). Сыворотка крови наносится на специальную среду, через которую впоследствии пропускается ток.
Белковый состав сыворотки крови
Результат электрофореза белков плазмы крови зависит от состава фракций двух основных типов белков: альбуминов и глобулинов. Альбумин — основной белковый компонент сыворотки крови — в нормальных физиологических условиях синтезируется в печени. Глобулины составляют значительно меньшую фракцию протеинового состава сыворотки крови. Интерпретация протеинограммы заключается прежде всего в анализе белковых фракций и их относительного количества.
Альбумин — наивысший пик протеинограммы — располагается ближе всего к положительному электроду. Следующие пять компонентов (глобулины), последовательно располагающиеся все ближе к отрицательному электроду, обозначаются соответственно α1, α2, β1, β2 и γ. На рисунке 1 приведен образец распределения белков сыворотки крови при помощи электрофореза в норме.
Рис. 1. Результат электрофореза белков плазмы крови в норме.
Альбумин представляет наибольшую белковую фракцию сыворотки крови человека. Его уровень снижается при нарушении синтезирующей функции печени и при повышенной потере или распаде данного белка. К снижению уровня альбумина приводят нарушения питания, тяжелые заболевания печени, потеря через почки (например, при нефротическом синдроме), гормонотерапия, ожоги и беременность, а к повышению — состояния, сопровождающиеся снижением относительного содержания воды в сыворотке крови (например, дегидратация).
α1-фракция состоит из α1-антитрипсина 1 , тиросвязывающего глобулина и транскортина 2 . Ее объем возрастает при злокачественных заболеваниях и остром воспалительном процессе (благодаря белкам острой фазы), а снижается при дефиците α1-антитрипсина и снижении синтеза глобулинов при заболеваниях печени. α2-фракция содержит церуплазмин 3 , α2-макроглобулин 4 и гаптоглобулин 5 , уровень которых может возрастать как белков острой фазы.
β-фракция глобулинов делится на два пика: β1 (состоит преимущественно из трансферрина) и β2 (β-липопротеин). К β-фракции также относятся факторы комплемента, IgA, IgM и иногда IgG.
Основное внимание клиницистов приковано к γ-фракции, поскольку она содержит иммуноглобулины, хотя данные белки при электрофорезе могут мигрировать и в другие фракции. С-реактивный белок находится между β- и γ-фракциями.
Показания к назначению протеинограммы
Электрофорез белков сыворотки крови, как правило, назначается при подозрении на множественную миелому, хотя есть и другие показания (таблица 1).
Таблица 1. Показания к назначению протеинограммы с помощью электрофореза
|
Если результат электрофореза белков сыворотки крови нормальный, однако все еще подозревается наличие множественной миеломы 6 , макроглобулинемии Вальденстрема, первичного амилоидоза или связанного с ними заболевания, следует назначить протеинограмму по методу иммунофиксации, поскольку данный метод более чувствителен для выявления небольших моноклональных (M) белков.
В ответ на острое воспаление, злокачественное заболевание, травму, некроз, инфаркт, ожоги и химическое поражение в плазме возрастает уровень так называемых “белков острой фазы”: фибриногена, антитрипсина, гаптоглобулина, церулоплазмина, С-реактивного белка, C3-фракции комплемента и α1-кислотного гликопротеина. Часто также снижается уровень альбумина и трансферрина. В таблице 2 приведены изменения состава белков острой фазы, характерные для определенных заболеваний.
Таблица 2. Заболевания и клинические состояния, связанные с характерными изменениями содержания белков острой фазы в протеинограмме
|
При интерпретации результатов электрофореза белков сыворотки крови основное внимание уделяется гамма-фракции, состоящей в основном из антител класса IgG. Хотя гамма-фракция может возрастать вследствие многих причин, есть несколько заболеваний, приводящих к появлению гомогенного острофазового пика в зоне гамма-глобулинов (рис. 2). Эти так называемые “моноклональные гаммапатии” составляют группу заболеваний, характеризующихся пролиферацией одного клона плазматических клеток, синтезирующих гомогенный М-белок.
Рис. 2. Патологический результат электрофореза белков сыворотки крови у больного с множественной миеломой. Обратите внимание на большой острофазовый пик в гамма-фракции.
Дифференциальная диагностика моноклональных и поликлональных гаммапатий
Очень важно отдифференцировать моноклональные гаммапатии от поликлональных, поскольку моноклональные гаммапатии связаны со злокачественным либо потенциально злокачественным клональным процессом, а поликлональные, наоборот, с какими-либо, как правило, незлокачественными реактивными или воспалительными изменениями. В таблице 3 приведены наиболее частые этиологические факторы поликлональной гаммапатии.
Таблица 3. Дифференциальная диагностика поликлональной гаммапатии
|
М-парапротеин характеризуется наличием на электрофорезограмме острофазовой, четкой полосы, состоящей из одной тяжелой цепи, и подобной полосы с κ- или λ-легкой цепью. При поликлональной гаммапатии присутствует широкая диффузная полоса с одной или несколькими тяжелыми и κ- и λ-легкими цепями.
После выявления моноклональной гаммапатии при помощи электрофореза белков сыворотки крови следует отдифференцировать множественную миелому от других факторов данного типа гаммапатий: макроглобулинемии Вальденстрема, солитарной плазмоцитомы, латентной множественной миеломы, эссенциальной моноклональной доброкачественной гаммапатии, плазмоклеточного лейкоза, болезни тяжелых цепей и амилоидоза.
Количественное содержание М-парапротеина может помочь в дифференциальной диагностике между множественной миеломой и эссенциальной моноклональной доброкачественной гаммапатией. Критерием постановки диагноза множественной миеломы является выявление поражения 10–15% плазматических клеток в биоптате костного мозга. В таблице 4 приведены характерные дифференциальные симптомы моноклональных гаммапатий.
Таблица 4. Характерные признаки моноклональных гаммапатий
(по E. D. George, R. Sadovsky, 1999)
| Заболевание | Характерные признаки | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Фракция | Норма в г/л |
|---|---|
| Альбумин | 35-44 |
| Глобулин альфа-1 | 1-3 |
| Глобулин альфа-2 | 5-8 |
| Бета-глобулин | 4-10 |
| Гамма-глобулин | 5-12 |
Значения показателей, в зависимости от того какие реактивы применяются в конкретной лаборатории, могут несколько изменяться. Поэтому в бланке результатов исследования в каждом медицинском учреждении обязательно указываются значения нормы, которые приняты в нем. На них будет ориентироваться врач при расшифровке анализа.
Электрофорез белков крови назначают не очень часто, так как сегодня современные лабораторные исследования позволяют провести анализ на определенный белок, что ускоряет процесс диагностики. Абсолютным показанием к электрофорезу является наличие монолокальной гаммапатии. Также иногда анализ может быть показан в таких случаях:
- чрезмерно высокая скорость оседания эритроцитов, когда она превышает 50 мм/ч;
- значительно повышенный уровень гамма-глобулинов;
- скрининговое обследование для контроля эффективности лечения миеломной болезни;
- чрезмерно высокий общий белок в крови;
- ряд аутоиммунных заболеваний, поражающих печень и почки;
- слабость, для которой нет выраженной причины;
- развитие патологических переломов костей и постоянные боли в костях;
- частые рецидивы инфекционных заболеваний;
- нарушения, обнаруженные в прочих анализах, указывающие на то, что у человека могут развиваться анемии, лейкемии, гиперкальциемия или гипоальбуминемия.
При общей диспансеризации и получении медицинских справок для трудоустройства данное исследование крови не осуществляется. Не требуется оно и в процессе подготовки человека к хирургическому вмешательству.
Для получения наиболее точных результатов рекомендуется соблюдение правил подготовки к анализу. Они включают в себя голодную диету в течение 15 часов до того как будет взята кровь, когда пациент может употреблять только чистую не газированную воду. За 90 минут до проведения исследования необходимо полностью исключить нагрузки как эмоциональные, так и физические, и курение в активной или пассивной форме. Чтобы не допустить искажение данных, забор материала не проводят сразу после того, как был осуществлен гемодиализ или проведена процедура, при которой использовались радиоконтрастные составы. Важно также, чтобы за несколько дней до исследования полностью было исключено лечение пенициллином, так как он вызывает расщепление амбулина, что исказит результат.
| Фракция | Повышение | Понижение |
|---|---|---|
| Амбулин | Злоупотребление алкоголем, период вынашивания ребёнка, дегидрация | Холецистит в острой форме, лейкоз, миелома, саркоидоз, пневмония, остеомиелит, системная красная волчанка, лимфома |
| Глобулин альфа-1 | Цирроз печени, стрессовые состояния, лимфогранулематоз, период вынашивания ребёнка, язва желудка, острое или хроническое воспаление | Гепатит вирусной природы в острой форме |
| Глобулин альфа-2 | Сахарный диабет, остеомиелит, гломерулонефрит в острой форме, стрессовые состояния, системная красная волчанка, узловатый полиартрит, цирроз | Гипертиреоз, гепатит вирусной природы в острой форме, гемолиз интраваскулярный |
| Бета-глобулин | Сахарный диабет, саркоидоз, ревматоидный артрит, беременность, гломерулонефрит, желтуха подпеченочная, нефротический синдром | Лейкоз, цирроз, склеродермия имеющая системный характер, лимфома, системная красная волчанка |
| Гамма-глобулин | Цирроз, склеродермия системного характера, ревматоидный артрит, лимфолейкоз в хронической форме, муковисцидоз, синдром Шегрена | Лейкоз, склеродермия, гепатит вирусной природы в острой форме, лимфома, гломерулонефрит |
Исказить показатели, кроме неправильной подготовки к проведению анализа, могут 2 фактора: недавно проведенная процедура гемодиализа, из-за которой произошло разрушение эритроцитов в крови, и повышенный уровень билирубина в организме. В любом из этих случаев потребуется пересдача анализа через некоторое время, которое определит врач.
источник
