ГБОУ ВПО РНИМУ им. Н.И. Пирогова
Минздрава России
Кафедра медицинских нанобиотехнологий МБФ
Учебно-методическое пособие для проведения практических занятий со студентами фармакологического факультета
Денатурирующий электрофорез белков а полиакриламидных гелях.
кафедры медицинских нанобиотехнологий
Абакумов Максим Артемович
Для занятия студентов фармакологического факультета на 2 академических часа.
Цель занятия: Ознакомиться с основами метода определения молекулярной массы белков с помощью электрофореза в денатурируюших условиях в присутствии додецилсульфата натрия.
1) Физические принципы лежащие в основе метода электрофореза.
2) Химические основы метода получения акриламидных гелей.
3) Условия необходимые для эффективного разделения белков.
4) Правила безопасности при работе с источниками постоянного тока.
5) Устройство прибора для элекрофореза.
1) Объяснить принцип работы прибора .
2) Подготовить прибор к проведению эксперимента.
3) Определять молекулярную массу белка по электрофореграмме.
Базовые знания, необходимые для выполнения работы:
3) Основы молекулярной биологии
Основная литература: Остерман Л. А. Методы исследования белков и нуклеиновых кислот: электрофорез и ультрацентрифугирование. (практическое пособие). М.: Наука, 1981. 288 с.
Электрофорез — способ разделения веществ, основанный на различной скорости их передвижения под действием электрического поля. При пропускании электрического поля через водный раствор происходит перераспределение ионов. Катионы, находящиеся в растворе мигрируют к отрицательно заряженному электроду (катоду), а анионы к отрицательно заряженному (аноду). Скорость миграции определяется несколькими параметрами, в частности величиной напряжения, размером мигрирующего иона (пропорционального молекулярной массе), зарядом иона, плотностью раствора. Необходимо учитывать, что белок является полиэлекролитом, а его заряд зависит от аминокислотного состава и рН окружающего раствора. Таким образом, на подвижность белка влияет несколько факторов, что затрудняет определение его молекулярной массы и идентификацию. Чтобы нивелировать эти факторы был предложен метод дентатурирующего гель электрофореза в присутствии додецилсульфата натрия. Это было впервые предложено Лэмли в 1970г для определения строения белкового капсида бактериофага Т4. Им было предложено проводить разделение не в воде, где скорость миграции относительно высока, а полиакриламидном геле (Рисунок 1). Трёхмерная сетка геля создаёт ячеистую структуру, в которой размер ячейки контролируется процентным содержанием мономеров в геле. Чем больше мономера в растворе, тем более плотная структура образуется, и тем меньше размер ячеек. Добавление 2-меркаптоэтанола и прогревание образца с белком до 95°С в течении 5 минут полностью разрушает дисульфидные связи и вызвает денатурацию белка до линейной полипептидной цепи. Добавление додецилсульфата натрия вызывает его сорбцию на поверхности белка, а собственный заряд додецилсульфата нивелирует собственный заряд белка.
При использовании описываемого метода исходят из следующих допущений:
· белки после обработки SDS находятся в полностью денатурированном состоянии;
· количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе;
· собственный заряд полипептида несущественен в сравнении с зарядом связанного с ним SDS.
В данных условиях, все полипептиды имеют одинаковый удельный заряд и разделяются обратно пропорционально логарифму их молекулярной массы. Практика подтверждает верность данных предположений в подавляющем большинстве случаев.
Рисунок 1. Структура и получение полиакриламидного геля.
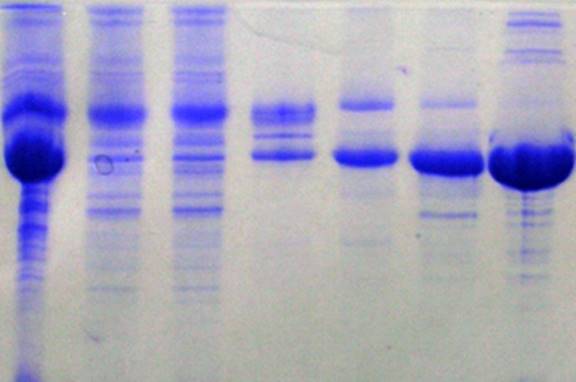
После проведения электрофореза необходима визуализация результатов, которая производиться с помощью прокрашивания геля белок-специфичными красками, например Comassie G250. При этом места расположения белков прокрашиваются синим цветом (Рисунок 2).
Рисунок 2. Вид электрофореграммы после окрашивания красителем Comassie.
Поскольку время и напряжение во время электрофореза может варьироваться, для построения калибровочной кривой на гель наносят образец белков маркеров, с заранее известной молекулярной массой. На основании положения маркеров строится график зависимости десятичного логарифма молекулярной массы от расстояния, которое прошёл белок (Рисунок 3).
Рисунок 3. Примерный вид калибровочной кривой.
Дата добавления: 2015-04-12 ; просмотров: 10 | Нарушение авторских прав
источник
Содержимое (Table of Contents)
Настоящая общая фармакопейная статья распространяется на метод молекулярной биологии и биохимии – электрофорез в полиакриламидном геле (ПААГ), используемый для разделения белков и нуклеиновых кислот, который основан на движении заряженных биологических макромолекул в постоянном электрическом поле.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Электрофорез ОФС.1.2.1.0023.15
в полиакриламидном геле Вводится впервые
Настоящая общая фармакопейная статья распространяется на метод молекулярной биологии и биохимии – электрофорез в полиакриламидном геле (ПААГ), используемый для разделения белков и нуклеиновых кислот, который основан на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также в зависимости от конфигурации молекул. Изменяя концентрацию полимера, можно получать гели с широким диапазоном размеров пор, позволяющих проводить разделение белков и пептидов с молекулярными массами от 2 до 300 тыс. кДа. Можно также изменять электрический заряд макромолекул (путем вариации рН буферного раствора) и их конформацию за счет введения в буферный раствор денатурирующих агентов или детергентов.
Протекание через жидкость электрического тока неизбежно связано с выделением тепла, поэтому следует обеспечивать теплоотвод и стабильность температурного режима с целью исключения изменений вязкости, проводимости и скорости потока и, следовательно, искажения зон анализируемых компонентов.
Для наблюдения за процессом в исходный препарат добавляют краситель, молекулы которого несут электрический заряд того же знака, что и фракционируемые молекулы, но не взаимодействуют с ними, причем скорость миграции наиболее подвижных макромолекул пробы должна быть несколько ниже, чем у молекул красителя. Когда фронт красителя достигает противоположной границы геля, электрофорез прекращают.
Разделившиеся зоны биополимеров во избежание их диффузии немедленно фиксируют. Для этого гель извлекают из стеклянной формы и выдерживают в смеси кислоты со спиртом так, что белки или нуклеиновые кислоты фиксируются в том самом месте, где закончилась их миграция. После фиксации или одновременно с ней проводят окрашивание зон путем выдерживания геля в растворе красителя, прочно связывающегося с белком или нуклеиновой кислотой. Излишек красителя удаляют.
Вместо окрашивания или наряду с ним могут использоваться радиоактивные метки и приемы регистрации полос на фотопленке посредством авторадиографии или флюорографии и различные способы счета радиоактивности в геле с помощью жидкостных сцинтилляционных счетчиков.
Гель полиакриламида имеет ряд преимуществ, определяющих его широкое использование. Он прозрачен, химически стабилен, инертен, устойчив к изменениям рН и температуры, нерастворим в большинстве растворителей, и, наконец, в нем практически отсутствуют адсорбция и электроосмос.
Разделяющие свойства полиакриламидных гелей (ПААГ) определяются трехмерной сетью волокон и пор, которая сформирована за счет бифункциональных бисакриламидных связей между смежными полиакриламидными цепями. Полимеризация катализируется системой, производящей свободные радикалы, составленной из аммония персульфата и тетраметилэтилендиамина.
С увеличением концентрации акриламида в геле эффективный размер пор уменьшается. Эффективный размер пор геля определяет его разделяющие свойства, то есть сопротивление геля к перемещению макромолекул. Существуют пределы концентраций акриламида, которые могут использоваться. При высоких концентрациях акриламида гели становятся более ломкими и трудны в обращении. С уменьшением размера пор геля уменьшается скорость перемещения белка через гель. Регулируя размер пор геля путем изменения концентрации акриламида, можно оптимизировать разрешающую способность метода для конкретного анализируемого образца. Таким образом, физическое состояние ПААГ характеризуется по составу акриламида и бисакриламида. Обычно используются гели, в которых общая концентрация мономера и сшивающего агента находится в диапазоне от 3 до 30 %, а количество сшивающего агента обычно составляет от одной десятой до одной двадцатой от количества мономера. При этом содержание сшивающего агента тем меньше, чем выше общая концентрация геля.
Электрофорез в полиакриламидных гелях с использованием натрия додецилсульфата (SDS) – наиболее распространенный способ электрофореза, используемый для оценки подлинности и чистоты белковых продуктов. Денатурированные под воздействием высокой температуры полипептиды, связываясь с анионным детергентом SDS, становятся отрицательно заряженными и приобретают конформацию, при которой радиус Стокса является функцией молекулярной массы независимо от типа белка. Поскольку количество связанного SDS почти всегда пропорционально молекулярной массе полипептида и не зависит от последовательности аминокислот в полипептиде, SDS-полипептидные комплексы мигрируют через полиакриламидные гели с подвижностью, прямо пропорциональной молекулярной массе полипептида.
Молекулярная масса белка может быть оценена по его относительной подвижности на прокалиброванном геле, и обнаружение отдельной полосы в таком геле является критерием чистоты.
Однако, наличие у полипептида радикалов типа N- или O-связанных гликозидов оказывает существенное влияние на оценку молекулярной массы белка, поскольку SDS не связывается с углеводной частью молекулы так же, как с полипептидной. Таким образом, пропорциональность отношения «заряд к массе» не выдерживается и электрофоретическая подвижность белков, подвергшихся посттрансляционным модификациям, не является истинным отражением молекулярной массы полипептидной цепи.
Трехмерная структура белков часто поддерживается за счет дисульфидных связей. Цель анализа SDS-ПААГ в восстанавливающих условиях состоит в том, чтобы разрушить эту структуру путем расщепления дисульфидных связей. Денатурация и дезагрегация белков заключается в обработке их 2-меркаптоэтанолом или дитиотреитолом (DTT), в результате которой происходит разрыв S-S связей, разворачивание полипептидной цепи и последующее связывание с SDS. В этих условиях молекулярная масса полипептидных субъединиц может быть рассчитана методом линейной регрессии при использовании подходящих стандартов молекулярных масс.
Без обработки восстанавливающими агентами типа 2-меркаптоэтанола или DTT дисульфидные ковалентные связи остаются неповрежденными и разделения на полипептидные субъединицы не происходит. Невосстановленные белки не могут полностью насыщаться SDS и, следовательно, не могут связывать детергент в постоянном массовом отношении. Это делает определение молекулярных масс этих молекул методом SDS-ПААГ менее стандартизованным, чем исследование полностью денатурированных полипептидов. Однако, выявление одной полосы в таком геле (т.е. отсутствие любых компонентов, отличных от основного компонента) является показателем чистоты белка.
Электрофорез белков в полиакриламидных гелях с натрия додецилсульфатом (SDS-PAGE), как правило, проводится в неоднородной буферной системе, которая описывается ниже.
Электрофорез в геле с неоднородной буферной системой (диск—электрофорез)
Метод диск-электрофореза, благодаря своей высокой разрешающей способности, рекомендуется для характеристики смесей белков и для обнаружения примесей, которые могут иметь подвижность, близкую к подвижности главного компонента.
Метод подразумевает использование прерывистой системы, состоящей из двух отличных гелей: разделяющего (нижнего) геля и концентрирующего (верхнего) геля. Эти два геля имеют различную пористость (верхний – крупнопористый, нижний – мелкопористый). Кроме степени пористости, эти два геля резко различаются по рН и молярности буферов, в которых они полимеризуются. Пористость, длина и тип буфера для нижнего геля определяются точно такими же соображениями, что и для простого непрерывного электрофореза.
Отличительной особенностью данного вида электрофореза является обязательное использование в составе электродного буферного раствора подвижных ионов, мигрирующих в том же направлении, что и белки; например, применение иона Cl — для щелочных буферных растворов или иона K + – для кислых. В этом буферном растворе подвижность иона, мигрирующего в том же направлении, что и белок, должна сильно зависеть от рН. Для этого удобно использовать цвиттерионы: например, простые аминокислоты (глицин и р-аланин). Их изоэлектрические точки лежат в нейтральной области рН (для глицина рI=5,97).
Под действием электрического поля ионы глицина, входящие в состав электродного буферного раствора, следуют за белками в концентрирующий гель. Область перемещающихся границ быстро формируется под действием высоко подвижных хлорид-ионов во фронте и относительно медленных замыкающих ионов глицина. Хлорид-ион из-за его небольшого размера мигрирует быстрее, чем любой из белков, присутствующих в образце. Величина рH образца и концентрирующих слоев выбирается так, чтобы быть приблизительно на 3 единицы ниже, чем верхнее значение pKa глицина. Поэтому, на пересечении этих слоев только около 0,1% глициновых молекул имеют отрицательный заряд. Таким образом, быстродвижущиеся хлорид-ионы постепенно замещаются ионами глицина, которые при рН 6,8 в концентрирующем геле нейтрализуются и перестают участвовать в проведении тока. Сопротивление верхней части концентрирующего геля резко возрастает, а вместе с ним возрастает и напряженность поля. Локализованные зоны высоковольтового градиента между передним и задним ионными фронтами вызывают относительно высокую скорость миграции белков в концентрирующем геле, которая не ограничивается благодаря крупнопористой структуре этого геля.
На границе концентрирующего и разделяющего гелей белки достигают высокоплотных слоев геля и замедляются из-за уменьшающегося размера пор разделяющего геля. Более высокое значение pH, с которым фронт электродного буферного раствора встречается в разделяющем геле, также заставляет глицинат мигрировать быстрее, и напряженность поля падает, что также снижает скорость движения белков. Таким образом, происходит концентрирование пробы и все компоненты образца, независимо от первоначальной высоты столбика пробы в лунке, входят в нижний гель практически одновременно в виде узкой зоны с высокой концентрацией белка.
В мелкопористом разделяющем геле начинается процесс медленной миграции белков и их фракционирования в зависимости от молекулярных масс, а то обстоятельство, что процесс разделения начинается с узкой исходной зоны, обеспечивает высокую разрешающую способность системы вцелом.
Прибор для электрофореза состоит из:
1) источника постоянного тока с регулируемым напряжением и со стабилизатором напряжения;
2) камеры для электрофореза, служащей для размещения пластинки или трубки геля и поддержания постоянных условий проведения анализа. Камера обычно имеет прямоугольную форму, изготовлена из стекла или твердой пластмассы с двумя изолированными буферными резервуарами (анодным и катодным), содержащими раствор электролита. В каждый резервуар погружен электрод (например, платиновый), подключенный к соответствующему полюсу источника тока. Должен поддерживаться одинаковый уровень электролитов в резервуарах, чтобы предотвратить поток жидкости и гидростатическое давление на гель. Камера для электрофореза оснащена крышкой, которая предотвращает испарение растворителей и обеспечивает равномерно насыщенную влагой атмосферу во время всего процесса. Предпочтительно использование предохранителя для отключения электропитания, когда крышка камеры снята. Если мощность тока, приложенного к электрофоретической пластинке, превышает 10 Вт, то рекомендуется применять охлаждение камеры.
3) устройства для заливки геля, представляющего собой стеклянную трубку, стеклянную пластину или пару прямоугольных пластин (ячейку), служащих для формирования поддерживающей среды, в которой непосредственно проводится процесс электрофоретического разделения. Пластины могут быть расположены в камере вертикально или горизонтально (вариант горизонтального электрофореза обычно применяется для агарозных гелей) и должны быть погружены или иметь контакт посредством фитилей с катодным и анодным изолированными буферными резервуарами, содержащими раствор электролита. Преимуществом пластин для проведения процесса является возможность сравнения образцов в одной общей ячейке геля, что более информативно по сравнению с набором гелей из ряда трубок. Преимущество горизонтальных пластин по сравнению с вертикальными заключается в отсутствии проблемы герметизации швов, а недостаток – в большой поверхности контакта с воздухом и, соответственно, риске испарения жидкости.
Сборку прибора и его очистку после использования проводят в соответствии с инструкцией производителя.
Перед заливкой геля основание и боковые стороны ячейки закрывают подходящими прокладками, толщина которых определяет толщину рабочего геля (при этом после полимеризации геля прокладку в основании убирают). Ячейку заполняют раствором мономера с поперечно-сшивающим агентом и катализатором. Растворы должны быть дегазированы перед полимеризацией и гели должны использоваться свежеприготовленными. Заливку растворов проводят таким образом, чтобы исключить попадание внутрь ячейки пузырьков воздуха.
Гребенку, имеющую зубцы соответствующего размера (в зависимости от объемов наносимого образца), устанавливают в верхнюю часть ячейки на разделяющий гель и оставляют там до окончания полимеризации геля. Формирование геля обычно занимает не менее 30 мин и может считаться законченным, когда между гелем и водным слоем появляется четкая граница. После удаления гребенки из геля, прошедшего полимеризацию, остается ряд лунок.
Заполняют нижний и верхний резервуары камеры предписанным электродным буферным раствором. Готовят испытуемый и стандартный растворы, содержащие краситель и сахарозу или другой плотный и вязкий растворитель. Наносят образцы шприцем или микропипеткой в основания лунок, сразу включают электрический ток и начинают электрофорез, соблюдая предписанные условия (температуру и величину напряжения).
После окончания процесса (когда краситель достигает нижней границы пластины) ток выключают, пластину удаляют из камеры, зоны фиксируют, окрашивают и при необходимости пластину высушивают.
Подготовка полиакриламидного геля для вертикального электрофореза с SDS в неоднородной буферной системе
Сначала готовят и заливают в подготовленную ячейку нижний разделяющий гель, а затем сверху наслаивают концентрирующий гель.
В конической колбе готовят рассчитанное в зависимости от объема ячейки количество раствора для разделяющего геля, содержащего требуемую концентрацию акриламида, используя значения, приведенные в Таблице 1. Смешивают компоненты в указанном порядке. В тех случаях, где требуется, перед добавлением раствора аммония персульфата и тетраметилэтилендиамина (TEMED) раствор фильтруют, и, если необходимо, дегазируют раствор через мембрану из ацетата целлюлозы (с диаметром пор
0,45 мкм) под вакуумом при перемешивании. Добавляют соответствующие количества раствора аммония персульфата и TEMED как указано в табл. 1, перемешивают и немедленно заливают в промежуток между двумя стеклянными пластинами ячейки. Оставляют достаточное место для концентрирующего геля (длина зубцов гребенки плюс 1 см). Используя суженную стеклянную пипетку, тщательно наслаивают на гель сверху воду или изобутанол. Оставляют гель в вертикальном положении при комнатной температуре до завершения полимеризации.
После окончания полимеризации воду или изобутанол сливают и промывают верхнюю часть геля несколько раз водой, чтобы удалить остатки неполимеризованного акриламида и изобутанола, если он использовался. Сливают с верхней части геля так много жидкости, как только возможно и затем удаляют любую оставшуюся влагу фильтровальной бумагой.
В конической колбе готовят соответствующее количество раствора, содержащего требуемую концентрацию акриламида, используя значения, приведенные в табл. 2. Смешивают компоненты в том же порядке и с использованием тех же приемов фильтрации и дегазирования, что и для разделяющего геля. После добавления соответствующих количеств раствора аммония персульфата и TEMED, как указано в табл.2, перемешивают и немедленно заливают в промежуток между двумя стеклянными пластинами ячейки непосредственно на поверхность полимеризованного разделяющего геля. Немедленно, но с осторожностью, вставляют чистую тетрафторполиэтиленовую гребенку в раствор концентрирующего геля так, чтобы избежать попадания в гель воздушных пузырей. Добавляют избыточное количество раствора концентрирующего геля так, чтобы полностью заполнить пространство между зубцами гребенки.
| Компоненты раствора | Объем компонента (мл) на ячейку заданного объема | |||||||
| 5 мл | 10 мл | 15 мл | 20 мл | 25 мл | 30 мл | 40 мл | 50 мл | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 4% акриламида | ||||||||
| Вода очищенная | 2,6 | 5,3 | 7,9 | 10,6 | 13,2 | 15,9 | 21,2 | 26,6 |
| Раствор акриламида 1) | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 | 8,0 | 10,0 |
| 1,5М Трис | ||||||||
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
| Компоненты раствора | Объем компонента (мл) на ячейку заданного объема | |||||||
| 1 мл | 2 мл | 3 мл | 4 мл | 5 мл | 6 мл | 8 мл | 10 мл | |
| Вода очищенная | 0,68 | 1,4 | 2,1 | 2,7 | 3,4 | 4,1 | 5,5 | 6,8 |
| Раствор акриламида 1) | 0,17 | 0,33 | 0,5 | 0,67 | 0,83 | 1,0 | 1,3 | 1,7 |
| 1,0М Трис | ||||||||
(рН 6,8) 6)
1) Раствор акриламида: 30% раствор акриламида/бисакриламида (29:1)
2) 1,5М Трис (рН 8,8): 1,5 М буферный раствор трис-гидрохлорида, рН 8,8
3) 100 г/л SDS: раствор натрия додецилсульфата 100 г/л
4) 100 г/л APS: раствор аммония персульфата 100 г/л. Аммония персульфат является источником свободных радикалов, которые управляют полимеризацией акриламида и бисакриламида. Таким образом, раствор аммония персульфата должен добавляться медленно.
5) TEMED: тетраметилэтилендиамин.
6) 1,0М Трис (рН 6,8): 1 М буферный раствор трис-гидрохлорида, рН 6,8
Гель со вставленной гребенкой оставляют в вертикальном положении при комнатной температуре до окончания полимеризации.
Если в фармакопейной статье нет других указаний, то определение молекулярных масс проводят при нагрузке на лунку 10 мкг общего белка, а определение чистоты – при нагрузке 40 мкг при окрашивании Кумасси бриллиантовым R250, а при окрашивании нитратом серебра достаточно 2–5 мкг белка на лунку.
Толщина гребенки выбирается точно в соответствии с толщиной используемых прокладок, а размер зубцов – в соответствии с предполагаемым объемом образцов. Необходимый и достаточный объем формируемой лунки определяется как произведение длины, ширины и высоты (в микрометрах) одного зубца гребенки: V = L ∙ D ∙ H.
Объем наносимого образца вычисляют следующим образом:
где: k – коэффициент разбавления пробы буферным раствором для образца;
Х – требуемое для нанесения на гель количество белка в зависимости от целей анализа, в мкг;
С – концентрация общего белка, определяемая по методу Лоури, в мкг/мл.
После окончания полимеризации аккуратно удаляют гребенку, немедленно ополаскивают лунку водой, чтобы удалить любые остатки неполимеризованного акриламида. Если необходимо, выправляют зубцы концентрирующего геля при помощи тупой подкожной иглы, насаженной на шприц.
Устанавливают гель в прибор для электрофореза согласно инструкциям изготовителя оборудования. Добавляют электродный буферный раствор в верхнюю и нижнюю буферные емкости. Обычно, если нет других указаний в фармакопейной статье, в качестве электродного буферного раствора используется трис-глициновый буферный раствор с рН 8,3-8,4.
Удаляют любые пузыри, которые могут появиться у основания геля между стеклянными пластинами. Не следует включать электрический ток до внесения образцов, так как это уничтожит неоднородность буферных систем.
Готовят испытуемый раствор и раствор сравнения в рекомендованном буферном растворе для образцов в соотношении, указанном в фармакопейной статье или нормативной документации.
Обычно для обеспечения полной денатурации образец в смеси с буферным раствором подвергают дополнительно температурной обработке, режим которой должен быть указан в фармакопейной статье или нормативной документации.
Наносят соответствующие объемы каждого из растворов в лунки концентрирующего геля. Начинают электрофорез, используя условия, рекомендуемые изготовителем оборудования.
Изготовители оборудования для SDS-ПААГ могут обеспечивать применение гелей различной площади и толщины. Соответственно продолжительность электрофореза и сила тока (или напряжение) могут быть изменены, как описано изготовителем прибора, чтобы достичь оптимального разделения, что проверяют по скорости перемещения фронта индикатора в разделяющем геле.
Когда индикатор достигает основания геля, электрофорез останавливают. Удаляют ячейку с гелем из прибора и отделяют стеклянные пластины. Удаляют прокладки, отрезают и удаляют концентрирующий гель и немедленно проводят процедуру окрашивания. Для того, чтобы можно было выявить присутствие в исследуемом образце агрегатов и других компонентов, не входящих в гель, концентрирующий гель рекомендуется обрезать не полностью, оставляя 2–3 мм.
Так называемые, «готовые к использованию» коммерческие гели и наборы реактивов к ним могут быть применены при условии, что они дают результаты, отвечающие валидационным критериям, приведенным ниже в разделе «Оценка пригодности системы».
Окрашивание Кумасси бриллиантовым R250 – наиболее распространенный метод окрашивания белков с пределом обнаружения порядка от 1 до 10 мкг белка в полосе. Окрашивание нитратом серебра – более чувствительный метод окрашивания белков в гелях, позволяющий выявлять до 1 нг белка.
Для селективного окрашивания гликозилированных белков или липопротеидов иногда применяют другие красители или их смеси, о чем должно быть сделано дополнительное указание в фармакопейной статье или нормативной документации.
Все процедуры окрашивания геля проводят, как правило, при комнатной температуре и при слабом перемешивании в любом удобном контейнере. При окрашивании геля следует использовать одноразовые перчатки, иначе на геле могут быть прокрашены отпечатки пальцев.
Погружают гель в большой избыток красящего раствора Кумасси раствора и выдерживают, по крайней мере, 1 ч. Поскольку кислотно-спиртовой состав окрашивающего раствора не позволяет полностью фиксировать белки на геле, это может приводить к потерям некоторых низкомолекулярных белков во время окрашивания и обесцвечивания тонких гелей. Полная фиксация возможна при выдерживании геля в 10 % растворе трихлоруксусной кислоты в течение 1 ч перед погружением в окрашивающий Кумасси раствор.
Для ускорения процедуры окрашивания допускается подогрев геля в окрашивающем растворе в микроволновой печи. Режим подогрева должен быть описан в фармакопейной статье или нормативной документации. Затем окрашивающий раствор удаляют и гель промывают водой.
Обесцвечивают гель избытком обесцвечивающего раствора. Заменяют порции обесцвечивающего раствора несколько раз до тех пор, пока окрашенные полосы белка не станут ясно различимы на прозрачном фоне. Чем более полно обесцвечен гель, тем меньшие количества белка могут быть обнаружены этим методом. Обесцвечивание может быть ускорено при добавлении в обесцвечивающий раствор нескольких граммов анионобменной смолы или маленького кусочка пористого материала.
После обесцвечивания гель промывают водой и либо высушивают, либо оставляют в воде для хранения при температуре от 2 до 8 °С.
Погружают гель в большой избыток фиксирующего раствора и выдерживают в течение 1 ч. Фиксирующий раствор сливают, добавляют новую порцию того же раствора и инкубируют, по крайней мере 1 ч или оставляют на ночь. Сливают фиксирующий раствор и промывают гель в большом избытке воды в течение 1 ч. После этого пропитывают гель в течение 15 мин в 1 % растворе глутарового альдегида. Промывают гель дважды по 15 мин большим количеством воды. Выдерживают гель в темноте в свежеприготовленном 2 % растворе серебра нитрата в течение 15 мин. Промывают гель три раза по 5 мин в большом количестве воды. Погружают гель приблизительно на 1 мин в проявляющий раствор, пока не будет достигнуто удовлетворительное окрашивание. Окрашивание прекращают в момент проявления полосы в треке с минимальным количеством препарата (например, 0,001 мкг). Останавливают развитие окраски погружением в стоп-раствор на 15 мин. Ополаскивают гель водой.
Целесообразно использовать готовые наборы реактивов для окрашивания гелей серебра нитратом.
В зависимости от используемого метода окрашивания подготовку геля к высушиванию проводят различными способами:
– при окраске Кумасси после процедуры обесцвечивания гель выдерживают в смеси 10,0 г глицерина и 92 мл воды очищенной не менее 2 ч (возможна инкубация «на ночь»);
– при окраске нитратом серебра гель после заключительной процедуры ополаскивания выдерживают в течение 5 мин в смеси 2,0 г глицерина и 98 мл воды очищенной.
Погружают два листа пористой целлюлозной пленки в воду и выдерживают в течение 5–10 мин. Растягивают один из листов на рамке для высушивания. Аккуратно помещают пропитанный в глицериновом растворе гель на натянутую целлюлозную пленку. Удаляют все случайно попавшие воздушные пузыри, и заливают вокруг граней геля несколько миллилитров воды. Помещают второй лист пленки сверху и снова удаляют все воздушные пузыри. Заканчивают сборку рамки для сушки геля и помещают ее в сушильный шкаф или оставляют при комнатной температуре до полного высыхания.
Молекулярные массы белков определяют по сравнению их подвижностей с подвижностью нескольких белков-маркеров известной молекулярной массы. Готовые смеси белков с точно известными молекулярными массами (маркеры) для калибрования гелей предлагаются производителями материалов и оборудования для электрофореза в различных диапазонах молекулярных масс. Концентрированные исходные растворы полипептидов известной молекулярной массы готовят в соответствующем буферном растворе для образцов и наносят на гель одновременно с образцом испытуемого белка.
Сразу после того, как электрофорез завершен, следует отметить положение полосы красителя бромфенолового синего, которая соответствует электрофоретическому ионному фронту. Это может быть сделано при помощи меток-надрезов в геле или путем прокола геля в зоне окрашенного фронта иглой, предварительно обмакнутой в черную тушь или другой подходящий контрастный краситель.
После окрашивания геля измеряют расстояния пробега для каждой полосы белка (маркеров и испытуемого образца) от вершины разделяющего геля. Вычисляют отношение расстояния пробега каждого белка к расстоянию пробега фронта красителя. Нормализованные расстояния пробега, вычисленные таким образом, называются относительными подвижностями белков (относительно фронта красителя) и обозначаются как Rf.
где: R – расстояние пробега белка;
RS – расстояние пробега красителя
Строят график зависимости логарифма относительных молекулярных масс стандартов белка (Мr) от значения Rf. Неизвестные молекулярные массы могут быть оценены методом линейной регрессии или интерполяцией кривых зависимости logMr от Rf в том случае, если значения, полученные для испытуемых образцов, находятся в линейной части графика.
В тех случаях, когда в фармакопейной статье указан предел примесей, то перед анализом должен быть приготовлен раствор сравнения, соответствующий этому уровню примеси, путем разбавления испытуемого раствора. Например, в случае 5 % предела, раствор сравнения должен быть приготовлен разведением испытуемого раствора в соотношении 1:20. При этом примесь (полоса, отличная от главной полосы) на электрофореграмме с испытуемым препаратом не должны быть интенсивнее, чем полоса, полученная с раствором сравнения. При наличии нескольких полос примесей должно быть предусмотрено требованию к содержанию каждой из них и к содержанию суммы примесей.
Приемлемым условием определения примесей может считаться метод количественной нормализации с использованием денситометрического интегрирования. В этом случае предварительно должна быть показана линейность отклика прибора.
Результаты анализа считаются достоверными только в том случае, если:
- белки маркера молекулярных масс распределены приблизительно на 80 % длины геля и охватывают весь требуемый диапазон разделения (например, диапазон молекулярных масс продукта и его димера или продукта и родственных примесей);
- зависимость логарифма молекулярной массы белков-маркеров и Rf – линейна в необходимом диапазоне.
Дополнительные требования приемлемости результатов анализа должны быть описаны в фармакопейной статье или нормативной документации.
1) Приготовление 30% раствора акриламида/бисакриламида. В мерный стакан вместимостью 250 мл помещают 29,2 г акриламида и 0,8 г N,N’-метиленбисакриламида, растворяют в воде очищенной при перемешивании, доводят объем раствора водой до 100 мл и вновь перемешивают (при необходимости раствор фильтруют, как указано в фармакопейной статье или нормативной документации). Раствор хранят во флаконе из темного стекла при температуре 4–6 °С не более 1 мес.
2) Приготовление раствора натрия додецилсульфата. В мерный стакан вместимостью 250 мл помещают 10,0 г натрия додецилсульфата, растворяют в воде очищенной при аккуратном перемешивании, избегая вспенивания, доводят объем раствора до 100 мл и вновь перемешивают. Раствор хранят при комнатной температуре.
3) Приготовление раствора аммония персульфата. Растворяют 100,0 мг аммония персульфата в 1,0 мл воды очищенной. Раствор используют свежеприготовленным.
4) Приготовление 1,5М буферного раствора трис-гидрохлорида (рН 8,8). В мерный стакан вместимостью 500 мл помещают 90,8 г трис(гидроксиметил)аминометана и растворяют в 400 мл воды. Доводят рН раствора до 8,8 с помощью 1 М раствора хлористоводородной кислоты, затем доводят объем раствора тем же растворителем до 500 мл и перемешивают. Раствор хранят при температуре 4–6 °С не более 1 мес.
5) Приготовление 1,0 М буферного раствора трис-гидрохлорида (рН 6,8). В мерный стакан вместимостью 500 мл помещают 60,6 г трис(гидроксиметил)аминометана и растворяют в 400 мл воды. Доводят рН раствора до 6,8 с помощью 1 М раствора хлористоводородной кислоты, затем доводят объем раствора тем же растворителем до 500 мл и перемешивают. Раствор хранят при температуре 4–6 °С не более 1 мес.
6) Приготовление электродного буферного раствора (10×) (рН 8,3). В мерный стакан, вместимостью 1000 мл помещают 30,0 г трис(гидроксиметил)аминометана, 144,0 г глицина и 10,0 г натрия додецилсульфата, растворяют в воде и доводят объем раствора тем же растворителем до метки. Фильтруют и измеряют рН раствора, который должен быть 8,3 — 8,4. Доводить рН раствора кислотой или щелочью до необходимого значения не допускается.
Раствор хранят при комнатной температуре не более 3 мес.
Непосредственно перед анализом 1 часть приготовленного раствора смешивают с 9 частями воды очищенной.
7) Приготовление буферного раствора для образцов (4×) для электрофореза в восстанавливающих условиях с 2-меркаптоэтанолом. В химическом стакане смешивают 4,7 мл воды очищенной, 0,5 мл 1М буферного раствора трис-гидрохлорида (рН 6,8), 0,8 мл глицерина, 1,6 мл 10% раствора натрия додецилсульфата, 0,4 мл 2-меркаптоэтанола и 2 мг бромфенолового синего. Раствор хранят при температуре 4–6 °С не более 1 мес.
8) Приготовление буферного раствора для образцов (4×) для электрофореза в восстанвливающих условиях с дитиотреитолом. В химическом стакане тщательно перемешивают 5,0 мл воды очищенной, 0,5 мл 1М буферного раствора трис-гидрохлорида (рН 6,8), 0,8 мл глицерина, 1,6 мл 10% раствора натрия додецилсульфата, 0,06 г 1,4-дитиотреитола и 2 мг бромфенолового синего. Раствор используют свежеприготовленным.
9) Приготовление буферного раствора для образцов (4×) для электрофореза в невосстанвливающих условиях. В химическом стакане тщательно смешивают 5,1 мл воды очищенной, 0,5 мл 1М буферного раствора трис-гидрохлорида (рН 6,8), 0,8 мл глицерина, 1,6 мл 10% раствора натрия додецилсульфата и 2 мг бромфенолового синего. Раствор хранят при температуре 4–6 °С не более 3 мес.
10) Приготовление красящего раствора Кумасси. Раствор готовят по одному из способов приготовления (№ 1 или № 2):
Раствор № 1. Растворяют 0,3 г Кумасси бриллиантового R250 в смеси 100 мл спирта метилового или этилового и 100 мл воды очищенной. Перемешивают до полного растворения (в течение 1 ч). Добавляют 25 мл ледяной уксусной кислоты, доводят объем раствора водой очищенной до 250 мл и перемешивают. Хранят окрашивающий раствор в темной бутыли при комнатной температуре. Раствор хранят при температуре 18-25 0 С в течение 2 мес.
Раствор № 2. 1,0 г Кумасси ярко-голубого R-250 помещают в химический стакан, доводят до объема 250,0 мл этиловым спиртом, перемешивают не менее 3,5 часов до полного растворения красителя, добавляют 100,0 мл кислоты ледяной уксусной и доводят объем деионизованной водой до 1000,0 мл. Раствор хранят при температуре 18-25 0 С в течение 2 мес.
11) Приготовление обесцвечивающего раствора. К 400 мл спирта метилового или этилового добавляют 100 мл ледяной уксусной кислоты, доводят объем раствора до 1000 мл и перемешивают.
12) Приготовление фиксирующего раствора. К 250 мл спирта метилового или этилового добавляют 0,27 мл 37 % раствора формальдегида, доводят объем раствора водой очищенной до 500 мл и перемешивают.
13) Приготовление 1 % раствора глутарового альдегида. В мерную колбу вместимостью 100 мл помещают 4 мл 25 % глутарового альдегида или 2 мл 50 % глутарового альдегида, доводят объем раствора водой очищенной до метки и перемешивают.
14) Приготовление раствора серебра нитрата. Смешивают 2,75 мл 25 % раствора аммиака и 40 мл 1 М раствора натрия гидроксида, прибавляют по каплям при постоянном перемешивании 8 мл 20 % раствора серебра нитрата, доводят объем раствора водой очищенной до 200 мл и перемешивают.
15) Приготовление 20 % раствора серебра нитрата. Растворяют в воде очищенной 2,0 г (точная навеска) серебра нитрата, доводят объем раствора водой до 10 мл и перемешивают. Раствор используют свежеприготовленным.
16) Приготовление проявляющего раствора. Смешивают 2,5 мл 2,0 % раствора лимонной кислоты и 0,27 мл 37 % раствора формальдегида, доводят объем раствора водой очищенной до 500 мл и перемешивают.
17) Приготовление стоп-раствора. К 50 мл воды прибавляют 10 мл ледяной уксусной кислоты, доводят объем раствора водой очищенной до 100 мл и перемешивают.
В случае использования других реактивов и растворов они должны быть описаны в фармакопейной статье или нормативной документации.
источник
Лабораторная работа 1.1. Анализ белков при помощи электрофореза в полиакриламидном геле в денатурирующих условиях (SDS-PAGE)
В основе метода электрофореза лежит явление миграции заряженных частиц под действием электрического поля. Многие биологические микро- и макромолекулы, такие как пептиды, белки, нуклеиновые кислоты, обладают ионизируемыми группами и при определенном значении рН окружающей среды существуют в растворе в виде положительно заряженных частиц – катионов, либо в виде отрицательно заряженных частиц – анионов. Следовательно, под влиянием внешнего приложенного электрического поля эти заряженные частицы будут мигрировать либо к катоду, либо к аноду, в зависимости от своего результирующего заряда и молекулярной массы.
Метод электрофореза, предложенный еще в начале ХХ века, сейчас широко используют в биологии и медицине для разделения белков в исследовательских и клинических целях. С помощью электрофореза можно разделить на отдельные компоненты белковую смесь, что позволяет установить молекулярную массу белка или его субъединиц, подтвердить чистоту выделенного белка. Таким образом, электрофоретический метод в биохимии – это способ пространственного разделения молекул в плотном пористом геле, имеющих разный заряд и размеры. Результатом проведения электрофореза является электрофореграмма — изображение, полученное после разделения сложной смеси с помощью электрофореза и специфического проявления (окрашивания).
Электрофореграммы белков различных биологических жидкостей человека (сыворотка крови, моча, спинномозговая жидкость и др.) позволяют врачам и медицинским биохимикам получить значительную диагностическую информацию. Результаты электрофоретического разделения ферментов (зимограммы) позволяют изучать изменения активности и изоферментного спектра таких белков под действием внешних и внутренних факторов, как у человека, так и у других организмов (рис. 1).
Обычно белки находятся в растворе в виде заряженных частиц. Заряд на поверхности белков возникает в результате диссоциации группировок, находящихся в боковых радикалах аминокислот (карбоксильных, амино-, имидазольных и др. групп), а также при связывании ионов. Так как степень диссоциации группировок зависит от рН раствора, то величина и знак суммарного заряда белковой молекулы зависят от рН среды, а также от ионной силы (интенсивности электрического поля, создаваемого ионами в растворе).
Рисунок 1 — Результаты электрофореза 7 образцов белков в полиакриламидном геле (ПААГ). После разделения белков, гель погружался в раствор красителя – Coomasie R250, который связывается с молекулами белков. Изображение (электрофореграмма) было получено сканированием окрашенного геля.
Для каждого белка существует такое значение рН среды (обозначаемое как рI – изоэлектрическая точка), при котором положительные и отрицательные заряды ионизированных групп будут скомпенсированы. Вследствие этого факта, заряд всей белковой молекулы равен нулю. Таким образом, в буферном растворе со значением рН = рI изучаемого белка, невозможно движение белковой молекулы в приложенном электрическом поле.
Из-за разницы в аминокислотном составе, все белки имеют разные значения рI. При рН ≠ pI молекулы белка приобретают заряд и под действием электрического поля перемещаются к противоположно заряженным электродам – катоду(‑) или аноду(+). Например, кислые белки, богатые моноаминодикарбоновыми аминокислотами (аспарагиновая кислота (Asp); глютаминовая кислота (Glu), даже в буферном растворе со слабощелочным значением рН (8.0 – 8.5) приобретут значительный суммарный отрицательный заряд, вследствие диссоциации карбоксильных групп на СОО ‑ и H + и будут двигаться к аноду.
Для электрофоретического разделения биологических макромолекул оптимально такое значение рН рабочего буферного раствора, которое обусловливает максимальное различие зарядов разных белков, составляющих исходную смесь, а не их максимальный заряд. Обычно электрофорез проводят в среде (буфере) со значением рН, на 3 — 4 единицы отличающимся от среднего значения рI для белков данного типа. Это позволяет добиться хорошей электрофоретической подвижности и, вместе с тем, сохранить ощутимые различия молекул по заряду. Предпочтительно использовать буфер известной и постоянной ионной силы на основе однозарядных ионов. От рабочего буфера также требуется существенная емкость, так как локальная концентрация белка в образующихся при разделении смеси зонах скопления молекул может оказаться значительной. Поэтому используют буферы с концентрацией не менее 0.1 — 0.2 М. При проведении электрофореза электрическое поле создают с помощью источника питания – стабилизированного выпрямителя, способного давать регулируемое напряжение до 100 – 1000 В, при силе тока в несколько десятков миллиампер (мА).
Электрофорез проводят в однородном электрическом поле, то есть в поле, напряженность E которого во всех точках одинакова. Электрический ток пропускают через проводник – буферный раствор, налитый в канал из изолирующего материала (например, стекла) или пропитывающий какую-либо поддерживающую среду – носитель (например, бумагу или гель). Сопротивление R буферного раствора задается двумя факторами: концентрацией в нем свободных ионов и их электрофоретической подвижностью. Электрофоретической подвижностью (u) данной молекулы называют скорость движения заряженной молекулы (выражаемой в см/ч) в электрическом поле с напряженностью 1 В/см. Именно различия в электрофоретической подвижности белков, содержащихся в анализируемой смеси, делают возможным разделить эти белки в пространстве (в разных зонах электрофореграммы).
Скорость V движения белков к тому или иному электроду снижается из-за их трения в окружающей среде. Сила трения прямо пропорциональна скорости движения белковых молекул. Коэффициент трения белковой молекулы, обозначенный как f, зависит как от размера, формы и степени гидратированности этой молекулы, так и от свойств самой среды. Электрофоретическая подвижность белка зависит:
- от самой молекулы: ее размера (молекулярной массы), формы, электрического заряда, степени диссоциации и гидратации,
- от концентрации молекул,
- от свойств среды: ее вязкости, рН, температуры и ионной силы,
- от характеристик используемого электрического поля (для крупных макромолекул применяется электрофорез в пульсирующем электрическом поле).
1.1.2. Классификация электрофоретических методов:
Основными типами электрофореза являются:
- зональный электрофорез,
- изотахофорез,
- изоэлектрическое фокусирование,
- иммуноэлектрофорез.
Зональный электрофорез проводится при постоянном (не изменяющемся) значении рН буферного раствора, заполняющего данный носитель (бумагу, гель, др.). Исследуемый образец наносится пятном или тонким слоем на носитель, по которому и перемещается в электрическом поле. Усложненным вариантом зонального электрофореза является диск-электрофорез (многофазный зональный электрофорез), при котором рН и другие характеристики, постоянные внутри одной “фазы”, при переходе к другой “фазе” скачкообразно изменяются.
При изоэлектрическом фокусировании в среде для электрофореза создается плавный градиент рН. Белок останавливается в зоне, где значение рН равно его изоэлектрической точке (pI). Для создания градиента рН обычно используют раствор полиамино-поликарбоновых кислот, которыми насыщают носитель. В отсутствии электрического поля эта смесь обычно имеет значение рН равное 6.5. При наложении электрического поля указанные кислоты обеспечивают линейный градиент рН от 3 до 10.
В случае изотахофореза заряженные ионы сначала разделяются в соответствии с величинами их заряда и подвижности, а затем перемещаются в электрическом поле с одинаковыми и постоянными скоростями.
Иммуноэлектрофорез сочетает в себе электрофоретическое разделение белков с иммунопреципитацией, основанной на реакции “антиген – антитело”. Этот тип электрофореза превосходит остальные по чувствительности и разрешающей способности.
По цели применения электрофореза различают:
- аналитический электрофорез (для анализа состава смеси),
- препаративный электрофорез (для получения препаратов — значительных количеств чистых веществ).
По степени денатурации разделяемых белков различают:
- нативный электрофорез,
- электрофорез в денатурирующих условиях.
В отличие от нативного электрофореза, электрофорез в денатурирующих условиях предполагает применение химических реагентов, разрушающих пространственную структуру разделяемых белков и экранирующих собственный заряд молекулы.
По направлению фракционирования различают:
- одномерный (1D) электрофорез, при котором белки движутся в одном направлении (горизонтальный или вертикальный электрофорез);
- двумерный (2D) электрофорез, при котором сначала проводят разделение в одном направлении, а затем – в направлении, перпендикулярном первому. Двумерный электрофорез позволяет резко увеличить разрешающую способность при разделении смесей, состоящих из большого количества разных белков. В зависимости от ориентации носителя (геля, бумаги, др.) электрофорез также может быть вертикальным или горизонтальным;
- электрофорез в объеме (3D). Один из наиболее точных аналитических методов, применяемых для анализа белков и нуклеиновых кислот. Носитель находится внутри стеклянного сосуда (колонки). Примером такого способа служит капиллярный зональный электрофорез – метод разделения молекул по заряду и размеру в тонком капилляре, заполненном электролитом. Для проведения капиллярного электрофореза требуется относительно простое оборудование. Основные компоненты системы: флакон для нанесения образца, стартовый флакон, конечный флакон, капилляр, электроды, мощный источник питания, детектор и устройство обработки данных. Флакон для нанесения образца, стартовый и конечный флаконы заполнены электролитом, например, водным буферным раствором. Для нанесения образца конец капилляра опускают во флакон с образцом и затем перемещают в стартовый флакон. Миграция молекул анализируемых веществ осуществляется под действием электрического поля, которое прилагается между стартовым и конечным флаконами. Ионы передвигаются по капилляру в одном направлении под действием электроосмотического тока. Анализируемые вещества разделяются по электрофоретической мобильности и детектируются около конца капилляра. Эффективность разделения путем капиллярного электрофореза значительно выше, чем эффективность других методов разделения, например, высокоэффективной жидкостной хроматографии (ВЭЖХ). В отличие от ВЭЖХ, в случае капиллярного электрофореза не происходит массообмена между фазами. Профиль потока для систем электроосмотического потока является плоским, в противовес ламинарному профилю хроматографических колонок, в которых разделение происходит под давлением. В результате этого при электроосмотическом разделении не происходит расширения полос, как при хроматографии. Разделение капиллярным электрофорезом может иметь несколько сотен тысяч теоретических тарелок. Еще сильнее повысить разрешающую способность электрофореза помогает комбинирование различных типов, например, иммуноэлектрофорез в вариации капиллярного зонального электрофореза.
На сегодняшний день, в целях обеспечения высокого качества фармацевтических и биофармацевтических субстанций, принято использовать так называемые «системы для электрофореза». Это оборудование, позволяющее производить быстрый, точный и качественный анализ препаратов различными методами электрофоретического разделения. Программное обеспечение данных систем позволяет подобрать оптимальный метод и грамотно проанализировать полученные результаты.
Рисунок 2 — Система фармацевтического анализа «PA 800 plus» от «Beckman Coulter» позволяет проводить высокоточные качественные и количественные исследования биофармацевтических субстанций с высокой производительностью. Предел детекции: 10 ‑18 – 10 ‑21 моль. Обеспечивает лабораторию следующими методами контроля: электрофорез белков в денатурирующих условиях с додецилсульфатом натрия (SDS) высокого разрешения для разделения белковых примесей и определения чистоты лекарственной субстанции; автоматический анализ чистоты препаратов рекомбинантных моноклональных антител IgG (иммуноэлектрофорез высокого разрешения), капиллярное электрофоретическое изофокусирование для анализа гетерогенности белковой лекарственной субстанции; изучение профиля гликозилирования молекул для определения микрогетерогенности белковой лекарственной субстанции.
1.1.3. Носители, применяемые для проведения электрофореза
Рассматривая историю появления метода электрофореза, можно отметить, что впервые электрофорез был применен без какого-либо носителя: электрическая цепь между электродами замыкалась через буферный раствор, в котором и происходило разделение белков. Позднее при электрофорезе начали применять носители жидкой фазы – полимеры, служащие “каркасом” для буферного раствора. Применение носителей позволило заметно снизить конвекцию (перемешивание) и, следовательно, повысить качество разделения белков. Носитель может быть в форме порошка, пленки, геля и др. Последующие разработки были посвящены усовершенствованию свойств носителей.
Идеальный носитель должен:
- резко снижать конвекцию;
- быть простым в приготовлении;
- иметь высокую теплопроводность (при низкой теплопроводности трудно охлаждать систему);
- обладать низкой адсорбционной емкостью и химической инертностью в отношении веществ, подвергаемых электрофорезу;
- быть электронейтральным (не иметь заряда на поверхности), чтобы не вызывать эндоэлектроосмос. Если разделяемые белки заряжены отрицательно, то при электрофорезе они должны двигаться к аноду (+), однако, эндоэлектроосмос будет “тянуть” их в другую сторону, к катоду (‑), мешая электрофоретическому разделению.
Гели легко принимают разные геометрические формы, поэтому в названии электрофоретического метода с их использованием указывают, какова конфигурация рабочего пространства.
Гель для электрофореза можно заполимеризовать:
- в трубках,
- в капиллярах,
- в пластинах (“слэбах” – от англ. slab),
Основной недостаток электрофореза в трубках — это отсутствие теплооттока: температура в центре цилиндра геля оказывается выше, чем у его прилегающей к стеклу поверхности. Это приводит к изгибу белковых зон. На одну трубку наносится одна исследуемая проба. Повысить теплоотток можно, применяя очень тонкие трубки — капилляры. В тонких пластинах также достигается гораздо более эффективное отведение тепла, чем в трубках. Кроме того, конфигурация пластины позволяет в абсолютно идентичных условиях проводить разделение сразу нескольких проб. Пластины легко сканировать и удобно разрезать. По сравнению с цилиндрическими гелями, пластины позволяют значительно уменьшить концентрацию белка в наносимой пробе.
Таблица 1 — Преимущества и недостатки использования различных носителей при электрофорезе
Преимущества метода и/или носителя
Электрофорез с подвижной границей (в свободном растворе). Носителя нет.
Первый электрофоретический метод, позволивший разделять белки
Сложно избежать конвекции – перемешивания разделяемых зон; для исследования нужна проба в десятки мг белка; разрешающая способность мала (не более 8 компонентов в пробе).
На фильтровальной или хроматографической бумаге (50-е годы XX в.)
Сниженная конвекция, разделенные зоны можно зафиксировать и окрасить. Оборудование проще.
Непрозрачность. Загрязнения и неоднородность бумаги мешают разделению. “Хвосты” на электрофореграммах из-за высокой адсорбционной емкости. Фон окрашивается, что затрудняет распознавание белковых зон.
На пленках из ацетата целлюлозы (известен с 1957г.)
Быстрый, требует меньшего количества пробы для анализа. Низкая адсорбционная емкость помогает избежать появления “хвостов” на электрофореграмме. После окрашивания фон остается бесцветным. Пригодны для иммуноэлектрофореза.
Непрозрачность в водных растворах (можно добиться прозрачности, погрузив в минеральное масло). Дороже, чем при использовании бумаги. Мало пригоден для препаративного электрофореза.
В крахмальном геле (предложен О. Смитисом)
Первый носитель со свойствами молекулярного сита. Активно препятствует конвекции. Повышает разрешение.
Низкая прозрачность, хрупкость, размер пор можно менять лишь в небольших пределах. Приготовление качественного геля трудоемко.
В агаровых и агарозных гелях
Удовлетворительная прозрачность, высокая пластичность (проще резать, удобнее красить и определять ферментативную активность прямо в геле), простота изготовления.
Из-за отрицательного заряда на сульфатных и СООН-группах сетки агара возникает электроосмос, приводящий к неравномерному распределению электрического поля, а иногда – гидростатического давления. Возможно химическое взаимодействие веществ с агаром.
В полиакриламидном (ПААГ) геле (предложен Л. Орнстейном и Д. Дэвисом)
Химически инертен, можно кипятить. Можно задать необходимый размер пор и обеспечить свойства молекулярного сита. Высокая прозрачность. Легко готовить. Упругий, прочный.
На сегодняшний день — лучший носитель, но готовится из акриламида — ядовитого вещества.
1.1.4. Особенности электрофореза в полиакриламидном геле
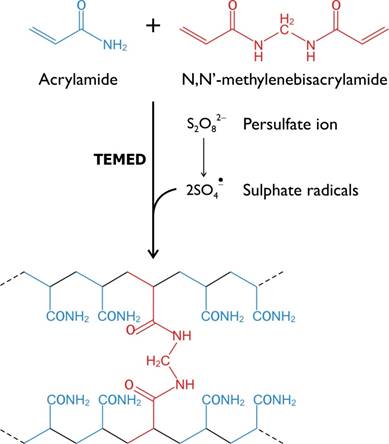
Полиакриламидный гель (ПААГ) обладает многими качествами идеального носителя. Имея свойства молекулярного сита, он обеспечивает электрофоретическое разделение белковых смесей не только по заряду, но и по размеру и форме частиц. При электрофорезе в ПААГ крупные молекулы, размеры которых соизмеримы с диаметром пор геля, движутся медленнее, а мелкие молекулы свободно и быстро проходят через поры геля. ПААГ формируют путем сополимеризации акриламида, создающего линейную основу, и N,N′-метиленбисакриламида (BIS), служащего для поперечных «сшивок» линейных цепей.
В результате сополимеризации образуется трехмерная сетка геля. Каждый второй углеродный атом линейной цепи содержит кислотную амидную группу (рис. 3), что обеспечивает гидрофильность полимера. В то же время ПААГ не содержит ионизируемых групп. Для сополимеризации нужны инициаторы и катализаторы (окислительно-восстановительные системы – источники свободных радикалов). Чаще всего используют систему из двух компонентов:
- персульфат аммония (ПСА, APS). Синоним — надсернокислый аммоний. Функция: инициатор полимеризации
- N,N,N’,N’-тетраметилэтилендиамин (ТЕМЕД, TEMED). Функция: катализатор образования ПААГ
Рисунок 3 — Реакция полимеризации полиакриламидного геля
Меняя концентрацию акриламида от 2 до 50% можно задать определенную пористость геля. Например, диаметр пор в геле, содержащем 7.5% акриламида, равен 5 нм, а 30% акриламида — 2 нм. При выборе концентрации геля учитывают среднюю молекулярную массу (Mr) разделяемых веществ и форму их молекул. Отнеситесь к этому факту внимательно! Если плотность геля не будет соответствовать молекулярной массе исследуемого белка, то он, либо не войдет в гель, либо будет мигрировать с очень высокой скоростью и, как следствие, выйдет из геля раньше времени. Также в качестве параметров, влияющих на эффективность разделения, в особенности белков с приблизительно равной молекулярной массой, можно отметить время проведения электрофореза, длину разгоночной дистанции (чем больше гель, тем выше разрешение), температура процесса (при пониженной температуре белковые зоны меньше размываются за счет диффузии).
Таблица 2 — Выбор концентрации акриламида для оптимального разрешения смеси белков
Линейный диапазон распределения, кДа
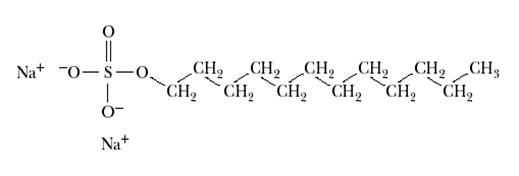
В случае, когда требуется фракционировать белки исключительно по молекулярной массе, применяют ПААГ-электрофорез в денатурирующих условиях. Такая система была разработана в 1970 году Лэммли ( англ. Laemmli) для изучения процесса сборки капсида четного бактериофага Т4. Для этого перед нанесением на гель образцы кипятили в присутствии додецилсульфата натрия (ДСН, SDS) и 2-меркаптоэтанола. Под воздействием 2-меркаптоэтанола происходило восстановление дисульфидных связей, что предотвращало выпетливание денатурированных полипептидов и повышение их подвижности. SDS является сильным детергентом, его молекула состоит из двенадцатичленной алифатической неразветвленной цепи и ковалентно связанного с ним сульфат-иона, имеющего в растворе отрицательный заряд.
При использовании данного метода исходят из следующих допущений:
- белки после обработки SDS находятся в полностью денатурированном состоянии;
- количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе;
- собственный заряд полипептида несущественен по сравнению с суммарным отрицательным зарядом связанных с ним молекул SDS;
- все полипептиды имеют одинаковый удельный заряд и разделяются обратно пропорционально логарифму их молекулярной массы.
При более реалистичном рассмотрении вопроса, эффективность разделения зависит не от молекулярной массы белка, а от его молекулярного радиуса, так называемого радиуса Стокса. Действительно, многие белки имеют аномальную подвижность при проведении электрофореза, что зависит от множества факторов, в результате которых меняется удельный заряд, размер и форма комплексов «белок- SDS ». Тем не менее, практика подтверждает верность данных допущений в подавляющем большинстве случаев.
Для проведения денатурирующего электрофореза в ПААГ используются различные буферные системы. Наиболее распространённая система, которая подразумевается по умолчанию — это буферная система Лэммли. Кроме того, в подавляющем числе работ используют, так называемый, disc-электрофорез (от англ. discontinous — разрывный) то есть используют гель, состоящий из двух частей:
- Формирующий (концентрирующий) гель имеет pH 6.8 и концентрацию полиакриламида от 2 до 8 %. Крупнопористый гель. Размер его пор ограничивает диффузию, но не обеспечивает гелю свойства молекулярного сита по отношению к большинству разделяемых белков. Этот гель нужен для электрохимического концентрирования белков пробы. Таким образом, концентрирующий гель собирает смесь белков перед переходом в разделяющий гель в одну узкую полосу.
- Разделяющий гель имеет рН 8.5 – 9 и концентрацию полиакриламида от 5 до 20 %. Это мелкопористый гель, в котором, собственно, и происходит электрофоретическое и молекулярно-ситовое разделение компонентов пробы.
Выбор плотности геля зависит от молекулярных масс исследуемых белков. Все буферы не содержат неорганических солей, основным переносчиком тока в них является глицин . При рН 6.8 суммарный заряд молекулы глицина близок к нулю. Вследствие этого для переноса определенного заряда (который определяется силой тока в электрофоретической ячейке), отрицательно заряженные комплексы полипептидов с SDS должны двигаться с большой скоростью. При рН 8.8 глицин приобретает отрицательный заряд, вследствие чего на границе концентрирующего и разделяющего гелей белки резко тормозятся. В переносе одинакового заряда через единицу площади теперь участвует гораздо больше заряженных молекул, следовательно, они двигаются с меньшей скоростью. Результатом этого является концентрирование белков на границе гелей, что очень сильно повышает разрешающую способность метода. В разделяющем геле белки мигрируют в зависимости от длины полипептидной цепи, то есть обратно пропорционально молекулярной массе.
1.1.5. Способы визуализации результатов (электрофореграмм)
Зоны разделившихся белков удобно анализировать, если их проявить, то естьсделать видимыми невооруженным глазом. Проявление осуществляют либо с целью обнаружения всех белков, либо только белков с определенной ферментативной активностью. В последнем случае получают зимограммы (энзимограммы). Иногда делят белки, заранее меченые хромофором (например, флуорескамином), и обнаруживают их по флуоресценции в УФ-области спектра с помощью специального оборудования. Используют также и радиоактивную метку (радиоактивным углеродом или йодом). Регистрацию полос в этом случае проводят методом авторадиографии с помощью рентгеновской пленки.
Для окрашивания белковых зон на ПААГ-электрофореграмме используют несколько универсальных методов. Для этого разделившиеся зоны белков фиксируют раствором уксусной кислоты (1 – 10%), смесью уксусной кислоты и этанола (реже – метанола), раствором ТХУ, насыщенным раствором сульфата аммония и окрашивают, используя раствор красителя. Фиксация предотвращает размывание зон из-за диффузии белковых молекул в геле. Используют такие красители, как амидочерный (амидошварц), кумасси ярко-синий (марок G250, R250), Zn/имидазол, нитрат серебра. Окраска полос происходит пропорционально количеству белка в зоне. Окраска и количество полос, соответствующих белкам, также зависят от чувствительности того или иного красителя. Так, нитрат серебра выявляет зоны с меньшим содержанием белка, чем кумасси.
Чрезвычайно высокой чувствительностью отличаются методы окраски белковых полос при помощи Zn/имидазола и солей серебра. Проявление с помощью Zn/имидазола состоит в последовательной обработке геля растворами 0.2 М имидазола и 0.3 М ZnCl2 в очень чистой дистиллированной воде, полученной с применением ионообменной хроматографии и очистки на мембранных фильтрах (дистиллят milliQ). Сочетание этих реактивов позволяет выявить 30 – 100 нг белка на полосу. Окрашивание с использованием нитрата серебра приближается по чувствительности к авторадиографии.
В настоящее время самым удобным и широко используемым является краситель кумасси ярко-синий, или бриллиантовый синий («Coomassie brilliant blue», он же ксилоловый яркий цианин), выпускаемый в двух модификациях: R-250 и G-250. Обе модификации кумасси плохо растворимы в воде и разбавленных кислотах, причем G-250 растворяется хуже, чем R-250. Повышению растворимости способствует добавление в раствор кумасси метанола, изопропанола или других спиртов. Не растворившиеся примеси следует отфильтровать. По сравнению с другими красителями кумасси ярко-синий имеет следующие преимущества:
- его чувствительность выше, чем у амидочерного, и в большинстве случаев вполне подходит исследователям, — зависимость интенсивности окраски от концентрации белка остается линейной в более широком диапазоне концентраций,
- кумасси значительно дешевле и проще в использовании, чем нитрат серебра и не требует особо чистой дистиллированной воды, как Zn/имидазол
- в отличие от гелей, окрашенных Zn/имидазолом, гели при использовании кумасси можно хранить (либо высушить, либо поместить в 5%-ную уксусную кислоту, где существенного снижения интенсивности окраски полос не произойдет в течение 8-11 недель).
К недостаткам метода относится более низкая чувствительность, а также длительность процедуры отмывки геля от избытка связавшегося красителя. Для этих целей существуют модифицированные протоколы, например, окрашивание полиакриламидных гелей «коллоидным раствором кумасси». Также кумасси G250 используется для спектрофотометрического определения концентрации белков по методу Бредфорд.
Таким образом, целью лабораторного занятия является знакомство с методикой анализа белков при помощи электрофореза в полиакриламидном геле в денатурирующих условиях (возможные варианты сокращений, наиболее часто встречающихся в литературе: ДСН‑ПААГ, SDS‑ПААГ, SDS‑PAGE).
Для реализации поставленной цели необходимо:
- приготовить полиакриламидный гель, применимый для разделения белков с соответствующей молекулярной массой;
- приготовить образцы для электрофореза;
- приготовить электродный буферный раствор;
- провести электрофоретическое разделение исследуемых образцов;
- окрасить гель при помощи раствора кумасси ярко-синего;
- получить электрофореграмму и проанализировать полученные результаты.
Лабораторное занятие проводится при строгом соблюдении правил безопасности при работе в химической лаборатории и эксплуатации электроприборов.
1.2.1. Расходные материалы и оборудование:
- Камера для вертикального электрофореза белков «MiniProtean Tetra» (Bio-Rad, США или аналог);
- Источник тока «Эльф-8» (ДНК-технология, Россия или аналог);
- Система гель-документирования с функцией детекции в видимой области светового излучения (UVP, США или аналог);
- Электронные аналитические весы (Shimadzu, Япония или аналог) и набор шпателей для взвешивания;
- Система для получения деионизированной воды milliQ (Millipore, США или аналог);
- Термостат «Гном» (ДНК-технология, Россия или аналог);
- Комплект оборудования для формирования геля (Bio-Rad, США или аналог);
- Настольная центрифуга (Eppendorf, Германия или аналог);
- рН-метр (Аквилон, Россия или аналог);
- Холодильник (Стинол, Россия или аналог);
- Шейкер (ELMI, Латвия или аналог);
- Набор автоматических пипеток (Sartorius, Швейцария или аналог);
- Магнитная мешалка с нагревом (He >;
- Набором магнитов для мешалки (Heidolph Instruments, Германия или аналог);
- Химические стаканы (Simax, Чехия или аналог);
- Пластиковые пробирки на 1.5, 5 и 50 мл (Corning или аналог);
- Мерные колбы на 50, 100 и 1000мл (Simax, Чехия или аналог);
- Мерные цилиндры (50 и 100мл) и мерные стеклянные стаканы (Simax, Чехия или аналог);
- Стеклянные бутыли для хранения растворов (Simax, Чехия или аналог);
- Фильтровальная бумага, парафильм;
- Носики для автоматических пипеток (Corning или аналог);
- Носики для автоматической пипетки для нанесения образцов в гель (Corning или аналог), либо шприц многоразовый на 25 мкл (Hamilton, Швейцария или аналог)
акриламид, N,N’ –метиленбисакриламид, Трис, додецилсульфат натрия (SDS), персульфат аммония, N,N,N’,N’ – тетраметилэтилендиамин (ТЕМЕД), глицин, глицерин, β-меркаптоэтанол, ЭДТА, бромфеноловый синий, кумасси R250 (Bio-Rad, США или аналог), набор маркеров молекулярных масс белков (15-150 кДа) (Thermo Scientific или аналог), уксусная кислота, соляная кислота (х.ч), этанол.
1.2.3. Прописи для приготовления требуемых растворов:
1% раствор бромфенолового синего
Способ приготовления: Навеску бромфенолового синего растворить в воде MilliQ, довести объем раствора до метки. Хранить при комнатной температуре.
Лабораторная пропись для получения 10 мл раствора: 0.1г бромфенолового синего, деионизированная вода .
30%-ный раствор бис-акриламида
Состав:1% BIS, 29% акриламид, деионизированная вода .
Способ приготовления: Соответствующие навески веществ растворить в воде MilliQ, довести объем раствора до метки. Добавить активированный уголь и оставить для перемешивания на ночь на магнитной мешалке. Профильтровать и хранить при 4 0 С.
Лабораторная пропись для получения 100 мл раствора: 1г BIS, 29г акриламида, деионизированная вода .
10%-ный раствор персульфата аммония
Состав: персульфат аммония, деионизированная вода .
Способ приготовления: Навеску персульфата аммония растворить в деионизированной воде MilliQ, довести объем раствора до метки. Хранить при ‑20 0 С.
Лабораторная пропись для получения 5 мл раствора:0.5г персульфата аммония, деионизированная вода .
Состав: «ледяная» уксусная кислота, деионизированная вода .
Способ приготовления: Разбавить «ледяную» уксусную кислоту водой MilliQ в соотношении 1:9. Хранить при комнатной температуре.
Лабораторная пропись для получения 100мл раствора: 10мл «ледяной» уксусной кислоты, 90 мл деионизированной воды .
Буферный раствор TES для приготовления образцов
Состав: 2% SDS, 100 мМ трис-HCl, pH 8.0, 10 мМ ЭДТА, деионизированная вода .
Способ приготовления: Смешать компоненты раствора и довести объем раствора до метки водой MilliQ. Довести рН до 8.0 при помощи соляной кислоты. Отфильтровать и хранить при комнатной температуре.
Лабораторная пропись для получения 50 мл раствора: 10 мл 10%-ного раствора SDS, 5 мл 1М раствора трис, 1 мл 0.5 М раствора ЭДТА, соляная кислота, деионизированная вода.
Буферный раствор 1 М трис-HCl, рН 6.8
Состав: 1М Tрис, соляная кислота, деионизированная вода .
Способ приготовления: Растворить навеску трис в деионизированной воде MilliQ. Довести рН до значения 6.8 при помощи соляной кислоты. Довести объем раствора до метки, отфильтровать и хранить при температуре +4 0 С.
Лабораторная пропись для получения 100 мл раствора: 12.13 г трис, соляная кислота, деионизированная вода.
Буферный раствор 1 М трис-HCl, рН 8.8
Состав: 1М Tрис, соляная кислота, деионизированная вода .
Способ приготовления: Растворить навеску трис в деионизированной воде MilliQ. Довести рН до значения 8.8 при помощи соляной кислоты. Довести объем раствора до метки, отфильтровать и хранить при температуре +4 0 С.
Лабораторная пропись для получения 100 мл раствора: 12.13 г трис, соляная кислота, деионизированная вода.
Окрашивающий раствор для геля:
Состав: 5% CH3COOH, 45% C2H5OH, 0.25% Coomassie R-250, деионизированная вода .
Способ приготовления: Смешать соответствующее количество уксусной кислоты и этилового спирта, довести объем раствора до метки водой MilliQ, добавить сухой краситель сoomassie R-250. Хранить при комнатной температуре. Окрашивающая способность сохраняется на 15 – 20 использований.
Лабораторная пропись для получения 100 мл раствора: 50мл 10%-ной CH3COOH, 45мл 96%-ного C2H5OH, 0.25 г сoomassie R250.
Окрашивающий раствор для образцов (Лэммли буфер)
Состав: 62.5 мМ трис- HCl , pH 6.8, 5% β -меркаптоэтанол, 10% глицерин, 2% SDS (10%), до 0.2% бромфенолового синего, деионизированная вода.
Способ приготовления: Смешать все компоненты раствора в указанном количестве.
Лабораторная пропись для получения 8.5 мл раствора: 0.5 мл 1М трис– HCl , pH 6.8, 0.4 мл β -меркаптоэтанола, 0.8 мл (1 г) глицерина, 1.6 мл 10%-ного раствора SDS , 0.2 мл 1%-ного раствора бромфенолового синего, 4.8 мл деионизированной воды .
Tрис-глициновый стоковый раствор 10Х:
Состав: 250 мМ трис, 1.92 М глицин, деионизированная вода .
Способ приготовления: Растворить навески трис и глицина в деионизированной воде MilliQ , довести объем до 1 л водой. Значение рН результирующего раствора должен быть в районе 8.3. Ни в коем случае нельзя подводить рН буфера до требуемого значения! Следует переделать его! Профильтровать через фильтр с диаметром пор 0.65 мкм.
Лабораторная пропись для получения 1л раствора: 30.25г трис, 144г глицина, деионизированная вода.
Tрис-глициновый электродный буферный раствор 1Х
Состав: 25 мМ трис, 192 мМ глицин, 0.1% SDS, деионизированная вода .
Для приготовления электрофорезного буфера развести в десять раз трис-глициновый стоковый раствор в мерной колбе и добавить SDS до конечной концентрации 0.1%. Довести деионизированной водой до требуемого объема.
Лабораторная пропись для получения 1л раствора: 100 мл трис-глицинового стокового раствора 10Х, 10 мл 10%-ного SDS , деионизированная вода .
Состав: 62.5 мМ трис-НС l , рН 8.8, 46.5% бис-акриламид (30%, 29:1), 0.1% SDS , 0.5% персульфата аммония, 0.09% TEMED , деионизированная вода .
Способ приготовления: Смешать все компоненты геля в указанном количестве
Лабораторная пропись для получения 1 геля: 0.74 мл деионизированной воды, 1.50 мл 1М трис-НС l , рН 8.8, 2.00 мл раствора бис-акриламида (30%, 29:1), 40 мкл 10%-ного раствора SDS , 20 мкл 10%-ного раствора персульфата аммония, 4 мкл TEMED .
Формирующий (концентрирующий) гель:
Состав: 62.5 мМ трис-НС l , рН 6.8, 26.85% бис-акриламид (30%), 0.1 % SDS , 0.94% персульфата аммония, 0.2% TEMED , деионизированная вода .
Способ приготовления: Смешать все компоненты геля в указанном количестве
Лабораторная пропись для получения 1 геля: 0.8 мл деионизированной воды, 0.25 мл 1М Трис-НС l , рН 6.8, 0.4 мл раствора бис-акриламида (30%, 29:1), 20 мкл 10%-ного раствора SDS , 14 мкл 10%-ного раствора APS , 3 мкл TEMED
Для выполнения данной лабораторной работы рекомендуется использовать гребенки с 10 ячейками и спейсеры толщиной 0.75 мм. Ширина каждой ячейки – 6.5 мм. Максимальный объем образца – 30 мкл.
- В качестве подготовки к лабораторной работе стеклянные пластины промывают мягким детергентом, ополаскивают достаточным объемом деионизированной воды и спирта, затем высушивают в вертикальном положении.
- Рамку для заливки геля ставят в вертикальное положение зажимами вперед в открытом положении, затем собирают форму для геля – одно стекло – с приклеенным спейсером, второе – укороченное.
- Форму берут таким образом, чтобы метки («up») на стекле со спейсером находились вверху и укороченное стекло ‑ спереди, и устанавливают в рамку для заливки геля. Следует убедиться, что нижние края обоих стекол находятся на одном уровне, после чего необходимо зафиксировать форму зажимами.
- Собранную рамку устанавливают в стенд для заливки геля стеклянной формой вперед: упираясь нижним краем стекол в резиновую прокладку, подводят верхний край стекол под выступ на клипсе.
- Затем вставляют гребенки между стекол: надписями вперед, пока выступ на гребенке не упрется в укороченное стекло. От дна ячеек отмеряют 1 см и отмечают это положение фломастером. Удаляют гребенку.
- До этого уровня будет заливать разделяющий гель. После заливки разделяющего геля поверх него наслаивают 96% этиловый спирт. Как только разделяющий гель заполимеризовался (это занимает примерно полчаса), спирт тщательно удаляют при помощи фильтровальной бумаги.
- Заливают формирующий гель и устанавливают гребенку. Дают гелю полимеризоваться (это занимает примерно полчаса), и достают рамку из стенда для заливки геля.
- Повернув защелки вперед, извлекают кассету с гелем, вставляют в щели на дне электродной ячейки (укороченное стекло смотрит внутрь) и прижимают к зеленой прокладке. Следует убедиться, что укороченное стекло попадает в углубления на зеленой прокладке.
- Вставляют кассеты с гелем и электродную ячейку в фиксирующую рамку. Надавливая сверху на электродную ячейку, защелкивают оба зажима на фиксирующей рамке, и опускают фиксирующую рамку в мини-резервуар.
- Внутреннюю камеру заполняют трис-глициновым электродным буферным раствором так, чтобы его уровень располагался между верхними краями укороченного стекла и стекла со спейсером (для этого необходимо примерно 125 мл буфера) и добавляют примерно 200 мл трис-глицинового буфера в мини-резервуар.
- Готовят образцы для электрофореза.
Приготовление образцов из телец включения, клеточной биомассы, нерастворимой фракции:
Центрифугируют 100 мкл образца при 7000 g в течении 10 минут, тщательно удаляют полностью супернатант, затем добавляют к пробе 100 мкл горячего буфера TES и прогревают образец в течение 5 минут при 99 0 С. После чего добавляют к пробе 100 мкл буфера Лэммли и снова прогревают образцы 5 минут при 99 0 С.Приготовление растворимых белковых образцов:
Отбирают 100 мкл образца и добавляют к нему 100 мкл буфера Лэммли. Прогревают образцы в течение 5 минут при 99 0 С.
Маркер молекулярных весов поставляется уже в готовом состоянии. Его необходимо только прогреть в течение 5 минут при 99 0 С. - Наносят образцы в ячейки геля при помощи мини-шприца Гамильтона или дозатора с тонким носиком.
- Электрофорез проводят при постоянном напряжении 200 В. Время электрофореза — примерно один час.
- По окончании электрофореза отсоединяют ячейку Mini-Protean III от источника напряжения. Снимают крышку и осторожно достают фиксирующую рамку с электродной ячейкой и кассетами для геля, после чего сливают электрофорезный буферный раствор, открывают защелки фиксирующей рамки и достают электродную ячейку с кассетами для гелей.
- Специальным шпателем разъединяют стеклянную форму для геля. Гель погружают в фиксирующий раствор (10%-ная уксусная кислота) и, осторожно покачивая, отсоединяют его от стекла.
- Фиксируют гель в течение 30 мин при постоянном покачивании, после чего заливают его окрашивающим раствором. Для ускорения процесса окрашивания можно подогреть окрашивающий раствор вместе с гелем в микроволновой печи.
- Когда интенсивность полос на геле перестает меняться, окрашивающий раствор необходимо слить, а гель промыть раствором 10%-ой уксусной кислоты. Раствор для отмывки также можно подогреть вместе с гелем в микроволновой печи. Это существенно ускоряет процесс отмывки.
- Результаты электрофореза визуально анализируют по электрофореграмме, путем сравнения со стандартными образцами и маркером молекулярных весов.
1.3. Вопросы для подготовки к вебинару
- Какое свойство белковых молекул позволяет им образовывать отдельные зоны на электрофореграмме? От каких условий это свойство зависит и может изменяться?
- Что такое суммарный заряд белковой молекулы? Почему он изменяется при изменении рН окружающей среды? Что такое pI?
- Как будет изменяться суммарный заряд белковых молекул при проведении электрофореза в нативных и денатурирующих ( SDS ) условиях?
- Почему не следует выбирать электродные буферные растворы со значением рН, значительно (более чем на 4 ед.) отличающимся от рI разделяемых белков?
- Напишите структурную формулу полиакриламидного геля. Почему ПААГ считается лучшим носителем жидкой фазы?
- Объясните использование следующих компонентов для приготовления геля: персульфат аммония, акриламид, N,N′-метиленбисакриламид , додецилсульфат натрия, трис?
- Объясните использование следующих компонентов для приготовления буфера Лэммли: трис, β-меркаптоэтанол, додецилсульфат натрия, глицерин, метиленовый синий?
- Как можно повысить разрешающую способность электрофореза для более эффективного разделения препарата, состоящего из белков со следующими значениями молекулярной массы: 10 кДа, 18 кДа, 30 кДа, 32 кДа, 36 кДа, 48 кДа, 79 кДа, 112 кДа, 220 кДа?
источник