Все электрокинетические явления связаны с относительным перемещением дисперсной фазы и дисперсионной среды, осуществляемой по границе скольжения. Их интенсивность определяется значением ζ-потенциала. Поэтому данную величину используют для оценки электрокинетических явлений.
Двойной электрический слой можно рассматривать в качестве своеобразного конденсатора (рис. 7.9). Относительность движения дисперсной фазы и дисперсионной среды определяется силами f1и f2. Сила f1возникает в результате взаимодействия избытка зарядов потенциалобразующего слоя по отношению к адсорбционному слою; она характеризует заряд диффузного слоя и направлена параллельно границе скольжения (линия АА), противодействуя силе трения. Сила f1определяется по формуле
где Е — напряженность или градиент внешнего поля; qB— плотность заряда поверхности.
Сила f2определяет трение жидкости при ее перемещении:
где h — коэффициент трения; ω — скорость движения жидкости; h — расстояние между поверхностями (см. рис. 7.9).
При установившемся движении эти силы равны, т.е.
Формула (7.11) определяет скорость взаимного перемещения дисперсной фазы и дисперсионной среды. Удельный заряд qВможно связать с φ-потенциалом:
где εа— абсолютная диэлектрическая проницаемость.
Подставляя равенство (7.12) в формулу (7.11), получим
Скорость движения в расчете на единицу напряженности электрического поля называют электрофоретической подвижностью, которая определяется по формуле
С учетом формы частиц дисперсной фазы уравнения (7.13) и 7.14) принимают следующий вид:
(7.15) (7.16)
где v — скорость, м/с; vE— электрофоретическая подвижность, м 2 /с ∙ В, Ψ — коэффициент, зависящий от формы частиц; ζ — дзета-потенциал, В; Е — напряженность или градиент внешнего электрического поля, В/м.
Коэффициент Ψ учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент Ψ равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля — 1.
Абсолютная диэлектрическая проницаемость среды εа= ε ∙ ε, где ε — относительная диэлектрическая проницаемость; ε— абсолютная диэлектрическая проницаемость вакуума, или электрическая постоянная, равная 8,85∙10 —12 K 2 /H∙м 2 (8,85∙10 —12 Ф/м).
С учетом значения абсолютной диэлектрической проницаемости формулу (7.15) можно представить в виде
или (7.17)
Согласно формуле (7.17) величины, которые определяют интенсивность электрофореза и электроосмоса, зависят от свойств среды (η, ε), формы частиц (Ψ), напряженности внешнего электрического поля (Е) и электрокинетического потенциала (ζ), определяемого структурой ДЭС.
Электрофоретическую подвижность и электрокинетический потенциал довольно просто определить экспериментально по скорости перемещения дисперсной фазы; электрофоретическая подвижность обычно не превышает 5,0∙10 —8 м 2 /с∙В, а электрокинетический потенциал — 100 мВ.
В формулах (7.15) и (7.17) не учитывается ряд особенностей дисперсных систем, например электропроводность частиц дисперсной фазы, специфические свойства дисперсной системы в случае ее нахождения в щелях, каналах и капиллярах. Тем не менее, эти формулы являются основными для количественной характеристики электрокинетических явлений.
Для расчета потенциала течения Еткоторый осуществляется под внешним воздействием Р1(см. рис. 7.8), можно воспользоваться следующей формулой:
(7.18)
где ΔР = Р1— Р2— перепад давления при течении дисперсионной среды; χ — удельная электропроводность дисперсионной среды.
Заметим, что потенциал течения возникает на любой границе раздела фаз при перемещении дисперсной фазы или дисперсионной среды. Так, например, кровь организма человека является дисперсной системой. Сердце, как своеобразный насос, заставляет кровь двигаться по сосудам. Потенциал течения крови составляет примерно 1—2 мВ, т.е. незначителен. При движении нефти по трубопроводам потенциал течения намного выше и может привести к электрическому пробою, пожару или взрыву. По той же причине наливать бензин в полиэтиленовую емкость крайне опасно, так как при опорожнении канистры возникает потенциал течения, который может вызвать искру и воспламенить бензин.
Таким образом, электрокинетические явления и электрофоретическую подвижность можно рассматривать как следствие образования ДЭС на границе раздела фаз. Возможность и интенсивность относительного перемещения фаз определяется величиной z-потенциала, которая обусловлена структурой ДЭС.
1. Электрокинетический потенциал высокодисперсных частиц золя апельсинового сока равен 50 мВ. Определите скорость электрофореза и электрофоретическую подвижность частиц золя сферической формы, если относительная диэлектрическая проницаемость среды e равна 54,8, внешняя ЭДС — 120 В, расстояние между электродами h = 40 см, вязкость среды η= 4,5∙10—3Па ∙ с.
В соответствии с формулой (7.17) при Е = E1/h
2. Определите электрокинетический потенциал коллоидов 20%-го раствора сахарозы при градиенте внешнего электрического поля 400 В/м, относительной диэлектрической проницаемости ε = 69,1, вязкости η = 2,5∙10—3Па ∙ с и скорости электрофореза v = 13.5 мкм/с.
3. Найдите значения потенциала течения, если через мембрану продавливается 42,4%-й раствор спирта при следующих условиях: ΔР = 20∙10 —3 Па, удельная электропроводность χ = 1,3∙ 10—3См ∙ м —1 , относительная диэлектрическая проницаемость ε = 41,3, вязкость η = 0,9∙10 —3 Па∙с, электрокинетический потенциал ζ = 6∙10 —3 В.
4. Чему равен электрокинетический потенциал при протекании 0,01 М раствора КСl через керамический фильтр под избыточным давлением (ΔР) 3,1∙10 4 Па и потенциале течения Ет = 1,2∙10 —2 В. При 298 К вязкость раствора η = 8,94∙10 —4 Па∙с, удельная электропроводность χ = 0.141 См∙м —1 , относительная диэлектрическая проницаемость ε = 78,5.
Дата добавления: 2014-10-15 ; Просмотров: 4498 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Электрокинетические явления
Влияние природы дисперсионной среды
Влияние рН среды
Введение в золь ионов Н + и ОН — может сильно сказываться на величине z-потенциала, так как эти ионы обладают высокой сорбционной способностью: первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы, вторые – из-за большого дипольного момента (большой поляризуемости).
Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью e и вязкостью m.
z-потенциал частиц золя тем больше, чем больше e (полярность растворителя).
Чем больше вязкость, тем толще слой дисперсионной среды, который прилипает к частице при разрыве мицеллы и, следовательно, тем меньше численное значение z-потенциала.
Электрокинетические явления – это явления, которые возникают при воздействии электрического поля на дисперсную систему (электрофорез, электроосмос), а также в результате перемещения частиц дисперсной фазы или дисперсионной среды (потенциал протекания, потенциал оседания).
Несмотря на различие электрокинетических явлений, все они связаны с наличием ДЭС на частицах дисперсной фазы. Интенсивность всех электрокинетических явлений определяется значением z-потенциала.
Электрофорез – направленное движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля.
При наложении внешнего электрического поля происходит разрыв мицеллы: частицы дисперсной фазы вместе с адсорбированными на них потенциалопределяющими ионами и противоионами адсорбционного слоя перемещаются к электроду, знак которого противоположен знаку заряда коллоидной частицы (z-потенциалу), а противоионы диффузионного слоя – к другому электроду. Например, если дисперсная фаза заряжена отрицательно, коллоидные частицы движутся к аноду (положительному электроду), а положительно заряженные противоионы диффузного слоя – к катоду (рис. 32).
Если дисперсная фаза заряжена положительно, направление движения частиц меняется на противоположное.
|
Скорость движения, или электрофоретическая скорость, зависит от величины электрокинетического потенциала z, напряженности электрического поля E/L и свойств сплошной среды – динамической вязкости μ и диэлектрической проницаемости e:
,
где u – электрофоретическая скорость; z – электрокинетический потенциал; e – диэлектрическая проницаемость среды; e – электрическая постоянная, e = 8,85×10 -12 Кл/(В×м); Е – разность потенциалов внешнего электрического поля; L – расстояние между электродами; E/L=H –напряженность, или градиент, внешнего электрического поля; m – динамическая вязкость сплошной среды; y – фактор формы.
Коэффициент y учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент y равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля – 1.
Скорость движения в расчете на единицу напряженности электрического поля Н называется электрофоретической подвижностью
.
Электрофоретическая подвижность зависит только от свойств дисперсной фазы и дисперсионной среды.
На подвижность коллоидной частицы оказывают влияние электрофоретический и релаксационный эффекты.
Электрофоретический эффект (эффект торможения): под действием внешнего электрического поля противоионы передвигаются в направлении, противоположном движению частицы. За счет гидратации противоионы увлекают за собой и окружающую их жидкость (дисперсионную среду). Это приводит к тому, что частица перемещаются в направлении, противоположном движению жидкости, скорость ее уменьшается.
Релаксационный эффект вызывается нарушением симметрии ДЭС вокруг частицы при ее движении. ДЭС деформируется и отстает от частицы. В результате возникает добавочное электрическое поле, которое действует на частицу, стремясь двигать ее в обратном направлении, и тем самым влияет на скорость электрофореза.
Для учета влияния этих факторов в уравнение для расчета электрофоретической скорости и вводится коэффициент y.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8427 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Электрофорез — направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов. Это явление наблюдается в седиментационно устойчивых дисперсных системах. При наложении на такую систему внешней разности потенциалов происходит разрыв ДЭС по плоскости скольжения, в результате чего частица получает заряд и перемещается к соответствующему электроду.
Приведенные выше уравнения Гельмгольца — Смолуховского справедливы для электрофореза, в частности для электрокинетического потенциала используется уравнение (4.9). Отличие состоит только в системе координат: в одном случае рассматривается скорость жидкости, в другом — скорость движения частиц, которую обычно определяют по смещению цветной границы.
Электрофорез наблюдают в U-образном сосуде (см. лабораторный практикум). В нижнюю часть сосуда наливают золь, сверху — контактную (боковую) жидкость, имеющую одинаковую (или немного большую) с золем электрическую проводимость. Наблюдают за изменением уровня золя в обоих коленах трубки и по скорости перемещения частиц дисперсной фазы определяют линейную скорость электрофореза Wq :
где S — путь, пройденный золем за время г (время электрофореза).
При электрофорезе отношение линейной скорости к напряженности
электрического поля 
Напряженность электрического поля Е зависит от приложенной разности потенциалов на электродах U и расстояния между ними L:
Рассмотренные уравнения справедливы при допущениях: 1) частицы движутся в однородном электрическом поле; 2) частицы могут иметь любую форму и не проводят электрический ток; 3) толщина ДЭС много меньше размеров частиц золя.
Для расчета ^-потенциала частиц, находящихся в разбавленных водных растворах при 293 К, можно использовать простое соотношение:
в котором электрофоретическая подвижность и, выражена в(тогда
^-потенциал будет иметь размерность В).
Несовпадение экспериментальных и теоретических значений объясняется релаксационным эффектом и электрофоретическим торможением.
Релаксационный эффект проявляется в нарушении симметрии диффузионного слоя вокруг частицы при относительном перемещении фаз в противоположные стороны.
Электрофоретическое торможение обусловлено сопротивлением движению частицы обратным потоком противоионов, которые увлекают за собой жидкость. В некоторых случаях несовпадение можно учесть введением поправок, иногда этим несовпадением можно пренебречь.
Скорость электрофореза зависит нс только от приложенного напряжения, но и от радиуса частиц и других факторов. Это можно учесть введением в уравнение (4.8) поправочного коэффициента к:
Поправочный коэффициент определяется экспериментально в каждом отдельном случае электрофореза.
Для примера рассмотрим данные по электрофорезу в суспензиях глин Трошковского, Никольского и Слюдянского месторождений, микрофотографии которых приведены на рис. 1.1.
Электрокинетический потенциал определяли методом подвижной границы при электрофорезе и рассчитывали по уравнению:
где S — путь;
L — расстояние между электродами;
U — разность потенциалов между электродами;
г — преимущественный радиус частицы, определяемый обычно по максимуму на кривой распределения частиц но размерам;
/(к г) — поправочная функция, учитывающая эффекты электрофоретического торможения и релаксации (табл. 4.1);
к — параметр Дебая, равный обратной величине плотной части двойного электрического слоя, то есть к = 1/6.
источник
Электрофорез — метод разделения веществ, основанный на явлении миграции заряженных микрочастиц в жидкой среде под действием внешнего электрического поля.
Существует три различных электрофоретических метода. Под собственно электрофорезом обычно понимают зональный электрофорез (ЗЭ), два других называют методами изоэлектрофокусирования (ИЭФ)и изотахофореза (ИТФ).Электрофорез применяют главным образом для разделения веществ, молекулы которых различаются по электрофоретической подвижности, т. е. отношению скорости электрофореза (скорости перемещения заряженных частиц вещества) к напряженности электрического поля, которое зависит от свойств заряженных частиц окружающей их среды. Путем изменения внешних условий (например, рН среды, температуры, силы тока, состава и концентрации буферного раствора или носителя) создают подходящие условия для разделения. Вследствие того что при разделении на молекулы действуют только электростатические силы, электрофорез считают «мягким» методом и поэтому часто применяют для работы с лабильными веществами.
Электрофорез можно проводить в растворе, но из-за неизбежного выделения теплоты и возникающей в связи с этим тепловой конвекции процесс, как правило, проводят на носителе. Вследствие некоторых сопутствующих явлений (адсорбция, несоизмеримость размеров высокомолекулярных соединений и пор носителя) введение носителя ограничивает область применения метода. Однако свойства носителя иногда используют для повышения эффективности разделения: например, при электрофорезе в градиенте полиакриламидного геля фракционирование осуществляется не столько за счет различной электрофоретической подвижности веществ, сколько за счет различия в их молекулярных массах.
Зональный электрофорез (ЗЭ) — это метод разделения заряженных частиц в электрическом поле, основанный на том, что частицы с разными соотношениями заряд/масса мигрируют с различными скоростями. В зависимости от знака заряда молекулы вещества мигрируют в электрическом поле по направлению к аноду или катоду.
Результаты этого процесса регистрируются на электрофореграфе (по аналогии с хроматографией).
Ранее использовали один и тот же буфер в слое носителя электродных камерах, т. е. разделение вели в непрерывной буферной системе. В настоящее время этот прием еще применяют при электрофорезе на бумаге и пластинках. Приэлектрофорезе в прерывистой буферной системе (различные буферы в слое носите электродных камерах) быстро мигрирующие вещества образую более узкие зоны. Электрофорез в прерывистой буферной системе используют главным образом в гель-электрофорезе. ЗЭ обычно проводят на бумаге, пластинках и в гелях в водных буферных растворах.
При электрофорезе в электродных камерах происходит электролиз раствора и вследствие этого изменяется состав буфера. Поэтому электроды располагают так, чтобы они не касались носителя, а контакт между ними осуществлялся при помощи полосок фильтровальной бумаги. Электродная камера разделена на два отсека, которые соединяются дополнительным мостиком из фильтровальной бумаги. Подбирая соответствующий объем электродных камер или перекачивая буфер насосом от анода к катоду, поддерживают постоянными концентрацию и значение рН буфера в двухкамерной системе. Рекомендуется также проводить деполяризации электродов после каждого электрофоретического разделения.
Материалы-носители подразделяются на две группы:
первая — бумага, целлюлоза, ацетилированная целлюлоза, агароза и материалы для ТСХ(например, силикагель);
вторая — крахмал и полиакриламид.
Эффективность разделения зависит не только от суммарного заряда молекул анализируемых веществ, но и от размеров молекул. Определяющим параметром является соотношение заряд — масса.
Носители первой группы относительно инертны и слабо влияют на эффективность разделения. Материалы второй группы обладают пористой структурой, что существенно влияет на качество разделения. Поскольку размеры пор соизмеримы с размером макромолекул, то можно разделять вещества с одинаковыми суммарными зарядами, но с разными молекулярными массами (например, при ионообменной хроматографии).
Электрофорез на бумаге позволяет экстрагировать вещества из соответствующих зон или пятен и использовать для дальнейшей работы; обнаруживать вещества, используемые в бумажной хроматографии; проводить фракционирование в двух направлениях.
Для электрофореза на бумаге используют специальные сорта бумаги, характеризующиеся следующими свойствами: достаточной механической прочностью; удовлетворительным для удерживания достаточного количества электролита и образца.
Наряду с камерами погружного типа применяют камеры для электрофореза в тонком слое с охлаждаемыми пластинами, в которых лист бумаги помещают между двумя изолирующими пленками.
Электрофорез в тонком слое проводят на стеклянных пластинках, покрытых слоем носителя. По сравнению с полосками бумаги пластины более удобны в обращении. Электрофорез на бумаге и в тонком слое применяют для исследования фракций, полученных при колоночной хроматографии, ферментативных гидролизатов белков, метаболитов, а также для разделения аминов, аминокислот, пептидов и белков, нуклеотидов, фенолов, нафтолов, фенолкарбоновых кислот, красителей, неорганических соединений.
Гель- электрофорез. Вместо целлюлозы и силикагеля можно использовать мягкие гели. Ниже приведены основные рабочие стадии проведения электрофореза в слое геля: приготовление гелей и подготовка образца ® электрофоретическое разделение ® детектирование ® анализ результатов и оформление их в рабочем журнале. Из множества гелей на практике применяют только два — гели агарозы и полиакриламида. В зависимости от способа приготовления геля и типа буферной системы различают несколько вариантов метода:
· электрофорез в геле полиакриламида (ПААГ);
· диск-электрофорез (диск-ПААГ) в прерывистой буферной системе;
· электрофорез в геле полиакриламида в присутствии додецилсульфата натрия (ДСН-ПААГ);
· электрофорез в градиенте пористого полиакриламидного геля.
Гель окрашивают красителем. Поскольку молекулы красителя заряжены, гель можно обесцвечивать электрофоретически при напряжении 50 В. В местах, не содержащих исследуемое вещество, гель обесцвечивается. Количественную оценку проводят спектрофотометрически при помощи сканирующего денситометра.
После усадки гелей в водном этаноле или ацетоне их высушивают между двумя листами целлофана в вакууме при слабом нагреве.
Гель-электрофорез применяют для разделения всех классов заряженных веществ, например белков, ферментных комплексов, вирусов, олигонуклеотидов и нуклеиновых кислот; определения молекулярных масс биополимеров; анализа белков на микроуровне (антигенов при количественном иммуноэлектрофорезе).
При электрофорезе в свободном потоке электролит (буфер) перемещается в вертикальном направлении (перпендикулярно направлению электрического поля). Заряженные частицы под действием электрического поля мигрируют в горизонтальном направлении и одновременно увлекаются потоком буфера. В итоге разделенные вещества распределяются в потоке в соответствии с их электрофоретической подвижностью и элюируются из прибора в различных фракциях. Электрофорез в свободном потоке применяют для препаративного разделения заряженных частиц, в том числе коллоидных, субклеточных частиц и клеток.
Изоэлектрическое фокусирование (ИЭФ). С помощью изоэлектрического фокусирования по изоэлектрическим точкам (ИЭТ) разделяют амфотерные вещества, в частности белки. Сущность метода заключается в том, что молекулы белков мигрируют под действием электрического поля в среде с линейным и стабильным градиентом рН до достижения области рН, соответствующей их ИЭТ.
Изоэлектрическое фокусирование отличается от зонального электрофореза тем, что разделение осуществляется не в буфере с постоянным значением рН, а в среде с линейным градиентом рН. Значение рН минимально вблизи анода, максимально — вблизи катода. Главное условие эффективного разделения белков — наличие стабильного градиента рН среды. В связи с тем что белки обладают амфотерными свойствами, необходимо, чтобы амфолиты – носители — вещества, с помощью которых формируется градиент рН, обладали высокой буферной емкостью. Амфолиты — носители представляют собой многокомпонентную смесь изомеров и гомологов алифатических полиаминополикарбоновых кислот, сульфокислот и фосфоновых кислот, изоэлектрические точки которых располагаются в широкой области значений рН.
ИЭФ применяют для аналитического разделения пептидов, белков, нуклеотидов, органических кислот, ионов металлов и препаративного разделения белков; накопления следовых количеств веществ из больших объемов пробы; определения электрофоретической подвижности.
Необходимым условием проведения ИЭФ является наличие высокого напряжения при низкой ионной силе раствора. Однако именно в этих условиях усиливается электроосмос. Отрицательное воздействие на эффективность разделения веществ оказывают так же примеси солей, занесенные вместе с реактивами (гели для ИЭФ следует готовить из особо чистых реактивов). Для проведения ИЭФ более всего подходит полиакриламидный гель с низкими электроосмотическими свойствами. Продолжительность эксперимента зависит от напряженность поля и характера изменения рН- градиента.
Препаративное изоэлектрическое фокусирование проводят в вертикальных колонках (в градиенте плотности сахарозы, глицерина, этиленгликоля) или в слое инертного материала. В качестве таких материалов используют гранулированные гели (рН градиент формируют с помощью амфолитов).
источник
Движение частиц в жидкой фазе под действием электрического поля называется, электрофорезом. Скорость движения макромолекул в электрическом поле можно использовать для определения молекулярной массы белков, для идентификации макромолекул по заряду, по форме, для определения изменений в первичной структуре, а также для количественного разделения различных видов макромолекул.
Рассмотрим коротко теоретические основы электрофореза. На макромолекулы с суммарным зарядом q в электрическом поле с напряженностью Е действует электрическая сила
Под действием этой силы происходит ускоренное движение макромолекул. В результате такого движения возникает сопротивление вязкой среды с силой трения Fc = fv, где v – скорость движения макромолекул. Через определенное время, когда силы уравновешиваются (Fэ = Fc), наступает стационарное состояние, и макромолекулы движутся с постоянной скоростью v . Тогда
Отношение скорости v к напряженности электрического поля Е называется электрофоретической подвижностью u. Из (3.45)
Электрофоретическая подвижность измеряется в м 2 •В -1 •с -1 . Для сферических макромолекул f = 6πηr, тогда
где η– вязкость среды; г–радиус макромолекулы.
Как видно, коэффициент электрофоретической подвижности, дает информацию о радиусе макромолекулы, соответственно, и о ее размерах. Однако среда, в которой происходит движение заряженных частиц, является не изолятором, а электролитом, состоящим из различных ионов. Это обстоятельство вносит большие затруднения для теоретического описания движения заряженной частицы в электрическом поле. Макромолекула в растворе электролита окружена ионной оболочкой, экранирующей ее от приложенного электрического поля. Ионная оболочка частично нарушается как действием электрического поля, так и при движении частицы. Существующая теория электрофореза пока не в состоянии точно описать эти ( ряд других) процессов, и поэтому данные электрофореза не могут трактоваться с точки зрения информации о макромолекулярной структуре. Но, тем не менее, различные варианты электрофореза широко применяются для аналитических и препаративных целей. Методы препаративного электрофореза разработаны для получения относительно больших количеств чистого (гомогенного) материала. Аналитический электрофорез используется для контроля чистоты препаратов, определения количества компонентов в смеси, оценки их соотношения и т. д. На практике оптимальные условия для электрофореза тех или иных препаратов подбираются в большинстве случаев эмпирическим путем.
Для разделения макромолекул электрофорезом используют специальные приборы. Существуют три основных типа электрофореза: с подвижной границей, зональный и непрерывный.
При электрофорезе с подвижной границей макромолекулы присутствуют во всем обьеме раствора и положение молекул с течением времени можно определять оптическими методами.
В зональном электрофорезе раствор препарата наносят в виде пятна или полосы, и частицы мигрируют через растворитель. Растворитель обычно содержится в гомогенной инертной среде ( бумага, гель).
В непрерывном электрофорезе образец также наносят в виде зоны, но раствор наносится не однократно, а прибавляется постоянно по мере проведения электрофореза.
Наибольшее применение на практике нашли различные модификации зонального электрофореза с различными носителями: на бумаге, на ацетате целлюлозы, на геле. Два остальных типа электрофореза используются сравнительно редко. Рассмотрим более подробно один из методов зонального электрофореза – гель-электрофорез, нашедший наиболее широкое применение в исследовании макромолекул.
Лучшие результаты при электрофоретическом разделении белков и нуклеиновых кислот достигаются при использовании в качестве носителя гелей из крахмала, полиакриламида, агарозы и комбинированных гелей из этих веществ. Качественное разделение макромолекул при использовании этих носителей достигается тем, что эффект электрофоретического разделения дополняется разделяющим действием гель-проникающей хромотаграфии (эффект «молекулярного сита»). Первоначально для гель-электрофореза применяли крахмальный гель, однако, в настоящее время его заменили полиакриламидные и агарозные гели. Полиакриламид оказался наиболее эффективным носителем для электрофореза белков и небольших молекул РНК, например т-РНК. Это связано с тем, что в полиакриламидном геле можно контролировать эффект молекулярного сита ( размер пор в геле ) с помощью изменения концентрации геля. Для нуклеиновых кислот, размер молекул которых больше размеров пор полиакриламида, используются агарозные или агарозно-полиакриламидные гели. Полиакриламидный гель получается при сшивании акриламида с метилен-бис-акриламидом. Такой гель готовят непосредственно перед экспериментом в контейнере ( стеклянная трубка, пластина) для проведения электрофореза (Рис. 9). После окончания электрофоретического разделения, зоны распределения макромолекул в геле обнаруживают путем окрашивания специфическими красителями и или другими способами. Например, для обнаружения белков используются красители амид черный, бромфеноловый синий, Кумасси бриллиантовый голубой. Если разделяются биологически активные молекулы, положение молекулы можно идентифицировать по измерению активности, например, по измерению ферментативной активности. Локализацию нуклеиновых кислот в гелях определяют после обработки флоуресцентными красителями (например, бромид этидия) или по радиоактивности разделенных фрагментов.
Рис.. 9. Устройство для электрофореза на горизонтальных пластинах геля ( Фрайфельдер, с.229)
1. Пластина геля; 2. охлаждающая подложка; 3. отсек для буферного раствора; 4. бумажный электрод между гелем и буфером; 5. циркуляционный термостат с охлаждающей жидкостью; 6. электроды; 7. источник электрического тока
Электрофорез в полиакриламидном геле проводят или в колонках (трубках) с гелем или на пластинах с гелем. Рассмотрим один из вариантов этого метода, наиболее широко используемых для разделения белков .
ДСН-гель-электрофорез. Для определения молекулярной массы белков используют электрофорез в присутствии додецилсульфата натрия в полиакриламидном геле. Этот метод предложили в 1969 году Клаус Вебер и Мери Осборн.
До проведения электрофореза белок обрабатывают 1 % раствором додецилсульфата натрия (ДСН) с 0,1 М β-меркаптоэтанолом при нейтральном рН. В таком растворе большинство многоцепочечных белков связываются с ДСН и диссоциируют, дисульфидные связи разрываются, вторичная структура белка исчезает.
Рис. 10. Типичная полулогарифмическая зависимость М от электрофоретической подвижности uпри определениимолекулярной массы ДСН-электрофорезом в ПАА-геле.
а – комплекс полипептидной цепи (1) с молекулами ДСН (2); б– полулогарифмическая зависимость молекулярной массы М от относительной электрофоретической подвижности u. Маркерные белки: 1–фосфолипаза А, 2 – трансферин, 3 – каталаэа, 4 – овальбумин, 5 – пепсин, 6 – химотрипсиноген
Додецилсульфат натрия совершенно одинаково связывается с молекулами различных белков: 1,4 кг ДСН связывается с 1 кг белка. Каждая молекула ДСН несет один отрицательный заряд и, таким образом, общая плотность заряда примерно одинаковая для разных белков. Таким образом, поверхностная шуба из молекул ДСН устраняет зарядовые различия, существующие в нативных белках. После обработки ДСН, полипептидная цепь представляет вытянутый цилиндр с диаметром 1,8 нм. Длина таких стержней коррелирует с молекулярной массой белков: чем длиннее цилиндр, тем больше молекулярная масса (рис. 1, а). Обработанные таким образом белки имеют одну и ту же форму и одинаковое отношение заряд/масса. Электрофоретическая подвижность таких молекул будет зависеть только от молекулярной массы вследствие движения в молекулярном сите.
В качестве носителя при электрофорезе используют полиакриламидный гель в концентрации от 5 до 15 %. Экспериментально установлена линейная связь между электрофоретической подвижностью и логарифмом молекулярной массы:
где а и b – постоянные величины, зависящие от свойств полиакриламидного геля.
Определение молекулярной массы исследуемого белка проводят по калибровочной кривой. Для построения калибровочной кривой в идентичных условиях проводится электрофорез маркерных белков с известной молекулярной массой и строится зависимость u = f (lgM) (рис. 1, б). По значению электрофоретической подвижности на калибровочной кривой с высокой точностью (до 5 %) находят молекулярную массу исследуемого белка.
Кроме измерения молекулярной массы, ДСН-гель- электрофорез позволяет определить и идентифицировать субъединичное строение сложных белков, имеющих четвертичную структуру.
Изоэлектрическое фокусирование белков.
Белковые молекулы являются амфолитами, т.е. содержат положительно и отрицательно заряженные группировки. Для таких молекул характерна зависимость их заряда от рН . При низких значениях рН отрицательные заряженные группировки молекулы нейтрализуются ионами Н + и в целом она имеет положительный заряд. При высоких значениях рН такие молекулы заряжены отрицательно, т.к. положительно заряженные группировки молекулы нейтрализуются ионами гидроксила. Для каждого амфолита существует такое значение рН, при котором заряд молекулы равен нулю. Это значение рН называется изоэлектрической точкой рI молекулы. При электрофорезе в градиенте рН молекулы белков будут двигаться до тех пор, пока не достигнут области геля, где рН геля будет равен значению рI молекулы. В этой точке заряд молекулы будет равен нулю, т.е. она станет незаряженной и перестанет двигаться. В случае разгонки смеси белков, каждый белок остановится в той области градиента рН, которая соответствует значению изоэлектрической точки соответствующей молекулы (рис 11). Такой метод разделения белков в градиенте рН, основанный на различиях значений изоэлектрических точек, называется изоэлектрическим фокусированием. Для создания стабильного градиента рН в состав геля добавляют синтетические низкомолекулярные полиамфолиты (многозарядные молекулы с м.м. 300-600). Полиамфолиты представляют собой смесь полимеров алифатических амино- и карбоновых кислот, например, амфолины фирмы LKB. Меняя соотношение различных амфолитов, можно приготовить гель с соответствующим, для определенных белковых молекул, интервалом градиента рН. При приложении на гель электрического поля начинается движение полиамфолитов и через определенное время устанавливается градиент рН
Изоэлектрическое фокусирование по сравнению с электрофорезом характеризуется более высокой разрешающей способностью разделения и возможностью концентрации разделяемых фракций. В последние годы появились методы, комбинирующие оба способа разделения белковых молекул. На гелевых пластинах в одном направлении проводят разделение электрофорезом, в другом, перпендикулярном направлении – изоэлектрическим фокусированием. За счет такого двумерного разделения, разрешающая способность метода резко возрастает, что делает возможным разделение компонентов, которое нельзя осуществить другими методами.
Рис. 11. Принцип электрофоретического разделения заряженных молекул в градиенте рН ( метод изоэлектрического фокусирования ) . (Фрайфельдер,240с)
источник
Электрофорез
2. Электрофорез с подвижной границей.
4. Изоэлектрическая фокусировка.
Белки, нуклеиновые кислоты, полисахариды, находясь в растворе несут определенный электрический заряд благодаря наличию групп, способных к электролитический диссоциации. Общий заряд данной частицы определяется, прежде всего, концентрацией Н + -ионов в среде. Под действием электрического тока заряженные частицы перемещаются к катоду или аноду в зависимости от знака их суммарного заряда. Такое явление носит название электрофореза. Скорость движения частиц (см/с) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью.Она имеет размерность см 2 /с -1 ·в -1 .
Различия в подвижности частиц служат основой для разделения смесей веществ.
Если приложить к электропроводящему раствору равномерное электрическое поле (Е), то на частицу будет действовать сила ускорения:
где d– расстояние между электродами, q – заряд молекулы. Так как молекула перемещается не в вакууме, то на неё действует противоположно направленная сила трения, которая зависит от размеров, формы молекулы, вязкости среды и описывается уравнением Стокса:
где f– коэффициент трения, v – скорость движения молекулы. Для сферических частиц коэффициент трения равен 6πηr, где r – радиус частиц и η – коэффициент вязкости растворителя. В растворе силе ускорения противодействует сила трения, поэтому:
Е/d·q = 6πηrv, преобразуя выражение, получим:
Таким образом, скорость молекулы (v) пропорциональна напряженности электрического поля Е/d и заряду молекулы и обратно пропорциональна размеру молекулы и вязкости среды. Заряд и размер являются строго индивидуальными характеристиками молекулы. Следовательно, и путь, который пройдет та или иная молекула при электрофорезе за определенный интервал времени, тоже будет характерен для данной молекулы.
Существуют три основных типа электрофоретических систем – электрофорез с подвижной границей, зональный электрофорез и стационарный электрофорез.
Элекрофорез с подвижной границей
Электрофорез макромолекул, растворенных в буфере с соответствующим значением рН, проводится в V-образной кювете с прямоугольным поперечным сечением. Раствор макромолекул в буфере заливают в нижнюю часть кюветы, доливают оба конца трубки тем же буфером и монтируют в них электроды. Если вести электрофорез в щелочном буфере, то все белки заряжаются отрицательно и начинают перемещаться к аноду: скорость перемещения данного белка зависит от его рН, и от величины суммарного заряда при данном рН буфера. Как видим, в данном методе электрическое поле прикладывается к исходно разной границе между раствором молекул и буфером. Скорость миграции заряженных частиц определяется путем наблюдения за перемещением этой границы. Если раствор содержит гетерогенную смесь ионизированных макромолекул, то можно увидеть множество движущихся границ. Способы наблюдения за пограничными изменениями концентрации вещества основаны на измерении градиента показателя преломления, который пропорционален градиенту концентрации.
Сконструирование Филпонтом и Свенссоном астигматической фотокамеры со специальной оптической системой, называемой шлирен-оптикой, позволяет непосредственно регистрировать градиент показателя преломления вдоль кюветы.
Электрофорез по методу подвижной границы нашел широкое применение при исследовании белков. Этот метод в основном используется для определения подвижностей и изоэлектрических точек белков, т.к. количественно трудно оценить подвижности. Метод электрофореза с подвижной границей используется редко.
Зональный элекрофорез
В зональном электрофорезе пятно или тонкий слой раствора, нанесенного на полутвердый или гелеобразный материал, помещают в электрическое поле, в результате чего молекулы перемещаются по или через материал носитель. В первую очередь функцией носителя является предотвращение механических воздействий и конвекции, которая происходит в результате температурных или высокой плотности концентрированных растворов.
Однако, носитель может действовать в качестве молекулярного сита, приводя тем самым к хроматографическим эффектам, что может или улучшить разделение, или ухудшать его.
а) электрофорез на бумаге.
В качестве носителя здесь используется фильтровальная бумага, которая должна содержать 96% α-целлюлозы, нерастворимой в концентрированном растворе NaOH. Приборы для электрофореза состоят из двух электродных сосудов и устройства для поддержания полосок фильтровальной бумаги. В качестве электродов обычно применяются платиновые проволоки. Можно использовать и угольные электроды. Для предотвращения чрезмерного испарения всю систему помещают в закрытую камеру, что обеспечивает создание влажной атмосферы.
Перед анализом электрофоретическую бумагу погружают в буферный раствор, слегка промокают между чистыми листами промокательной бумаги, а затем помещают на подставку.
Пробу наносят либо капиллярной пипеткой с закрученным носиком, либо с помощью различных аппликаторов, обеспечивающих быстрое и равномерное нанесение исследуемого раствора.
После нанесения проб к кювете подключают напряжение. Для наблюдения за ходом электрофореза на бумагу наносят пятно определенного стандартного вещества. По окончании процедуры бумагу высушивают при 105-110°С. Макромолекулы затем можно обнаружить при помощи соответствующего метода окрашивания.
Б) электрофорез в ПААГ.
В качестве среды для электрофоретического разделения макромолекул наиболее широкое распространение получил ПААГ, обладающий рядом преимуществ. Среди них можно отметить химическую стабильность, инертность, прозрачность в широком диапазоне длин волн, возможность получения пор с заданной величиной, отсутствием адсорбции. С помощью ПААГ можно разделить вещества с молекулярной массой от 2500 до 2000000 дальтон.
Системы электрофореза в ПААГ можно разделить на две группы по применяемым буферным системам. К первой относятся системы вертикального и горизонтального электрофореза, в которых применяется один тип буфера в электродных камерах и геле. Ко второй группе относятся системы вертикального «диск-электрофореза»: в них используются разные виды буферов (2-3) и гели разной концентрации. Название данного метода происходит от английского слова discontinuty (прерывистый), обозначающего в данном контексте неоднородность электрофоретической среды. Для диск-электрофореза характерны скачкообразные изменения рН, концентрации геля и градиента напряжения.
Прибор для диск-электрофореза состоит из верхнего и нижнего резервуара для электродного буфера и вертикальной стеклянной трубки. Нижняя часть трубки заполняется разделяющим гелем с мелкими порами, которые действуют как молекулярное сито по отношению к изучаемым макромолекулам. Над разделяющим гелем находится концентрирующий гель, имеющий крупные поры и поэтому не обладающий свойствами молекулярного сита, а еще выше расположен стартовый гель, содержащий пробу и краситель, используемый в качестве свидетеля.
Принцип диск-электрофореза основан на эффекте подвижной границы Кольрауша, суть которого состоит в использовании двух разных буферов: в электродных камерах трис-глициновый буфер (рН 8,3) , а в концентрирующих(рН 6,7) и разделяющем гелях(рН 8.9) – трис-НСl. В электродном буфере рН на 1,5-2 единицы выше, чем в концентрирующем. Образец растворяется в том же буфере, который используется в концентрирующем геле. При рН 8,3 глицин находится в виде цвиттериона:
После включения тока все ионы (в том числе белки и краситель) начинают двигаться к аноду в следующей последовательности: Сl — > бромфеноловый синий > белки > глицинат.
Рис. 1. Прибор для диск-электрофореза.
Между ионами хлора и глицината образуется граница раздела. Так как оба эти иона принадлежат к одной и той же электрической системе, то в области глицинатных ионов напряжение, а следовательно, и их скорость, возрастают, а в области ионов хлора напряжение и скорость уменьшаются. Следовательно, замыкающие глицинатные ионы будут стремиться догнать ведущие ионы хлора, а зона белков и красителя, находящаяся между ними, будет сужаться (концентрироваться). Этот процесс происходит в концентрирующем (крупнопористом) геле.
Когда подвижная граница доходит до мелкопористого геля (рН 8,9), то, с одной стороны, подвижность глицинатных ионов возрастает, а с другой – на белки начинает действовать эффект молекулярного сита, и они отстают от подвижной границы. Таким образом, белки попадают в более щелочной трис-глициновый буфер, их отрицательный заряд возрастает, и они разделяются согласно своим индивидуальным характеристикам (заряду, форме молекул, молекулярному весу).
При проведении электрофореза гель полимеризуется непосредственно в стеклянной трубке, которую потом соединяют с сосудами с буфером. Образец суспендируют в концентрированном растворе сахарозы и наносят на поверхность геля в виде тонкого слоя с помощью пипетки. Электрофорез прекращают, когда зона красителя (подвижная граница) проходит 0,8-0,9 длины геля. Затем гель извлекают из трубки и окрашивают специальными красителями обнаружения зон. Каждую зону можно характеризовать по значениям их Rf или по площади пика после денсатометрирования. Диск-электрофоретический метод особенно часто используется для разделения белков.
источник
Направленное перемещение частиц дисперсной фазы под действием электрического поля может наблюдаться в седиментационно-устойчивых дисперсных системах. При этом происходит разрыв ДЭС по плоскости скольжения, в результате частица приобретает определенный заряд и движется к соответствующему электроду.

Рис. 18. Схема движения коллоидных частиц в электрическом поле.
Линейная скорость (U) – движение частиц относительно мембраны при электроосмосе и движение частиц при электрофорезе:
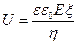
где 
При движении частиц дисперсной фазы они вынуждены взаимодействовать с противоионами дисперсионной среды, что вызывает электрофоретическое торможение, что уменьшает линейную скорость при электрофорезе.
Электрофоретическое торможение 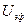
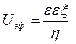
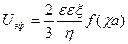
где f — параметр Дебая, α – диаметр частицы. Единицы измерения электрофоретического торможения 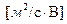
Характеристикой электрофореза является также электрофоретическая подвижность, которая характеризует электрофоретические свойства системы без учета влияния внешнего электрического поля и служит для сравнения способности к электрофорезу различных коллоидных систем.
При исследовании явления электроосмоса для практического применения при расчете электрокинетического потенциала удобнее использовать уравнение, в которое входят величины, измеряемые экспериментально. Выразим линейную скорость через объёмную:
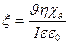
где r – радиус капилляра, l – длина капилляра, I – сила тока, ρ – удельное сопротивление, χv – удельная электрическая проницаемость жидкости, R – сопротивление.
Пи расчете электрокинетического потенциала и при выборе оптимального режима ряда технологических процессов (проведение электродиализа, определении пористости грунтов т.д.) необходимо учитывать поверхностную проводимость χs – это явление сводится к тому, что находящиеся около межфазной границы ионы изменяют состав среды, они являются причиной передвижения жидкости или частиц. Изменение состава среды ведёт к изменению электропроводности раствора у межфазной границы.
Поверхностная проводимость χs учитывается путём введения коэффициента эффективности диафрагмы α:
Путём электроосмоса удаляют влагу из капиллярнопористых систем и понижают уровень грунтовых вод при возведении гидротехнических сооружений.
Метод электрофореза применяют для формирования изделий из тонких взвей последующим спеканием для разделения, выделения и исследования биоколлоидов, особенно белков.
Возникновение электрических полей при течении грунтовых вод помогает в геологической разведке полезных ископаемых и водных источников.
источник
ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ г. СЕМЕЙ
Методическое пособие по теме:
Терапевтическая техника, основанная на применении постоянного тока
Электрофорез и гальванизация в медицинской практике.
Подвижность ионов
Фазыгетерогенной системы придут в движение вследствие взаимодействия с электрическим полем, если к системе приложить постоянную разность потенциалов. Движение частиц дисперсной фазы в электрическом поле по направлению к противоположно заряженному электроду называется электрофорезом. Электрофорез был открыт Ф. Рейссом в 1807 г
Электрофорез это движение взвешенных частиц (пузырьков газа, коллоидных частиц и макромолекул) в жидкости под действием электрического поля. Метод, сочетающий воздействие на организм постоянного тока и введение лекарственных веществ, носит название лечебного электрофореза или ионогальванизации.
Профессор В. Виленский применил постоянный ток в сочетании с лекарственными веществами впервые в России в 1859 году, теоретические обоснования нашли подтверждение в исследованиях физика, невропатолога, психиатра А.Б. Щербака.
Электрофорез получил широкое применение в современной медицине в клинических исследованиях сыворотки крови, желудочного сока, мочи, спинно-мозговой жидкости. Электрофорез применяется в физиотерапии. Обычно применяются два основных метода — макроскопический и микроскопический электрофорез.
Макроскопический электрофорез используются для разделения веществ, находящихся в смеси, и их последующего выделения.
Микроскопический электрофорез используются для изучения подвижности ионов, клеток, частиц в электрическом поле, величины электрокинетического потенциала, а также электрохимических свойств поверхности исследуемых веществ.
Скорость передвижения частиц дисперсной фазы можно найти из уравнения Смолуховского: 
где υ — скорость передвижения частиц; ε- диэлектрическая проницаемость дисперсионной среды; Е – градиент потенциала электрического поля; ζ — электрокинетический потенциал; η -коэффициент вязкости дисперсионной среды.
Мы можем применить уравнение (1) для эритроцитов, лейкоцитов, микроорганизмов и других клеток. Электрофоретическая подвижность белковых молекул и коллоидных частиц зависит от их размера и формы. Коэффициент, зависящий от размера и формы частиц, вводится для расчетов в уравнение (1). Уравнение (1) применяется для вычисления величины электрокинетического потенциала. Для этого необходимо знать напряженность внешнего поля, диэлектрическую проницаемость и коэффициент вязкости среды, а также скорость движения дисперсной фазы. Один из методов электрофореза заключается в следующем. Исследуемую дисперсную систему помещают на дно V — образной трубки и наливают в боковые колена чистый буферный раствор. Между исследуемой жидкостью и буферным раствором должна быть отчетливая граница раздела. Электроды, соединенные с источником постоянного тока, погружаются в каждое колено V- образной трубки. Создаваемое электрическое поле вызывает перемещение дисперсной фазы исследуемого раствора, и граница между дисперсной системой и буферным раствором перемещается. Перемещение границы регистрируется с помощью длиннофокусной оптики. Если исследуемая смесь содержит несколько компонентов, то каждый компонент движется со скоростью, пропорциональной величине ξ потенциала. В результате смесь разделяется на ряд функций. При регистрации сигнала получается кривая, имеющая ряд пиков. Высота пиков служит количественным показателем данных функций. Затем выделяются и исследуются отдельные фракции белков кровяной плазмы. Данный метод распространился после разработки техники этого метода Тизелиусом.
На аппарате Тизелиуса можно получить результаты высокой точности, но это сложный и громоздкий прибор.
Рис. 1. Диаграмма электрофоретического анализа по Тизелиусу: I — нормальная сыворотка; II — плазма крови при миэломе; III – сыворотка при нефрозе.

Важные данные, характеризующие электрохимические свойства биологических поверхностей, получены с помощью методов электрофореза. Живая протоплазматическая поверхность всегда заряжена отрицательно, все биологические поверхности обладают отрицательным электрокинетическим потенциалом. Это установлено на основе многочисленных экспериментов. Не известно ни одного примера положительного потенциала поверхности живого объекта.
Величина ξ- потенциала может иметь различные значения для разных клеток. У человека она составляет примерно 16,3 мВ. Потенциал эритроцитов очень стабильная величина. Например, нет различий в величине ξ- потенциала эритроцитов у людей различных рас и пола. Различий не наблюдаются также между представителями разных групп крови. Электрофоретическая подвижность эритроцитов не изменяется при ряде заболеваний крови, в том числе при многих формах анемий. Электрохимические свойства поверхности эритроцитов отличаются большой стойкостью и постоянством.
Ученые пришли к выводу, что электрокинетический потенциал эритроцитов обусловлен диссоциацией кислотных групп молекул фосфолипидов (кефалина) на поверхности эритроцитов и не связан с процессами адсорбции белков и ионов. Величина электрокинетического потенциала эритроцитов меняется в том случае, если происходит изменение физико-химического состава самой поверхности клетки. Это наблюдается при некоторых заболеваниях, например гемобластозах, лимфосаркоме. Для других форменных элементов крови ξ- потенциал изучен значительно слабее, чем для эритроцитов. Лейкоциты движутся к аноду при электрофорезе, как и эритроциты, но их подвижность примерно в 2 раза ниже подвижности эритроцитов. Электрофоретическая подвижность лейкоцитов весьма близка к подвижности кварцевых частиц. Явление электрофореза наблюдается при миграции лейкоцитов в воспалительные очаги. Электрокинетические явления могут способствовать миграции лейкоцитов. В воспаленных участках происходят процессы разрушения структур и накопления свободных молекул, главным образом органических кислот, что приводит к сдвигу pH в кислую сторону. В результате этих физико-химических изменений пограничный участок между воспаленной и невоспаленной тканью приобретает избыточный положительный потенциал величиной до 100-150 мВ. А так как лейкоциты обладают отрицательным электрокинетическим потенциалом, то они движутся через стенку капилляра в ткань по направлению к положительно заряженному воспаленному участку.
Бактериальные клетки обладают отрицательным ζ потенциалом, который может меняться в очень широких пределах: от нуля до десятков милливольт. Благодаря этим исследованиям большинство бактерий удалось разделить на две группы.
К первой группе принадлежат бактерии, поверхность которых имеет белковую природу. Диссоциация ионогенных групп белковых молекул обусловливает заряд и ζ- потенциал таких клеток. ζ — потенциал этих клеток меняется при изменении pH среды, так как степень диссоциации ионогенных групп зависит от pH.
Ко второй группе относятся бактерии, поверхность которых состоит из полисахаридов. Заряд клеток в данном случае обусловлен адсорбцией ионов из дисперсионной среды полисахаридами поверхности. Электрофоретическая подвижность таких клеток практически не зависит от pH среды. Однако такое деление оказывается довольно условным, т.к. свойства поверхности бактериальных клеток могут изменяться при изменении внешних условий существования. Так, например, ζ потенциал золотистого стафилококка при обычных условиях культивирования остается постоянным при большом изменении pH среды. Если же бактерии культивируются в среде, богатой глюкозой, то наблюдается зависимость ξ- потенциала от величины pH. Эта зависимость появляется вследствие накопления на поверхности клеток групп белковой природы. Таким образом, знание подвижности ионов, применение метода электрофореза является хорошим средством изучения электрохимических свойств биологических поверхностей: способности к ионизации и способности к адсорбции молекул и ионов.
Проводимость электролитов осуществляется за счет ионов, возникающих при растворении и расщеплении молекул веществ. Молекулы распадаются на положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы. Явление расщепления растворимого вещества на ионы называется электролитической диссоциацией.
Если два электрода погрузить в электролит и подвести к ним напряжение, то под действием электрического поля ионы с отрицательными зарядами (анионы) будут двигаться к аноду, а ионы с положительными зарядами (катионы)- к катоду. Если разность потенциалов на электродах, расположенных на расстоянии L друг от друга, равна φ1-φ2, тогда напряженность электрического поля электролита определяется по формуле E= (φ1-φ2)/L
Электрическое поле действует на заряженные частицы с постоянной силой, заставляя их перемещаться к электродам с некоторой постоянной скоростью. Чем больше напряженность, тем быстрее будут перемещаться ионы. Скорость перемещения ионов прямо пропорциональна напряженности электрического поля, υ=υE, где υ, — коэффициент пропорциональности, называемый подвижностью ионов: υ = υ/E
Напряженность электрического поля измеряется в В/м, скорость движения ионов — в м/с. Подвижность ионов определенного вида выражается их скоростью перемещения в растворителе под действием электрического поля и измеряется в
Подвижность различных ионов при одинаковых условиях перемещения зависит от размеров ионов и валентности. Подвижность является величиной характерной для определенного вида ионов. По величине подвижности ионов можно определить вид иона или разделить смесь ионов электролитическим путем.
Лекарственный электрофорез
Лекарственный электрофорез – сочетание воздействия на организм постоянного электрического тока и лекарственного вещества, введенного с его помощью. При этом лечебные эффекты вводимого лекарственного вещества добавляются к механизмам действия постоянного тока. Они зависят от подвижности, способа введения, количества поступающего в организм лекарства и области его введения. Лекарственные вещества в растворе распадаются на ионы и заряженные гидрофильные комплексы. При помещении таких растворов в электрическое поле содержащиеся в них ионы перемещаются по направлению к противоположным электрическим полюсам (электрофорез), проникают в глубь тканей и оказывают лечебное действие. Из прокладки под положительным электродом в ткани организма вводятся ионы металлов (из растворов солей), а также положительно заряженные частицы более сложных веществ; из прокладки под отрицательным электродом – кислотные радикалы, а также отрицательно заряженные частицы сложных соединений.




Вводимые лекарственные вещества проникают в эпидермис и накапливаются в верхних слоях дермы, из которой они диффундируют в сосуды микроциркуляторного русла и лимфатические сосуды. Период выведения различных препаратов из кожного «депо» колеблется от 3 ч до 15-20 суток. Это обусловливает продолжительное пребывание лекарственных веществ в организме и их пролонгированное лечебное действие. Количество лекарственного вещества, проникающего в организм путем электрофореза, составляет 5-10 % от используемого лекарства при проведении лечебной процедуры. Повышение концентрации растворов (свыше 5%) для увеличения количества вводимых в организм веществ не улучшает леченый эффект. В этом случае возникают электрофоретические и релаксационные силы торможения, вследствие электростатического взаимодействия ионов (феномен Дебая-Хюккеля). Они тормозят перемещение ионов лекарств в ткани.
Фармакологические эффекты поступающих в организм лекарственных веществ проявляются при введении сильнодействующих препаратов и ионов металлов в малом количестве. Лекарственные средства действуют локально на ткани, находящиеся под электродами. Они способны вызывать выраженные рефлекторные реакции соответствующих органов, усиливать их кровоток и стимулировать регенерацию тканей. Например, ионы йода введенные в организм с помощью электрофореза увеличивают дисперсность соединительной ткани и повышают степень гидрофильности белков:
Ионы лития растворяют литиевые соли мочевой кислоты.
Ионы меди и кобальта активируют метаболизм половых гормонов и участвуют в их синтезе.
Ионы магния и кальция оказывают выраженное гипотензивное действие.
Ионы цинка стимулируют регенерацию и обладают фунгицидным действием.
Некоторые из введенных веществ могут изменять функциональные свойства кожных волокон тактильной и болевой чувствительности. Исходя из этого, совместное воздействие электрического тока и местных анестетиков вызывает уменьшение импульсного потока из болевого очага и создает анальгетический эффект постоянного тока. Такие явления выражены под катодом. Постоянный электрический ток изменяет фармакологическую кинетику и фармакологическую динамику вводимых препаратов. В результате сочетанного действия лечебные эффекты большинства из них (за исключением некоторых антикоагулянтов, ферментных и антигистаминных препаратов) потенцируются. Поступающие в кожу вещества накапливаются локально. Это позволяет создавать значительные концентрации этих веществ в поверхностных зонах поражения. При таком способе введения отсутствуют побочные эффекты перорального и парентерального введения лекарственных веществ. Действие балластных ингредиентов слабо выражено и растворы не требуют стерилизации. Это позволяет использовать их в полевых условиях. Возможно также накопление лекарственных веществ (в частности, антибиотиков) в патологических очагах внутренних органов (внутриорганный электрофорез), цитостатиков и иммуностимуляторов в опухолях (электрохимиотерапия). При этом концентрация лекарств в межэлектродных тканях увеличивается в 1,5 раза.
Суммарное количество прошедшего электричества через ткани не должно превышать 200 кулон. Количество применяемого лекарственного вещества обычно не превышает его разовой дозы для парентерального и перорального введения.
Гальванизация
Лечебный метод, при котором используется действие на организм постоянного тока незначительной силы, называется гальванизацией. Это связано со старым названием постоянного тока – гальванический ток. Первичное действие тока на ткани организма связано с движением в тканях ионов электролитов и других заряженных частиц. Разделение ионов и соответственно, изменение концентрации ионов в различных элементах тканевых структур происходит вследствие разной подвижности ионов, а так же задержки и накопления их у полупроницаемых мембран, в тканевых элементах, снаружи и внутри клеток. Это вызывает изменение функционального состояния клетки и другие физиологические процессы в тканях. Терапевтическое действие постоянного тока зависит от этого явления. Таким образом, изменение концентрации ионов в тканевых образованиях это основа первичного действия постоянного тока на организм человека.

Повышение этого соотношения вызывает реакцию возбуждения, а понижение-реакцию торможения. В частности действие в области катода при замыкании тока связано с повышением концентрации более подвижных одновалентных ионов, преимущественно К и Na, а повышение возбудимости в области анода связано с концентрацией менее подвижных, и поэтому остающихся в избытке вблизи анода, двухвалентных ионов Са, Mg и др.

Для соединения электродов с клеммами аппарата применяют многожильные изолированные провода.
При подготовке к проведению лечебной процедуры гальванизации гидрофильные прокладки погружают в горячую водопроводную воду, затем их умеренно отжимают и накладывают на подлежащие воздействию участки тела вместе с токопроводящими пластинками, соединенными с многожильными проводами. Провода соединяют с пластинами специальными пружинящими зажимами, припаивают или накладывают на пластину. Все вместе плотно прибинтовывают эластичным бинтом, прижимают мешочки с песком. Плотное и ровное прилегание прокладок к телу и невозможность соприкосновения с ним металлической части электрода должны быть тщательно проверены, равно как проверено и отсутствие на коже под электродами ссадин, царапин и других нарушений эпидермального слоя (в крайнем случае, мелкий дефект кожи может быть прикрыт кусочком ваты или марли с вазелином).

Для процедур гальванизации используется аппарат «Поток – 1». Аппарат гальванизации это регулируемый источник постоянного тока, питаемый от сети. Аппарат имеет корпус из ударопрочного полистирола, состоящий из собственного корпуса и съемного дна.
Миллиамперметр (1), расположен слева на верхней стенке корпуса, служащей панелью управления. Ручка регулятора тока «3», — справа от амперметра — переключатель диапазонов тока и пределов 
До проведения процедур необходимо проверить правильность установки переключателя напряжения сети. Перевести выключатель сети в положение «Выкл», переключатель диапазонов — в положение «5 mA», а ручку регулировки тока — в нулевое положение. Включить вилку сетевого шнура в розетку питающей сети. Подключить соединительные провода к выходным зажимам и укрепить в их зажимах выбранные электроды. Наложить на тело больного электроды с прокладками, смоченными водой или лекарственным раствором (при проведении процедур лекарственного электрофореза). Включить сетевое напряжение (при этом загорится лампа на панели управления) и, плавно поворачивая ручку регулятора, установить необходимое значение тока. Следует иметь в виду, что в течение первых минут после начала процедуры сопротивление тела несколько уменьшается, что приводит к увеличению тока. По этой причине в начале процедуры необходимо следить за величиной тока и при необходимости подрегулировать его. Для уменьшения диапазона тока предварительно вывести в начальное положение ручку регулировки тока и снять электроды с пациента. При перерыве в работе выключить сетевое питание, переведя ручку сетевого выключателя в положение «выкл».
Включения тока должно начинаться с нулевого значения, нарастать очень постепенно и плавно, без рывков и толчков. Выключение должно проводиться также очень плавно до нуля. По окончании процедуры аппарат должен быть выключен и провода отключены от него.
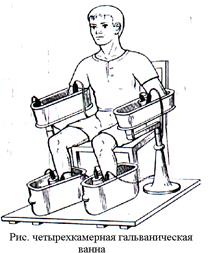
Подводимый к больному ток дозируется по плотности – отношению силы тока к площади электрода. Допустимая плотность тока при местной гальванизации не должна превышать 0.1 mA/сm 2 . При общих воздействиях допустимая плотность тока на порядок ниже — 0.01 mA/сm 2 — 0.05 mA/сm 2 . Помимо объективных показателей, при дозировании учитывают и субъективные ощущения больного. Во время процедуры он должен чувствовать легкое покалывание (пощипывание) под электродами во время процедуры. Появление чувства жжения служит сигналом к снижению плотности проводимого тока.Длительность процедур, частота проведения и общее число их на курс лечения зависит от характера, стадии и фазы заболевания, общего состояния больного и его индивидуальных особенностей.
Продолжительность гальванизации не превышает 20 – 30 мин. Обычно на курс лечения назначаются 10 – 15 процедур. При необходимости повторный курс гальванизации проводится через один месяц.
Гальванизацию сочетают с высокочастотной магнитотерапией (гальваноиндуктотермия), пелоидотерапией (гальванопелоидотерапия) и акупунктурой (гальваноакупунктура).
К преимуществам метода лекарственного электрофореза относят:
1. создание кожного депо, в котором лекарственные вещества обнаруживаются от 1 до 3 дней,
2. воздействие непосредственно на патологический очаг,
3. значительное урежение физиологических реакций,
4. безболезненное введение лекарственных веществ.
ГАЛЬВАНИЗАЦИЯ ПОКАЗАНА при лечении
— травмы и заболевания периферической нервной системы-ПНС (плекситы, радикулиты, моно- и полинейропатии, невралгии и др.),
— травмы и заболевания ЦНС ( черепно-мозговые и спиномозговые травмы, расстройства мозгового и спинального кровообращения),
— вегетативная дистония, неврастении и другие невротические состояния,
— заболевания органов пищеварения, протекающие с нарушением моторной и секреторной функции (хронические гастриты, колиты, холециститы, дискинезии желчевыводящих путей, язвенная болезнь желудка и двенадцатиперстной кишки),
— гипертоническая и гипотоническая болезнь, стенокардия, атеросклероз в начальных стадиях,
— хронические воспалительные процессы в различных органах и тканях,
— хронические артриты и периартриты травматического, ревматического и обменного происхождения.
ПРОТИВОПОКАЗАНИЯ для гальванизации:
новообразования, острые воспалительные и гнойные процессы, системные заболевания крови, резко выраженный атеросклероз, гипертоническая болезнь III стадии, лихорадочное состояние, экзема, дерматит, обширные нарушения целостности кожного покрова и расстройства кожной чувствительности в местах наложения электродов, склонность к кровотечениям, беременность, индивидуальная непереносимость гальванического тока.
ПОКАЗАНИЯ К ЛЕКАРСТВЕННОМУ ЭЛЕКТРОФОРЕЗУ
весьма широки – они определяются фармакотерапевтическими свойствами вводимого препарата с обязательным учётом показаний к использованию постоянного тока. На общее действие лекарственного вещества можно рассчитывать главным образом при функциональных вегетативно-сосудистых расстройствах и состояниях, при которых достаточно микродозы лекарственных веществ.
Противопоказания к лекарственному электрофорезу те же, что и к гальванизации, а также индивидуальная непереносимость лекарственных веществ.
Одной из важнейших задач при разработке, промышленном выпуске и эксплуатации электромедицинской аппаратуры является обеспечение полной электробезопасности для обслуживающего персонала и пациентов. Основными предохранительными средствами от действия на организм электрического тока является защитное заземление, зануление. Поражение организма электрическим током может быть в виде электрической травмы или электрического удара .Электрическая травма – это результат внешнего местного действия тока на тело: электрические ожоги, электрометаллизация кожи, знаки тока. Электрические ожоги являются следствием теплового действия тока, проходящего через тело человека, либо происходят под действием электрической дуги, возникающей обычно при коротких замыканиях в установках с напряжением выше 1000 В. Электрометаллизация кожи происходит при внедрении в кожу мельчайших частиц расплавленного под действием тока металла. Электрические знаки тока, являющиеся поражением кожи в виде резко очерченных округлых пятен, возникают в местах входа и выхода тока из тела при плотном контакте с находящимися под напряжением частями тела человека. Электрический удар – возбуждение тканей организма под действием тока, которое сопровождается непроизвольным судорожным сокращением мышц. Электрические удары могут вызывать наиболее тяжелые повреждения, поражая внутренние органы человека: сердце, легкие, центральную нервную систему и др. расстройство сердечной деятельности (нарушение ритма, фибрилляция желудочков сердца), расстройство дыхания, шок, в особо тяжелых случаях приводящие к смертельному исходу может быть в результате электрического удара иметь. Действие электрического тока на организм зависит от большого количества различных факторов, основными из которых являются: величина тока, определяемая приложенным к телу напряжением и сопротивлением тела, вид и частота тока, продолжительность воздействия, путь прохождения тока.
Величина тока является основным параметром, определяющим степень поражения. ощущения тока частотой 50-60 Гц появляются при силе тока 1 мА при сжимании руками электродов, судороги в руках начинаются при увеличении тока до 5-10 мА, при токе 12-15 мА уже трудно оторваться от электродов. При 50-80 мА паралич дыхания наступает, а при 90-100 мА и длительности воздействия 3 секунды и более – паралич сердца. При действии постоянного тока соответствующие реакции могут быть в момент замыкания и размыкания цепи и наступают при его большой величине. Так ощущения постоянного тока появляются при 5-10 мА, затруднение дыхания при 50-80 мА, паралич дыхания – при 90-100 мА.
Электрическое сопротивление тела не является постоянной величиной. На низких частотах оно определяется, в основном, сопротивлением рогового слоя кожи. При неповрежденной сухой коже ее удельное объемное сопротивление составляет около 10 Ohm∙m. При влажной коже ее сопротивление может снижаться в десятки и сотни раз.
Сопротивление кожи является нелинейной величиной, оно зависит от величины и времени приложения напряжения, значительно уменьшаясь после пробоя ее верхнего слоя. Сопротивление кожи уменьшается также с нагревом и увеличением потоотделения, что имеет место при большой площади контакта и значительном контактном давлении. Сопротивление внутренних органов практически не зависит от вышеуказанных факторов и принимается равным 1000 Ом.
время действия тока на организм имеет важнейшее значение для исключения несчастного случая. сила тока увеличивается с уменьшением времени действия, не вызывающая паралича, или фибрилляции сердца.
путь тока в теле человека является важным. случаи поражения, при которых ток проходит через сердце и легкие, т.е. от руки к руке, или от руки к ноге особенно опасны.
случаи поражения электрическим током связаны с касанием металлических частей, находящихся под напряжением питающей сети наиболее часто встречаются. Это могут быть сетевые провода, металлические корпуса изделий, имеющих поврежденную изоляцию и замыкание сети на корпус. Напряжение прикосновения снижается примерно во столько раз, во сколько сопротивление заземления меньше сопротивления тела человека. Сопротивление защитного заземления, применяемого при эксплуатации электромедицинской аппаратуры, не должно быть более 4 Ом. Электромедицинские приборы и аппараты имеют рабочую часть, соединенную с током или касающуюся тела пациента (электроды, излучатели, датчики). электрическая энергия передается тканям тела пациента с помощью рабочей части при применении терапевтических, хирургических электромедицинских аппаратов. биопотенциалы воспринимаются с помощью рабочей части при использовании диагностических электромедицинских приборов. Наличие рабочей части приводит связи пациента с аппаратурой и к повышенной опасности поражения электрическим током. электрический ток используется для лечебного воздействия на организм в некоторых лечебных аппаратах. Неправильная эксплуатация таких аппаратов связана с возможностью передозировок.
Пациент во многих случаях не может реагировать на действие электрического токаю Он может быть парализован, находиться под наркозом. Кожный покров пациента обрабатывается дезинфицирующими и другими растворами и теряет свои защитные свойства. Условия проведения диагностических и лечебных процедур могут быть самыми различными, от кабинета лечебного учреждения, до жилых помещений. Различные условия эксплуатации, накладывают дополнительные требования к электробезопасности аппаратуры.
Основные требования к электробезопасности электромедицинских приборов и аппаратов.
Одно из основных требований электробезопасности — исключить возможность случайного прикосновения к находящимся под напряжением частям. Части, находящиеся под напряжением, не должны становиться доступными после снятия, крышек, задвижек, а также сменных частей. различные способы применяют для защиты от напряжения. Защитное заземление осуществляется с помощью заземляющего устройства, состоящего из заземлителей и заземляющих проводников.
Заземлители подразделяются на естественные и искусственные. металлические конструкции и аппаратура железобетонных конструкций зданий могут быть использованы в качестве естественных заземлителей. Если естественные зеземлители отсутствую, или если их сопротивление превышают 4 Ом, то необходимо устройство искусственных заземлителей. выходная мощность должна быть минимальной. Для исключения электрических травм при использовании приборов с широкими пределами регулирования выходной мощности
В аппаратах для электрохирургии весьма важно правильное наложение пассивного электрода на пациента и надежное соединение его с аппаратом. Как следует из примеров, использование средств автоматики позволяет значительно снизить опасность для пациента, которая может быть вызвана как нарушениями в аппарате, так и небрежным или неправильным действием обслуживающего медперсонала.
Лабораторная работа (лабораторные исследования, выполнение практической работы, овладение и закрепление практических навыков ).
Упражнение 1. Проверка исправности аппарата «Поток-1».
- Переключатель сети Т1 поставить в положение «выкл», а Т3 в положение «50».
- Ручку потенциометра R повернуть до отказа против часовой стрелки.
- Подключить к выходным клеммам аппарата (6) сопротивление порядка 10 000 Ом.
- Переключатель сети Т1 поставить в положение «Вкл». Сигнальная лампа ЛП (2) должна загореться.
- Подождите 2-3 мин., для нагрева аппарата.
- Плавно вращая по часовой стрелки рукоятку потенциометра, проследите за изменением тока. Плавное изменение тока свидетельствует об исправности аппарата.
- Поверните до отказа против часовой стрелки ручку потенциометра.
- Отключите прибор переводом тумблера Т1 в положение «выкл».
- Запишите в отчет заключение о состоянии аппарата.
Упражнение 2. Проверка полюсов.
- Отсоедините сопротивление.
- Присоедините к каждой клемме по медному электроду.
- Положите в чашку вату и смочите ее немного раствором K I.
- Положите электроды от аппарата на чашку Петри так, чтобы расстояние между электродами было 2 см, и хороший контакт с ватой.
- Включите прибор переводом тумблер Т1 в положение «вкл».
- Установите ток порядка 5-20 мА, поворачивая ручку потенциометра.
- Пронаблюдайте изменение, происходящее у электродов, пока у одного из них не появится интенсивное окрашивание ваты.
- Ручку поверните против часовой стрелки до отказа.
- Отключите прибор тумблером Т1 в положение «выкл».
- Опишите реакции, происходящие у электродов, и установите правильность обозначения клемм прибора.
Упражнение 3. Определение ощутимого тока, протекающего через ткань организма.
Дата добавления: 2016-10-30 ; просмотров: 897 | Нарушение авторских прав
источник





