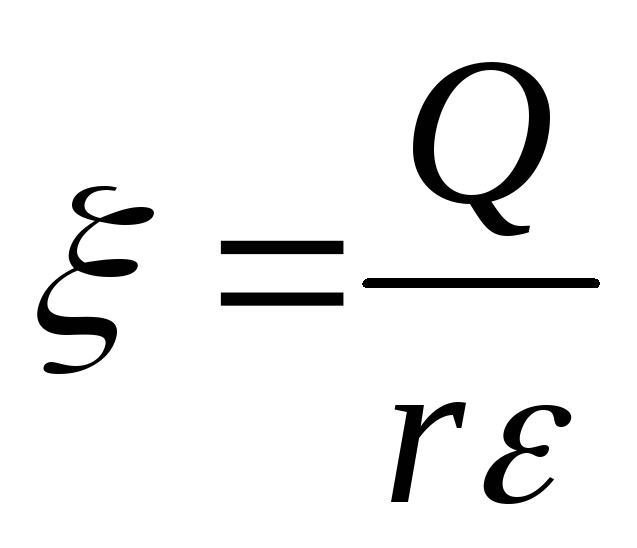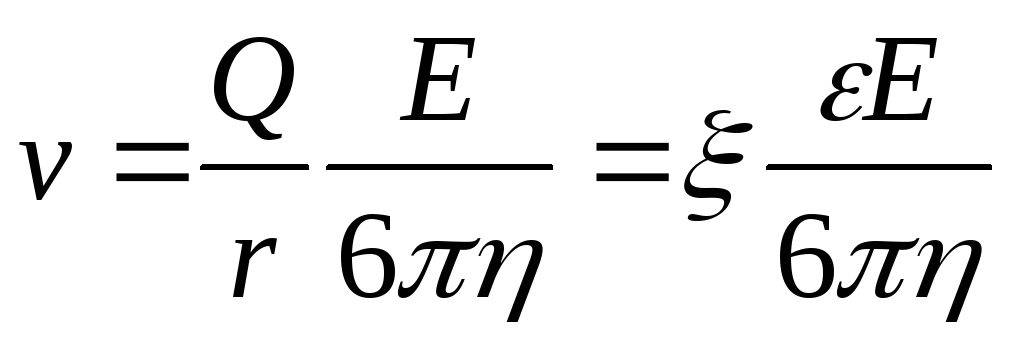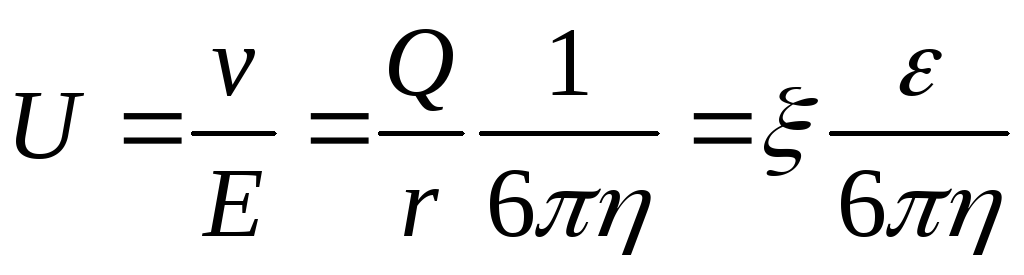Курс является частью большого практикума и предназначен для студентов III курса кафедры биохимии. В курсе рассматриваются общетеоретические вопросы электрофоретических и хроматографических методов исследования и приводятся примеры практического использования методов электрофореза для анализа белков и нуклеиновых кислот, а также анализируется использование методов электрофореза для исследования протеома.
Лекторы — заведующий кафедрой биохимии, чл.-корр. РАН, профессор, д.б.н. Н.Б. Гусев, доцент М.И. Сафронова
Время проведения: весенний семестр III курса
Продолжительность курса: 8 лекций
Форма отчетности: Зачет
Альтернативный курс: Нет
Лекция 1. Классификация различных электрофоретических методов разделения макромолекул (аналитически и препаративные методы разделения в электрическом поле, электрофорез со свободной границей, зональный электрофорез, вытеснительные методы электрофореза). Перемещение частицы в электрическом поле. Зависимость скорости перемещения от напряженности электрического поля, заряда частицы и силы трения, препятствующей перемещению. Частицы в электрическом поле. Зависимость скорости перемещении заряженной частицы от ее молекулярной массы и формы.
Лекция 2. Электрофорез с подвижной границей. Электрофоретический прибор Тизхелиуса и современные жидкостные сортировщики клеток. Различные виды зонального электрофореза. Бумажный электрофорез и разделение аминокислот и пептидов. Зависимость электрофоретической подвижности аминокислот от рК и рН. Условия разделения аминокислот и пептидов на бумаге. Используемые буферы и приборное оснащение. Электрофоретическое разделение мононуклеотидов на бумаге. Методы детекции аминокислот, пептидов и нуклеотидов при электрофорезе на бумаге. Электрофорез на нитроцеллюлозе.
Лекция 3. Электрофорез в крахмале, агарозе и полиакриламидном геле. Достоинства полиакриламидного геля. Строение и свойства акриламида, метиленбисакриламида, инициаторов и катализаторов полимеризации. Полимеризация с использованием персульфата аммония и рибофлавина. Зависимость пористости геля от концентрации мономеров и «сшивки». Механические и оптические свойства полиакриламидных гелей. Использование окислителей и восстановителей и специальных видов «сшивок» для деполимеризации гелей. Уравнение Фергюссона и его использование для определения молекулярной массы белков и их олигомерного состава. Гомогенные и гетерогенные (прерывистые) буферные системы, используемые для электрофоретического разделения белков. Диск-электрофорез при щелочных и кислых значениях рН. Использование ионных детергентов для электрофоретического определения молекулярной массы белков и пептидов. Додецилсульфат натрия и цетилтриметиламмоний бромид и их использование для определения кажущейся молекулярной массы белков. Факторы, влияющие на определение молекулярной массы с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, возможные артефакты и пути их преодоления. Сопоставление различных способов определения молекулярной массы с помощью электрофореза.
Лекция 4. Способы детекции белков в полиакриламидном геле (окрашивание анионными красителями Кумасси, амидовый черный, окрашивание универсальным красителем stains-all, окрашивание серебром). Способы электропереноса белков и пептидов на нитроцеллюлозные фильтры. Сухие и влажные блоттеры, состав буферных растворов, используемых для электропереноса. Детекция белков на нитроцеллюлозной мембране (красители, авидин-биотиновый метод, «окрашивание» антителами, окрашивание коллоидным золотом, использование радиоактивных изотопов для детекции катион-связывающих белков) Секвенирование белков, перенесенных на нитроцеллюлозные фильтры.
Капиллярный электрофорез. Приборное оснащение, влияние электроэндоосмоса. Различные варианты капиллярного электрофореза (зональный электрофорез, мицеллярная электрокинетическая хроматография, капиллярных электрофорез, использование изоэлектрофокусирования и изотахофореза в капиллярном электрофорезе)
Лекция 5. Использование методов электрофореза для решения задач современной протеомики. Одно- и двумерное электрофоретическое разделение белков. Элюция белков с геля и определение их молекулярной массы с помощью методов масс-спектроскопии. Различные виды масс-спектроскопии (MALDI и электроспрей). Гидролиз белков геле и разделение полученных пептидов методами масс-спектроскопии. Высокоэффективная жидкостная хроматография и масс-спектроскопия. Тандемная масс-спектроскопия и определение частичной и полной первичной структуры неизвестных белков. Изучение экспрессии различных белков на разных этапах жизнедеятельности клетки.
Лекция 6. Особенности электрофореза нуклеиновых кислот (размер молекулы, постоянство соотношения заряд/масса, высокая гибкость, наличие вторичной структуры). Пульсовый электрофорез. Разделение нуклеиновых кислот в агарозе. Электрофорез олигонуклеотидов в полиакриламидном геле. Принципы секвенирования нуклеиновых кислот. Эффективность определения первичной структуры белка по структуре гена.
Лекция 7. Изоэлектрофокусирование как один из методов вытеснительного электрофореза. Искусственные градиенты рН (градиенты рН, создаваемые с помощью градиента температуры или градиента неэлектролитов). Структура амфолинов и их свойства. Требования, предъявляемые к амфолинам. Препаративное и аналитическое изоэлектофокусирование, носители, используемые при проведении опытов по изоэлектрофокусированию. Роль электроэндоосмоса и катодный дрейф. Особенности окрашивания гелей после проведения изоэлектрофокусирования. Иммобилины и электрофокусирование на гелях с иммобилизованным градиентом рН. Изотахофорез. Принципы метода и его разрешающая способность. Управляющее уравнение Кольрауша и соотношение концентрации исследуемых веществ в разделяемых зонах. Техническое оснащение метода изотахофореза. Использование амфолинов для разделения зон веществ, фракционируемых при изотахофорезе. Разрешающая способность изотахофореза и сравнение процессов, происходящих при изотахофорезе, с процессами, происходящими при диск-электрофорезе.
версия для печати
Страница последний раз обновлялась 17.04.2018
источник
Для разделения белков сыворотки крови на их составляющие используют метод электрофореза, основанный на различной подвижности белков сыворотки крови в электрическом поле.
Принцип разделения белков сыворотки крови на фракции состоит в том, что в электрическом поле белки сыворотки крови движутся по смоченной буферным раствором хроматографической бумаге (ацетатцеллюлозной пленке, крахмаловому, агаровом гелям) со скоростью, зависящей в основном от величины электрического заряда и молекулярной массы частиц.
Вследствие этого белки сыворотки крови разделяются обычно на пять основных фракций: альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины, гамма-глобулины, содержание которых определяется с помощью фотометрии или денситометрии.
Электрофорез в агаровом, крахмальном и особенно полиакриламидном геле дает лучшие результаты: четкое разделение и большое количество белковых фракций сыворотки. Недостатки метода: сложность процедуры приготовления геля (дороговизна готовых гелевых пластин).
Преимущества электрофореза на ацетатцеллюлозной пленке:
1. Химическая однородность пленки и одинаковый размер пор
2. Требует малый объем пробы (0,2-2 мкл) для разделения
3. Быстрота разделения и окраски белков, легкость отмывания фона
В сыворотке крови здорового человека при электрофорезе можно обнаружить шесть белковых фракций: преальбумины, альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины и гамма-глобулины.
Это исследование в диагностическом отношении более информативно чем определение только общего белка или альбумина. При многих заболеваниях изменяется процентное соотношение белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы.
Анализ фореграммы белков позволяет установить, за счет какой фракции происходит увеличение или дефицит белка, а также судить о специфичности изменений, характерных для данной патологии. Исследование белковых фракций, позволяет судить о характерном для какого-либо заболевания избытке или дефиците белка только в самой общей форме.
Белковые фракции сыворотки крови в норме:
| Фракции | Содержание, % |
| Преальбумины | 2-7 |
| Альбумины | 52-65 |
| Альфа-1-глобулины | 2,5-5,0 |
| Альфа-2-глобулины | 7,0-13,0 |
| Бета-глобулины | 8,0-14,0 |
| Гамма-глобулины | 12,0-22,0 |
При анализе результатов исследования сыворотки крови на белковые фракции выявляются три типа нарушений:
1. Диспротеинемия (изменение соотношения белковых фракций)
2. Генетические дефекты синтеза белков
3. Парапротеинемия (аномальные белки в крови)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9336 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Этот анализ является исследованием, которое позволяет определить их количественные и качественные показатели по тому, как белки распределяются в электрическом поле. Исследование основано на том, что белковые молекулы несут заряды, положительные или отрицательные в зависимости от того, какой кислотностью будет обладать среда, в которой будет проводиться непосредственно электрофорез. Молекулы, которые окажутся положительно заряженными, будут адсорбироваться лучше, нежели чем те, которые несут отрицательный заряд.
Носителями, которые будут применяться для электрофореза, могут быть хроматографическая бумага, агаровый гель, полиакриловой гель, ацетатцеллюлозная бумага или акриловый гель. Значительно реже применяется капиллярный электрофорез.
Во время анализа белки разделяют на 5 или 6 фракций, в зависимости от применяемого метода. Это будут гамма-глобулины, которые делятся на бета-1 и бета-2, альбумины — альфа-1 и альфа-2, а также бета-глобулины.
Имеются установленные нормы белковых фракций, которые должны присутствовать в крови. Отклонение их от показателей является признаком нарушения в организме, что требует проведения обследования для выявления причины.
| Фракция | Норма в г/л |
|---|---|
| Альбумин | 35-44 |
| Глобулин альфа-1 | 1-3 |
| Глобулин альфа-2 | 5-8 |
| Бета-глобулин | 4-10 |
| Гамма-глобулин | 5-12 |
Значения показателей, в зависимости от того какие реактивы применяются в конкретной лаборатории, могут несколько изменяться. Поэтому в бланке результатов исследования в каждом медицинском учреждении обязательно указываются значения нормы, которые приняты в нем. На них будет ориентироваться врач при расшифровке анализа.
Электрофорез белков крови назначают не очень часто, так как сегодня современные лабораторные исследования позволяют провести анализ на определенный белок, что ускоряет процесс диагностики. Абсолютным показанием к электрофорезу является наличие монолокальной гаммапатии. Также иногда анализ может быть показан в таких случаях:
- чрезмерно высокая скорость оседания эритроцитов, когда она превышает 50 мм/ч;
- значительно повышенный уровень гамма-глобулинов;
- скрининговое обследование для контроля эффективности лечения миеломной болезни;
- чрезмерно высокий общий белок в крови;
- ряд аутоиммунных заболеваний, поражающих печень и почки;
- слабость, для которой нет выраженной причины;
- развитие патологических переломов костей и постоянные боли в костях;
- частые рецидивы инфекционных заболеваний;
- нарушения, обнаруженные в прочих анализах, указывающие на то, что у человека могут развиваться анемии, лейкемии, гиперкальциемия или гипоальбуминемия.
При общей диспансеризации и получении медицинских справок для трудоустройства данное исследование крови не осуществляется. Не требуется оно и в процессе подготовки человека к хирургическому вмешательству.
Для получения наиболее точных результатов рекомендуется соблюдение правил подготовки к анализу. Они включают в себя голодную диету в течение 15 часов до того как будет взята кровь, когда пациент может употреблять только чистую не газированную воду. За 90 минут до проведения исследования необходимо полностью исключить нагрузки как эмоциональные, так и физические, и курение в активной или пассивной форме. Чтобы не допустить искажение данных, забор материала не проводят сразу после того, как был осуществлен гемодиализ или проведена процедура, при которой использовались радиоконтрастные составы. Важно также, чтобы за несколько дней до исследования полностью было исключено лечение пенициллином, так как он вызывает расщепление амбулина, что исказит результат.
| Фракция | Повышение | Понижение |
|---|---|---|
| Амбулин | Злоупотребление алкоголем, период вынашивания ребёнка, дегидрация | Холецистит в острой форме, лейкоз, миелома, саркоидоз, пневмония, остеомиелит, системная красная волчанка, лимфома |
| Глобулин альфа-1 | Цирроз печени, стрессовые состояния, лимфогранулематоз, период вынашивания ребёнка, язва желудка, острое или хроническое воспаление | Гепатит вирусной природы в острой форме |
| Глобулин альфа-2 | Сахарный диабет, остеомиелит, гломерулонефрит в острой форме, стрессовые состояния, системная красная волчанка, узловатый полиартрит, цирроз | Гипертиреоз, гепатит вирусной природы в острой форме, гемолиз интраваскулярный |
| Бета-глобулин | Сахарный диабет, саркоидоз, ревматоидный артрит, беременность, гломерулонефрит, желтуха подпеченочная, нефротический синдром | Лейкоз, цирроз, склеродермия имеющая системный характер, лимфома, системная красная волчанка |
| Гамма-глобулин | Цирроз, склеродермия системного характера, ревматоидный артрит, лимфолейкоз в хронической форме, муковисцидоз, синдром Шегрена | Лейкоз, склеродермия, гепатит вирусной природы в острой форме, лимфома, гломерулонефрит |
Исказить показатели, кроме неправильной подготовки к проведению анализа, могут 2 фактора: недавно проведенная процедура гемодиализа, из-за которой произошло разрушение эритроцитов в крови, и повышенный уровень билирубина в организме. В любом из этих случаев потребуется пересдача анализа через некоторое время, которое определит врач.
источник
Электрофорез — это перемещение частиц дисперсной фазы в жидкой или газообразной среде под действием внешнего электрического поля. Впервые был открыт профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии. Этот метод находит широчайшее применение для разделения смесей биомолекул на фракции или индивидуальные вещества. Он используется в биохимии, молекулярной биологии, клинической диагностике, популяционной биологии.
В биохимии и молекулярной биологии электрофорез используется для разделения макромолекул — белков и нуклеиновых кислот, а также их фрагментов. Различают множество разновидностей этого метода.
Электрофорез белков — способ разделения смеси белков на фракции или индивидуальные белки. Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка и определения его молекулярной массы. Наиболее распространенным вариантом электрофоретического анализа белков, является электрофорез белков в полиакриламидном геле по Лэммли.
Существует множество разновидностей и модификаций данного метода, которые используются в различных областях:
электрофорез в свободных средах;
электрофорез с подвижной границей;
зональный электрофорез без поддерживающей среды;
зональный электрофорез в поддерживающей среде с капиллярной структурой;
электрофорез на фильтровальной бумаге;
электрофорез в колонках и блоках гранулированной поддерживающей среды;
Методы электрофореза белков подразделяются на одномерный и двумерный электрофорез, препаративный и аналитический, а также электрофорез нативных белков и электрофорез в присутствии детергента. Разновидностью метода электрофореза являются изоэлектрическое фокусирование и изотахофорез. В случае использования иммунологических методов для выявления разделённых белков говорят про иммуноэлектрофорез.
В начале 70-х годов было показано, что с помощью гель-электрофореза можно определить длину и чистоту молекул ДНК, а также разделить и выделить нужные фрагменты. Этот метод прост, так как каждый нуклеотид в молекуле нуклеиновой кислоты обладает отрицательным зарядом, который под действием приложенного электрического поля заставляет молекулы двигаться к положительному электроду. Чтобы разделить молекулы ДНК, исходя из их размера, электрофорез проводят в гелях. Были разработаны специальные гели, с помощью которых удается разделить фрагменты ДНК длиной до 500 нуклеотидов, отличающиеся всего лишь на несколько нуклеотидов.
Поскольку поры в полиакриламидном геле для больших молекул ДНК слишком малы, то для разделения молекул ДНК по размеру были разработаны специальные гели на основе агарозы (полисахарида, выделяемого из морских водорослей). Оба эти метода разделения ДНК (в полиакриламидном геле и агарозном геле) широко используются для аналитических и препаративных целей.
В 80-х годах была предложена модификация гель-электрофореза в агарозном геле, названная электрофорезом в пульсирующем электрическом поле или пульс-электрофорез. С ее помощью удается разделять очень большие молекулы ДНК. Обычный гель-электрофорез не позволяет разделить молекулы размером более 20000 пар оснований ввиду постоянства электрического поля, которое придает молекулам змеевидную конфигурацию. Обладающие такой конфигурацией молекулы движутся в гелях с постоянной скоростью вне зависимости от длины молекул. Если же направление электрического поля будет часто меняться, скорость движения молекул будет определяться их способностью переориентировываться согласно этому изменению. Такой процесс у больших молекул занимает значительно больше времени, вследствие чего они заметно будут отставать. Электрофорез проводится в камере, заполненной буферным раствором. Буфер необходим для повышения ионной силы раствора, в котором будет происходить разделение молекул ДНК. Он же используется для приготовления агарозного геля.
Электрофорез в агарозном геле – стандартный метод, используемый для разделения, идентификации и очистки фрагментов ДНК. С помощью этой простой техники можно быстро разделить такие смеси фрагментов ДНК, которые не могут быть разделены другими способами, например центрифугированием в градиенте плотности.
Кроме того, при разделении в геле прямо следят за положением ДНК, так как полосы ДНК в геле можно окрашивать флуоресцирующим в ДНК красителем – бромистым этидием в низкой концентрации. Просматривая прокрашенный гель в ультрафиолетовом свете, можно заметить даже 1 нг ДНК.
Скорость миграции ДНК через агарозный гель при электрофорезе определяется следующими пятью главными параметрами: размером молекул ДНК, конформацией ДНК, концентрацией агарозы, напряженностью электрического поля, используемым буфером.
Литература к теме 5:
- Березов Т.Т., Коровкин Б.Ф. Биологическая химия. 3-е изд., Москва : Медицина, 2007.
- Николаев, А. Я. Биологическая химия : учеб. / А. Я. Николаев. – 3-е изд., перераб. и доп. – М., 2007.
- Сова В.В.,Кусайкин М.И. Методическое пособие к практическим занятиям по очистке белков. Владивосток: Изд-во Дальневост. ун-та, 2006.
- Биохимия: Учеб. для вузов / Под ред. Е.С. Северина, Москва : ГЭОТАР-МЕД, 2003.
- Остерман Л.А. Методы исследования белков и нуклеиновых кислот. М.: МЦНМО, 2002.
- Гааль Э., Медьеши Г., Верецкеи Л. Электрофорез в разделении биологических макромолекул. М. Мир, 1982.
- Elliott. – Oxford : University Press, 2002.
- Michaux S., Pallisson J., Garles-Nurit M.-J, Bourg G., Allerdet-Servent A., Ramuz M. Presence of two independent chromosome in the Brucella melitensis 16 M genome // J. Bacteriol. 1993. V. 175. ‹ 3. P. 701–705.
Вопросы для самоконтроля.
- Что понимают под электрофорезом биологических молекул?
- В каких разделах биологических исследований применяется электрофрорез?
- Для каких целей в биологии используется электрофорез?
- Какие физические и химические механизмы лежат в основе электрофореза?
- Назовите используемые разновидности электрофореза биологических макромолекул.
- Для каких целей используют электрофорез белковых молекул?
- Охарактеризуйте методику электрофореза белков в полиакриламидном геле по Лэммли.
- Перечислите и охарактеризуйте разновидности и модификации методики электрофореза белков в полиакриламидном геле по Лэммли.
- Для каких целей используют электрофорез нуклеиновых кислот?
- В каких случаях используют электрофорез ДНК в полиакриламидном геле, а в каких случаях в агарозном геле?
- Охарактеризуйте метод электрофореза в пульсирующем электрическом поле.
- Опишите алгоритм проведения гель-электрофореза ДНК.
- Какими способами можно определить положение различных фрагментов ДНК в гелях после проведения электрофореза?
- Какими параметрами определяется скорость миграции ДНК в геле при электрофорезе?
ДНК (дезоксирибонуклеиновая кислота) – одна из важнейших для живых существ молекула, в которой содержится вся генетическая информация о них. Живое существо – это сложная система, а ДНК – это архив, в котором хранятся инструкции по созданию этой системы и ее функционированию. Молекулы ДНК есть в каждой клетке любого организма. Чтобы понять особенности функционирования клеток различных организмов, проводят исследование их ДНК, первым шагом которого является ее выделение и очистка. Впервые ДНК была выделена Ф. Мишером в1869 году.
Большая часть нуклеиновых кислот в клетках находится в соединении с белками. Поэтому, кроме разрушения клеточных оболочек гомогенизацией биологического материала, необходимо отделить нуклеиновые кислоты от белков. Этого можно достичь обработкой образца крепким раствором соли, например 10%-ным раствором NaCl. После удаления нерастворимой фазы нуклеиновые кислоты можно осадить из охлажденного до 0 0 С раствора этанолом или раствором трихлоруксусной кислоты. Осадок нуклеиновых кислот отделяют центрифугированием, тщательно промывают и высушивают.
Часто применяют фенольный метод выделения нуклеиновых кислот, с помощью которого можно получить нативные препараты. Для этого гомогенизированный охлажденный биологический материал заливают водонасыщенным раствором фенола. Полученную смесь перемешивают и центрифугируют. При этом содержимое центрифужной пробирки разделяется на четыре четко отличающихся друг от друга разных по консистенции и цвету слоя. В верхнем водном слое и подстилающем его вязком слое белого цвета находится основная масса нуклеиновых кислот. В третьем желеобразном прозрачном, желтоватом слое находится фенол с растворенными в нем белками. Четвертый, самый нижний, слой коричневого цвета содержит остатки ткани, денатурированные белки и мизерную примесь нуклеиновых кислот. Процесс выделения нуклеиновых кислот данным методом называют также фенольной депротеинизацией.
Освободить препараты, содержащие нуклеиновые кислоты от белка возможно и путем обработки их солевого экстракта двойным объемом смеси хлороформ-изоамиловый спирт. Далее смесь центрифугируют, отделяют верхнюю водную фазу, содержащую нуклеиновые кислоты. Их осаждают двойным объемом охлажденного этилового спирта.
Полученные суммарные препараты нуклеиновых кислот можно разделить на фракции, используя такие методы как хроматография, фильтрация через гели агарозы и сефарозы, распределение в двухфазных системах, ультрацентрифугирование и электрофорез.
Высокоэффективным методом разделения нуклеиновых кислот, является ультрацентрифугирование в градиенте плотности хлористого цезия. В этом случае высокая ионная сила буферного раствора в центрифужных пробирках способствует разрушению комплексов белков и нуклеиновых кислот, разделение макромолекул происходит на основании их различий в плавучей плотности. Перемещение макромолекул во время центрифугирования происходит до тех пор, пока они не достигнут зоны раствора CsCl с плотностью, равной их плавучей плотности. В этой зоне происходит их концентрирование. Метод центрифугирования в градиенте плотности CsCI в присутствии бромистого этидия используется в генной инженерии для получения плазмид в препаративных количествах. Он позволяет отделять суперскрученные молекулы ДНК от кольцевых и линейных, так как их плавучие плотности заметно различаются из-за разного количества молекул бромистого этидия, интеркалированного в эти топологические изомеры плазмидной ДНК. В целях обычного применения рекомбинантных ДНК, в том числе для молекулярного клонирования, построения рестрикционных карт и секвенирования, разработаны методы минипрепаративного выделения. В одном из них суперскрученные молекулы рекомбинантных плазмидных ДНК легко отделяются от линейных молекул хромосомной и плазмидной ДНК в процессе щелочной денатурации с последующей быстрой нейтрализацией раствора. При этом в основном успевают ренатурировать только суперскрученные молекулы ДНК, так как две их цепи остаются физически связанными друг с другом в процессе денатурации. Образовавшийся комплекс денатурированной ДНК и белков отделяется от плазмидной ДНК центрифугированием.
ДНК освобождаются от основной массы РНК переосаждением смеси нуклеиновых кислот в присутствии высокой концентрации LiCl. Также для освобождения препаратов ДНК от примесей РНК часто применяют высокоочищенные препараты РНКаз без примесей ДНКаз. После обработки смеси нуклеиновых кислот РНКазой, белковый компонент смеси удаляется с использованием смеси хлороформ-изоамиловый спирт (24:1). После последующего центрифугирования ДНК из отобранного верхнего водного слоя можно выделить осаждением охлажденным этанолом или изопропанолом.
- Охарактеризуйте роль ДНК в клетках живых организмов.
- В каком виде находится большая часть нуклеиновых кислот в клетках?
- Как разъединить нуклеиновые кислоты и белки в гомогенатах биологического материала?
- Охарактеризуйте фенольный метод выделения ДНК.
- Опишите хлороформ-изоамиловый метод выделения ДНК.
- Перечислите способы фракционирования смеси нуклеиновых кислот.
- Что называется фенольной депротеинизацией?
- Опишите метод разделения нуклеиновых кислот ультрацентрифугированием в градиенте плотности хлористого цезия.
- Перечислите методы минипрепаративного выделения и охарактеризуйте их.
- Какие приемы применяются для освобождения препаратов ДНК от примесей РНК?
- Для каких целей используют электрофорез ДНК?
источник
Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
· дробление биологического материала и разрушение клеточных мембран;
· фракционирование органелл, содержащих те или иные белки;
· экстракцию белков (перевод их в растворённое состояние);
· разделение смеси белков на индивидуальные белки.
Для разрушения биологического материала используют методы: гомогенизации (измельчения) ткани, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком. Наиболее трудоёмкий этап получения индивидуальных белков — их очистка от других белков, находящихся в растворе, полученном из данной ткани. Часто изучаемый белок присутствует в небольших количествах, составляющих доли процента от всех белков раствора.
Так как белки обладают конформационной лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах.
После достижения полной экстракции белков, т.е. перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Электрофорез – явление перемещения частиц коллоидных растворов под действием внешнего электрического поля.
Виды: электрофорез в жидкостях, на бумаге и в блоках (крахмальном, полиакриламидном и т.д.)
Электрофорез на бумаге осуществляется на листах (полосках) хроматографич. или фильтровальной бумаги, концы которой опущены в электродные камеры. Разделяемая смесь наносится на бумагу в виде пятна либо узкой зоны. По способу отведения теплоты, выделяющейся при прохождении через бумагу электрич. тока, используют приборы: с охлаждающими пластинами из изолирующих материалов; с охлаждающей несмешивающейся с водой орг. жидкостью (рис. 3), например керосином; с естеств. охлаждением бумаги на воздухе или во влажной камере.
В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. При электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций. Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций.
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) является общепринятым методом определения гомогенности белковых препаратов. Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na). Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики.
Электрофорез проводят в тонком слое полиакриламида. После завершения электрофореза, зоны белков выявляют c помощью красителя.
Дата добавления: 2015-11-05 ; просмотров: 1674 | Нарушение авторских прав
источник
В процессе проведения биохимического анализа при клинико-лабораторных исследованиях часто возникает необходимость предварительного выделения анализируемых веществ, отделения их от других компонентов, находящихся в исследуемом биологическом материале. Для этих целей чаще всего используются такие физико-химические методы, как электрофорез и хроматография.
Электрофорез. Под электрофорезом понимают процесс разделения заряженных частиц в электрическом поле. Многие биологически важные молекулы (белки, аминокислоты, нуклеиновые кислоты и др.) имеют в своем составе ионизирующие группы. Поэтому в биологических жидкостях (крови, лимфе и др.) они существуют в виде катионов и анионов. Помимо этого молекулы имеющие примерно одинаковый заряд могут отличаться молекулярными массами и отношением заряда к массе. На этих различиях и основано разделение ионов при движении их в растворе под действием электрического поля.
Скорость перемещения зависит от величины заряда, а также в ряде случаев, от размера и формы молекул. Так как в большинстве случаев молекулы отличаются по своим физическим и химическим свойствам то очень немногие из них имеют одинаковую электрофоретическую подвижность. Скорость движения частиц (см/с) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью.
В зависимости от способа проведения электрофореза его делят на свободный или фронтальный, когда электрофоретическое разделение осуществляется в водной фазе и зональный, т.е. электрофорез на поддерживающей среде, когда разделение осуществляется на каком-либо инертном носителе (бумага, асбестовые пластины, целлюлоза, агаровый, крахмальный и полиакриламидный гели и др.).
Суть зонального электрофореза заключается в том, что раствор смеси веществ подлежащих разделению вводят на определенный участок носителя, пропитанного электролитом. Биологический материал, подлежащий электрофоретическому разделению, растворяют или суспензируют в буфере, чтобы обеспечить проведение электрического тока, этим же буфером насыщают и носитель. В растворе между электродами ток обусловлен ионами буфера и образца, в остальной части цепи — электронами. После снятия электрического поля ионы исследуемой смеси распределятся в соответствии с их электрофоретической подвижностью.
В клинико-лабораторных исследованиях чаще используется зональный электрофорез на агаре или полиакриламидном геле. При наложении электрического поля частицы подлежащей разделению смеси придут в состояние направленного движения (будут двигаться к противоположно заряженному полюсу) и распределятся на носителе в виде отчетливых зон, которые легко обнаружить соответствующим аналитическим методом.
Важными характеристиками процесса зонального электрофореза являются градиент потенциала (В/см) и сила тока, приходящаяся на 1 см поперечного сечения полосы (плотность тока — мА/см).
Под градиентом потенциала понимают падение напряжения на 1 см носителя расположенного между электродами. В зависимости от градиента потенциала различают низковольтный электрофорез (5-15 В/см) и высоковольтный (более 50 В/см). Низковольтный электрофорез используется для разделения высокомолекулярных соединений типа белков, липопротеинов, гликопротеинов и др. Высоковольтный электрофорез используется для разделения низкомолекулярных веществ, типа аминокислот, их производных и др. Так как различие в заряде и молекулярной массе у таких веществ невелико, то нужен большой градиент потенциала, чтобы произошло эффективное разделение частиц. Так как при этом происходит значительное разогревание носителя, требуются специальные устройства для его охлаждения.
В зависимости от целей исследования электрофорез делят на аналитический и препаративный. В клинико-биохимических исследованиях используют обычно аналитический электрофорез, который позволяет работать с очень небольшими количествами исследуемого вещества и вести их количественное определение. В тех случаях, когда требуется получить большое количество изучаемого вещества, необходимого для дальнейших исследований используют препаративный вариант электрофореза.
В настоящее время для анализа биологических смесей все шире используется капиллярный электрофорез, при котором электрофоретическое разделение проводится в тонких капиллярах диаметром 25-200 мкм и длинной 10-100 см, заполненных буферным раствором. Под действием электрического поля (электрофорез проводится при напряжении 10000-30000 В) в капилляре создается электроосмотический поток, направленный к отрицательному полюсу, вместе с которым перемешаются и компоненты подлежащие разделению. В зависимости от заряда и массы скорость их движения будет различной, что приводит к фракционированию смеси. В концевой точке капилляра разделенные компоненты количественно определяют, используя различные оптические детекторы Близким к электрофорезу является метод изоэлектрического фокусирования, когда разделение белков и некоторых других анализируемых веществ идет в зависимости от величины их изоэлектрических точек.
Изоэлектрической точкой называют такое состояние белковой молекулы, при котором ее суммарный заряд равен нулю. В методе изоэлектрического фокусирования вначале между электродами устанавливают градиент рН с помощью веществ особой химической природы, получивших название амфолитов-носителей. Заряженные молекулы белков в ходе опыта будут двигаться в направлении противоположно заряженного электрода в соответствии с их действительным зарядом. Так как молекулы белков амфотерны, то при перемещении в градиенте рН их суммарный заряд будет меняться до тех пор, пока он не станет равным 0. Это произойдет в том месте, где величина рН будет равна изоэлектрической точке. Поэтому молекулы с одинаковой изоэлектрической точкой сконцентрируются в одной узкой зоне.
Хроматография. Это метод разделения и анализа многокомпонентных систем, основанный на использовании явлений сорбции и десорбции в динамических условиях. В процессе хроматографии происходит многократное повторение актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента. Вещество подвижной фазы непрерывно вступает в контакт с новым участком сорбента и частью сорбируется, а сорбированное вещество контактирует со свежими порциями подвижной фазы и частично десорбируется.
Методы хроматографического анализа различаются: по агрегатному состоянию системы, в которой проводится разделение на газовую и жидкостную: по механизму разделения — на адсорбционную, распределительную, ионообменную, гель-хроматографию, аффинную и др. В ряде случаев разделение оказывается результатом нескольких одновременно протекающих процессов с различными механизмами. Это приводит к образованию хроматограммы смешанного типа, но один из процессов всегда является доминирующим (рис. 9 и 10, см. стр. 20-21).
В газовой хроматографии подвижной фазой является газ. В зависимости от состояния неподвижной фазы газовая хроматография подразделяется на газо-адсорбционную, когда неподвижной фазой является твердый адсорбент и газо-жидкостную, когда неподвижной фазой является жидкость, или точнее пленка жидкости на поверхности частиц твердого адсорбента.
Жидкостная хроматография основана на адсорбции твердым веществом, играющим роль неподвижной фазы, определяемых компонентов, находящихся в растворенном состоянии.
В основе адсорбционной хроматографии лежит различная сорбируемость разделяемых веществ на твердом сорбенте в соответствии с их сродством к адсорбенту. При этом сорбируемость растворителя должна быть незначительной по сравнению с таковой анализируемой смеси. Процесс адсорбции зависит от свойства адсорбента, адсорбируемых соединений, растворителя. В зависимости от этих свойств вещества, подлежащие хроматографическому разделению, образуют адсорбционный ряд выражающий относительное адсорбционное сродство его членов к адсорбенту. Образующееся в колонке адсорбента зональное распределение веществ соответствует их положению в адсорбционном ряду. В качестве адсорбентов в адсорбционно-жидкостной хроматографии применяются органические и неорганические вещества: сахароза, крахмал, оксид алюминия, силикагель, активированный уголь и др.
Ионообменная хроматография основана на способности некоторых твердых веществ (ионитов) обмениваться ионами с подлежащими разделению веществами. Применяемые в ионообменной хроматографии иониты могут быть как органическими, так и неорганическими. Способность к ионному обмену определяется строением ионита, представляющего собой каркас, на котором закреплены активные группы (-СООН, -SO3H, — NH3Cl, -NH2Cl и др.). В зависимости от обмена катионов или анионов иониты делят на катиониты, аниониты и амфолиты. На принципах ионообменной хроматографии основано разделение аминокислот в аминокислотных анализаторах.
Распределительная хроматография основана на распределении компонентов разделяемой смеси между несмешивающимися фазами. Образующая неподвижную фазу жидкость находится на поверхности или в порах твердого носителя, на который наносится смесь веществ, подлежащих разделению. Затем создают ток подвижного растворителя. Чем лучше вещество растворимо в жидкости, играющей роль подвижной фазы, тем дальше оно продвинется по направлению тока растворителя. Вещества, плохо растворимые в подвижной фазе, расположатся ближе к точке нанесения. В зависимости от техники выполнения распределительная хроматография выполняется как колоночная, бумажная или тонкослойная. Методика распределительной хроматографии в колонках аналогична адсорбционной или ионообменной: вначале в колонку с носителем и закрепленным на нем неподвижной фазой вводят небольшой объем раствора смеси компонентов и затем промывают колонку подвижным растворителем.
При бумажной хроматографии разделение проводят на полосах бумаги, где роль неподвижной фазы играет вода, удерживаемая гидрофильными целлюлозными волокнами бумаги, а подвижной фазой является какой-либо органический растворитель. В каждый момент имеет место определенное перераспределение разделяемых компонентов между слоем органического растворителя и водой. В результате одни вещества движутся быстрее вслед за фронтом органического растворителя, другие в той или иной степени отстают, а некоторые вообще остаются на стартовой линии.
При тонкослойном варианте разделение идет в тонком слое носителя. Чаще всего для этих целей используются пластинки из силикагеля (например, Silufol) широко используемые для фракционирования липидов, аминокислот и других биосубстратов.
Гель-хроматография основана на различии в размерах и молекулярных массах белков и других макромолекул, являющихся важнейшей характеристикой молекулы. В качестве материала-носителя в гель- хроматографии используется сшитый декстран (сефадекс), сшитый полиакриламид (биогель Р) и агароза. Они получили широкое распространение как в аналитической, так и в препаративной лабораторной работе, а также в производстве, в химической и биологической промышленности.
Колонка с сефадексом действует по принципу «молекулярного сита». Молекулы большие, чем самые крупные поры разбухшего сефадекса не могут проникать в гранулы и сравнительно быстро проходят в жидкой фазе вне частиц геля, поэтому элюируются первыми. В настоящее время имеется большое число сефадексов, позволяющих разделить белки и полипептиды в диапазоне молекулярных масс от 700 до 800000 Да.
Были разработаны также хроматографические материалы для разделения белков, путем связывания некоторых ионообменных групп с сефадексами. Полученные производные-ДЭАЭ-сефадекс, КМ-сефадекс и другие широко используются при хроматографии.
Аффинная хроматография или (биоспецифическая по сродству хроматография), основана на принципе специфического взаимодействия с особыми веществами (лигандами), закрепленными на носителе. Биологические макромолекулы обладают способностью обратимо связывать многие вещества. Например, ферменты образуют комплексы с субстратами, антитела взаимодействуют с антигенами, мРНК с комплементарной ДНК и т. д. Все эти взаимодействия строго специфичны. Образование специфических комплексов биологических макромолекул, способных в определенных условиях к диссоциации лежит в основе метода разделения получившего название аффинной хроматографии. Если закрепить один из компонентов этого комплекса на матрице, иммобилизовать его, то получится специфический сорбент для второго компонента (аффинат). Нерастворимые аффинаты готовят обычно путем ковалентного присоединения лиганда к нерастворимому носителю. Если смесь белков пропустить через колонку, заполненную таким аффинатом, то все молекулы, которые не обладают сродством к лиганду, закрепленному на носителе пройдут не задерживаясь, а белок имеющий сродство к аффинному лиганду будет адсорбироваться на колонке. Вымыть адсорбированный белок с колонки можно буферными смесями с измененной величиной рН, ионной силой, а также введением в состав элюента веществ, ослабляющих связи между белками и лигандами.
Одними из первых биоспецифических сорбентов, были антигены ковалентно связанные с нерастворимым носителем. Они были использованы для получения моноспецифических антител. Затем аналогичным путем были получены иммобилизованные ферменты. Стало возможным создание ферментных реакторов для получения различных веществ с использованием иммобилизованных ферментов.
источник
Курс является частью большого практикума и предназначен для студентов III курса кафедры биохимии. В курсе рассматриваются общетеоретические вопросы электрофоретических и хроматографических методов исследования и приводятся примеры практического использования методов электрофореза для анализа белков и нуклеиновых кислот, а также анализируется использование методов электрофореза для исследования протеома.
Лекторы — заведующий кафедрой биохимии, чл.-корр. РАН, профессор, д.б.н. Н.Б. Гусев, доцент М.И. Сафронова
Время проведения: весенний семестр III курса
Продолжительность курса: 8 лекций
Форма отчетности: Зачет
Альтернативный курс: Нет
Лекция 1. Классификация различных электрофоретических методов разделения макромолекул (аналитически и препаративные методы разделения в электрическом поле, электрофорез со свободной границей, зональный электрофорез, вытеснительные методы электрофореза). Перемещение частицы в электрическом поле. Зависимость скорости перемещения от напряженности электрического поля, заряда частицы и силы трения, препятствующей перемещению. Частицы в электрическом поле. Зависимость скорости перемещении заряженной частицы от ее молекулярной массы и формы.
Лекция 2. Электрофорез с подвижной границей. Электрофоретический прибор Тизхелиуса и современные жидкостные сортировщики клеток. Различные виды зонального электрофореза. Бумажный электрофорез и разделение аминокислот и пептидов. Зависимость электрофоретической подвижности аминокислот от рК и рН. Условия разделения аминокислот и пептидов на бумаге. Используемые буферы и приборное оснащение. Электрофоретическое разделение мононуклеотидов на бумаге. Методы детекции аминокислот, пептидов и нуклеотидов при электрофорезе на бумаге. Электрофорез на нитроцеллюлозе.
Лекция 3. Электрофорез в крахмале, агарозе и полиакриламидном геле. Достоинства полиакриламидного геля. Строение и свойства акриламида, метиленбисакриламида, инициаторов и катализаторов полимеризации. Полимеризация с использованием персульфата аммония и рибофлавина. Зависимость пористости геля от концентрации мономеров и «сшивки». Механические и оптические свойства полиакриламидных гелей. Использование окислителей и восстановителей и специальных видов «сшивок» для деполимеризации гелей. Уравнение Фергюссона и его использование для определения молекулярной массы белков и их олигомерного состава. Гомогенные и гетерогенные (прерывистые) буферные системы, используемые для электрофоретического разделения белков. Диск-электрофорез при щелочных и кислых значениях рН. Использование ионных детергентов для электрофоретического определения молекулярной массы белков и пептидов. Додецилсульфат натрия и цетилтриметиламмоний бромид и их использование для определения кажущейся молекулярной массы белков. Факторы, влияющие на определение молекулярной массы с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, возможные артефакты и пути их преодоления. Сопоставление различных способов определения молекулярной массы с помощью электрофореза.
Лекция 4. Способы детекции белков в полиакриламидном геле (окрашивание анионными красителями Кумасси, амидовый черный, окрашивание универсальным красителем stains-all, окрашивание серебром). Способы электропереноса белков и пептидов на нитроцеллюлозные фильтры. Сухие и влажные блоттеры, состав буферных растворов, используемых для электропереноса. Детекция белков на нитроцеллюлозной мембране (красители, авидин-биотиновый метод, «окрашивание» антителами, окрашивание коллоидным золотом, использование радиоактивных изотопов для детекции катион-связывающих белков) Секвенирование белков, перенесенных на нитроцеллюлозные фильтры.
Капиллярный электрофорез. Приборное оснащение, влияние электроэндоосмоса. Различные варианты капиллярного электрофореза (зональный электрофорез, мицеллярная электрокинетическая хроматография, капиллярных электрофорез, использование изоэлектрофокусирования и изотахофореза в капиллярном электрофорезе)
Лекция 5. Использование методов электрофореза для решения задач современной протеомики. Одно- и двумерное электрофоретическое разделение белков. Элюция белков с геля и определение их молекулярной массы с помощью методов масс-спектроскопии. Различные виды масс-спектроскопии (MALDI и электроспрей). Гидролиз белков геле и разделение полученных пептидов методами масс-спектроскопии. Высокоэффективная жидкостная хроматография и масс-спектроскопия. Тандемная масс-спектроскопия и определение частичной и полной первичной структуры неизвестных белков. Изучение экспрессии различных белков на разных этапах жизнедеятельности клетки.
Лекция 6. Особенности электрофореза нуклеиновых кислот (размер молекулы, постоянство соотношения заряд/масса, высокая гибкость, наличие вторичной структуры). Пульсовый электрофорез. Разделение нуклеиновых кислот в агарозе. Электрофорез олигонуклеотидов в полиакриламидном геле. Принципы секвенирования нуклеиновых кислот. Эффективность определения первичной структуры белка по структуре гена.
Лекция 7. Изоэлектрофокусирование как один из методов вытеснительного электрофореза. Искусственные градиенты рН (градиенты рН, создаваемые с помощью градиента температуры или градиента неэлектролитов). Структура амфолинов и их свойства. Требования, предъявляемые к амфолинам. Препаративное и аналитическое изоэлектофокусирование, носители, используемые при проведении опытов по изоэлектрофокусированию. Роль электроэндоосмоса и катодный дрейф. Особенности окрашивания гелей после проведения изоэлектрофокусирования. Иммобилины и электрофокусирование на гелях с иммобилизованным градиентом рН. Изотахофорез. Принципы метода и его разрешающая способность. Управляющее уравнение Кольрауша и соотношение концентрации исследуемых веществ в разделяемых зонах. Техническое оснащение метода изотахофореза. Использование амфолинов для разделения зон веществ, фракционируемых при изотахофорезе. Разрешающая способность изотахофореза и сравнение процессов, происходящих при изотахофорезе, с процессами, происходящими при диск-электрофорезе.
версия для печати
Страница последний раз обновлялась 17.04.2018
источник
В биохимии широко применяют диализ, центрифугирование, оптические методы, различные виды хроматографии и др.
В основу абсорбционной спектроскопии положен принцип измерения поглощения света, проходящего сквозь раствор исследуемого вещества, вследствие его абсорбции. Измерение спектров осуществляют на специальных спектральных аппаратах, в которых пробу вещества помещают между источником света и фотоэлементом, регистрирующим свет. Каждое вещество имеет характерный свет поглощения. Для аналитических целей используют длину волны, соответствующую максимуму поглощения исследуемого соединения (λmax).
Фотоэлектроколориметрия – это измерение поглощения видимой части спектра окрашенными растворами.
Собственно спектрофотомерия – это измерение поглощения (пропускания) прозрачных растворов в ультрафиолетовой, видимой и инфракрасной зонах спектра (220-1100 нм).
Нефелометрия – метод измерения интенсивности рассеянного света.
К приборы, базирующимся на измерении светопоглощения веществ, относятся фотоэлектроколориметры (ФЭК) и спектрофотометры (СФ). ФЭК позволяют проводить измерения поглощения в видимой части спектра. СФ дают возможность проводить измерения в широком диапазоне длин волн – от ультрафиолетового до инфракрасного (210-1100 нм) и исследовать окрашенные и бесцветные растворы в узкой зоне спектра, на участке максимального поглощения монохроматического потока света.
В основе абсорбционной спектрофотометрии лежат общие принципы способности веществ поглощать световую энергию по законом Бугера-Ламберта и Бера: D = k c d;
где D – оптическая плотность раствора;
k – молярный коэффициент поглощения (экстинкция), который равен оптической плотности 1 М раствора при толщине слоя в 10 мм;
с – концентрация раствора, моль/л;
d – толщина слоя жидкости, см.
Явление электрофореза – это перемещение заряженных частиц в электрическом поле.
Поведение частицы в электрическом поле описывается тремя основными характеристиками: скоростью движения частицы v, электрокинетическим потенциалом и электрофоретической подвижностью U. -потенциал прямо пропорционален свободному (не скомпенсированному ионами среды) заряду частицы (Q) и обратно пропорционален ее радиусу (r). Скорость заряженной частицы прямо пропорциональна -потенциалу. Электрофоретическая подвижность U равна отношению скорости частицы к напряжению электрического поля.
где Е – напряженность электрического поля, В/см;
– диэлектрическая постоянная среды,
Наиболее часто метод используют для аналитических целей – для разделения смеси заряженных веществ на фракции с последующим качественным и количественным их определением. Таким способом удается разделить, например, белки сыворотки крови на 5 фракций: альбумин и 4 фракции глобулинов. Эту задачу часто решают в клинической биохимии, так как соотношение фракций закономерно изменяется при многих патологических процессах.
Метод подразделяется на фронтальный или свободный электрофорез (электрофорез в жидкой среде) и зональный или электрофорез в поддерживающих средах. В качестве поддерживающих сред применяются различные инертные пористые природные либо синтетические материалы: бумага, ацетилцеллюлоза, крахмал в виде влажных зерен и в виде геля, гель агара либо агарозы, полиакриламидный синтетический гель – ПААГ. Задача поддерживающей среды – стабилизировать жидкость, уменьшить диффузию, а в ряде случаев – создать дополнительный механизм разделения. Например, в некоторых вариантах метода разделение по электрофоретической подвижности можно сочетать с разделением по молекулярной массе (наилучшим образом это достигается в ПААГ).
Одной из высокоразрешающих разновидностей метода является диск-электрофорез (от английского «discontinuos» — прерывистый, неоднородный). В этом методе движение молекул проходит вначале через концентрирующий крупнопористый гель, где разделяемая смесь концентрируется благодаря движению между 2-мя сортами ионов. Движущиеся впереди пробы ведущие ионы (принадлежат сильному электролиту) и находящиеся позади пробы замыкающие ионы (принадлежат слабому электролиту) создают разную напряженность поля по обе стороны зоны, занятой пробой. Вследствие этого «фронт» пробы тормозится, а «тыл», напротив, подгоняется. Таким путем достигается эффект концентрирования. Затем проба переходит в разделяющий гель с иным значением рН буферного раствора. Вследствие изменения рН (а значит, и степени диссоциации слабого электролита) замыкающие ионы опережают пробу, которая перемещается теперь на фоне замыкающих ионов — оказывается в однородной по рН мелкопористой среде. В этом втором, разделяющем геле происходит обычный электрофорез. Повышение разрешающей способности метода достигается за счет того, что перед разделением проба концентрируются в виде очень узкой стартовой зоны, и таким образом удается разделить даже вещества, мало отличающиеся друг от друга по свойствам.
Хроматографические методы основаны на динамическом разделении смеси веществ. Общий принцип хроматографии состоит в том, что непрерывный поток подвижной фазы, содержащей анализируемый образец, направленно проходит через стационарную фазу, которая в зависимости от своей природы, взаимодействует в различной степени с компонентами образца.
Распределение соединения между двумя несмешивающимися фазами определяется коэффициентом распределения, который для каждого конкретного вещества в системе из двух фаз при данной температуре постоянен и выражается отношением концентрации вещества в подвижной фазе к его концентрации в стационарной фазе. Фазы для хроматографического разделения выбирают так, чтобы коэффициенты распределения компонентов смеси в них были различными.
В зависимости от агрегатного состояния подвижной фазы хроматографические методы делят на газовую и жидкостную хроматографию; в зависимости от геометрической формы стационарной фазы – на колоночную и плоскостную (бумажную или тонкослойную).
В зависимости от механизма разделения веществ выделяют следующие виды хроматографии:
Адсорбционная хроматография основана на различной адсорбируемости компонентов разделяемой смеси на поверхности раздела фаз. Эти различия связаны главным образом с различиями в дипольных моментах (в полярности) разделяемых веществ, а также подвижной и неподвижной фаз хроматографической системы. Так, из полярной подвижной фазы на неполярном адсорбенте лучше адсорбируются неполярные вещества. Примером неполярного адсорбента может служить активированный уголь, сажа; полярного – окислы металлов, гидроокиси, некоторые соли, силикагель, полисахариды.
Абсорбционная или распределительная хроматография основана на различной абсорбируемости (поглощении всем объемом стационарной жидкой фазы, растворимости в ней) компонентов разделяемой смеси. В основе метода также лежит соотношение дипольных моментов разделяемых веществ и компонентов хроматографической системы. Примером распределительной хроматографии может служить разделение аминокислот в системе бутанол-вода либо фенол-вода. Стационарная полярная фаза – вода — удерживается инертным пористым твердым телом – бумагой, силикагелем и т.п.. Бутанол – неполярная подвижная фаза содержит компоненты разделяемой смеси и движется относительно воды, удерживаемой твердой пористой подложкой.
Хемосорбционные методы основаны на использовании хемосорбции. Наиболее распространенным из них является ионообменный метод, в котором используются различия в константах диссоциации разделяемых веществ-электролитов. Разделяемые вещества в виде катионов или анионов обратимо обмениваются на катионы или анионы, содержащиеся в стационарной твердой фазе (катионите или анионите, соответственно). Подвижная фаза – полярный растворитель (обычно буферный или солевой водный раствор). В качестве твердого пористого тела, содержащего прикрепленные к нему обмениваемые ионы, служат природные или синтетические полимеры – ионообменные смолы (целлюлоза, декстран, агароза, полиакриламид, полистирол).
Гель-хроматография или молекулярно-ситовая хроматография основана на разделении веществ в соответствии с их размерами (молекулярными массами). В этом методе используются те же пористые тела, что служат основой для ионообменной хроматографии, но без прикрепленных к ним ионогенных групп. Материал стационарной фазы представляет собой сферические гранулы определенного размера, внутри которых имеются поры. Размер пор также стандартен и выбирается так, чтобы обеспечить хорошую разрешающую способность метода. Наиболее крупные молекулы не могут проникнуть во внутренние мелкие поры и передвигаются только по промежуткам между гранулами. Они идут с наибольшей скоростью. Более мелкие частицы движутся с разными скоростями, в зависимости от того, какая доля объема внутренних пор доступна для них в соответствии с их размерами. Медленнее всех движутся самые мелкие молекулы.
Аффинная хроматография. Метод основан на специфическом сродстве (affinity) некоторых биологически активных веществ друг к другу. Один из партнеров – аффинант – обездвиживают (иммобилизуют) на твёрдой пористой подложке, вместе с которой он образует стационарную фазу. Второй партнер содержится в подвижной фазе. Аффинная хроматография позволяет выделить его из смеси любой степени сложности. Так, при пропускании через крахмал был выделен из панкреатического сока только один из его компонентов – фермент амилаза, для которого крахмал является субстратом. Наиболее распространенные пары веществ: фермент и субстрат, фермент и ингибитор, фермент и кофермент, антитело и антиген, рецептор и сигнальная молекула, транспортный белок и транспортируемое им вещество, комплементарные друг другу нуклеотиды. В связи с чем аффинная хроматография широко используется для очистки антигенов и антител, гормонов, рецепторов, транспортных белков, ферментов и т.п.
Разделение и исследование веществ с помощью центрифугирования основано на разной скорости оседания (седиментации) в центробежном поле частиц, имеющих разную плотность, форму или размеры.
Коэффициент седиментации зависит от молекулярной массы и формы частицы, а также от плотности и вязкости среды выделения, что используется для определения молекулярной массы.
Простейшая задача центрифугирования заключается в отделении осаждённых веществ от растворов как этап выполнения аналитических работ. Например, отделение белков от других органических соединений после осаждения. Подбирая скорости центрифугирования и определенные среды выделения, можно избирательно осаждать разные клеточные структуры: ядра, митохондрии, лизосомы, рибосомы, эндоплазматический ретикулум.
Основаны на способности нестабильных радиоизотопов испускать частицы или электромагнитное излучение, которые фиксируются специальными методами.
Основными преимуществами методов с применением радиоизотопных меток являются их чувствительность и возможность вводить метки в живой организм, что позволяет исследовать метаболические превращения, механизмы и скорости поглощения и переноса веществ в интактном организме, возраст биологических образцов.
источник