Здесь— значение электрич. потенциала на расстоянии от пов-сти, где скорость течения жидкости обращается в нуль (т. наз. плоскость скольжения).
Распределение потенциала в двойном электрическом слое; х — расстояние от пов-сти.
На больших расстояниях от пов-сти Ф(х) 0 и скорость течения вне пределов диффузной части ДЭС оказывается постоянной:
Эта постоянная величина наз. скоростью электроосмотич. скольжения. Такое назв. было введено потому, что для толщин ДЭС, много меньших характерных размеров капилляров с электролитом или твердых частиц дисперсной фазы, течение выглядит как скольжение жидкости вдоль твердой пов-сти со скоростью иs.
Параметр наз. дзета-потенциалом (-потенциалом), является осн. характеристикой электрокинетических явлений. В реальных системах вязкость и диэлектрич. проницаемость жидкости зависят от расстояния до твердой пов-сти, однако и в этих случаях скорость электроосмотич. скольжения также можно представить в виде выражения (2), но интерпретация параметра усложняется, поскольку он несет в себе информацию не только о распределении электростатич. потенциала в диффузной части ДЭС, но и об особенностях структуры и реологич. поведения жидкости в граничных слоях. Несмотря на сложность интерпретации-потенциала, он является одной из важнейших характеристик жидких коллоидных систем. Его значение и характер изменения при варьировании параметров электролита, адсорбции на пов-сти разл. в-в и т. п. позволяет судить о структуре граничных слоев, особенностях взаимод. компонентов р-ра с пов-стью, заряде пов-сти и т.д. Кроме того, выражение (1) для скорости электроосмотич. скольжения справедливо для капилляров произвольной геометрии при условии, что толщина ДЭС мала в сравнении с радиусом капилляра.
В капиллярнопористых телах, мембранах, горных породах, почвах и др. связнодисперсных системах, характеризующихся твердым каркасом и системой открытых пор, заполненных р-ром электролита, граничные слои жидкости с измененными св-вами составляют значит. долю от объемной фазы. В этих условиях электрокинетические явления тесно связано с адсорбцией ионов, для отражения этой связи часто пользуются термином «электроповерхностные явления».
Э лектрокинетическое явление, обратное электроосмосу,- возникновение потенциала течения — удобно рассмотреть на примере проницаемой мембраны, разделяющей резервуары с электролитом. При наложении перепада давления и течения жидкости под действием этого перепада с расходом V появляется электрич. ток через мембрану. Природа этого тока — увлечение ионов подвижной части ДЭС. Поскольку в диффузной части ДЭС имеется избыток ионов одного знака, возникает конвективный перенос заряда по порам мембраны, т. е. через мембрану течет ток. Если к резервуарам, разделенным мембраной, не подводятся электрич. заряды, то по одну сторону мембраны будут накапливаться положит, заряды, а по другую — отрицательные. Накопление зарядов в резервуарах приводит к появлению разности потенциалов между ними и протеканию электрич. тока I во всем объеме электролита в порах мембраны; направление тока противоположно конвективному переносу зарядов. Накопление зарядов в резервуарах и увеличение разности потенциалов между ними будет происходить до тех пор, пока не произойдет полной компенсации конвективного тока. Этому стационарному состоянию отвечает разность потенциалов к-рая наз. потенциалом течения.
Электроосмос и электрич. ток через мембрану (возникновение потенциала течения) — перекрестные явления, связанные феноменологич. ур-ниями в рамках термодинамики необратимых процессов. Расход V и ток I связаны с перепадом давления и электростатич. потенциалом на торцах мембраны ур-ниями:
где кинетич. коэф. L11, L12, L2l и L22 характеризуют соотв. гидродинамич. проницаемость мембраны, скорость электроосмотич. течения, ток течения и уд. электропроводность электролита в мембране. Кинетич. коэффициенты удовлетворяют соотношению Онсагера: L12 = L2l. Ур-ния (3) и соотношения Онсагера устанавливают простую связь между электроосмосом и потенциалом течения:
Отношение носит назв. электроосмотич. переноса. Оно является одной из осн. характеристик разделит. мембран (см. Мембранные процессы разделения). В случае тонких ДЭС это отношение м. б. легко рассчитано для мембран с произвольной геометрией пор. На основе подобия распределений электрич. полей и скоростей электроосмотич. течения установлено след. соотношение:
где— уд. электрич. проводимость электролита.
Электрофоретич. движение частиц в электролите имеет родственную электроосмосу природу: внеш. электрич. поле увлекает ионы подвижной части ДЭС, заставляя слои жидкости, граничащие с частицами, перемещаться относительно пов-сти частиц. Однако в силу массивности объема жидкости и малости взвешенных частиц эти перемещения сводятся в отсутствие внеш. сил к движению частицы в покоящейся жидкости. Для непроводящих частиц с плоской пов-стью в системах с тонкой диффузной частью ДЭС скорость электрофореза совпадает со скоростью электроосмотич. скольжения, взятой с обратным знаком. Для проводящих сферич. частиц скорость электрофореза м. б. рассчитана по ур-нию:
где— уд. электрич. проводимость частицы. В этом ур-нии учитываются особенности искажения силовых линий электростатич. поля в окрестности проводящей частицы. С увеличением толщины диффузной части ДЭС скорость электрофореза начинает зависеть от отношения дебаевского радиуса к диаметру частицы. В общем случае эта зависимость имеет довольно сложный характер.
Эффект Дорна связан с конвективным переносом ионов диффузной части ДЭС при движении частицы в электролите. Конвективные потоки ионов поляризуют двойной слой, и частицы в целом приобретают дипольный момент. При этом силовые линии электрич. поля выходят за пределы двойного слоя. При движении в электролите ансамбля частиц с диполь-ными моментами, имеющими одну и ту же ориентацию, порождаемые этими моментами электрич. поля складываются и в системе возникает однородное электрич. поле, направленное параллельно (или антипараллельно) скорости движения частиц (группу движущихся с одинаковой скоростью частиц можно рассматривать как своеобразную мембрану, сквозь к-рую протекает электролит). Если частицы движутся в пространстве между двумя электродами, то на последних возникает разность потенциалов, к-рая м. б. измерена. В частном случае осаждения ансамбля частиц под действием сил гравитации эта разность потенциалов наз. потенциалом оседания (седиментац. потенциалом).
Электрофорез и эффект Дорна м. б. описаны парой феноменологич. ур-ний неравновесной термодинамики с кинетич. коэф. l11, l12, l21 и l22:
где v — скорость движения частицы; F — действующая на нее сила; Е — напряженность внеш. электрич. поля; М — индуцированный на частице дипольный момент. Кинетич. коэф., определяющие скорость электрофореза и дипольный момент в эффекте Дорна, удовлетворяют соотношению Онсагера:
Исторический очерк. Электроосмос и электрофорез были открыты Ф. Ф. Рейссом в 1809, к-рый наблюдал вызванное внеш. электрич. полем перемещение жидкости в U-образной трубке, перегороженной в ниж. части мембраной из кварцевого песка, и движение глинистых частиц в покоящейся жидкости при наложении электрич. поля. Г. Видеман установил (1852), что скорость электроосмотич. течения пропорциональна силе тока и отношение не зависит от площади сечения и толщины мембраны.
В 1859 Г. Квинке предположил, что должно иметь место явление, обратное электроосмосу, и наблюдал возникновение потенциала течения на мембранах разл. природы, а в 1880 Э. Дорн обнаружил возникновение разности потенциалов в трубке, заполненной водой, при центрифугировании в ней суспензии кварца.
Разл. аспекты теории электрокинетических явлений были предложены Г. Гельмгольцем (1879) для простейшей модели ДЭС как мол. конденсатора, затем М. Смолуховским (1906) для случая протяженного ДЭС. Именно Смолуховский вывел ф-лу для расчета скорости электрофореза и дал количеств, теорию седиментационного потенциала. Ему же удалось выяснить сущность отличия термодинамич.-потенциала (см. Межфазные скачки потенциала)от электрокинетич.-потенциала.
В разное время были предложены теор. расчеты скорости электрофореза для частиц, размеры к-рых меньше толщины ДЭС (Э. Хюккель, 1924), для проводящих частиц произвольного размера (Д. Генри, 1931), с учетом поляризации ДЭС внеш. полем (М. Овербек, 1943). Применение методов термодинамики неравновесных явлений к изучению электрокинетических явлений развили Б. В. Дерягин и С. С. Духин (1966).
Практическое применение. Электроосмос используют для обезвоживания пористых тел — при осушке стен зданий, сыпучих материалов и т. п., а также для пропитки материалов. Все шире применяют электроосмотич. фильтрование, сочетающее фильтрование под действием приложенного давления и электроосмотич. перенос жидкости в электрич. поле. Использование электрофореза связано с нанесением покрытий на детали сложной конфигурации, для покрытия катодов электроламп, полупроводниковых деталей, нагревателей и т. п. Этот метод применяется также для фракционирования полимеров, минеральных дисперсий, для извлечения белков, нуклеиновых к-т. Лекарств, электрофорез — метод введения в организм через кожу или слизистые оболочки разл. лек. средств. Эффект возникновения потенциала течения используется для преобразования мех. энергии в электрическую в датчиках давления.
Лит.: Кройт Г., Наука о коллоидах, пер. с англ., М., 1955; Духин С. С., Дерягин Б.В., Электрофорез, М., 1976; Ньюмен Дж., Электрохимические системы, пер. с англ., М., 1977.
источник
Федеральное Агентство по образованию РФ
ШАХТИНСКИЙ ИНСТИТУТ (ФИЛИАЛ)
ТЕХНИЧЕСКОГО УНИВЕРСИТЕТА (НПИ)
на тему: «Электрофорез и электроосмос»
К защите Защита принята с оценкой «__»__________2008 г. ________________________
___________________ «__»____________ 2008 г.
В данном реферате рассматриваются общие сведения о дисперсных системах, электрокинетические явления в них, в частности электрофорез и электроосмос, основные понятия, формулы. Также практическое применение электрокинетических явлений в науке и технике.
1 Электрокинетические явления
2 Практическое применение электрокинетических явлений
Список используемых источников
Дисперсные системы. Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 – 0,1 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2 – 0,1мм до 400 – 300 нм*, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии. Постепенно складывались представления о том, что миром молекул и микроскопически видимых частиц находится область раздробленности вещества с комплексом новых свойств, присущих этой форме организации вещества.
Представим себе кубик какого-либо вещества, который будем разрезать параллельно одной из его плоскостей, затем полученные пластинки начнем нарезать на палочки, а последние на кубики. В результате такого диспергирования (дробления) вещества получаются плёночно-, волокнисто- и корпускулярнодисперсные (раздробленные) системы. Если толщина пленок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа, то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400 – 300 нм до 1 нм – коллоидным состоянием вещества.
1. Электрокинетические явления
Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания). Перенос коллоидных частиц в электрическом поле называется электрофорезом, а течение жидкости через капиллярные системы под влиянием разности потенциалов – электроосмосом. Оба эти явления были открыты профессором Московского университета Ф. Ф. Рейссом в 1809 г.
Рейсс поставил два эксперимента. В одном из них он использовал U-образную трубку, перегороженную в нижней части диафрагмой из кварцевого песка и заполненную водой. При наложении электрического поля он обнаружил движение жидкости в сторону отрицательно заряженного электрода. Происходящее до тех пор, пока не устанавливалась определенная разность уровней жидкости (равновесие с гидростатическим давлением). Поскольку без диафрагмы движение жидкости отсутствовало, то последовал вывод о заряжении жидкости при контакте с частицами кварца. Явление получило название электроосмоса.
В другом эксперименте Ф. Ф. Рейсс погрузил в глину две стеклянные трубки, заполнил их водой и после наложения на них электрического поля наблюдал перемещение частиц глины в жидкости в направлении положительно заряженного электрода. Это был электрофорез. Таким образом, было обнаружено, что частицы имеют заряд, противоположный заряду жидкости.
Первые количественные исследования электроосмоса были выполнены Видеманном (1852). Он показал, что объёмная скорость υ электроосмоса пропорциональна силе тока I при прочих фиксированных параметрах, а отношение υ/I не зависит от площади сечения и толщены диаграммы.
В 1859 г. Квинке показал, что существует явление, обратное электроосмосу, т. е. при течении жидкости через пористое тело под влиянием перепада давлений возникает разность потенциалов. Возникновение разности потенциалов Квинке наблюдал при течении воды и водных растворов через разнообразные пористые материалы (глина, дерево, песок, графит и др.). Это явление получило название потенциала течения (или протекания). Позже было установлено, что потенциал течения не зависит от размера диаграммы, количества фильтруемой жидкости, но, как и при электроосмосе, пропорционален объёмной скорости фильтрации.
Количественное исследование эффекта, обратного электрофорезу, впервые было выполнено Дорном в 1878 г. Он измерял возникающую разность потенциалов при седиментации частиц суспензии кварца в центробежном поле. Явление возникновения разности потенциалов при осаждении дисперсной фазы получило название потенциала седиментации или оседания (или эффект Дорна).
Таким образом, по причинно-следственным признакам электрокинетические явления делят на две группы. К первой группе относят явления, при которых относительное движение фаз вызывается электрической разностью потенциалов, это электроосмос и электрофорез. Ко второй группе электрокинетических явлений принадлежат потенциал течения и потенциал седиментации, в которых возникновение электрической разности потенциалов обусловлено относительным движением фаз.
Наибольшее практическое применение получили электрофорез и электроосмос.
Основную роль в возникновении электрокинетических явлений играет двойной электрический слой (ДЭС), формирующийся у поверхности раздела фаз. Внешнее электрическое поле, направленное вдоль границы раздела фаз, вызывает смещение одного из ионных слоев, образующих ДЭС, по отношению к другому, что приводит к относительному перемещению фаз, т. е. к электроосмосу или электрофорезу. Аналогичным образом при относительном движении фаз, вызываемом механическими силами, происходит перемещение ионных слоев ДЭС, что приводит к пространственному разделению зарядов (поляризации) в направлении движения и к перепаду электрического потенциала (потенциал течения, потенциал оседания).
Направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов называется электроосмосом. Рассмотрим, например, электроосмотическое скольжение электролита в капилляре или порах мембраны. Примем для определенности, что на поверхности адсорбированы отрицательные ионы, которые закреплены неподвижно, а положительные ионы формируют диффузную часть ДЭС. Внешнее поле Е направлено вдоль поверхности. Электростатическая сила, действующая на любой произвольный элемент диффузной части ДЭС, вызывает движение этого элемента вдоль поверхности. Поскольку плотность заряда в диффузной части ДЭС Ф(х ) меняется в зависимости от расстояния до поверхности х (рис. 1), разложенные слои жидкого электролита движутся с разными скоростями. Стационарное состояние (неизменность во времени скорости течения) будет достигнуто, когда действующая на произвольный слой жидкости электростатическая сила скомпенсируется силами вязкого сопротивления, возникающими из-за различия скоростей движения слоев жидкости, находящихся на разном удалении от поверхности. Уравнения гидродинамики, описывающие движение жидкости при постоянных вязкости жидкости
источник
Различают 4 вида электрокинетических явлений: электрофорез, электроосмос, потенциал протекания (течения), потенциал седиментации (оседания).
Под действием внешнего электрического поля наблюдаются два явления:
1. перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды – электрофорез.
2. перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмос.
Явления, обратные электрофорезу и электроосмосу.
1. Возникновение разности потенциалов при перемещении дисперсной фазы относительно неподвижной дисперсионной среды – потенциал седиментации (оседания).
2. Возникновение разности потенциалов при перемещении дисперсионной среды относительно неподвижной дисперсной фазы – потенциал протекания.
Причиной электрокинетических явлений является образование двойного электрического слоя и, как следствие, наличие электрического заряда, как у частиц дисперсной фазы, так и у частиц дисперсионной среды.
Значение электрофореза, электроосмоса
Электрофорез используют в клинических исследованиях для диагностики многих заболеваний, для разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, форменных элементов крови, для определения чистоты белковых препаратов, для введения лекарственных препаратов.
Кроме того в медицине электрофорез применяют для введения лекарственных препаратов. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху электроды, к которым приложен низкий, безопасный для организма потенциал. Частички лекарственного препарата под действием электрического поля переходят в ткани организма.
Электроосмос используют для обезвоживания различных пористых материалов. Влажную массу помещают между электродами, а вода под действием электрического поля в зависимости от структуры ДЭС перемещается к одному из электродов и собирается в специальные емкости.
Скорость электрофореза (электрофоретическую активность) рассчитывают по уравнению Гельмгольца-Смолуховского:
U – скорость электрофореза (электрофоретическая подвижность)
ε – диэлектрическая проницаемость среды
ξ – электрокинетический потенциал
H – напряженность электрического поля
Напряженность электрического поля выражается отношением разности потенциалов к расстоянию между электродами:
Устойчивость дисперсных систем
Под устойчивостью дисперсной системы понимают ее способность сохранять во времени
— их равномерное распределение в среде
Для дисперсных систем различают два вида устойчивости – кинетическую (седиментационную) и агрегатную.
Кинетическая (седиментационная) устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегатная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными свои размеры.
Коллоидные растворы по устойчивости занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы обычно представляют собой седиментационно устойчивые системы, что обусловлено
1. малыми размерами частиц
2. их интенсивным броуновским движением
К факторам агрегативной устойчивости относится следующее:
1. наличие электрического заряда частиц препятствует их слипанию
2. способность к сольватации противоионов диффузного слоя; образующиеся на поверхности частиц защитные слои из сольватированных противоионов также препятствуют их слипанию
3. адсорбция на поверхности веществ ПАВ (поверхностно-активных веществ); вокруг “гидрофильных головок” ПАВ ориентируются диполи воды, в результате формируется адсорбционно-сольватный слой, препятствующий слипанию. Данное явление называется — “коллоидная защита”
4. вязкость среды: чем больше вязкость, тем меньше скорость частиц, меньше возможности для столкновения и седиментации.
Нарушение устойчивости дисперсных систем приводит к возникновению коагуляции, а в дальнейшем к седиментации частиц дисперсной фазы.
Коагуляцией называется процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости.
Коагуляцию могут вызвать различные внешние воздействия:
1. добавление небольших количеств электролита
2. концентрирование коллоидного раствора
5. действие электромагнитного поля
6. встряхивание, перемешивание и т.д.
В биологических системах наибольшее практическое значение имеет коагуляция электролитами, т.к. коллоидные растворы клеток и биологических жидкостей находятся в соприкосновении с электролитами.
Для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции или пороговой концентрацией (СПК).
Величина, обратная порогу коагуляции, называется коагулирующей способностью:
Существуют следующие правила коагуляции электролитами:
1. Коагуляцию вызывают ионы, которые имеют знак заряда, противоположный знаку заряда гранул. Коагуляцию положительно заряженных золей вызывают анионы, отрицательно заряженных – катионы.
2. Коагулирующее действие ионов тем сильнее, чем выше заряд иона – коагулянта (правило Шульце-Гарди)
лиотропный ряд катионов
лиотропный ряд анионов
3. Для ионов одного заряда коагулирующая способность зависит от радиуса сольватированного иона: чем больше радиус, тем меньше коагулирующая способность.
Следовательно, для катионов щелочных металлов можно записать следующий лиотропный ряд:
В механизмах коагуляции роль электролитов заключается в том, что:
1. может происходить уменьшение заряда поверхности твердой фазы (заряда поверхности ядер), т.е. за счет снижения межфазного (электротермодинамического) потенциала E.
2. может происходить уменьшение толщины диффузного слоя при неизменном заряде поверхности ядер.
В связи с этим различают следующие теории коагуляции:
1. адсорбционная (химическая) теория Фрейндлиха
2. физическая теория коагуляции ДЛФО (Б. В. Дерягина, Л.Д. Ландау, Э. Фервея, Дж. Т. Овербека)
1. Согласно теории Фрейндлиха коагуляция происходит под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение (например, переводя в осадок).
Так, при добавлении к положительно заряженному золю иодида серебра AgI сульфида калия K2S между коагулирующими анионами S 2- и потенциалопределяющими катионами Ag + происходит реакция: 2Ag + + S 2- → Ag2S↓. В результате величина межфазного потенциала падает, число противоионов, необходимых для компенсации заряда ядер также уменьшается, а, следовательно, уменьшаются и гидратные оболочки вокруг ионов, что и приводит к слипанию частиц, т.е. к коагуляции. Кроме того, снижение величины межфазного потенциала влечет и уменьшение ξ-потенциала, т.е. уменьшение заряда частиц, что приводит к падению устойчивости, т.е. к коагуляции.
2. Согласно теории ДЛФО коагуляция наступает под действием электролита, который химически не взаимодействует с ПОИ и не изменяет заряд ядра.
В этом случае коагулирующее действие проявляют те ионы добавленного электролита, которые являются противоионами для данных мицелл.
Повышение концентрации электролита приводит к уменьшению диффузного слоя. Межфазный потенциал при этом остается неизменным, однако происходит уменьшение ξ-потенциала.
Например: при добавлении нитратов к положительно заряженному золю иодида серебра AgI, мицеллы которого содержат противоионы NO3 —
По мере увеличения концентрации добавляемых ионов NO3 — они способствуют внедрению противоионов из диффузного слоя в слой адсорбционный. Диффузный слой сжимается и может наступить такое состояние, при котором диффузный слой совсем исчезнет и гранула станет электронейтральной, т.е. она будет находиться в изоэлектрическом состоянии.
Изоэлектрическим состоянием называется состояние коллоидных частиц, при котором электрокинетический потенциал (ξ) равен 0 и, которое характеризуется отсутствием направленного движения гранул в электрическом поле.
В агрегативно-устойчивом состоянии коллоидного раствора значение ξ-потенциала колеблется в пределах 50-70 мВ. При уменьшении ξ-потенциала под действием электролита до 25-30 мВ в системе не наблюдается никаких внешних изменений (помутнения или изменения окраски), так как скорость коагуляции очень низкая, вследствие чего эта стадия (I) называется “скрытой” коагуляцией (рис).
рис. Влияние концентрации электролита на скорость коагуляции
Дальнейшее добавление электролита ( > Сnn) сопровождается помутнением раствора и начинается “явная” коагуляция. Вначале скорость коагуляции быстро увеличивается (стадия II), а затем становится постоянной, когда значение ξ-потенциала станет равным 0 и наступит стадия быстрой коагуляции (III).
Коагуляция смесями электролитов
Существуют 3 возможных варианта взаимодействия между электролитами: аддитивное действие, антагонизм и синергизм.
Аддитивность – это суммирование коагулирующего действия ионов, вызывающих коагуляцию.
Аддитивное действие наблюдается в тех случаях, когда электролиты, содержащие коагулирующие ионы, химически не взаимодействуют между собой.
Например, смесь солей KCl, NaNO3 проявляет аддитивное действие по отношению и к отрицательно заряженным золям (коагуляцию вызывают K + , Na + ), и к положительно заряженным золям (коагуляцию вызывают Cl — , NO3 — ).
Антагонизм – это ослабление коагулирующего действия одного электролита в присутствии другого.
Антагонизм проявляется в том случае, когда в результате химической реакции между электролитами коагулирующие ионы связываются в нерастворимые соединения (выпадают в осадок) или в прочный комплекс, который не обладает коагулирующей способностью.
Например, коагулирующее действие катионов Pb 2+ по отношению к отрицательным золям ослабляется в присутствии NaCl, т.к. протекает реакция
Синергизм – это усиление коагулирующего действия одного электролита в присутствии другого.
Синергизм возможен, если между электролитами происходит химическое взаимодействие, в результате которого образуется многозарядный ион.
Например, коагулирующее действие FeCl3 и KCNS по отношению к положительным золям (коагулирующие ионы Cl — , CNS — ) усиливается, т.к. происходит реакция
и образуются ионы [Fe(CNS)6] 3- , обладающие высокой коагулирующей способностью.
Используя электролиты в медицине, необходимо учитывать возможность коагуляции в биологических средах, так например при введении различных лекарственных веществ в организм в виде инъекций следует знать, не являются ли эти вещества синергистами, чтобы избежать возможной коагуляции.
Гетерокоагуляцией называется коагуляция коллоидных растворов, содержащих разнородные частицы, отличающиеся по химической природе, знаку или величине заряда.
Частным случаем гетерокоагуляции является взаимная коагуляция – слипание разноименно заряженных коллоидных частиц. При этом коагуляция происходит тем полнее, чем полнее нейтрализуются заряды коллоидных частиц (заряды гранул).
Пептизацией называют процесс, обратный коагуляции – процесс превращения осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор.
Пептизацию на практике осуществляют двумя способами:
1. Промывание осадка чистым растворителем (дисперсионной средой), что приводит к вымыванию ионов, вызывающих коагуляцию.
2. Добавление специального электролита – пептизатора, ионы которого, адсорбируясь на поверхности частиц, восстанавливают ионные атмосферы вокруг частиц.
Условия, необходимые для проведения пептизации:
1. К пептизации способны только свежеполученные осадки, т.к. длительное хранение приводит к срастанию частиц осадка, к его постепенному уплотнению и вытеснению из его структуры жидкой фазы.
2. Добавление небольших количеств электролита (иначе наступает коагуляция)
Коллоидной защитой называется повышение агрегативной устойчивости лиофобных золей при добавлении к ним ВМС.
Механизм защитного действия заключается в том, что в водных коллоидных растворах дифильные молекулы ВМС, адсорбируясь на поверхности коллоидных частиц, ориентируются таким образом, что их гидрофобные участки обращены к частицам дисперсной фазы, а гидрофильные – к воде. В результате поверхность частиц становится лиофильной и покрывается дополнительной сольватной оболочкой.
По отношению к водным коллоидным растворам защитным действие обладают хорошо растворимые в воде белки. Так, белки крови препятствуют выпадению в осадок и выделению на стенках кровеносных сосудов холестерина и солей кальция.
Коллоидная защита используется при получении устойчивых лиофобных золей, применяемых в качестве лекарственных препаратов. Например, колларгол и протаргол содержат высокодисперсное металлическое серебро, защищенное высокомолекулярными соединениями.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9438 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Образование коллоидных систем происходит в присутствии электролита. При взаимодействии коллоидных частиц с электролитами на поверхности частиц адсорбируется один из ионов в соответствии с правилами избирательной адсорбции Пескова-Фаянса.
В результате вещество дисперсионной фазы приобретает определенный электрический заряд, а дисперсионная среда – противоположный. Наложение постоянного электрического поля приводит к тому, что частицы дисперсной фазы и среды движутся к противоположно заряженным электродам.
Наличие у дисперсных систем электрического заряда впервые было открыто в 1808г. профессором Московского университета Рейссом. Перенос коллоидных частиц в электрическом поле получил название электрофореза.
Исследованиями Видемана, проведенными в 1852г., было установлено, что количество жидкости, прошедшей через капилляры пористой диафрагмы, пропорционально силе тока и при постоянной силе тока не зависит от площади сечения или толщины диафрагмы. Это явление было названо электроосмосом.
| а) | б) |
Рис. 20.1 а) Схема опыта Рейсса по электрофорезу;
б) Схема опыта по электроосмосу.
В первом опыте жидкость помутнела, следовательно, частицы глины переносятся в электрическом поле к положительному полюсу. При электрофорезе в результате возникновения электрического поля между электродами, благодаря малому размеру частиц глины, происходит перенос отрицательно заряженной дисперсной фазы к положительному электроду. При электроосмосе ввиду того, что частицы песка слишком тяжелы, под влиянием электрического поля по капиллярам, имеющимся в слое песка, к отрицательному электроду передвигается положительно заряженная жидкость.
Причина обоих явлений одна и та же – наличие разноименных зарядов у твердой и жидкой фазы коллоидного раствора.
Явление электрофореза широко используется на практике при обезвоживании сырых нефтей, для улавливания в заводских трубах отходов ценных металлов и т.д. Принципы электроосмоса применяются при строительстве дамб, плотин, намывке грунтов, удалении из них избыточной влаги и др.
В дальнейшем были обнаружены два явления, которые противоположны электрофорезу и электроосмосу. Дорн в 1878г. обнаружил, что при оседании каких-либо частиц в жидкости, например песка в воде, возникает разность потенциалов между двумя электродами, введенными в разные места столба жидкости. Это явление, противоположное электрофорезу, получило название эффекта Дорна, или потенциала седиментации (оседания), являющегося, как предполагают, причиной возникновения грозовых разрядов в атмосфере.
При продавливании жидкости через пористую перегородку, по обеим сторонам которой находятся электроды, также было обнаружено возникновение разности потенциалов. Явление это, открытое Квинке в 1859г. и обратное электроосмосу, было названо потенциалом протекания, или потенциалом течения.
Все четыре указанных явления получили общее название электрокинетических явлений. Причиной этих свойств дисперсных систем считают существование двойного электрического слоя на границе раздела фаз. Теоретические основы электрокинетических явлений были разработаны Гельмгольцем (1879) и позднее Смолуховским (1921).
| Рис. 20.2 Схема образования двойного электрического слоя вокруг частицы иодида серебра, находящейся в растворе KI. |
С современной точки зрения заряд на коллоидных частицах лиозолей, проявляющийся при электрофорезе, обусловлен наличием на их поверхности двойного электрического слоя из ионов, возникающего либо в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе, либо за счет ионизации поверхностных молекул веществ.
Иодид-ионы (потенциалопределяющие ионы (ПОИ)) достраивают кристаллическую решетку иодида серебра и тем самым придают частицам отрицательный заряд, а ионы калия (противоионы) находятся в растворе вблизи межфазной поверхности. В целом, весь комплекс, называемый мицеллой, остается электронейтральным.
Возникновение двойного электрического слоя за счет ионизации можно проиллюстрировать образованием двойного электрического слоя на частицах водного золя диоксида кремния. Молекулы SiO2, находящиеся на поверхности таких частиц, взаимодействуют с дисперсионной средой, гидратируются и образуют кремниевую кислоту, способную ионизироваться:
При этом силикат ионы SiO3² – остаются на поверхности частицы, обуславливая ее отрицательный заряд, а ионы водорода переходят в раствор.
При действии электрического поля на частицы, несущие двойной электрический заряд, происходит явление, напоминающее электролиз. Если дисперсная фаза заряжена отрицательно, коллоидные частицы вместе с адсорбированными на них отрицательными ПОИ движутся к аноду, а положительно заряженные противоионы – к катоду. Если дисперсная фаза заряжена положительно, направление движения частиц и ионов меняется на обратное.
Следует отметить, что к электроду, имеющему заряд, одноименный с заряженными частицами, движется только часть противоионов. Другая часть противоионов, находящихся весьма близко от поверхности дисперсной фазы, под действием значительных электрических и адсорбционных сил оказывается связанной с частицами и вынуждена двигаться вместе с ними.
Рис. 20.3 Схема движения коллоидных частиц и противоионов
При этом совершенно произвольно принято, что ПОИ заряжены отрицательно, а противоионы – положительно.
Дата добавления: 2014-01-07 ; Просмотров: 1606 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
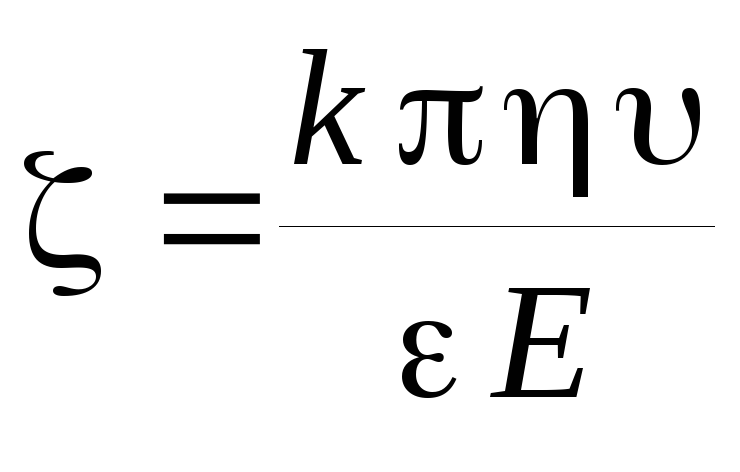
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
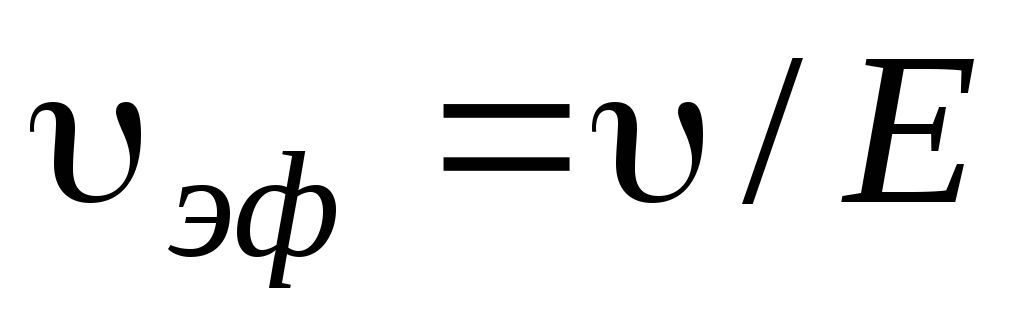
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
К осаждению дисперсной фазы — характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
лиофильные, обладающие термодинамической устойчивостью;
лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса G min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
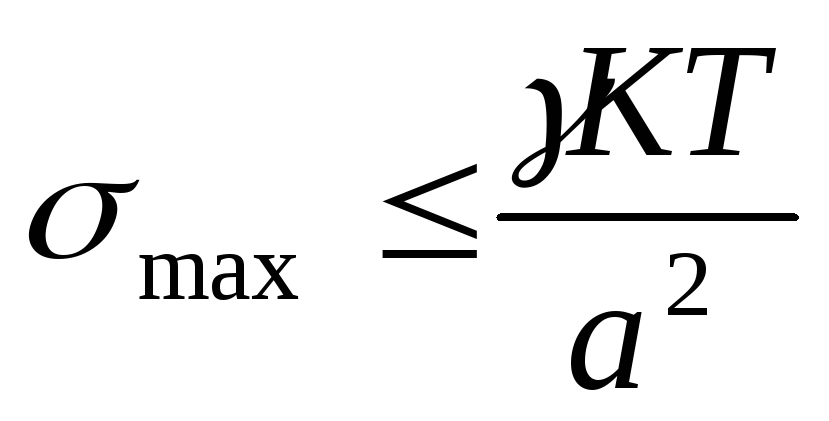
где ỵ езразмерный коэффициент;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,410 -7 до 1,410 -3 Дж/м 2 . Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Правила коагуляции электролитами. Порог коагуляции. Правило Шульце-Гарди. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия — явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
источник
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез — это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 6.11, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 6.11).
Рис. 6.11. Схема электрофореза:
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху — электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 6.12). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
Рис. 6.12. Схема электроосмоса
1 — дисперсная система; 2 — перегородка
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
источник
Фердинанд Фридрих фон Рейсс (1778-1852).
Явления электрофореза и электроосмоса.
В 1803 году куратор Московского университета М.Н.Муравьев пригласил заведовать кафедрой химии молодого энергичного ученого из Германии Фридриха Рейса, который активно занялся научной деятельностью, в частности, исследованиями электрокинетических явлений.
Фердинанд Фридрих фон Рейсс (1778 – 1852) родился в Тюбингене. Его отец являлся профессором Тюбингского университета. В 1800 г. Ф. Рейсс, окончив университетский курс в Тюбингене, получил степень лиценциата медицины. Уже в 1801 г. Рейсс получил степень доктора медицины и хирургии и одновременно звание приват-доцента всеобщей медицинской химии. По приезде в Москву молодой ученый был сразу удостоен звания экстраординарного профессора (1804) Московского университета. Год спустя он был выбран в члены-корреспондены Петербургской АН. С 1808 года одинарный профессор Московского университета. Кроме того, ученый являлся в 1817– 39гг. профессором кафедры химии и рецептуры в Московском Отделении Императорской Медико-Хирургической Академии, там же возглавлял кафедру истории, методологии и энциклопедии медицины. В 1828 г. Был избран академиком Медико-хирургической академии.
В 1839 г. ученый возвратился на родину.
Важным направлением деятельности ученого явились исследования врачебного действия различных лекарств, часть его исследований была посвящена изучению физиологических процессов, происходящих в живых организмах.
В 1809 году Рейс открыл явления электрофореза и электроосмоса.
К сожалению, малая распространенность изданий, в которых были напечатаны работы Рейса, связанные с исследованием электрокинетических явлений (к тому же большая часть их была уничтожена пожаром 1812 года), объясняет то, что его труды в этой области остались практически неизвестными для широкой научной общественности. В частности, имя Рейсса даже не упоминается в работах по истории физической химии В. Оствальда.
Тем не менее, открытия Рейсса дали начало большому числу научных направлений (теория двойного электрического слоя, электрохимия, теория устойчивости дисперсных систем и др.) и практических применений электрофореза и электроосмоса в технике, геологоразведке, медицине. Несомненно, что открытие Рейсса является одним из наиболее крупных достижений ученых Московского университета.
Московский университет, которому Рейс отдал 30 лет своей творческой деятельности, высоко ценит вклад ученого в развитие науки. И хотя он не принимал российского подданства, он был занесен в список выдающихся ученых России.
Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания).
Рейсс поставил два эксперимента.
В одном из них Ф. Ф. Рейсс погрузил в глину две стеклянные трубки, заполнил их водой и после наложения на них электрического поля наблюдал перемещение частиц глины в жидкости в направлении положительно заряженного электрода. Через некоторое время жидкость в трубке с положительным электродом становилась мутной из-за подъема частиц глины к электроду. Одновременно уровень жидкости в этой трубке понизился, а в другой поднялся. Этот опыт показал, что частицы глины имеют отрицательный заряд и перемещаются в электрическом поле.
Движение дисперсных частиц относительно дисперсионной среды (жидкой и газообразной) под действием электрического поля было названо электрофорезом. В водной среде частица двигается к электроду, знак заряда которого противоположен знаку электрокинетического потенциала.
В другом эксперименте Рейсс использовал U -образную трубку, перегороженную в нижней части диафрагмой из кварцевого песка и заполненную водой. При наложении электрического поля он обнаружил движение жидкости в сторону отрицательно заряженного электрода. Происходящее до тех пор, пока не устанавливалась определенная разность уровней жидкости (равновесие с гидростатическим давлением). Поскольку без диафрагмы движение жидкости отсутствовало, то последовал вывод о заряжении жидкости при контакте с частицами кварца. Явление получило название электроосмоса.
Таким образом, электроосмос – перемещение дисперсионной среды под действием электрического поля: противоионы диффузного слоя притягиваются к соответствующему электроду и увлекают за собой жидкость дисперсионной среды. Электроосмос проявляется также при движении жидкости дисперсной системы через капилляры или поры диафрагмы под действием электрического тока. Электроосмосом можно объяснить некоторые природные процессы.
Электроосмос используют для обезвоживания древесины, грунта, торфа и других материалов.
Первые количественные исследования электроосмоса были выполнены много позже Видеманном (1852). Он показал, что объёмная скорость υ электроосмоса пропорциональна силе тока I при прочих фиксированных параметрах, а отношение υ/ I не зависит от площади сечения и толщины диафрагмы.
Электрокинетические явления имеют практическое применение.
На электрофорезе основаны очистка воды, улавливание частиц дыма или пыли, выделение белков, аминокислот, витаминов и т.п. Поскольку вместе с гранулами передвигаются молекулы жидкости, составляющие их сольватные оболочки, электрофорезом производят частичное обезвоживание различных материалов (глины, почвы, мокрого торфа). Электрофоретическим методом производится нанесение покрытий на различные поверхности, например, в нашей стране эксплуатируются автоматические линии грунтовки кузовов автомобилей, также он широко применяется для покрытия катодов радиоламп, полупроводниковых деталей, нагревателей и т. д.
Практическое применение электроосмоса ограничено из-за большого расхода электроэнергии. Тем не менее, это явление используется для удаления влаги при осушке различных объектов (стен зданий, сыпучих материалов, при строительстве плотин, дамб и т. д.), для пропитки материалов различными веществами. Все большее значение приобретает электроосмотическая фильтрация,
источник



