Лекарственный электрофорез представляет собой сочетанное воздействие медикаментозного средства и электрического тока. Синонимом этого термина является ионофорез.
Ток проходит через ткани организма по направлению от одного электрода к другому. На пути его встречаются препятствия, которые имеют различную электропроводность. Так в глазном яблоке наименьшая электропроводность у кожного покрова век, а наибольшая – у внутриглазной жидкости. Чтобы преодолеть ткани с низкой проводимостью, требуется высокая энергия тока. В результате развиваются гальванические экзотермические реакции, изменяется кислотность среды, формируются активные метаболиты и ферменты. В результате улучшается микроциркуляция, а в области воздействия тока появляется ощущение жжения.
Одновременно с усиление крово- и лимфотока, увеличивается так называемая резорбционная способность тканей, повышается проницаемость гематоофтальмического барьера. В результате эффективная доза лекарственных средств уменьшается по сравнению с парентеральным способом введения.
Роговица глаза является отличной полупроницаемой мембраной, которая пропускает ионы вещества внутрь глазного яблока. Концентрация лекарства внутри глаза становится достаточно высокой, чтобы лечение привело к должному результату. Эффективность влияния на патологические очаги носит пролонгированный характер.
Эндоназальный электрофорез назначают пациентам с дистрофией и воспалением глазных структур, включая ячмень, халязион, флегмону. Также эта методика помогает при рубцовых изменениях век, кератите, эписклерите, макулодистрофических процессах, посттромботической ретинопатии, неврите и атрофических изменениях оптического нерва. С помощью электрофореза можно улучшить состояние глаза при помутнении вещества стекловидного тела, гемофтальме, спайках в передней камере глаза.
Эндоназальный электрофорез в офтальмологии имеет ряд противопоказаний:
- Тяжелая гипертония;
- Новообразования в организме;
- Заболевания крови и кроветворных органов;
- Склонность к эпилептическим припадкам;
- Острые инфекции, лихорадка;
- Обострение хронических инфекций;
- Декомпенсация соматических заболеваний;
- Наличие инородного тела из металла внутри глаза.
Электрофорез проводят с исопльзование аппаратов непрерывного постоянного тока (Поток, Элфор) или импульсного постоянного тока (Тонус-2, Амплипульс). Электроды выполнены из металла и имеют прокладку гидрофильной ткани, на которую наносят препарат.
При выполнении электрофореза можно применять различные методики:
- Электрофорез по Бургиньону. При этом электрод с лекарством помещают на кожу, а второй электрод – на кожу шеи. В результате лекарственное средство проникает в передние отделы глаза. Методика подходят для лечения заболеваний век и структур передней камеры.
- Ванночковый электрофорез. Методика используется чаще. При этом раствор лекарства наливают в специальную ванночку, в которую нужно погрузить открытый глаз. второй электрод помещают на заднюю поверхность шеи. Методика подходит для лечения воспаления и дистрофических изменений в переднем отрезке глаза.
- Эндоназальный электрофорез. Электроды с лекарством при этом помещают в носовые ходы. Второй электрод традиционно крепится на коже шеи сзади. При этом лекарство лучше проникает в задние структуры глазного яблока. Методику используют при лечении воспаления и дистрофии сетчатки, сосудистой оболочки глаза.
- Локальный электрофорез. Для этого требуется специальный точечный электрод. Также методика подходит для диагностического обследования роговицы и наблюдения за током внутриглазной жидкости у пациентов с глаукомой.
Продолжительность сеанса составляет 10-20 минут, а сила тока колеблется от 0,5 до 1 мА. Курс лечения включает в себя 10-15 процедур, которые назначают через день или ежедневно.
В качестве лекарственных средств при электрофорезе могут применяться сосудорасширяющие, ферменты, ангиопротекторы, нейропротекторы, вещества, изменяющие величину зрачкового отверстия (миотики, мидриатики). Препараты вводят с анода на катод.
Перед началом процедуры нужно установить устойчивость лекарства в электрическом поле, а также риск образования токсичных метаболитов. Это помогает рассчитать оптимальную концентрацию лекарства.
источник
На сегодняшний день, несмотря на значительные достижения в офтальмологии, глаукома остается одной из основных причин слабовидения и необратимой слепоты среди населения. По современным представлениям, глаукому определяют как мультифакторное, нейродегенеративное заболевание [7,10], характеризующееся развитием и прогрессированием оптической нейропатии с ассоциированной потерей зрительных функций, независимо от уровня внутриглазного давления (ВГД) [6,9].
Терапия данного заболевание должна быть комплексной и направлена на устранение всех причин (механических, дисциркуляторных и метаболических), приводящих к развитию атрофии зрительного нерва. Известно, что даже при эффективном снижении внутриглазного давления, возможно дальнейшее ухудшение зрительных функций [3]. Поэтому одной из основных задач лечения глаукомы, помимо эффективного снижения офтальмотонуса, является предотвращение гибели нейрональных клеток [2].
Нейропротекторная терапия направлена на защиту нейронов сетчатки и зрительного нерва от воздействия повреждающих факторов [1]. В настоящее время с этой целью широко используется препарат Ретиналамин, представляющий собой комплекс низкомолекулярных водорастворимых пептидных фракций, полученный методом уксуснокислой экстракции из сетчатки глаз крупного рогатого скота. Ретиналамин обладает тканеспецифическим действием на сетчатку, регулирует процессы метаболизма, улучшает функциональную активность клеточных элементов сетчатки, стимулирует репаративные процессы, нормализует проницаемость сосудов глазного яблока [4,8].
Согласно инструкции по применению, Ретиналамин может вводиться внутримышечно или парабульбарно. Но, к настоящему времени, разработано множество альтернативных путей его введения: субконъюнктивально, в субтеноново пространство, под кожу висков, эндолимфатическим путем, а также методом эндоназального электрофореза [5]. У каждого из этих методов есть как свои преимущества, так и недостатки, такие как низкая концентрация в зоне патологического очага из-за системной абсорбции препарата, длительность курса лечения, парабульбарные гематомы, риск перфорации глазного яблока и др. Это приводит к поиску новых способов введения, которые позволят облегчить адресную доставку лекарственного вещества и создать его депо у диска зрительного нерва.
С этой целью на нашей кафедре были проведены экспериментальные исследования по применению Ретиналамина путем эпиретинального введения.
Цель – провести комплексную оценку безопасности применения Ретиналамина с помощью методики эпиретинального введения в эксперименте.
Материалы и методы. Проведена серия экспериментов на 20 крысах породы Wistar (половозрелые самцы) массой 250-300 гр. Согласно цели эксперимента животные были разделены на 2 группы.
В условиях операционной под наркозом после обработки операционного поля с соблюдением правил асептики и антисептики каждому животному из основной группы через плоскую часть цилиарного тела выполняли прокол инъекционной иглой в 30 Гейч, эпиретинально вводили 0,25% раствора Ретиналамина (содержимое флакона 5 мг предварительно растворяли в 2 мл физиологического раствора) в дозе 0,01 мл, что составляет 0,025 мг лекарственного вещества, до исчезновения пульсации центральной артерии сетчатки, после чего иглу выводили через первоначальный прокол.
Животным группы сравнения также через плоскую часть цилиарного тела выполняли прокол инъекционной иглой в 30 Гейч, вводили физиологический раствор в дозе 0,01 мл до исчезновения пульсации центральной артерии сетчатки, иглу выводили через первоначальный прокол.
Общая продолжительность эксперимента составила 21 сутки. Забор материала (энуклеация глаза) производился на 1, 3, 7, 14, 21 сутки от начала эксперимента. В ходе эксперимента проводили наружный осмотр, непрямую офтальмоскопию с фоторегистрацией, гистологическое исследование.
Для оценки морфологических изменений иссекали заднюю стенку глаза с фрагментом зрительного нерва, фиксировали в 10%-ном растворе нейтрального формалина и заливали в парафин по стандартной методике. После приготовления срезов толщиной 4-6 мкм, проводили окрашивание гематоксилином и эозином. Просмотр и фотографирование микропрепаратов осуществляли на микроскопе «Axiostar plus» (Carl Zeiss, Германия), ок. х10, об. х40.
Результаты и обсуждения. При наружном осмотре и при проведении непрямой офтальмоскопии у подопытных животных основной группы и группы сравнения изменений не выявлено.
При подготовке материала для гистологических исследований макроскопически глазные яблоки животных обеих группы находились в пределах нормы (передне-задний размер — 7-8 мм).
При морфологическом исследовании сетчатки крыс через 1, 3, 7, 14 и 21 сутки после эпиретинальной инъекции, и в основной группе, и в группе сравнения патологических изменений не выявлено. Слои сетчатки сохраняют нормальное строение на протяжении всего эксперимента (рис. 1, 2). Ввиду того, что лабораторные животные альбиносы, слой пигментоэпителиоцитов выглядит нехарактерно. Фоторецепторный слой представлен наружными сегментами палочек и колбочек. За счет их тонкой, нежной структуры на препаратах нередко встречается отрыв сетчатки, имитирующий отслойку, что связано с технической сложностью изготовления препаратов. Сосуды сетчатой оболочки на всем протяжении умеренно полнокровны или запустевают. В месте перехода в диск зрительного нерва сетчатка незначительно истончается, особенно в области наружного и внутреннего зернистого слоев (рис. 3, 4), нередко наблюдается ее отрыв от пигментного слоя, что так же связано с техническими причинами (рис. 5).
Рис. 1. Сетчатка крысы через 1 сутки после введения препарата, сокращениями обозначены следующие слои: Ск – склера; ПЭ – слой пигментоэпителиоцитов; ФР – слой фоторецепторов; НЗ – наружный зернистый слой; ВЗ – внутренний зернистый слой; ВС – внутренний сетчатый слой; Г – ганглионарный слой. Окраска гематоксилином и эозином. Увел. 400
Рис. 2. Сетчатка крысы через 3 суток после введения препарата: Ск – склера; СО – сетчатая оболочка; СТ – стекловидное тело; Х – хрусталик. Окраска гематоксилином и эозином. Увел. 200
Рис. 3. Сетчатка крысы через 7 суток после введения препарата: ДЗН – диск зрительного нерва; Ск – склера; СО – сетчатая оболочка; СТ – стекловидное тело; Х – хрусталик. Окраска гематоксилином и эозином. Увел. 100
Рис. 4. Сетчатка крысы через 14 суток после введения препарата: ДЗН – диск зрительного нерва; Ск – склера; СО – сетчатая оболочка. Окраска гематоксилином и эозином. Увел. 200
Рис. 5. Сетчатка крысы через 21 сутки после введения препарата: ДЗН – диск зрительного нерва; Ск – склера; СО – сетчатая оболочка. Окраска гематоксилином и эозином. Увел. 20
Таким образом, в ходе эксперимента патологических изменений, а также различий между глазными яблоками животных основной группы и группы сравнения при наружном осмотре, офтальмоскопии и проведении морфологического исследования, выявлено не было. Во все сроки оптические среды оставались прозрачные, сетчатка сохраняла нормальное строение.
Исходя из этого, можно сделать вывод, что применение Ретиналамина путем эпиретинального введения является безопасным.
Выводы. Результаты проведенного эксперимента подтверждают безопасность эпиретинального введения Ретиналамина. Кроме этого, данный способ введения позволяет адресно доставить препарат и создать его депо непосредственно у диска зрительного нерва. Полученные результаты могут быть перспективными для дальнейших экспериментальных и клинических исследований в офтальмологии.
Шилова О.Г., д.м.н., профессор кафедры офтальмологии ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск;
Хороших Ю.И., д.м.н., доцент кафедры офтальмологии ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.
источник
Автореферат и диссертация по медицине (14.01.07) на тему: Эффективность лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препарата Ретиналамин
Автореферат диссертации по медицине на тему Эффективность лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препарата Ретиналамин
Флоренцева Светлана Сергеевна
Эффективность лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препарата Ретиналамин
14.03.11-Восстановительная медицина, спортивная медицина, лечебная физкультура, курортология и физиотерапия.
диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена на кафедре офтальмологии ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации и на базе СПб ГБУЗ «Диагностический центр № 7 (глазной)» для детского и взрослого населения.
Астахов Юрий Сергеевич — доктор медицинских наук профессор. Кирьянова Вера Васильевна — доктор медицинских наук профессор. Официальные оппоненты:
Сайдашева Эльвира Ирековиа — доктор медицинских наук, профессор, заведующая кафедрой детской офтальмологии ГБОУ ВПО «СЗГМУ им. И.И. Мечникова» Министерства здравоохранения Российской Федерации.
Суслова Галина Анатольевна — доктор медицинских наук, профессор заведующей кафедрой реабилитологии ФП и ДПО ГБОУ ВПО «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации.
ФГБВОУ ВПО «Военно-Медицинская академия им. С.М. Кирова» Министерства обороны РФ.
Защита диссертации состоится «26_»_февраля_2015 г. в 15.00 часов на заседании Диссертационного совета Д.208.090.04 при ГБОУ ВПО ПСПбГМУ им. акад. И.П. Павлова Минздрава России по адресу: 197022, Санкт-Петербург, ул. Л. Толстого, д. 6-8, тел.: 8 (812) 4997104, e-mail: usovet@spb-gmu.ru в зале Ученого Совета.
С диссертацией можно ознакомиться в библиотеке Первого Санкт-Петербургского государственного медицинского университета имени академика И.П. Павлова МЗ РФ и на сайте http://spb-gmu.ru.
Автореферат разослан « У $_¿^У^ 2015 г.
Ученый секретарь диссертационного совета доктор медицинских наук, доцент Ткаченко Татьяна Борисовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Возрастная макулярная дегенерация (ВМД) — основная причина стойкой утраты центрального зрения в развитых странах, после катаракты и глаукомы у пациентов старше 50 лет (Resnikoff S., 2004). 30 миллионов человек в мире потеряли зрение от этого заболевания. Ожидается, что к 2020 году количество пациентов с данной патологией удвоится. Это обусловлено увеличением продолжительности жизни, «старением» населения и улучшением методов диагностики заболевания (Американская Академия Офтальмологии, Экспертный Совет по возрастной макулярной дегенерации, 2009). По сведениям различных авторов (Holz F.G., Pauleikhoff D., Spaide R.F., Bird A.C., 2012), ВМД в общей популяции встречается в возрасте 65-74 года в 15% случаев, 75-84 года — в 25% и 85 и более лет — в 30% случаев. В России заболеваемость ВМД составляет более 15 человек на 1000 населения, причем в 60% случаев поражаются оба глаза, что ведет к первичной инвалидности у 11% лиц трудоспособного возраста и у 28% пожилых пациентов (Балашевич Л.И., Измайлов A.C., 2011). Ежегодно в России ВМД диагностируется у 100 000 человек (Измайлов A.C., 2010). Распространенность ВМД среди лиц в возрасте 65-75 лет составляет 10%, старше 75 лет — 30% (Балашевич Л.И., Измайлов A.C., 2011). В 2011 году в Санкт-Петербурге, по данным М.И. Разумовского, 16,8% случаев первичной инвалидности при офтальмопатологии составили заболевания сетчатки.
Известно, что в последние годы наблюдается, с одной стороны, устойчивая тенденция к возрастанию частоты дистрофических поражений макулярной области инволюционного характера, что связано с увеличением продолжительности жизни и изменением возрастной структуры населения (Егоров Е.А., Романенко И.А., 2009), а с другой стороны — «омоложение» данного заболевания и появление признаков ВМД у лиц среднего возраста.
Особая значимость сухой формы ВМД объясняется центральной локализацией процесса и двусторонним характером поражения. По мнению ряда авторов, вероятность вовлечения второго глаза составляет 10-15% в год после поражения первого, и через 5-8 лет уже 70% больных страдают потерей центрального зрения обоих глаз (Holz F.G., Pauleikhoff D., Spaide R.F., Bird A.C., 2012). В Российской Федерации ВМД является одной из основных причин необратимой слепоты, в частности сухая форма приводит к потере зрения в 10% случаев выявленной патологии сетчатки (Либман Е.С., 2006).
Распространенность, неуклонный рост заболеваемости среди лиц среднего возраста, тяжелый исход и инвалидизация трудоспособного населения, отсутствие эффективных методов лечения определяют социальную значимость ВМД.
Возрастная макулярная дегенерация — прогрессирующее заболевание, проявляющееся хроническим дегенеративным процессом в пигментном эпителии, мембране Бруха и хориокапиллярном слое макулярной области сетчатки, с последующим вовлечением фоторецепторов (Donald J., Gass M., 1977).
Медикаментозная терапия сухой формы ВМД должна быть патогенетически направленной. Принятые схемы лечения нацелены на профилактику замедленного формирования друз, отложений липофусцина, повышение плотности макулярного пигмента и тем самым на предупреждение развития патологических изменений в центральной зоне сетчатки. С 1986 года в офтальмологической практике стал широко применяться нейропептид Ретиналамин.
Ретиналамин (ретилин) — комплекс пептидов, выделенных из сетчатки глаза крупного рогатого скота. Препарат регулирует процессы метаболизма в сетчатке, стимулирует функции клеточных элементов сетчатой оболочки, способствует улучшению функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов при различной патологии сетчатки, усиливает активность ретинальных макрофагов, оказывает
нормализующее влияние на коагуляцию крови и обладает выраженным протекторным эффектом в отношении сосудистого эндотелия (Хавинсон В.Х. и др., 1988, 1997). Пептидные биорегуляторы, воздействуя на процессы межклеточной регуляции, способствуют восстановлению и сохранению регуляторных механизмов синтеза белка (Яковлев Г. М. и др., 1987, 1990).
Изученный механизм действия препарата на сетчатку определил показания к применению Ретиналамина в офтальмологии: центральные и периферические тапеторетинальные абиотрофии сетчатки; диабетическая ретинопатия; посттравматические и поствоспалительные центральные дистрофии сетчатки; послеоперационная реабилитация больных с отслойкой сетчатки; избыточная лазерная коагуляция сетчатки; профилактика ретромбозов сетчатки; глаукомной нейрооптикопатии. Применяемые схемы лечения Ретиналамином предусматривают инъекционный способ введения препарата. При этом отмечаются болезненность в месте инъекции, последующий дискомфорт и травматизация окружающих тканей. Поэтому наше внимание привлекли физиотерапевтические методики введения лекарственных средств, которые являются неивазивными и атравматичными.
Электрофорез лекарственных препаратов представляет собой метод сочетанного воздействия на организм постоянного электрического тока и лекарственного вещества, вводимого с его помощью. Основная особенность метода лекарственного электрофореза состоит в том, что лекарственные вещества в организме действуют на фоне изменений, вызванных постоянным током. Именно благодаря этому отчетливое терапевтическое действие лекарственных средств, вводимых путем электрофореза, проявляется при концентрациях, которые при других путях их введения недейственны или малоэффективны. По данным литературы эндоназальный электрофорез Ретиналамина применяется офтальмологами для лечения врожденной миопии у детей (патент от 18.05.2006 г., МНТК «Микрохирургия глаза» С.Н. Фёдорова). Однако данных по определению электрофоретичности Ретиналамина. в литературе мы не нашли. Клиническому применению электрофореза лекарственных препаратов, особенно сложной структуры,
должны предшествовать тщательные физико-химические (определение полярности, электрофоретической подвижности лекарств, устойчивости их к постоянному току, выбор подходящего растворителя) и клинико-физиологические (контроль проникновения вещества через кожу или слизистые оболочки, его количественная оценка, терапевтическая эффективность и др.) исследования, которые мы и провели в своей работе.
Для определения эффективности применения препарата Ретиналамин при лечении сухой формы ВМД и степени его влияния на функции и структуру сетчатки необходимы объективные современные методы оценки функционального состояния зрительно-нервного аппарата. На сегодняшний день электрофизиологические и морфометрические методы исследований позволяют оценить изменения функций и структуры сетчатки в реальном времени (Mkelberg Р., 1995). Эти методы имеют несомненное преимущество- возможность получения объективной информации и ее хранения и передачи в цифровом формате (Hassenstein A., Meyer С. Н., 2009).
Сравнить лечебное действие Ретиналамина, введенного с помощью эндоназального электрофореза и посредством инъекций под конъюнктиву, у больных с сухой формой возрастной макулярной дегенерации (стадии 1,2 AREDS) для повышения эффективности лечения.
Для достижения поставленной цели были сформулированы следующие задач» исследования:
1. Определить форетичность (биодоступность) препарата Ретиналамин.
2. Разработать условия и методику эндоназального электрофореза Ретиналамина.
3. Сравнить эффективность Ретиналамина, введенного с помощью эндоназального электрофореза и путем субконъюнктивальных инъекций, по результатам электрофизиологических исследований.
4. Провести сравнительную оценку результатов лечения возрастной макулярной дегенерации сухой формы (стадии 1, 2 AREDS) Ретиналамином, введенным с помощью эндоназального электрофореза и инъекционно под
конъюнктиву, на основании данных электрофизиологических (макулярной и ритмической электроретинограмы) и морфометрических (оптической когерентной томографии) исследований.
Научная новизна исследования заключается в том, что впервые:
— проведено определение форетичности препарата Ретиналамин;
— обоснованы специальные условия проведения эндоназалышго электрофореза препарата Ретиналамин;
— впервые для лечения пациентов с сухой формой возрастной макулярной дегенерации (стадии 1,2 А11ЕОЗ) использован метод эндоназального электрофореза препарата Ретиналамин;
— на клиническом материале произведена сравнительная оценка эффективности двух методов введения препарата Ретиналамин для лечения пациентов с возрастной макулярной дегенерацией с помощью электрофизиологических методов (макулярной и ритмической электроретинограмы) и морфометрии (оптической когерентной томографии макулярной области).
1. Доказана электрофоретичность препарата Ретиналамин.
2. На основании выполненного исследования разработана методика и рекомендации по лечению возрастной макулярной дегенерации (стадии 1, 2 АИШ^) эндоназальным электрофорезом препарата Ретиналамин.
3. Определен как наиболее эффективный и при этом неинвазивный метод лечения сухой формы возрастной макулярной дегенерации (стадии 1, 2 АИШ^) эндоназальный электрофорез препарата Ретиналамин.
Положения, выносимые на защиту:
1. Целесообразность применения эндоназального электрофореза препарата Ретиналамин для лечения пациентов с сухой формой возрастной макулярной дегенерации (стадии 1, 2 АКЕББ).
-82. Объективное исследование электрофоретичности препарата Ретиналамин.
Материалы и основные положения диссертации доложены и обсуждены на:
1. XV международном офтальмологическом конгрессе «Белые ночи» (5-й Конгресс Межрегиональной ассоциации врачей-офтальмологов России), 25-28 мая 2009 года, Санкт-Петербург;
2. Научно-практической конференции с международным участием «Российский общенациональный офтальмологический форум» (РООФ), 8-9 октября 2009 года, Москва;
3. XVI международном офтальмологическом конгрессе «Белые ночи» (6-й Конгресс Межрегиональной ассоциации врачей-офтальмологов России) 31 мая — 4 июня 2010 года, Санкт-Петербург;
4. Научно-практической конференции с международным участием «Российский общенациональный офтальмологический форум» (РООФ), 7-8 октября 2010 года, Москва;
5. Научно-практической конференции с международным участием «Российский общенациональный офтальмологический форум» (РООФ), 6-8 октября 2011 года, Москва;
6. II Международном конкурсе молодых ученых и специалистов «Пептидные препараты — препараты XXI века» (Санкт-Петербург, 2010 год, третье место).
По материалам диссертации опубликовано 9 печатных работ, из них 3 статьи в рецензируемых центральных научных изданиях, рекомендованных ВАК для публикации результатов диссертации на соискание степени кандидата медицинских наук. По теме диссертационной работы изданы два методических руководства.
Внедрение результатов в практику
Результаты исследования внедрены в практику СПб ГБУЗ ДЦ № 7 (глазной) для взрослого и детского населения (Моховая ул., 38). С 2011 г. используются в СПб ГБУЗ «Городская поликлиника № 39», в СПб ГБУЗ «Городская поликлиника № 3» ДПО 24, с 2013 г. — в СПб ГБУЗ «Городская поликлиника № 54», в СПб ГБУЗ «Городская больница № 31».
Объем проведенных исследований
Всего в настоящей работе использованы результаты обследований 120 человек (239 глаз). Всего проведено 2400 инструментальных исследований.
Диссертационная работа изложена на 140 страницах машинописного текста, состоит из введения, трех глав, заключения, выводов, практических рекомендаций, списка литературы. Содержит 56 таблиц, 48 рисунков, 3 диаграммы и 2 формулы. Список литературы включает 185 источников, в том числе 82 отечественных и 103 иностранных авторов.
ОБЩАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ИХ ОБСЛЕДОВАНИЯ
Материалы и методы исследования
Исследуемая группа пациентов с сухой формой ВМД (стадии 1,2 AREDS) получала обследование и лечение в Санкт-Петербургском государственном бюджетном учреждении здравоохранения «Диагностический центр № 7» (глазной) для взрослого и детского населения. Всего в настоящей работе использованы результаты обследования 120 пациентов. Все пациенты длительное время наблюдались в консультативно-диагностическом центре (от 3 мес до 5 лет). Для определения сравнительных результатов эффективности Ретиналамина, введенного с помощью эндоназалыюго электрофореза и путем субконъюнктивальных инъекций, проведено
проспсктивное рандомизированное слепое исследование. Рандомизация проведена методом конвертов.
В исследование включено 120 человек с установленным диагнозом ВМД, сухая форма. Все пациенты были разделены на 4 группы (таблица 1).
Таблица 1 — Распределение пациентов по видам лечения и возрасту
Группа, средний возраст Количество больных Вид лечебного воздействия
№ 1, 65,4±0,3 года 30 пациентов (60 глаз) Эндоназальный электрофорез Ретиналамина
№2, 67,3±0,3 года 30 пациентов (59 глаз) Субконъюнктивальные инъекции Ретиналамина
№3, 64,3±0,5 года 30 пациентов (60 глаз) Имитация ФТЛ
№4, 67,3±0,3 года 30 пациентов (60 глаз) Эндоназальная гальванизация
Всего, 67,3±0,1 года 120 пациентов (239 глаз)
В исследование были включены пациенты с установленным диагнозом сухой формы ВМД (стадии 1,2АЩЮ8), с наличием информированного согласия на участие в исследовании.
Критериями исключения из исследования явились: помутнения оптических сред глаза (поражение’ роговицы, катаракта с выраженной степенью помутнения в центральной части хрусталика), препятствующие проведению обследований, нарушения рефракции, препятствующие проведению ретинальной томографии (аметропии высокой степени); глазные заболевания: ВМД, влажная форма; глаукома, частичная атрофия зрительного нерва, дегенеративная миопия; некомпенсированные соматические заболевания (гипертоническая болезнь, сахарный диабет и т. д.), отказ пациента от участия в программе.
Всего нами обследовано 120 человек (239 глаз): 36 мужчин и 84 женщины, в возрасте от 46 до 67 лет, средний возраст составил 66,3±0,4 года. Распределение больных по полу представлено в таблице 2. Таблица 2 — Распределение пациентов по полу и группам
Группа Количество Пол пациентов
пациентов глаз женщины, % мужчины, %
Всего 120 239 78 (65%) 42 (35%)
Установленный диагноз возрастной макулодистрофии у обследуемых больных сомнения не вызывал. Все пациенты длительное время находились под наблюдением в консультативно-диагностическом центре. Форма возрастной макулодистрофии была сухой (стадии 1, 2 АЯЕБЗ).
В нашем исследовании использовались следующие диагностические методы.
Общепринятые офтальмологические методы исследования:
визометрия (проектор знаков Торсоп-АСР 7, Япония), авторефрактометрия (авторефрактометр Тотеу-ЯС 4000, Япония), стандартная автоматизированная периметрия (Периком, Россия), биомикро-офтальмоскопия глазного дна с асферической линзой 60 и 90 Э, измерение ВГД тонометром Маклакова.
Специальные методы диагностики
Для оценки функций центрального отдела сетчатки: макулярная электроретинография, ритмическая электроретинография на стимул 30 Гц (электроретинограф МБН, Россия).
Для оценки структуры центрального отдела сетчатки: оптическая когерентная томография макулярной области (Торсоп 3D Oct-lOOO, Япония).
Все исследования выполнялись на базе Санкт-Петербургского государственного бюджетного учреждения здравоохранения «Диагностический центр № 7» (глазной) для взрослого и детского населения. Указанные методики применялись в 4 группах пациентов до начала лечения Ретиналамином, через 3 и 6 месяцев после начала лечения. Повторный курс терапии пациенты получали в течение 10 дней в условиях дневного стационара СПб ГБУЗ ДЦ № 7 через 6 месяцев. После окончания лечения исследования проводились снова. Выполнено 2400 исследований.
Статистическая обработка. Для описания количественных переменных использовались характеристики среднего ± ошибка среднего (в некоторых случаях среднего ± стандартное отклонение), для описания порядковых показателей медиана — интерквартильный размах (нижняя и верхняя квартили) — размах (минимум-максимум). Для исследования однородности данных по группам в начальной точке использовался однофакторный дисперсионный анализ (модель с фиксированными эффектами) с учетом множественных сравнений Дункана. В случае порядковой шкалы анализ дублировался при помощи множественных сравнений Ван дер Вардена. Для анализа повторных наблюдений (левый-правый глаз, динамика показателя в разные моменты времени) использовались метод дисперсионного анализа для зависимых выборок в виде планов с расщепленными блоками (ANOVA Repeated Measures) и общая линейная модель (частичный план) с ковариатой в виде данных в первой точке наблюдений.
Однородность дисперсий проверялась при помощи критериев Бартлетта и Левина. Согласие остатков с нормальным законом распределения проверялось при помощи критерия Шапиро-Уилкса. Для анализа множественных сравнений использовались критерии Тьюки (Tukey HSD test) и непараметрический Дункана (Duncan’s test).
Для исследования зависимости между количественными переменными использовался коэффициент корреляции Пирсона, для порядковых —
коэффициент корреляции Сиирмеиа, значимость отклонения от нуля коэффициентов корреляции проверялась при помощи соответствующего критерия Стыодента. Значимость фактора времени для порядковых признаков проверялась при помощи критерия Фридмана. Расчеты выполнены при помощи статистических пакетов программ Statistica 7.0, PASW Statistics 18 R.
Характеристика методов лечения, применявшихся в ходе данных
Методика эндоназалыюго электрофореза Ретиналамина
Для приготовления раствора, используемого в методике эндоназалыюго электрофореза, предварительно 5 мг сухого лиофилизированного порошка «Ретиналамин» растворяли в 2,0 мл 0,9% раствора натрия хлорида (0,25% раствор Ретиналамина), рН полученного лекарственного раствора доводили до 5,4-5,8, добавляя капельным путем 2-3 капли 0,1 нормальной соляной кислоты (НС1). Перед процедурой проводили промывание носа водой. Пациента укладывали на кушетку. Активный электрод положительной полярности (анод) присоединяли к терапевтическому разъему аппарата гальванизации Поток-1. Затем 2 марлевые турунды длиной до 10 см, смоченные в 0,25% растворе Ретиналамина, вводили в средние носовые ходы. Концы турунд укладывали на клеенку, расположенную на верхней губе, покрывали влажной прокладкой 1 хЗ см с электродом и фиксировали. Второй электрод — отрицательной полярности (катод), с марлевой прокладкой 8×12 см, смоченной изотоническим раствором натрия хлорида, располагали на задней поверхности шеи в области I—III шейных позвонков.
Сила тока дозировалась по индивидуальным ощущениям пациента в диапазоне 0,5-1,0 мА (до возникновения у пациента ощущений приятного покалывания или жжения). Продолжительность процедуры составляла от 8 до 15 мин, увеличивая время по 2 мин через процедуру. Курс продолжался в течение 10 дней.
Методика эндоназалыюй гальванизации
Процедуры проводились по вышеописанной схеме, но марлевые турунды, которые вводили в средний носовой ход пациентов, смачивали 0,9% изотоническим раствором натрия хлорида. Курс лечения продолжался в течение 10 дней.
Методика субконъюнктивальных инъекций Ретиналамина
Под местной анестезией 5 мг раствора Ретиналамина вводили субконъюнктивально по 0,5 мл в оба глаза № 10 ежедневно. Препарат растворяли в 1 мл 0,9% раствора натрия хлорида (по инструкции).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Элсктрофоретичность Ретиналамина была установлена на кафедре восстановительной медицины и физиотерапии СЗГМУ им. И.И. Мечникова под руководством профессора В.В. Кирьяновой. Известно, что вещества полипептидной природы обладают амфолитными свойствами, поэтому для обоснования лечебного метода электрофореза комплекса полипептидов Ретиналамин нами проведено исследование по определению его изоэлектрической точки, оптимальной полярности и оптимального значения pH растворителя, при котором достигается наибольшая эффективность электрофореза (максимальное количество перемещенного вещества) (Малахова М.Я., 1995).
Изучали электрофоретическую подвижность, а в контрольных пробах -диффузию препарата Ретиналамин в камерной установке для аналитического электрофореза при значениях pH растворителя 5,0; 5,4; 5,8; 6,2; 6,6; 7,0; 7,4; 7,8; 8,2; 8,6; 9,0. Концентрацию полипептидов . в пробах определяли микрореакцией О.Н. Lowry в модификации М.Я. Малаховой (Lowry О.Н., Rosenbrough N.J., Farr A.L., 1951).
Установлено, что изоэлектрическая точка препарата Ретиналамин соответствует рН 7,4, оптимальная полярность активного электрода положительная, наибольшая эффективность электрофореза имеет место при рН 5,4-5,8.
Данные клинических исследований
Динамика остроты зрения после курса лечения Ретиналамином представлена в таблице 3.
Таблица 3 — Динамика остроты зрения после курса терапии Ретиналамином
№ 1 (п=30) № 2 (п=59) № 3 (п=30) № 4 (п=30)
1. До лечения 0,7±0,12 0,7±0,13 0,72±0,09 0,73±0,11
2. Через 3 мес 0,89±0,18 0,86±0,15 0,72±0,17 0,73±0,12
3. Через 6 мес 0,82±0,25 0,75±0,31 0,71±0,13 0,72±0,22
4. Через 6 мес и 10 дней 0,89±0,28 0,85±0,29 0,71 ±0,18 0,72±0,31
Достоверность различий между группами, р р )/ нормализованные ранги (N0) Значимости эффектов в модели дисперсионного анализа для зависимых выборок
препарат ток взаимодействие препарата и тока время взаимодействие факторов времени с эффектами
препарат ток взаимодействие препарата и тока
а-Волна, амплитуда Ы) 0,0846 Зе-04 0,1917 0 0 0 8с-04
N0 0,3259 0,001 0,3154 0 0 2е-04 0
Ь-Волна, амплитуда 1Ш 0,0025 0,003 0,0941 0 0 0 0
N0 0,0072 7е-04 0,0933 0 0 0 0
Амплитуда РЭРГ 1Ш 0,1027 0 0,7074 0 0 0 0
а-Волна, латснгность яо 0,1648 0,0272 0,2657 0 0 0 0
ОКТ (по первым трем точкам) 1ГО 0,865 0,1503 0,671 0,2013 0,2013 0,1697 0,1697
N0 0,4803 0,1359 0,5031 0 0,1966 0,5126 0,4635
Подводя итоги нашей работы, можно говорить об изменениях в электрогенезе фоторецепторов макулярной области сетчатки на фоне лечения исследуемым препаратом и о стабилизации морфометрического показателя в течение всего времени наблюдения.
Таким образом, инструментальными методами доказано, что в группах больных, получавших Ретиналамин в виде субконъюнктивальных инъекций и с помощью эндоназального электрофореза, отмечался клинический эффект: повысилась функциональная активность наружных и внутренних слоев сетчатки в макулярной области: увеличилась амплитуда волн а и Ь, уменьшалась латентность а-волны, т. е. наблюдалось увеличение активности фоторецепторов и ганглиозных клеток сетчатки (см. таблицу 5). По
результатам анализа полученных данных можно отметить, что латентность волны b не менялась в течение всего периода исследования, что говорит о стабилизации патологического процесса, так как латентность является более устойчивым параметром МЭРГ при повторных исследованиях, и ее изменения при прогрессировании дегенеративных процессов весьма показательны (Шамшинова A.M., Зуева М.В., Цапенко И.В., 1999).
При физиотерапевтическом лечении был получен более выраженный клинический эффект, процедуры хорошо переносились всеми пациентами. По результатам изменений амплитуды а-волны до и после курсов лечения, выраженных в процентах, можно говорить об эффективности предложенных методик. Клинический эффект Ретиналамина, введенного электрофорезом, сохраняется 3 месяца. Повторное лечение Ретиналамином через 6 месяцев дает более выраженный клинический эффект в группе № 1 (рисунок) по сравнению с инъекционным введением препарата.
Рисунок — Клинический эффект эндоназального электрофореза Ретиналамина.
Через 3 месяца в обеих исследуемых группах клинический эффект от применения Ретиналамина составил 49,1% в группе № 1 и 43,1% в группе № 2 (по данным изменений а-волны МЭРГ). При повторном курсе лечения через 6 месяцев эффективность препарата увеличивалась до 49,8% в группе № 1 и до 46,2% в группе № 2, по сравнению с исходными данными этой группы (по данным амплитуды а-волны МЭРГ), что позволяет рекомендовать применять этот метод два раза в год.
1. Определена электрофоретичность препарата Ретиналамин: изо-электрическая точка соответствует рН 7,4 с анода, оптимальный рН составляет 5,4-5,8 — и впервые разработаны условия проведения эндоназального электрофореза Ретиналамина.
2. Впервые для лечения больных с сухой формой возрастной макулярной дегенерации (стадии 1,2 АЯЕОЗ) применен метод эндоназального электрофореза Ретиналамина и доказана его эффективность.
3. Клинический эффект эндоназального электрофореза Ретиналамина сохраняется 3 месяца, к 6 месяцам показатели снижаются (по данным анализа амплитуды а-волны).
4. Повторное лечение Ретиналамином через 6 месяцев дает более выраженный клинический эффект (по данным электрофизиологических исследований) в группе, получавшей лечение методом эндоназального электрофореза, чем в группе с инъекционным путем введения.
5. Метод может быть рекомендован для использования в клинической практике как в стационаре, так и в поликлиниках.
1. Метод эндоназального электрофореза Ретиналамина можно рекомендовать для лечения сухой формы возрастной макулярной дегенерации.
2. Метод может быть рекомендован для внедрения в практику не только в условиях стационара, но и в поликлинике.
3. Проводить эндоназальный электрофорез Ретиналамина у пациентов с сухой формой возрастной макулярной дегенерации (стадии 1,2АШЮ8) следует не реже, чем 1 раз в 6 месяцев.
Список работ, опубликованных по теме диссертации
(жирным шрифтом отмечены издания, рекомендованные ВАК)
1. Морозова, Н.В. Эффективность лечения ВМД сухой формы методом эндоназального электрофореза препаратом Ретиналамин / Н.В.Морозова, Д.П. Новиков, В.О. Соколов, С.С. Флоренцева // Офтальмологические ведомости. — 2009. — Т. 2, № 3. — С. 40-45.
2. Морозова, Н.В. Лечение сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препаратом Ретиналамин: методические рекомендации / Н.В. Морозова, В.О. Соколов, С.С. Флоренцева. — СПб., 2009. — 16 с.
3. Морозова, Н.В. Результаты лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препаратом Ретиналамин / Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Сб. тр. науч.-практ. конф. с междунар. участием «Российский общенациональный офтальмологический форум» (РООФ), Москва, 8-9 октября 2009 г. / Под ред.
B.В. Нероева. — М„ 2009. — Т. 1. — С. 93-95.
4. Кирьянова, В.В. Применение эндоназального электрофореза Ретиналамина в комплексном лечении сухой формы возрастной макулярной дегенерации / В.В. Кирьянова, Н.В. Морозова, В.О. Соколов,
C.С. Флоренцева // Нелекарственная медицина. — 2010. — № 2. — С. 11-20.
5. Астахов, Ю.С. Оптимизация лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препаратом Ретиналамин / Ю.С. Астахов, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева. A.B. Ракицкий // Офтальмологические ведомости. -2010. — Т. 2, № 3. — С. 40-45.
6. Астахов, Ю.С. Опыт лечения ВМД сухой формы методом эндоназального электрофореза препаратом Ретиналамин / Ю.С. Астахов, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Сб. тр. III науч. конф. с междунар. участием «Роль и место фармакотерапии в современной офтальмологической практике»13-14 декабря 2012. — СПб.: МНТК, 2012. -С. 82-84.
7. Астахов, Ю.С. Опыт лечения ВМД сухой формы методом эндоназального электрофореза препаратом Ретиналамин / Ю.С. Астахов, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Сб. тр. науч. конф. с междунар. участием «Новые технологии в офтальмологии». — Казань, 2013. -С. 34—36.
-238. Астахов, Ю.С. Опыт применения «Ретиналамина» в лечении глау-комной нейрооптикопатии и возрастной макулярной дегенерации / Ю.С. Астахов, Е.В. Бутин, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Офтальмологические ведомости. — 2013. — Т. 5, № 2. -С. 45-49.
9. Морозова, Н.В. Лечение ПОУГ 1-2 стадии методом эндоназального электрофореза препаратом Ретиналамин: методические рекомендации / Н.В. Морозова, В.О. Соколов, С.С. Флоренцева. — СПб., 2012. — 20 с.
БМ — биомикроскопия (глазного дна) ВГД — внутриглазное давление
ВМД — возрастная макулярная дегенерация (возрастная макулодистрофия) ВОЗ — Всемирная Организация Здравоохранения МЭРГ — макулярная электроретинограмма
ОКТ — оптическая когерентная томография, оптический когерентный томограф
ПЭС — пигментный эпителий сетчатки
РЭРГ — ритмическая электроретинограмма
ФТЛ — физиотерапевтическое лечение
ЦПЗ — центральное поле зрения
ЭФИ — электрофизиологические исследования
Подписано к печати 12.01.2015. Формат 60×84 1/16. Бум.офсетная. Усл. печ. л. 1,0. Тираж 100 экз. Заказ 4.
Отпечатано в ООО ИД «Петрополис» 197101 Санкт-Петербург ул. Б.Монетная, д. 16, офис 22
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Цель исследования: оценка эффективности и переносимости Ретиналамина у пациентов с различными офтальмологическими заболеваниями при проведении 1-го или 2-х последовательных курсов лечения с интервалом в 3 мес. В исследование включали пациентов в возрасте старше 18 лет с «сухой» или «влажной» формой возрастной макулярной дегенерации (ВМД), первичной открытоугольной глаукомой (ПОУГ) с компенсированным внутриглазным давлением (ВГД), диабетической ретинопатией и миопической болезнью.
Материал и методы: общее количество пациентов составило 4172 человека (64% женщин и 36% мужчин). Средний возраст пациентов – 59±17 лет. Для оценки эффективности и переносимости ретинопротекторной терапии были запланированы контрольные визиты через 1, 3, 4 и 6 мес. от начала терапии в случае назначения 2-х курсов Ретиналамина. При проведении 1-го курса лечения Ретиналамином пациенты обследовались через 1, 3 и 6 мес. от начала терапии. Эффективность оценивалась по изменению остроты зрения (ОЗ) и состоянию полей зрения (ПЗ) (расширению границ ПЗ суммарно, уменьшению количества скотом и изменению показателей MD, PSD).
Результаты: отмечалась тенденция к улучшению состояния зрительных функций в процессе наблюдения. Выраженная положительная динамика ОЗ с коррекцией, периметрических индексов, увеличение периферических границ ПЗ, уменьшение количества скотом наблюдались в сроки 1 и 3 мес. от начала терапии. В дальнейшем наблюдалась стабилизация большинства оцениваемых показателей.
Переносимость Ретиналамина у пациентов с различными офтальмологическими заболеваниями при проведении 2-х последовательных курсов с интервалом в 3 мес. была хорошей, нежелательные явления в ходе исследования выявлены не были.
Ключевые слова: Ретиналамин, нейропротекция, ВМД, глаукома, диабетическая ретинопатия, миопическая болезнь.
Для цитирования: Егоров Е.А. Опыт применения Ретиналамина при различных офтальмологических заболеваниях // РМЖ. Клиническая офтальмология. 2017. №1. С. 35-38
Retinalamin for various ophthalmic disorders: clinical experience
Egorov E.A.
N.I. Pirogov Russian National Research Medical University, Moscow
Aim. To assess the efficacy and tolerability of Retinalamin for the treatment of various ophthalmic disorders (one or two consecutive treatment courses with a 3-month interval).
Patients and methods. The study included 4172 patients (64% of women and 36% of men) aged 18 years and older (mean age 59 ± 17 years) with dry and wet macular degeneration, primary open-angle glaucoma with normal IOP, diabetic retinopathy, and myopic disease. The efficacy of Retinalmin was evaluated after 1, 3, 4, and 6 months (two treatment courses) or after 1, 3, and 6 months of the therapy (one treatment course) by the changes in visual acuity and visual fields (overall improvement, resolution of scotomas, improvement of MD and PSD).
Results. Visual functions tended to improve during the follow-up. Significant improvement of best-corrected visual acuity, peripheral visual fields, and perimetric indices as well as resolution of scotomas were observed after 1 and 3 months of the therapy. Later, most parameters remained stable.
Retinalamin for various ophthalmic disorders (two treatment courses with a 3-month interval) is well tolerated and has no significant adverse side effects/
Key words: Retinalamin, neuroprotection, AMD, glaucoma, diabetic retinopathy, myopic disease.
For citation: Egorov E.A. Retinalamin for various ophthalmic disorders: clinical experience // RMJ. Clinical ophthalmology. 2017. № 1. P. 35–38.
Статья посвящена применению Ретиналамина в офтальмологии
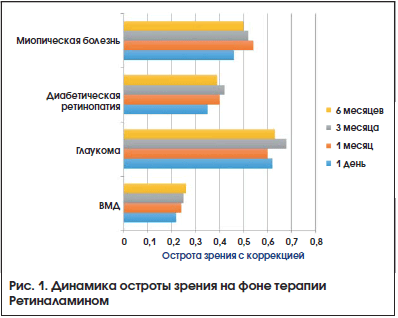
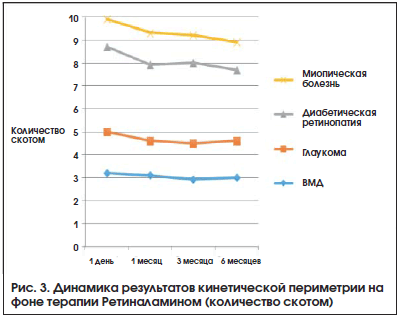
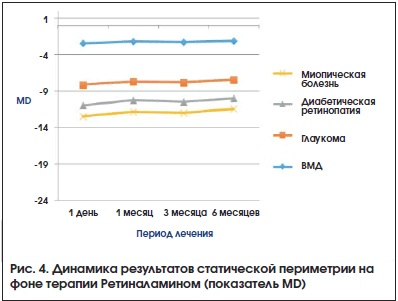
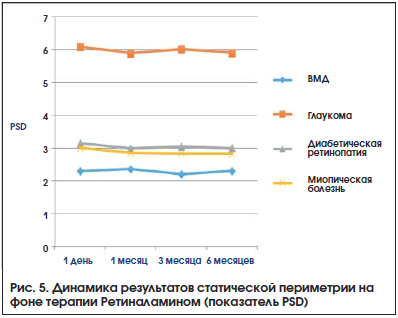
Динамика ОЗ на фоне терапии представлена на рис. 1. Наблюдалась тенденция к повышению ОЗ, наиболее выраженная в большинстве случаев через 3 мес. терапии. Результаты исследования ПЗ были разделены на 2 группы в зависимости от применяемого метода периметрии. Кинетическая периметрия использовалась в 37% наблюдений, ее применение было связано как с оснащением диагностических центров, так и с ограничениями для проведения стандартной автоматической периметрии (низкая ОЗ, сложность методики). Оценивали динамику периферических границ ПЗ по сумме 8 меридианов (Σ, в градусах) и количеству скотом (рис. 2, 3). Изменение результатов статической периметрии оценивали по изменению основных индексов
светочувствительности: MD – среднее снижение и PSD – отклонение паттерна (рис. 4, 5).
Все изменения результатов периметрии были статистически недостоверны (p>0,05). Наблюдалась тенденция к улучшению состояния зрительных функций в процессе наблюдения. Выраженная положительная динамика ОЗ с коррекцией, периметрических индексов, увеличение периферических границ ПЗ, уменьшение количества скотом наблюдались в сроки 1 и 3 мес. от начала терапии. В дальнейшем отмечалась стабилизация большинства оцениваемых показателей.
Различие в ответах по «Опроснику для пациента» в разные сроки наблюдения было недостоверным, однако отмечалось некоторое снижение значения общего балла на фоне терапии Ретиналамином, что свидетельствует о тенденции к улучшению качества жизни больных. Различие в ответах между нозологическими группами наиболее вероятно связано с особенностями клинической картины заболеваний.
Переносимость Ретиналамина у пациентов с различными офтальмологическими заболеваниями при проведении 2-х последовательных курсов с интервалом в 3 мес. была хорошей, НЯ в ходе исследования выявлены не были.
При назначении Ретиналамина у пациентов с ВМД, глаукомой, диабетической ретинопатией, миопической болезнью в виде 2-х последовательных курсов с интервалом в 3 мес. наблюдались положительная динамика средней ОЗ и тенденция к увеличению светочувствительности сетчатки (расширение границ ПЗ, уменьшение количества скотом и изменение показателей MD и PSD).
Ретиналамин может быть рекомендован в качестве универсального нейропротектора при различных офтальмологических заболеваниях, связанных с дегенеративными поражениями ткани сетчатки.
1 MD (mean deviation), среднее отклонение от возрастной нормы, показывает общую депрессию или наличие в ПЗ участков с нормальной светочувствительностью и дефектами.
2 PSD (pattern standard deviation), частное стандартное отклонение, представляет собой степень отклонения формы холма зрения пациента от возрастной нормы.
Только для зарегистрированных пользователей
источник
Учеными и врачами КРЦРЗ совместно со специалистами других научных и лечебных учреждений создан авторский проект «Методическое пособие: Медикаментозное лечение возрастной макулярной дистрофии (ВМД)».
Авторы:
| Ширшова О.Н. | Скибина Т.Г. | Осипова Г.Б. |
Авторское свидетельство:
Ширшова О.Н., Скибина Т.Г., Осипова Г.Б., Рубан В.В.
Методическое пособие: Медикаментозное лечение возрастной макулярной дистрофии
Возрастная макулодистрофия в последние 15-20 лет считается одним из наиболее распространенных офтальмологических заболеваний, что непосредственно связано с широким распространением гипертонической болезни, атеросклероза, сахарного диабета.
В развитых странах макулодистрофия является основной причиной необратимой потери центрального зрения. По данным различных авторов дистрофические поражения макулярной области наблюдаются у 25 – 40 % больных, чаще у пожилых.
Данные ВОЗ также указывают на наиболее быстрый ежегодный рост страдающих возрастной макулодистрофией. Этому заболеванию отводится одно из центральных мест среди медико – социальных проблем мирового здравоохранения. По данным статистики в Крыму около 20 тыс. человек страдают ВМД.
Двусторонний характер поражения и необратимое снижение зрения при этом заболевании усуглубляют серьезность этой проблемы и обуславливают высокую практическую значимость усилий в поисках новых методов решения.
Главная роль в запуске патогенеза ВМД отводится к нарушению гемодинамики в хориокапиллярах глаза. Атеросклеротические и дегенеративные процессы с возрастом вызывают поражения как капилляров, так и крупных сосудов хориоидеи. Патогенез заболевания часто связывается с различными общими заболеваниями, нарушением обмена веществ, активностью металлоферментов, наследственностью, курением, уровнем холестерина в крови, солнечным светом, уменьшением уровня антиоксидантов в сыворотке крови. Эти факторы являются предрасполагающими для развития ВМД. Изменения в капиллярах хориоидеи приводят к нарушению питания фоторецепторного аппарата, деструкции мембраны Бруха и пигментного эпителия сетчатки. Это, в свою очередь, нарушает фагоцитарную и лизисную функции пигментного эпителия, способствуя появлению друз дефектов в мембране Бруха. Клетки пигментного эпителия при нарушении баланса ангиогенеза освобождают факторы роста эндотелия сосудов, что стимулирует ангиогенез. В результате появляется неоваскуляризация. Врастание новообразованных сосудов происходит из хориоидеи через повреждения в мембране Бруха. Стенка новообразованных сосудов не является полноценной по своей структуре, в результате чего не устраняется гипоксия.
Лечение ВМД должно быть патогенетическим, комплексным, направленным на все звенья патогенетической цепи. Поэтому основным принципом консервативной терапии является коррекция:
— микроциркуляции и транкапиллярного обмена;
— улучшение реологических свойств крови;
— метаболизма в ишемизированных тканях и в стенке пораженных сосудов.
Все лекарственные препараты, применяемые в этом случае должны соответствовать следующим критериям:
С этой целью применяются вазоактивные препараты, ноотропные средства, ангиопротекторы, антиоксиданты, противосклеротические средства, полипептидные препараты.
Кроме того, при выборе препаратов мы должны учитывать проницаемость их через гематоэнцефалический и гематоофтальмический барьер. Что же из себя представляют эти барьеры?
Еще в 1885 году выдающийся немецкий микробиолог П. Эрлих обнаружил, что кислые красители, введенные в кровь животного, в мозг не попадают. Прошло немало лет, и сотрудник Эрлиха – Э. Гольдман поставил два ставших знаменитыми опыта с полуколлоидной краской «трипановый синий». Оказалось, что если эту краску ввести в кровь, то она окрашивает все органы, кроме мозга. Если же краска вводится в подмозжечковую цистерну, то окрашивается и вещество мозга. Тогда-то и возникла мысль о существовании сосудистого барьера, как бы запирающего центральную нервную систему от веществ, циркулирующих в крови.
Схематическое изображение опытов Э. Гольдмана, в которых было установлено существование преграды для веществ, идущих из крови в мозг. В опыте А краситель вводили в кровь, и мозг оставался неокрашенным. В опыте Б краситель вводили в ликвор (через так называемую подмозжечковую цистерну), мозг окрашивался, но в кровь краситель не попадал. Неодолимая для него граница гематоэнцефалического барьера показана жирной чертой.
От опытов Эрлиха – Гольдмана до современных представлений о мозговом барьере наука прошла длинный и тернистый путь. В начале двадцатых годов прошлого столетия фундаментальные работы академика Л.С. Штерн и ее сотрудников заложили учение о гематоэнцефалическом (кровемозговом) барьере.
Мозговой барьер защищает центральную нервную систему от всевозможных чужеродных, ядовитых веществ, проникающих в кровь или образовавшихся в самом организме, способных повредить необычайно чувствительные нервные клетки головного и спинного мозга.
Соответственно гематоофтальмический барьер предохраняет глаз.
Непроницаемость барьеров относительна и зависит в значительной степени от количества и концентрации находящихся в крови веществ, от состояния организма, от длительности пребывания вещества в организме, от внешних воздействий и ряда других причин. Анатомические элементы, из которых складывается структура барьеров, не только защищают мозг, и глаз, но и регулируют их жизнедеятельность, питание, выведение продуктов обмена веществ и т.п.
Конечно, мозговой барьер не орган тела, подобно печени, селезенке или легким. Это совокупность анатомических элементов, которые выполняют роль преграды наряду с другими своими функциями.
Так, основная функция мозговых капилляров – доставлять к мозгу кровь, через их стенки в ткань мозга поступает питание, через них же выводятся отработанные материалы. Обмен этот идет непрерывно, но не все вещества проникают через эти стенки.
Мозговой капилляр – первая линия обороны мозга, искусно построенная, проницаемая для одних веществ, полупроницаемая для других и непроницаемая для третьих.
Вообще строение капилляров, вернее, их внутреннего слоя – эндотелия, отличается в различных тканях и органах по форме ядра, структуре его оболочки и т.п. Вещества переходят из крови в околоклеточную жидкость через мельчайшие поры (щели) между эндотелиальными клетками и сквозь некоторые истонченные участки самих клеток – так называемые окошки, или фенестры.
Стенки мозговых капилляров не имеют ни пор, ни окошек. Отдельные клетки накладываются друг на друга подобно черепицам (гребенчатое строение), и места стыковок прикрыты особыми замыкательными пластинками. Щели между клетками необычайно узкие, поэтому движение жидкости из капилляра в ткань идет в основном сквозь его стенку. Строение самих эндотелиальных клеток мозгового капилляра также отличается некоторыми особенностями. Например, они содержат богатый набор митохондрий, что указывает на высокую активность в них энергетических и обменных процессов. В то же время в клетках капилляров мозга гораздо меньше транспортных пузырьков (вакуолей), причем особенно в той их стороне, что прилегает к просвету капилляра, но на границе с нервной тканью число их несколько выше. Это указывает, что проницаемость капилляра в направлении из крови в ткани мозга ниже, чем в обратном направлении. Цитоплазматические вакуоли в клетках различных органов обычно участвуют в эвакуации ненужных частиц вещества, перенося их во внеклеточную жидкость. Обратный же процесс, когда клеточная мембрана захватывает извне частицы и отправляет их внутрь клетки, в стенках мозговых капилляров почти полностью отсутствует.
Определенную роль в осуществлении барьерной функции мозговых капилляров играет также расположенная под слоем эндотелиальных клеток прочная трехслойная базальная мембрана со слоем гликокаликса над ней. Составляющие этот слой нити и гранулы образуют своеобразную сеть, которая служит дополнительным препятствием для молекул различных веществ. Кроме того, исследования последних лет показали, что капилляры мозга содержат целый набор ферментов, способных снижать активность химических соединений, поступающих из крови в ткань мозга.
Однако одной лишь стенкой капилляров не ограничивается структура мозгового барьера. Вторая линия обороны расположена между стенкой капилляра и нейронами. Природа поставила здесь сложное сплетение звездчатых клеток (астроцитов) и их отростков (дендритов), образующих слой так называемой нейроглии. Она покрывает около 85 процентов наружной поверхности мозговых капилляров, к которой тесно прилегают присосковые ножки клеток нейроглии. Они способны растягивать просвет капилляра и суживать его. Основная их роль сводится к питанию нейронов. Присосковые ножки высасывают из крови необходимые нейронам питательные вещества и выводят обратно в кровь продукты их обмена веществ (не случайно астроциты получили название «питательных клеток» или «клеток-кормилиц»). При этом нейроглия может менять окислительный потенциал входящих в ее состав элементов, что вызывает изменение электрического заряда клеток и – соответственно – активности мозгового барьера: он становится менее проницаемым, если окислительный потенциал астроцитов повышен.
Мозговые капилляры опутаны сложным сплетением астроцитов (звездчатых клеток), их отростков-дендритов и присосковых ножек, которые проникают в эндотелий капилляров. Все вместе они образуют одну из «линий обороны» гематоэнцефалического барьера. 1 – просвет капилляра, 2 – астроциты, 3 – базальная мембрана, 4 – присосковые ножки астроцитов.
Но и нейроглией не исчерпывается заслон между кровью и мозгом. Барьерными функциями обладают также окутывающие мозг мягкие оболочки и сосудистые сплетения его боковых желудочков, принимающих активное участие в образовании цереброспинальной жидкости. Проницаемость капилляров сосудистых сплетений несколько выше, чем у капилляров мозга. Щели между эндотелиальными клетками в капиллярах сосудистых сплетений шире, хотя также замкнуты плотными контактами, обращаемыми в сторону полости мозговых желудочков. Здесь проходит третья линия обороны, третья ступень гематоэнцефалического барьера.
В целом же из этих линий образуется объединенный защитный и регуляторный механизм, подобно тому, как из отдельных органов с различным строением и назначением складываются дыхательная, пищеварительная, сердечно-сосудистая, эндокринная и другие системы. Гематоэнцефалический барьер – это мозаика приспособительных механизмов головного и спинного мозга, или, образно выражаясь, федерация автономных, но взаимосвязанных составных частей не только анатомического, но и физиологического механизма.
По аналогии с ГЭБ, гематоретинальный барьер осуществляется за счет ретинальных капилляров.
Эндотелий ретинальных капилляров отличается наличием особо прочных межклеточных соединений zonula occludens (прочность их повышается при введении гистамина). Клетки эндотелия не имеют фенестрированной стенки.
Эндотелий хориокапилляров имеет фенестрированную стенку, проницаем и не выполняет барьерных функций. Барьерная функция осуществляется пигментным эпителием. Клетки его соединяются между собой так прочно как и эндотелий ретинальных капилляров.
При выборе сосудорасширяющего препарата необходимо учитывать специфические требования офтальмологии. Во-первых, препарат должен оказывать избирательное влияние на периферические и церебральные сосуды. Не каждый ангиотропный препарат периферического действия влияет на глаз. Кроме того, чрезмерное расширение церебральных сосудов может вызывать неблагоприятное для глаз перераспределение крови в системе внутренней сонной артерии. Поэтому необходимо предварительно проверить его действие на сосудистую систему глаза. Во-вторых, такой препарат не должен снижать общее артериальное давление. Большинство вазодилататоров, как известно, снижает уровень артериального давления, что может привести к нарушению баланса между интравазальным и экстравазальным давлением. В этом случае сосуды сетчатки, особенно хориоидеи, подвергаются компрессии, что вместо оживления кровообращения может привести к противоположному состоянию – ишемии.
В последнее время в лечении ВМД применяются пептидные биорегуляторы. Полипептиды сетчатки глаз телят относятся к группе пептидных биорегуляторов ( цитомединов) — веществ полипептидной природы, получаемых из различных органов и тканей организма (головного мозга, гипоталамуса, костного мозга, селезенки, легких, печени, вилочковой железы, сетчатки и других). Полипептиды сетчатки глаз телят – комплекс пептидов выделенных из сетчатки крупного рогатого скота.
В организме человека и животных регуляторные полипептиды расположены на поверхности клетки и входят в состав клеточных мембран. Они отсутствуют в ядерной, митохондриальной и лизосомальной фракциях. Их биологические эффекты осуществляются через специфические рецепторы, расположенные на поверхности клетки. После экзогенного введения полипептидов развивается эффект пептидного каскада, в результате чего даже после полного выведения экзогенных полипептидов из организма их биологическое действие сохраняется. Полипептиды сетчатки глаз телят уменьшают деструктивные изменения в пигментном эпителии сетчатки при различных формах дегенерации, модулируют активность клеточных элементов сетчатки, улучшают эффективность функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов, стимулируют фибринолитическую активность крови, оказывают иммуномодулирующее действие (увеличивается экспрессия рецепторов на Т и В – лимфоцитах, повышается фагоцитарная активность нейтрофилов).
При лечении дегенерации сетчатки успешно применяются пептиды – тималин, тимоген, кортексин, ретиналамин, эпиталон, вилон по схеме.
Учитывая все вышеизложенное, нашей задачей являлось составление схемы лечения при которой отсутствовал бы «медикаментозный стресс», наблюдающийся при назначении большого количества препаратов и в больших дозах. Лечение должно быть направлено на постоянное поддержание уровня гемодинамики и улучшения трофики в ишемизированных тканях. Оно должно хорошо переноситься пациентом, быть доступным, не требовать постоянного пребывания на больничной койке, т.е. проводиться в домашних условиях. К тому же с целью предотвращения медикаментозного стресса схема лечения должна быть разработана на длительный период, одномоментно не должно применяться большого количества препаратов (не более 2-3). Кроме того, при составлении схемы лечения предпочтение отдавалось препаратам, обладающим более широким спектром действия, сочетающим в себе воздействие на различные звенья патогенеза.
По данным статистики из 20 тыс. пациентов, страдающих ВМД, только 156 человек за 2006 г. получили стационарное лечение в глазном отделении РКБ им. Н.А. Семашко. Это и понятно, стационары должны оказывать неотложную помощь, хирургическое лечение, консервативную и лечебную помощь пациентам со сложной офтальмологической патологией. Поэтому принципиальным условием при составлении схемы лечения было проведение ее в домашних условиях. К тому же концентрация препаратов должна поддерживаться на необходимом уровне в течение месяцев.
Обязательным требованием к применяемым препаратам являлось прохождение через гематоэнцефалический и гематоофтальмический барьеры. Мы ставили задачу оптимизировать пути введения препаратов по возможности избегая парабульбарных, ретробульбарных, субконъюнктивальных инъекций, которые проводятся только врачом офтальмологом. С этой целью предложено применение физиотерапевтических методов лечения в домашних условиях, т.к. они обеспечивают лучший доступ препаратов к тканям глаза.
Лекарственный электрофорез /ЛЭФ/, предложенный в России в 1801 году, получил широкое применение в различных отраслях клинической медицины. В то же время в офтальмологии до настоящего времени этот метод применяется ограничено. Такое положение связано, прежде всего, с недостаточным знакомством практических врачей офтальмологов с этим методом лечения, а также с определенными техническими трудностями организации, в частности ванночкового электрофореза.
ЛЭФ представляет электрофармакологический комплексный метод электротерапии, при котором воздействуют однонаправленным током, чаще гальваническим, и лекарственным веществом, введеным в организм посредством этого тока.
Действие лекарственного вещества, вводимого в организм с помощью постоянного тока, развивается двумя путями:
1 — лекарственные вещества вызывают непрерывное как в процессе процедуры, так и после нее ( из образовавшегося в результате процедуры депо лекарственного вещества ) длительное раздражение нервных окончаний, заложенных в участках кожи или слизистой, подвергнутых электрофорезу, т.е. возникает рефлекторная реакция.
2 — лекарственные вещества, поступая из тканей, через которые они вводятся во внутренние среды организма, оказывают непосредственное действие как на ткани, контактирующие с лекарственным агентом, так и на глубже лежащие за счет воздействия их гуморальным путем.
Особенности этого метода лечения, применительно к офтальмологии можно сформулировать следующим образом:
1. Методом электрофореза лекарственное вещество может быть введено в ткани и среды глаза в достаточном количестве для получения выраженного терапевтического эффекта.
Поступление лекарственного вещества в ткани при электрофорезе обусловлено созданием разницы электропотенциалов и электродвижущей силой, электропроводностью тканей, явлениями электролитической диссоциации и нахождением медикаментов в ионизированном состоянии, увеличением проницаемости клеточных мембран под влиянием гальванического тока.
2. При соблюдении правил проведения процедур ЛЭФ, не отмечается какого-либо повреждающего действия на ткани глаза. Этим данный метод выгодно отличается от подконъюктивального введения в инъекциях.
3. Лекарственное вещество при ЛЭФ депонируется в тканях глаза и действие его значительно пролонгируется.
4. Усвоение медикамента, вводимого методом электрофореза, происходит на фоне активации процессов метаболизма в тканях глаза под действием электрического тока.
5. Лекарственное вещество, введенное в состоянии электрической активности, т.е. не в молекулярной форме, а в виде ионов или отдельных ингредиентов, на терапевтическое действие которых рассчитывают, обладает более выраженным фармакологическим действием.
6. Метод ЛЭФ дает возможность достигнуть высоких концентраций медикаментов в тканях и средах глаза без насыщения ими всего организма, что особенно важно при использовании средств с выраженным побочным действием, а также при отсутствии необходимости парентерального введения каких-либо медицинских препаратов при абсолютно соматически здоровом организме.
7. Преимущество метода состоит и в том, что путем электрофореза можно вводить только биологически активные субстанции медикаментов, оставляя за пределами организма балластные вещества, которые могут вызывать побочное действие.
8. Электрофорез лекарственного вещества сопровождается элиминированием из тканей продуктов воспаления и дегенеративно — дистрофических процессов.
9. При проведении ЛЭФ необходимо учитывать полюсность введения лекарственных средств и действие гальванического тока. В тканях, находящихся в зоне локализации электродов накапливаются продукты электролиза, изменяется РН среды, на катоде повышается проницаемость тканей и электровозбудимость нерва, обратные явления наблюдаются на аноде. Улучшается трофика тканей и активизируются процессы регенерации. Под влиянием слабых воздействий гальваническим током находили изменения в палочковом и колбочковом зрении /С. В.Кравков и Л.П.Галочкина/. При действии анода чувствительность зрительного анализатора повышалась и, напротив, снижалась под действием катода. Аналогичным образом изменялась цветовая /колбочковая/ чувствительность адаптированного к темноте глаза. Анод повышал чувствительность глаза к сине-зеленым лучам и понижал к оранжево-красным, катод вызывал обратные явления. Под действием анода снижалось внутриглазное давление, уменьшаются слепое пятно и ангиоскотомы/ Р.Б.Зарецкая,1948; А.В.Рославцев, 1949/.
10. Результаты применения гальванизации и ЛЭФ во многом зависят от дозировки тока и лекарственного вещества. Гальванический ток малой плотности /0,01-0,05 мА/ см.кв. при непродолжительном воздействии, действуя по типу слабого раздражителя, оказывает симпатикотропный эффект, повышая жизнедеятельность клеточного вещества, улучшая реактивность организма, способствует ликвидации или торможению патологического процесса. Высокие дозировки тока приводят к необратимым изменениям, денатурации белка, вплоть до гибели клетки. Поэтому с терапевтической целью используются малые и средние плотности /0,01-0,1 мА см кв./ гальванического тока.
В ЛЭФ обычно используются концентрации лекарственных веществ в пределах от 0,1% до 10%, реже 20-30% растворы. Высокие концентрации медикаментов существенно не увеличивают количество вводимых препаратов, но при этом значительно возрастают побочные реакции.
11. Электрофорез сложных лекарственных смесей и комплексов правильно подобранных и примененных усиливает конечный лечебный эффект. При использовании лекарственных смесей необходимо соблюдать химическую и электрофизиологическую совместимость. Для аминокислот и ферментных препаратов следует учитывать изоэлектрическую точку соединения, а также РН среды растворителя и снижение скорости перемещения ионов в сложных электролитах.
Нами разработан удобный портативный и простой в использовании аппарат для электрофореза, позволяющий пациенту самостоятельно или под наблюдением семейного врача получать процедуры дома.
Учитывая все вышеизложенное предлагаются следующие схемы лечения:
Обоснование выбора лекарственных средств.
Пентоксифиллин обладает преимуществом среды препаратов, предназначенных для коррекции нарушений микроциркуляции при сосудистых заболеваниях, благодаря его многосторонним эффектам и является оптимальным препаратом для лечения на разных стадиях заболеваний.
— блокада аденозиновых рецепторов и ингибирование фосфодиэстеразы, что приводит к :
а) выделению ПГI2 (активный вазодилятатор)
б) увеличению концентрации цАМФ в тромбоцитах и лейкоцитах (что снижает их способность к агрегации)
— увеличение концентрации ионов кальция в эритроцитах и улучшение энергетического метаболизма клетки (влияние на деформабельность);
— стимуляция выработки факторов снижающих вязкость крови и снижение уровня фибриногена
1. Быстро всасывается в ЖКТ.
2. Максимальная концентрация в плазме крови достигается в течение 1 часа и начинает снижаться через 2 часа после приема препарата, за первые 4 ч выводится до 90% дозы.
3. Метаболизируется в печени.
4. Способ выведения – почки.
Физиологические эффекты пентоксифиллина:
— увеличение деформабельности (эластичности) эритроцитов
— уменьшение агрегации форменных элементов крови, с преимущественным действием на эритроциты
— уменьшение уровня фибриногена плазмы
— снижение активности нейтрофилов (уменьшение образования свободных радикалов, адгезии и агрегации)
— блокада действия воспалительных цитокинов и выработки ряда гуморальных факторов, способствующих повреждению сосудистой стенки в условиях ишемии.
Исследования, которые проводились в мире за последние 30 лет, доказали, что максимального результата лечения пентоксифиллином можно достичь при применении дозировки 1200 мг в сутки. (Hartmann, 1985, Porter, 1982, Lindgarde, 1989, Ernst, 1992, Black, 1992, Blume, 1992, Ward A.,Clissold P.,Drugs,1987) (По данным С.А. Дроздова, 2003, именно дозировка 1200 мг позволяет значимо снизить индуцируемую ишемией активизацию нейтрофилов и связанное с ней образование свободных радикалов, что препятствует дальнейшему повреждению эндотелия и усугублению ишемии).
В связи с доказательством высокой эффективности пентоксифиллина в дозировке 1200 мг, стало необходимым применение пролонгированных (ретардных) форм. Это также позволило снизить количество побочных эффектов за счет постепенного выделения активного вещества и снижения пика концентрации. Ретардная форма пентоксифиллина имеет более низкий процент побочных эффектов по сравнению с неретардными формами
В исследовании Passero с соавт, 1981 было доказано, что пероральное и внутривенное использование пентоксифиллина, достоверно увеличивает регионарное и общее церебральное кровообращение у пациентов с хроническими цереброваскулярными заболеваниями. Среднее увеличение кровотока достигает в соответствующих случаях в среднем 20% от исходного уровня, причем эффект максимален в наиболее плохо кровоснабжаемых областях (отсутствие синдрома обкрадывания).
Вазонит — новый, высокоэффективный, безопасный и удобный для врача и пациента препарат пентоксифиллина с уникальным механизмом выделения активного вещества, который позволяет проводить терапию сосудистых заболеваний на уровне мировых стандартов при минимальном риске для пациента, и дает врачу уверенность в правильном соблюдении его предписаний, за счет минимальной кратности приема.
Ключевые преимущества препарата, используемые для решения проблем клиентов
1. Уникальный механизм выделения активного вещества, благодаря которому поддерживается стабильная терапевтическая концентрация препарата на протяжении 12 часов, что обеспечивает:
— отсутствие ночного перерыва в лечении
— отсутствие пика концентрации
— отсутствие «синдрома обкрадывания»
— хорошую переносимость и минимальное количество побочных эффектов (до 2-3 %)
Пролонгированный эффект обусловлен:
частичной гидратацией внешней поверхности таблетки с образованием «оболочки» псевдогеля, замедляющей скорость эрозии таблетки, общую скорость растворения и, соответственно, скорость выделения активного вещества.
2. Дозировка 600 мг, которая обеспечивает эффективную суточную дозу 1200 мг за 2 приема, что соответствует мировым стандартам терапии, а также обеспечивает удобство приема для пациента и уверенность доктора в выполнении его предписаний
3. Количество побочных эффектов при применении Вазонита в 2 раза меньше чем при применении других ретардных форм, что дает право считать Вазонит максимально безопасным препаратом пентоксифиллина (А. Покровский, А. Чупин, 2003)
Эффекты, указанные в пп.2-6 реализуются при длительном (свыше трех месяцев) применении препарата. Острая патология (тромбоз центральной артерии сетчатки) требует дополнительного применения тромболитиков (гепарин или клексан или фраксипарин), антиагрегантов (аспирин или клопидогрель или тиклопедин) и более мощных антиоксидантов (унитиол, витамины С и Е).
Витамины группы В – неуробекс, нейровитан.
Витамины группы В, особенно В1, В6, В12, непосредственно участвуют в обменных процессах, происходящих в нервной ткани, препятствуют образованию продуктов конечного гликозилирования. В частности, витамин В1 участвует в синтезе ацетилхолина, оказывает регулирующее воздействие на трофику и деятельность нервной системы. Витамин В6 участвует в синтезе нейромедиаторов, белков некоторых ферментов, а также снижает уровень холестерина и липидов крови. Витамин В12, кроме непосредственного участия в эритропоэзе, оказывает анаболическое действие, улучшая трофику периферической нервной системы. Следовательно, применение комплексных препаратов, содержащих лечебные дозировки витаминов группы В в составе медикаментозной терапии ВМД имеет патогенетическую направленность. Современные оптимально сбалансированные В — витаминные комплексные препараты для перорального применения Неуробекс и нейровитан содержат витамины В1, В6, В12 в дозировках, обеспечивающих суточную потребность организма, удобны для применения, имеют минимальный риск развития передозировки и побочных эффектов.
Важным аспектом в вопросе комплексной терапии, кроме эффективности и безопасности, является ее стоимость. Еще одно достоинство препарата Неуробекс, кроме доказанной клинической эффективности, заключается в его экономической доступности. В настоящее время на рынок выведена экономичная упаковка Неуробекс № 60, что более удобно и экономически оправданно при курсовом назначении препарата в составе комплексной терапии.
Является антиоксидантом, обладающим антигипоксической, ангиопротекторной, антиагрегантной активностью. Применяется для лечения заболеваний сопровождающихся уменьшением и гипоксией.
Стабилизируя клеточные мембраны эндотелиоцитов и тромбоцитов, он обладает ангиопротекторными свройствами. За счет увеличения количества тромбоксана А2 и простагландина Е, эмоксипин уменьшает проницаемость сосудистой стенки и вязкость крови и аэрацию тромбоцитов и нейтрофилов, улучшая реологические свойства крови. Улучшает рассасывание внутриглазных кровоизлияний, обладает фибриологическими свойствами, улучшает микроциркуляцию глаза. Эмоксипин также является ретинопротектором, защищая сетчатку от повреждающего действия света высокой интенсивности.
Фезам представляет собой комбинацию циннаризина 25 мг и пирацетама 400 мг, позволяет достичь одновременного сочетания положительных качеств 2-х препаратов в одном медикаментозном средстве.
Основной механизм действия пирацетама связан с изменением метаболических, биоэнергетических процессов в нервной клетке, повышением скорости обмена информационных макромолекул и активацией синтеза белка.
Исследования в области эксперименталь¬ной фармакологии позволили выделить основ¬ные фармакологические эффекты, присущие ноотропным препаратам, в т.ч. и пирацетам:
1. Коррекция нарушений обучения и памяти, вызванных различными воздействиями.
2. Повышение устойчивости мозга к различ¬ным вредным воздействиям (гипоксия, инток-сикации, понижение или повышение темпера¬туры и т. д.).
3. Специфические эффекты на вызванные по¬тенциалы и спектры мощности ЭЭГ – увеличение амплитуд транскаллозальных вызванных потенциалов, усиление спектра мощности ЭЭГ коры и гипокампа, увеличение доминирующего пика, сглаживание межполушарной асимметрии.
4. Коррекция нарушений функций ЦНС и невро¬логических дефицитов, возникающих при старе¬нии и у молодых, подвергшихся вредным воздей¬ствиям (алкоголизация, интоксикация, гипоксия).
5. Улучшение специфических гемореологических показателей и нормализация нарушен¬ного мозгового кровообращения.
Клиническая практика дает основание создавать и испытывать комбинации пирацетама с представителями различных фармакотерапевтических средств, в том числе вазоактивными.
Среди цереброангиопротекторов наиболее распространенным является применение ан-тагонистов кальция, в частности циннаризина.
Действие циннаризина характеризуется вы¬сокой тропностью к сосудам головного мозга. Его в значительной мере связывают с блокадой кальциевых каналов. Ингибируя поступление в гладкомышечные клетки сосудов ионов каль¬ция, циннаризин снижает тонус гладкомышечной оболочки артериол, уменьшает их реакции на биогенные сосудосуживающие вещества (адреналин, норадреналин, брадикинин), пре¬дупреждает патологическую вазоконстрикцию (синдром вторичной постишемической гипоперфузии). Кроме того, повышение деформи¬руемости эритроцитов и снижение вязкости крови улучшает микроциркуляцию. Необходи¬мо отметить, что циннаризин увеличивает сум¬марный и регионарный мозговой кровоток, оказывая избирательное действие на спазмированные сосуды, и не вызывает синдром об¬крадывания. Этими механизмами обеспечива¬ется защитное противоишемическое действие. В патогенезе острой и хронической ишемии мозга значительная роль отводится нарушени¬ям процессов транспорта кальция. Избыток внутриклеточного кальция, обусловленный ишемией, активизирует клеточные энзимы, ко¬торые приводят к нарушениям белковых и липидных структур, к функциональной недоста¬точности нейрона. Применение антагонистов кальция приводит к прерыванию патобиохимических реакций, обусловленных гипоксией. Из других свойств циннаризина следует отме¬тить уменьшение возбудимости вестибулярно¬го аппарата и антигистаминную активность.
Таким образом, имеющиеся клинические и эксперименталь¬ные предпосылки дали основание предложить фиксированную комбинацию пирацетама и циннаризина с назва¬нием «Фезам». Цель комбинации — получение препарата, обладающего более сильными антигипоксическим и церебропротекторным эф¬фектами для лечения заболеваний, связанных с гипоксическими и ишемическими состояния¬ми.
Терапия комбинированным препаратом Фезам дает возможность уменьшить количество таблеток по сравнению с раздельным приемом циннаризина и пирацетама, и тем самым сократить затраты на лечение и повысить комплаентность больных к назначенной терапии.
Оксибрал – винкамин, это природный алкалодид, содержащийся в барвинке малом, оказывающий пролонгированное действие, в форме капсул с медленным высвобождением действующего вещества.
По сравнению с большинством других ноотропных и вазотропных средств, ОКСИБРАЛ обладает сбалансированным соотношением трех принципиальных компонентов своего фармакологического эффекта, а именно:
1) нейрометаболическим действием;
2) нейромедиаторным действием (Olpe H.R., 1982; Hock F.J., 1995; Erdo S.A., 1996);
В результате этого для препарата ОКСИБРАЛ характерно интегральное нейропротекторное действие, свойственное только данному препарату. ОКСИБРАЛ нормализует процессы энергетического обмена в нейронах, улучшает кислородное обеспечение нервных клеток, повышает их устойчивость к гипоксии, стимулирует процессы белкового синтеза (Karpati E., 2002). ОКСИБРАЛ также нормализует нарушенный при старении и различных заболеваниях нервной системы баланс активности различных нейромедиаторных систем мозга. Наконец, он улучшает кровоснабжение мозга, прежде всего на уровне капилляров, и эффективно предотвращает развитие перикапиллярного отека (Jucker M., 1990). Таким образом, ОКСИБРАЛ действует практически на все звенья ишемии мозга и поэтому может быть признан комплексным антиишемическим препаратом.
Кавинтон, синтезированный специалистами «Гедеон Рихтер», представляет собой синте¬тическое призводное винкамина, ес¬тественного алкалоида малого бар¬винка, относится к группе вазоактивных протекторов антигипоксического действия.
Выбор препарата связан с особенностями его действия:
— сочетанием высокой эффек¬тивности, хорошей переносимости и отсутствия взаимодействия с дру¬гими лекарственными средствами;
— отсутствием синдрома обкра¬дывания;
— отсутствием токсического действия и кумуляции;
— избирательностью действия на цен¬тральную нервную систему при отсут¬ствии влияния на функции других органов, отсутствием влияния на уровень артери¬ального давления и частоту сердечных со¬кращений;
— безопасностью для пациентов пожи¬лого возраста даже при длительном лече¬нии.
Фармакологическое действие кавинтона заключается:
— в оказании сосудорасширяющего воз¬действия на сосуды головного мозга. При этом препарат осуществляет нормализацию гемодинамики в сосудах крупного и сред¬него калибра, а также в зонах артерио — венозного кровотока, нормализует тонус ар¬терий и вен;
— препарат обладает гемореологической активностью, повышая деформируе¬мость эритроцитов, снижая вязкость кро¬ви, агрегационную активность эритроцитов и тромбоцитов, замедляя синтез катехоламинов и АТФ;
— оказывает протективное действие на ткани мозга, влияя на нормализацию простаноидного контроля метаболизма мозго¬вой ткани, усиливает аэробный гликолиз в мозге, улучшает усвоение кислорода в моз¬говой ткани;
— влияет на сосудистую стенку, сни¬жая адгезивную активность стенки сосу¬да за счет предупреждения и/или устране¬ния кальцификации артерий;
— снижает судорожную готовность мозга за счет увеличения активности «антиэпилептического вала».
Экстракт имеет сложный химический состав, включая более 40 ингредиентов, основными из которых являются флавоноидные гликозиды (24 %), терпеновые соединения (6 %), а также гинкголиды А, В, С, J и билобалиды; именно эти соединения обусловливают специфическую фармакологическую активность экстракта гинкго двулопастного. Кроме того, в нем содержатся проантоцианидины и органические кислоты, котрые способствуют повышению биодоступности прочих компонентов.
Входящие в состав экстракта вещества обладают широким спектром фармакологической активности. Экстракт гинкго двулопастного оказывает вазопротекторное действие, нормализует тонус артерий и вен, препятствует ангиоспазму, уменьшает проницаемость капилляров, улучшает микроциркуляцию, тормозит агрегацию тромбоцитов, увеличивает потребление мозгом кислорода и глюкозы, повышает содержание АТФ в коре головного мозга. Улучшает коронарное и мозговое кровообращение, обладает антиоксидантными свойствами, улучшает сенсорную и когнитивную функции, эффективен при вестибулопатиях. Имеются данные о том, что применение экстракта гинко билоба способствует увеличению М – холинорецепторов в коре головного мозга и повышает обмен допамина и норадреналина в структурах головного мозга.
Терапевтический эффект наступает в среднем через 7-8 дней, максимальный эффект развивается через 18-20 дней после начала приема экстракта. При нормотензии не влияет на уровень АД, а при АГ способствует некоторому его снижению. При длительном применении (более 6 мес) не оказывает влияния на функцию почек.
Высокой терапевтической эффективностью при лечении дистрофических заболеваний сетчатки (ДЗС) обладают пептидные биорегуляторы ретиналамин и эпиталон. Ретиналамин — комплекс низкомолекулярных полипептидов с молекулярным весом до 10000 Д получают методом специальной экстракции из сетчатки глаза телят. При изучении влияния ретиналамина на пролиферативую активность клеток сетчатки и пигментного эпителия, была выявлена его способность тканеспецифически вызвать активную пролиферацию культуры данных клеток. В ряде исследований последних лет доказана многофункциональная способность ретиналамина и его синтетического аналога — тетрапептида эпиталона (см.ниже) контролировать пролиферативную активность клеток соответствующей ткани и запускать процесс дифференцировки в полипотентной ткани. При этом запускается не просто дифференцировка, а каскад взаимосвязанных дифференцировок, как, например, в направлении формирования тканей глаза.
Имеющиеся экспериментальные данные, позволяют предполагать, что биологически значимый информационный импульс — сигнал, материальным субстратом которого является группа активных центров молекул полипептида (например, группа из 2 — 4 определенных аминокислот), изменяет функциональную активность генома клеток-мишеней, инициируя экспрессию генов, участвующих в процессе дифференцировки ткани глаза. По-видимому, направление воздействия пептидного комплекса ретиналамина и эпиталона зависит от исходного функционального состояния и степени дифференцировки клеток, обусловленного в частности состоянием их мембранорецепторной зоны, являющейся каналом передачи пептидных сигнальных молекул к геному клетки. Характерно, что при воздействия пептидов на дифференцированные клетки взрослого организма в кратковременной культуре наблюдается пролиферативная активность клеток, однако при этом поддерживается и их тканевая специфичность. В проведенных в последнее время исследованиях показано, что процесс пролиферации ткани под воздействием пептидов не подавляет процесс поддержания тканеспецифической дифференцировки — оба этих механизма работают синхронно и взаимосвязано, в результате чего клетки в процессе культивирования под воздействием пептидов не теряют признаков дифференцировки, сохраняя высокую интенсивность пролиферации. Таким образом, пептидные препараты ретиналамин и эпиталон, обладают природными модулирующими функциями и способны воздействовать как на дифференцированные клетки взрослого организма, запуская пролиферацию клеток сетчатки, поддерживая при этом тканевую специфичность, так и на полипотентные или стволовые (в том числе аутоклетки) индуцируя их тканеспецифическую дифференцировку. Последним, вероятно, обусловлена высокая клиническая эффективность применения пептидных препаратов совместно со стволовыми клетками, превышающая эффективность изолированного применения этих методов лечения.
Ретиналамин и эпиталон обладает тканеспецифическим действием на сетчатку глаза, оказывают стимулирующее действие на фоторецепторы и клеточные элементы сетчатки, способствуют улучшению функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов при дистрофических изменениях, ускоряет восстановление световой чувствительности сетчатки. Ретиналамин нормализует проницаемость сосудов, уменьшает проявления воспалительной реакции, стимулирует репаративные процессы при заболеваниях и травмах глаза. Ретиналамин применяют у больных при всех формах ДЗС и ряде других заболеваний сетчатки глаза. Особенно выкая эффективность отмечена при применении ретиналамина при центральных и периферических тапеторетинальных абиотрофиях, диабетической ретинопатии, а также вторичных посттравматических и поствоспалительных дистрофиях сетчатки и пигментной дегенерации сетчатки различного генеза – при этих заболеваниях удается достичь различной степени улучшения основных показателей зрения у 95,2 % больных. Препарат разрешен для медицинского применения приказом МЗ РФ №212 от 01.06.1999 9рег. № 99.212.7. Метод получения пептидного биорегулятора ретиналамина исключает возможность присутствия в препарате жизнеспособных вирусов, прионов или функционально активных протоонкогенов. Следует подчеркнуть отсутствие каких – либо токсических или аллергических реакций за весь период (более 10 лет) изучения и применения ретиналамина у пациентов. Препарат хорошо переносится пациентами, совместим со всеми лекарственными веществами, используемыми в комплексном лечении сопутствующих соматических заболеваний.
Учитывая данные полученные в последние годы о механизме действия регуляторных иептидов как сигнальных молекул, действующих на уровне двойной спирали ДНК и влияющих на активность промоторных центров ряда генов, была детально изучена молекулярная структура полипептидньк факторов входящих в состав ретиналамина. В результате были выявлены аминокислотные группы, ответственные за реализацию основных биологических эффектов ретиналамина и являющиеся теми ключевыми участками молекул полипептидов, входящих в состав данного препарата, которые ответственны за передачу биологически наиболее значимой информации на уровне генома. На основании изучения аминокислотного состава ретиналамина, путем целенаправленного химического синтеза был получен тетрапептид эпиталон, обладающий всеми биологическими эффектами ретаналамина в «концентрированном» виде (11). В ряде экспериментов установлены уникальные ретинопротекторные и геропротекторные свойства эпиталона и его способность вызывать активную дифференцировку полипотентных клеток в клеточные элементы сетчатки глаза. В настоящее время препарат проходит клинические испытания в ряде ведущих научных центров РФ и Украины.
Ретиналамин применяется в виде внутримышечных инъекций, ежедневно, однократно по 5,0 — 10,0мг в сутки, в течение 10 дней (50,0 — 100,0 мг на курс лечения). Препарат может также вводиться с помощью электрофореза и фонофореза через различные участки тела, в том числе через ткани глаза и слизистой оболочки носовых ходов. Физиотерапевтические методы введения ретиналамина не только не уменьшают клиническую эффективность, но и способствуют прямой, целенаправленной доставке препарата в зону его преимущественного приложения, приводя к более быстрому и полному позитивному клиническому эффекту. При этом исключается возможность появления осложнений, встречающихся при использовании инъекционного метода введения. Кроме того, применение физиотерапевтических способов введения ретиналамина позволяет проводить курсовое лечение (а, при необходимости, и повторные курсы лечения) на дому у пациента, без соблюдения специальных стерильности процедурного кабинета, в удобное для больного время, без отрыва от его ежедневной профессиональной и бытовой деятельности, что без сомнения является более комфортным и служит улучшению качества жизни данного пациента.
В заключение следует отметить, что при проведении курса лечения ретиналамином практически все пациенты отмечают повышение качества жизни, как за счет повышения зрительных функций , так и в результате улучшения общего самочувствия, эмоционального фона и повышения работоспособности. При применении ретиналамина побочных реакций, осложнений или лекарственной зависимости не наблюдается. Аллергических реакций не отмечается даже у лиц с неблагоприятным аллергическим анамнезом. Все вышеперечисленное позволяет считать ретиналамин одним из наиболее эффективных препаратов для лечения патологи сетчатой оболочки глаза и рекомендовать его в качестве препарата выбора при дистрофических заболеваниях глаз. Методы введения ретиналамина с помощью электро- и фонофореза могут быть оценены, как особо перспективные.
источник