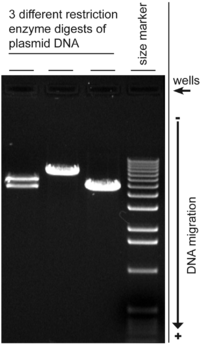
Электрофорез в агарозном геле проводят в горизонтальном направлении, так как при этом 1) гель с низкой концентрацией агарозы лучше держится, 2) получается меньшее перекашивание (коллапс) в процессе электрофореза и 3) меньше искажаются полосы ДНК. По-видимому, проще всего работать с системой, когда гель полностью покрыт слоем буфера для электрофореза толщиной около 1 мм. Сопротивление агарозы ненамного превышает сопротивление буфера, так что значительная часть тока течет через агарозу.
Во все буферы с нейтральными значениями рН можно добавлять 0,5 мкг/мл бромистого этидия.
В процессе электрофореза буфер у анода защелачивается, а у катода закисляется. Поэтому обычно пользуются буферной системой с высокой емкостью. Буферы не содержат ионов Cl — , так как последние не обладают буферной емкостью, и их присутствие может привести к тому, что ДНК в геле утратит биологическую активность.
- Трис-боратный буфер. Обладает высокой буферной емкостью. При его использовании, по-видимому, получаются наиболее узкие полосы. Основной раствор 10 × не зарастает, но при длительном хранении в нем образуется осадок, который растворим в щелочи. В присутствии бората агарозные гели не растворяются при высокой концентрации NaClO4 или KI.
- Трис-фосфатный буфер. Тоже обладает высокой емкостью. При его использовании получаются примерно такие же результаты, что и при использовании трис-боратного буфера. Основной раствор, однако, может зарастать. Его преимущество заключается в том, что такие гели можно растворять в концентрированном растворе NaClO4 или KI.
- Трис-ацетатный буфер. Обладает относительно низкой буферной емкостью, и при длительном электрофорезе может возникнуть необходимость в рециркуляции буфера в аппарате. Использование при электрофорезе высоких напряжений не вызывает нагрева. Исходные растворы могут зарастать. Гели в трис-ацетатном буфере можно растворять в концентрированном NaClO4 или KI. Этот буфер, по-видимому, используется наиболее широко.
- Щелочной буфер. Обладает очень низкой емкостью. Обычно при его использовании необходима рециркуляция буфера в аппарате. Наносимые образцы не должны содержать Mg 2+ , иначе ДНК выпадет в осадок. Ионы Mg 2+ необходимо удалять, добавляя избыточные количества ЭДТА.
Препараты агарозы значительно различаются по твердости, по разрешающей способности при разделении фрагментов ДНК, электрофоретической подвижности ДНК, легкости плавления, прозрачности и наличию вредных примесей. Наиболее вредной примесью являются, по-видимому, сульфонированные агарозы, подавляющие активность многих ферментов, работающих на нуклеиновых кислотах.
Обычно мы пользуемся агарозой фирмы МС/В. Агарозу растворяют в буфере для электрофореза, нагревая до кипения в микроволновой печи. Необходимо убедиться, что раствор стал гомогенным и что в нем не осталось твердых частиц агарозы. Перед тем как залить гель, раствор охлаждают до 50°С. Если заливать гель слишком горячей агарозой, то легко можно повредить аппарат для электрофореза
Лунки для образцов делают с помощью погруженной в расплавленный гель гребенки из оргстекла, полихлорвинила или тефлона. Гребенку устанавливают до заливки геля таким образом, чтобы кончики зубьев находились примерно в 0,5 мм от основания геля. Если лунки достанут дна, то образец может протечь под гель. Когда гель полностью застынет, гребенку вынимают и лунки заполняют буфером для электрофореза.
Г. Нанесение образцов и краски
Наносимые образцы содержат 5-10% глицерола или 5-10% сахарозы и 0,025% красителя, благодаря которому можно проследить за ходом электрофореза. Например, можно добавить в образец 1 /10 объема раствора, содержащего 50% глицерола и 0,25% красителя.
ДНК. Наносите около 10 нг ДНК в расчете на каждую ожидаемую полосу. Гель будет перегружен, если в полосе окажется более чем примерно 100 нг ДНК.
Бромфеноловый синий (распадается в щелочи).
Бромкрезоловый зеленый (обладает одинаковой подвижностью и в нейтральных, и в щелочных растворах). Ксиленцианол FF (распадается в щелочи; подвижность ниже, чем подвижность бромфенолового или бромкрезолового).
Образцы можно наносить, используя автоматическую пипетку и полипропиленовый наконечник или с помощью микрошприца, на который надет тонкий пластиковый шланг.
Подвижность небольших молекул ДНК может быть такой же или даже большей, чем подвижность используемого красителя. Чем ниже концентрация агарозы и (или) выше напряженность, тем больший фрагмент ДНК будет обладать такой же подвижностью, как и краситель. Краситель поглощает флуоресценцию связанного с ДНК бромистого этидия. Это приводит к тому, что в том месте геля, где находится краска, невозможно наблюдать слабые полосы ДНК. Образцы можно наносить и без краски.
источник
Электрофорез (от электро- и др.-греч. φορέω — «переношу») —метод разделения макромолекул, различающихся по размеру, молекулярной массе, пространственной конфигурацией, вторичной структурой или электрическому заряду. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
Молекулы в буферном растворе обладают электрическим зарядом, величина и знак которого зависят от pH среды. При пропускании электрического тока через раствор в нем формируется направленное электрическое поле, напряженность которого измеряется разностью потенциалов по концам емкости, в которой производится электрофорез. Под действием поля молекулы начинают движение в направлении катода или анода. Скорость движения зависит от величины заряда, размеров и трения окружающей среды. С течением времени смесь разделяется на фракции, состоящие из молекул, движущихся с одинаковой скоростью. В современных экспериментах рабочий канал приборов для электрофореза заполняют гелем, имеющим структуру сетки. В этом случае основное влияние на подвижность молекул и их степень разделения оказывают их линейные размеры. В некоторых случаях может возникнуть ситуация, при которой особо крупные молекулы не проходят через поры геля.
Бромфеноловый синий и ксиленцианол — могут заметно мешать наблюдению фрагментов под UV. Краситель Cresol red совместим с ферментативными реакциями, практически не мешает наблюдению под UV. OrangeG наиболее подвижный краситель, практически всегда находится вне «рабочей зоны». Заметен под UV. Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле.
Самое широкое применение агарозные гели имеют в исследованиях, связанные с разделением нуклиновых кислот. Последние имеют довольно значительные отрицательный заряд, величина которого слабо зависиот от pH раствора, вследствие чего разделение на фракции происходит в основном за счет различия в линейных размеров молекул. В таких экспериментах используют 0.089М Трис-боратный, 0.05 Трсфосфатный и Трис-ацетатный буфер. Стоит отметить, что при обычном электрофорезе в геле можно разделять фрагменты нуклеиновых кислот, размер которых менее 50 тыс п.н. Также часто из эксперимента нужно получить оценку размеров молекул. Для этого используются наборы молекул известной длины. Например, для регистрации продуктов амплификации ДНК применяется электрофорез в агарозном геле в присутствии бромистого эитидия, который образует с фрагментами ДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФ-излучением длиной волны 290-330 нм.
источник
Электрофорез в агарозном геле является методом гель — электрофореза , используемого в биохимии , молекулярной биологии , генетики и клинической химии , чтобы отделить смешанную популяцию макромолекул , таких как ДНК или белков в матрице из агарозы , один из двух основных компонентов агара . Белки могут быть разделены с помощью заряда и / или размером ( изоэлектрофокусирование электрофореза в агарозном, по существу , не зависит размер), а также ДНК и РНК — фрагменты длиной. Биомолекулы разделены путем применения электрического поля для перемещения заряженных молекул через матрицу агарозы, и биомолекулы отделены друг от друга размером в матрице агарозном геле.
Гель агарозов легко отливать, имеет относительно меньшее количество заряженных групп, и особенно подходит для разделения ДНК диапазона размеров наиболее часто встречающегося в лабораториях, на долю которого приходится популярности ее использование. Разделены ДНК может быть просмотрен с красителем, чаще всего под действием УФ-света, и фрагменты ДНК могут быть извлечены из геля с относительной легкостью. Большинство гели агарозы используются между 0.7-2%, растворенного в подходящем буфере для электрофореза.
Агарозном гель является трехмерный матрицей , составленной из спиральных молекул в агарозных суперспиральных пучках , которые объединяются в трехмерный структуры с каналами и порами , через которые могут проходить биомолекулы. Структура 3-D проводится совместно с водородными связями и , следовательно , может быть разрушена путем нагрева обратно в жидкое состояние. Температура плавления отличается от температуры желатинизации, в зависимости от источников, агарозный гель имеет температуру гелеобразования 35-42 ° C и температуру плавления 85-95 ° С. Низкое плавление и низкие желирующие агарозы , сделанные с помощью химических модификаций, также доступны.
Агарозном гель имеет большой размер пор и хорошую прочность геля, что делает его пригодным в качестве антиконвекции среды для электрофореза ДНК и крупных белковых молекул. Размер пор 1% геле была оценена от 100 нм до 200-500 нм, а его прочность геля позволяет гели в виде разбавленных в 0,15% с образованием сляба для гель — электрофореза. Низкая концентрация-гели (0,1-0,2%) , однако являются хрупкими и , следовательно , трудно управлять. Гель агарозы имеет более низкую разрешающую способность , чем полиакриламидный гель для ДНК , но имеет больший диапазон разделения, и поэтому используется для фрагментов ДНК обычно 50-20,000 п.н. в размере. Предел разрешения для стандартного электрофореза в агарозном геле составляет около 750 кб, но разрешение более 6 Мб возможны с электрофорезом геля импульсным поля (PFGE). Он также может быть использован для разделения больших белков, и это является предпочтительным матрица для гель — электрофореза частиц с эффективным радиусом больше 5-10 нм. 0,9% агарозный гель имеет поры достаточно большой для ввода бактериофага Т4 .
Агарозном полимер содержит заряженные группы, в частности пирувата и сульфата . Эти отрицательно заряженные группы создают поток воды в направлении, противоположном направлению движения ДНК в процессе , называемом electroendosmosis (РВЗ), и , следовательно , может замедлить движение ДНК и вызывает размывание полос. Более высокие концентрации гели будут иметь более высокий электроосмотический поток. Низкая РВЗ агарозу поэтому обычно предпочтительным для использования в агарозном гель — электрофореза нуклеиновых кислот , но высокая РВЗ агарозы может быть использована для других целей. Ниже , содержание сульфатов низкой РВЗ агарозы, в частности , низкой температурой плавления (LMP) агарозы, также полезно в тех случаях , когда ДНК экстрагировали из геля , которые будут использоваться для дальнейших манипуляций в присутствии загрязняющих сульфаты может влиять на некоторые последующие процедуры, такие , в качестве лигирования и ПЦР . Нулевые РВЗЫ агарозы однако являются нежелательными для некоторых применений , так как они могут быть сделаны путем добавления положительно заряженных групп и такие группы могут повлиять на последующие реакции фермента. Electroendosmosis является причиной агарозном используется в предпочтении к агар как агаропектин компонент в агар содержит значительное количество отрицательно заряженных сульфатов и карбоксильных групп. Удаление агаропектина в агарозе существенно снижает РВЗ, а также уменьшения неспецифической адсорбции биомолекул на гелевой матрице. Тем не менее, для некоторых приложений , таких как электрофорез белков сыворотки, высокая РВЗ может быть желательной, и агаропектин может быть добавлен в геле используется.
Ряд факторов может повлиять на миграции нуклеиновых кислот: размерность поры геля (концентрация геля), размер ДНК будучи электрофорез, напряжение используется, ионная сила буфера, а концентрация интеркалирования красителя, такие как бромид этидий если используется во время электрофореза.
Более мелкие молекулы движутся быстрее , чем более крупные молекулы в геле, и движется двухцепочечной ДНК со скоростью, обратно пропорциональна логарифму числа пар оснований. Это соотношение , однако ломается при очень больших фрагментах ДНК, и разделение очень больших фрагментов ДНК требует использования электрофореза импульсного геля — поля (PFGE), который применяет переменный ток с двух разных направлений и большие ДНК — фрагменты разделены , как они переориентироваться с изменение тока.
Для стандартного электрофореза в агарозном геле, более крупные молекулы разрешаются лучше, используя низкую концентрацию геля в то время как меньшие молекулы отделить лучше при высокой концентрации геля. Высокие концентрации геля, однако, требует больше времени запуска (иногда дней).
Движение ДНК может влиять на конформации молекулы ДНК, например, суперспирализовано ДНК , как правило , двигается быстрее , чем расслабленный ДНК , поскольку она плотно спиральная и , следовательно , более компактным. В нормальной подготовке плазмидной ДНК, множественные формы ДНК могут присутствовать. Гель — электрофорез плазмид обычно показывает отрицательно суперспиральную форму как основная полоса, в то время как зазубрины ДНК (открытая круговая форма) и расслаблена закрыт круглая форма появляются как незначительные полосы. Скорость , с которой различными формами перемещения , однако , может изменяться с использованием различных условий электрофореза, а подвижность большой кольцевой ДНК могут быть более сильно , чем влияние линейной ДНК размера пор гель.
Этидий бромид, который интеркалирует в кольцевую ДНК может изменить заряд, длину, а также superhelicity молекулы ДНК, поэтому его присутствие в геле при электрофорезе может повлиять на его движение. Например, положительный заряд бромистого этидия может уменьшить движение ДНК на 15%. Электрофорез в агарозном геле может быть использован для решения круговой ДНК с различной топологией суперспирализации.
Повреждение ДНК из — за увеличенное поперечное сшивание также приведет к уменьшению электрофоретической миграции ДНК в зависимости от дозы.
Скорость миграции ДНК пропорциональна приложенного напряжения, т.е. чем выше напряжение, тем быстрее движется ДНК. Разрешение больших фрагментов ДНК, однако ниже, при высоком напряжении. Подвижность ДНК может также изменяться в нестационарном поле — в поле, которое периодически обращено, подвижность ДНК определенного размера может значительно снижаться при определенной частоте езды на велосипеде. Это явление может привести к инверсии зоны в поле электрофореза гель инверсии (ФИГЕ), в результате чего более крупные фрагменты ДНК движутся быстрее, чем более мелкие.
- «смайлик» гели — это краевой эффект возникает, когда напряжение, приложенное слишком высоко для концентрации геля, используемой.
- Перегрузки ДНК — перегружать ДНК замедляет миграцию фрагментов ДНК.
- Загрязнение — наличие примесей, такие как соль или белки может влиять на движение ДНК.
Отрицательный заряд его остова ДНК перемещает в сторону положительно заряженного анода при электрофорезе. Тем не менее, миграция молекул ДНК в растворе, в отсутствии гелевой матрицы, не зависит от молекулярной массы при электрофорезе. Гелевая матрица, следовательно , отвечает за разделение ДНК по размерам в процессе электрофореза, а также ряд моделей существует , чтобы объяснить механизм разделения биомолекул в гелевой матрице. Широко принято одна модель Ogston , которая рассматривает матрицу полимера в виде сита. Шаровые белки или случайная катушка ДНК перемещается через взаимосвязанные поры, и движение больших молекул, более вероятно, будет затруднено и замедлены столкновениями с гелевой матрицей, и , следовательно , молекулы различных размеров могут быть отделенны в этом процессе просеивания ,
Модель Ogston однако ломается при больших молекул в результате чего поры значительно меньше , чем размер молекулы. Для молекул ДНК размера более 1 кб, А рептации модель (или его варианта) наиболее часто используется. Эта модель предполагает , что ДНК может сканировать в моде «змеиной» (отсюда «рептации») через пору в виде удлиненной молекулы. Необъективное модель рептаций применяется при более высокой напряженности электрического поля, в результате чего передний конец молекулы становится сильно предвзятым в прямом направлении и тянет остальную часть молекулы вместе. В режиме реального времени флуоресцентной микроскопии окрашенных молекул, однако, показали более тонкие динамики во время электрофореза с ДНК показывает значительную эластичность , как она попеременно растяжения в направлении приложенного поля , а затем договаривающуюся в шарик, или становится замкнув в U-образную форму когда он попадает на полимерных волокон.
Детали электрофорезом на агарозном геле эксперимента могут варьироваться в зависимости от методов, но большинство следовать общей процедуре.
источник
Электрофорез в агарозном геле.
Принцип метода электрофореза.
Электрофорез – метод разделения макромолекул, различающихся по таким параметрам, как размеры (или молекулярная масса), пр о- странственная конфигурация, вторичная структура и элек трический заряд.
Физический принцип метода заключается в следующем. Наход я- щиеся в буферном растворе макромолекулы обладают некоторым су м- марным электрическим зарядом, величина и знак которого зависит от рН среды. Если через этот раствор, зак люченный в канал из изолирующего материала начать пропускать электрический ток, то вдоль канала установится определенный градиент напряжения, т.е. сформируется электрическое поле. Его напряженность измеряется разностью поте н- циалов по концам канала, отнесен ной к его длине (В/с). Под действием поля макромолекулы в соответствии со своим суммарным зарядом м и- грируют в направлении катода или анода, причем их трение об окр у- жающую среду ограничивает скорость миграции. В зависимости от в е- личины заряда и размеров мол екулы приобретают различные скорости. Постепенно исходный препарат, состоящий из различных молекул, ра з- деляется на зоны одинаковых молекул, мигрирующих с одинаковой скоростью. В современных приборах рабочий канал заполняют гелем, наличие сетки которого вн осит важную дополнительную деталь в эле к- трофоретическую миграцию молекул. Фракционируемые молекулы сталкиваются с нитями полимера, образующую сетку геля, что увел и- чивает сетку геля и снижает скорость движения молекул. Препятствия для миграции становятся о собенно серьезными, если средний размер пространственных ячеек геля оказывается соизмерим с размерами ма к- ромолекул. В этом случае решающее влияние на электрофоретическую подвижность различных макромолекул и степень разделения оказывает соотношение их линей ных размеров. Возможна даже такая ситуация, когда особенно крупные молекулы белков или нуклеиновых кислот в о- обще не могут «протиснуться» через поры геля и их миграция прекр а- титься.
В настоящее время используют ПААГ и агарозный гель. В а- рьируя концентрацию полимера, можно получать гели с очень шир оким диапазоном размеров пор. Кроме того, можно изменять электрич еские заряды макромолекул путем вариации рН буфера, а их конфигур ацию путем введения в буфер денатурирующих агентов или детергентов. Все это придает методу электрофореза исключительную гибкость.
В ходе электрофореза зоны макромолекул остаются невид и- мыми. Для наблюдения за процессом в исходный препарат добавляют краситель, молекулы которого несут электрический заряд того же зн а-
ка, что и фракционируемые молекулы, но не взаимодействуют с ними. Краситель тоже передвигается в электрическом поле, но уже в виде окрашенной зоны. Его подбирают таким образом, чтобы скорость м и-
грации наиболее подвижных макромолекул была несколько ниже, чем у молекул красителя. Когда окрашенная зона доходит до конца трубки, электрофорез прекращают.
Разделившиеся зоны биополимеров во избежание их дифф у- зии немедленно фиксируют. Для этого гель извлекают из стеклянной формы и вымачивают в смеси, кислоты выпадают в осадок в том мес те, где закончилась их миграция в ходе электрофореза. После фиксации (или одновременно с ней) проводят окрашивание зон путем вымачив а- ния геля в растворе красителя, прочно связывающегося с белком или нуклеиновой кислотой. Излишек красителя удаляют.
Вместо цилиндрических часто используют гели в виде тонких пластин, заполимеризованные между двумя плоскими стеклами. Такие пластины имеют важное преимущество: на них можно одновременно фракционировать несколько препаратов. Обычно их вносят с одного края геля на равных расстояниях друг от друга. Каждый препарат ра з- деляется в электрическом поле независимо от своих соседей, образуя свой набор зон. Кроме того, поскольку гель заливают в форму для п о- лимеризации жидким, то его концентрация, состав буфера и содерж а- ние добавок строго одинаковы по всему сечению геля. Следовательно, плотность тока и напряжение электрического поля также одинаковы. Это обеспечивает строго идентичные условия фракционирования ра з- ных препаратов и дает возможность достоверного сопоставления их с о- става путем сравнения положения полос в параллельных треках.
Особенности агарозного геля.
Агароза – это особо чистая фракция природного линейного пол и- сахарида агара, который получают из морских красных водорослей
(Gracilaria, Gelidium, Ahnfeltia).
Агароза состоит из строго чередующихся остатков 3-О- замещенной-β-D-галактопиранозы и 4-О-замещенной 3-6-ангидро-α-L- галактопиранозы. Молекулярная масса ее составляет 10 4 -10 5 . Гелеобразование идет путем связывания в пространственную сетку пучков нитей за счет водородных связей между ними. Некоторые виды агарозы обр а- зуют прочные гели уже при концентрации 0,3%.
При температурах 84 -96 o (а у специальных типов – уже при 70 o ) раствор агарозы переходит в прозрачную жидкость – «плавится». Вязкость расплавленного 1%-ного раствора агарозы составляет 10 -15 с П, что примерно соответствует вязкости 50% -ного раствора сахарозы при комнатной температуре. Растворы агарозы характеризуются ярко выр а- женным гистерезисом: они затвердевают, образуя гель, при значител ь- но более низких температурах (36 -42 o ). У легкоплавких типов агарозы
эта температура снижается до 30 o . Такая особенность облегчает ман и- пуляции с расплавленной агарозой — можно не опасаться преждевременного ее застывания в гель. Более того, расплавленную агарозу пре д- варительно охлаждают до 50 -55 o и уже при этой температуре заливают
в формы; это удобно и не связано с возникновением значительных те п- ловых деформаций.
Гели агарозы не вполне прозрачны, что обусловлено «кристалл и- зацией» геля.
Затвердевший гель представляет собой н е вполне равновесную систему: со временем он несколько уплотняется, выдавливая из себя жи д- кость. Температура плавления и гелеобразования зависят от с одержания в агарозе метоксильных групп, которое может достигать 3 -4%. Наличие этих групп затрудняет гелеоб разование.
В агарозе неизбежно содержатся и эфиры серной кислоты. Чем меньше в агарозе заряженных сульфогрупп, тем слабее силы электр о- статического отталкивания между молекулами полимера и выше их способность к связыванию водородными связями. Их присутствие существенно влияет не только на температуры плавления и застывания гелей, но и на сам процесс электрофореза. В частности, именно эфиры серной кислоты обусловливают сильно выраженное при электрофорезе
в гелях агарозы явление эндосмоса, суть которого в след ующем: отрицательно заряженные остатки серной кислоты неподвижно связаны с полимерными нитями агарозы. Соответствующие им положительные ионы, находясь в водной фазе под действием электрического поля м и- грируют в направлении катода. Их место занимают катионы, которые увлекают за собой всю массу жидкости, находящейся внутри геля, и вместе с ней – растворенные в водной фазе геля макромолекулы. Эле к- трофорезом в агарозном геле чаще всего разделяют отрицательно зар я- женные макромолекулы, а эндосмос направлен в про тивоположную сторону и ухудшает разделение. Поэтому агарозу подвергают спец и- альной очистке, и содержание иона сульфата в продажных препаратах не превышает 0,5%.
Рис. 1. Влияние эндосмоса в агарозном геле на характер фракционирования двунитевых ДНК одина кового разме-
1 — сверхскрученная ДНК; 2 — линейная; 3 — кольцевая; степень эндосмоса увеличивается слева направо
Типы агарозы, отличающиеся слабо выраженным эндосмосом, с о- держат менее 0,3% сульфата. В случае необходимости мо жно провести дополнительную очистку агарозы от сульфата обработкой 1М NаОН в 0,05%-ном боргидриде натрия и переосаждением 50% -ным этанолом. Наличие заряженных сульфогрупп иногда обусловливает еще и не специфическую сорбцию белков на агарозе, в результате чег о полосы расплываются с образованием «хвостов». Степень эндосмоса колич е- ственно оценивают с помощью коэффициента относительной миграции
(-m r ) – представляющего собой отношение скоростей миграции незаряженного полимера (за счет только эндосмоса) и сходного с ним по структуре полианиона при электрофорезе в агарозе данного типа.
Некоторые типы агарозы по номенклатуре фирмы « Miles»: тип LE – малая степень эндосмоса -m r =0,1-0,15;
тип HE – сильно выраженный эндосмос -m r =0,23-0,26.
Агароза с повышенными темпера турами плавления и гелеобразования (тип HGT) имеет -m r r >0,3) , но не за счет увеличения сульфатов, б лагодаря чему неспецифической сорбции белков на агарозе этого типа почти не происходит.
Агароза для электрофореза выпускается обычно в виде лиофилизированного порошка. Для приготовления геля выбранной концентр а- ции навеску порошка растворяют в соответствую щем буфере и нагре-
вают до 90-95 o . Перед заливкой в форму раствор агарозы охлаждают до 50 o .
Выбор концентрации агарозы, т.е. пористости ее геля, диктуется размерами фракционируемых макромолекул. Средний размер пор 2% — ного геля агарозы приблизительно соот ветствует диаметру сферически упакованной молекулы биополимера с массой 50 млн. дальтон. Гели с более высоким содержанием агарозы используют для гель -фильтрации. При электрофорезе поры геля должны быть легко проницаемы для м о- лекул биополимеров, чтобы лишь тормозить их миграцию в электрич е- ском поле за счет трения, поэтому для электрофореза применяют аг а-
розные гели с концентрацией 0,4 -2%. Ниже представлены примерные концентрации гелей агарозы (в %) для некоторых распространенных объектов фракционирования:
Высокомолекулярная ДНК вирусов и пла з-
Рестрикты ДНК (5-20 тыс. пар оснований)
Реовирусная двунитевая РНК (500 -5000 пар
Нативные мРНК; рестрикты ДНК (100 -1000
Разновидности электрофореза в агарозном геле.
Современные варианты электрофореза используют пластинки или колонки с агарозным гелем.
В зависимости от цели исследований эоектрофорез в агарозном геле может быть аналитическим и/или препаративным.
Аналитический электрофорез в агарозном геле имеет целью электрофоретическое разделение макромолекул с последующей визуализ а- цией и анализом полученных результатов.
Агарозный электрофорез применяют в препаративных целях. Для извлечения из геля разделенных компо нентов используют несколько способов: агарозный гель подвергают элюции буферными растворами, центрифугированию, замораживанию и оттаиванию.и др.
Вертикально расположенные трубки
Вертикальное расположение гелей и меет то преимущество, что препарат, наносимый на гель сверху, при любом его объеме равномерно покрывает всю рабочую поверхность геля. Затруднение при вертикал ь-
ном расположении могут возникать при недостаточной сцепле нности геля со стеклом, он будет сползат ь вниз.
Все приборы для с вертикальным расположением гелей ко н- структивно сложнее, чем аппараты с горизонтальным расположением, т.к. верхний электродный резервуар должен быть поднят над гелем.
Необходимо уплотнение в местах сочленения его с трубками или пл а- стинами.
Трубки (12-18штук) с уже заполимеризованным в них гелем вставляют снизу в резиновые прокладки так, чтобы их верхние концы выступали над дном резервуара. Если используют не все трубки, то на их место ставят заглушки. Собранный вместе с трубками в ерхний электродный резервуар устанавливают на нижний так, чтобы концы трубок оказались на некотором расстоянии от дна последнего и заполняют нижний резервуар электродным буфером до такого уровня, что трубки оказываются почти полностью погруженными в буфер. Это делается для улучшения теплоотвода в процессе электрофореза. С этой же целью нижний буфер перемешивают магнитной мешалкой или вводят допо л-
нительную охлаждающую систему. Оба резервуара цилиндрической или прямоугольной формы изготавливают из плексигласа , что позволяет следить за продвижением фронта красителя. В резервуарах должны быть закреплены электроды из платиновой проволоки. Нижний эле к- трод при этом должен располагаться так, чтобы поднимающиеся от н е- го пузырьки газа не попадали на нижние торцы трубо к, что создавало бы помехи протекания через них тока. Объемы электродных резерву а- ров достаточно велики, чтобы рН находящегося в них буфера не изм е- нялся под влиянием продуктов электролиза.
Для заливки и полимеризации геля нижние торцы трубок з а- клеивают парафильмом и устанавливают строго вертикально в штатив. Заливают гель. Собрав прибор, заливают буфер в верхний электродный резервуар. При полимеризации геля часть трубки с верхнего ее конца оставляют свободной, и туда при заливке попадает буфер. Затем под него, на поверхность геля, пипеткой наслаивают препарат, в который добавляют предварительно 5 -10% сахарозы. При любом варианте эле к- трофореза надо быть уверенным в том, что исходный препарат своб о- ден от взвешенных частиц (пыли или осадков), которые будут соб и- раться на торце геля и однородность тока по его сечению, что повлечет за собой деформацию разделяющихся зон. В этом случае препарат сл е- дует отфильтровать или очистить центрифугированием.
По окончанию электрофореза гель из трубки извлекают. В большинстве случаев это легко сделать с помощью длинной и зату п- ленной иглы шприца, которую вводят с одного из концов трубки, кр у- говыми движениями отслаивая гель от ее стенок. Если необходимо т а- кую операцию проводят и с другого конца. Через иглу при этом пост у- пает вода из закрепленного выше резервуара. Если гель отслаивается с трудом, в воду можно добавить 0,5 -1% раствор детергента. Во избеж а-
ния поломки следует дать гелю возможность выскользнуть из трубки в сосуд с водой, над которым проделывают эти манипуляции. Иногда д ля удаления геля из очень длинных трубок по его периферии с концов впрыскивают глицерин, а сам гель выталкивают водой из присоединя е- мого к трубке шприца. Если гель высокой концентрации вынуть не уд а- ется, его приходится замораживать, а трубку разбивать моло тком. Иногда можно решить проблему путем вымачивания трубки с гелем в мет а- ноле: гель постепенно съеживается и отстает от стенки.
Основным недостатком электрофореза в трубках является з а- трудненный отвод тепла даже при диаметре 5мм. На оси геля темпер а- тура оказывается выше, чем у его прилегающей к стеклу поверхности.
Это приводит к изгибу зон и соответственно окрашенных полос, п о- скольку электрофоретическая подвижность зависит от температуры. В условиях хорошего теплоотвода можно вести микроэлектрофорез в к а- пиллярах диаметром 0,7 -1,5мм.
Вертикально расположенные пластины
Для электрофореза белков обычно используют пластины ш и- риной 8-14 см и длиной (в направлении электрофореза) 8 -28 см.
Полимеризацию акриламида или застывание агарозы, а затем и электрофорез ведут в форме, образованной двумя пластинами зе р- кального стекла толщиной 5 -6мм. Расстояние между пластинами зад а- ется толщиной прокладок из тефлона или плексигласа («спейсеров») и определяет толщину геля. Прокладки шириной 10 -15мм устанавливают вдоль боковых краев стекол. Эти же прокладки можно использовать и для уплотнения формы во время нахождения в ней еще не затвердевш е- го геля. Для этого устанавливают еще одну прокладку точно такой же толщины по нижнему краю стекол и плотно прижимают ее к фрезер о- ванным торцам боковых прокладок.
При заливке агарозы уплотнение формы можно осуществить проще — заклеить торцы стекол липкой лентой. Нижнюю прокладку при этом можно не устанавливать. Уплотнение не будет совершенным, но агароза в контакте с прокладками и лент ой быстро застынет и заметного ее вытекания не будет. Для надежности можно сначала залить н е- большой слой агарозы и дать ей застыть в нижней части формы, а п о- том залить остальной ее объем.
Собранную и уплотненную форму устанавливают вертикал ь- но и заливают в нее раствор мономеров ПААГ или расплавленную аг а- розу.
В аналитических опытах на каждой пластине обычно ведут электрофорез нескольких препаратов, состав которых можно затем с о- поставить при идентичных условиях разделения. Сопоставляемые пр е- параты фракционируют в параллельных друг другу «треках». В ходе полимеризации на верхнем крае геля формируют ряд одинаковых углублений прямоугольной формы — «карманов», в которые затем вн о-
сят исследуемые препараты. Для этого в еще незаполимеризовавшийся
гель или горячую агарозу вставляют гребенку из тефлона или плекс и- гласа. Прямоугольные зубцы гребенки и формируют карманы.
Гель или агарозу заливают между пластинами с таким расч е- том, что при опускании гребенки до упора жидкий гель заполнил пр о- межутки между ее зубцами. Гре бенку начинают вставлять с некоторым перекосом, чтобы под ее зубцами не задерживались пузырьки воздуха. Когда гель готов, вынимают нижнюю прокладку или снимают липкую ленту и осторожно вытаскивают гребенку. При работе с концентрир о- ванным ПААГ гель может прилипать к зубцам гребенки и нижние плоскости карманов могут оказаться неровными. Это ухудшает условия формирования исходных полос в геле. В таком случае имеет смысл вв е- сти еще один слой геля пониженной концентрации, и гребенку устана в- ливают в него.
Для проведения электрофореза чаще всего используются приборы конструкции, предложенной Стадиером. Верхний и нижний резервуары прямоугольной формы соединены вертикальной стенкой, в которой имеется вырез, ведущий в полость верхнего резе рвуара. Такой
же вырез имеет и одна из двух стеклянных пластин, меду которыми п о- лимеризуется гель. Пластины прижимаются пружинными зажимами к вертикальной стенке так, чтобы оба выреза совпадали. Буфер в верхний резервуар заливают до такого уровня, чтобы он через в ырез покрывал верхний торец геля. При этом вторая, не вырезанная, стеклянная пл а- стинка выступает в роли передней стенки резервуара. В месте совм е- щения двух вырезов, между стеклянной пластиной и стенкой, должно быть осуществлено уплотнение, препятствующее вытеканию верхне го буфера. В оба резервуара вмонтированы электроды из платиновой пр о- волоки. При установке в прибор форму с гелем частично погр ужают в буфер нижнего резервуара, так что она опирается на разнесенные по сторонам выступы и ее нижний торец оказывается приподнят ым над дном резервуара. После погружения необходимо удалить пузырьки воздуха.
По окончании электрофореза пластины разнимают, отслаивая одну из них от геля с помощью шпателя. Его всовывают между пласт и- нами со стороны карманов и слегка поворачивают. Со вто рой пластины гель снимают руками и переносят в ванночку для фиксации или окр аски. Необходимо проводить манипуляции в перчатках, т.к. случайное прикосновение кожи рук к рабочей поверхности геля при современных чувствительных методах окрашивания может остави ть на геле артефактное белковое пятно.
Горизонтально расположенные пластины
Преимущество-отсутствие проблемы уплотнения. Оба эле к- тродных буфера находятся в резервуарах, расположенных ниже уровня горизонтального столика, на который кладут гель.
Гель, полимеризованный на тонкой стеклянной пластинке или плашке из плексигласа, помещают на столик открытой поверхн о- стью кверху, поскольку препарат вносят не с торца, а в ряд специал ь- ных «колодцев», расположенных на некотором расстоянии от края. Электрофорез проводят в форезных камерах. Препараты вносят в «к о- лодцы» вместе с красителем — бромфеноловым синим, содержащим также глицерин, который «прижимает» краситель и препарат, не позв о- ляя им диффундировать в геле или в буфере.
Пластины для горизонтального элект рофореза в агарозе можно приготовить чрезвычайно просто. На горизонтально установленную (по уровню) плоскость кладут тонкое стекло определенного размера и на него выливают расплавленный раствор агарозы в буфере. Его объем надо рассчитать или подобрать так, чтобы получить пластину нужной толщины. Колодцы для препаратов в этом случае можно и не делать. Фирма LKB рекомендует наносить препараты прямо на поверхность
агарозы через прорези наложенного на пластину специального шаблона со щелями. Препарат объемом 2 — 4 мкл вносят в щель шаблона, откуда он полностью впитывается в агарозу. Впрочем, сравнительно пр о- стое приспособление, смонтированное на столике для заливки, позволяет установить над пластиной (перпендикулярно к ее плоскости) гребенку и с ее помощью при з аливке агарозы образовать колодцы для препаратов. Перед использованием пластину агарозы тоже следует выдержать во влажной атмосфере в течение суток.
Итак, электофорез в агарозном геле позволяет идентифицировать большое количество белковых фракций. Пример – электрофоретическое разделение белков сыворотки крови.
Электрофорез проводят в 1% -ном агарозном геле в мединал — вероналовом буфере рН=8,6 с ионной силой 0,05. Все белки сыворотки крови при рН=8,6 заряжаются отрицательно заряд и движутся от катода к аноду, причем дальше всего уходят альбумины, имеющие меньшую молекулярную массу, затем располагаются 1 -, 2 -, — и -глобулины. Иногда каждая из этих основных фракций может разделиться на н е- сколько подфракций. Первоначальная оценка результатов электрофор е- тического разделения сывороточных белков (выявление нормы или п а- тологии) должна проводиться визуально, путем сравнения с картиной нормальной сыворотки, а количественные данные предназначены тол ь- ко для документирования результатов и динамического наблюдения.
Для электрофореза белков используются различные аппараты, как ручные, так и полуавтоматические. Современные комплексы оснащены микропроцессорными блоками питания и управляются компьютером; в большинстве систем на последней стадии исследования окрашенных мембран или гелевых пластинок (определения относительного колич е- ства белков в каждой фракции) используется электронный цветной ск а-
нер или миниатюрная фотокамера, что существенно повышает точность
и воспроизводимость результатов. Программное обеспечение дает во з- можность усредненного расчета оптической плотности отдельных фракций путем автоматического определения границ «дорожек» и мн о- гократного сканирования каждой из них в нескольких «разрезах», что позволяет исключить ошибки из -за локальных микродефектов и неро в- ного положения носителя, а также до определенной степени нивелир о- вать искривление дорожки и влияние окрашенного фона при неполной отмывке. На экран дисплея и на принтер выводится график — денситограмма с рассчитанным содержанием отдельных белковых фракций. При необходимости маркеры границ фракций на графике можно ско р- ректировать, при этом будет произведен автоматический пересчет их показателей. В компьютере, как правило, создается архив электрофор е- грамм; их можно в любое время извлечь и просмотреть. Электрофорез белков, позволяющий определить их количественные сдвиги и физико — химические характеристики, помогает выявить заб олевания печени и почек, иммунной системы, некоторые злокачественные новообразов а- ния (лейкозы), острые и хронические инфекции, генетически е поломки
Методика электрофореза в агарозном геле.
Для приготовления агарозного геля в СВЧ-печи или на водяной бане расплавляют смесь агарозы, буфера и воды. Охлажденную до 50-60 о С смесь тонким слоем заливают в форму и с помощью специальных гребенок делают в геле лунки для нанесения образца. Исследуемый препарат (раствор белка, ДНК или РНК) вносят в лунку, расположенную у края геля — полужидкой среды с сетчатой пространственной структурой (обычно для электрофореза используют тонкие пластины геля). Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают электрический ток, они перемещаются в электрическом поле. Молекулы одинакового размера (и одинакового заряда) движутся единым фронтом, образуя в геле дискретные невидимые полосы. Чем меньше размер молекул, тем быстрее они движутся. Постепенно исходный препарат, состоящий из разных макромолекул, разделяется на зоны, распределенные по длине пластинки. За ходом электрофореза следят по перемещению в геле красителя — заряженного низкомолекулярного вещества, которое вносят в каждую лунку перед началом электрофореза. Когда краситель достигает конца пластины, электрофорез останавливают, а гель окрашивают красителем, прочно связывающимся с белками или нуклеиновыми кислотами. Если образец представляет собой дискретный набор макромолекул разного размера, то после электрофореза получается набор четких полос, расположенных одна под другой. Если же распределение молекул по размеру более или менее непрерывно, то получается смазанная картина. По интенсивности окраски полос можно судить о концентрации макромолекул в образце. Чтобы определить относительную молекулярную массу разделенных фрагментов, одновременно проводят электрофорез маркерных макромолекул с известными молекулярными массами. Набор маркеров
источник
Особенности работы с низкопроцентными (0.3%) гелями.
в плашку для электрофореза залить «подложку» — слой агарозы 1.5-2.0% толщиной
2-3 mm, дать застыть;
ВНИМАНИЕ! Работать в холодной комнате. Гель очень хрупкий, все манипуляции проводить только вместе с 2% подложкой; не лить буфер на поверхность геля. Низкопроцентные гели особенно чувствительны к перегрузке по количеству DNA на дорожку.
Разделение линейных молекул
Диапазон нормального разделения линейных dsDNA молекул для гелей с различной концентрацией агарозы:
|
Меньший предел определяется (в основном) диффузией полосы в геле. Т.е. в гелях с низкой концентрацией агарозы мелкие фрагменты вполне разделяются, но полосы не четкие.
Верхний предел сильно зависит от напряженности поля, при которой проводится форез. Чем меньше напряженность поля, тем более длинные молекулы можно эффективно разделить.
Разделение суперскрученных и кольцевых молекул
К сожалению относительная подвижность линейных и кольцевых молекул зависит от условий фореза: % геля, скорость фореза (в частности, это означает, что нельзя пользоваться линейным маркером для оценки размера кольцевых молекул).
Приведенная таблица дает некоторое представление о соотношении подвижностей при умеренной (
6V/cm) скорости фореза (в скобках — при более быстром разгоне):
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В присутствии 0.5 µg/ml EtBr разрешение релаксированной и суперскрученной pDNA увеличивается примерно в 20 раз при повышении ионной силы буфера до 4хТАЕ. Того же увеличения можно добиться понижая концентрацию EtBr.
На 1% агарозном форезе ssDNA бежит чуть быстрее (
10%), чем dsDNA того же размера. ssDNA окрашивается EtBr заметно слабее, чем ds (разница в
4-5 раз). Tо есть, чтобы полосы имели одинаковую интенсивность окраски, требуется взять
Чтобы разделить цепи, нужно либо непосредственно перед форезом прогреть
1′ 100 o C, либо добавить к образцу NaOH до 0.1 М, 5-10′ (NT или 37 o C);
При оценке напряженности поля для горизонтального фореза принято пренебрегать конкретной геометрией камеры и измерять расстояние непосредственно между электродами.
На рисунке показана схема форезов, при разном напряжении. Форезы проводились разное время, так, чтобы 0.5kb фрагмент прошел одинаковое расстояние. Видно, что проведение фореза при высоком напряжении эквивалентно уменьшению длины геля.
Разумный компромисс между скоростью и качеством фореза для высококачественных или препаративных форезов:
2V/cm(можно меньше для ON форезов). Для аналитических форезов приемлемое качество сохраняется до
DNA особенно легко теряет EtBr при повышенной температуре (что обычно случается, если гонять форезы при высоком напряжении).
EtBr при форезе движется от (+) к (-). Если хочется, чтобы он не уходил из геля, лучше ввести его и в форезный буфер.
Количество DNA, которое можно наносить на дорожку
Нижний предел определяется используемым методом детекции. Если применяется окрашивание EtBr, то не стоит надеяться увидеть 2 O; рабочая концентрация в 1х буфере
0.005-0.02%) могут заметно мешать наблюдению фрагментов под UV. По нашему опыту, элюция фрагмента в РEG вместе с любым из этих красителей не оказывает заметного влияния на меченье, лигирование и трансформацию.
Cresol red (Na соль) — (стоковый раствор 50mM в H 2 O; рабочая концентрация в 1х буфере
0.1mM) совместим с ферментативными реакциями, практически не мешает наблюдению под UV.
OrangeG — (стоковый раствор 1% в формамиде; рабочая концентрация в 1х буфере
0.01-0.05%) наиболее подвижный краситель, практически всегда находится вне «рабочей зоны». Заметен под UV.
Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле. Обычно приводимые в методиках
0.025% для бромфенолового синего и ксиленцианола (в 1х буфере) по нашему мнению слишком большое количество.
* буфера с различными красителями.
* различные разведения буфера для внесения (10х, 2х, 1х). При этом образец любого объема собирается из двух компонентов (буфер+образец), а не из трех (буфер+ вода + образец).
1x если объем образца 25-75%;
10x ==> 75%
Смотри также:
/ссылки на сетевые ресурсы/
| Дополнения, комментарии, вопросы Для оптимального разделения не очень больших фрагментов, можно пользоваться буфером для внесения по рецепту, указанному в каталоге MBI Fermentas: 6x Orange Loading Dye Solution (#R0631) При этом ксиленцианол мигрирует с > 4 kb, а оранжевый — с 50 bp. Такой подход позволяет оптимизировать рабочее напряжение, а, соответственно, и разделение. И еще — я человек в мол.биологии непросвещенный, а потому да простят меня профессионалы, если я скажу всем известную вещь: вносить образцы в лунки гораздо проще, если под камеру подложить листок темной (черной или синей) бумаги, чтобы оттеняла лунки. Люди, хелп! Если кто-нибудь знает что-то про технологию внесения биополимеров в гель под названием Shark Teeth, напишите, пожалуйста! А почему бы заодно не добавить в текст, что рабочая концентрация бромистого этидия, например, 0,5 мкг/мл и что его можно добавлять прямо в гель, что гель с добавленным в него EthBr спокойно стоит ночь под электродным буфером без заметного вымывания из него краски? Полезные, вобшем-то факты, хоть и мелкие, но, с моей точки зрения, вполне не лишние. Акульи зубы — не гель. а гребенка в виде этих самых зубок. Втыкается в гель, и не вынимается, а образец наносится тонким-тонким носом в дырки между зубами. См. инструкцию к Макрофору. Только это не про агарозный форез. 2Re: что это гребенка такая, я знаю. Только сейчас вижу, что по формулировке моего вопроса кажется, будто это гель так называется:) Все, спасибо, уже поздно:) Только по моим данным, это имено про форез. Не знаю уж, про агарозный или ПААГ, по-моему, в данном случае не суть важно Народ, а какова длина волны для визуализации ПЦР-фрагментов? народ, а как точно называется маркер мол веса (лестница)? и куда, как ее наносить? а почему в гел Этьбромид а не GelStar ? GelGreen ? GelRed ? SYBRSafe ? а почему ТБЕ ТАЕ а не SB (sodium borate) ? а почему UV а не Blue ( Safe Imager , Dark Reader , FlashGel) А ПОКОЧАНУ )))) ответ от радио Molbiol — Не выпендрюйся Василий Иваныч-слушай свои «Валенки» 1: Biotechniques. 2004 Feb;36(2):214-6. Links Erratum in: Johns Hopkins University School of Medicine, Baltimore, MD, USA. PMID: 14989083 [PubMed — indexed for MEDLINE] All: 1 1: Electrophoresis. 2001 Mar;22(5):814-28.Click here to read Links Clare Chemical Research, Inc, Denver, CO 80206, USA. mseville@clarechemical.com The Dark Reader optical system (Clare Chemical Research, Denver, CO, USA) uses relatively low intensity broad-band visible blue light in combination with broad-band optical filters to detect fluorescence with a level of sensitivity that often surpasses that of UV transilluminators and can rival that of laser-based scanners. Applications of DR (Clare Chemical Research) devices include the detection of DNA and SYBR-stained protein samples following, and also during, electrophoresis. Unlike laser-based imaging systems, the fluorescence is directly visible to the user as well as being fully compatible with charge-coupled device (CCD) and Polaroid camera-based detection and imaging. Additionally, the DR optical system functions well in multicolor fluorophor environments. Because the Dark Reader does not emit any UV light, the extent of DNA damage incurred when visualizing DNA samples is drastically reduced compared to the damage produced by a UV device and this can have a significant benefit on downstream cloning protocols. Furthermore, dye photobleaching is minimal, extending the length of time that a fluorescent sample is visible. The inherent flexibility of the DR optical system allows many different configurations of the Dark Reader to be constructed such as transilluminators, hand lamps and integrated transilluminator-electrophoresis units. PMID: 11332748 [PubMed — indexed for MEDLINE] Today’s Featured Review Until recently Sybr green had been our labs nucleic stain of choice. We have, however, recently migrated to Biotium’s GelRed. GelRed is a newer nucleic acid gel stain that is safer and more temperature stable than other dyes. GelRed is safer because it is non mutagenic and is diluted in water. It is more thermostable than Sybr dyes because it does not degrade with repeated freeze-thaws or long storage (couple months at RT) and can be stored at room temperature, and sensitivity seems to at least equal if not exceed Sybr green when visualized with UV transilluminator. The dye is used similarly to Sybr dyes with staining (available at 10,000X ) or direct sample additions. The technology is not particularly ground breaking or new but the safety profile of this product makes it a viable alternative to potentially more dangerous dyes. Review by Vitelli Using GelGreen ‘In-Gel’ Save even more Time. GelGreen Safety FlashGel™ DNA System The FlashGel System is the fastest way to separate DNA and the only way to watch DNA migration as it happens. This revolutionary new tool separates DNA in 2 – 7 minutes. Monitor gel runs right at the bench, without UV light. The highly sensitive system allows a 5X reduction in DNA levels – saving both time and money. * Get results in 5 minutes or less. The FlashGel System consists of enclosed, disposable, precast agarose gel cassettes and a combination electrophoresis and transilluminator unit. * FlashGel Cassettes contain precast, prestained agarose gels and buffer – no need for gel preparation, buffer addition or gel staining. это все называется «ДНК технология» — не путайте с одноименной фирмой всем привет. Здравствуйте! «. При этом ксиленцианол мигрирует с > 4 kb, а оранжевый — с 50 bp. « а при какой процентности геля? Я так понимаю, как мигрируют красители именно от этого и зависит Как лучше выделить днк 200п.н. из геля для последующей амплификации. Скорее всего малая концентрация? Спасибо —Заранее спасибо ответившим, особенно ответившим правильно —. При этом ксиленцианол мигрирует с > 4 kb, а оранжевый — с 50 bp. « —а при какой процентности геля? Я так понимаю, как мигрируют красители именно от этого и зависит. Вроде красители в агарозе мигрируют на одно и тоже Rf не зависимо от процентности. А вот фрагменты сильно зависимо от процентности. Берете 2 маркера 100b и 1000b и в разных процентностях агарозы гоните с красителями и очень хорошо определяете, что с чем бежит. 3 процентный агароз вам уже трудно будет растворить. Я так дУмаю-у Мне кажется это лишняя работа элюировать ДНК из геля для последующей амплификации. Срез геля в воду, заморозить-разморозить и 1-2 мкл на ПЦР. Вы реамплифицируете кг. Спасибо, попробую на следующей неделе. А что если уже выделил из геля с помощью QG и при исходнике с приблизительной количеством 50 нг получил 40 мкг в 40 мкл. На форезе 1,2% в 10 мкл пробы ясен перец ничего не видно, агароза супер. Поставил на ПЦР, отправил 20 мкл в смесь, жду результатов. Сколько приблизительно может быть продукта? Спасибо Вопрос 1: Может ли в реакции сильнее амплифицироваться плазмида, чем нужная вставка?? 1% агарозу (в 2% линейная ДНК идет очень близко к суперскрученной, в 0.7% — близко к релаксированной). Если требуется проконтролировать циклизацию 3kbp фрагмента, то надо использовать 2% агарозу. если у Вас не нарабатывается большое кол-во продукта (20 нг в мкл и выше), дело уж конечно не в пирофосфатах- откуда бы им взяться, коли буквы не включились в амплификат (его мало)? Скорее всего проблемы с праймерами- посмотрите, нет ли «бомбы» (димер праймеров) внизу, или полимераза дохнет, что вря ли. Если проблема не лечится «в лоб», то просто замешайте исходно большой объем смеси, грубо говоря, накопите продукт экстенсивным путем, и всех делов. Я наверное перегрелся на солнцепёке (отпуск все-таки) — не понимаю в чем проблема плазмида или вставка, одна пара праймеров. По классике в ПЦР сильнее амплифицмруется всегда более короткий фрагмент. Без бутылки не разберешься, дождусь вечера. Здравствуйте, подскажите чем красить агарозный гель после щелочного электрофореза? И на какой стадии (до или после фиксирования в кислоте). Обязательно ли сушить? -Здравствуйте, подскажите чем красить агарозный гель после щелочного электрофореза? Бромий этидием или сибирским зеленым и иже с ними -до или после фиксирования в кислоте. «если я скажу всем известную вещь: вносить образцы в лунки гораздо проще, если под камеру подложить листок темной (черной или синей) бумаги, чтобы оттеняла лунки» Чем тогда думали в Сигма, если сделали столик в камере для фореза из белого пластика, к тому же скользкого в первом случае можно наклеить синей изоленты под место, где карманы)) Но от скольжения избавиться сложно — гель частенько уплывает от любых дуновений во время фореза. хоть гвоздями прибивай Можно ли заменить ТВЕ-буфер на Трис-СІ+EDTA для фореза ДНК, и какой молярности? За Трис.НСI в форезном буфере ставлю кол. Борная кислота испорчена у нас. Похоже, это ко мне . Поставляем наборы готовых гелей для электрофореза ДНК, рассчитанные на использование в ПЦРных лабораториях. В каждый комплект входит пузырёк ТАЭх20 (50 мл) для приготовления литра электрофоретического буферного раствора (EtBr 0,5 мкг/мл). Если нужно, то эти пузырёчки можно продавать и без гелей . Если интересно, то пишите. Ели реклама здесь неуместна, то удалите. Размер:: 19.19к кол-во скачиваний: 1724 Ну как может испортиться борная кислота? Купите тогда в аптеке. Борная кислота старая и «Ч.» по квалификации чистоты. Надо заказывать новые реактивы. Могу отсыпать сухой (белый порошок) ТВЕ. И дам пропись как самому готовить. Но про Трис.НСI для фореза — забудь. Лучше водопроводную воду. Забудьте и про Трис-HCl, и про все прочие буферы на основе Триса. Наиболее продвинутые пользователи за бугром переходят на Li-борат и Li-ацетат. Давно хотел попробовать карбонатный буфер, но всё руки не доходили. Недавно дошли. Приготовили Li-карбонатный буфер. Форезы получаются отлично! При 10V/см ни перегрева, ни закисления или защелачивания. Очень рекомендую! * ubMed will retrieve 2 records. J Virol Methods. 2010 May 13. [Epub ahead of print]Fast short-fragment PCR for rapid and sensitive detection of shrimp viruses. Mrotzek G, Haryanti, Koesharyani I, Tretyakov AN, Sugama K, Saluz HP. Leibniz Institute for Natural Product Research and Infection Biology, Hans Knoell Institute, Beutenbergstrasse 11a, 07745 Jena, Germany; Friedrich-Schiller-University, Jena, Germany. This article describes a fast short-fragment PCR method for the detection of white spot syndrome virus (WSSV), infectious hypodermal and hematopoietic necrosis virus (IHHNV), and monodon baculovirus (MBV). Fast two-temperature (95 degrees C denaturation and 60 degrees C annealing/extension) PCRs were performed in 5-10mul volume samples in miniaturized microplates using a fast Peltier thermal cycler. 40 cycles were completed in 25-30min. Rapid high-resolution agarose gel electrophoresis of 70-150bp PCR fragments was performed in 10min. High sensitivity of PCR product detection (50-100pg) was obtained using ultra sensitive dyes such as GelStar(®) and a gel documentation system equipped with a blue-light transilluminator. This novel method is faster and more sensitive than its TaqMan(®) real-time PCR counterparts. Copyright © 2010. Published by Elsevier B.V. да уж сам себя не похвались как оплеванный ходишь. © источник |