Электрокинетические явления
Влияние природы дисперсионной среды
Влияние рН среды
Введение в золь ионов Н + и ОН — может сильно сказываться на величине z-потенциала, так как эти ионы обладают высокой сорбционной способностью: первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы, вторые – из-за большого дипольного момента (большой поляризуемости).
Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью e и вязкостью m.
z-потенциал частиц золя тем больше, чем больше e (полярность растворителя).
Чем больше вязкость, тем толще слой дисперсионной среды, который прилипает к частице при разрыве мицеллы и, следовательно, тем меньше численное значение z-потенциала.
Электрокинетические явления – это явления, которые возникают при воздействии электрического поля на дисперсную систему (электрофорез, электроосмос), а также в результате перемещения частиц дисперсной фазы или дисперсионной среды (потенциал протекания, потенциал оседания).
Несмотря на различие электрокинетических явлений, все они связаны с наличием ДЭС на частицах дисперсной фазы. Интенсивность всех электрокинетических явлений определяется значением z-потенциала.
Электрофорез – направленное движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля.
При наложении внешнего электрического поля происходит разрыв мицеллы: частицы дисперсной фазы вместе с адсорбированными на них потенциалопределяющими ионами и противоионами адсорбционного слоя перемещаются к электроду, знак которого противоположен знаку заряда коллоидной частицы (z-потенциалу), а противоионы диффузионного слоя – к другому электроду. Например, если дисперсная фаза заряжена отрицательно, коллоидные частицы движутся к аноду (положительному электроду), а положительно заряженные противоионы диффузного слоя – к катоду (рис. 32).
Если дисперсная фаза заряжена положительно, направление движения частиц меняется на противоположное.
|
Скорость движения, или электрофоретическая скорость, зависит от величины электрокинетического потенциала z, напряженности электрического поля E/L и свойств сплошной среды – динамической вязкости μ и диэлектрической проницаемости e:
,
где u – электрофоретическая скорость; z – электрокинетический потенциал; e – диэлектрическая проницаемость среды; e – электрическая постоянная, e = 8,85×10 -12 Кл/(В×м); Е – разность потенциалов внешнего электрического поля; L – расстояние между электродами; E/L=H –напряженность, или градиент, внешнего электрического поля; m – динамическая вязкость сплошной среды; y – фактор формы.
Коэффициент y учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент y равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля – 1.
Скорость движения в расчете на единицу напряженности электрического поля Н называется электрофоретической подвижностью
.
Электрофоретическая подвижность зависит только от свойств дисперсной фазы и дисперсионной среды.
На подвижность коллоидной частицы оказывают влияние электрофоретический и релаксационный эффекты.
Электрофоретический эффект (эффект торможения): под действием внешнего электрического поля противоионы передвигаются в направлении, противоположном движению частицы. За счет гидратации противоионы увлекают за собой и окружающую их жидкость (дисперсионную среду). Это приводит к тому, что частица перемещаются в направлении, противоположном движению жидкости, скорость ее уменьшается.
Релаксационный эффект вызывается нарушением симметрии ДЭС вокруг частицы при ее движении. ДЭС деформируется и отстает от частицы. В результате возникает добавочное электрическое поле, которое действует на частицу, стремясь двигать ее в обратном направлении, и тем самым влияет на скорость электрофореза.
Для учета влияния этих факторов в уравнение для расчета электрофоретической скорости и вводится коэффициент y.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8425 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Электрофорез — направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов. Это явление наблюдается в седиментационно устойчивых дисперсных системах. При наложении на такую систему внешней разности потенциалов происходит разрыв ДЭС по плоскости скольжения, в результате чего частица получает заряд и перемещается к соответствующему электроду.
Приведенные выше уравнения Гельмгольца — Смолуховского справедливы для электрофореза, в частности для электрокинетического потенциала используется уравнение (4.9). Отличие состоит только в системе координат: в одном случае рассматривается скорость жидкости, в другом — скорость движения частиц, которую обычно определяют по смещению цветной границы.
Электрофорез наблюдают в U-образном сосуде (см. лабораторный практикум). В нижнюю часть сосуда наливают золь, сверху — контактную (боковую) жидкость, имеющую одинаковую (или немного большую) с золем электрическую проводимость. Наблюдают за изменением уровня золя в обоих коленах трубки и по скорости перемещения частиц дисперсной фазы определяют линейную скорость электрофореза Wq :
где S — путь, пройденный золем за время г (время электрофореза).
При электрофорезе отношение линейной скорости к напряженности
электрического поля 
Напряженность электрического поля Е зависит от приложенной разности потенциалов на электродах U и расстояния между ними L:
Рассмотренные уравнения справедливы при допущениях: 1) частицы движутся в однородном электрическом поле; 2) частицы могут иметь любую форму и не проводят электрический ток; 3) толщина ДЭС много меньше размеров частиц золя.
Для расчета ^-потенциала частиц, находящихся в разбавленных водных растворах при 293 К, можно использовать простое соотношение:
в котором электрофоретическая подвижность и, выражена в(тогда
^-потенциал будет иметь размерность В).
Несовпадение экспериментальных и теоретических значений объясняется релаксационным эффектом и электрофоретическим торможением.
Релаксационный эффект проявляется в нарушении симметрии диффузионного слоя вокруг частицы при относительном перемещении фаз в противоположные стороны.
Электрофоретическое торможение обусловлено сопротивлением движению частицы обратным потоком противоионов, которые увлекают за собой жидкость. В некоторых случаях несовпадение можно учесть введением поправок, иногда этим несовпадением можно пренебречь.
Скорость электрофореза зависит нс только от приложенного напряжения, но и от радиуса частиц и других факторов. Это можно учесть введением в уравнение (4.8) поправочного коэффициента к:
Поправочный коэффициент определяется экспериментально в каждом отдельном случае электрофореза.
Для примера рассмотрим данные по электрофорезу в суспензиях глин Трошковского, Никольского и Слюдянского месторождений, микрофотографии которых приведены на рис. 1.1.
Электрокинетический потенциал определяли методом подвижной границы при электрофорезе и рассчитывали по уравнению:
где S — путь;
L — расстояние между электродами;
U — разность потенциалов между электродами;
г — преимущественный радиус частицы, определяемый обычно по максимуму на кривой распределения частиц но размерам;
/(к г) — поправочная функция, учитывающая эффекты электрофоретического торможения и релаксации (табл. 4.1);
к — параметр Дебая, равный обратной величине плотной части двойного электрического слоя, то есть к = 1/6.
источник
Электрофорезом называется движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля
Экспериментально электрофорез обнаруживается по выделению дисперсной фазы на одном из электродов или в приэлектродном пространстве, по смещению границы раздела коллоидная система — дисперсионная среда к одному из электродов (макроэлектрофорез), а также путем наблюдения за перемещением отдельных частиц с помощью микроскопа (микроэлектрофорез)
В теории электрофореза, разработанной Смолуховским, Гюккелем и другими авторами, движение частицы в электрическом поле рассматривается как результат действия на ее поверхностный заряд электрической силы F1 и силы сопротивления среды F2
В стационарных условиях, т е. когда F1+F2=0 и при ca>>1 (где c-параметр Дебая; a—радиус частицы), для скорости электрофореза получено уравнение
; (9)
Таблица 1 Зависимость функции f от ca
| ca | f |
| 0,1 | 1,0005 |
| 0,3 | 1,0040 |
| 1,0 | 1,0267 |
| 3,0 | 1,1005 |
| 5,0 | 1,1630 |
| 10,0 | 1,2500 |
| 20,0 | 1,3400 |
| 50,0 | 1,4200 |
| 100,0 | 1,4580 |
Если толщина ДЭС мала по сравнению с размером частицы, т.е. ca>>1, f®1.5,уравнение превращается в формулу (3), предложенную Смолуховским; если ca >1(тонкий ДЭС), а также в случае слабозаряженных частиц поправкой на электрическую релаксацию можно пренебречь.
Для сравнения способности к электрофорезу различных дисперсных систем пользуются электрофоретической подвижностью — линейной скоростью движения частиц при единичной напряженности электрического поля:
. (12)
Электрофорез широко применяют в практике для получения электрофоретических покрытий и электрокоагуляции суспензий.
Образование электрофоретического осадка на поверхности электрода представляет собой многостадийный процесс, в котором основными стадиями являются следующие:
1) подвод и концентрировать частиц у поверхности электрода;
2) стесненная коагуляция в приэлектродном пространстве.
При осаждении из коллоидных систем и суспензий, содержащих частицы размером меньше 1 мкм, подвод частиц и их концентрирование у поверхности электрода происходит в основном за счет сил, действующих на поверхностный заряд частиц.
Скорость подвода и масса образующегося на электроде осадка зависят от характера электрического поля. При осаждении в неоднородном электрическом поле, заданном системой двух соосных цилиндрических электродов, массу осадка m, образующегося на центральном электроде за время t, рассчитывают по формуле
, (13)
. (14)
Здесь e—диэлектрическая проницаемость; e = = 8,85-10 -12 Ф/м; z—электрокинетический потенциал; U— разность потенциалов; h—вязкость дисперсионной среды; l—длина покрытой части электрода; с — концентрация суспензии; ст — концентрация суспензии в приэлектродной зоне: г1 и г2—радиусы цилиндрических электродов.
При выводе этой формулы предполагалось, что лимитирующей стадией процесса является доставка частиц к электроду и, следовательно, стесненная коагуляция протекает быстро при достижении предельного значения ст.
При осаждении в однородном электрическом поле, образованном системой параллельно расположенных плоских электродов, массу электрофоретического осадка рассчитывают по формуле
, (15)
где uэф—электрофоретическая подвижность; Е — напряженность поля; с—концентрация суспензии; t—время осаждения; S — поверхность электрода.
Дата добавления: 2015-08-31 ; Просмотров: 1361 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Частицы дисперсных размеров получают либо измельчением крупных тел (диспергированием), либо объединением (конденсацией) атомов, молекул, ионов.
Образование систем высокой дисперсности по конденсационному механизму возможно, если возникает большое число зародышей новой, термодинамически более стабильной фазы, с другой стороны, скорость роста этих зародышей лежит в области умеренных значений.
Процессы, приводящие к появлению коллоидной системы, можно разделить на две группы: химические, то естьпротекание химических реакций, приводящих к возникновению высокой концентрации слаборастворимого соединения; и физические, такие как изменение давление, температура, растворителя и т.д.
Любая химическая реакция, приводящая к образованию нерастворимого продукта, может быть использована для получения коллоидной системы. К образованию коллоидных растворов – золей приводят различные химические реакции: окисления-восстановления, гидролиза, обмена и т.д. Любой золь состоит из мицелл и интермицеллярной жидкости. Под интермицеллярной жидкостью понимают дисперсионную среду, содержащую растворенные электролиты и неэлектролиты.
Мицеллы – это электрически нейтральные структурные единицы, находящиеся в растворе и участвующие в броуновском движении. Они представляют собой сложное структурное образование, состоящее из агрегата (ядра), потенциалообразующих ионов и противоионов.
Коллоидная частица, или золь, включает в себя ядро, адсорбированные ионы, противоионы и растворитель. Ядро состоит из электронейтрального агрегата частиц малорастворимых соединений, на которых адсорбируются ионы элементов, входящих в состав ядра. При выборе потенциалообразующих ионов пользуются эмпирическим правилом Фаянса – Панета –Пескова: на твердой поверхности агрегата в первую очередь адсорбируются ионы, которые
· способны достраивать кристаллическую решетку агрегата;
· образуют малорастворимое соединение с ионами агрегата;
· изоморфны с ионами агрегата.
Поверхность ядра приобретает определенный заряд благодаря избирательной адсорбции ионов определенного знака, называемых потенциалообразующими ионами. К этим ионам электростатически притягивается эквивалентное количество ионов противоположного знака, называемых противоионами. Часть противоионов прочно связана с ядром в составе его адсорбционного слоя, образуя гранулу, или коллоидную частицу; остальные входят в диффузный слой за границей скольжения. Коллоидная частица содержит ещё молекулы растворителя. Адсорбированные ионы и противоионы с растворителем образуют адсорбционный слой. Суммарно заряд частицы равен разности зарядов адсорбированных ионов и противоионов. Знак заряда коллоидной частицы определяется знаком заряда потенциалообразующих ионов. Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
В качестве примера приведем золь йодида серебра:
а) при избытке в растворе нитрата серебра
двойной электрический слой

 |  |

где 1- потенциалообразующие ионы
б) при избытке в растворе йодида калия
двойной электрический слой

 |  |
где 1- потенциалообразующие ионы
Электролит, ионы которого образуют двойной электрический слой (ДЭС), называется электролитом-стабилизатором, поскольку он стабилизирует золь, придавая ему агрегативную устойчивость.
Пример 30. Золь йодида серебра получен методом химической конденсациипри избытке нитрата серебра. К какому электроду будет двигаться частица при электрофорезе? Напишите формулу мицеллы золя.
Решение. Рассмотрим процесс образования мицеллы золя йодида серебра при избытке нитрата серебра:
Так как нитрат серебра взят в избытке, следовательно, раствор AgNO3 будет являться электролитом-стабилизатором, ионы которого образуют ДЭС:
AgNO3 → Ag + + NO
Согласно правилу Фаянса – Панета – Пескова, ионы серебра Ag + будут являться потенциалообразующими ионами, а ионы NO 
Формулу мицеллы можно записать в следующем виде:
·yH2O] x+ ∙xNO 
Так как коллоидная частица заряжена положительно, то при электрофорезе она будет двигаться к отрицательно заряженному электроду (катоду).
Пример 31. Для получения золя хлорида серебра смешали 15 см 3 0,025 н раствора хлорида калия с 85 см 3 0,005 н раствора нитрата серебра. Написать формулу мицеллы полученного золя.
Решение. Находим число мг-экв KCl:
15см 3 ∙0,025 мг-экв/см 3 = 0,375мг-экв
Определяем количество мг-экв AgNO3:
85∙0,005 мг-экв/см 3 = 0,425 мг-экв
Очевидно, что в растворе имеется избыток AgNO3. ядром коллоидных частиц золя AgCl будут адсорбироваться преимущественно ионы Ag + и частично ионы NO 
Формула мицеллы хлорида серебра будет
 |  |  |
19. Какой объём 0,005н раствора нитрата серебра надо прибавить к 20см 3 0,015н раствора иодида калия, чтобы получить положительный золь иодида серебра? Написать формулу мицеллы.
19. Золь бромида серебра получен смешиванием 25см 3 0,008н раствора бромида калия и 18см 3 0,0096н раствора нитрата серебра. Определить знак заряда частиц золя и написать формулу его мицеллы
19. Золь иодида серебра получен при постепенном добавлении к 20см 3 0,01н раствора иодида калия 15см 3 0,2%-ного раствора нитрата серебра. Написать формулу мицеллы образовавшегося золя. Плотность раствора нитрата серебра равна единице.
19. Золь хлорида серебра получен смешиванием равных объёмов 0,0095М хлорида калия и 0,012М нитрата серебра. Написать формулу мицеллы.
19. Золь сульфата бария получен сливанием равных объёмов растворов нитрата бария и серной кислоты. Одинаковы ли исходные концентрации электролитов, если при электрофорезе частица перемещается к аноду? Напишите формулу мицеллы золя BsSO4..
19. Напишите формулы мицелл золей: Al(OH)3, стабилизированного AlCl3; SiO2, стабилизированного H2SiO3. К каким электродам будут двигаться коллоидные частицы каждого из указанных золей при электрофорезе?
19. Для получения золя AgCl смешали 10 мл 0,02 М KCl и 100 мл 0,05 М AgNO3. Напишите формулу мицеллы полученного золя. К какому электроду будет двигаться частица при электрофорезе?
19. Золь хлорида серебра получен смешиванием равных объёмов 0,0095 М хлорида калия и 0,012 М нитрата серебра. Напишите формулу мицеллы.
19. Золь гидроксида алюминия получен сливанием равных объёмов растворов хлорида алюминия и гидкроксида натрия. Одинаковы ли исходные концентрации электролитов, если при электрофорезе частица перемещается к катоду? Напишите формулу мицеллы золя Al(OH)3.
19. Напишите формулу мицеллы гидрозоля AgBr, полученного при сливании разбавленного раствора AgNO3 с избытком КBr. Как изменится строение мицеллы, если гидрозоль AgBr получать при сливании сильно разбавленного раствора КBr с избытком AgNO3?
Дата добавления: 2014-12-07 ; просмотров: 4792 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
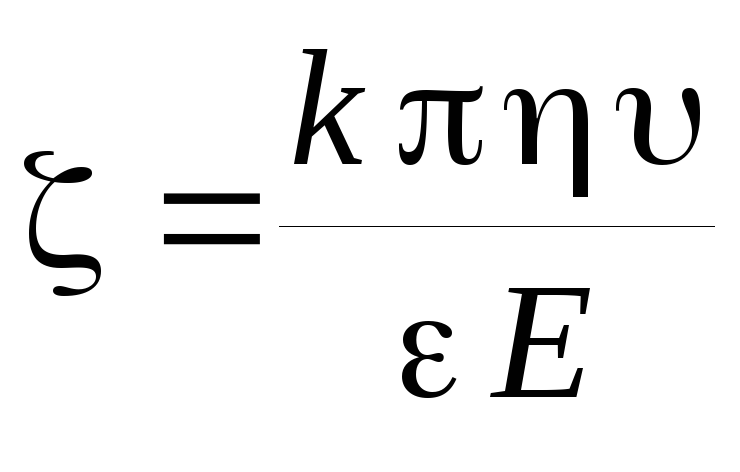
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
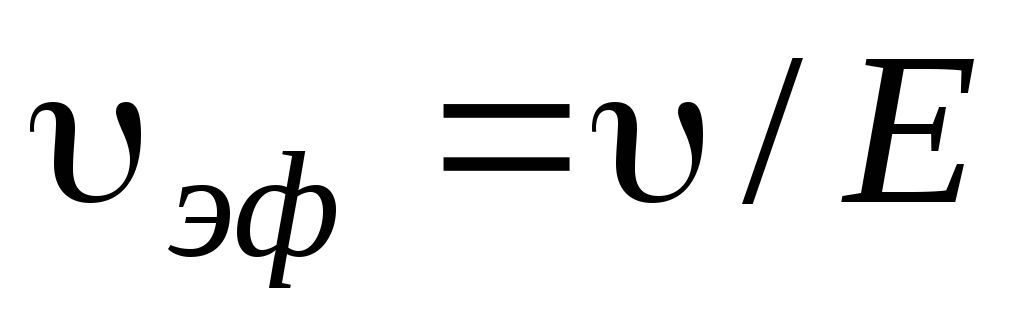
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
К осаждению дисперсной фазы — характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
лиофильные, обладающие термодинамической устойчивостью;
лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса G min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
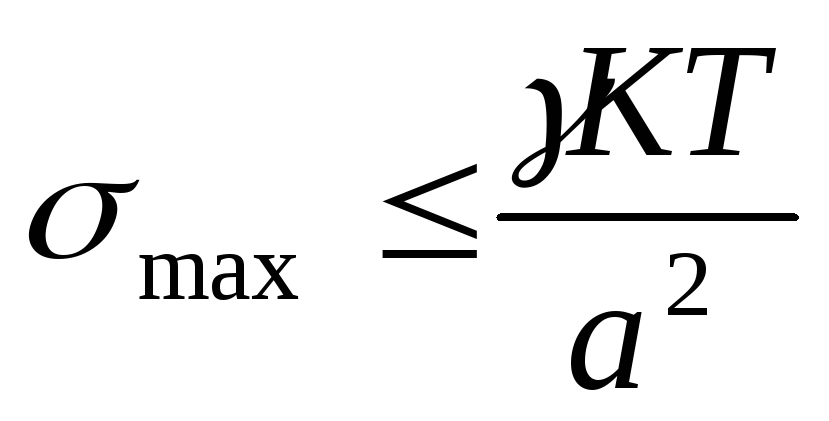
где ỵ езразмерный коэффициент;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,410 -7 до 1,410 -3 Дж/м 2 . Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Правила коагуляции электролитами. Порог коагуляции. Правило Шульце-Гарди. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия — явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
источник
На поверхности частиц дисперсных фазы при их контакте с жидкостью самопроизвольно возникает избыточный электрический заряд и формируется потенциалобразующий слой ионов (см. тему 3). К твердой поверхности из жидкой среды притягиваются ионы, знак которых противоположен знаку потенциалобразующего слоя. Они называются противоионами. Возникает двойной электрический слой (ДЭС). Его можно рассматривать как своеобразный конденсатор, внутренняя обкладка которого формируется из потенциалобразующего слоя ионов, а внешняя – из противоионов. Противоионы находятся в двух положениях: одна их часть образует адсорбционный слой, другая находится в диффузном слое.
Потенциал, возникающий на поверхности коллоидной частицы, называют электрокинетическим или ζ (дзета) – потенциалом. Электрокинетический потенциал численно равен работе, которую нужно совершить при переносе единицы заряда с поверхности гранулы в глубь дисперсной среды или наоборот.
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Наличие заряда на поверхности коллоидных частиц является причиной возникновения электрокинетических явлений, характерных только для дисперсных систем. Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы и дисперсной среды.
Внешнее электрическое поле вызывает такие электрокинетические явления, как электрофорез и электроосмос. Электрофорез – это перемещение дисперсной фазы относительно дисперсной среды в электрическом поле. Электроосмос – перемещение дисперсной среды относительно дисперсной фазы под действием внешнего электрического поля. При электрофорезе коллоидные частицы движутся к одному электроду, а диффузный слой противоионов перемещается к другому электроду. Измеряя скорость электрофореза и электроосмоса, можно определить электрокинетический потенциал. Зависимость скорости перемещения фаз от электрокинетического потенциала описывается уравнением Гельмгольца-Смолуховского:
(17),
U – скорость перемещения фазы,
ζ – электрокинетический потенциал,
E – напряженность или градиент внешнего поля,
η – вязкость дисперсионной среды,
ε – диэлектрическая проницаемость среды,
ε – электрическая постоянная или абсолютная диэлектрическая проницаемость вакуума, равная .
При электрофорезе скорость движения частиц U при напряженности электрического поля Е, равной единице, называют электрофоретической подвижностью Иэф, , то есть:
(18)
Электрокинетический потенциал можно рассчитать по формулам:
(19),
(20),
Электрокинетический потенциал является важным фактором устойчивости коллоидных систем.
Рассмотрим решение типовой задачи.
Задача 4.1. определите электрокинетический потенциал 20%-ного коллоидного раствора сахарозы при градиенте внешнего электрического поля 400 В/м, относительной диэлектрической проницаемости 69,4 , вязкости . Скорость электрофореза равна 13,5 мкм/с.
Решение: электрокинетический потенциал рассчитывается по формуле (19):
Ответ:электрокинетический потенциал равен 82,4мВ.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
источник
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.2.4 Двойной электрический слой и электрокинетические явления
При рассмотрении строения мицеллы было показано, что на поверхности лиофобных коллоидов образуется двойной электрический слой. Первая теория строения ДЭС была развита Гельмгольцем и Перреном; в их представлении двойной электрический слой подобен плоскому конденсатору, внутренняя обкладка которого находится в твердой фазе, а внешняя – в жидкости параллельно поверхности ядра на расстоянии порядка диаметра иона. Потенциал электрического поля внутри ДЭС φ в этом случае линейно уменьшается с увеличением расстояния от поверхности r (рис. 4.12а).
Позднее Гуи и Чепмен предложили другую модель, согласно которой противоионы, благодаря тепловому движению, образуют вблизи твердой поверхности ядра диффузную ионную атмосферу . Уменьшение электрического потенциала ДЭС φ с увеличением расстояния r в этом случае происходит нелинейно (рис. 4.12б).
Рис. 4.12 Строение ДЭС: а) – по Гельмгольцу и Перрену, б) – по Гуи и Чепмену, в) – по Штерну. Вверху – схема расположения противоионов, внизу – зависимость потенциала от расстояния
Предложенная Штерном модель строения ДЭС объединяет ранние модели, учитывая как адсорбцию противоионов, так и их тепловое движение . Согласно этой модели, являющейся в настоящее время общепринятой, часть противоионов находится на расстояниях порядка диаметра иона от поверхности ядра, образуя т.н. слой Гельмгольца (адсорбционный слой противоионов), а другая часть образует диффузный слой (т.н. слой Гуи). Потенциал диффузной части двойного электрического слоя называют электрокинетическим потенциалом (см. рис.4.12в). Электрокинетический потенциал обычно обозначают греческой буквой ζ (дзета) и называют поэтому дзета-потенциалом. Поскольку ζ -потенциал пропорционален заряду коллоидной частицы, агрегативная устойчивость золя пропорциональна его величине.
Если поместить золь в постоянное электрическое поле, то, как и в растворах электролитов, заряженные частицы будут двигаться к противоположно заряженным электродам: коллоидная частица с адсорбированными на ней противоионами – в одну сторону, противоионы диффузного слоя – в другую. Сила, с которой электрическое поле действует на частицы и, следовательно, скорость движения частиц, очевидно, будет пропорциональна ζ -потенциалу. Движение частиц дисперсной фазы в электрическом поле называется электрофорезом . Явление электрофореза можно наблюдать, поместив в U-образную трубку какой-либо окрашенный золь, поверх которого налит не смешивающийся с золем бесцветный электролит. Если опустить в электролит электроды и наложить разность потенциалов, то граница окрашенного золя в одном из колен трубки будет подниматься, в другом – опускаться (рис. 4.13). Если поместить в U-образную трубку пористую перегородку (например, мелкий кварцевый песок) и заполнить её водой, то при наложении разности потенциалов в одном колене будет наблюдаться подъем уровня жидкости, в другом – его опускание (рис. 4.14). Движение дисперсной среды в электрическом поле относительно неподвижной дисперсной фазы (в рассмотренном случае – относительно поверхности пористых тел) называется электроосмосом . Явления электрофореза и электроосмоса получили общее название электрокинетических явлений .
Рис. 4.13 Схема опыта по электрофорезу
Рис. 4.14 Схема опыта по электроосмосу
Скорость движения частиц дисперсной фазы при электрофорезе, а также скорость движения дисперсной среды при электроосмосе прямо пропорциональны напряженности электрического поля E и диэлектрической проницаемости дисперсионной среды ε и обратно пропорциональны вязкости среды η . Скорость движения частиц дисперсной фазы при электрофорезе U связана с величиной ζ -потенциала уравнением Гельмгольца-Смолуховского (К – постоянная, зависящая от формы частиц дисперсной фазы; для сферических частиц К = 6):
(IV.20)
Обратные электрофорезу и электроосмосу электрокинетические явления (т.н. электрокинетические явления второго рода) называются соответственно потенциал седиментации и потенциал протекания. Потенциал седиментации (эффект Дорна) – возникновение разности потенциалов при вынужденном движении дисперсной фазы относительно неподвижной дисперсионной среды (например, под действием силы тяжести). Потенциал протекания (эффект Квинке) есть явление возникновения разности потенциалов при движении дисперсионной среды относительно неподвижной дисперсной фазы (например, при продавливании электролита через пористое тело).
Copyright © С. И. Левченков, 1996 — 2005.
источник
Электрофорезом называется движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля
Экспериментально электрофорез обнаруживается по выделению дисперсной фазы на одном из электродов или в приэлектродном пространстве, по смещению границы раздела коллоидная система — дисперсионная среда к одному из электродов (макроэлектрофорез), а также путем наблюдения за перемещением отдельных частиц с помощью микроскопа (микроэлектрофорез)
В теории электрофореза, разработанной Смолуховским, Гюккелем и другими авторами, движение частицы в электрическом поле рассматривается как результат действия на ее поверхностный заряд электрической силы F1 и силы сопротивления среды F2
В стационарных условиях, т е. когда F1+F2=0 и при ca>>1 (где c-параметр Дебая; a—радиус частицы), для скорости электрофореза получено уравнение
; (9)
Таблица 1 Зависимость функции f от ca
| ca | f |
| 0,1 | 1,0005 |
| 0,3 | 1,0040 |
| 1,0 | 1,0267 |
| 3,0 | 1,1005 |
| 5,0 | 1,1630 |
| 10,0 | 1,2500 |
| 20,0 | 1,3400 |
| 50,0 | 1,4200 |
| 100,0 | 1,4580 |
Если толщина ДЭС мала по сравнению с размером частицы, т.е. ca>>1, f®1.5,уравнение превращается в формулу (3), предложенную Смолуховским; если ca >1(тонкий ДЭС), а также в случае слабозаряженных частиц поправкой на электрическую релаксацию можно пренебречь.
Для сравнения способности к электрофорезу различных дисперсных систем пользуются электрофоретической подвижностью — линейной скоростью движения частиц при единичной напряженности электрического поля:
. (12)
Электрофорез широко применяют в практике для получения электрофоретических покрытий и электрокоагуляции суспензий.
Образование электрофоретического осадка на поверхности электрода представляет собой многостадийный процесс, в котором основными стадиями являются следующие:
1) подвод и концентрировать частиц у поверхности электрода;
2) стесненная коагуляция в приэлектродном пространстве.
При осаждении из коллоидных систем и суспензий, содержащих частицы размером меньше 1 мкм, подвод частиц и их концентрирование у поверхности электрода происходит в основном за счет сил, действующих на поверхностный заряд частиц.
Скорость подвода и масса образующегося на электроде осадка зависят от характера электрического поля. При осаждении в неоднородном электрическом поле, заданном системой двух соосных цилиндрических электродов, массу осадка m, образующегося на центральном электроде за время t, рассчитывают по формуле
, (13)
. (14)
Здесь e—диэлектрическая проницаемость; e = = 8,85-10 -12 Ф/м; z—электрокинетический потенциал; U— разность потенциалов; h—вязкость дисперсионной среды; l—длина покрытой части электрода; с — концентрация суспензии; ст — концентрация суспензии в приэлектродной зоне: г1 и г2—радиусы цилиндрических электродов.
При выводе этой формулы предполагалось, что лимитирующей стадией процесса является доставка частиц к электроду и, следовательно, стесненная коагуляция протекает быстро при достижении предельного значения ст.
При осаждении в однородном электрическом поле, образованном системой параллельно расположенных плоских электродов, массу электрофоретического осадка рассчитывают по формуле
, (15)
где uэф—электрофоретическая подвижность; Е — напряженность поля; с—концентрация суспензии; t—время осаждения; S — поверхность электрода.
Дата добавления: 2015-08-31 ; Просмотров: 1362 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез — это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 6.11, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 6.11).
Рис. 6.11. Схема электрофореза:
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху — электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 6.12). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
Рис. 6.12. Схема электроосмоса
1 — дисперсная система; 2 — перегородка
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
источник
При электрофорезе лекарственных веществ необходимо иметь в виду значение постоянного тока. Последний, вызывая в подлежащих тканях гиперемию и набухание, расширяя межклеточные пространства, как бы создает условия для благоприятного проникновения лекарственного вещества в ткань. Постоянный ток продвигает лекарственное вещество внутрь тканей с одного какого-либо полюса; он вызывает изменение реакции среды в месте наложения электродов.
Для уяснения процессов, происходящих в тканях при электрофорезе лекарственных веществ, следует ознакомиться с некоторыми положениями электрохимии. Согласно теории электролитической диссоциации, часть молекул растворенного вещества распадается на противоположно заряженные ионы — анионы и катионы. Диссоциация представляет своего рода химическую реакцию и подчиняется закону действия масс. В растворе поваренной соли наряду с молекулами NaCl находятся ионы натрия (положительно заряженные катионы) и ионы хлора (отрицательно заряженные анионы). При растворении различные электролиты диссоциируют в различной степени; так как между одновалентными ионами силы сцепления меньше, чем между двухвалентными, то степень диссоциации у них будет больше. Диссоциация молекул элекролита на ионы при его растворении связана с особыми свойствами растворителя; чем выше способность растворителя присоединяться к атомам или ионам, образуя с ними комплексы, тем сильнее диссоциирует растворенное в нем вещество. Растворитель, обладающий высокой диэлектрической постоянной (например, вода), проникает между противоположно заряженными ионами, образующими молекулу, снижает или уничтожает их электростатическое взаимодействие, уничтожает их взаимное притяжение.
Следует помнить, что твердые вещества с ионной кристаллической решеткой в твердом состоянии обладают заметной ионной электропроводностью. При растворении ионного кристалла решетка его разрушается, связи, удерживающие ионы в решетке, разрываются, и ионы переходят в раствор.
В настоящее время установлено, что молекулы воды, которая в биологических системах является растворителем, имеют сложное строение. В молекуле воды атомы водорода расположены асимметрично под определенным углом. В результате этого вода имеет положительный и отрицательный заряд и действует как диполь. Благодаря тому, что молекулы воды представляют собой диполи, вода не только служит растворителем, но играет значительно более важную роль, определяя структуру раствора. Дипольный характер молекул воды лежит в основе явления, называемого гидратацией. Оно заключается в том, что вводном растворе электрически заряженные частицы растворенного вещества окружаются так называемой гидратной оболочкой, образованной молекулами воды, обращенными к заряженной частице своими концами, несущими противоположный электрический заряд. Гидратная оболочка не имеет определенной граничной поверхности, а постепенно переходит в несвязанную воду. Гидратация существенным образом влияет на свойства водных растворов, а тем самым и на их электрокинетические явления. Так, например, ион натрия, меньший по размерам, чем ион калия, окружен более обширной гидратной оболочкой, а потому гидратированный ион натрия обладает большим эффективным диаметром, чем ион калия, что имеет существенное значение для процессов проницаемости.
Процесс гидратации, т. е. взаимодействие частиц растворенного вещества с частицами растворителя, обычно протекает с выделением энергии, которая часто велика, и гидратация ионов при лекарственном электрофорезе может оказать весьма существенное влияние на взаимоотношения между электрически заряженными частицами лекарственного вещества и внутритканевыми частицами, окруженными ионной сферой гидратов противоположного знака. Гидратационный ион, двигаясь к противоположному по заряду полюсу тока, перемещается из одной ионной среды в другую, оставляя за собой гидраты, которые могут в какой-то степени тормозить своим противоположным зарядом поступательное движение лекарственного иона.
Ионы в растворе обычно находятся только в тепловом движении, но при включении тока возникает электрическое поле, под действием которого возникает направленное движение ионов к электродам. Тепловое движение при этом не прекращается, но участвующие в нем ионы, находясь под постоянным действием электрического поля, перемещаются к электродам.
Согласно представлениям классической теории диссоциации, сама по себе скорость движения иона не связана непосредственно с концентрацией раствора.
Скорость движения иона зависит от его природы, определяющей размер сольватного комплекса, сопротивления среды (вязкость) и напряженности поля, в котором ион движется. Концентрация в известной мере влияет на вязкость и в основном на напряженность. Действительно, от концентрации зависит электропроводность раствора, а тем самым падение напряжения в направлении между электродами на единицу времени.
Подвижность ионов зависит от размеров (валентности вещества) и степени гидратации ионов; она также связана с температурой и природой растворителя.
Большую подвижность ионов водорода и гидроксила объясняют особым механизмом их перемещения путем передачи протона Н+ от одной молекулы воды к другой. Правильность этого положения подтверждается тем, что эти ионы имеют исключительно большую подвижность только в растворителях, молекулы которых способны образовать водородную связь (вода, спирты и др.). Резкое увеличение подвижности ионов с повышением температуры связано с уменьшением вязкости жидкости.
При электрофорезе лекарственных веществ приходится иметь дело не только с элементарными частицами, но и со сложными органическими соединениями типа коллоидов. В этом случае процессы переноса молекул несколько усложняются. При взаимодействии коллоидов с электролитами на поверхности частиц адсорбируется преимущественно один из ионов, сообщающий поверхности свой знак заряда, а противоположные, или компенсирующие, ионы полностью остаются в растворе. Под действием сил электрического притяжения последние будут стремиться расположиться возможно ближе к ионам, адсорбированным на поверхности. Образуются два слоя ионов, из которых один расположен на поверхности, а другой — в растворе на молекулярном расстоянии от первого. Этот двойной электрический слой имеет свое электрокинетическое значение.
Когда коллоидные частицы находятся в постоянном электрическом поле, в них, как и в простых электролитах, происходит движение зарядов к противоположно заряженным электродам: коллоидная частица движется в одну сторону, компенсирующие — в другую. Если бы все компенсирующие ионы были свободны в своем движении, то общая картина была бы аналогичной простому переносу ионов. Однако коллоидная частица движется не только с адсорбированными на ней зарядами (число которых в отличие от простых ионов часто бывает непостоянным), но и с той частью компенсирующих ионов, которые непосредственно к ней прилегают.
Скорость движения коллоидной частицы в электрическом поле пропорциональна ее потенциалу. Если бы она передвигалась без части компенсирующих ионов, то ее измеримый потенциал соответствовал бы полной разности потенциалов между поверхностью частицы и глубиной раствора. Благодаря захвату частиц компенсирующих ионов вместе с коллоидной частицей, очевидно, что определяемый по передвижению в электрическом поле так называемый электрокинетический потенциал будет составлять лишь часть термодинамического.
Известно также, что распад в электрическом поле более сложных органических соединений на электрически активные составляющие не аналогичен электролитической диссоциации неорганических элементов. Органические вещества, будучи электрически активными, обладают избыточным электрическим зарядом, который они стремятся отдать, т. е. вступить в электрический контакт с другими веществами. Эта особенность органических соединений имеет огромное значение в современном электрофорезе лекарственных веществ, в котором используют часто сложные органические, соединения.
В соответствии с законом полярности в электрическом поле тока будут перемещаться как электрически активные частицы из этих органических соединений, так и адсорбированные паразитарными ионами Н+ и ОН- электрически неактивные элементы. Будучи электрически заряженными, или поляризованными, все они будут неизбежно взаимодействовать между собой, причем взаимодействие это иногда может оказаться значительно сильнее, нежели химическое взаимодействие, и может качественно отличаться от последнего. Следует принять во внимание и то, что в сильных и даже слабых растворах электролитов между электрически заряженными частицами существует более или менее значительное электрическое взаимодействие. В зависимости от валентности вещества или его электрической активности, а также от расстояния между частицами это взаимодействие различно и может быть даже весьма высоким.
Из изложенного следует, что электрофорез лекарственных веществ очень сложен, особенно когда дело касается перемещения материальных частиц в смешанных растворах, особенно таких, какими являются ткани организма, представляющие среду с различными физико-химическими и биологическими свойствами. Поэтому при выборе нового вещества для электрофореза условия его введения обычно устанавливают экспериментально, исходя из опыта введения других веществ.
источник





