На сегодняшний день, несмотря на значительные достижения в офтальмологии, глаукома остается одной из основных причин слабовидения и необратимой слепоты среди населения. По современным представлениям, глаукому определяют как мультифакторное, нейродегенеративное заболевание [7,10], характеризующееся развитием и прогрессированием оптической нейропатии с ассоциированной потерей зрительных функций, независимо от уровня внутриглазного давления (ВГД) [6,9].
Терапия данного заболевание должна быть комплексной и направлена на устранение всех причин (механических, дисциркуляторных и метаболических), приводящих к развитию атрофии зрительного нерва. Известно, что даже при эффективном снижении внутриглазного давления, возможно дальнейшее ухудшение зрительных функций [3]. Поэтому одной из основных задач лечения глаукомы, помимо эффективного снижения офтальмотонуса, является предотвращение гибели нейрональных клеток [2].
Нейропротекторная терапия направлена на защиту нейронов сетчатки и зрительного нерва от воздействия повреждающих факторов [1]. В настоящее время с этой целью широко используется препарат Ретиналамин, представляющий собой комплекс низкомолекулярных водорастворимых пептидных фракций, полученный методом уксуснокислой экстракции из сетчатки глаз крупного рогатого скота. Ретиналамин обладает тканеспецифическим действием на сетчатку, регулирует процессы метаболизма, улучшает функциональную активность клеточных элементов сетчатки, стимулирует репаративные процессы, нормализует проницаемость сосудов глазного яблока [4,8].
Согласно инструкции по применению, Ретиналамин может вводиться внутримышечно или парабульбарно. Но, к настоящему времени, разработано множество альтернативных путей его введения: субконъюнктивально, в субтеноново пространство, под кожу висков, эндолимфатическим путем, а также методом эндоназального электрофореза [5]. У каждого из этих методов есть как свои преимущества, так и недостатки, такие как низкая концентрация в зоне патологического очага из-за системной абсорбции препарата, длительность курса лечения, парабульбарные гематомы, риск перфорации глазного яблока и др. Это приводит к поиску новых способов введения, которые позволят облегчить адресную доставку лекарственного вещества и создать его депо у диска зрительного нерва.
С этой целью на нашей кафедре были проведены экспериментальные исследования по применению Ретиналамина путем эпиретинального введения.
Цель – провести комплексную оценку безопасности применения Ретиналамина с помощью методики эпиретинального введения в эксперименте.
Материалы и методы. Проведена серия экспериментов на 20 крысах породы Wistar (половозрелые самцы) массой 250-300 гр. Согласно цели эксперимента животные были разделены на 2 группы.
В условиях операционной под наркозом после обработки операционного поля с соблюдением правил асептики и антисептики каждому животному из основной группы через плоскую часть цилиарного тела выполняли прокол инъекционной иглой в 30 Гейч, эпиретинально вводили 0,25% раствора Ретиналамина (содержимое флакона 5 мг предварительно растворяли в 2 мл физиологического раствора) в дозе 0,01 мл, что составляет 0,025 мг лекарственного вещества, до исчезновения пульсации центральной артерии сетчатки, после чего иглу выводили через первоначальный прокол.
Животным группы сравнения также через плоскую часть цилиарного тела выполняли прокол инъекционной иглой в 30 Гейч, вводили физиологический раствор в дозе 0,01 мл до исчезновения пульсации центральной артерии сетчатки, иглу выводили через первоначальный прокол.
Общая продолжительность эксперимента составила 21 сутки. Забор материала (энуклеация глаза) производился на 1, 3, 7, 14, 21 сутки от начала эксперимента. В ходе эксперимента проводили наружный осмотр, непрямую офтальмоскопию с фоторегистрацией, гистологическое исследование.
Для оценки морфологических изменений иссекали заднюю стенку глаза с фрагментом зрительного нерва, фиксировали в 10%-ном растворе нейтрального формалина и заливали в парафин по стандартной методике. После приготовления срезов толщиной 4-6 мкм, проводили окрашивание гематоксилином и эозином. Просмотр и фотографирование микропрепаратов осуществляли на микроскопе «Axiostar plus» (Carl Zeiss, Германия), ок. х10, об. х40.
Результаты и обсуждения. При наружном осмотре и при проведении непрямой офтальмоскопии у подопытных животных основной группы и группы сравнения изменений не выявлено.
При подготовке материала для гистологических исследований макроскопически глазные яблоки животных обеих группы находились в пределах нормы (передне-задний размер — 7-8 мм).
При морфологическом исследовании сетчатки крыс через 1, 3, 7, 14 и 21 сутки после эпиретинальной инъекции, и в основной группе, и в группе сравнения патологических изменений не выявлено. Слои сетчатки сохраняют нормальное строение на протяжении всего эксперимента (рис. 1, 2). Ввиду того, что лабораторные животные альбиносы, слой пигментоэпителиоцитов выглядит нехарактерно. Фоторецепторный слой представлен наружными сегментами палочек и колбочек. За счет их тонкой, нежной структуры на препаратах нередко встречается отрыв сетчатки, имитирующий отслойку, что связано с технической сложностью изготовления препаратов. Сосуды сетчатой оболочки на всем протяжении умеренно полнокровны или запустевают. В месте перехода в диск зрительного нерва сетчатка незначительно истончается, особенно в области наружного и внутреннего зернистого слоев (рис. 3, 4), нередко наблюдается ее отрыв от пигментного слоя, что так же связано с техническими причинами (рис. 5).
Рис. 1. Сетчатка крысы через 1 сутки после введения препарата, сокращениями обозначены следующие слои: Ск – склера; ПЭ – слой пигментоэпителиоцитов; ФР – слой фоторецепторов; НЗ – наружный зернистый слой; ВЗ – внутренний зернистый слой; ВС – внутренний сетчатый слой; Г – ганглионарный слой. Окраска гематоксилином и эозином. Увел. 400
Рис. 2. Сетчатка крысы через 3 суток после введения препарата: Ск – склера; СО – сетчатая оболочка; СТ – стекловидное тело; Х – хрусталик. Окраска гематоксилином и эозином. Увел. 200
Рис. 3. Сетчатка крысы через 7 суток после введения препарата: ДЗН – диск зрительного нерва; Ск – склера; СО – сетчатая оболочка; СТ – стекловидное тело; Х – хрусталик. Окраска гематоксилином и эозином. Увел. 100
Рис. 4. Сетчатка крысы через 14 суток после введения препарата: ДЗН – диск зрительного нерва; Ск – склера; СО – сетчатая оболочка. Окраска гематоксилином и эозином. Увел. 200
Рис. 5. Сетчатка крысы через 21 сутки после введения препарата: ДЗН – диск зрительного нерва; Ск – склера; СО – сетчатая оболочка. Окраска гематоксилином и эозином. Увел. 20
Таким образом, в ходе эксперимента патологических изменений, а также различий между глазными яблоками животных основной группы и группы сравнения при наружном осмотре, офтальмоскопии и проведении морфологического исследования, выявлено не было. Во все сроки оптические среды оставались прозрачные, сетчатка сохраняла нормальное строение.
Исходя из этого, можно сделать вывод, что применение Ретиналамина путем эпиретинального введения является безопасным.
Выводы. Результаты проведенного эксперимента подтверждают безопасность эпиретинального введения Ретиналамина. Кроме этого, данный способ введения позволяет адресно доставить препарат и создать его депо непосредственно у диска зрительного нерва. Полученные результаты могут быть перспективными для дальнейших экспериментальных и клинических исследований в офтальмологии.
Шилова О.Г., д.м.н., профессор кафедры офтальмологии ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск;
Хороших Ю.И., д.м.н., доцент кафедры офтальмологии ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.
источник
Лекарственный электрофорез представляет собой сочетанное воздействие медикаментозного средства и электрического тока. Синонимом этого термина является ионофорез.
Ток проходит через ткани организма по направлению от одного электрода к другому. На пути его встречаются препятствия, которые имеют различную электропроводность. Так в глазном яблоке наименьшая электропроводность у кожного покрова век, а наибольшая – у внутриглазной жидкости. Чтобы преодолеть ткани с низкой проводимостью, требуется высокая энергия тока. В результате развиваются гальванические экзотермические реакции, изменяется кислотность среды, формируются активные метаболиты и ферменты. В результате улучшается микроциркуляция, а в области воздействия тока появляется ощущение жжения.
Одновременно с усиление крово- и лимфотока, увеличивается так называемая резорбционная способность тканей, повышается проницаемость гематоофтальмического барьера. В результате эффективная доза лекарственных средств уменьшается по сравнению с парентеральным способом введения.
Роговица глаза является отличной полупроницаемой мембраной, которая пропускает ионы вещества внутрь глазного яблока. Концентрация лекарства внутри глаза становится достаточно высокой, чтобы лечение привело к должному результату. Эффективность влияния на патологические очаги носит пролонгированный характер.
Эндоназальный электрофорез назначают пациентам с дистрофией и воспалением глазных структур, включая ячмень, халязион, флегмону. Также эта методика помогает при рубцовых изменениях век, кератите, эписклерите, макулодистрофических процессах, посттромботической ретинопатии, неврите и атрофических изменениях оптического нерва. С помощью электрофореза можно улучшить состояние глаза при помутнении вещества стекловидного тела, гемофтальме, спайках в передней камере глаза.
Эндоназальный электрофорез в офтальмологии имеет ряд противопоказаний:
- Тяжелая гипертония;
- Новообразования в организме;
- Заболевания крови и кроветворных органов;
- Склонность к эпилептическим припадкам;
- Острые инфекции, лихорадка;
- Обострение хронических инфекций;
- Декомпенсация соматических заболеваний;
- Наличие инородного тела из металла внутри глаза.
Электрофорез проводят с исопльзование аппаратов непрерывного постоянного тока (Поток, Элфор) или импульсного постоянного тока (Тонус-2, Амплипульс). Электроды выполнены из металла и имеют прокладку гидрофильной ткани, на которую наносят препарат.
При выполнении электрофореза можно применять различные методики:
- Электрофорез по Бургиньону. При этом электрод с лекарством помещают на кожу, а второй электрод – на кожу шеи. В результате лекарственное средство проникает в передние отделы глаза. Методика подходят для лечения заболеваний век и структур передней камеры.
- Ванночковый электрофорез. Методика используется чаще. При этом раствор лекарства наливают в специальную ванночку, в которую нужно погрузить открытый глаз. второй электрод помещают на заднюю поверхность шеи. Методика подходит для лечения воспаления и дистрофических изменений в переднем отрезке глаза.
- Эндоназальный электрофорез. Электроды с лекарством при этом помещают в носовые ходы. Второй электрод традиционно крепится на коже шеи сзади. При этом лекарство лучше проникает в задние структуры глазного яблока. Методику используют при лечении воспаления и дистрофии сетчатки, сосудистой оболочки глаза.
- Локальный электрофорез. Для этого требуется специальный точечный электрод. Также методика подходит для диагностического обследования роговицы и наблюдения за током внутриглазной жидкости у пациентов с глаукомой.
Продолжительность сеанса составляет 10-20 минут, а сила тока колеблется от 0,5 до 1 мА. Курс лечения включает в себя 10-15 процедур, которые назначают через день или ежедневно.
В качестве лекарственных средств при электрофорезе могут применяться сосудорасширяющие, ферменты, ангиопротекторы, нейропротекторы, вещества, изменяющие величину зрачкового отверстия (миотики, мидриатики). Препараты вводят с анода на катод.
Перед началом процедуры нужно установить устойчивость лекарства в электрическом поле, а также риск образования токсичных метаболитов. Это помогает рассчитать оптимальную концентрацию лекарства.
источник
Автореферат и диссертация по медицине (14.01.07) на тему: Эффективность лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препарата Ретиналамин
Автореферат диссертации по медицине на тему Эффективность лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препарата Ретиналамин
Флоренцева Светлана Сергеевна
Эффективность лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препарата Ретиналамин
14.03.11-Восстановительная медицина, спортивная медицина, лечебная физкультура, курортология и физиотерапия.
диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена на кафедре офтальмологии ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации и на базе СПб ГБУЗ «Диагностический центр № 7 (глазной)» для детского и взрослого населения.
Астахов Юрий Сергеевич — доктор медицинских наук профессор. Кирьянова Вера Васильевна — доктор медицинских наук профессор. Официальные оппоненты:
Сайдашева Эльвира Ирековиа — доктор медицинских наук, профессор, заведующая кафедрой детской офтальмологии ГБОУ ВПО «СЗГМУ им. И.И. Мечникова» Министерства здравоохранения Российской Федерации.
Суслова Галина Анатольевна — доктор медицинских наук, профессор заведующей кафедрой реабилитологии ФП и ДПО ГБОУ ВПО «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации.
ФГБВОУ ВПО «Военно-Медицинская академия им. С.М. Кирова» Министерства обороны РФ.
Защита диссертации состоится «26_»_февраля_2015 г. в 15.00 часов на заседании Диссертационного совета Д.208.090.04 при ГБОУ ВПО ПСПбГМУ им. акад. И.П. Павлова Минздрава России по адресу: 197022, Санкт-Петербург, ул. Л. Толстого, д. 6-8, тел.: 8 (812) 4997104, e-mail: usovet@spb-gmu.ru в зале Ученого Совета.
С диссертацией можно ознакомиться в библиотеке Первого Санкт-Петербургского государственного медицинского университета имени академика И.П. Павлова МЗ РФ и на сайте http://spb-gmu.ru.
Автореферат разослан « У $_¿^У^ 2015 г.
Ученый секретарь диссертационного совета доктор медицинских наук, доцент Ткаченко Татьяна Борисовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Возрастная макулярная дегенерация (ВМД) — основная причина стойкой утраты центрального зрения в развитых странах, после катаракты и глаукомы у пациентов старше 50 лет (Resnikoff S., 2004). 30 миллионов человек в мире потеряли зрение от этого заболевания. Ожидается, что к 2020 году количество пациентов с данной патологией удвоится. Это обусловлено увеличением продолжительности жизни, «старением» населения и улучшением методов диагностики заболевания (Американская Академия Офтальмологии, Экспертный Совет по возрастной макулярной дегенерации, 2009). По сведениям различных авторов (Holz F.G., Pauleikhoff D., Spaide R.F., Bird A.C., 2012), ВМД в общей популяции встречается в возрасте 65-74 года в 15% случаев, 75-84 года — в 25% и 85 и более лет — в 30% случаев. В России заболеваемость ВМД составляет более 15 человек на 1000 населения, причем в 60% случаев поражаются оба глаза, что ведет к первичной инвалидности у 11% лиц трудоспособного возраста и у 28% пожилых пациентов (Балашевич Л.И., Измайлов A.C., 2011). Ежегодно в России ВМД диагностируется у 100 000 человек (Измайлов A.C., 2010). Распространенность ВМД среди лиц в возрасте 65-75 лет составляет 10%, старше 75 лет — 30% (Балашевич Л.И., Измайлов A.C., 2011). В 2011 году в Санкт-Петербурге, по данным М.И. Разумовского, 16,8% случаев первичной инвалидности при офтальмопатологии составили заболевания сетчатки.
Известно, что в последние годы наблюдается, с одной стороны, устойчивая тенденция к возрастанию частоты дистрофических поражений макулярной области инволюционного характера, что связано с увеличением продолжительности жизни и изменением возрастной структуры населения (Егоров Е.А., Романенко И.А., 2009), а с другой стороны — «омоложение» данного заболевания и появление признаков ВМД у лиц среднего возраста.
Особая значимость сухой формы ВМД объясняется центральной локализацией процесса и двусторонним характером поражения. По мнению ряда авторов, вероятность вовлечения второго глаза составляет 10-15% в год после поражения первого, и через 5-8 лет уже 70% больных страдают потерей центрального зрения обоих глаз (Holz F.G., Pauleikhoff D., Spaide R.F., Bird A.C., 2012). В Российской Федерации ВМД является одной из основных причин необратимой слепоты, в частности сухая форма приводит к потере зрения в 10% случаев выявленной патологии сетчатки (Либман Е.С., 2006).
Распространенность, неуклонный рост заболеваемости среди лиц среднего возраста, тяжелый исход и инвалидизация трудоспособного населения, отсутствие эффективных методов лечения определяют социальную значимость ВМД.
Возрастная макулярная дегенерация — прогрессирующее заболевание, проявляющееся хроническим дегенеративным процессом в пигментном эпителии, мембране Бруха и хориокапиллярном слое макулярной области сетчатки, с последующим вовлечением фоторецепторов (Donald J., Gass M., 1977).
Медикаментозная терапия сухой формы ВМД должна быть патогенетически направленной. Принятые схемы лечения нацелены на профилактику замедленного формирования друз, отложений липофусцина, повышение плотности макулярного пигмента и тем самым на предупреждение развития патологических изменений в центральной зоне сетчатки. С 1986 года в офтальмологической практике стал широко применяться нейропептид Ретиналамин.
Ретиналамин (ретилин) — комплекс пептидов, выделенных из сетчатки глаза крупного рогатого скота. Препарат регулирует процессы метаболизма в сетчатке, стимулирует функции клеточных элементов сетчатой оболочки, способствует улучшению функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов при различной патологии сетчатки, усиливает активность ретинальных макрофагов, оказывает
нормализующее влияние на коагуляцию крови и обладает выраженным протекторным эффектом в отношении сосудистого эндотелия (Хавинсон В.Х. и др., 1988, 1997). Пептидные биорегуляторы, воздействуя на процессы межклеточной регуляции, способствуют восстановлению и сохранению регуляторных механизмов синтеза белка (Яковлев Г. М. и др., 1987, 1990).
Изученный механизм действия препарата на сетчатку определил показания к применению Ретиналамина в офтальмологии: центральные и периферические тапеторетинальные абиотрофии сетчатки; диабетическая ретинопатия; посттравматические и поствоспалительные центральные дистрофии сетчатки; послеоперационная реабилитация больных с отслойкой сетчатки; избыточная лазерная коагуляция сетчатки; профилактика ретромбозов сетчатки; глаукомной нейрооптикопатии. Применяемые схемы лечения Ретиналамином предусматривают инъекционный способ введения препарата. При этом отмечаются болезненность в месте инъекции, последующий дискомфорт и травматизация окружающих тканей. Поэтому наше внимание привлекли физиотерапевтические методики введения лекарственных средств, которые являются неивазивными и атравматичными.
Электрофорез лекарственных препаратов представляет собой метод сочетанного воздействия на организм постоянного электрического тока и лекарственного вещества, вводимого с его помощью. Основная особенность метода лекарственного электрофореза состоит в том, что лекарственные вещества в организме действуют на фоне изменений, вызванных постоянным током. Именно благодаря этому отчетливое терапевтическое действие лекарственных средств, вводимых путем электрофореза, проявляется при концентрациях, которые при других путях их введения недейственны или малоэффективны. По данным литературы эндоназальный электрофорез Ретиналамина применяется офтальмологами для лечения врожденной миопии у детей (патент от 18.05.2006 г., МНТК «Микрохирургия глаза» С.Н. Фёдорова). Однако данных по определению электрофоретичности Ретиналамина. в литературе мы не нашли. Клиническому применению электрофореза лекарственных препаратов, особенно сложной структуры,
должны предшествовать тщательные физико-химические (определение полярности, электрофоретической подвижности лекарств, устойчивости их к постоянному току, выбор подходящего растворителя) и клинико-физиологические (контроль проникновения вещества через кожу или слизистые оболочки, его количественная оценка, терапевтическая эффективность и др.) исследования, которые мы и провели в своей работе.
Для определения эффективности применения препарата Ретиналамин при лечении сухой формы ВМД и степени его влияния на функции и структуру сетчатки необходимы объективные современные методы оценки функционального состояния зрительно-нервного аппарата. На сегодняшний день электрофизиологические и морфометрические методы исследований позволяют оценить изменения функций и структуры сетчатки в реальном времени (Mkelberg Р., 1995). Эти методы имеют несомненное преимущество- возможность получения объективной информации и ее хранения и передачи в цифровом формате (Hassenstein A., Meyer С. Н., 2009).
Сравнить лечебное действие Ретиналамина, введенного с помощью эндоназального электрофореза и посредством инъекций под конъюнктиву, у больных с сухой формой возрастной макулярной дегенерации (стадии 1,2 AREDS) для повышения эффективности лечения.
Для достижения поставленной цели были сформулированы следующие задач» исследования:
1. Определить форетичность (биодоступность) препарата Ретиналамин.
2. Разработать условия и методику эндоназального электрофореза Ретиналамина.
3. Сравнить эффективность Ретиналамина, введенного с помощью эндоназального электрофореза и путем субконъюнктивальных инъекций, по результатам электрофизиологических исследований.
4. Провести сравнительную оценку результатов лечения возрастной макулярной дегенерации сухой формы (стадии 1, 2 AREDS) Ретиналамином, введенным с помощью эндоназального электрофореза и инъекционно под
конъюнктиву, на основании данных электрофизиологических (макулярной и ритмической электроретинограмы) и морфометрических (оптической когерентной томографии) исследований.
Научная новизна исследования заключается в том, что впервые:
— проведено определение форетичности препарата Ретиналамин;
— обоснованы специальные условия проведения эндоназалышго электрофореза препарата Ретиналамин;
— впервые для лечения пациентов с сухой формой возрастной макулярной дегенерации (стадии 1,2 А11ЕОЗ) использован метод эндоназального электрофореза препарата Ретиналамин;
— на клиническом материале произведена сравнительная оценка эффективности двух методов введения препарата Ретиналамин для лечения пациентов с возрастной макулярной дегенерацией с помощью электрофизиологических методов (макулярной и ритмической электроретинограмы) и морфометрии (оптической когерентной томографии макулярной области).
1. Доказана электрофоретичность препарата Ретиналамин.
2. На основании выполненного исследования разработана методика и рекомендации по лечению возрастной макулярной дегенерации (стадии 1, 2 АИШ^) эндоназальным электрофорезом препарата Ретиналамин.
3. Определен как наиболее эффективный и при этом неинвазивный метод лечения сухой формы возрастной макулярной дегенерации (стадии 1, 2 АИШ^) эндоназальный электрофорез препарата Ретиналамин.
Положения, выносимые на защиту:
1. Целесообразность применения эндоназального электрофореза препарата Ретиналамин для лечения пациентов с сухой формой возрастной макулярной дегенерации (стадии 1, 2 АКЕББ).
-82. Объективное исследование электрофоретичности препарата Ретиналамин.
Материалы и основные положения диссертации доложены и обсуждены на:
1. XV международном офтальмологическом конгрессе «Белые ночи» (5-й Конгресс Межрегиональной ассоциации врачей-офтальмологов России), 25-28 мая 2009 года, Санкт-Петербург;
2. Научно-практической конференции с международным участием «Российский общенациональный офтальмологический форум» (РООФ), 8-9 октября 2009 года, Москва;
3. XVI международном офтальмологическом конгрессе «Белые ночи» (6-й Конгресс Межрегиональной ассоциации врачей-офтальмологов России) 31 мая — 4 июня 2010 года, Санкт-Петербург;
4. Научно-практической конференции с международным участием «Российский общенациональный офтальмологический форум» (РООФ), 7-8 октября 2010 года, Москва;
5. Научно-практической конференции с международным участием «Российский общенациональный офтальмологический форум» (РООФ), 6-8 октября 2011 года, Москва;
6. II Международном конкурсе молодых ученых и специалистов «Пептидные препараты — препараты XXI века» (Санкт-Петербург, 2010 год, третье место).
По материалам диссертации опубликовано 9 печатных работ, из них 3 статьи в рецензируемых центральных научных изданиях, рекомендованных ВАК для публикации результатов диссертации на соискание степени кандидата медицинских наук. По теме диссертационной работы изданы два методических руководства.
Внедрение результатов в практику
Результаты исследования внедрены в практику СПб ГБУЗ ДЦ № 7 (глазной) для взрослого и детского населения (Моховая ул., 38). С 2011 г. используются в СПб ГБУЗ «Городская поликлиника № 39», в СПб ГБУЗ «Городская поликлиника № 3» ДПО 24, с 2013 г. — в СПб ГБУЗ «Городская поликлиника № 54», в СПб ГБУЗ «Городская больница № 31».
Объем проведенных исследований
Всего в настоящей работе использованы результаты обследований 120 человек (239 глаз). Всего проведено 2400 инструментальных исследований.
Диссертационная работа изложена на 140 страницах машинописного текста, состоит из введения, трех глав, заключения, выводов, практических рекомендаций, списка литературы. Содержит 56 таблиц, 48 рисунков, 3 диаграммы и 2 формулы. Список литературы включает 185 источников, в том числе 82 отечественных и 103 иностранных авторов.
ОБЩАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ИХ ОБСЛЕДОВАНИЯ
Материалы и методы исследования
Исследуемая группа пациентов с сухой формой ВМД (стадии 1,2 AREDS) получала обследование и лечение в Санкт-Петербургском государственном бюджетном учреждении здравоохранения «Диагностический центр № 7» (глазной) для взрослого и детского населения. Всего в настоящей работе использованы результаты обследования 120 пациентов. Все пациенты длительное время наблюдались в консультативно-диагностическом центре (от 3 мес до 5 лет). Для определения сравнительных результатов эффективности Ретиналамина, введенного с помощью эндоназалыюго электрофореза и путем субконъюнктивальных инъекций, проведено
проспсктивное рандомизированное слепое исследование. Рандомизация проведена методом конвертов.
В исследование включено 120 человек с установленным диагнозом ВМД, сухая форма. Все пациенты были разделены на 4 группы (таблица 1).
Таблица 1 — Распределение пациентов по видам лечения и возрасту
Группа, средний возраст Количество больных Вид лечебного воздействия
№ 1, 65,4±0,3 года 30 пациентов (60 глаз) Эндоназальный электрофорез Ретиналамина
№2, 67,3±0,3 года 30 пациентов (59 глаз) Субконъюнктивальные инъекции Ретиналамина
№3, 64,3±0,5 года 30 пациентов (60 глаз) Имитация ФТЛ
№4, 67,3±0,3 года 30 пациентов (60 глаз) Эндоназальная гальванизация
Всего, 67,3±0,1 года 120 пациентов (239 глаз)
В исследование были включены пациенты с установленным диагнозом сухой формы ВМД (стадии 1,2АЩЮ8), с наличием информированного согласия на участие в исследовании.
Критериями исключения из исследования явились: помутнения оптических сред глаза (поражение’ роговицы, катаракта с выраженной степенью помутнения в центральной части хрусталика), препятствующие проведению обследований, нарушения рефракции, препятствующие проведению ретинальной томографии (аметропии высокой степени); глазные заболевания: ВМД, влажная форма; глаукома, частичная атрофия зрительного нерва, дегенеративная миопия; некомпенсированные соматические заболевания (гипертоническая болезнь, сахарный диабет и т. д.), отказ пациента от участия в программе.
Всего нами обследовано 120 человек (239 глаз): 36 мужчин и 84 женщины, в возрасте от 46 до 67 лет, средний возраст составил 66,3±0,4 года. Распределение больных по полу представлено в таблице 2. Таблица 2 — Распределение пациентов по полу и группам
Группа Количество Пол пациентов
пациентов глаз женщины, % мужчины, %
Всего 120 239 78 (65%) 42 (35%)
Установленный диагноз возрастной макулодистрофии у обследуемых больных сомнения не вызывал. Все пациенты длительное время находились под наблюдением в консультативно-диагностическом центре. Форма возрастной макулодистрофии была сухой (стадии 1, 2 АЯЕБЗ).
В нашем исследовании использовались следующие диагностические методы.
Общепринятые офтальмологические методы исследования:
визометрия (проектор знаков Торсоп-АСР 7, Япония), авторефрактометрия (авторефрактометр Тотеу-ЯС 4000, Япония), стандартная автоматизированная периметрия (Периком, Россия), биомикро-офтальмоскопия глазного дна с асферической линзой 60 и 90 Э, измерение ВГД тонометром Маклакова.
Специальные методы диагностики
Для оценки функций центрального отдела сетчатки: макулярная электроретинография, ритмическая электроретинография на стимул 30 Гц (электроретинограф МБН, Россия).
Для оценки структуры центрального отдела сетчатки: оптическая когерентная томография макулярной области (Торсоп 3D Oct-lOOO, Япония).
Все исследования выполнялись на базе Санкт-Петербургского государственного бюджетного учреждения здравоохранения «Диагностический центр № 7» (глазной) для взрослого и детского населения. Указанные методики применялись в 4 группах пациентов до начала лечения Ретиналамином, через 3 и 6 месяцев после начала лечения. Повторный курс терапии пациенты получали в течение 10 дней в условиях дневного стационара СПб ГБУЗ ДЦ № 7 через 6 месяцев. После окончания лечения исследования проводились снова. Выполнено 2400 исследований.
Статистическая обработка. Для описания количественных переменных использовались характеристики среднего ± ошибка среднего (в некоторых случаях среднего ± стандартное отклонение), для описания порядковых показателей медиана — интерквартильный размах (нижняя и верхняя квартили) — размах (минимум-максимум). Для исследования однородности данных по группам в начальной точке использовался однофакторный дисперсионный анализ (модель с фиксированными эффектами) с учетом множественных сравнений Дункана. В случае порядковой шкалы анализ дублировался при помощи множественных сравнений Ван дер Вардена. Для анализа повторных наблюдений (левый-правый глаз, динамика показателя в разные моменты времени) использовались метод дисперсионного анализа для зависимых выборок в виде планов с расщепленными блоками (ANOVA Repeated Measures) и общая линейная модель (частичный план) с ковариатой в виде данных в первой точке наблюдений.
Однородность дисперсий проверялась при помощи критериев Бартлетта и Левина. Согласие остатков с нормальным законом распределения проверялось при помощи критерия Шапиро-Уилкса. Для анализа множественных сравнений использовались критерии Тьюки (Tukey HSD test) и непараметрический Дункана (Duncan’s test).
Для исследования зависимости между количественными переменными использовался коэффициент корреляции Пирсона, для порядковых —
коэффициент корреляции Сиирмеиа, значимость отклонения от нуля коэффициентов корреляции проверялась при помощи соответствующего критерия Стыодента. Значимость фактора времени для порядковых признаков проверялась при помощи критерия Фридмана. Расчеты выполнены при помощи статистических пакетов программ Statistica 7.0, PASW Statistics 18 R.
Характеристика методов лечения, применявшихся в ходе данных
Методика эндоназалыюго электрофореза Ретиналамина
Для приготовления раствора, используемого в методике эндоназалыюго электрофореза, предварительно 5 мг сухого лиофилизированного порошка «Ретиналамин» растворяли в 2,0 мл 0,9% раствора натрия хлорида (0,25% раствор Ретиналамина), рН полученного лекарственного раствора доводили до 5,4-5,8, добавляя капельным путем 2-3 капли 0,1 нормальной соляной кислоты (НС1). Перед процедурой проводили промывание носа водой. Пациента укладывали на кушетку. Активный электрод положительной полярности (анод) присоединяли к терапевтическому разъему аппарата гальванизации Поток-1. Затем 2 марлевые турунды длиной до 10 см, смоченные в 0,25% растворе Ретиналамина, вводили в средние носовые ходы. Концы турунд укладывали на клеенку, расположенную на верхней губе, покрывали влажной прокладкой 1 хЗ см с электродом и фиксировали. Второй электрод — отрицательной полярности (катод), с марлевой прокладкой 8×12 см, смоченной изотоническим раствором натрия хлорида, располагали на задней поверхности шеи в области I—III шейных позвонков.
Сила тока дозировалась по индивидуальным ощущениям пациента в диапазоне 0,5-1,0 мА (до возникновения у пациента ощущений приятного покалывания или жжения). Продолжительность процедуры составляла от 8 до 15 мин, увеличивая время по 2 мин через процедуру. Курс продолжался в течение 10 дней.
Методика эндоназалыюй гальванизации
Процедуры проводились по вышеописанной схеме, но марлевые турунды, которые вводили в средний носовой ход пациентов, смачивали 0,9% изотоническим раствором натрия хлорида. Курс лечения продолжался в течение 10 дней.
Методика субконъюнктивальных инъекций Ретиналамина
Под местной анестезией 5 мг раствора Ретиналамина вводили субконъюнктивально по 0,5 мл в оба глаза № 10 ежедневно. Препарат растворяли в 1 мл 0,9% раствора натрия хлорида (по инструкции).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Элсктрофоретичность Ретиналамина была установлена на кафедре восстановительной медицины и физиотерапии СЗГМУ им. И.И. Мечникова под руководством профессора В.В. Кирьяновой. Известно, что вещества полипептидной природы обладают амфолитными свойствами, поэтому для обоснования лечебного метода электрофореза комплекса полипептидов Ретиналамин нами проведено исследование по определению его изоэлектрической точки, оптимальной полярности и оптимального значения pH растворителя, при котором достигается наибольшая эффективность электрофореза (максимальное количество перемещенного вещества) (Малахова М.Я., 1995).
Изучали электрофоретическую подвижность, а в контрольных пробах -диффузию препарата Ретиналамин в камерной установке для аналитического электрофореза при значениях pH растворителя 5,0; 5,4; 5,8; 6,2; 6,6; 7,0; 7,4; 7,8; 8,2; 8,6; 9,0. Концентрацию полипептидов . в пробах определяли микрореакцией О.Н. Lowry в модификации М.Я. Малаховой (Lowry О.Н., Rosenbrough N.J., Farr A.L., 1951).
Установлено, что изоэлектрическая точка препарата Ретиналамин соответствует рН 7,4, оптимальная полярность активного электрода положительная, наибольшая эффективность электрофореза имеет место при рН 5,4-5,8.
Данные клинических исследований
Динамика остроты зрения после курса лечения Ретиналамином представлена в таблице 3.
Таблица 3 — Динамика остроты зрения после курса терапии Ретиналамином
№ 1 (п=30) № 2 (п=59) № 3 (п=30) № 4 (п=30)
1. До лечения 0,7±0,12 0,7±0,13 0,72±0,09 0,73±0,11
2. Через 3 мес 0,89±0,18 0,86±0,15 0,72±0,17 0,73±0,12
3. Через 6 мес 0,82±0,25 0,75±0,31 0,71±0,13 0,72±0,22
4. Через 6 мес и 10 дней 0,89±0,28 0,85±0,29 0,71 ±0,18 0,72±0,31
Достоверность различий между группами, р р )/ нормализованные ранги (N0) Значимости эффектов в модели дисперсионного анализа для зависимых выборок
препарат ток взаимодействие препарата и тока время взаимодействие факторов времени с эффектами
препарат ток взаимодействие препарата и тока
а-Волна, амплитуда Ы) 0,0846 Зе-04 0,1917 0 0 0 8с-04
N0 0,3259 0,001 0,3154 0 0 2е-04 0
Ь-Волна, амплитуда 1Ш 0,0025 0,003 0,0941 0 0 0 0
N0 0,0072 7е-04 0,0933 0 0 0 0
Амплитуда РЭРГ 1Ш 0,1027 0 0,7074 0 0 0 0
а-Волна, латснгность яо 0,1648 0,0272 0,2657 0 0 0 0
ОКТ (по первым трем точкам) 1ГО 0,865 0,1503 0,671 0,2013 0,2013 0,1697 0,1697
N0 0,4803 0,1359 0,5031 0 0,1966 0,5126 0,4635
Подводя итоги нашей работы, можно говорить об изменениях в электрогенезе фоторецепторов макулярной области сетчатки на фоне лечения исследуемым препаратом и о стабилизации морфометрического показателя в течение всего времени наблюдения.
Таким образом, инструментальными методами доказано, что в группах больных, получавших Ретиналамин в виде субконъюнктивальных инъекций и с помощью эндоназального электрофореза, отмечался клинический эффект: повысилась функциональная активность наружных и внутренних слоев сетчатки в макулярной области: увеличилась амплитуда волн а и Ь, уменьшалась латентность а-волны, т. е. наблюдалось увеличение активности фоторецепторов и ганглиозных клеток сетчатки (см. таблицу 5). По
результатам анализа полученных данных можно отметить, что латентность волны b не менялась в течение всего периода исследования, что говорит о стабилизации патологического процесса, так как латентность является более устойчивым параметром МЭРГ при повторных исследованиях, и ее изменения при прогрессировании дегенеративных процессов весьма показательны (Шамшинова A.M., Зуева М.В., Цапенко И.В., 1999).
При физиотерапевтическом лечении был получен более выраженный клинический эффект, процедуры хорошо переносились всеми пациентами. По результатам изменений амплитуды а-волны до и после курсов лечения, выраженных в процентах, можно говорить об эффективности предложенных методик. Клинический эффект Ретиналамина, введенного электрофорезом, сохраняется 3 месяца. Повторное лечение Ретиналамином через 6 месяцев дает более выраженный клинический эффект в группе № 1 (рисунок) по сравнению с инъекционным введением препарата.
Рисунок — Клинический эффект эндоназального электрофореза Ретиналамина.
Через 3 месяца в обеих исследуемых группах клинический эффект от применения Ретиналамина составил 49,1% в группе № 1 и 43,1% в группе № 2 (по данным изменений а-волны МЭРГ). При повторном курсе лечения через 6 месяцев эффективность препарата увеличивалась до 49,8% в группе № 1 и до 46,2% в группе № 2, по сравнению с исходными данными этой группы (по данным амплитуды а-волны МЭРГ), что позволяет рекомендовать применять этот метод два раза в год.
1. Определена электрофоретичность препарата Ретиналамин: изо-электрическая точка соответствует рН 7,4 с анода, оптимальный рН составляет 5,4-5,8 — и впервые разработаны условия проведения эндоназального электрофореза Ретиналамина.
2. Впервые для лечения больных с сухой формой возрастной макулярной дегенерации (стадии 1,2 АЯЕОЗ) применен метод эндоназального электрофореза Ретиналамина и доказана его эффективность.
3. Клинический эффект эндоназального электрофореза Ретиналамина сохраняется 3 месяца, к 6 месяцам показатели снижаются (по данным анализа амплитуды а-волны).
4. Повторное лечение Ретиналамином через 6 месяцев дает более выраженный клинический эффект (по данным электрофизиологических исследований) в группе, получавшей лечение методом эндоназального электрофореза, чем в группе с инъекционным путем введения.
5. Метод может быть рекомендован для использования в клинической практике как в стационаре, так и в поликлиниках.
1. Метод эндоназального электрофореза Ретиналамина можно рекомендовать для лечения сухой формы возрастной макулярной дегенерации.
2. Метод может быть рекомендован для внедрения в практику не только в условиях стационара, но и в поликлинике.
3. Проводить эндоназальный электрофорез Ретиналамина у пациентов с сухой формой возрастной макулярной дегенерации (стадии 1,2АШЮ8) следует не реже, чем 1 раз в 6 месяцев.
Список работ, опубликованных по теме диссертации
(жирным шрифтом отмечены издания, рекомендованные ВАК)
1. Морозова, Н.В. Эффективность лечения ВМД сухой формы методом эндоназального электрофореза препаратом Ретиналамин / Н.В.Морозова, Д.П. Новиков, В.О. Соколов, С.С. Флоренцева // Офтальмологические ведомости. — 2009. — Т. 2, № 3. — С. 40-45.
2. Морозова, Н.В. Лечение сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препаратом Ретиналамин: методические рекомендации / Н.В. Морозова, В.О. Соколов, С.С. Флоренцева. — СПб., 2009. — 16 с.
3. Морозова, Н.В. Результаты лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препаратом Ретиналамин / Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Сб. тр. науч.-практ. конф. с междунар. участием «Российский общенациональный офтальмологический форум» (РООФ), Москва, 8-9 октября 2009 г. / Под ред.
B.В. Нероева. — М„ 2009. — Т. 1. — С. 93-95.
4. Кирьянова, В.В. Применение эндоназального электрофореза Ретиналамина в комплексном лечении сухой формы возрастной макулярной дегенерации / В.В. Кирьянова, Н.В. Морозова, В.О. Соколов,
C.С. Флоренцева // Нелекарственная медицина. — 2010. — № 2. — С. 11-20.
5. Астахов, Ю.С. Оптимизация лечения сухой формы возрастной макулярной дегенерации методом эндоназального электрофореза препаратом Ретиналамин / Ю.С. Астахов, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева. A.B. Ракицкий // Офтальмологические ведомости. -2010. — Т. 2, № 3. — С. 40-45.
6. Астахов, Ю.С. Опыт лечения ВМД сухой формы методом эндоназального электрофореза препаратом Ретиналамин / Ю.С. Астахов, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Сб. тр. III науч. конф. с междунар. участием «Роль и место фармакотерапии в современной офтальмологической практике»13-14 декабря 2012. — СПб.: МНТК, 2012. -С. 82-84.
7. Астахов, Ю.С. Опыт лечения ВМД сухой формы методом эндоназального электрофореза препаратом Ретиналамин / Ю.С. Астахов, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Сб. тр. науч. конф. с междунар. участием «Новые технологии в офтальмологии». — Казань, 2013. -С. 34—36.
-238. Астахов, Ю.С. Опыт применения «Ретиналамина» в лечении глау-комной нейрооптикопатии и возрастной макулярной дегенерации / Ю.С. Астахов, Е.В. Бутин, Н.В. Морозова, В.О. Соколов, С.С. Флоренцева // Офтальмологические ведомости. — 2013. — Т. 5, № 2. -С. 45-49.
9. Морозова, Н.В. Лечение ПОУГ 1-2 стадии методом эндоназального электрофореза препаратом Ретиналамин: методические рекомендации / Н.В. Морозова, В.О. Соколов, С.С. Флоренцева. — СПб., 2012. — 20 с.
БМ — биомикроскопия (глазного дна) ВГД — внутриглазное давление
ВМД — возрастная макулярная дегенерация (возрастная макулодистрофия) ВОЗ — Всемирная Организация Здравоохранения МЭРГ — макулярная электроретинограмма
ОКТ — оптическая когерентная томография, оптический когерентный томограф
ПЭС — пигментный эпителий сетчатки
РЭРГ — ритмическая электроретинограмма
ФТЛ — физиотерапевтическое лечение
ЦПЗ — центральное поле зрения
ЭФИ — электрофизиологические исследования
Подписано к печати 12.01.2015. Формат 60×84 1/16. Бум.офсетная. Усл. печ. л. 1,0. Тираж 100 экз. Заказ 4.
Отпечатано в ООО ИД «Петрополис» 197101 Санкт-Петербург ул. Б.Монетная, д. 16, офис 22
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Цель исследования: оценка эффективности и переносимости Ретиналамина у пациентов с различными офтальмологическими заболеваниями при проведении 1-го или 2-х последовательных курсов лечения с интервалом в 3 мес. В исследование включали пациентов в возрасте старше 18 лет с «сухой» или «влажной» формой возрастной макулярной дегенерации (ВМД), первичной открытоугольной глаукомой (ПОУГ) с компенсированным внутриглазным давлением (ВГД), диабетической ретинопатией и миопической болезнью.
Материал и методы: общее количество пациентов составило 4172 человека (64% женщин и 36% мужчин). Средний возраст пациентов – 59±17 лет. Для оценки эффективности и переносимости ретинопротекторной терапии были запланированы контрольные визиты через 1, 3, 4 и 6 мес. от начала терапии в случае назначения 2-х курсов Ретиналамина. При проведении 1-го курса лечения Ретиналамином пациенты обследовались через 1, 3 и 6 мес. от начала терапии. Эффективность оценивалась по изменению остроты зрения (ОЗ) и состоянию полей зрения (ПЗ) (расширению границ ПЗ суммарно, уменьшению количества скотом и изменению показателей MD, PSD).
Результаты: отмечалась тенденция к улучшению состояния зрительных функций в процессе наблюдения. Выраженная положительная динамика ОЗ с коррекцией, периметрических индексов, увеличение периферических границ ПЗ, уменьшение количества скотом наблюдались в сроки 1 и 3 мес. от начала терапии. В дальнейшем наблюдалась стабилизация большинства оцениваемых показателей.
Переносимость Ретиналамина у пациентов с различными офтальмологическими заболеваниями при проведении 2-х последовательных курсов с интервалом в 3 мес. была хорошей, нежелательные явления в ходе исследования выявлены не были.
Ключевые слова: Ретиналамин, нейропротекция, ВМД, глаукома, диабетическая ретинопатия, миопическая болезнь.
Для цитирования: Егоров Е.А. Опыт применения Ретиналамина при различных офтальмологических заболеваниях // РМЖ. Клиническая офтальмология. 2017. №1. С. 35-38
Retinalamin for various ophthalmic disorders: clinical experience
Egorov E.A.
N.I. Pirogov Russian National Research Medical University, Moscow
Aim. To assess the efficacy and tolerability of Retinalamin for the treatment of various ophthalmic disorders (one or two consecutive treatment courses with a 3-month interval).
Patients and methods. The study included 4172 patients (64% of women and 36% of men) aged 18 years and older (mean age 59 ± 17 years) with dry and wet macular degeneration, primary open-angle glaucoma with normal IOP, diabetic retinopathy, and myopic disease. The efficacy of Retinalmin was evaluated after 1, 3, 4, and 6 months (two treatment courses) or after 1, 3, and 6 months of the therapy (one treatment course) by the changes in visual acuity and visual fields (overall improvement, resolution of scotomas, improvement of MD and PSD).
Results. Visual functions tended to improve during the follow-up. Significant improvement of best-corrected visual acuity, peripheral visual fields, and perimetric indices as well as resolution of scotomas were observed after 1 and 3 months of the therapy. Later, most parameters remained stable.
Retinalamin for various ophthalmic disorders (two treatment courses with a 3-month interval) is well tolerated and has no significant adverse side effects/
Key words: Retinalamin, neuroprotection, AMD, glaucoma, diabetic retinopathy, myopic disease.
For citation: Egorov E.A. Retinalamin for various ophthalmic disorders: clinical experience // RMJ. Clinical ophthalmology. 2017. № 1. P. 35–38.
Статья посвящена применению Ретиналамина в офтальмологии
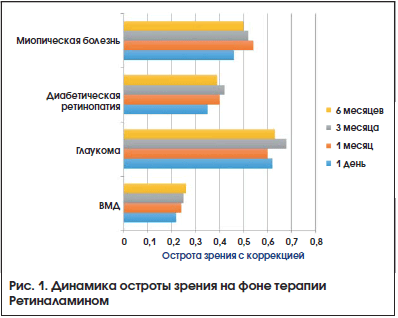
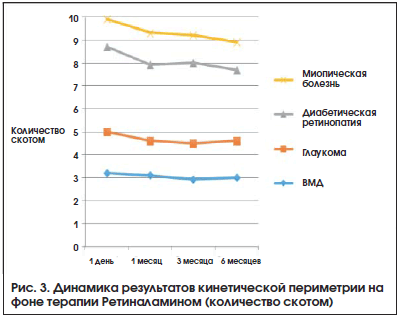
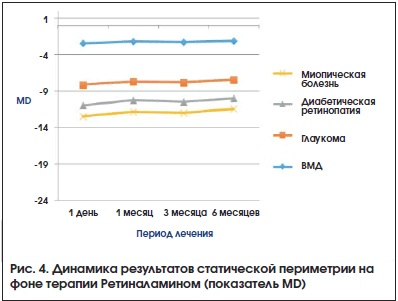
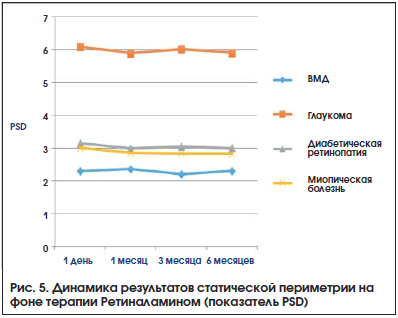
Динамика ОЗ на фоне терапии представлена на рис. 1. Наблюдалась тенденция к повышению ОЗ, наиболее выраженная в большинстве случаев через 3 мес. терапии. Результаты исследования ПЗ были разделены на 2 группы в зависимости от применяемого метода периметрии. Кинетическая периметрия использовалась в 37% наблюдений, ее применение было связано как с оснащением диагностических центров, так и с ограничениями для проведения стандартной автоматической периметрии (низкая ОЗ, сложность методики). Оценивали динамику периферических границ ПЗ по сумме 8 меридианов (Σ, в градусах) и количеству скотом (рис. 2, 3). Изменение результатов статической периметрии оценивали по изменению основных индексов
светочувствительности: MD – среднее снижение и PSD – отклонение паттерна (рис. 4, 5).
Все изменения результатов периметрии были статистически недостоверны (p>0,05). Наблюдалась тенденция к улучшению состояния зрительных функций в процессе наблюдения. Выраженная положительная динамика ОЗ с коррекцией, периметрических индексов, увеличение периферических границ ПЗ, уменьшение количества скотом наблюдались в сроки 1 и 3 мес. от начала терапии. В дальнейшем отмечалась стабилизация большинства оцениваемых показателей.
Различие в ответах по «Опроснику для пациента» в разные сроки наблюдения было недостоверным, однако отмечалось некоторое снижение значения общего балла на фоне терапии Ретиналамином, что свидетельствует о тенденции к улучшению качества жизни больных. Различие в ответах между нозологическими группами наиболее вероятно связано с особенностями клинической картины заболеваний.
Переносимость Ретиналамина у пациентов с различными офтальмологическими заболеваниями при проведении 2-х последовательных курсов с интервалом в 3 мес. была хорошей, НЯ в ходе исследования выявлены не были.
При назначении Ретиналамина у пациентов с ВМД, глаукомой, диабетической ретинопатией, миопической болезнью в виде 2-х последовательных курсов с интервалом в 3 мес. наблюдались положительная динамика средней ОЗ и тенденция к увеличению светочувствительности сетчатки (расширение границ ПЗ, уменьшение количества скотом и изменение показателей MD и PSD).
Ретиналамин может быть рекомендован в качестве универсального нейропротектора при различных офтальмологических заболеваниях, связанных с дегенеративными поражениями ткани сетчатки.
1 MD (mean deviation), среднее отклонение от возрастной нормы, показывает общую депрессию или наличие в ПЗ участков с нормальной светочувствительностью и дефектами.
2 PSD (pattern standard deviation), частное стандартное отклонение, представляет собой степень отклонения формы холма зрения пациента от возрастной нормы.
Только для зарегистрированных пользователей
источник

Терапевтический эффект лекарственного электрофореза объясняется воздействием, и используемого ЛС, и влиянием постоянного электрического тока. Проходя от одного электрода к парному через ткани, электроток встречает определенное сопротивление, величина которого обусловлена электропроводностью тканей. Наилучшей электропроводностью в глазном яблоке обладает внутриглазная жидкость, а эпидермис век — наихудшей. Чтобы преодолеть места, имеющие наименьшую электропроводность, должна быть затрачена значительная энергия тока. При этом увеличение энергии для преодоления сопротивления тканей вызывает в них гальванические реакции, что сопровождается образованием значительного количества тепла и перераспределением ионов, как в межклеточном, так и в клеточном веществе. Кроме того, происходит изменение кислотно-щелочного баланса среды, приводящее к образованию биоактивных веществ и ферментативной активности в обменных процессах. Благодаря этому, происходит быстрая активация локального кровообращения с ощущением жжения в месте соприкосновения электродов с тканями и небольшим покраснением самих тканей.
Реакция гальванизации вызывает усиление крово- и лимфообращения в тканях, повышает их резорбционную способность, стимулируется процессы обмена и трофики, активирует секреторную функцию желез, в значительной мере улучшает проницаемость гематоофтальмического барьера. Электрофорез способствует продлению действия ЛС в значительно меньшей дозе, чем обычно назначают для парентерального введения. Роговица – это идеальная полупроницаемая мембрана, сквозь которую ионы способны проникать внутрь глаза. Улучшенная гальванизацией проницаемость гематоофтальмического барьера дает возможность более полному проникновению внутрь глаза лекарственных средств, что значительно эффективнее, чем инъекционное их введение в ткани вокруг глазного яблока. Кроме того, после введения ЛС с помощью электрофореза происходит накапливание их в тканях, чем и объясняется пролонгированное медикаментозное воздействие на подвергающиеся терапии патологии.
Проведение процедур электрофореза показано при воспалительных и дистрофических заболевания глаз в острой и хронической форме. К ним относят:
- Ячмени, флегмоны и халазионы;
- Рубцы на веках;
- Кератиты, иридоциклиты, эписклериты;
- Процессы образования спаек в переднем отделе глаза;
- Кровоизлияния в глаз;
- Помутнения стекловидного тела;
- Хориоретиниты и хориоретинальные дегенерации (центральные и периферические);
- Макулодистрофии, невриты, атрофии зрительного нерва;
- Посттромботические ретинопатии.
Противопоказания к выполнению электрофореза в офтальмологи подразделяются на общие, которые касаются всех физиотерапевтических процедур (обозначены *), и частные, справедливые в данном случае конкретно для электрофореза:
- Онкологические новообразования (доброкачественные, злокачественные) *;
- Болезни крови или органов кроветворения (нарушения свертываемости крови, геморрагические состояния) *;
- Эпилепсия *;
- Инфекционные заболевания в остром периоде*;
- Лихорадочные состояния *;
- Инфекционные заболевания хронического течения в острой стадии (туберкулез, бруцеллез и пр.) *;
- Декомпенсированная форма заболеваний внутренних органом (сердца, легких и пр.) *;
- Гипертония III степени*;
- Металлические инородные тела внутри глаза.
Для процедур электрофореза в офтальмологии используются устройства типа «Поток-1», «Поток-2» или «Элфор», являющиеся генераторами непрерывного постоянного тока. Кроме того, применяются аппараты типа «Амплипульс» либо «Тонус-2», которые реализуют прерывистые постоянные или пульсирующие токи. Электродами в таких устройствах служат металлические (или другие проводящие ток) пластины, укомплектованные прокладками из ткани с гидрофильными свойствами. Размеры таких прокладок, превышают на 1,5 см размеры токопроводящих пластин, а их толщина составляет 1 см. Перед процедурой электрофореза, прокладки подвергаются стерилизации.
Сегодня существует несколько способов проведения лекарственного электрофореза, которые широко применяют в офтальмологии:
Электрофорез по Бургиньону. Такой способ введения растворов медикаментов эффективен при заболеваниях переднего отрезка глаза и век. В этом случае, прокладка одного электрода пропитывается определенным раствором ЛС и устанавливается на глаза с закрытыми веками. Место локализации второго электрода — задняя поверхность шеи.
Ванночковый электроферез. Применение этого способа оправдано при лечении воспалительных процессов переднего отрезка глаза и его дистрофий. Ведь он особенно эффективен в качестве воздействия на внутренние структуры глаза. В этом случае, растворы ЛС наливаются в специальную ванночку, куда и погружается электрод. Пациент во время процедуры наклоняет голову вперед и прикладывает ванночку к открытому глазу, с целью контакта поверхности глаза и раствора медикамента. Второй электрод, как и в первом случае, крепится к задней поверхности шеи.
Эндоназальный электрофорез. Способ применяется как наиболее эффективная доставка растворов лекарственных средств к структурам заднего отрезка глаза — сетчатой и сосудистой оболочкам при их воспалении или дегенерации. Он осуществляется с помощью электродов со специальными прокладками или ватными турундами, которые помещают в носовые ходы. Второй электрод крепится к задней поверхности шеи.
Локальный электрофорез. Этот способ целесообразен для диагностики и лечения патологий роговицы, а также для оценки оттока внутриглазной жидкости в случае глаукомы. Его проводят с использованием специального «точечного» электрода.
Лекарственные средства для введения с помощью электрофореза подбираются в соответствии с клинической картиной заболевания и его нозологической формой. Это могут быть: ферментные и сосудорасширяющие средства, нейро- и ангиопротекторы, мидриатики, миотики и др. Растворы лекарственных средств могут вводиться с анода либо катода, в зависимости от их полярности.
До введения ЛС посредством электрофореза, обязательно экспериментальным путем устанавливают устойчивость препаратов к электрическому полю и возможность образования токсичных метаболитов. Также определяют полярность растворов ЛС и рассчитывают их оптимальную концентрацию для введения. Поэтому, для электрофореза в офтальмологии применяют только медикаментозные средства из специального списка утвержденного в Минздраве РФ препаратов для физиотерапии, которые расположены там согласно их полярности с указанием оптимальной для введения концентрации.
Процедуры электрофореза всеми описанными методами продолжаются не более 10-20 минут, с использованием силы тока в 0,5-1,0 мА. Курс лечения, как правило, включает до 10-15 процедур, которые проводятся ежедневно либо через день.
источник
«СБОРНИК НАУЧНЫХ ТРУДОВ КОНФЕРЕНЦИИ ВЫПУСК № 7 Почетный спонсор Спонсоры Санкт-Петербург 2012 Научное издание Российская глаукомная школа Конференция Глаукома: теория и . »
У 43 больных выявлена сопутствующая патология, такая как ишемическая болезнь сердца, гипертоническая болезнь, сахарный диабет, атеросклероз, ревматизм, ревматоидный артрит, заболевания щитовидной железы, по поводу чего они получали терапевтическое лечение.
Результаты На 66 глазах был выявлен синдром «сухого глаза», что составило 77,3%.
На 44 глазах (67,6% случаев) синдром сухого глаза протекал в легкой форме. У этих пациентов определялось «нитчатое» отделяемое из конъюнктивальной полости, локальный отек бульбарной конъюнктивы, а так же «загрязнения» слезной пленки глыбками слизи и остатками частичек эпителия. Количество общей слезопродукции в среднем равнялось 2,4 мм, время разрыва слезной пленки — 8,1±1,2 с. Стаж заболевания у этих больных составлял в среднем 2-3 года.
На 16 глазах (24,6% случаев) был диагностирован синдром «сухого глаза» средней степени тяжести. Заболевание характеризовалось уменьшением у края век слезных менисков, появлением слизистых нитей в конъюнктивальной полости, наличием включений загрязняющих слезную пленку. В отдельных случаях определялись дегенеративные изменения роговичного эпителия. Общая слезопродукция у этих пациентов составила в среднем 2,3 мм, время разрыва слезной пленки – 5,1±1,5 с. Глаукома у этих пациентов протекала на протяжении 4-5 лет.
Только на 5 глазах (7,6% случаев) ССГ проявился в тяжелой форме. У этих больных выявлено отсутствие слезных менисков, отек бульбарной конъюнктивы с наползанием её на свободный край века, наличие эпителиальных нитей на роговице, потеря её блеска и появление субэпителиальных помутнений различной выраженности. Общая слезопродукция составляла у этих пациентов 8,5 мм, время разрыва слезной пленки — 2,3±1,3 с.
Эти пациенты были больны глаукомой более 5 лет.
Проведенная работа показала, что у больных с глаукомой, принимающих препараты для снижения внутриглазного давления, в 77,3% случаев имеет место развитие синдрома «сухого глаза»: легкая степень встречается в 67,6%, средняя — в 24,6%, тяжелая — в 7,6% случаев.
Развитие ССГ можно связывать с длительным применением гипотензивных препаратов, а также с сопутствующей патологией.
Для уменьшения симптомов сухого глаза необходимо рекомендовать слезозаменители или использовать препараты, которые не содержат консерванты (тафлотан).
МУЗ ГП №31, Клинический госпиталь ветеранов войн2, Исследовалась группа пациентов 73 глаза с клиническими проявлениями псевдоэксфолиативного синдрома (ПЭС) (58 глаз) и без таковых (15 глаз) в возрастной группе преимущественно 70-79 лет. Разница в показателях центральной толщины роговицы (ЦТР) в этих группах составила 11±0,4 мкм. При сравнении группы с клиническими проявлениями ПЭС при различных стадиях глаукомы отмечено значительное истончение ЦТР в глазах с и Y стадией ( на 9±0,4 мкм и 28±0,4 мкм соответственно). В парных глазах с и Y стадии глаукомы (4 глаза) разница в показателях ЦТР составила 15 мкм.
Ключевые слова: Псевдоэксфолиативный синдром, Центральная толщина роговицы.
Псевдоэксфолиативный синдром (ПЭС) — возраст-ассоциированный патологический процесс, представляющий собой стресс-индуцируемый эластозис, имеющий системный характер (5). Глазные проявления ПЭС многообразны и затрагивают все структуры глазного яблока. Поражение роговицы получило название псевдоэксфолиативной кератопатии. (4,6,7) Результаты больших мультицентровых исследований, таких, как Ocular Hypertension Treatment Study [OHTS] и Еuropean Glaucoma Prevention Study [EGPS], определили основные факторы риска развития и прогрессирования глаукомной оптиконейропатии (ГОН). Кроме того, OHTS впервые указывает ЦТР в качестве независимого и потенциального фактора риска.
Толщина роговицы влияет на показатели тонометрии, в наименьшей степени эта зависимость отмечена при тонометрии по Маклакову грузиком весом 10г.(2) По данным разных авторов, средний показатель ЦТР составляет 534 мкм (1), 558 мкм (3). В нашем исследовании за среднестатистическую норму примем ЦТР 530-550 мкм.
Изучить ЦТР в глазах с клиническими проявлениями ПЭС, сравнить полученные данные с группой пациентов без клинических проявлений ПЭС. Проанализировать данные, характерные для глаз с ПЭС при различных стадиях глаукомного процесса, в сравнении с глазами с неустановленной глаукомой.
Исследование проведено в группе из 37 пациентов (73 глаза), из них 58 глаз с клиническими проявлениями ПЭС, группа контроля составила 15 глаз без признаков ПЭС.
В группе пациентов с ПЭС исследовалась ЦТР при различных стадиях глаукомы, группа контроля составила 8 глаз с неустановленным диагнозом глаукомы.
Женщин было 24, мужчин – 13. Преобладали пациенты в возрасте 70-79 лет ( 62%)в.
Всем пациентам проводилось традиционное офтальмологическое обследование, включающее визометрию, тонометрию (по Маклакову, пневмотонометрию), Рис 1. Показатели ЦТР в глазах с клиническими проявлений ПЭС (р0,05). У пациенпроявлениями ПЭС и без таковых тов без клинических проявлений ПЭС переднего отрезка глаза ЦТР составила 536±0. мкм, у пациентов с клиническими проявлениями ПЭС разной степени выраженности – 525±0. мкм. Разница составила 11±0,4 мкм (рис. 1).
В глазах с клиническими проявлениями ПЭС получены следующие параметры ЦТР: у Рис 2. Разница показателей ЦТР в глазах с клиническими пропациентов с неустанов- явлениями ПЭС при различных стадиях глаукомы ленным диагнозом глаукома — группа контроля (8 глаз) ЦТР составила 530±0.7 мкм, с стадией глаукомы (21 глаз) — 530±0.1 мкм, с стадией (24 глаза) — 538±0.8 мкм, с стадией (12 глаз)- 521±0.3 мкм, с V стадией ( глаз) — 502 ±0.3мкм (рис 2).
При этом выявлено, что ЦТР тем меньше, чем более выражены клинические проявления ПЭС в глазах с продвинутыми стадиями глаукомного процесса. У лиц, с и стадией глаукомы ЦТР статистически неотличима от группы контроля и находится в пределах нормы. У лиц с и V стадией, ЦТР статистически ниже нормы и отличается от группы контроля на 9±0,4 мкм и 28±0,4 мкм соответственно.
Отмечено существенное различие в ЦТР у лиц, в парных глазах которых установлена и V стадии глаукомы (4 глаза) — 15 мкм. В глазах с односторонним ПЭС (12 пациентов) разница в показателях ЦТР составила 7 мкм.
1. ЦТР при ПЭС меньше в сравнении с глазами, без клинических проявлений ПЭС, что обуславливает необходимость измерения ЦТР в дополнение к стандартному обследованию таких пациентов.
2. ЦТР меньше в газах с и V стадией глаукомного процесса, осложненного ПЭС, в то время, как в и стадии находится в пределах нормы.
3. Требуется определение ЦТР в динамике для выяснения, возможно ли истончение роговицы с течением глаукомного процесса, осложненного ПЭС, или же изначально измененные параметры роговицы обуславливают гиподиагностику, затрудняют мониторинг.
Астахов Ю.С., Кирьянова В.В., Максимов А.В., Морозова Н.В., Диагностический центр № 7 (глазной) для взрослого и детского населения, В статье показана возможность лечения методом эндоназального электрофореза препарата «Ретиналамин» пациентов с первичной открытоугольной глаукомой 1-2 стадии. Доказано нейропротекторное действие препарата, как при субконъюнктивальном способе введения, так и физиотерапевтическим путем.
Ключевые слова: первичная открытоугольная глаукома, ретиналамин, эндоназальный электрофорез.
Среди современных научно обоснованных физических методов лечения глазных болезней ведущее место принадлежит электролечению — около 80% от всех физиотерапевтических процедур (Улащик В.С., 1976).
Под электролечением понимают применение с лечебной и профилактической целями различных видов электрического тока и электрических полей (Кирьянова В.В., 2005).
Техника и специфические особенности электролечебных методов, применяемых в офтальмологии, наиболее полно представлены в работах Л.Л. Шерешевской и Л.В. Черикчи (Черикчи Л.Е, 1979).
В последние годы в целях достижения максимального терапевтического эффекта стала применяться методика электрофореза с использованием смесей лекарственных веществ.
Основные лекарственные смеси для электрофореза и методики их приготовления предложены еще Л.Е. Черикчи (Черикчи Л.Е, 1979). При составлении смеси необходимо учитывать как природу (структуру, класс), так и фармакодинамическую оправданность одновременного введения в глаз составляющих смесей, в расчете на характер их действия и одинаковую полярность. Вводимые в организм при помощи постоянного тока лекарства значительно реже вызывают побочные реакции, чем применяемые перорально и парентерально, что служит достаточно обоснованной причиной разработки новых частных методик лекарственного электрофореза (Кирьянова В.В., 2005).
В офтальмологической практике применяют 5 методик: две ванночковые – электрофорез через закрытые веки (по Бургиньону) и электрофорез глаза непосредственно через ванночку; три рефлекторно-сегментарные – электрофорез области воротниковой зоны, области шейных узлов и эндоназальный электрофорез.
Первичная открытоугольная глаукома (ПОУГ) – одно из наиболее тяжелых глазных заболеваний, занимающее ведущее место среди причин слепоты и слабовидения (Douglas G.R., 1997). В России по официальным данным каждый пятый среди инвалидов по зрению ослеп в результате данного заболевания (Нестеров А.П., 2000).
Повышение ВГД, хотя и является основной причиной повреждения зрительного нерва, однако существование первичной глаукомы с нестабильным течением при нормализованном ВГД позволяет предположить, что в патогенез глаукомы могут быть вовлечены и другие повреждающие факторы. К таким факторам относят эксайтотоксическое повреждение третьего нейрона и активацию свободно-радикальных процессов в сетчатке и зрительном нерве (Федоров С.Н., Линник Л.Ф., Андропов Г.Н., 1989).
Снижение офтальмотонуса у больных глаукомой не всегда приводит к стабилизации зрительных функций (Douglas G.R., 1989). Таким образом, необходим поиск новых путей лечения первичной глаукомы.
При глаукомной оптиконейропатии (ГОН) существенное значение имеют механизмы повреждения и гибель нейронов, связанные с внутриглазным давлением и независимые от его воздействия (Anton A., 1998). Поэтому, с учетом имеющихся на сегодняшний день представленной о патогенезе гибели нейронов, предпринимаются попытки использования и создания лекарственных препаратов, воздействующих на различные звенья патогенеза ГОН с обобщающим названием «нейропротекторы».
Е.А. Егоров, Ю.С. Астахов, Т.В. Ставицкая (2004) отмечают, что ткани глаза, особенно те, которые отвечают за зрительные функции, хорошо изолированы от системного кровообращения множеством барьеров, которые обеспечивают высокую степень отбора для попадающих из крови растворимых веществ. Это, своего рода, защитный механизм. Но именно низкомолекулярные биологически активные нейропептиды обладают способностью преодолевать гематоэнцефалический барьер и непосредственно поступать к нейронам.
Ретиналамин® производится фармацевтической компанией «ГЕРОФАРМ» и относится к тканеспецифическим лекарственным средствам. Ретиналамин® — это комплекс низкомолекулярных полипептидов с молекулярной массой от 1000 до 10000 дальтон, достаточный для проникновения через гематоофтальмический барьер. Данный препарат, получаемый по уникальной отечественной технологии из сетчатки животных (телят), получил широкое применение в офтальмологии.
Механизм действия цитомединов полностью не изучен. Считают, что цитомедины, получаемые из тканей головного мозга и сетчатки, обладают функцией нейропептидов и участвуют в регуляции деятельности нервной ткани, поэтому могут быть использованы для лечения ГОН.
Представляется, что использование пептидных препаратов в офтальмологии имеет большие возможности в лечении ПОУГ, так как они обладают способностью индуцировать процессы специфической дифференцировки в популяции клеток, являющихся исходным материалом для их получения. Биологические эффекты адресного воздействия пептидов осуществляются через специфические рецепторы, расположенные на поверхности клетки. После экзогенного введения полипептидов развивается эффект пептидного каскада, в результате чего даже после полного выведения экзогенных полипептидов из организма их биологическое действие сохраняется (Хавинсон В.Х., Разумовский М.И., Балашов Н.В., 1990).
Методика применения Ретиналамина® разрабатывалась и обосновывалась сотрудниками кафедры офтальмологии ВМедА, Московским НИИГБ им. Гельмгольца, Санкт-Петербургским институтом биорегуляции и геронтологии. Многолетний опыт отечественной офтальмологии доказал успешность введения Ретиналамина® в дозе 5- мг парабульбарно, субконъюнктивально, в субтеноново пространство, эндолимфатическим путем и внутримышечно в течение 10 дней. Однако существует и неинвазивная методика введения лекарственных веществ для лечения глазных заболеваний – электрофорез (являющийся одним из методов физиотерапии).
Электрофорез лекарственных препаратов представляет собой метод сочетанного воздействия на организм постоянного электрического тока и лекарственного вещества, вводимого с природы обладают амфолитными свойствами, поэтому для по определению его изоэлектрической точки, оптимальной полярности и оптимального значения pH растворителя, при котором достигается наибольшая эффективность электрофореза (максимальное количество перемещенного вещества).
Изучали электрофоретическую подвижность, а в контрольных пробах диффузию препарата Ретиналамин в камерной установке для аналитическоРис. го электрофореза. Установлено, препарата Ретиналамин соответствует pH 7,4, оптимальная полярность активного электрода положительная, наибольшая эффективность электрофореза процедур электрофореза эндоназальной методикой осуществляется по силе тока, которая, ввиду высокой чувствительности слизистой оболочки носа к электрическому току, устанавливается в пределах диапазона «физиологической плотности» Рис. 0,03-0,1 мА/см2 площади поверхности эндоназальной турунды (Шерешевская Л.Я., 1976).
Методика эндоназального электрофореза Ретиналамина® и результаты ее применения.
Для приготовления раствора, используемого в методике эндоназального электрофореза, предварительно 5 мг сухого лиофилизированного порошка растворяли в 2,0 мл 0,9% раствора хлорида натрия (0,25% раствор ретиналамина), pH полученного лекарственного раствора доводили до 5,4-5,8, добавляя капельным путем 0,1 N НСl. Активный электрод положительной полярности (анод) – 2 марлевые турунды длиной до 10 см, смоченные в 0,25% растворе ретиналамина, вводили в средние носовые ходы. Второй электрод отрицательной полярности (катод) с прокладкой 8х12 см, смоченной физиологическим раствором, располагали на задней поверхности шеи в области 1-3 шейных позвонков. Сила тока дозироваРис. лась по индивидуальным ощущениям пациента в диапазоне 0,5-1 мА. Продолжительность процедуры составляла от 3 до 15 мин. Проводили ежедневно.
Курс продолжался в течение дней. Процедуру осуществляли аппаратом «Поток-1».
Для определения сравнительных результатов эффективности Ретиналамина®, введенного с помощью эндоназального электрофореза и путем субконъюнктивальных инъекций, было проведено рандомизированное слепое плацебо контролируемое исследование.
3 группа получала имитацию ФТЛ: без подключения электрического тока (30 глаз – 23 человек);
4 группа – ПОУГ1 получала препарат в виде субконъюнктивальных инъекций (30 глаз – 30 человек);
5 группа – ПОУГ2 получала препарат в виде субконъюнктивальных инъекций (30 глаз – 20 человек).
В процессе исследования всем больным проводились визометрия (проектор знаков Topcon-ACP 7 (Япония)), авторефрактометрия (рефрaктометр Tomey-RC (Япония)), стандартная автоматизированная периметрия (Периком, Oculus), биомикроофтальмоскопия, измерение ВГД тонометром Перкинса и Маклакова. Дополнительно использовались следующие объективные методы: лазерная конфокальная сканирующая томография ДЗН (HRT-2, Германия), вакуум-компрессионная проба с контролем зрительных вызванных корковых потенциалов с использованием «чашечки-присоски»
Указанные методики выполнялись во всех группах пациентов до начала лечения Ретиналамином®, через 3 и 6 месяцев от начала лечения, после чего пациенты получали повторный курс лечения. После окончания лечения исследования проводились повторно. Всего было проведено 1616 инструментальных исследований.
Результаты исследования представлены ниже на диаграммах.
По данным субъективных методик выявлено достоверное улучшение клинических показателей:
— повышение остроты зрения (рис.1);
— уменьшение количества абсолютных и относительных скотом (рис.2, рис 3).
Объективные методы исследования позвонили получить положительные достоверные данные об эффективности в четырёх группах пациентов (субконъюнктивальных инъекций и физиотерапевтического лечения Ретиналамином):
— параметры нейроретинального пояска стабильны. Толщина нейроретинальных волокон увеличивается, больше в группах, получавших ФТЛ (рис. 4);
— латентность волны р-100 уменьшается, больше в группах, получавших ФТЛ (рис. 5);
— амплитуда волны р-100 увеличивается, больше в группах, получавших ФТЛ (рис. 6);
— уменьшение изменений значений латентности и амплитуды волны Р-100 при вакуум — компрессии на фоне лечения Ретиналамином объективно доказывает его нейропротекторное действие, т.е. Ретиналамин увеличивает толерантность зрительного нерва к повышенному ВГД у пациентов с ПОУГ I и II стадии, больше в группе ФТЛ (рис.7).
1. Доказана эффективность лечения ПОУГ 1-2 стадии Ретиналамином® с помощью методики эндоназального электрофореза.
2. Клиническая эффективность Ретиналамина® при лечении ПОУГ 1-2 стадии достигнута как при введении препарата субконъюнктивально, так и 3. При физиотерапевтическом лечении был получен более выраженный клинический эффект.
4. В группе, получавшей имитацию ФТЛ, данные оставались стабильными, с 5. Данные объективных электрофизиологических исследований показывают, что лекарственный препарат Ретиналамин обладает нейропротекторным действием (увеличивает толерантность зрительного нерва к повышенной нагрузке) в начальной и развитой стадии глаукомы.
6. Анализ структурных изменений зрительного нерва (по данным НRT-II) выявил достоверное увеличение средней толщины ретинальных нервных волокон в группах пациентов применявших Ретиналамин в начальной и 7. После проведения курса лечения установлено достоверное повышение остроты зрения и уменьшение абсолютных скотом в начальной и развитой стадиях глаукомы, больше в группе получавшей Ретиналамин 8. Отмечены преимущества лечением эндоназального электрофореза: отсутствие болевых ощущений, отсутствие аллергических реакций на препарат, неинвазивность метода, комфортность лечения, отсутствие формирования рубцовых изменений конъюнктивы.
9. Анализ результатов наблюдений показывает:
— через 3 месяца от начала лечения клинический эффект сохраняется;
— через 6 месяцев от начала лечения клинический эффект уменьшается.
10. Повторное применение ретиналамина через 6 месяцев позволяют получить более выраженный клинический эффект, больше в группе, получавшей лечение физиотерапевтическим методом.
11. Рекомендовано повторять лечение 1 раз в 6 месяцев.
Афонина Е.А., Левко М.А., Корелина В.Е., Матерова Ю.В.
Первичная открытоугольная глаукома (ПОУГ) является одной из ведущих причин слепоты в развитых странах. Этиопатогенез сложен и до конца не изучен, поэтому чрезвычайно актуальными остаются вопросы совершенствования диагностики и лечения этого заболевания. Основываясь на изученных в настоящее время механизмах патогенеза ПОУГ, для достижения наилучших результатов в лечении, следует назначать патогенетически обоснованную терапию. Данный обзор будет посвящен патогенетическому аспекту лечения глаукомы.
Ключевые слова: первичная открытоугольная глаукома, патогенез, патогенетическое лечение.
До настоящего времени нет четкого и общепризнанного определения глаукомы. В последнее время все чаще приводится определение глаукомы, данное J. Flammer (2001):
«Глаукома – это прогрессирующая оптическая нейропатия, характеризующаяся экскавацией диска зрительного нерва и соответствующим ей снижением светочувствительности сетчатки».
Исходя из патогенеза ПОУГ, определены основные направления ее лечения:
1. снижение ВГД до толерантного уровня или до давления цели;
4. использование цито- и нейропротекторов;
5. лечение сопутствующих заболеваний.
Уровень ВГД может быть снижен медикаментозным, лазерным или хирургическим Для улучшения глазной гемодинамики в настоящее время применяются, прежде всего, вазодилататоры – препараты, усиливающие кровоток в ишемизированных тканях.
Традиционными в этом плане являются но-шпа, папаверин, эуфиллин. Для улучшения коллатерального кровообращения применяются препараты, улучшающие микроциркуляцию – никошпан, вазонит. Полезными с этих позиций являются антиагреганты, препятствующие склеиванию тромбоцитов и восстанавливающие деформируемость эритроцитов (аспирин, курантил, тиклид, трентал и др.). Для улучшения реологических свойств крови применяют гемокорректоры (реополиглюкин).
Важную роль в лечении сосудистых расстройств играют ангиопротекторы, которые оказывают влияние на проницаемость и эластичность сосудистой стенки (добесилат кальция, этамзилат натрия, продектин, рутозид, троксерутин и др.) (Курышева Н.И,, 2006).
Из средств, корректирующих гемодинамику глаза при вазоспастических реакциях, следует упомянуть антагонисты серотонина. В работе Achache F. (1999) было показано, что применение ингибиторов серотонина повышает кровоток в ДЗН и улучшает поля зрения при глаукоме, особенно нормотензивной.
Другими препаратами, показанными при вазоспазме, являются рамиприл – антагонист ренин-ангиотензиновой системы, и каптоприл – ингибитор ангиотензин-превращающего фермента. Эти препараты улучшают поля зрения больных глаукомой и снижают ВГД при пероральном приеме препарата (Rekik R., 2002). Так же доказано влияние на микроциркулляцию глаза применение препарата экстракта гингко билоба (Ritch R., 2003). Эффективность его связана с полиморфизмом эффектов: препарат повышает периферическую и ретробульбарную циркуляцию, улучшает поля зрения при нормотензивной глаукоме, является ловушкой для свободных радикалов, включая оксид азота, а также ингибирует его продукцию. Кроме того, препарат снижает вазоспазм церебральных сосудов, защищает фоторецепторы от повреждения светом и подавляет токсичность глутамата, защищая ГКС от апоптоза (Zhu I. et al., 1997).
Терапия, направленная на улучшение регенераторно-репатаривных процессов, и коррекцию метаболизма, подразумевает применение ноотропов. К таким препаратам относится пирацетам (обладает способностью улучшать метаболические процессы в нервной ткани, влияя на нейротрансмиссию и пластичность нейронов), винпотропил (обладает свойствами пирацетама и церебровазодилатирующего средства – винпоцетина), пикамилон (оказывает сильное и стойкое действие на кровоснабжение нервной ткани), цитиколин (природное эндогенное соединение с антиоксидантной активностью) (Курышева Н.И,, 2006).
Одним из важных направлений в лечении глаукомы является нейропротекторная терапия, которая подразумевает защиту сетчатки и волокон зрительного нерва от повреждающего действия различных факторов, в первую очередь от ишемии. Нейропротекция направлена на коррекцию метаболических нарушений, возникающих при глаукоме в головке зрительного нерва, улучшение местной микроциркуляции и трофики тканей, нормализацию реологических свойств крови (Егоров Е.А. и соавт., 2011), и показана только при условии нормализации офтальмотонуса.
В связи с нейропротекцией принято различать как прямое нейропротекторное действие того или иного лекарственного препарата, так и его опосредованное действие (Levin L., 1999). В свою очередь, прямые нейропротекторы подразделяются на первичные и вторичные.
Прямым нейропротекторным эффектом обладают так называемые первичные нейропротекторы, действие которых направлено на прерывание самых ранних процессов ишемического каскада, лежащего в основе быстрого поражения ГКС. К ним относятся:
1. Блокаторы NMDA-рецепторов – элипродил, мемантин, магнезия, глицин, ремацемид, лубелузол, флюпиртин (Курышева Н.И., 2006).
Одним из наиболее изученных и привлекших внимание исследователей в офтальмологии, является препарат мемантин. Мемантин представляет собой аналог амантадина, обладающего противовирусными свойствами. С начала 1970-х годов начал применяться при заболеваниях ЦНС (при деменции, спастическом синдроме и болезни Паркинсона). Впервые как нейропротектор при глаукоме был исследован в 1992 г., Н.
Chen. Клинические наблюдения по применению мемантина в лечении больных ПОУГ были предприняты Астаховым Ю.С. и соавт. (2004). Авторы наблюдали улучшение функциональных показателей и результатов исследования зрительных вызванных потенциалов на фоне трехнедельного применения препарата. В работе Y. Yucel (2005) было показано, что мемантин защищает не только ГКС, но и нейроны в наружных коленчатых телах, которые также вовлечены в процесс ГОН в результате эксайтотоксического повреждения.
Элипродил относится к селективным блокаторам NMDA-рецепторов, эффективность которого при ишемическом повреждении ГКС была показана в исследовании M.
Kapin (1999). Однако клинические испытания больных ПОУГ не проводились.
Из блокирующих NMDA-рецепторы препаратов следует упомянуть магнезию и глицин. Эти препараты положительно зарекомендовали себя в лечении ишемических поражений головного мозга.
Однако данная терапия при глаукоме до сих пор практически не применяется ввиду наличия ряда проблем, связанных с большим количеством побочных эффектов, доступностью препаратов к сетчатке глаза, оптимальных сроках введения и дозах, эффективных при ПОУГ.
2. Антагонисты потенциал-зависимых кальциевых рецепторов (блокаторы кальциевых каналов). По сравнению с препаратами, блокирующими NMDA-рецепторы, блокаторы кальциевых каналов гораздо подробнее исследованы как в эксперименте, так и в клинике (Harris A., 1997). К препаратам этой группы относятся стугерон, циннаризин, циннисан, нифедипин, нимотоп-С, нимодипин и др.
Вторичные нейропротекторы так же обладают прямым нейропротекторным действием, однако, их действие направленно на прерывание отсроченных механизмов гибели нейронов. К препаратам этой группы относятся антиоксиданты, антиапоптотические агенты, блокаторы NO-синтазы, нейротрофические факторы, нейропептиды, пептидные биорегулянты, ганглиозиды, каннабиноиды.
1. Антиоксиданты могут быть ферментной и неферментной природы.
Ферментные антиоксиданты являются природными компонентами антиоксидантной защиты организма. К ним относятся: каталаза, глутатион-редуктаза, супероксиддисмутаза (СОД).
СОД (препарат Эрисод)– это фермент, который катализирует захват супероксидного анион-радикала. В работах Е.Б. Мартыновой (1995) было показано, что Эрисод благодаря выраженному антиоксидантному действию тормозит развитие процессов деградации трабекулярной ткани и волокон зрительного нерва.
К неферментным антиоксидантам относятся: коэнзим Q, витамины А, Е, С, К; биофлавоноиды группы витамина Р, бета-каротин, кварцетин, гистохром, эмоксипин, мексидол, некоторые микроэлементы, входящие в состав СОД – цинк, медь.
Гистохром – производное хинонов, обладает наряду с антигеморрагическим действием так же антигипоксическим и антиоксидантным свойствами. Кроме того гистохром может так же непосредственно перехватывать свободные радикалы и улучшать энергетический обмен в тканях при ишемии (Полунин Г.С., 2000).
Наиболее распространенным антиоксидантом, применяемым в офтальмологии, является эмоксипин. Многочисленные наблюдения показали, что эмоксипин обладает целым комплексом свойств, способствующих защите сетчатки и зрительного нерва от гипоксии: ингибирование СРО, нормализация энергетических процессов, стабилизация мембран эритроцитов, ингибирование агрегации тромбоцитов.
Отечественным антиоксидантом нового поколения является мексидол. Препарат относится к группе фенольных соединений, которые являются синергистами аскорбиновой кислоты и образуют буферную окислительно-восстановительную систему (Егоров А.Е. и соавт., 2002). Биологические эффекты мексидола многообразны: он оказывает положительное влияние на процессы энергообразования в клетке, активируют клеточный синтез белка и нуклеиновых кислот. Активизируя ферментативные процессы цикла Кребса, препарат способствует утилизации глюкозы и увеличению образования АТФ. Улучшает кровоток в зоне ишемии, ограничивает зону ишемического поражения и стимулирует репаративный процесс. Стабилизирует мембраны клеток крови и способствует улучшению реологических свойств крови (Воронина Т.А. и соавт., 2001).
Такие антиоксиданты как коэнзим Q, витамины А, Е, С, К, биофлавоноиды группы витамина Р, бета-каротин, широко используются как отдельно, так и в комплексах препаратов с витаминами и микроэлементами. Доказано, что такие препараты улучшают микроциркуляцию в сетчатке, а так же тканевой метаболизм, способствуя регенерации поврежденных тканей.
2. Препараты, ингибирующие апоптоз.
Установление контроля над процессами апоптоза является одной из важнейших стратегических задач нейропротекции. Проблема медикаментозного подавления апоптоза связана с тем, что сам по себе апоптоз является в физиологическом смысле очень значимым механизмом. При нарушении баланса проапоптотических и антиапоптотических факторов происходят срывы, приводящие к развитию тяжелых раковых и дегенеративных заболеваний. Предотвращая апоптоз ГКС, мы рискуем вызвать раковые заболевания. Это можно проиллюстрировать обсуждаемым в литературе назначением антиапоптотического агента bcl2, который одновременно является канцерогеном.
3. Применение ингибиторов NO-синтазы.
Высвобождение оксида азота и образование пероксинитрита может быть ингибировано блокатором синтазы оксида азота (NOS). Применение селективных блокаторов нейрональной NOS – 7-нитроиндазола и имидазола – подтвердило эффективность данного лечения в клинике ишемических поражений мозга. Относительная селективная блокада индуцибельной NOS аминогуанидинами так же оказывает мощное нейропротекторное действие. Данные препараты предложены в качестве нейропротекторов в лечении ГОН A. Neufeld в 2004 году. В некоторых исследованиях было показано, что применение ингибиторов NOS значительно снижает хориоидальный кровоток, а достаточная концентрация NOS, напротив, улучшает микроциркуляцию в сосудах глаза и к тому же снижает ВГД. Таким образом, встает вопрос о сроках назначения препаратов, корригирующих продукцию оксида азота, и их адекватных доз (Курышева Н.И., 2006).
4. Применение нейротрофических факторов.
Нейротрофические факторы играют важную роль в защите ГКС и их аксонов. Среди них выделяют несколько классов: нейротрофины, в образовании которых участвует фактор роста нерва (NGF) (Carmignoto G., 1989), цилиарный нейротрофический фактор (CNTF), фактор, выделенный из мозга (BDNF), нейротрофины 3 и 4, фибробластный фактор роста FGF (Sievers J., 1987), представленный 18 классами, трансформирующий фактор роста (TGF), нейротрофический и глиальный нейротрофический фактор (GDNF).
Использование нейротрофических факторов для предупреждения гибели нейронов представляет собой более нейрорегенеративную, нежели нейропротекторную терапию.
Наиболее важным нейротрофическим фактором является BDNF (Ma Y., 1998). Механизм их действия до конца не изучен, но предполагается, что они стимулируют продукцию эндогенных антиоксидантов.
Впервые защитное действие BDNF на ГКС было продемонстрировано в эксперименте по перерезке зрительного нерва более десяти лет назад (Unoki K., 1994). Позднее эти результаты были подтверждены другими исследователями, и работы в данном направлении активно продолжаются. (Martin K. et al., 2004).
5. Применение нейропептидов в лечении глаукомы.
Нейропептиды играют особо важную роль в функционировании нервной ткани.
Работают они лишь «в нужном месте» и «в нужное время» и затем быстро исчезают.
Действие нейропептидов различно. Так, церебролизин, представляющий собой белковую вытяжку из головного мозга молодых свиней, регулирует энергетический метаболизм мозга, имеет собственное нейротрофическое влияние и модулирует активные эндогенные факторы роста. Препарат положительно зарекомендовал себя в лечении ишемических поражений головного мозга, однако в литературе отсутствуют данные о применении его в лечении ГОН (Курышева Н.И., 2006).
Особого внимания заслуживает синтетический аналог адренокортикотропного гормона (АКТГ) – семакс, разработанный под руководством акад. И.П. Ашмарина учеными ИМГ РАН и МГУ в 1997 г., и успешно примененный в офтальмологии для лечения оптических невритов различной этиологии, а также некоторых форм атрофии зрительного нерва (Полунин Г.С. и соавт., 2000). В 1999 г. Курышевой Н.И.
были предприняты исследования семакса в качестве нейропротектора в лечении ГОН. Двухлетние наблюдения за больными показали высокую эффективность этого препарат. Наблюдалась стабилизация и улучшение клинико-функциональных показателей, улучшение реологических свойств крови, повышение линейной скорости кровотока в глазничной артерии и повышение реологического коэффициента (Курышева Н.И. и др., 2001).
6. Пептидные биорегулянты в лечении глаукомы.
С возрастом происходит снижение синтеза и секреции регуляторных пептидов, а также ослабление чувствительности к ним клеток-мишеней (Kaskow J.W. et al., 1999).
Нарушение пептидной регуляции снижает резистентность клеток и тканей организма к дестабилизирующим факторам как внешней, так и внутренней среды. Это может служить одной из причин развития ряда заболеваний, инволюции органов и тканей, а также ускоренного старения (Ашмарин И.П. и соавт., 1986).
В результате пептидной регуляции в клетках понижается скорость развития патологических изменений (повреждение ДНК, мутации, злокачественная трансформация и т.д.) и повышается активность репаративных процессов, направленных на восстановление клеточного гомеостаза (Анисимов С.В. и соавт., 2002; Бродский В.Я. и соавт., 2001; Морозов В.Г. и соавт., 1985; Хавинсон В.Х., 2002).
Ведущим ПБ в офтальмологии, разрешенным к медицинскому применению Минздравом РФ, является ретиналамин и кортексин.
7. Применение ганглиозидов.
Ганглиозиды представляют собой важную составляющую клеточных мембран нейронов и глиальных клеток, особенно в синаптических участках, являясь одним из основных компонентов нейрональных рецепторов. Ганглиозиды обладают способностью к сильному взаимодействию с ионами кальция у пресинаптической мембраны, обеспечивая функциональную активность нервной клетки. Препараты этой группы детально изучаются в неврологии. Некоторые из них (кронассиал, состоящий из ганглиозидов групп, в наибольшем количестве содержащихся в ткани мозга) оказались эффективными в лечении ишемических повреждений мозга. Однако в лечении ПОУГ применение данных препаратов пока не изучено (Курышева Н.И,, 2006).
8. Применение каннабиноидов.
Каннабиноиды – вещества, очень близкие по структуре к простагландинам.
Эндогенные каннабиноиды обнаружены в сетчатке животных. Не так давно было показано, что каннабиноиды способны снижать ВГД, и обладают нейропротекторными свойствами, защищая нейроны от токсического действия глутамата (Remessy A. et al., 2003). Однако применение каннабиноидов ограничивается их побочными действиями на лёгкие и психику.
Лечение сопутствующей патологии (сахарный диабет, гипотиреоз, сердечнососудистые заболевания) является важной задачей, так как она оказывает неблагоприятное влияние на течение глаукомного процесса (Нестеров А.П., 2007).
Бабушкин А.Э., Оренбуркина О.И., Матюхина Е.Н.
Актуальность проблемы Несмотря на очевидные успехи достигнутые в лечении глаукомы, она остается одной из главных причин снижения зрения и необратимой слепоты, причем удельный вес первичной открытоугольной глаукомы (ПОУГ) самая весомая – около 80%. Увеличение числа пожилых людей, появление новых высокоинформативных методов диагностики глаукомы, а также, на наш взгляд, социально-экономические потрясения в Российской Федерации (РФ) в 90-х годах XX века, несомненно, оказали влияние на рост распространенности и заболеваемости, а также утяжеление течения этой болезни превратившейся, по сути, в главное инвалидизирующее заболевание глаз у взрослых [1-7].
Цель – изучение распространенности, заболеваемости и первичной инвалидности вследствие глаукомы в Республике Башкортостан (РБ) за 2010 год.
Материал и методы Материалом исследования явились данные годового республиканского отчета Уфимского НИИ глазных болезней и Главного бюро медико-социальной экспертизы РБ.
Результаты и обсуждение По данным республиканского годового отчета за 2010 год на диспансерном учете с диагнозом глаукома в Республике Башкортостан состоит 24536 человек, из них хирургическое лечение осуществлено 27,9% больным.
С первичной глаукомой на учете состоит 92,3% человек. Мужчин – 43,9%, женщин — 56,1%. Возраст больных: старше 60 лет – 76,8 %, 35-60 лет – 22,5% и лица моложе 35 лет – 0,7%. С I-II стадиями глаукомы зафиксировано 65,6% пациентов, с III-IV – 34,4%.
Доля первичной открытоугольной глаукомы (ПОУГ) составила 81,8%, закрытоугольной — 12,3%, смешанной — 5,9%.
Слепых на оба глаза среди диспансерных больных глаукомой — 1327 человек, на один глаз – 2919, т.е. в целом, 17,3% от общего числа пациентов состоящих на учете.
С целью раннего выявления глаукомы в 2010 году обследовано 590866 человек (86,0% от подлежащих осмотру). С подозрением на глаукому выявлено 6304 человек (1,1%), впервые установленным диагнозом — 2939 (0,5%). При этом, I стадия болезни была диагностирована в 37,3%, II – 43,0%, III – 13,2% и IV в 6,5% случаев. Удельный вес ПОУГ составил 82,6%, закрытоугольной – 11,9%, смешанной – 5,5%.
Распространенность ПОУГ в РБ в 2010 г. составила в среднем 114,6 случаев на населения старше 40 лет, при разбросе данного показателя от 23,3 до 210,4.
Заболеваемость ПОУГ в РБ в 2010 г. составила 12,9 на 10 тыс. населения старше лет при вариабельности от 0,8 до 50,4.
Инвалидность по всей офтальмопатологии в РБ составила 2,6. В нозологической структуре первичной инвалидности (ПИ) в 2010 году глаукома занимает II ранговое место (36,2%) после заболеваний сетчатки и зрительного нерва (37,9%). На III и IV местах находятся дегенеративная миопия и травмы глаз. Следует отметить, что, начиная с года по 2009 год, глаукома в РБ занимала стабильно I ранговое место (соответственно 20,5% и 35%) в структуре ПИ среди различной офтальмопатологии (табл.).
Установлено, что значительная часть инвалидов с глаукомой в РБ в 2010 году имеют первичную открытоугольную форму заболевания (80,9%), в большинстве случаев — начальное (30,7%) либо средне-специальное (57,9%) образование — 88,6%, являются пенсионерами (83,9%); преимущественно это женщины (59,3%), имеющие I или II группу инвалидности (52,1%, причем среди них мужчин 42,5%, женщин — 57,5%). Доля ПИ, проживающих в городах, составила 67,3%, в районах РБ – 32,7%.
Таблица. Нозологическая структура первичных инвалидов по зрению в 2009 — 2010 гг.
и зрительного нерва последствия 1. По данным за 2010 год в Республике Башкортостан на диспансерном учете по поводу глаукомы состоит всего 24 536 человек, при этом большинство больных имеют начальную и развитую стадии заболевания (65,6%). Хирургическим лечением охвачено 27,9% больных. Число слепых глаукомой (на один и оба глаза) составляет 17,3%, от общего числа пациентов состоящих на учете. С подозрением на глаукому было выявлено 1,1%, с впервые установленным диагнозом – 0,5% (19,7% — в продвинутых стадиях заболевания).
2. Распространенность ПОУГ в РБ за 2010 год составила 114,6, заболеваемость на 10 тыс. населения у лиц старше 40 лет. Анализ первичной инвалидности показал, что глаукома занимает II ранговое место – 36,2% в нозологической структуре различной офтальмопатологии, уступая I место заболеваниям сетчатки и зрительного нерва (37,9%). При этом, у подавляющего большинства пациентов (более 80,9%) причиной инвалидности явилась первичная открытоугольная форма заболевания. Большинство ПИ с ПОУГ проживают в городах (67,3%) имеют начальное или средне-специальное образование (88,6%) и при освидетельствовании впервые были признаны инвалидами I или II групп (52,1%).
СПб филиал МНТК «Микрохирургия глаза им. акад. С.Н. Фёдорова», Представлены результаты пилотного исследования субсклерального удаления наружной стенки шлеммова канала в микрофистулизирующем варианте при ОУ глаукоме.
Предлагаемая технология — технически проста, безопасна и эффективна, плавно снижает ВГД и минимизирует повреждение тканей в зоне фильтрации.
Ключевые слова: глаукома, хирургическое лечение.
Актуальность Несмотря на постоянное совершенствование методов диагностики и лечения, глаукома продолжает оставаться одним из наиболее тяжелых глазных заболеваний, нередко приводящих к слабовидению, слепоте и инвалидности по зрению. Постоянно ведётся поиск новых методов хирургии, как наиболее радикального метода лечения данной патологии.
Ещё в 1962 г. М.М.Красновым была разработана операция наружного вскрытия венозного синуса склеры («экстернализации» шлеммова канала) – синусотомия (Краснов М.М., 1980). В 1986 году И.Я.Барановым было предложено субсклеральное удаление стенки шлеммова канала в сочетании с последующей лазерной трабекулопунктурой (Баранов И.Я., 1989). Эта операция поэтапно воздействует на различные уровни ретенции оттока внутриглазной жидкости (интрасклеральный, трабекулярный и блок шлеммова канала). Данная операция выполнялась без вскрытия глазного яблока, что уменьшает проблему послеоперационных осложнений таких как формирование кистозной фильтрационной подушки, развития синдрома мелкой передней камеры, прогрессирование катаракты и др. В тоже время операция обеспечивала хороший гипотензивный эффект у большинства больных (89,2%). В 1989 году похожая операция была предложена акад.
С.Н.Федоровым и В.И.Козловым, которая получила название непроникающая глубокая склерэктомия (НГСЭ) (Федоров С.Н. и др., 1989). Эти вмешательства определили развитие нового современного направления — неперфорирующих методов хирургического лечения первичной открытоугольной глаукомы (ПОУГ).
В ходе многолетних исследований шел поиск оптимальной гипотензивной операции, при которой минимальный объем вмешательства обеспечивал бы хороший гипотензивный эффект, с уменьшением процента операционных и послеоперационных осложнений. Появились так называемые микроинвазивные операции, среди которых следует упомянуть микроинвазивную НГСЭ (Тахчиди Х.П. и др., 2003). Однако данная методика имеет свои недостатки, в связи с чем, нами предложена новая методика — субсклеральное удаление наружной стенки шлеммова канала с последующей лазерной трабеклопунктурой в микрофистулизирующем варианте.
Разработать технику новой эффективной методики гипотензивного хирургического лечения глаукомы.
За основу предлагаемой нами методики оперативного вмешательства с гипотензивной целью при ПОУГ взята операция, предложенная И.Я.Барановым (Баранов И.Я., 1989). Микрофистулизирующая операция субсклерального удаления стенки синуса (СУСС) включает в себя субсклеральное иссечение наружной стенки шлеммова канала на первом этапе и лазерную гониопунктуру в зоне операции на втором этапе. В ходе первого этапа рассекают конъюнктиву в 6 мм от лимба и отсепаровывают ее до лимба.
Далее выкраивают поверхностный склеральный лоскут размером 2х2 мм основанием к лимбу, наружную стенку шлеммова канала иссекают по предложенному нами зонду (Баранов И.Я., 2010) с последующим удалением его наружной стенки в зоне операции.
Склеральный лоскут подшивается к склере одним узловым швом (шовным материалом темного цвета, например, нейлоном) и узелок продергивается через поверхностный склеральный лоскут с таким расчетом, чтобы узелок оказался между склеральными поверхностями и в дальнейшем отчетливо был виден гониоскопически.
Второй этап — лазерную гониопунктуру, выполняют точно в зоне хирургического вмешательства, которая легко определяется по просвечиваемому через трабекулу шовному материалу. Оптимальные сроки выполнения лазерной операции 7-14 день после хирургического вмешательства, что объясняется сроками заживления конъюнктивальных и склеральных тканей.
В ходе исследования проанализировано 23 случая СУСС у пациентов с ПОУ глаукомой. Распределение глаз в зависимости от стадии глаукомы выглядит так: I стадия глаукомы – 26,1%, II стадия глаукомы – 21,7%, III. стадия глаукомы – 52,2%. Средний возраст больных составил 68±7,4 лет. Глаукома нередко сочеталась с другими заболеваниями, такими как катаракта, близорукость, гиперметропия, диабетическая ретинопатия и др.
Все больные проходили комплексное офтальмологическое обследование, включавшее в себя измерение остроты зрения по таблицам Сивцева-Головина, поля зрения на проекционном периметре, внутриглазного давления тонометром Маклакова, биомикроскопию переднего отрезка глаза и глазного дна, гониоскопию, а также переднюю оптическую когерентную томографию (ОКТ) зоны операции. Визометрия, биомикроскопия, гониоскопия и тонометрия выполнялись до операции и при каждой последующей явке.
Поле зрения определяли перед операцией, при выписке и через 12 месяцев после хирургии.
Через год после операции проводили ОКТ фильтрационной полости с замером ее объема.
Корригированная острота зрения до операции равнялась 0,6 ± 0,31. Суммарные значения поля зрения, измеренные на проекционном периметре в 8 меридианах, составили 406± градусов. В среднем значения внутриглазного давления равнялись 30,5 ± 6,3 мм.рт.ст.
В 30% случаев пациенты инстиллировали один гипотензивный препарат, в 70% 2 и более гипотоников. У 8,7% пациентов уже была выполнена лазерная трабекулопластика лазерная иридэктомия (ЛИЭ). У 13% такие как глубокая склерэктомия, непроникающая глубокая склерэктомия и синустрабекулэктомия. параметрических методов статии стики (тест согласованных групп Вилкоксона, U тест Манна-Уитни).
При корреляционном анализе вы- Рис. Изменение ВГД в различные сроки наблюдения числялся коэффициент Спирмена. после операции Все результаты описательной стаТаблица 1. Среднее снижение ВГД в различные сротистики представлены в виде M±, ки после операции дартное отклонение.
чалось статистически достоверное ния в различные сроки наблюдения представлено на рисунке. Среднее ражено в таблице 1.
Рассматривая изменение внутриглазного давления необходимо Таблица 2. Назначение гипотензивных препаратов учитывать тот факт, что снижение после операции торами, такими как эффект самой назначение гипотоников. Процент в таблице 2.
операции выполнялись лазерные вмешательства, такие как трабекулопунктура (ЛТПу), ЛИЭ, иридопластика и рассечение гониосинехий. При вставлении корня радужки в сформированную фистулу, выполняли ЛИЭ и лазерную иридопластику. Если в зоне операции в поздние сроки формировались гониосинехии лазерное вмешательство дополнялось лазерным рассечением спаек.
Количество сделанных лазерных операций представлено в таблице 3.
Таблица 3. Лазерные вмешательства после операции После ЛТПу происходило статистически значимое снижение ВГД с 26,1±2,75 mmHg до 17,8±5,39 mmHg (р 0,01), в среднем на 8,3±4,51 mmHg. После лазерной трабекулопунктуры в 8 глазах (40%) наблюдалось развитие цилиохориоидальной отслойки (ЦХО), что объясняется значительным снижением ВГД. Двум пациентам была выполнена ЗТС.
В двух случаях после ЛТПу отмечена блокада зоны трабекулопунткутуры корнем радужки, что потребовало выполнения лазерного рассечения гониосинехий, ЛИЭ и лазерной иридопаластики. У некоторых пациентов возникала необходимость проведения повторных лазерных операций — лазерная трабекулопунктура была выполнена в 6 (13%) случаях. В среднем после второй лазерной операции ВГД изменялось на 5,4±7,33 mm Hg.
Статистический анализ данных периметрии не выявил достоверных изменений поля зрения после проведенных операций.
В 2 случаях (8,7%), несмотря на хирургические и лазерные вмешательства, требовалось проведения дополнительных мер, таких как активация фильтрационной подушки, вследствие ее фиброза, что было произведено на 14 день после операции.
У части пациентов отмечалось развитие послеоперационных осложнений. В 39% (9 глаз) случаев отмечалось формирование ЦХО, но только одна из них появилась непосредственно после операции, остальные развились после лазерной трабекулопунктуры.
Кроме того после СУСС наблюдалось формирование фасетки (1 глаз), развитие вирусного кератита (1 глаз) и позднего увеита (1 глаз).
В ходе проведения передней оптической когерентной томографии было обнаружено, что через 6-12 месяцев после СУСС средний объем фильтрационной полости составил 1,84±1,2 мм3.
Корреляционный анализ выявил прямую зависимость между степенью снижения ВГД и объемом зоны фильтрации (коэффициент Спирмена равен 0,59, p 0,05). Это подтверждает, что чем больше полость фильтрации, тем ниже внутриглазное давление.
1. Предлагаемая технология микрофистулизирующей операции субсклерального удаления наружной стенки шлеммова канала является технически 2. Благодаря особенностям техники СУСС даёт возможность плавного снижения ВГД, что положительно влияет на состояние зрительного нерва у 3. Возможность своевременного проведения лазерного вмешательства вторым этапом с хорошей визуализацией зоны хирургического вмешательства (благодаря тёмному просвечиваемому через трабекулу шовному материалу) позволяет осуществить лазерную гониопунктуру максимально точно, что повышает эффективность операции.
4. Микрофистулизирующая методика даёт возможность минимизировать повреждение тканей в зоне фильтрации, благодаря чему уменьшается объем рубцевания и сохраняется более стойкий гипотензивный эффект после
Актуальность Проблема первичной открытоугольной глаукомы (ПОУГ) является одним из приоритетных направлений в офтальмологии. Меры для снижения слепоты от данного заболевания хорошо известны: раннее выявление больных, пожизненная диспансеризация с регулярными осмотрами и полноценным их обследованием, комплексное (местное и общее) лечение, обязательно включающее нейропротекторные препараты, своевременное применение современных хирургических и лазерных методов лечения в случае нестабилизации глаукомного процесса. При этом скорость прогрессирования глаукомного процесса во многом зависит от уровня, до которого снижено внутриглазное давление (ВГД) [1-3,5].
Цель — изучение эффективности диспансеризации больных ПОУГ.
Материалы и методы Произведен ретроспективный анализ амбулаторных карт 300 больных (598 глаз) ПОУГ, состоящих на диспансерном учете в разных поликлиниках г. Уфы. Женщин было 188 (62,7%), мужчин – 112 (37,3%). На момент постановки на диспансерный учет возраст пациентов составлял: до 35 лет — 1 человек (0,3%), от 35 до 50 лет — 18 человек (6,0%), 51 – 60 лет — 60 человек (20,0%), старше 60 лет — 221 человек (73,7%). Начальная стадия ПОУГ была выявлена в 39,5% (236 глаз), развитая – в 41,1% (246 глаз), далеко зашедшая – в 16,6% (99 глаз) и терминальная стадия — в 2,8% (17 глаз) случаев.
Длительность диспансерного наблюдения варьировала от 2 лет до 21 года (в среднем — 7,3 лет). При этом, с длительностью диспансерного наблюдения 2-4 года (в среднем — 2,9 года) было 119 человек (237 глаз), не менее 5 и не более 9 лет (в среднем — 6, лет) — 117 человек (233 глаза) и 10 и более лет (в среднем — 12,4 лет) — 64 человека (128 глаз).
Фиксировались стадия ПОУГ и данные ВГД по Маклакову и кинетической периметрии (по сумме градусов по 8 меридианам), измеренные во время взятия пациентов на диспансерный учет и последнего визита в текущем календарном году.
Рис. Прогрессирование ПОУГ взависимости от стартовой терапии пришлось назнасроков диспансерного наблюдения на момент последнего осмотра увеличилась до 24,9%, причем существенно (в 2 раза) только в группе пациентов, находившимися под диспансерным наблюдением 5-9 лет.
Монотерапия -блокаторами в динамике диспансерного наблюдения имела место примерно в 90,0% случаев, причем чаще (в среднем в 58,1%) назначались селективные бета-блокаторы, доля которых со временем увеличилась с 56,5% до 59,7%. Значительно реже в качестве монотерапии назначались простагландины – в среднем в 6,5% (в динамике диспансерного наблюдения увеличение в 2,7 раза — с 3,5% до 9,5%), холиномиметики — в 1,8% (уменьшение в 4 раза – с 2,8% до 0,7%), и очень редко ингибиторы карбоангидразы – 0,7% (увеличение в 2,3 раза — с 0,4% до 0,9%). Назначение альфа и бета-блокаторов в 2,4% было отмечено только на момент взятия больных на диспансерный учет.
Значительно чаще (в среднем в 85,4% случаев) применялись нефиксированные комбинации препаратов (на момент постановки больных на учет в 90,2%, на момент последнего обследования – в 80,6%), чем фиксированные — в среднем в 14,6% (увеличение в раза — соответственно в 9,8% и 19,4%).
Чаще всего имело место сочетание бета-блокаторов с аналогами простагландинов – в среднем в 65,2% (увеличение с 59,8% до 70,5%). Если в начале диспансерного наблюдения на втором месте находилась комбинация бета-блокаторов с холиномиметиками — 32,6% (в динамике уменьшение до 1,5%, т.е. в 22 раза!), то на момент последнего обследования – бета-блокаторов с ингибиторами карбоангидразы – в 10,8% (увеличение с 8,7%) и в пределах 1,5% — 2,2% в динамике — самые различные другие комбинации.
Сопоставление достигнутого уровня ВГД (по Маклакову) на фоне местного медикаментозного лечения стадиям ПОУГ (I-III) на момент постановки больных на диспансерный учет и последнего их обследования в поликлинике показало следующее. На момент постановки пациентов на диспансерный учет, достигнутое в результате гипотензивной терапии ВГД, в 61,1% случаев оказалось выше верхней границы желаемого офтальмотонуса [4], несмотря на то, что находилось в пределах среднестатистической нормы, а на момент последнего обследования – в 52,7%. Таким образом, более чем у половины больных (в среднем в 57,0%) не был достигнут желаемый и безопасный уровень ВГД.
Анализ также показал, что 19,7% больных не всегда регулярно использовали назначенные гипотензивные капли. За весь же период диспансерного наблюдения к оперативному лечению пришлось прибегнуть в 13,7% случаев, причем чаще в далекозашедшей (47,6%) и терминальной (12,2%). В ходе исследования было также установлено, что медикаментозная поддерживающая терапия регулярно (1-2 раза в год) проводилась только в 14,7% случаев, а назначенное офтальмологом целенаправленное нейропротекторное лечение проводилось в последние три года лишь в 1,3% случаев. Таким образом, общее медикаментозное лечение выполнялось лишь у 16,0% больных.
Проведенное исследование показало недостаточную эффективность системы диспансерного наблюдения и поликлинического этапа лечения ПОУГ, так как в 65,6% случаев у больных со стажем заболевания 10 и более лет при регулярном ежегодном обследовании больных выявлено прогрессирование заболевания. Возможными причинами этого могут являться: отсутствие достижения желаемого (целевого) давления (в 57,0%), значительное преобладание консервативного гипотензивного лечения (в 86,3%), с преимущественным использованием (примерно в 90,0% случаев) бета-блокаторов, над микрохирургическим (в 13,7%), позднее направление пациентов на оперативное лечение (почти в 60,0% случаев операции проводились в III-IV стадиях), явно недостаточное проведение курсов общей медикаментозной поддерживающей терапии (в 16,0%), направленной на коррекцию метаболических нарушений, улучшение гемодинамики, нейропротекцию.
Врожденная глаукома, угол передней камеры, внутриглазное давление, оперативное лечение, синусотрабекулэктомия, компенсация, стабилизация.
В работе проводилась оценка эффективности хирургического лечения больных врожденной глаукомой. Были исследованы 22 истории болезней детей, прооперированных в УЗ 4 ГДКБ г. Минска в период с 2008 по 2011 гг. Изучались показатели тонометрии, гониоскопии, кератометрии, биомикроскопии, офтальмоскопии, В-сканирования до и после оперативного лечения. Проводилась оценка глаукомы среди обследуемых детей по стадиям глаукомного процесса. Для изучения отдаленных результатов было обследовано десять детей. У подавляющего числа больных была произведена синусотрабекулэктомия (СТЭ), позволившая получить стойкую компенсацию внутриглазного давления (ВГД) и стабилизацию зрительных функций глаукомного процесса.
Основная часть По данным различных авторов, врожденная глаукома встречается с частотой 1 на 10000 новорожденных. Несмотря на достаточно редкую патологию, врожденная глаукома чаще, чем другие глазные болезни, приводит к ранней слепоте и инвалидизации детей первых лет жизни. В связи с этим основой профилактики слепоты от врожденной глаукомы является ее ранняя диагностика и своевременное хирургическое лечение.
Существует такая статистика, что если врожденную глаукому прооперировать вовремя, то зрение сохранится в 75% случаев, а если не прооперировать, то в 75% случаев наступает слепота.
Целью исследования явилась оценка результатов хирургического лечения больных с врожденной глаукомой на основе изучения этиопатогенеза данного заболевания.
Этиология врожденной глаукомы изучена не до конца. Считается, что воздействующие на беременную женщину тератогенные факторы в период закладки и формирования органа зрения, а точнее иридокорнеального угла (15-16 неделя беременности) могут привести к неправильным закладке и развитию угла передней камеры глаза.
источник