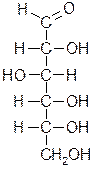На свойствах аминокислот основаны методы их разделения из смеси. С практической точки зрения разделение аминокислот является необходимой процедурой в выяснении аминокислотного состава белков и пептидов. Наиболее популярными являются хроматографические методы.
Сам термин «хроматография» (греч. сhroma — цвет, graphein — писать) был введен в 1903г. русским ботаником Михаилом Цветом. Ему удалось разделить смесь пигментов листьев растений, используя твердые сорбенты. Современные методы разделения многих соединений базируются на хроматографии. При этом смесь веществ, подлежащих разделению, растворяется в жидкости или газовой среде, составляя «мобильную фазу». Она фильтруется через колонку, заполненную поросодержащим твердым матриксом, получившим название «стационарная фаза». Последний в некоторых типах хроматографии может быть ассоциирован с жидкостью.
Взаимодействие со стационарной фазой каждого из растворенных веществ приводит к задержке его прохождения через матрикс. Сила этой задержки зависит от свойств растворенного вещества. Поэтому если смесь, подлежащая фракционированию, начинает двигаться через колонку, на каждое из находящихся в ней соединений будут действовать задерживающие силы разной интенсивности. В результате такого воздействия постепенно смесь разделится на зоны, содержащие чистые вещества. Разделенные компоненты можно собрать в отдельные фракции для анализа или последующего фракционирования.
В зависимости от мобильной и стационарной фаз различают газожидкостную хроматографию (мобильная фаза — газ, стационарная — жидкость), жидкостно-жидкостную хроматографию (мобильная и стационарная фазы — несмешивающиеся жидкости, одна из которых связана с инертной твердой подложкой). Дальнейшая классификация хроматографических методов основана на природе преобладающего взаимодействия между стационарной фазой и разделяемыми веществами. К примеру, если сила, замедляющая продвижение вещества в твердой фазе, ионная по характеру, хроматография называется ионообменной; если же она является результатом адсорбции растворенных веществ на твердой стационарной фазе — хроматография будет адсорбционной.
Ионообменная хроматография.В процессе ионного обмена ионы, которые электростатически связаны с нерастворимым и химически инертным матриксом, обратимо замещаются ионами из раствора:
где R + A — — анионообменник, а В — — анионы из раствора. Соответственно катионообменник представляет отрицательно заряженные группы, которые обратимо связывают катионы.
Аминокислоты относятся к полиэлектролитам, поскольку они имеют положительный и отрицательный заряд. За счет этого они могут присоединяться к анионо- и катионообменникам в зависимости от суммарного электрического заряда. Принцип разделения аминокислот ионообменной хроматографией представлен на рис. 1.4.
Рис.1.4. Принцип разделения аминокислот ионообменной хроматографией
Различные аминокислоты взаимодействуют и связываются с ионообменниками с различной силой. Колонку промывают, постоянно добавляя жидкость (обычно, буферный раствор) на поверхность сорбента; соответственно, пройдя через твердую фазу, она вытекает из колонки. Этот процесс получил название «элюция». При этом те аминокислоты, у которых низкая связывающая способность к данному ионообменнику, будут продвигаться через колонку быстрее аминокислот с более высокой связывающей способностью (рис.1.5).
Рис.1.5. Сбор аминокислот, разделенных ионообменной хроматографией
Аминокислоты, которые более сильно связаны с ионообменником, можно вымыть, заменив элюирующий буфер на буфер с другим рН или с более высокой концентрацией соли. Такой процесс называется «этапной элюцией» (рис.1.6).
Рис. 1.6. Принцип этапной элюции при проведении ионообменной хроматографии
Весь этот процесс сейчас полностью автоматизирован так, что отдельные его стадии — элюирование, сбор фракций, их анализ и запись данных анализа — осуществляются по заданной программе в специальном приборе — аминокислотном анализаторе.
Прибор был предложен в 1958г. американскими учеными С. Муром и У. Стейном. Принцип его работы заключается в разделении смеси аминокислот ионообменной хроматографией на колонке, заполненной сульфированной полистирольной смолой. Колонка промывается буферными растворами с последовательным повышением их рН и концентрации. Время удержания каждой аминокислоты строго определенно и зависит от степени её ионизации. Выходящий из колонки элюат смешивается с раствором нингидрина и в специальной ячейке нагревается до 100 0 С. Аминокислоты, реагируя с нингидрином, превращаются в аммиак, СО2 и альдегид. Освобождающийся аммиак взаимодействует с другой молекулой нингидрина и дает окрашенное в фиолетовый цвет производное. Интенсивность окраски получающихся в результате реакции продуктов пропорциональна содержанию аминокислот в смеси. Она измеряется с помощью спектрофотометра, показания которого регистрируются самописцем.
Высокоэффективная жидкостная хроматография. В последние годы для разделения аминокислот используют метод высокоэффективной жидкостной хроматографии. С этой целью аминокислоты предварительно дансилируют (взаимодействием с дансилхлоридом). Разделение дансилпроизводных аминокислот проводится на силикагеле с ковалентно присоединенными углеводородами с помощью специального жидкостного хроматографа. В его состав входят особым образом упакованные колонки, насос, позволяющий создавать давление до 200 атм, градиентный смеситель, работающий с высокой степенью воспроизводимости и высокочувствительный флюоресцентный детектор. К достоинствам метода следует отнести исключительно высокую скорость разделения (менее 1 ч), воспроизводимость результатов и возможность проводить аналитические опыты на микрограммовых количествах вещества.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 10527 — 

источник
В процессе проведения биохимического анализа при клинико-лабораторных исследованиях часто возникает необходимость предварительного выделения анализируемых веществ, отделения их от других компонентов, находящихся в исследуемом биологическом материале. Для этих целей чаще всего используются такие физико-химические методы, как электрофорез и хроматография.
Электрофорез. Под электрофорезом понимают процесс разделения заряженных частиц в электрическом поле. Многие биологически важные молекулы (белки, аминокислоты, нуклеиновые кислоты и др.) имеют в своем составе ионизирующие группы. Поэтому в биологических жидкостях (крови, лимфе и др.) они существуют в виде катионов и анионов. Помимо этого молекулы имеющие примерно одинаковый заряд могут отличаться молекулярными массами и отношением заряда к массе. На этих различиях и основано разделение ионов при движении их в растворе под действием электрического поля.
Скорость перемещения зависит от величины заряда, а также в ряде случаев, от размера и формы молекул. Так как в большинстве случаев молекулы отличаются по своим физическим и химическим свойствам то очень немногие из них имеют одинаковую электрофоретическую подвижность. Скорость движения частиц (см/с) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью.
В зависимости от способа проведения электрофореза его делят на свободный или фронтальный, когда электрофоретическое разделение осуществляется в водной фазе и зональный, т.е. электрофорез на поддерживающей среде, когда разделение осуществляется на каком-либо инертном носителе (бумага, асбестовые пластины, целлюлоза, агаровый, крахмальный и полиакриламидный гели и др.).
Суть зонального электрофореза заключается в том, что раствор смеси веществ подлежащих разделению вводят на определенный участок носителя, пропитанного электролитом. Биологический материал, подлежащий электрофоретическому разделению, растворяют или суспензируют в буфере, чтобы обеспечить проведение электрического тока, этим же буфером насыщают и носитель. В растворе между электродами ток обусловлен ионами буфера и образца, в остальной части цепи — электронами. После снятия электрического поля ионы исследуемой смеси распределятся в соответствии с их электрофоретической подвижностью.
В клинико-лабораторных исследованиях чаще используется зональный электрофорез на агаре или полиакриламидном геле. При наложении электрического поля частицы подлежащей разделению смеси придут в состояние направленного движения (будут двигаться к противоположно заряженному полюсу) и распределятся на носителе в виде отчетливых зон, которые легко обнаружить соответствующим аналитическим методом.
Важными характеристиками процесса зонального электрофореза являются градиент потенциала (В/см) и сила тока, приходящаяся на 1 см поперечного сечения полосы (плотность тока — мА/см).
Под градиентом потенциала понимают падение напряжения на 1 см носителя расположенного между электродами. В зависимости от градиента потенциала различают низковольтный электрофорез (5-15 В/см) и высоковольтный (более 50 В/см). Низковольтный электрофорез используется для разделения высокомолекулярных соединений типа белков, липопротеинов, гликопротеинов и др. Высоковольтный электрофорез используется для разделения низкомолекулярных веществ, типа аминокислот, их производных и др. Так как различие в заряде и молекулярной массе у таких веществ невелико, то нужен большой градиент потенциала, чтобы произошло эффективное разделение частиц. Так как при этом происходит значительное разогревание носителя, требуются специальные устройства для его охлаждения.
В зависимости от целей исследования электрофорез делят на аналитический и препаративный. В клинико-биохимических исследованиях используют обычно аналитический электрофорез, который позволяет работать с очень небольшими количествами исследуемого вещества и вести их количественное определение. В тех случаях, когда требуется получить большое количество изучаемого вещества, необходимого для дальнейших исследований используют препаративный вариант электрофореза.
В настоящее время для анализа биологических смесей все шире используется капиллярный электрофорез, при котором электрофоретическое разделение проводится в тонких капиллярах диаметром 25-200 мкм и длинной 10-100 см, заполненных буферным раствором. Под действием электрического поля (электрофорез проводится при напряжении 10000-30000 В) в капилляре создается электроосмотический поток, направленный к отрицательному полюсу, вместе с которым перемешаются и компоненты подлежащие разделению. В зависимости от заряда и массы скорость их движения будет различной, что приводит к фракционированию смеси. В концевой точке капилляра разделенные компоненты количественно определяют, используя различные оптические детекторы Близким к электрофорезу является метод изоэлектрического фокусирования, когда разделение белков и некоторых других анализируемых веществ идет в зависимости от величины их изоэлектрических точек.
Изоэлектрической точкой называют такое состояние белковой молекулы, при котором ее суммарный заряд равен нулю. В методе изоэлектрического фокусирования вначале между электродами устанавливают градиент рН с помощью веществ особой химической природы, получивших название амфолитов-носителей. Заряженные молекулы белков в ходе опыта будут двигаться в направлении противоположно заряженного электрода в соответствии с их действительным зарядом. Так как молекулы белков амфотерны, то при перемещении в градиенте рН их суммарный заряд будет меняться до тех пор, пока он не станет равным 0. Это произойдет в том месте, где величина рН будет равна изоэлектрической точке. Поэтому молекулы с одинаковой изоэлектрической точкой сконцентрируются в одной узкой зоне.
Хроматография. Это метод разделения и анализа многокомпонентных систем, основанный на использовании явлений сорбции и десорбции в динамических условиях. В процессе хроматографии происходит многократное повторение актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента. Вещество подвижной фазы непрерывно вступает в контакт с новым участком сорбента и частью сорбируется, а сорбированное вещество контактирует со свежими порциями подвижной фазы и частично десорбируется.
Методы хроматографического анализа различаются: по агрегатному состоянию системы, в которой проводится разделение на газовую и жидкостную: по механизму разделения — на адсорбционную, распределительную, ионообменную, гель-хроматографию, аффинную и др. В ряде случаев разделение оказывается результатом нескольких одновременно протекающих процессов с различными механизмами. Это приводит к образованию хроматограммы смешанного типа, но один из процессов всегда является доминирующим (рис. 9 и 10, см. стр. 20-21).
В газовой хроматографии подвижной фазой является газ. В зависимости от состояния неподвижной фазы газовая хроматография подразделяется на газо-адсорбционную, когда неподвижной фазой является твердый адсорбент и газо-жидкостную, когда неподвижной фазой является жидкость, или точнее пленка жидкости на поверхности частиц твердого адсорбента.
Жидкостная хроматография основана на адсорбции твердым веществом, играющим роль неподвижной фазы, определяемых компонентов, находящихся в растворенном состоянии.
В основе адсорбционной хроматографии лежит различная сорбируемость разделяемых веществ на твердом сорбенте в соответствии с их сродством к адсорбенту. При этом сорбируемость растворителя должна быть незначительной по сравнению с таковой анализируемой смеси. Процесс адсорбции зависит от свойства адсорбента, адсорбируемых соединений, растворителя. В зависимости от этих свойств вещества, подлежащие хроматографическому разделению, образуют адсорбционный ряд выражающий относительное адсорбционное сродство его членов к адсорбенту. Образующееся в колонке адсорбента зональное распределение веществ соответствует их положению в адсорбционном ряду. В качестве адсорбентов в адсорбционно-жидкостной хроматографии применяются органические и неорганические вещества: сахароза, крахмал, оксид алюминия, силикагель, активированный уголь и др.
Ионообменная хроматография основана на способности некоторых твердых веществ (ионитов) обмениваться ионами с подлежащими разделению веществами. Применяемые в ионообменной хроматографии иониты могут быть как органическими, так и неорганическими. Способность к ионному обмену определяется строением ионита, представляющего собой каркас, на котором закреплены активные группы (-СООН, -SO3H, — NH3Cl, -NH2Cl и др.). В зависимости от обмена катионов или анионов иониты делят на катиониты, аниониты и амфолиты. На принципах ионообменной хроматографии основано разделение аминокислот в аминокислотных анализаторах.
Распределительная хроматография основана на распределении компонентов разделяемой смеси между несмешивающимися фазами. Образующая неподвижную фазу жидкость находится на поверхности или в порах твердого носителя, на который наносится смесь веществ, подлежащих разделению. Затем создают ток подвижного растворителя. Чем лучше вещество растворимо в жидкости, играющей роль подвижной фазы, тем дальше оно продвинется по направлению тока растворителя. Вещества, плохо растворимые в подвижной фазе, расположатся ближе к точке нанесения. В зависимости от техники выполнения распределительная хроматография выполняется как колоночная, бумажная или тонкослойная. Методика распределительной хроматографии в колонках аналогична адсорбционной или ионообменной: вначале в колонку с носителем и закрепленным на нем неподвижной фазой вводят небольшой объем раствора смеси компонентов и затем промывают колонку подвижным растворителем.
При бумажной хроматографии разделение проводят на полосах бумаги, где роль неподвижной фазы играет вода, удерживаемая гидрофильными целлюлозными волокнами бумаги, а подвижной фазой является какой-либо органический растворитель. В каждый момент имеет место определенное перераспределение разделяемых компонентов между слоем органического растворителя и водой. В результате одни вещества движутся быстрее вслед за фронтом органического растворителя, другие в той или иной степени отстают, а некоторые вообще остаются на стартовой линии.
При тонкослойном варианте разделение идет в тонком слое носителя. Чаще всего для этих целей используются пластинки из силикагеля (например, Silufol) широко используемые для фракционирования липидов, аминокислот и других биосубстратов.
Гель-хроматография основана на различии в размерах и молекулярных массах белков и других макромолекул, являющихся важнейшей характеристикой молекулы. В качестве материала-носителя в гель- хроматографии используется сшитый декстран (сефадекс), сшитый полиакриламид (биогель Р) и агароза. Они получили широкое распространение как в аналитической, так и в препаративной лабораторной работе, а также в производстве, в химической и биологической промышленности.
Колонка с сефадексом действует по принципу «молекулярного сита». Молекулы большие, чем самые крупные поры разбухшего сефадекса не могут проникать в гранулы и сравнительно быстро проходят в жидкой фазе вне частиц геля, поэтому элюируются первыми. В настоящее время имеется большое число сефадексов, позволяющих разделить белки и полипептиды в диапазоне молекулярных масс от 700 до 800000 Да.
Были разработаны также хроматографические материалы для разделения белков, путем связывания некоторых ионообменных групп с сефадексами. Полученные производные-ДЭАЭ-сефадекс, КМ-сефадекс и другие широко используются при хроматографии.
Аффинная хроматография или (биоспецифическая по сродству хроматография), основана на принципе специфического взаимодействия с особыми веществами (лигандами), закрепленными на носителе. Биологические макромолекулы обладают способностью обратимо связывать многие вещества. Например, ферменты образуют комплексы с субстратами, антитела взаимодействуют с антигенами, мРНК с комплементарной ДНК и т. д. Все эти взаимодействия строго специфичны. Образование специфических комплексов биологических макромолекул, способных в определенных условиях к диссоциации лежит в основе метода разделения получившего название аффинной хроматографии. Если закрепить один из компонентов этого комплекса на матрице, иммобилизовать его, то получится специфический сорбент для второго компонента (аффинат). Нерастворимые аффинаты готовят обычно путем ковалентного присоединения лиганда к нерастворимому носителю. Если смесь белков пропустить через колонку, заполненную таким аффинатом, то все молекулы, которые не обладают сродством к лиганду, закрепленному на носителе пройдут не задерживаясь, а белок имеющий сродство к аффинному лиганду будет адсорбироваться на колонке. Вымыть адсорбированный белок с колонки можно буферными смесями с измененной величиной рН, ионной силой, а также введением в состав элюента веществ, ослабляющих связи между белками и лигандами.
Одними из первых биоспецифических сорбентов, были антигены ковалентно связанные с нерастворимым носителем. Они были использованы для получения моноспецифических антител. Затем аналогичным путем были получены иммобилизованные ферменты. Стало возможным создание ферментных реакторов для получения различных веществ с использованием иммобилизованных ферментов.
источник
Методы разделения белков и аминокислот
Хроматографический метод определения аминокислот
ХРОМАТОГРАФИЯ — метод разделения, анализа и физико-химического исследования веществ. Хроматография обычно основана на распределении исследуемого вещества между двумя фазами — неподвижной и подвижной (элюент).
Неподвижная (стационарная) фаза – представляет собой сорбент с развитой поверхностью, а подвижная (мобильная) фаза — поток газа (пара, флюида — вещество в сверхкритичном состоянии) или жидкости. Поток подвижной фазы фильтруется через слой сорбента или перемещается вдоль слоя сорбента.
Хроматография — процесс разделения веществ, находящихся в смеси или растворе, на составляющие компоненты в системе двух фаз, одна из которых неподвижна, а другая перемещается относительно первой. Перемещение способствует миграции веществ, при этом неподвижная фаза не изменяется, а каждый компонент движется независимо от других с собственной скоростью.
Хроматографические методы применяют для сорбционно-динамического разделения смеси аминокислот, белков, углеводов, липидов и их метаболитов.
В зависимости от природы адсорбента и механизма разделения веществ хроматографию подразделяют на несколько видов:
1. Адсорбционная – основана на различной способности отдельных компонентов смеси (в силу их различной полярности) адсорбироваться на поверхности твёрдой фазы сорбента. Этот метод предложен М. С. Цветом в 1903 году. В качестве сорбентов используются активированный древесный уголь, окись алюминия или кремния.
2. Распределительная – основана на различной растворимости разделяемых веществ в двух малосмешивающихся жидкостях; в отличие от адсорбционной, твердая фаза служит опорой (основой) для стационарной (неподвижной) фазы. Разновидностью распределительной хроматографии является хроматография на бумаге, широко используемая в биохимических и клинических лабораториях для разделения белков, пептидов, аминокислот и других веществ.
3. Ионообменная – основана на различной способности разделяемых веществ к обмену их ионов на ионы неподвижной фазы сорбента. В качестве неподвижной фазы сорбента применяются ионообменные смолы – полимерные органические соединения, содержащие функциональные группы, способные вовлекаться в ионный обмен. Различают анионообменники, представленные органическими основаниями и аминами, и катионообменники, содержащие фенольные, сульфо- или карбоксильные группы. В зависимости от заряда разделяемых белков используют подходящую ионообменную смолу, с функциональными группами которой обменивается часть белков и задерживается на колонке, в то время как другие белки беспрепятственно выносятся из колонки. «Осажденные» на колонке белки снимают с колонки применением более концентрированных солевых растворов или изменением рН элюента.
4. Осадочная – основана на образовании труднорастворимых осадков в определённой последовательности.
5. Диффузионная – основана на разделении веществ по скорости диффузии внутрь сорбента в зависимости от размера молекул. К данному типу относится гель-фильтрация — разделение веществ, основанное на механическом явлении молекулярных сит (просеивания). Этот метод широко используется при очистке белков от примесей и для фракционирования белков плазмы.
6. Аффинная (хроматография сродства) – основана на принципе избирательного взаимодействия белков (или других макромолекул) со специфическими веществами – лигандами, закрепленными на носителе. Благодаря высокой специфичности сродства белков к определенному лиганду, связанному с носителем (которым заполняют хроматографическую колонку) присоединяется только один какой-нибудь белок из смеси. Затем этот белок снимают с колонки элюированием буферными смесями с измененным рН или иной ионной силой, а также введением в состав элюента детергентов, ослабляющих связи между белками и лигандами. Достоинством этого метода является то, что с его помощью удается выделить одноэтапно заданный белок или другой биополимер высокой степени чистоты. При помощи аффинной хроматографии, например, определяют гликозилированный гемоглобин, являющийся наиболее достоверным показателем гликемии.
По технике выполнения хроматографические методы исследования подразделяют на колоночную и плоскостную (на бумаге или в тонком слое).
В зависимости от агрегатного состояния фаз хроматографию подразделяют на газовую, жидкостную, газожидкостную.
По направлению движения растворителя (подвижной фазы) хроматографию подразделяют на восходящую, нисходящую, одномерную, двухмерную и радиальную.
источник
При всех хроматографических методах разделения молекулы распределяются между стационарной и подвижной фазами (табл. 3.6). Разделение зависит от относительной способности содержащихся в смеси молекул к более прочной ассоциации с одной или другой фазой.
Здесь мы рассмотрим в основном методы разделения аминокислот, однако применение этих методов ни в коей мере не ограничивается данными молекулами.
Сейчас этот метод в значительной мере вытеснен более совершенными методами, однако он все же применяется для разделения аминокислот. Образцы наносят на бумагу в заранее отмеченную точку, отступив примерно 5 см от верхнего края полоски фильтровальной бумаги. Затем полоску подвешивают в закрытом сосуде, на дно которого налита смесь растворителей (рис. 3.9).
Для разделения аминокислот используют полярные растворители в виде бинарных, тройных и более сложных смесей воды, спиртов, кислот и оснований. Более полярные компоненты растворителя ассоциируются с целлюлозой и образуют стационарную
Таблица 3.6. Физическое состояние фаз в хроматографических системах, используемых в биохимии
Рис. 3.9. Устройство для хроматографии на бумаге (в нисходящем варианте).
фазу, а менее полярные составляют подвижную фазу. Это — нормальная распределительная хроматография. В распределительной хроматографии с обращенной фазой полярная и неполярная фазы меняются местами (для этого, например, бумагу предварительно погружают в раствор силикона). Распределительная хроматография с обращенной фазой используется для разделения неполярных пептидов или липидов; для таких полярных соединений, как аминокислоты, она непригодна. Растворитель перемещается по бумаге вверх или вниз (восходящая или нисходящая хроматография). Когда он доходит почти до конца, полоску вынимают из сосуда, высушивают и обрабатывают определенным образом, чтобы на ней проявились интересующие исследователя соединения (при разделении аминокислот используют обработку 0,5%-ным нингидрином в ацетоне с последующим прогреванием в течение нескольких минут при . Аминокислоты с объемными неполярными боковыми цепями , перемещаются быстрее, чем аминокислоты с более короткими неполярными боковыми цепями или с полярными боковыми цепями . Это обусловлено большей растворимостью полярных молекул в гидрофильной стационарной фазе и неполярных — в органических растворителях. Отметим, что в ряду неполярных аминокислот при увеличении длины неполярной боковой цепи, сопровождающемся усилением ее неполярного характера, увеличивается и подвижность аминокислоты.
Отношение расстояния, на которое перемещается данная аминокислота, к расстоянию, пройденному фронтом растворителя (оба они отсчитываются от точки нанесения смеси аминокислот), обозначают через (подвижность по отношению к фронту растворителя). Значение для данной аминокислоты зависит от условий эксперимента, например от типа растворителя. Хотя предварительную идентификацию аминокислоты можно провести исходя лишь из ее значения R, рекомендуется одновременно с неизвестной смесью проводить хроматографирование известной стандартной смеси аминокислот.
Рис. 3.10. Идентификация аминокислот, входящих в состав белков. После хроматографического разделения на бумаге с использованием в качестве растворителя системы бутанол/уксусная кислота (нисходящий вариант) аминокислоты окрашивают нингидрином.
В этом случае подвижность исследуемой аминокислоты можно отнести к подвижности стандарта (например, не Подвижности, выраженные относительно стандарта, меняются от эксперимента к эксперименту в меньшей степени, чем
Для количественного анализа аминокислот каждое пятно вырезают и элюируют (вымывают) вещество подходящим растворителем; затем проводят количественный колориметрический (нингидриновый) анализ. В другом варианте бумагу опрыскивают нингидрином и измеряют с помощью фотометра интенсивность окрашивания пятна в проходящем или отраженном свете.
При двумерной хроматографии на бумаге образец наносят на один из углов квадратного листа бумаги и проводят разделение в одной системе растворителей. Затем лист вынимают, высушивают, поворачивают его на 90° и хроматографируют в другом растворителе (рис. 3.11).
Имеются два четко различающихся варианта тонкослойной хроматографии. Распределительная тонкослойная хроматография (РТСХ) сходна с
Рис. 3.11. Двумерная хроматограмма аминокислот, входящих в состав белка (воспроизведена с некоторыми модификациями из работы Anal. Chem. 1953:25:396).
распределительной хроматографией на бумаге, а адсорбционная тонкослойная хроматография (АТСХ) основана на совершенно иных принципах.
При проведении РТСХ на порошке целлюлозы или на других сравнительно инертных носителях можно использовать такие же системы растворителей и такие же проявляющие реагенты, как и при хроматографии на бумаге. Возможна и РТСХ с обращенной фазой.
Разделение с помощью АТСХ определяется способностью растворителя (этот растворитель не обязательно является бинарной или более сложной смесью) элюировать компоненты образца с места его адсорбции на активированном сорбенте, например на нагретом силикагеле. АТСХ применима для разделения таких неполярных соединений, как липиды, но не для разделения аминокислот и большинства пептидов.
Разделение аминокислот можно проводить разными методами, но для анализа аминокислотного состава полипептида после его гидролиза обычно используют автоматическую ионообменную хроматографию. Полное разделение аминокислот, их идентификация и количественная оценка занимают менее трех часов. В методе Мура и Штейна используют короткую и длинную колонки, заполненные смолой из сульфонированного полистирола в -форме. Когда кислотный гидролизат при наносят на колонку, аминокислоты связываются в результате катионного обмена с Далее колонку элюируют раствором цитрата натрия при заранее запрограммированных значениях и температуры. Короткую колонку элюируют одним буфером, длинную — двумя. Элюат обрабатывают нингидрином, измеряя интенсивность окраски с помощью проточного колориметра. Данные автоматически регистрируются на ленте самописца и могут передаваться в компьютер для вычисления площади под пиком (рис. 3.12).
Рис. 3.12. Автоматический анализ кислотного гидролизата эндосперма пшеницы по Муру и Штейну на колонках . Л. Для идентификации оснбвных аминокислот используется короткая колонка (5 х 0,9 см); элюирование проводят при pH = 5,28, продолжительность опыта 60 мин. Б. Для разделения нейтральных и кислых аминокислот используется более длинная колонка (55 у 0,9 см); элюирование проводят сначала буфером с pH = 3,25, а затем буфером с pH = 4,25. В качестве внутреннего стандарта добавлен норлейцин. Оснбвные аминокислоты остаются на колонке. Продолжительность опыта 180 мин. Элюируемые фракции автоматически обрабатывают нингидрином, после чего измеряют их оптическую плотность при 570 и 440 нм. Регистрация при длине волны 440 нм используется исключительно для идентификации пролина и гидроксипролина (в эндосперме пшеницы они отсутствуют). (С любезного разрешения Е. Т. Mertz, Purdue University.)
В биохимии широкое применение нашло разделение аминокислот, полипептидов и других амфолитов (молекул, суммарный заряд которых зависит от среды) под действием наложенного постоянного электрического поля. При разделении аминокислот в качестве инертных носителей чаще всего используют полоски бумаги или тонкие слои целлюлозного порошка. Разделение проводят в течение 0,5—2 ч при напряжении 2000—5000 В в зависимости от суммарных зарядов амфолитов и их молекулярных масс. Среди молекул, несущих одинаковый заряд, более легкие мигрируют быстрее. Но более важным параметром при разделении является суммарный заряд. Метод применяется для разделения аминокислот, низкомолекулярных пептидов, некоторых белков, нуклеотидов и сахарофосфатов. Образец помещают на носитель, смачивают буфером при соответствующем и соединяют с буферным резервуаром полоской фильтровальной бумаги. Бумагу прикрывают стеклянной пластинкой или погружают в углеводородный растворитель для охлаждения. В электрическом поле молекулы, несущие при данном pH отрицательный заряд, мигрируют к аноду, а те, которые несут положительный заряд,—к катоду. Далее высушенную электрофореграмму «проявляют» нингидрином (при работе с аминокислотами, пептидами) или измеряют поглощение в Уф-свете (при работе с нуклеотидами).
Выбор определяется значениями диссоциирующих групп, входящих в состав молекул смеси. При глутамат и аспартат несут заряд — 1 и движутся к аноду; разделение их осуществляется благодаря различию в молекулярной массе. Лизин, аргинин и гистидин движутся в противоположном направлении, а все другие аминокислоты, входящие в состав белка, остаются вблизи места нанесения. При разделении пептидов, образовавшихся в результате ферментативного расщепления, уменьшение pH до 3,5 приводит к увеличению заряда катионных групп и обеспечивает лучшее разделение.
Barrett G. С. Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985.
Cooper T.G. The Tools of Biochemistry, Wiley, 1977. Friedman M. The Chemistry and Biochemisrty of the Sulfhydryl Group in Amino Acids, Peptides, and Proteins, Pergamon Press, 1973.
Greenstein J.P., Winitz M. Chemictry of the Amino Acids, 3 vols, Wiley, 1961.
Heftman E. Chromatography: A Laboratory Handbook of Chromatographic and Electrophoretic Methods, 3rd ed., Van Nostrand, 1975.
Touchstone J. C. Practice of Thin Layer Chromatography, Wi-ley-Interscience, 1978.
Zweig G., Sherma J. Handbook of Chromatography, 2 vols, CRC Press, 1972.
источник
Хроматография является эффективным методом для решения одной из важнейших задач биохимии – разделения и идентификации химических соединений (белков, аминокислот, жирных кислот, моно- и дисахаридов и др.). Метод предложен в 1903 г. профессором Воронежского университета М.С. Цветом для разделения растительных пигментов.
В настоящее время известно большое число различных видов хроматографии (распределительная, адсорбционная, ионообменная, на молекулярных ситах) и различных приемов их применения (на бумаге, колоночная, тонкослойная, газовая). Современные разновидности хроматографии, различающиеся по технике выполнения позволяют быстро разделить отдельные компоненты из небольшого количества сложной смеси.
Принцип распределительной хроматографии состоит в том, что вещества помещают в систему, которая содержит два физически различных компонента- подвижную и неподвижную фазы. Неподвижную (стационарную) фазу называют сорбентом. Если сорбентом служит жидкость, удерживаемая каким-либо твердым телом, то это тело называют носителем или матрицей. Подвижную фазу называют растворителем или проявителем; компоненты разделяемой смеси – растворенными веществами. В варианте распределительной хроматографии на бумаге носителем служит целлюлоза в виде листов хроматографической бумаги. Неподвижной фазой служат пары воды, насыщающие лист этой бумаги при данных условиях. В качестве подвижной фазы применяют насыщенный водой органический растворитель, который, двигаясь по бумаге, растворяет и увлекает за собой нанесенный образец.
Распределительная хроматография основана на том, что растворенное вещество распределяется между подвижной и неподвижной фазами. Этот процесс называется распределением и количественно описывается коэффициентом распределения, представляющим собой отношение концентраций растворенного вещества в каждой из двух фаз. Рассчитывают этот коэффициент по следующей формуле:

где, mп – масса подвижной фазы;
mн – масса неподвижной фазы;
Rf – коэффициент подвижности (скорости перемещения зоны компонента).
По мере движения растворителя происходит множество микроскопических актов распределения каждого из исследуемых компонентов между подвижной и неподвижной фазами, в результате чего вещества с разными коэффициентами распределения оказываются на различном расстоянии от старта.
Коэффициентом Rf (подвижности) называют отношение расстояния от места нанесения исследуемого вещества до середины пятна (а) к расстоянию, от места нанесения вещества до фронта растворителя (в): Rf = а/в. Каждое из разделяемых веществ имеет свой Rf. Этот коэффициент может быть использован для идентификации (определения) компонентов исследуемой смеси, но воспроизводимость его зависит от условий опыта (температура, сорт бумаги, чистота растворителя, однотипность процедур и др.).
Существуют различные виды хроматографии на бумаге: нисходящая (растворитель движется по бумаге сверху вниз), восходящая (растворитель движется по бумаге снизу верх), круговая (движение растворителя происходит от центра круга к периферии) и др. В учебных целях наиболее удобна круговая (радиальная) хроматография.
Все операции с хроматографической бумагой проделывают тщательно вымытыми перед работой руками или в чистых резиновых перчатках. Надписи на бумаге делают простым карандашом.

1.Разметка и маркировка хроматографической бумаги. Из хроматографической бумаги вырезают квадрат со стороной на 0,5 см больше диаметра используемой для работы чашки Петри (рис.3).

На взаимно перпендикулярных прямых, отступив от центра 1,5 см к краю каждой стороны квадрата, сделать карандашом метки (1). Это будет место для нанесения пробы (стартовая линия).
2. Нанесение растворов. В отмеченные точки микропипеткой наносят растворы аминокислот (в соответствии с надписью) или смесь в объеме 0,002-0,01 мл. Нанесение осуществляют прикосновением острого конца заполненной микропипетки к бумаге в отмеченную точку и быстром ее поднятии. При этом на бумаге должно оставаться пятно диаметром не более 3-4 мм. После полного подсыхания пятна операцию повторяют. Так поступают до тех пор, пока весь раствор из микропипетки не будет перенесен на отмеченную точку (стартовую линию).
В центре хроматограммы просверливают отверстие (2) и в него вставляют фитилек (трубочку, скрученную из хроматографической бумаги). Фитилек (3) должен плотно прилегать к краям отверстия, высота его должна быть несколько меньше, чем внутренняя высота камеры.
3. Приготовление растворителя. В колбу объемом 100 мл приливают бутанол, уксусную кислоту и воду в соотношении 12:3:5 и тщательно перемешивают. Полученный раствор наливают в одну из половин чашки Петри по 15-20 мл, приготовленного для разделения смеси аминокислот.
4. Разгонка аминокислот. Хроматограмму укладывают на половинку чашки так, чтобы фитилек располагался в центре и касался ее дна. Для уменьшения испарения растворителя хроматограмму накрывают второй половиной чашки, добиваясь совмещения краев чашек.
Насыщенный неподвижной фазой растворитель по фитильку непрерывно поступает к центру хроматограммы и, двигаясь к краям, растворяет нанесенные аминокислоты и увлекает их за собой. При этом каждая из аминокислот движется по слою бумаги с определенной скоростью, что обусловлено коэффициентом распределения. Скорость аминокислот неодинакова, так как зависит от степени их растворения в неподвижной и подвижной фазе растворителя. Аминокислоты с полярными незаряженными, отрицательно и положительно заряженными (гидрофильными) радикалами движутся медленно, вместе с водой, некоторые чуть впереди воды. Аминокислоты с неполярными, гидрофобными радикалами перемещаются быстрее, так как вода, продвигаясь по бумаге, выталкивает их, а бутилово-уксусная фракция – увлекает за собой. Скорость перемещения аминокислот одновременно зависит от величины и объема радикала.
После того как растворитель дойдет почти до краев чашки, хроматограмму снимают, удаляют фитилек, простым карандашом проводят линию между сухой и мокрыми зонами бумаги (отмечают границу фронта растворителя) и высушивают в вытяжном шкафу.
5. Проявление. Хроматограмму смачивают в налитом в ванночку растворе с массовой концентрацией нингидрина в ацетоне 1 %, вновь высушивают в вытяжном шкафу и помещают для развития окраски пятен аминокислот на 1,5-2 мин в сушильный шкаф при температуре 100 °С или прогревают над плиткой до полного развития окраски комплексов аминокислот с нингидрином.
6. Определение коэффициента подвижности аминокислот. Описывают кратко принцип метода бумажной хроматографии, определяют Rf аминокислот-метчиков и аминокислот смеси, идентифицируют аминокислоты смеси, хроматограмму зарисовывают. Замеряют расстояние, пройденное каждой аминокислотой от точки старта до середины пятна (а), и расстояние пройденное растворителем в данном секторе (в). По формуле рассчитывают коэффициент подвижности:
7. Идентификация аминокислот, содержащихся в смеси, осуществляется по совпадению их позиций с позицией аминокислот-метчиков на хроматограмме, по совпадению коэффициентов подвижности и по однородности окраски пятен.
Rf для аминокислот при разделении на бумаге растворителем, состоящим из бутанола, уксусной кислоты и воды в соотношении 12:3:5 приведены в табл.7.
Коэффициенты подвижности аминокислот (Rf)
| Аминокислоты | Rf | Аминокислоты | Rf | Аминокислоты | Rf |
| Цистеин | 0,08 | Оксипролин | 0,22 | Тирозин | 0,45 |
| Гистидин | 0,11 | Глицин | 0,23 | Триптофан | 0,50 |
| Лизин | 0,12 | Аспарагиновая | 0,23 | Метионин | 0,50 |
| Аспарагин | 0,12 | Треонин | 0,26 | Валин | 0,51 |
| Глутамин | 0,17 | Глутаминовая | 0,28 | Фенилаланин | 0,60 |
| Аргинин | 0,15 | Аланин | 0,30 | Изолейцин | 0,67 |
| Серин | 0,22 | Пролин | 0,34 | Лейцин | 0,70 |
Хроматографический метод позволяет произвести и количественное определение аминокислот в смеси. Для этого пятна аминокислот смеси и аминокислот-метчиков обводят карандашом, нумеруют, вырезают, делают в них надрезы и помещают в пробирки с соответствующим пятну номером.
Затем в пробирки наливают по 3 мл насыщенного сульфатом меди раствора с объемной концентрацией этанола 80 %, содержимое в пробирках перемешивают и ставят в темное место на 30 мин (каждые 10 мин содержимое пробирок перемешивают). Окраска с бумаги переходит в раствор этанола с образованием медных производных сине-фиолетового Руэмана, окрашенных в красный цвет. Оптическую плотность окрашенных растворов аминокислот-метчиков и аминокислот смеси измеряют при 540 нм (зеленный светофильтр) на ФЭКе против насыщенного сульфатом меди раствора с объемной концентрацией этанола 80 %. Массовую концентрацию каждой аминокислоты в смеси рассчитывают по формуле:

где, Х – массовая концентрация аминокислоты в исследуемой смеси, мг/мл;
С – массовая концентрация аминокислоты-метчика (свидетеля), мг/мл;
u — объем нанесенного на хроматограмму раствора аминокислоты-метчика, мл;
u1 — объем нанесенного на хроматограмму раствора исследуемой смеси, мл;
Dпр – оптическая плотность раствора с пятна аминокислоты смеси;
Dсв – оптическая плотность раствора с пятна аминокислоты метчика.
Результаты расчетов по количественному составу аминокислот смеси записывают и делают окончательный вывод по всей работе.
РЕАКТИВЫ. Хроматографическая бумага; вода дистиллированная; органический растворитель (бутанол, ледяная уксусная кислота, вода в соотношении по объему 12:3:5); этанол; раствор с массовой концентрацией нингидрина в ацетоне 1 %; смесь аминокислот (взвешивают по 10 мг лизина, аланина и лейцина, смешивают вместе и растворяют в 10 мл раствора с объемной концентрацией этанола 80 %, при отсутствии какой-либо из аминокислот для приготовления смеси можно взять другие аминокислоты с существенно отличающимися величинами Rf); растворы аминокислот-метчиков, или «свидетелей» (10 мг каждой из аминокислот, взятых для приготовления смеси, растворяют в отдельных флаконах в 10 мл раствора с объемной концентрацией этанола 80 %); раствор с объемной концентрацией этанола 80 % насыщенный сульфатом меди.
1. Общая характеристика метода хроматографии и ее роль в биохимии.
2. Назовите основные виды хроматографии.
3. Общая характеристика принципа хроматографии.
4. Назовите разновидности метода хроматографии на бумаге и чем они отличаются.
5. Назовите основные этапы радиальной хроматографии на бумаге.
6. Техника разметки и маркировки хроматографической бумаги.
7.Техника нанесения растворов в точки старта.
8. Состав и техника приготовления растворителя для «разгонки» аминокислот на бумаге.
9. От чего зависит скорость движения аминокислот в процессе хроматографии.
10. Как рассчитывается коэффициент подвижности (Rf) и что он характеризует?
11. Что такое «идентификация аминокислот» и как её проводят.
12. Назовите основные этапы количественного определения аминокислот методом хроматографии на бумаге.
13. Техника экстрагирования окрашенных пятен.
14. Как определяется содержание аминокислот в 1 мл смеси.
Дата добавления: 2015-02-13 ; просмотров: 5013 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Одним из основных методов разделения и идентификации аминокислот является хроматография. Принцип хроматографического разделения соединений состоит в том, что молекулы веществ разделяемой смеси по-разному распределяются между стационарной и подвижной фазами. По механизму разделения анализируемых веществ выделяют адсорбционную, распределительную, ионообменную и эксклюзионную хроматографии.
В адсорбционной хроматографии разделение веществ происходит за счет их различной способности адсорбироваться и десорбироваться на сорбенте с развитой поверхностью, например, силикагеле.
Распределительная хроматография обеспечивает разделение за счет разной растворимости анализируемых веществ в неподвижной и подвижной фазах. Неподвижная фаза, как правило, химически привита к поверхности неподвижного носителя.
В ионообменной хроматографии молекулы веществ смеси, диссоциированные в растворе на катионы и анионы, разделяются за счет ионных взаимодействий с сорбентом, на поверхности которого привиты катионные или анионные центры, способные к обмену с ионами анализируемых веществ.
В эксклюзионной (ситовой, гель-проникающей, гель-фильтрационной) хроматографии молекулы веществ разделяются по размеру за счет их разной способности проникать в поры носителя.
Хроматография на бумаге
В настоящее время этот метод в значительной мере вытеснен более совершенными методами, но его продолжают применять для разделения аминокислот. Выделяют восходящую и нисходящую хроматографии на бумаге. При восходящей хроматогафии растворитель заливают на дно хроматографической камеры, а бумагу с нанесенными на нее образцами (см. ход работы) располагают так, чтобы точки старта не были погружены в растворитель. Последний смачивает нижний конец бумаги, и фронт растворителя постепенно поднимается вверх, обеспечивая разделение анализируемых соединений. В нисходящей хроматографии растворитель заливают в специальную лодочку, помещаемую в верхней части камеры. Один из концов бумаги погружают в растворитель и закрепляют придавив, например, стеклянной палочкой, помещенной на дно лодочки. Остальная часть хроматографической бумаги свободно свисает в камере, и растворитель постепенно смачивает ее сверху вниз. Хроматографическая камера плотно закрывается для удержания паров растворителя, которые препятствуют высыханию бумаги. С этой же целью на дно камеры наливают небольшое количество растворителя для усиления испарения.
По окончании хроматографии полоску бумаги, смоченную растворителем, извлекают из камеры, высушивают и обрабатывают определенным образом, для проявления разделяемых соединений. При разделении аминокислот бумагу обрабатывают 0.5% раствором нингидрина в ацетоне с последующим прогреванием в течение нескольких минут при 90-110°С.
Для разделения аминокислот используют полярные растворители в виде бинарных, тройных и более сложных смесей воды, спиртов, кислот и оснований. Более полярные компоненты растворителя ассоциируют с целлюлозой и образуют стационарную фазу, а менее полярные составляют подвижную фазу. Поэтому разделение аминокислот на бумаге представляет собой вариант распределительной хроматографии. Аминокислоты с объемными неполярными боковыми цепями (Leu, Ile, Phe, Trp, Val, Met) перемещаются быстрее, чем аминокислоты с более короткими неполярными боковыми цепями (Pro, Ala, Gly) или с полярными боковыми цепями (Thr, Glu, Arg, Ser, Asp, His, Lys, Cys). Это обусловлено большей растворимостью полярных молекул в гидрофильной стационарной фазе и неполярных – в органических растворителях. Отметим, что в ряду неполярных аминокислот (Gly, Ala, Val, Leu) при увеличении длины неполярной боковой цепи, увеличивается и подвижность аминокислоты.
Отношение расстояния, на которое перемещается данная аминокислота, к расстоянию, пройденному фронтом растворителя (обе величины определяют от линии старта), называют подвижностью и обозначают символом Rf. Значение Rf для каждой аминокислоты зависит от условий разделения, например, от типа растворителя. Рекомендуется одновременно с неизвестной смесью аминокислот проводить хроматографирование стандартов. В этом случае подвижности компонентов исследуемой смеси можно сравнить с подвижностями стандартов.
Для количественного определения каждое пятно вырезают и аминокислоту элюируют (вымывают) подходящим растворителем; затем после добавления нингидрина измеряют оптическую плотность раствора. В другом случае бумагу обрабатывают нингидрином и интенсивность окрашивания пятен измеряют с помощью специального фотометра (денситометра) в проходящем или отраженном свете.
При разделении смесей аминокислот часто используют двухмерную хроматографию. В этом случае смесь наносят в один из углов квадратного листа бумаги и проводят разделение в одной системе растворителей. Затем лист извлекают, высушивают, разворачивают его на 90° и хроматографируют в другом растворителе. Данный метод получил наибольшее распространение именно для разделения аминокислот, так как при одномерной хроматографии не всегда удается достичь полного разделения вследствие близких значений Rf у некоторых аминокислот.
Пептиды – это органические молекулы, в состав которых входит несколько аминокислотных остатков, связанных пептидной связью. В зависимости от количества остатков аминокислот и молекулярной массы различают: низкомолекулярные пептиды (состоящие из двух – десяти остатков аминокислот – ди-, три-, тетра-, пентапептиды и т. д.), пептиды со средней молекулярной массой (от 500 до 5000 дальтон, так называемые «средние молекулы») и высокомолекулярные пептиды (с молекулярной массой от 5000 до 16000 дальтон).
Дата добавления: 2016-11-02 ; просмотров: 1852 | Нарушение авторских прав
источник
Исследование однородности белковых препаратов и выделение отдельных белковых фракций производится с помощью различных методов, наиболее важные из которых основаны на применении ультрацентрифугирования, электрофореза, хроматографии, а также на изучении растворимости белков.
1. Методы разделения белков и аминокислот, основанные на различиях веществ в молекулярной массе:
а) ультрацентрифугирование. В ультрацентрифуге сначала осаждаются более тяжелые молекулы, затем менее тяжелые.
б) гель-фильтрация. При этом методе хроматографическая колонка заполняется пористыми гранулами сильно гидратированного углеводного полимера, чаще всего сефадекса (специальным образом обработанные производные высокомолекулярного углевода декстрана). При фильтровании через такую колонку смеси низкомолекулярных и высокомолекулярных белков небольшие белковые молекулы, проникая через поры внутрь гранул сефадекса, будут протекать по колонке медленнее, чем белки, молекулы которых не помещаются в порах гранул и поэтому быстрее вытекают из колонки.
2. Методы разделения белков и аминокислот, основанные на различиях в их кислотно-основных свойствах (или различия их электрических зарядов):
а) метод электрофореза. Смысл электрофореза заключается в разделении находящихся в растворе веществ в электрическом поле на основе различий их электрических зарядов. Электрофоретическое исследование белка производят обычно при нескольких значениях рН, т.к. установлено, что если при одном рН препарат белка ведет себя как однородное вещество, то при другом рН этот же препарат может быть неоднородным.
За последние годы широкое распространение получил электрофорез растворов белков и пептидов на различных носителях – фильтровальной бумаге, целлюлозном или крахмальном порошке, полиакриламидном геле. Эти методы позволяют анализировать чрезвычайно малые количества белков.
б) диск-электрофорез в полиакриламидном геле, при котором смесь белков подвергается одновременному воздействию электрического поля и градиента рН. Он обладает особенно высокой разрешающей способностью.
Фильтрование через гель, так же как и электрофорез в полиакриламидном геле, широко применяется для быстрого приблизительного определения молекулярной массы белков.
в) ионообменная хроматография. В ионообменной хроматографии в качестве носителя используются полимеры, несущие на себе заряд – ионообменные смолы:
· катионообменные смолы (заряженные отрицательно) – обмениваются катионами;
· анионообменные смолы (заряженные положительно) – обмениваются анионами.
Например, часто используется катионообменная полистероидная сульфированная смола. Если раствор аминокислот имеет кислую среду, при загрузке колонки положительно заряженные аминокислоты и белки вытесняют натрий и соединяются с сульфид-анионом. При добавлении гидрооксида натрия рН увеличивается; когда рН достигнет значения, равного изоэлектрической точке молекулы белка, аминокислоты теряют заряд и становятся нейтральными. Под действием силы тяжести аминокислота выходит из колонки, потеряв заряд. Разные белки (аминокислоты) имеют разные значения изоэлектрических точек.
3. Методы разделения, основанные на различиях в веществ по растворимости:
а) метод фракционирования белков солевыми растворами. Основан на том, что каждый индивидуальный белок разделяемой смеси осаждается из нее при определенной концентрации той или иной соли, в то время как другие белки при данной концентрации соли остаются в растворе. Процесс осаждения белка из раствора под действием соли называется высаливанием. При дальнейшем насыщении солью выпадает следующий индивидуальный белок и, таким образом, можно один за другим выделить относительно чистые индивидуальные белки.
б) распределительная хроматография на бумаге. Этот метод основан на различной степени распределения компонентов смеси между двумя несмешивающимися жидкими фазами (подвижной и неподвижной) и заключается в том, что каплю гидролизата белка наносят на полоску хроматографической бумаги, один конец которой опускают в органический растворитель. Растворитель под действием капиллярных сил всасывается бумагой и, проходя по полоске бумаги, увлекает за собой аминокислоты.
Скорость перемещения аминокислот по бумаге зависит от их химического строения и способности растворяться в подвижном и неподвижном растворителях. В качестве подвижного растворителя используют водонасыщенный фенол, n-бутиловый спирт и др. Неподвижным растворителем является вода, пары которой насыщают бумагу. Чем меньше растворимость аминокислот в воде и чем больше их растворимость, например, в феноле, тем быстрее они движутся вслед за фронтом органического растворителя.
4. Определение первичной структуры белка
Наиболее ответственной процедурой при установлении первичной структуры белков является определение последовательности аминокислотных остатков. В настоящее время эту работу ведут преимущественно либо фенилизотиоцианатным методом Эдмана.
Метод Эдмана реализуется в специально созданном для этой цели приборе, получившем название секвенатор (от sequence – последовательность). Метод Эдмана сводится к обработке фенилизотиоцианатом белка или пептида, присоединенного через С-концевую аминокислоту к инертному носителю (полистиролу или пористому стеклу) в колонке секвенатора. После промывки колонки растворителями (метанол, дихлорэтан) образовавшийся фенилтиокарбамилпептид подвергают воздействию безводной трифторуксусной кислоты, в результате чего высвобождается анилинотиозолинон и в его составе N-концевая аминокислота, а укороченный на один аминокислотный остаток пептид или белок остается связанным с носителем.
Раздел 3. НУКЛЕОТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ
Лекция 4. Строение и функции нуклеотидов
1. Общая характеристика нуклеотидов
Нуклеотиды – сложные органические вещества, состоящие из 3-х обязательных компонентов:
3) остатка фосфорной кислоты.
Сложные органические соединения, состоящие только из азотистого основания и сахара-пентозы, называются нуклеозидами. Следовательно, нуклеотиды – фосфорнокислые эфиры нуклеозидов.
Азотистые основания являются производными двух гетероциклических соединений – пурина и пиримидина:
· пуриновые азотистые основания:
· пиримидиновые азотистые основания:
В состав нуклеотидов обязательно входит остаток фосфорной (ортофосфорной) кислоты.
Помимо указанных выше трех обязательных компонентов, в состав молекул нуклеотидов могут входит и другие функциональные группы.
При образовании нуклеозидов первый атом рибозы (дезоксирибозы) связывается с N-1 атомом пиримидинового или N-9 атомом пуринового основания.
С рибозой соединяются аденин, образуя аденозин; гуанин, образуя гуанозин; цитозин, образуя цитидин; урацил, образуя уридин.
С дезоксирибозой соединяются аденин, гуанин, цитозин и тимин, образуя соответственно дезоксиаденозин, дезоксигуанозин, дезоксицитидин, тимидин.
Наиболее распространено в природе присоединение по 5 положению сахара и оно не указывается.
В организме нуклеотиды являются мономерами нуклеиновых кислот, либо функционируют самостоятельно. В зависимости от того, в каком количестве в нуклеотидах представлены их основные компоненты, все нуклеотиды подразделяют на мононуклеотиды, динуклеотиды и полинуклеотиды (полинуклеиновые кислоты).
2. Строение и функции моно- и динуклеотидов
Моно- и динуклеотиды не входят в состав нуклеиновых кислот; они функционируют самостоятельно. В состав самостоятельных нуклеотидов в качестве сахара всегда входит рибоза.
К мононуклеотидам относятся АТФ, АДФ, АМФ, коэнзим А и другие нуклеотиды.
АТФ – аденозинтрифосфорная кислота:
АТФ – энергетический эквивалент клетки, она является посредником между реакциями, идущими с выделением энергии (экзергоническими) и реакциями, идущими с поглощением энергии (эндергоническими). Иными словами, в форме АТФ клеткой запасается энергия, которая затем используется для процессов жизнедеятельности.
Химические связи между различными атомами в органических соединениях делятся на 2 типа:
Нормальные связи – связи, при возникновении или распаде которых изменение уровня свободной энергии соединений составляет 12,5 Дж/моль.
Макроэргические связи – связи, при возникновении или распаде которых уровень свободной энергии соединения составляет 25-50 кДж/моль вещества.
Понятие «макроэргическая связь» учитывает энергетический эффект преобразованной связи посредством химической реакции вещества с нормальными свойствами.
Связи между остатками фосфорной кислоты являются макроэргическими – при их гидролизе выделяется энергия. Такие связи принято обозначать волнистой черточкой.
Энергия 1-й молекулы АТФ может служить только для 1-й реакции. АДФ и АМФ – не способны быть источником энергии.
В живых клетках имеются 3 способа образования АТФ:
1) Субстратное фосфорилирование.
2) Окислительное фосфорилирование.
3) Фотосинтетическое фосфорилирование.
Коэнзим А (КоА). КоА является переносчиком ацильных групп; участвует во многих процессах. В его состав входит аденин, рибоза, пирофосфат, пантотеновая кислота (витамин В3) и тиоламин. Упрощенно коэнзим А представляют в виде следующей формулы: HS-KoA. При взаимодействии коэнзима А с уксусной кислотой образуется ацетилкоэнзим А, в молекуле которого появляется макроэргическая (высокоэнергетическая):
Ацетилкоэнзим А является ключевым метаболитом, благодаря которому осуществляется не только распад и синтез различных веществ, но и взаимосвязь между процессами обмена белков, липидов и углеводов.
К динуклеотидам относятся НАД, НАДФ, ФАД и др.
НАДФ – никотинамидаденин динуклеотид фосфат.
В состав этих динуклеотидов входит никотинамид (амид никотиновой кислоты, являющееся важным витамином — витамином В5). Молекула НАДФ идентична по структуре НАД с той лишь разницей, что у НАДФ у С-3 атома рибозы ОН-группа замещена остатком молекулы фосфорной кислоты.
Молекулы НАД и НФДФ способны к обратимому окислению и восстановлению (благодаря окислительно-восстановительной способности никотинамида), поэтому они участвуют в качестве переносчиков водорода; в реакциях биологического окисления НАД и НАДФ являются кофакторами ферментов дегидрогеназ.
Структура НАД (окисленная форма)
ФАД – флавинадениндинуклеотид. В его состав входит рибофлавин (витамин В2).
Структура ФАД (окисленная форма)
ФАД, как и другие динуклеотиды, способен обратимо окисляться и восстанавливаться, присоединяя к своей молекуле 2 атома водорода, поэтому он участвует в биологическом окислении в качестве переносчика водорода. Является кофактором дегидрогеназ, так же, как и НАД и НАДФ.
3. Строение и функции нуклеиновых кислот
Самое замечательное свойство живых клеток – их способность воспроизводить себе подобных с почти предельной точностью и не один-два раза, а в сотнях и тысячах генераций.
Живые клетки обладают такой способностью благодаря наличию в них нуклеиновых кислот.
ДНК – дезоксирибонуклеиновая кислота;
РНК – рибонуклеиновая кислота.
ДНК и РНК – высокомолекулярные соединения, которые построены на основе нуклеотидов, соединенных 3, 5 — фосфодиэфирными связями. Их молекулярная масса сильно варьирует (от 15 тыс. до 1 млрд).
Нуклеиновые кислоты хорошо растворяются в фенолах; плохо – в слабых растворах кислот.
1. В составе ДНК – аденин, гуанин, цитозин, тимин;
в составе РНК – аденин, гуанин, цитозин, урацил.
2. В составе ДНК – дезоксирибоза; в составе РНК – рибоза.
3. Молекулы ДНК двухцепочечные; РНК – одноцепочечные.
Особенности структуры ДНК
· ДНК состоит из двух правозакрученных полинуклеотидных спиралей, имеющих общую ось.
· Две цепи ДНК антипараллельны, т.е. 3 и 5 фосфодиэфирные мостики ориентированы в противоположных направлениях.
· Основания плоские, гидрофобные, расположены в параллельных плоскостях и перпендикулярно длинной оси спиралей.
· Основания 2-х цепей спарены. Напротив А-Т; напротив Г-Ц;
Спаренные основания являются комплементарными по отношению друг к другу.
Комплементарность – пространственная взаимодополняемость поверхностей взаимодействующих молекул или их частей, приводящая к возникновению между ними вторичных связей.
Между А и Т возникает 2 водородные связи; между Г и Ц – 3 водородные связи.
Остатки сахаров и фосфорные группы остаются на поверхности молекулы и контактируют с водой. Отрицательно заряженные группы остатков фосфорной кислоты легко вступают во взаимодействие с белками, среди которых преобладают гистоны – белки, отличающиеся своей основной природой.
4. Нуклеиновые кислоты отличаются друг от друга по функциям.
Функции ДНК – хранение, репликация (удвоение) и передача наследственной информации (наследственная информация – это информация о первичной структуре белков).
Функции РНК определяются типом РНК.
а) м-РНК – матричная или и-РНК – информационная.
Матричная РНК выполняет функцию переноса наследственной информации из ядра клетки от ДНК в цитоплазму, к месту синтеза белка.
Реализация наследственной информации – синтез белка.
Существуют сотни тысяч видов м-РНК в клетке.
Переносит к месту синтеза белка необходимые аминокислоты.
Рибосомы – органоиды, выполняющие функции синтеза белка.
5. Нуклеиновые кислоты отличаются по локализации.
Основное количество ДНК находится в ядре клетки (в составе хромосом). Часть ДНК располагается в митохондриях и хлоропластах (ее называют цитоплазматической ДНК). РНК находится в цитоплазме.
4. Основные биохимические функции нуклеотидов
Таким образом, нуклеотиды объединяют группу веществ, которые выполняют самые разнообразные функции:
1. Являются строительными блоками нуклеиновых кислот, участвуют в молекулярных механизмах, с помощью которых генетическая информация хранится, реплицируется и транскрибируется.
2. Выполняют важную роль в энергетическом (фосфорном) обмене, в аккумулировании и переносе энергии.
3. Служат кофакторами ферментов, относящихся к различным классам.
4. Играют важную роль в синтезе и распаде углеводов, жирных кислот и липидов.
5. Некоторые нуклеотиды являются посредниками в сложных процессах сигнальной трансдукции (передачи сигналов в живых клетках).
Лекция 5. Строение, механизм действия и классификация ферментов
1. Строение и основные свойства ферментов
Ферменты (энзимы) – вещества белковой природы, присутствующие во всех живых клетках и выполняющие роль катализаторов биохимических процессов.
По своему составу ферменты делятся на:
1) простые – состоят только из аминокислот;
2) сложные – состоят из 2-х частей:
— из белковой, которая называется апоферментом и
— небелковой части – кофактора.
Комплекс апофермента и кофактора называется холоферментом.
Ни апофермент, ни кофактор по отдельности не способны катализировать реакцию. Функционально активен только их комплекс.
По своей химической природе кофакторы могут быть представлены как органическими, так и неорганическими соединениями.
Органические кофакторы можно разделить на две группы:
1) простетические группы – кофакторы, которые прочно соединены с апоферментом и при выделении из организма не отсоединяются от белковой части.
Например, ФАД в составе фермента сукцинатдегидрогеназы из цикла Кребса.
2) коферменты – кофакторы, которые соединены с апоферментами слабыми связями и легко от него отщепляются: например, НАД, НАДФ, а иногда и ФАД.
Неорганические кофакторы представлены ионами металлов (чаще всего ионами железа, меди, марганца, цинка и т.д.). Ионы металлов как кофакторы либо непосредственно участвуют в акте катализа, либо образуют мостики, связывающие фермент с субстратом.
Субстрат (S) – вещество, химические превращения которого катализирует фермент.
Строение фермента, или энзима (Е):
Поскольку молекулы субстрата обычно мельче молекул ферментов, то в непосредственный контакт с субстратом вступает только часть молекулы фермента – активный центр. Причем, геометрическая форма поверхности участка молекулы субстрата является комплементарной поверхности активного центра.
Активный центр фермента – уникальная комбинация аминокислотных остатков, обеспечивающая взаимодействие с молекулой субстрата и участвующая в акте катализа. У сложных ферментов в состав активного центра обязательно входит кофактор.
Активный центр может иметь 2 участка:
Якорный участок обладает геометрическим сходством (соответствием) молекулы субстрата и обеспечивает специфичность действия фермента.
Сходство между ферментами и небиологическими катализаторами
1. Любой катализатор (неорганический и органический) уменьшает энергию активации молекулы. Энергия активации – количество энергии в калориях, необходимая для перевода всех молекул 1-го моля вещества в активированное состояние, т.е. состояние, при котором они способны вступить в химическую реакцию.
2. Любой катализатор может ускорять только химические реакции, возможные с точки зрения термодинамики.
3. Катализаторы не изменяют направление химической реакции.
4. Катализаторы не расходуются в процессе реакции.
Отличия ферментов от неорганических катализаторов
1. Катализ осуществляется в очень мягких условиях (Т, рН)
2. Высокая эффективность: ферменты увеличивают скорость реакции
Пример: в организме есть фермент каталаза (кофактор — Fe).
1 мг железа в каталазе действует как 10 т неорганического железа.
3. Специфичность действия. Каждый фермент ускоряет только 1 реакцию. Виды специфичности:
— абсолютная (1 фермент действует только на 1 субстрат, например, фермент уреаза катализирует гидролиз мочевины);
— относительная (1 фермент может действовать на группу сходных по строению субстратов).
4. Возможность тонкой и точной регуляции скорости реакции изменением условий среды (связано с белковой природой фермента)
Для каждого фермента есть свой температурный оптимум.
Пример: температура тела – 36,6 град.; при Т=40-41град. может быть необратимая денатурация. При низких температурах наблюдается снижение скорости ферментативного катализа (из-за броуновского движения молекул).
Ферменты очень чувствительны к изменению кислотности среды, в которой они действуют. Активность фермента проявляется в пределах довольно узкой зоны рН, называемой оптимумом рН. Можно считать, что для каждого фермента имеется определенная оптимальная концентрация протонов, при которой он наиболее активен.
Изменение рН приводит к изменению зарядов на активном центре и на молекуле в целом; в результате этого изменяется конформация белковой молекулы, вследствие чего нарушается пространственное соответствие активного центра и субстрата, а значит, скорость реакции снижается.
5. Возможность насыщения фермента субстратом (особенности кинетики).
6. Ферментативный катализ – это строго запрограммированный процесс (1 реакция; 1 субстрат; 1 фермент) – серия элементарных превращений вещества, строго организованных в пространстве и времени.
2. Механизм действия ферментов
Действие фермента основано на образовании фермент-субстратного комплекса. Под действием субстрата изменяется конформация фермента, затем изменяется субстрат.
Механизм действия ферментов можно представить в виде следующей схемы:
1. Между субстратом и ферментом возникают соединения (ES), в которых соединения связаны ионной, ковалентной или другой связью.
2. Субстрат под действием присоединенного фермента претерпевает изменения (S→Z), делающие его более доступным для соответствующей реакции.
3. Происходит химическая реакция с образованием фермент-продуктного комплекса (EP).
4. Продукты реакции высвобождаются из фермент-продуктного комплекса.
3. Номенклатура и классификация ферментов
Номенклатура ферментов (правила образования их названий)
1. Случайная (по случайным признакам) – тривиальная
Пример: папаин (carica papaja – из дерева).
2. Рациональная: субстрат +”аза” (липиды – липаза)
3. Систематическая: субстрат + тип катализируемой реакции + «аза» (лактатдегидрогеназа), либо субстрат + название класса, к которому относится данный фермент+ «аза» (лактат-оксидоредуктаза).
В основу классификации положен тип катализируемой реакции:
1. Оксидоредуктазы (сложные ферменты, катализирующие окислительно-восстановительные реакции). Пример: изоцитратдегидрогеназа из цикла Кребса.
2. Трансферазы (катализируют реакции переноса функциональных групп или молекулярных остатков между молекулами). Пример: киназы – трансферазы 1-й стадии гликолиза.
3. Гидролазы (простые ферменты, катализируют реакции гидролиза крахмала, олигосахаридов, жиров). Примеры: липаза, инвертаза, мальтаза и др.
4. Лиазы (катализируют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи, либо присоединением по двойной связи). Пример: альдолаза из гликолиза.
5. Изомеразы (катализируют реакции изомеризации – пространственной или структурной перестройки в пределах 1-й молекулы). Пример: триозофосфатизомераза из гликолиза.
6. Лигазы (часто называются синтетазами) – катализируют реакции синтеза, сопряженные с распадом богатых энергией связей (АТФ).
Каждый фермент имеет 4-х-значный шифр: класс-подкласс-подподкласс- индивидуальный номер фермента.
4. Кинетика ферментативных реакций
Особенностью кинетики ферментативной реакции является насыщение фермента субстратом, при котором дальнейшее увеличение [S] не приводит к увеличению скорости реакции. Эмпирическим путем установлено, что кинетика ферментативной реакции может быть выражена следующим графиком:
Концентрация субстрата, при которой фермент достигает насыщения, является постоянной характеристикой для каждого конкретного фермента.
Кинетику ферментативной реакции можно описать с помощью уравнения, которое было выведено теоретическим путем учеными Михаэлисом и Ментен, и именно в честь них было названо.
Уравнение Михаэлиса — Ментен
Км – константа Михаэлиса. Это такая концентрация субстрата, при которой скорость реакции равна половине максимальной.
Константа Михаэлиса характеризует сродство фермента к субстрату: чем меньше эта константа, тем больше сродство фермента к субстрату, тем эффективнее реакция.
5. Регуляция ферментативных процессов в клетке
Многочисленные способы регуляции ферментативных процессов можно разделить на две группы:
1. Регуляция содержания фермента за счет изменения скорости его синтеза и распада. Следует отметить следующие процессы:
репрессия – процесс подавления (или снижения) скорости синтеза фермента;
индукция – процесс ускорения синтеза ферментов под действием специфических низкомолекулярных соединений – индукторов.
2. Регуляция активности имеющихся в клетке ферментов.
а) путем изменения температуры, значения рН, количества субстрата, кофакторов и т.д.;
б) аллостерическая регуляция (характерна только для аллостерических ферментов). Аллостерическими называют ферменты, имеющие кроме активного центра дополнительный центр связывания (аллостерический центр). Активность аллостерических ферментов регулируется путем изменения конформации молекул ферментов, вызванного присоединением специального метаболита к аллостерическому центу. Метаболит-регулятор (аллостерический эффектор) выполняет функции либо активатора, либо ингибитора;
в) ковалентная модификация ферментов – регуляция каталитической активности ферментов может осуществляться за счет ковалентного присоединения фосфатной группы или нуклеотида. Например, фосфорилированная форма гликогенфосфорилазы обладает более высокой каталитической активностью;
г) изменение активности ферментов с помощью активаторов – химических соединений, повышающих активность ферментов (например, аминокислота цистеин и трипептид глутатион активируют действие многих протеаз).
д) изменение активности ферментов с помощью ингибиторов – химических соединений, подавляющих активность ферментов.
Ингибирование – снижение или полное подавление активности ферментов под действием определенных веществ (ингибиторов).
Ингибирование может быть двух основных видов: небратимое и обратимое.
При необратимом ингибировании фермент и ингибитор образуют недиссоциирующий комплекс. Необратимое ингибирование в организме встречается редко и если оно есть, то из-за веществ, поступающих извне.
При обратимом ингибировании фермент и ингибитор образуют диссоциирующий комплекс.
Обратимое ингибирование, в свою очередь, делится на конкурентное и неконкурентное.
Конкурентное ингибирование – ингибирование, при котором субстрат и ингибитор обладают сходным строением и конкурируют за активный цент фермента. Конкурентное ингибирование в организме часто встречается и является способом регулирования активности фермента.
Скорость реакции при конкурентном ингибировании зависит от соотношения концентраций субстрата и ингибитора. Чем выше концентрация субстрата, тем выше вероятность формирования комплекса, тем выше скорость реакции. Таким образом, конкурентное ингибирование можно подавить путем увеличения концентрации субстрата.
Неконкурентное ингибирование – ингибирование, при котором субстрат и ингибитор взаимодействуют с разными частями молекулы фермента. При этом ингибитор, соединяясь с молекулой фермента, так модифицирует его структуру, что достижение максимальной скорости реакции невозможно.
При неконкурентном ингибировании увеличение концентрации субстрата не приводит к устранению действия ингибитора. Неконкурентное ингибирование в организме, как правило, связано с поступлением в организм тяжелых металлов.
Раздел 5. УГЛЕВОДЫ И ИХ ОБМЕН
Лекция 6. Химическое строение и свойства углеводов
1. Общая характеристика и классификация углеводов
К углеводам относятся соединения, обладающие разнообразными и часто совершенно противоположными свойствами. Среди них есть вещества низкомолекулярные и высокомолекулярные, кристаллические и аморфные, хорошо растворимые в воде и совершенно в ней нерастворимые, способные окисляться и сравнительно устойчивые к действию окислителей.
Общая формула, характерная для подавляющего числа углеводов, Сn(Н2О)m
По химической природе углеводы делятся на:
· моносахариды (простые сахара);
Моносахариды содержат 3-8 атомов углерода и не подвергаются гидролизу с образованием простых углеводородов.
Олигосахариды – полимеры моносахаридов, которые содержат 2-10 остатка моносахаров.
Полисахариды – полимеры моносахаридов, которые содержат более 10 остатков моносахаров.
2. Строение, свойства и функции моносахаридов
Моносахариды делятся на следующие группы:
1. По количеству атомов углерода:
2. По химическому строению:
Все моносахариды являются спиртами, либо альдегидоспиртами, либо кетоспиртами. В их молекулах, как правило, количество атомов углерода равно количеству молекул воды (т.е. m = n).
D-глюкоза (альдоза) D-фруктоза (кетоза)
Альдозы и кетозы являются изомерами.
Основные химические свойства моносахаридов:
1.Мутаротация – переход аномера из одной формы в другую (например, α-глюкоза →β-глюкоза). Аномерами называют энантиомерные формы моносахаридов, различающиеся положением полуацетального гидроксила.
2. Восстановление до многоатомных спиртов (например, глюкоза восстанавливается до сорбита, рибоза – до рибита).
3. Окисление с образованием соответствующих кислот (например, в зависимости от окисляемой группы глюкоза может образовывать глюконовую, глюкуроновую и глюкаровую кислоты).
4. Эпимеризация (например, в слабощелочной среде D-глюкоза находится в равновесии с кетогексозой (D-фруктозой) и альдогексозой (D-маннозой).
5. Образование гликозидов. Конденсация аномерной ОН-группы со спиртовой группировкой молекулы приводит к образованию О-гликозидов. Именно за счет этих связей построены олиго- и полисахариды. При взаимодействии аномерной ОН-группы с NH2-группой образуются N-гликозиды.
6. Этерификация. Гидроксильные группы моносахаридов образуют эфиры с различными кислотами. В метаболизме особо важную роль играет фосфорилирование сахаров.
7. Способность реагировать с азотсодержащими соединениями при высокой температуре с образованием специфических окрашенных веществ – меланоидинов.
8. Способность глюкозы (и других гексоз) подвергаться расщеплению (путем гликолиза) и сбраживанию микроорганизмами.
Основные функции моносахаридов:
1. Энергетическая (моносахариды легко расщепляются с выделением энергии, которая затрачивается на образование АТФ).
2. Пластическая (метаболическая). Моносахариды являются предшественниками для образования многих важных веществ: резервных и структурных полисахаридов, аминокислот, жирных кислот, глицерина и др.
3. Строение, свойства и функции олигосахаридов
Олигосахариды различаются по следующим показателям:
1. Количество моносахаридов.
3. Характер гликозидной связи между моносахаридами.
В растворах моносахариды всегда присутствуют в циклической форме; в состав олиго- и полисахаридов они также входят в циклической форме.
Первый углеродный атом, соединенный с кислородом, является наиболее реакционноспособным. Как правило, связь образуется за счет гликозидного (полуацетального) гидроксила.
Для олигосахаридов характерны некоторые свойства, отмеченные для моносахаридов. Следует также отметить, что олигосахариды, поступающие в организм человека с пищей, в желудочно-кишечном тракте подвергаются гидролизу до своих структурных блоков – моносахаридов. Поэтому в клетки они попадают уже в виде простых сахаров и, соответственно, выполняют те же функции, что и моносахариды.
Из олигосахаридов наибольшее распространение получили дисахариды. Рассмотрим химический состав наиболее важных из них.
Сахароза состоит из остатков α-глюкозы и β-фруктозы, соединенных β-гликозидной (или фруктозидной) связью. Гидролиз сахарозы происходит при участии фермента инвертазы (сахаразы):
сахароза α-глюкоза β-фруктоза
Инвертаза в больших количествах содержится в дрожжах и в кишечнике организмов. Смесь глюкозы и фруктозы в равных количествах, которая образуется при гидролизе сахарозы, называется инвертным сахаром.
Мальтоза – дисахарид, состоящий из 2-х остатков α-глюкозы. Это основной продукт гидролиза крахмала.
Мальтоза → α-глюкоза + α-глюкоза
Гидролиз мальтозы проходит при участии фермента мальтазы.
Мальтаза есть в слюне и поджелудочном соке.
Лактоза – молочный сахар, образуется в организме животных.
Лактоза = β-галактоза + α-глюкоза.Гидролиз лактозы катализируется ферментом лактазой.
Лактаза очень активна у младенцев; у некоторых взрослых лактаза не сохраняется, что влечет за собой непереносимость молока.
4. Строение, свойства и функции полисахаридов
Полисахариды подразделяются на гомосахариды и гетеросахариды.
В состав гомосахаридов входят моносахариды одного типа. Если мономер–фруктоза, то полисахарид нзывается фруктан; галактоза – галактан; глюкоза – глюкан.
Мономерами гетерополисахаридов являются моносахариды 2-х или нескольких типов. К примеру, арабиноза и глюкоза входят в состав арабиноглюканов; арабиноза и ксилоза – арабиноксиланов.
Крахмал (гомосахарид) – запасной полисахарид растений; существует в 2-х формах: амилоза и амилопектин.
Амилоза – линейный полисахарид, состоит из остатков α-глюкозы, соединенных α –1, 4 связью.
Амилопектин – разветвленный полисахарид, в котором на каждые 12 остатков глюкозы, соединенных α –1, 4 связью, приходится α –1, 6 связь.
Эти вещества сильно различаются по своим физическим и химическим свойствам. Так, например, от йода амилоза окрашивается в синий цвет, а амилопектин – в красно-фиолетовый. Они различаются и по растворимости: амилоза легко растворяется в теплой воде и дает растворы со сравнительно невысокой вязкостью, в то время как амилопектин растворяется в воде лишь при нагревании под давлением и дает очень вязкие растворы.
Гликоген(«животный крахмал») – по строению сходен с крахмалом, но характеризуется большей разветвленностью.
Является резервным питательным веществом (образуется главным образом в печени и мышцах).
Целлюлоза (клетчатка) – полисахарид, состоящий из большого количества остатков β-глюкопиранозы.
1. Запас питательных веществ (крахмал, гликоген – наиболее распространенные вещества).
2. Источники энергии (при использовании их в качестве источников энергии они должны сначала подвергаться расщеплению до моносахаридов).
3. Структурная (целлюлоза – образует клеточные стенки у растений, хитин – у животных, муреин – у бактерий).
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.041 с) .
источник