Для разделения белков сыворотки крови на их составляющие используют метод электрофореза, основанный на различной подвижности белков сыворотки крови в электрическом поле.
Принцип разделения белков сыворотки крови на фракции состоит в том, что в электрическом поле белки сыворотки крови движутся по смоченной буферным раствором хроматографической бумаге (ацетатцеллюлозной пленке, крахмаловому, агаровом гелям) со скоростью, зависящей в основном от величины электрического заряда и молекулярной массы частиц.
Вследствие этого белки сыворотки крови разделяются обычно на пять основных фракций: альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины, гамма-глобулины, содержание которых определяется с помощью фотометрии или денситометрии.
Электрофорез в агаровом, крахмальном и особенно полиакриламидном геле дает лучшие результаты: четкое разделение и большое количество белковых фракций сыворотки. Недостатки метода: сложность процедуры приготовления геля (дороговизна готовых гелевых пластин).
Преимущества электрофореза на ацетатцеллюлозной пленке:
1. Химическая однородность пленки и одинаковый размер пор
2. Требует малый объем пробы (0,2-2 мкл) для разделения
3. Быстрота разделения и окраски белков, легкость отмывания фона
В сыворотке крови здорового человека при электрофорезе можно обнаружить шесть белковых фракций: преальбумины, альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины и гамма-глобулины.
Это исследование в диагностическом отношении более информативно чем определение только общего белка или альбумина. При многих заболеваниях изменяется процентное соотношение белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы.
Анализ фореграммы белков позволяет установить, за счет какой фракции происходит увеличение или дефицит белка, а также судить о специфичности изменений, характерных для данной патологии. Исследование белковых фракций, позволяет судить о характерном для какого-либо заболевания избытке или дефиците белка только в самой общей форме.
Белковые фракции сыворотки крови в норме:
| Фракции | Содержание, % |
| Преальбумины | 2-7 |
| Альбумины | 52-65 |
| Альфа-1-глобулины | 2,5-5,0 |
| Альфа-2-глобулины | 7,0-13,0 |
| Бета-глобулины | 8,0-14,0 |
| Гамма-глобулины | 12,0-22,0 |
При анализе результатов исследования сыворотки крови на белковые фракции выявляются три типа нарушений:
1. Диспротеинемия (изменение соотношения белковых фракций)
2. Генетические дефекты синтеза белков
3. Парапротеинемия (аномальные белки в крови)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9336 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Метод электрофореза является одним из самых распространенных, мощных и доступных методов исследования белков. Этот метод широко применяется как в научных исследованиях, так и при экспертизе качества продуктов питания и медицинских препаратах, а также в клинических лабораториях.
С помощью метода электрофореза производят:
1) анализ сложных смесей белков (в генетических исследованиях, при выделении и биотехнологической наработке белков)
2) обнаружение определенного белка (при проведении экспертизы, контроле биотехнологических процессов, клинических анализах)
3) определение молекулярной массы белков (в фундаментальных исследованиях)
4) исследование структуры белков (анализ расположения в биологических мембранах, взаимодействия с другими белками, изучение вопросов фолдинга белков)
В основе метода электрофореза лежит тот факт, что молекулы белков в водных растворах заряжены, то есть фактически представляют собой ионы. Как любая частица, несущая электрический заряд, молекулы белков способны перемещаться в электрическом поле. Таким образом, если к раствору белка приложить электрическое поле (опустить в него электроды и подать постоянное напряжение), то все молекулы белков начнут двигаться. Вследствие разницы в аминокислотном составе разные белки заряжены разноименно — положительно или отрицательно. По этой причине различные белки будут двигаться в разных направлениях: положительно заряженные – к катоду (отрицательный электрод), отрицательно заряженные – к аноду (положительный электрод). Кроме того, величина заряда белковых молекул также неодинакова – молекулы одних белков заряжены сильнее, других – меньше. Белки, молекулы которых имеют больший заряд, будут двигаться быстрее, чем те, что несут меньший заряд. Также на разделение белков методом электрофореза большое влияние оказывает размер молекул белков. Более крупные белки движутся медленнее, чем белки небольших размеров, вследствие того, что вода оказывает сопротивление перемещению (является вязкой средой).
По причине того, что аминокислотный состав белков и их масса различаются достаточно сильно, электрофорез позволят анализировать очень сложные смеси белков. Для решения различных исследовательских задач было предложено множество различных вариантов электрофореза.
4.9 Электрофорез по Леммли
Электрофорез по Леммли — один из методов электрофореза в геле, применяемый для анализа сложных белковых смесей. Данный метод позволяет разделять белки по их молекулярной массе. Также электрофорез по Леммли может быть использован для определения молекулярной массы белков.
Белки, подлежащие анализу методом электрофореза по Леммли, предварительно обрабатывают концентрированным 5%-ным раствором додецилсульфата натрия (рис. 15) при 100С в присутствии β-меркаптоэтанола. При этом белковые молекулы приобретают отрицательный заряд, значительно превышающий её собственный. При последующем разделении в полиакриламидном геле белковые зоны распределяются на электрофоре граммах в соответствие с логарифмом их молекулярной массы
Рис. 15. Додецилсульфата-анион, присутствует в растворах додецилсульфата натрия
В качестве геля для электрофореза по Леммли используются полиакриламидные гели, что позволяет достичь высокой разрешающей способности данного метода. Полиакриламидный гель представляет собой продукт сополимеризации акриламида (рис. 16)
и сшивающего агента N,N- метиленбисакриламда (рис. 17)
Рис. 17. N,N- метиленбисакриламид
В результате процесса сополимеризации образуется прочный, упругий, термостабильный гель, обладающий высокими механическими свойствами и химической инертностью. Пространственная структура геля представляет собой сетку со структурой (рис. 18). Пористость геля зависит от концентрации мономеров и её можно варьировать в значительных пределах от 40 до 0,1 нм (2-30% мономеров). Регулярно чередующиеся амидные группы делают гель гидрофильным. Отсутствие ионизирующихся групп существенно снижает эндосмос, а также взаимодействие белков со структурой геля.
Рис. 18. Структура полиакриламидного геля
В качестве катализатора реакции сополимеризации применяют источник свободных радикалов — персульфат аммония или калия. Катализатором реакции выступает N,N,N,N-тетраметилэтилендиамин.
Полимеризацию геля ведут в стеклянных трубочках длиной 70-100 мм с внутренним диаметром 5 мм либо плоских пластинах. Для этого в одной трубке последовательно полимеризуют два геля для электрофореза, располагая их один под другим: 1) верхний – крупнопористый гель в котором образец сжимается в узкую полосу (концентрирующий гель), 2) нижний — мелкопористый гель, в котором происходит разделение белковой смеси на компоненты под действием эффекта «молекулярного сита».
Для проведения электрофореза гелевыми столбиками соединяют расположенные друг над другом резервуары с буферами, в которые введены электроды и подают на электроды напряжение 40-800 вольт.
В качестве отчета о проделанной работе:
1. Зарисуйте структурные формулы додецилсульфата натрия, акриламида, N,N- метиленбисакриламида, структуру полиакриламидного геля
2. Зарисуйте расположение белковых полос, полученных в результате электрофореза по Леммли, сделайте вывод о составе выданного вам раствора белка (количество компонентов, примерная доля главных компонентов и их число, примерная доля минорных компонентов и их число)
Подготовить пробу белка для электрофореза. Для этого в эппендорф объемом 2 мл поместить 100 мкл раствора белка с концентрацией 4 мг/мл и добавить 100 мкл буфера пробы. Содержимое перемешать инжектированием.
Поместить пробирки в поплавок и поместить в водяную баню. Нагреть до кипения и кипятить 5 минут, затем охладить
Растворить навеску персульфата калия в 2,5 мл ДВ. Для этого внести автоматической пипеткой 2,5 мл ДВ и перемешивать инжектированием до полного растворения соли (растворение идет медленно)
Собрать трубку для электрофореза и поместить её вертикально в штатив
В центрифужной пробирке приготовить смесь для разделяющего геля
Раствор Мономеров 1250 мкл
1,5 М Трис-HCl рН8,8 167 мкл
р-ра Персульфата калия 20 мкл
После внесения раствора персульфата калия , содержимое пробирки перемешивают инжектированием и немедленно вносят в трубку для электрофореза
Смесь для разделяющего геля вносят в трубку для электрофореза тремя порциями по 800 мкл. Раствор вносят осторожно, по стенке трубки не вспенивая его.
После внесения в трубку раствора для разделяющего геля поверх него осторожно наслоить примерно 100 мкл ДВ
Оставить трубку на 15-20 мин для полимеризации. Об окончании полимеризации свидетельствует появление четкой границы между раствором для разделяющего геля и наслоенной водой.
По окончании полимеризации слить воду с геля, остатки жидкости убрать с поверхности геля фильтровальной бумагой, скрученной в трубочку
В центрифужной пробирке приготовить смесь для концентрирующего геля
Раствор Мономеров 340 мкл
0,5 М Трис-HCl рН6,8 125 мкл
р-ра Персульфата калия 20 мкл
После внесения раствора персульфата калия , содержимое пробирки перемешивают инжектированием и немедленно вносят в трубку для электрофореза
250 мкл смеси для концентрирующего геля вносят в трубку для электрофореза. Раствор вносят осторожно, по стенке трубки не вспенивая его.
После внесения в трубку раствора для разделяющего геля поверх него осторожно наслоить примерно 100 мкл ДВ
Оставить трубку на 5-10 мин для полимеризации. Об окончании полимеризации свидетельствует появление четкой границы между раствором для разделяющего геля и наслоенной водой.
По окончании полимеризации геля с трубки снимаю заглушку и устанавливают трубки для электрофореза в катодную камеру прибора (рис. 19) так, чтобы граница концентрирующего и разделяющего геля была видна в верхней (катодной камере)
Рис. 19. Прибор для вертикального гель-электрофореза в трубках.
1- верхняя, анодная камера, 2 – нижняя, катодная камера, 3 – трубки с гелем для электрофореза, 4 – положительный электрод, анод, 5 — отрицательный электрод, катод.
Приготовить 1,2 л анодного буфера. Для этого разбавить исходный анодный буфер в 4 раза ДВ с помощью мерного цилиндра объемом 1 л.
Заполнить анодную камеру анодным буфером. Поместить в камеру анод (красный провод). Поместить катодную камеру над анодной и зафиксировать её винтами. При этом нижние концы трубок должны быть погружены в буфер в нижней камере (анодный буфер).
Приготовить 1,2 л катодного буфера. Для этого разбавить исходный катодный буфер в 4 раза ДВ с помощью мерного цилиндра объемом 1 л. заполнить катодную камеру катодным буфером. При этом концы трубок должны оказаться под слоем электродного буфера.
Промыть нижние и верхние концы трубок для удаления остатков растворов для полимеризации гелей и пузырьков воздуха.
60 мкл подготовленного раствора белка в эппендорфе смешивают со 180 мкл ДВ и перемешивают инжектированием. 200 мкл полученной смеси вносят в трубки для электрофореза, осторожно наслаивая на поверхность геля.
Включают напряжение 250 вольт, через 10 минут поднимают его до 300 вольт, а еще через 10 минут до 400.
Примерно через 40 минут, когда фронт бромфенолового синего пройдет практически всю трубку, напряжение выключают, внимают электрод из катодной камеры. Разбирают прибор и выливают катодный буфер. Затем вынимают трубки для электрофореза и выталкивают столбики геля из трубок стеклянным штоком. Концентрирующий гель отрезают скальпелем.
Разделяющий гель окрашивают коллоидным раствором кумасси бриллиантового голубого в течение 20 мин на кипящей водяной бане. Затем переносят окрашенный гель в кипящую воду и отмываю до проявления белковых полос.
Вопросы для самоподготовки
В чем практическое значение электрофореза?
Что можно установить с помощью электрофореза?
В чем суть метода электрофореза?
От каких параметров зависит скорость перемещения молекулы белка?
В чем особенность электрофореза по Леммли?
По какому параметру разделяются белки при проведении электрофореза по Леммли?
Вопросы к коллоквиуму по теме «Белки»
2. Элементный состав белков
3. Какие органические соединения называют аминокислотами, химические свойства аминокислот
4. Кислотно-основные свойства аминокислот (амфотерность аминокислот, биполярные ионы, кривые титрования)
5. Классификация аминокислот (биологическая, физико-химическая, химическая)
6. Физические свойства аминокислот, стереоконфигурация аминокислот
7. Специфические реакции на аминокислоты
8. Связь аминокислот в белках, пептидная связь – структура и свойства
9. Биуретовая реакция. Определение белка биуретовым методом.
10. Аминокислотный анализ. Методы хроматографии аминокислот.
11. Нингидриновая реакция. Практическое значение
12. Первичная структура белка. Методы установления первичной структуры белка
13. Вторичная структура белка, α-спираль, β-слой
14. Третичная и четвертичная структура белка
15. Химические связи, стабилизирующие структуру белка (первичную, вторичную, третичную и четвертичную)
16. Растворимость и осаждение белков. Силы удерживающие белок в растворе, условия осаждения белков.
17. Реакции обратимого и необратимого осаждения белков, их практическое значение.
18. Белки как носители электрических зарядов, кислотно-основные свойства белков, изоэлектрическая точка
19. Диализ. Электрофорез. Изоэлектрическое фокусирование
21. Выделение белков из тканей. Методы выделения и очистки белков
Использованная литература
The protein protocols handbook, 2 nd edition – edited by Walker J.M. – Humana press, 2002
Петров К.П. – Методы биохимии растительных продуктов – Киев: Вища школа, 1978.
Шапиро Д.К. – Практикум по биологической химии, 2-е изд. перераб. и доп. – Минск: Высшая школа, 1976
Практикум по биохимии: учебное пособие, 2-е изд. пререаб и доп. – под ред. Северина — М.: МГУ, 1989
Р.Досон, Д.Элиот и др. – Справочник биохимика, пер. с англ. – М.: Мир, 1991
Скурихин И.М., Нечаев А.П. – Все о пище с точки зрения химика: справочное издание. — М.: высшая школа, 1991
Степин Б.Д. — Техника лабораторного эксперимента в химии: учеб пособи для ВУЗов – М.: Химия, 1999
Химическая энциклопедия ТТ.1-5., гл. ред. Кнунянц И.Л. – М.: Советская энциклопедия, 1988-1998
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.007 с) .
источник
Электрофорез — метод разделения веществ, основанный на явлении миграции заряженных микрочастиц в жидкой среде под действием внешнего электрического поля.
Существует три различных электрофоретических метода. Под собственно электрофорезом обычно понимают зональный электрофорез (ЗЭ), два других называют методами изоэлектрофокусирования (ИЭФ)и изотахофореза (ИТФ).Электрофорез применяют главным образом для разделения веществ, молекулы которых различаются по электрофоретической подвижности, т. е. отношению скорости электрофореза (скорости перемещения заряженных частиц вещества) к напряженности электрического поля, которое зависит от свойств заряженных частиц окружающей их среды. Путем изменения внешних условий (например, рН среды, температуры, силы тока, состава и концентрации буферного раствора или носителя) создают подходящие условия для разделения. Вследствие того что при разделении на молекулы действуют только электростатические силы, электрофорез считают «мягким» методом и поэтому часто применяют для работы с лабильными веществами.
Электрофорез можно проводить в растворе, но из-за неизбежного выделения теплоты и возникающей в связи с этим тепловой конвекции процесс, как правило, проводят на носителе. Вследствие некоторых сопутствующих явлений (адсорбция, несоизмеримость размеров высокомолекулярных соединений и пор носителя) введение носителя ограничивает область применения метода. Однако свойства носителя иногда используют для повышения эффективности разделения: например, при электрофорезе в градиенте полиакриламидного геля фракционирование осуществляется не столько за счет различной электрофоретической подвижности веществ, сколько за счет различия в их молекулярных массах.
Зональный электрофорез (ЗЭ) — это метод разделения заряженных частиц в электрическом поле, основанный на том, что частицы с разными соотношениями заряд/масса мигрируют с различными скоростями. В зависимости от знака заряда молекулы вещества мигрируют в электрическом поле по направлению к аноду или катоду.
Результаты этого процесса регистрируются на электрофореграфе (по аналогии с хроматографией).
Ранее использовали один и тот же буфер в слое носителя электродных камерах, т. е. разделение вели в непрерывной буферной системе. В настоящее время этот прием еще применяют при электрофорезе на бумаге и пластинках. Приэлектрофорезе в прерывистой буферной системе (различные буферы в слое носите электродных камерах) быстро мигрирующие вещества образую более узкие зоны. Электрофорез в прерывистой буферной системе используют главным образом в гель-электрофорезе. ЗЭ обычно проводят на бумаге, пластинках и в гелях в водных буферных растворах.
При электрофорезе в электродных камерах происходит электролиз раствора и вследствие этого изменяется состав буфера. Поэтому электроды располагают так, чтобы они не касались носителя, а контакт между ними осуществлялся при помощи полосок фильтровальной бумаги. Электродная камера разделена на два отсека, которые соединяются дополнительным мостиком из фильтровальной бумаги. Подбирая соответствующий объем электродных камер или перекачивая буфер насосом от анода к катоду, поддерживают постоянными концентрацию и значение рН буфера в двухкамерной системе. Рекомендуется также проводить деполяризации электродов после каждого электрофоретического разделения.
Материалы-носители подразделяются на две группы:
первая — бумага, целлюлоза, ацетилированная целлюлоза, агароза и материалы для ТСХ(например, силикагель);
вторая — крахмал и полиакриламид.
Эффективность разделения зависит не только от суммарного заряда молекул анализируемых веществ, но и от размеров молекул. Определяющим параметром является соотношение заряд — масса.
Носители первой группы относительно инертны и слабо влияют на эффективность разделения. Материалы второй группы обладают пористой структурой, что существенно влияет на качество разделения. Поскольку размеры пор соизмеримы с размером макромолекул, то можно разделять вещества с одинаковыми суммарными зарядами, но с разными молекулярными массами (например, при ионообменной хроматографии).
Электрофорез на бумаге позволяет экстрагировать вещества из соответствующих зон или пятен и использовать для дальнейшей работы; обнаруживать вещества, используемые в бумажной хроматографии; проводить фракционирование в двух направлениях.
Для электрофореза на бумаге используют специальные сорта бумаги, характеризующиеся следующими свойствами: достаточной механической прочностью; удовлетворительным для удерживания достаточного количества электролита и образца.
Наряду с камерами погружного типа применяют камеры для электрофореза в тонком слое с охлаждаемыми пластинами, в которых лист бумаги помещают между двумя изолирующими пленками.
Электрофорез в тонком слое проводят на стеклянных пластинках, покрытых слоем носителя. По сравнению с полосками бумаги пластины более удобны в обращении. Электрофорез на бумаге и в тонком слое применяют для исследования фракций, полученных при колоночной хроматографии, ферментативных гидролизатов белков, метаболитов, а также для разделения аминов, аминокислот, пептидов и белков, нуклеотидов, фенолов, нафтолов, фенолкарбоновых кислот, красителей, неорганических соединений.
Гель- электрофорез. Вместо целлюлозы и силикагеля можно использовать мягкие гели. Ниже приведены основные рабочие стадии проведения электрофореза в слое геля: приготовление гелей и подготовка образца ® электрофоретическое разделение ® детектирование ® анализ результатов и оформление их в рабочем журнале. Из множества гелей на практике применяют только два — гели агарозы и полиакриламида. В зависимости от способа приготовления геля и типа буферной системы различают несколько вариантов метода:
· электрофорез в геле полиакриламида (ПААГ);
· диск-электрофорез (диск-ПААГ) в прерывистой буферной системе;
· электрофорез в геле полиакриламида в присутствии додецилсульфата натрия (ДСН-ПААГ);
· электрофорез в градиенте пористого полиакриламидного геля.
Гель окрашивают красителем. Поскольку молекулы красителя заряжены, гель можно обесцвечивать электрофоретически при напряжении 50 В. В местах, не содержащих исследуемое вещество, гель обесцвечивается. Количественную оценку проводят спектрофотометрически при помощи сканирующего денситометра.
После усадки гелей в водном этаноле или ацетоне их высушивают между двумя листами целлофана в вакууме при слабом нагреве.
Гель-электрофорез применяют для разделения всех классов заряженных веществ, например белков, ферментных комплексов, вирусов, олигонуклеотидов и нуклеиновых кислот; определения молекулярных масс биополимеров; анализа белков на микроуровне (антигенов при количественном иммуноэлектрофорезе).
При электрофорезе в свободном потоке электролит (буфер) перемещается в вертикальном направлении (перпендикулярно направлению электрического поля). Заряженные частицы под действием электрического поля мигрируют в горизонтальном направлении и одновременно увлекаются потоком буфера. В итоге разделенные вещества распределяются в потоке в соответствии с их электрофоретической подвижностью и элюируются из прибора в различных фракциях. Электрофорез в свободном потоке применяют для препаративного разделения заряженных частиц, в том числе коллоидных, субклеточных частиц и клеток.
Изоэлектрическое фокусирование (ИЭФ). С помощью изоэлектрического фокусирования по изоэлектрическим точкам (ИЭТ) разделяют амфотерные вещества, в частности белки. Сущность метода заключается в том, что молекулы белков мигрируют под действием электрического поля в среде с линейным и стабильным градиентом рН до достижения области рН, соответствующей их ИЭТ.
Изоэлектрическое фокусирование отличается от зонального электрофореза тем, что разделение осуществляется не в буфере с постоянным значением рН, а в среде с линейным градиентом рН. Значение рН минимально вблизи анода, максимально — вблизи катода. Главное условие эффективного разделения белков — наличие стабильного градиента рН среды. В связи с тем что белки обладают амфотерными свойствами, необходимо, чтобы амфолиты – носители — вещества, с помощью которых формируется градиент рН, обладали высокой буферной емкостью. Амфолиты — носители представляют собой многокомпонентную смесь изомеров и гомологов алифатических полиаминополикарбоновых кислот, сульфокислот и фосфоновых кислот, изоэлектрические точки которых располагаются в широкой области значений рН.
ИЭФ применяют для аналитического разделения пептидов, белков, нуклеотидов, органических кислот, ионов металлов и препаративного разделения белков; накопления следовых количеств веществ из больших объемов пробы; определения электрофоретической подвижности.
Необходимым условием проведения ИЭФ является наличие высокого напряжения при низкой ионной силе раствора. Однако именно в этих условиях усиливается электроосмос. Отрицательное воздействие на эффективность разделения веществ оказывают так же примеси солей, занесенные вместе с реактивами (гели для ИЭФ следует готовить из особо чистых реактивов). Для проведения ИЭФ более всего подходит полиакриламидный гель с низкими электроосмотическими свойствами. Продолжительность эксперимента зависит от напряженность поля и характера изменения рН- градиента.
Препаративное изоэлектрическое фокусирование проводят в вертикальных колонках (в градиенте плотности сахарозы, глицерина, этиленгликоля) или в слое инертного материала. В качестве таких материалов используют гранулированные гели (рН градиент формируют с помощью амфолитов).
источник
Этот анализ является исследованием, которое позволяет определить их количественные и качественные показатели по тому, как белки распределяются в электрическом поле. Исследование основано на том, что белковые молекулы несут заряды, положительные или отрицательные в зависимости от того, какой кислотностью будет обладать среда, в которой будет проводиться непосредственно электрофорез. Молекулы, которые окажутся положительно заряженными, будут адсорбироваться лучше, нежели чем те, которые несут отрицательный заряд.
Носителями, которые будут применяться для электрофореза, могут быть хроматографическая бумага, агаровый гель, полиакриловой гель, ацетатцеллюлозная бумага или акриловый гель. Значительно реже применяется капиллярный электрофорез.
Во время анализа белки разделяют на 5 или 6 фракций, в зависимости от применяемого метода. Это будут гамма-глобулины, которые делятся на бета-1 и бета-2, альбумины — альфа-1 и альфа-2, а также бета-глобулины.
Имеются установленные нормы белковых фракций, которые должны присутствовать в крови. Отклонение их от показателей является признаком нарушения в организме, что требует проведения обследования для выявления причины.
| Фракция | Норма в г/л |
|---|---|
| Альбумин | 35-44 |
| Глобулин альфа-1 | 1-3 |
| Глобулин альфа-2 | 5-8 |
| Бета-глобулин | 4-10 |
| Гамма-глобулин | 5-12 |
Значения показателей, в зависимости от того какие реактивы применяются в конкретной лаборатории, могут несколько изменяться. Поэтому в бланке результатов исследования в каждом медицинском учреждении обязательно указываются значения нормы, которые приняты в нем. На них будет ориентироваться врач при расшифровке анализа.
Электрофорез белков крови назначают не очень часто, так как сегодня современные лабораторные исследования позволяют провести анализ на определенный белок, что ускоряет процесс диагностики. Абсолютным показанием к электрофорезу является наличие монолокальной гаммапатии. Также иногда анализ может быть показан в таких случаях:
- чрезмерно высокая скорость оседания эритроцитов, когда она превышает 50 мм/ч;
- значительно повышенный уровень гамма-глобулинов;
- скрининговое обследование для контроля эффективности лечения миеломной болезни;
- чрезмерно высокий общий белок в крови;
- ряд аутоиммунных заболеваний, поражающих печень и почки;
- слабость, для которой нет выраженной причины;
- развитие патологических переломов костей и постоянные боли в костях;
- частые рецидивы инфекционных заболеваний;
- нарушения, обнаруженные в прочих анализах, указывающие на то, что у человека могут развиваться анемии, лейкемии, гиперкальциемия или гипоальбуминемия.
При общей диспансеризации и получении медицинских справок для трудоустройства данное исследование крови не осуществляется. Не требуется оно и в процессе подготовки человека к хирургическому вмешательству.
Для получения наиболее точных результатов рекомендуется соблюдение правил подготовки к анализу. Они включают в себя голодную диету в течение 15 часов до того как будет взята кровь, когда пациент может употреблять только чистую не газированную воду. За 90 минут до проведения исследования необходимо полностью исключить нагрузки как эмоциональные, так и физические, и курение в активной или пассивной форме. Чтобы не допустить искажение данных, забор материала не проводят сразу после того, как был осуществлен гемодиализ или проведена процедура, при которой использовались радиоконтрастные составы. Важно также, чтобы за несколько дней до исследования полностью было исключено лечение пенициллином, так как он вызывает расщепление амбулина, что исказит результат.
| Фракция | Повышение | Понижение |
|---|---|---|
| Амбулин | Злоупотребление алкоголем, период вынашивания ребёнка, дегидрация | Холецистит в острой форме, лейкоз, миелома, саркоидоз, пневмония, остеомиелит, системная красная волчанка, лимфома |
| Глобулин альфа-1 | Цирроз печени, стрессовые состояния, лимфогранулематоз, период вынашивания ребёнка, язва желудка, острое или хроническое воспаление | Гепатит вирусной природы в острой форме |
| Глобулин альфа-2 | Сахарный диабет, остеомиелит, гломерулонефрит в острой форме, стрессовые состояния, системная красная волчанка, узловатый полиартрит, цирроз | Гипертиреоз, гепатит вирусной природы в острой форме, гемолиз интраваскулярный |
| Бета-глобулин | Сахарный диабет, саркоидоз, ревматоидный артрит, беременность, гломерулонефрит, желтуха подпеченочная, нефротический синдром | Лейкоз, цирроз, склеродермия имеющая системный характер, лимфома, системная красная волчанка |
| Гамма-глобулин | Цирроз, склеродермия системного характера, ревматоидный артрит, лимфолейкоз в хронической форме, муковисцидоз, синдром Шегрена | Лейкоз, склеродермия, гепатит вирусной природы в острой форме, лимфома, гломерулонефрит |
Исказить показатели, кроме неправильной подготовки к проведению анализа, могут 2 фактора: недавно проведенная процедура гемодиализа, из-за которой произошло разрушение эритроцитов в крови, и повышенный уровень билирубина в организме. В любом из этих случаев потребуется пересдача анализа через некоторое время, которое определит врач.
источник
Выделение и очистка белков осуществляется поэтапно.
1. Гомогенизация – это тщательное измельчение объектов биохимического исследования до однородного, то есть гомогенного состояния, то есть белки подвергаются тщательной дезинтеграции вплоть до разрушения клеточной стенки.
а) ножевые гомогенизаторы типа Уорринга;
б) пестиковые гомогенизаторы Поттера — Эльвегейма;
в) шаровые и валковые мельницы – для более плотных объектов;
г) метод попеременного замораживания и оттаивания, при этом разрыв клеточной стенки происходит под действием кристалликов льда;
д) метод «азотной бомбы» – под высоким давлением клетки насыщаются азотом, затем давление резко сбрасывают, выделяется газообразный азот, который как бы взрывает клетку изнутри;
е) УЗ, различные пресс — методы, переваривание клеточных стенок ферментами. В большинстве случаев при гомогенизации выделяется тепло, при этом многие белки могут инактивироваться, поэтому все процедуры проводятся в холодных помещениях при t° 0° или охлаждают сырье с помощью льда. При этом тщательно контролируют объем и время разрушения клеток, рабочее давление. Идеальным считается такой гомогенизат, который может подвергнуться дальнейшему экстрагированию.
2. Экстракция белков, то есть их перевод в растворенное состояние; чаще всего экстракцию проводят вместе с измельчением одновременно. Экстракцию проводят:
а) растворением в 8-10% растворах солей;
б) с использованием буферных растворов с рН от кислых до слабощелочных (боратных, фосфатных, цитратных, трис — буферных: смесь трисаминометана с NH2 – CH3 + HCl;
в) осаждение белков органическими растворителями (этанол, метанол, бутанол, ацетон и их комбинациями), при этом происходит расщепление белково-липидных и белково-белковых компонентов, то есть разрушение ЧСБ.
3. Очистка и фракционирование белков. После экстрагирования производят разделение или фракционирование смеси на индивидуальные белки и их дальнейшую очистку:
а) высаливание – это процесс осаждения белков нейтральными солевыми растворами щелочных и щелочноземельных металлов.
Механизм высаливания – добавляемые анионы и катионы разрушают гидратную белковую оболочку белков, являющуюся одним из факторов устойчивости белковых растворов. Чаще всего применяются растворы сульфатов Na и аммония. Многие белки отличаются по размеру гидратной оболочки и величине заряда. Для каждого белка есть своя зона высаливания. После удаления высаливающего агента белок сохраняет свою биологическую активность и физико-химические свойства. В клинической практике применяется метод высаливания для разделения глобулинов ( при добавлении 50% раствора сульфата аммония (NH4)2SO4 выпадает осадок) и альбуминов ( при добавлении 100% раствора сульфата аммония (NH4)2SO4 выпадает осадок).
На величину высаливания оказывают влияние:
1) природа и концентрация соли;
Главную роль при этом играют валентности ионов. Поэтому действие соли оценивают по ионной силе раствора μ: 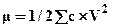
Метод Кона является разновидностью высаливания. Одновременно происходит экстракция и осаждения компонентов. Изменяя последовательно температуру (обычно низкие t° –0+8°С), рН раствора и концентрированного этанола, из плазмы крови последовательно выделяют до 18 фракций белков.
Метод Кона применяют в фармацевтическом производстве при получении кровезаменителей;
б) методы хроматографии. Основоположником разработки хроматографических методов анализа считается русский ученый Михаил Цвет (1903). В настоящее время существует много ее разновидностей. В основе метода лежит способность веществ специфически адсорбироваться на адсорбенте, заключенном в колонку или помещенном на каком-либо носителе. При этом происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают соответствующие элюенты (растворители), которые ослабляют силы адсорбции и вымывают адсорбированные вещества из колонки. Вещества собираются в коллекторе фракций.
Основополагающим в хроматографии является коэффициент распределения, который равен отношению концентрации вещества в подвижной фазе к концентрации вещества в неподвижной фазе (или стационарной фазе).
Неподвижная стационарная фаза – может быть твердой или жидкой или смесью твердой и жидкой.
Подвижная фаза – жидкая или газообразная, она течет по стационарной, или пропускается через нее.
В зависимости от вида стационарной и подвижной фазы бывают различные модификации хроматографического анализа.
Адсорбционная – основана на различной степени адсорбции белков адсорбентом и растворимости их в соответствующем растворителе.
Применяемые адсорбенты – кремниевая кислота, Al2О 3 , CaCO 3 , MgO, древесный уголь. Адсорбент в виде суспензии с растворителем (чаще с буферным раствором) упаковывают в колонке (стеклянная вертикальная трубка). Образец наносят на колонку, затем через нее пропускают растворитель или смесь растворителей.
Разделение основано на том, что вещества с более высоким Краспр. (Б), продвигаются по колонке с большей скоростью. Сбор фракций осуществляется с помощью коллектора фракций.
Распределительная хроматография – основана на распределении смеси белков между двумя жидкими фазами. Разделение может происходить на специальной хроматографической бумаге, а также в колонках, как в адсорбционной. Твердая фаза в данном случае служит только опорой для жидкой стационарной фазы. Хроматографическая бумага обладает свойством задерживать воду между своими целлюлозными волокнами. Эта вода — неподвижная стационарная фаза. Когда по бумаге под действием капиллярных сил движется неводный растворитель (подвижная фаза), молекулы вещества, нанесенного на бумагу, распределяются между двумя фазами в соответствии с их коэффициентом распределения. Чем выше растворимость вещества в подвижной фазе, тем дальше оно продвинется по бумаге вместе с растворителем.
В случае распределения хроматографии на колонке – носители – это целлюлоза, крахмал, силикагель и др., неподвижная фаза – вода. При нанесении на колонку вещества смеси движутся по колонке с разной скоростью с учетом Краспр.
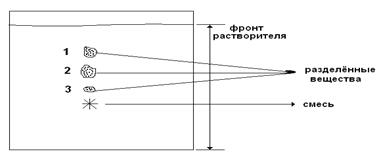 | 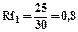 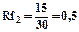 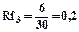 |
Rf для каждого соединения в стандартных условиях величина постоянная.
Ионообменная хроматография – основана на притяжении противоположно заряженных частиц. Для этого используют различные ионообменные смолы: катионообменные – содержат отрицательно заряженные группы – сульфированные стиролы 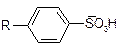
Анионообменные смолы, или основные ионообменники, содержат положительно заряженные группы, притягивающие отрицательно заряженные молекулы белков
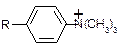
В зависимости от q разделяемых белков используют соответствующие ионообменники, с которыми взаимодействуют определенные белки, а другие беспрепятственно выходят из колонки. «Осажденные» на колонке белки снимают, используя более концентрированные солевые растворы или изменяя рН элюента.
Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков или других макромолекул с иммобилизованными на носителях специфическими веществами – лигандами (это может быть кофермент, если выделяют фермент, антитело антиген и др. Благодаря высокой специфичности белков к иммобилизованным лигандам к нему присоединяется только один белок из смеси. Смывается буферными смесями с измененным рН или измененной ионной силой.
Достоинство – возможность одноэтапно выделить заданное вещество высокой степени чистоты.
Метод гель — фильтрации или метод молекулярных «сит» — это разновидность проникающей хроматографии.
Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которые обладают многие пористые материалы, например органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Гель фильтрация – это разделение веществ с помощью гелей, основанное на различиях в размере молекул (сефароза, сефадекс, сефакрил, биогели и т.д.). Под действием эпихлоргидрина полисахаридные цепочки декстрана (синтезируется микроорганизмами) сшиваются в сетчатую структуру, становятся нерастворимыми в воде, но сохраняют к ней большое сродство. Благодаря этой гидрофильности полученные зерна (называемые сефадексом) сильно набухают с образованием геля, которым заполняют колонку. Метод основан на том, что крупные молекулы не проникают во внутреннюю водную фазу, а более мелкие молекулы сперва проникают в поры «сита», как бы застревают в них, а поэтому движутся с меньшей скоростью. Соответственно белки с большей Mr первыми поступают в приемник. В последнее время в проникающей хроматографии все чаще используют в качестве молекулярного сита пористые стеклянные гранулы.
Электрофоретический метод в биохимии – основан на различии скорости передвижения молекул в электрическом поле (аминокислоты, пептиды, белки, нуклеиновые кислоты).
Различие скорости движения зависит:
1. от q молекулы: подвижность молекул тем больше, чем больше суммарный q. Величина q зависит от рН;
2. от размеров молекул: чем крупнее молекулы, тем меньше их подвижность. Это связано с возрастанием сил трения и электростатических взаимодействий крупных молекул с окружающей средой;
3. от формы молекул: молекулы одинакового размера, но различной формы, например, фибрилл и глобул белка обладают различной скоростью. Это связано с различиями в силах трения и электростатического взаимодействия.
Виды электрофореза
а) Изоэлектрическое фокусирование. Разделение происходит на вертикальной колонке в град. как рН, так и напряжения. С помощью специальных носителей амфолитов в колонке устанавливается град. рН от 0 до 14. В колонку помещают смесь веществ, подключаю электроток. Каждый из компонентов движется к той части колонки, где значение рН соответствует его изоэлектрической точке и там останавливается, то есть фокусируется.
Достоинство: происходит разделение, очистка и идентификация белков в один прием. У метода высокая разрешительная способность (0,02 pI).
б) Изотахофорез – это электрофорез на поддерживающих средах. После включения электротока ионы с самой высокой подвижностью движутся к соответствующему электроду первыми, с самой низкой – последними, обладающие промежуточной подвижностью – располагаются посередине.
в) Диск-электрофорез – прибор состоит из двух сосудов с буфером – верхнего и нижнего, соединенных вертикальными трубками, содержащими разнопористый гель. По мере движения ионизированных частиц под действием электротока. Более высокая пористость – в верхней части геля.
г) Иммуноэлектрофорез – метод сочетающий электрофорез с иммунодиффузией (для обнаружения антигенов в сложных физиологических смесях). На специальный носитель перпендикулярно друг другу помещают смесь антигенов и смесь антител. При включении электротока они разделяются на индивидуальные вещества и диффундируют на гелевом носителе. В месте встречи антигена с соответствующим антителом происходит специфическая реакция преципитации в форме дуги. Количеств образовавшихся дуг соответствует количеству антигенов.
Дата добавления: 2015-12-22 ; просмотров: 1710 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Что такое клинические исследования и зачем они нужны? Это исследования, в которых принимают участие люди (добровольцы) и в ходе которых учёные выясняют, является ли новый препарат, способ лечения или медицинский прибор более эффективным и безопасным для здоровья человека, чем уже существующие.
Главная цель клинического исследования — найти лучший способ профилактики, диагностики и лечения того или иного заболевания. Проводить клинические исследования необходимо, чтобы развивать медицину, повышать качество жизни людей и чтобы новое лечение стало доступным для каждого человека.
У каждого исследования бывает четыре этапа (фазы):
I фаза — исследователи впервые тестируют препарат или метод лечения с участием небольшой группы людей (20—80 человек). Цель этого этапа — узнать, насколько препарат или способ лечения безопасен, и выявить побочные эффекты. На этом этапе могут участвуют как здоровые люди, так и люди с подходящим заболеванием. Чтобы приступить к I фазе клинического исследования, учёные несколько лет проводили сотни других тестов, в том числе на безопасность, с участием лабораторных животных, чей обмен веществ максимально приближен к человеческому;
II фаза — исследователи назначают препарат или метод лечения большей группе людей (100—300 человек), чтобы определить его эффективность и продолжать изучать безопасность. На этом этапе участвуют люди с подходящим заболеванием;
III фаза — исследователи предоставляют препарат или метод лечения значительным группам людей (1000—3000 человек), чтобы подтвердить его эффективность, сравнить с золотым стандартом (или плацебо) и собрать дополнительную информацию, которая позволит его безопасно использовать. Иногда на этом этапе выявляют другие, редко возникающие побочные эффекты. Здесь также участвуют люди с подходящим заболеванием. Если III фаза проходит успешно, препарат регистрируют в Минздраве и врачи получают возможность назначать его;
IV фаза — исследователи продолжают отслеживать информацию о безопасности, эффективности, побочных эффектах и оптимальном использовании препарата после того, как его зарегистрировали и он стал доступен всем пациентам.
Считается, что наиболее точные результаты дает метод исследования, когда ни врач, ни участник не знают, какой препарат — новый или существующий — принимает пациент. Такое исследование называют «двойным слепым». Так делают, чтобы врачи интуитивно не влияли на распределение пациентов. Если о препарате не знает только участник, исследование называется «простым слепым».
Чтобы провести клиническое исследование (особенно это касается «слепого» исследования), врачи могут использовать такой приём, как рандомизация — случайное распределение участников исследования по группам (новый препарат и существующий или плацебо). Такой метод необходим, что минимизировать субъективность при распределении пациентов. Поэтому обычно эту процедуру проводят с помощью специальной компьютерной программы.
- бесплатный доступ к новым методам лечения прежде, чем они начнут широко применяться;
- качественный уход, который, как правило, значительно превосходит тот, что доступен в рутинной практике;
- участие в развитии медицины и поиске новых эффективных методов лечения, что может оказаться полезным не только для вас, но и для других пациентов, среди которых могут оказаться члены семьи;
- иногда врачи продолжают наблюдать и оказывать помощь и после окончания исследования.
- новый препарат или метод лечения не всегда лучше, чем уже существующий;
- даже если новый препарат или метод лечения эффективен для других участников, он может не подойти лично вам;
- новый препарат или метод лечения может иметь неожиданные побочные эффекты.
Главные отличия клинических исследований от некоторых других научных методов: добровольность и безопасность. Люди самостоятельно (в отличие от кроликов) решают вопрос об участии. Каждый потенциальный участник узнаёт о процессе клинического исследования во всех подробностях из информационного листка — документа, который описывает задачи, методологию, процедуры и другие детали исследования. Более того, в любой момент можно отказаться от участия в исследовании, вне зависимости от причин.
Обычно участники клинических исследований защищены лучше, чем обычные пациенты. Побочные эффекты могут проявиться и во время исследования, и во время стандартного лечения. Но в первом случае человек получает дополнительную страховку и, как правило, более качественные процедуры, чем в обычной практике.
Клинические исследования — это далеко не первые тестирования нового препарата или метода лечения. Перед ними идёт этап серьёзных доклинических, лабораторных испытаний. Средства, которые успешно его прошли, то есть показали высокую эффективность и безопасность, идут дальше — на проверку к людям. Но и это не всё.
Сначала компания должна пройти этическую экспертизу и получить разрешение Минздрава РФ на проведение клинических исследований. Комитет по этике — куда входят независимые эксперты — проверяет, соответствует ли протокол исследования этическим нормам, выясняет, достаточно ли защищены участники исследования, оценивает квалификацию врачей, которые будут его проводить. Во время самого исследования состояние здоровья пациентов тщательно контролируют врачи, и если оно ухудшится, человек прекратит своё участие, и ему окажут медицинскую помощь. Несмотря на важность исследований для развития медицины и поиска эффективных средств для лечения заболеваний, для врачей и организаторов состояние и безопасность пациентов — самое важное.
Потому что проверить его эффективность и безопасность по-другому, увы, нельзя. Моделирование и исследования на животных не дают полную информацию: например, препарат может влиять на животное и человека по-разному. Все использующиеся научные методы, доклинические испытания и клинические исследования направлены на то, чтобы выявить самый эффективный и самый безопасный препарат или метод. И почти все лекарства, которыми люди пользуются, особенно в течение последних 20 лет, прошли точно такие же клинические исследования.
Если человек страдает серьёзным, например, онкологическим, заболеванием, он может попасть в группу плацебо только если на момент исследования нет других, уже доказавших свою эффективность препаратов или методов лечения. При этом нет уверенности в том, что новый препарат окажется лучше и безопаснее плацебо.
Согласно Хельсинской декларации, организаторы исследований должны предпринять максимум усилий, чтобы избежать использования плацебо. Несмотря на то что сравнение нового препарата с плацебо считается одним из самых действенных и самых быстрых способов доказать эффективность первого, учёные прибегают к плацебо только в двух случаях, когда: нет другого стандартного препарата или метода лечения с уже доказанной эффективностью; есть научно обоснованные причины применения плацебо. При этом здоровье человека в обеих ситуациях не должно подвергаться риску. И перед стартом клинического исследования каждого участника проинформируют об использовании плацебо.
Обычно оплачивают участие в I фазе исследований — и только здоровым людям. Очевидно, что они не заинтересованы в новом препарате с точки зрения улучшения своего здоровья, поэтому деньги становятся для них неплохой мотивацией. Участие во II и III фазах клинического исследования не оплачивают — так делают, чтобы в этом случае деньги как раз не были мотивацией, чтобы человек смог трезво оценить всю возможную пользу и риски, связанные с участием в клиническом исследовании. Но иногда организаторы клинических исследований покрывают расходы на дорогу.
Если вы решили принять участие в исследовании, обсудите это со своим лечащим врачом. Он может рассказать, как правильно выбрать исследование и на что обратить внимание, или даже подскажет конкретное исследование.
Клинические исследования, одобренные на проведение, можно найти в реестре Минздрава РФ и на международном информационном ресурсе www.clinicaltrials.gov.
Обращайте внимание на международные многоцентровые исследования — это исследования, в ходе которых препарат тестируют не только в России, но и в других странах. Они проводятся в соответствии с международными стандартами и единым для всех протоколом.
После того как вы нашли подходящее клиническое исследование и связались с его организатором, прочитайте информационный листок и не стесняйтесь задавать вопросы. Например, вы можете спросить, какая цель у исследования, кто является спонсором исследования, какие лекарства или приборы будут задействованы, являются ли какие-либо процедуры болезненными, какие есть возможные риски и побочные эффекты, как это испытание повлияет на вашу повседневную жизнь, как долго будет длиться исследование, кто будет следить за вашим состоянием. По ходу общения вы поймёте, сможете ли довериться этим людям.
Если остались вопросы — спрашивайте в комментариях.
источник
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«Харьковский политехнический институт»
Кафедра биотехнологии, биофизики и аналитической химии
по курсу: «Физико — химические методы анализа»
Выполнил: студент группы ХТ-57б
Нобатова Огулсенем Аганиязовна
1.2. Варианты метода электрофореза белков…………………………………. 5
1.3. Оборудования для электрофореза. Форезная камера……………….……..6
2.3. Процесс полимеризации ПААГ…………………………………………..12
2.4. Выбор концентраций мономеров…………………………………………14
2.5. Миграция белков в геле…………………………………………………. 17
3. Красители используемые для проявления белков …………. 19 Заключение………………………………………………………………………. 20 Список использованных источников……………………………………………. 21
Электрофорез (от электро- и греч. переносить) — это электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных или белковых растворов) в жидкой или газообразной среде под действием внешнего электрического поля. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновение в углубления и поры. Различают две разновидности электрофореза: катафорез — когда обрабатываемая поверхность имеет отрицательный электрический заряд (то есть подключена к отрицательному контакту источника тока) и анафорез — когда заряд поверхности положительный.
Электрофорез применяют в физиотерапии, для окраски автомобилей, в химической промышленности, для осаждения дымов и туманов, для изучения состава растворов и др. Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
Цели и задачи данной курсовой работы: — изучение истории электрофореза — изучение теоретических основ электрофореза — изучение методик использования электрофореза в полиакриламидном геле для анализа различных белков — умение использовать правильную плотность геля — изучение сути процесса полимеризации ПААГ — изучение миграции белков в геле — изучение красителей, используемых для проявления белков.
- Электрофорез. 1.1. Основы электрофореза.
Электрофорез – это перемещение заряженных частиц в растворе (в зависимости от знака их суммарного электрического заряда) к аноду или катоду под действием электрического поля. Поскольку скорость движения молекул в электрическом поле зависит от их заряда, формы и размера, то электрофорез может быть использован для их разделения. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, величина и знак которого зависят в основном от рН среды. Если через этот раствор начать пропускать электрический ток, то под действием электрического поля макромолекулы в соответствии со своим суммарным зарядом мигрируют в направлении катода или анода, причем их трение об окружающую среду ограничивает скорость миграции. В зависимости от величины заряда и размеров макромолекулы приобретают разные скорости, и в этом – сущность процесса электрофореза. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны одинаковых молекул мигрирующих с одной и той же скоростью. Однако в жидкости нельзя избежать конвекции, которая деформирует и смешивает разделяющиеся зоны, поэтому обычно электрофорез проводят в гелеобразной среде. Наличие сетки геля приводит к тому, что теперь фракционируемые макромолекулы сталкиваются с нитями полимера, образующего сетку геля, что увеличивает эффективное трение о среду, а следовательно, снижает скорость движения молекул. Очевидно, что препятствия для миграции становятся особенно серьезными, если средний диаметр пространственных ячеек геля оказывается соизмерим с размерами макромолекул. В этом случае решающее влияние на электрофоретическую подвижность различных молекул и степень разделения оказывает соотношение их линейных размеров. Электрофорез позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как размеры (или молекулярная масса), пространственная конфигурация, вторичная структура и электрический заряд, причем эти параметры могут выступать как порознь, так и в совокупности. Биологические макромолекулы – белки, нуклеиновые кислоты, полисахариды и др. – находятся в водном растворе в виде частиц, несущих определённый электрический заряд. Заряд макромолекулы определяется входящими в ее состав группами, способными к электролитической диссоциации. Степень диссоциации групп зависит от многих факторов, в частности, от рН среды. Общий заряд биологической макромолекулы также может изменяться при её взаимодействии с ионами или другими молекулами. Наиболее широкое применение электрофорез получил для анализа и очистки белков и нуклеиновых кислот, хотя этот метод может быть использован и для других заряженных биологических молекул, таких как сахара, аминокислоты, пептиды, нуклеотиды и др. Для фракционирования белков, нуклеиновых кислот и их фрагментов в настоящее время используют почти исключительно гель-электрофорез. Наиболее широко используются полиакриламидные (ПААГ) гели и гели агарозы. Варьируя концентрацию полимера, можно получать гели с очень широким диапазоном размеров пор. Кроме того, можно изменять электрические заряды макромолекул путем вариации рН буфера, а их конфигурацию путем введения в буфер денатурирующих агентов или детергентов. В качестве других «носителей» жидкой фазы широко используют пленки из ацетата целлюлозы, фильтровальную бумагу, тонкие слои силикагеля, целлюлозы, сефадекса и др. В некоторых случаях, например для разделения низкомолекулярных веществ, эти системы имеют свои преимущества.
1.2. Варианты метода электрофореза белков.
Существует множество разновидностей и модификаций данного метода, которые используются (или использовались в определённые периоды развития биохимии) в различных областях: 1) электрофорез в свободных средах (без поддерживающей среды) 2) электрофорез с подвижной границей 3) зональный электрофорез без поддерживающей среды 4) капиллярный электрофорез 5) зональный электрофорез в поддерживающей среде с капиллярной структурой 6) электрофорез на фильтровальной бумаге 7) электрофорез белков на ацетат-целлюлозной мембране 8) электрофорез в колонках и блоках гранулированной поддерживающей среды 9) электрофорез белков в ПААГ 10) электрофорез белков в крахмальном геле 11) электрофорез белков в агарозном геле 12) электрофорез в полиакриламидном геле.
1.3. Оборудования для электрофореза. Форезная камера.
Для проведения практикума необходима лаборатория (примерная площадь — 20 м х 20 м) оснащенная следующим оборудованием и расходными материалами: 1. Вертикальная камера для электрофореза с комплектующими; 2. Источник питания с регулировкой силы тока или/и напряжения; 3. Система гель-документирования; 4. Холодильник (+4º), с морозильной камерой (-20º) для хранения растворов; 5. Электронные аналитические весы и набор шпателей для взвешивания; 6. Система для получения деионизированной воды (milliQ); 7. Магнитная мешалка с набором магнитных якорей; 8. Мерные цилиндры (100 и 500 мл), мерные стеклянные стаканы. 9. Стеклянные бутыли для хранения растворов. 10. Один комплект пипеток-дозаторов (10, 200 и 1000 мкл); 11. Пробирки конусные (15 и 50 мл), пробирки типа эппендорф (0,5 и 1,5 мл), наконечники для пипеток (20, 200, 1000, 5000 мкл). 12. Список необходимых реактивов: акриламид, N,N’ –метиленбисакриламид, Трис, додецилсульфат натрия (SDS), персульфат аммония, N,N,N’,N’ – тетраметилэтилендиамин (ТЕМЕД), глицин, трицин, глицерин, β-меркаптоэтанол, ЭДТА, Бромфеноловый синий, Кумасси R 250, Кумасси G 250, изопропанол, уксусная кислота, глутаровый альдегид, набор маркеров молекулярных масс белков (15-150 кДа) и набор низкомолекулярных маркеров молекулярных масс белков и пептидов (1-30 кДа).
Рисунок – 1.3. Оборудование для электрофореза.
Форезная камера: Форезные камеры бывают двух типов: с двумя или с одним платиновым электродом. * камеры с двумя платиновыми электродами можно подключать к источнику напряжения в любой полярности. * камеры с одним — только одним способом. Обычно на таких камерах указана полярность подключения. Будьте внимательны. Подготовка камеры: мыть губкой, смоченной детергентом; сполоснуть раз 10 водопроводной водой; сполоснуть раза 2-3 дистиллятом. Форезные камеры имеют два уязвимых места: * сравнительно легко при мытье отодрать
платиновый электрод; * если при споласкивании или переносе держать камеру за один бортик, то в этом бортике появится трещина. Рисунок – 1.3. Вертикальная форезная камера.
Прибор для электрофореза в вертикальных трубках (в разрезе)
1 — верхний электродный резервуар; 2 — центральный цилиндр; 3 — верхний платиновый электрод; 4 — резиновая прокладка; 5 — трубочка с гелем; 6 — нижний электродный резервуар; 7 —нижний платиновый электрод. Для электрофореза белков обычно используют пластины шириной 8 — 14 см и длиной (в направлении электрофореза) 8 —28 см. Электрофорез нуклеиновых кислот и их фрагментов, например при секвенировании, нередко ведут в больших пластинах размером 33 43 см, что диктуется максимальным размером рентгеновской пленки для авторадиографии. Для разделения гидролизатов тРНК Пиртл и др. недавно использовали пластины ПААГ длиной 90 см.
- Гели для электрофореза. 2.1. Плотность геля.
Стандартно используют следующие обозначения: Т – процентное отношение суммарной массы обоих мономеров к объему раствора, С – процентное отношение массы бисакриламида к общей массе обоих мономеров. (Т = акриламид + мономер, образующий сшивки) и количество сшивающего агента в процентах от общего количества мономеров (С): Т = (a + b)/m x 100 % C = b/(a + b) x 100 %
a – количество акриламида; b – количество мономера, образующего сшивки (бисакриламида); m – объем буфера, мл. Т — обычно варьируется в пределах 3-30%, а С 1-5%. Выбор значений С и Т определяется диапазоном фракционирования белков и ограничивается механическими и адсорбционными свойствами геля. Для крупнопористых гелей необходимо увеличивать степень сшивки (повышать С до 3-5%), для мелкопористых гелей величина С не должна превышать 1-2%. На первый взгляд чем больше Т, тем мельче поры, но это не всегда так, поскольку ПААГ не является регулярной пространственной решеткой с жесткими ячейками определенного среднего размера. При малых значениях С он представляет собой скорее длинные нити, заполняющие весь объем и лишь в отдельных точках случайно сшитые между собой. Такая система не может быть внутренне жесткой. Поэтому мигрирующие в геле макромолекулы, по-видимому, могут раздвигать гибкие длинные участки линейных полимеров акриламида, при этом миграция молекул замедляется и происходит своеобразное трение их о гель. Однако жестких ограничений на размер мигрирующих молекул такая система не накладывает, и это очень существенно. Чем выше концентрация заполимеризованного акриламида, тем меньше размер пор в геле:
p = 1,5 d / Ö` c р – размер пор в ангстремах c – объемная концентрация акриламида d – диаметр молекулы акриламида Чем больше содержание акриламида (а величина Т, в основном, определяется им), тем гуще нити полимера, меньше промежутки между ними и сильнее трение. Увеличение содержания «сшивки» (С) сначала повышает жесткость геля, т.к. средняя длина свободных участков нитей уменьшается. Трение при этом увеличивается, а миграция биополимеров в геле замедляется. Однако далее картина меняется, экспериментально показано, что с увеличением С выше 10% тормозящий эффект геля (при одних и тех же значениях Т) ослабляется. При С>15% гель ведет себя как крупнопористый даже при высоких значениях Т. Внутренняя структура геля в этом случае приобретает, по-видимому, совсем иной характер. Благодаря частым сшивкам оказывается энергетически выгодным и вероятным многократное связывание нескольких параллельно идущих нитей в своего рода пучки, которые также образуют хаотически сшитую пространственную сетку. Эта сетка оказывается действительно жесткой – нити в пучках раздвинуть невозможно. Зато между пучками полимерных нитей образуются достаточно большие пустоты, заполненные жидкой фазой геля, по которым могут свободно мигрировать молекулы биополимеров. Поэтому содержание сшивки С в геле должно быть в пределе 2-5%. Соотношение между акриламидом и сшивающим агентом определяют механические и физические свойства геля. Для гелей с концентрацией Т 5 – 15 % С рекомендуется выбирать в пределах 2-4 %. Для выбора С была предложена следующая эмпирическая формула: С (%) = 6,5 – 0,3 Т (%) Концентрация полиакриламидных гелей, используемых для разделения макромолекул с различными молекулярными массами Концентрация геля Т, % | Концентрация бисакриламида С, % | Пределы разделения, дальтоны |15-2010-155-1052-5 | 0,20,32 – 356 | 1 х 104 — 4 х 1044 х 104 — 1 х 1051 х 105 — 3 х 1053 х 105 — 5 х 105выше 5 х 105|
2.2. Полиакриламидныи гель (ПААГ).
Исходные материалы: Акриламид (СН2 = СН — CONH2) представляет собой белый кристаллический порошок. Хорошо очищенный продажный препарат содержит не более 0,05% акриловой кислоты. Его 5%-ный водный раствор должен иметь рН не ниже 5, а оптическая плотность 1%-ного раствора при 290 нм (А290) не должна превышать 0,15. Такой препарат можно использовать без дополнительной очистки или перекристаллизации. Акриламид следует хранить сухим, в темной посуде, предпочтительно на холоду. В этих условиях он может храниться до года. Акриламид токсичен (воздействует на кожу и нервную систему), поэтому отвеши-вать и растворять его следует в перчатках и под тягой. Недостаточно чистый пре-парат можно перекристаллизовать. Для этого 70 г акриламида растворяют в 1 л хлороформа при 50°, фильтруют при этой же температуре, затем охлаждают до — 20°, быстро промывают кристаллы холодным хлороформом и высушивают в вакуум-эксикаторе. Для освобождения от УФ-поглощающих примесей акриламид можно обработать активированным углем. Для этого в маточный 30 — 40%-ный водный раствор акриламида в смеси с метиленбисакриламидом добавляют акти-вированный уголь (примерно 50 г/л), суспензию перемешивают в течение 30 мин и фильтруют сначала через бумажный, а затем через стекловолокнистый фильтр. NN’-Метиленбисакриламид («Бис») — используют в качестве «сшивки» линейных полимеров акриламида. Продажные препараты, содержащие не более 0,02% акриловой кислоты, не нуждаются в дополнительной очистке. В случае необходимости Бис можно перекристаллизовать из ацетона (12 г/л) в тех же усло-виях, что и акриламид. Условия хранения и токсичность — такие же, как у акриламида. В качестве «сшивки» иногда используют этилендиакрилат — СН2 = СН — СО — O — СН2 — СН2 — О — СО — СН = СН2, а также NN’-диаллилтартардиамид (ДАТД) —
CH2 = CH — CH2 — NH —CO — CH(OH) — CH(OH) — CO — NH — CH2 — CH = CH2. С их помощью получают «растворимые» гели. В первом случае эфирную связь можно разорвать обработкой геля щелочью или водным раствором пипери-дина. Гели, сшитые ДАТД, растворяются за 20 — 30 мин при комнатной темпера-туре в 2%-ной йодной кислоте.
2.3. Процесс полимеризации ПААГ.
При подготовке определенной серии опытов удобно заранее приготовить концентрированный (30 — 40%) водный раствор акриламида и метиленбисакрил-амида с определенным соотношением обоих мономеров. Такой раствор можно хранить в холодильнике в течение нескольких недель. Так же хранят и маточный раствор буфера, например 10-кратной концентрации. ТЕМЕД хранится хорошо, а персульфат аммония растворяют в воде непо-средственно перед началом опыта. Для приготовления геля маточные растворы мономеров и буфера смешивают в такой пропорции, чтобы получить нужную конечную концентрацию акриламида и буфера, дополняют до расчетного объема водой и вносят ТЕМЕД. После этого раствор деаэрируют в колбе Бунзена, присоединенной к водоструйному насосу, добавляют расчетный объем раствора персульфата и заливают в трубку или между стеклами для формирования пластин. При правильном выборе концентраций персульфата и ТЕМЕД полимеризация занимает 30 — 40 мин.Ее следует вести вдали от яркого источника света. Рассмотрим некоторые факторы, влияющие на этот процесс. Наибольшую опасность для нормального протекания полимеризации акриламида представляет растворенный в воде кислород, молекула которого является опреде-ленного рода бирадикалом и потому способна оборвать цепную реакцию свободно-радикальной полимеризации акриламида. Деаэрация смеси растворов необходима именно для удаления из нее растворенного кислорода. Ее можно вести достаточно энергично и с перемешиванием — так, чтобы жидкость при пониженном давлении закипела, но как только интенсивное выделение пузырей газа закончится, деа- эрацию следует прекратить, не допуская заметного испарения воды. Обычно эта процедура занимает несколько минут при комнатной температуре. Кислород воздуха в контакте с раствором мономеров может помешать полимеризации, поэто-му на поверхность раствора осторожно наслаивают до высоты 3 — 5 мм деаэри-рованную кипячением воду или изобутанол. Наслаивать следует по стенке формы через иглу от шприца с помощью перистальтического насоса. Им же удобно отсо-сать воду после окончания полимеризации геля. Вначале граница между гелем и водой исчезает, но затем вновь появляется, что указывает на окончание процесса полимеризации. Если в качестве инициатора используют рибофлавин, то форму с раствором мономеров освещают люминесцентной лампой «дневного света» с расстояния около 5см в течение30 — 45мин. Уже указывалось, что рибофлавин является более эффективным инициатором, чем персульфат. Кроме того, продукты его распада не опасны для белков и нуклеиновых кислот, в то время как ион пер-сульфата может вступать в реакцию с белками, создавая артефакты при их фракци-онировании. В тех случаях, когдаэто существенно, персульфат удаляют путем предварительного электрофореза («преэлектрофореза») геля до внесения в него препарата, однако полностью это сделать не удается. Тем не менее в последние годы в качестве инициатора предпочтение отдают персульфату, поскольку при работе с рибофлавином довольно трудно подобрать оптимальную степень деаэри-рования растворов. С одной стороны, растворенный кислород препятствует полимеризации, а с другой — он необходим, хотя и в небольшом количестве, для самого процесса инициации с участием рибофлавина. Полимеризация — экзотер-мический процесс, поэтому в случае высокой концентрации акриламида во избежа-ние образования пузырей газа и нарушения однородности геля необходимо обес-печить отвод тепла. Вместе с тем скорость полимеризации увеличивается с ростом температуры за счет ускорения образования свободных радикалов. Этим можно воспользоваться для замедления полимеризации: при охлаждении геля на 1° ее продолжительность увеличивается примерно на 2 мин. Полимеризацию гелей, содержащих более 15% акриламида, лучше вести на холоду. Гель получается наи-более однородным, если время полимеризации составляет 30 — 40 мин. Обычно этого добиваются эмпирически, подбирая оптимальную концентрацию персуль-фата. Она может варьировать в пределах от 0,02 до 0,2% в зависимости от концен-трации акриламида и качества самого персульфата. С увеличением содержания акриламида концентрацию персульфата приходится уменьшать. Имеет смысл предварительно внести различные количества данного препарата персульфата в ряд пробирок с рабочим раствором мономеров акриламида, наблюдая продолжи-тельность полимеризации в них.
2.4. Выбор концентраций мономеров.
Для удобства изложения используются следующие обозначения: Т — процентное отношение суммарной массы обоих мономеров к объему их раствора, С — процентное отношение массы метиленбисакриламида к общей массе обоих мономеров. Величина Т практически варьирует в пределах 3 — 30%, а С, как правило, составляет 1—5%, что соответствует отношению акриламид/Бис в пределах от 99:1 по 19:1. Однако в некоторых особых случаях, рассмотренных ниже, имеет смысл увеличивать С до 20% и более. При указании значений Т и С значок «%» далее будет опущен. Для крупнопористых гелей надо увеличивать степень сшивки (повышать величину С до 3 — 5), т. е. отношение акриламид/Бис брать в пределах от 35:1до20:1. При этом происходит одновременное повышение прочности геля и ухудшение его способности прилипать к стеклу — гель как бы «замыкается». Мелкопористые гели (T около 20) при высоком содержании «сшивки» оказываются хрупкими и мутными, поэтому для них величина С не должна превышать 1 — 2. Неправильно было бы считать ПААГ регулярной пространственной решеткой с жесткими ячейками определенного среднего размера. При малых зна-чениях С он представляет собой скорее длинные нити, заполняющие весь объем и лишь вот дельных точках случайным образом сшитые между собой. Расстояние между этими точками вдоль нити (при C 2) в среднем равно 50 — 100 мономерных единиц. Такая система не может быть внутренне жесткой. Мигрирующие в геле мак- ромолекулы, по-видимому, могут раздвигать гибкие длинные участки линей-ных полимеров акриламида. Разумеется, на это расходуется энергия, миграция мо-лекул замедляется и происходит своеобразное «трение» их о гель. Однако жестких ограничений на размер мигрирующих молекул такая система не накладывает, и это очень существенно. Чем больше содержание акриламида, тем гуще нити полимера, меньше промежутки между ними и сильнее трение. Увеличение содержания «сшивки» (С) сначала повышает жесткость геля, так как средняя длина свободных участков нитей уменьшается. Трение при этом увеличивается, а миграция биопо-лимеров в геле замедляется, — именно этого и можно было ожидать. Возвращаясь к ПААГ, следует указать, что гели с очень высоким содержанием метиленбисак-риламида (С > 15) хрупки, легко отстают от стенок, непрозрачны и сильно окраши-ваются. Этих недостатков лишены гели, сшитые NN/-диaллилтapтapдиaмидом. Например, гель с T = 5 и С = 15, сшитый ДАТД, оказывается настолько крупно пористым, что не тормозит миграцию биополимеров с молекулярной массой 0,5млн. дальтон; при этом он механически прочен, хорошо сцепляется со стеклом и прозрачен. Вспомним, что такой гель к тому же растворим в йодной кислоте.
Недавно описано успешное использование для электрофореза белков еще сильнее сшитого геля этого типа. В нем величина С достигала 27,т.е. отношение акриламид/ДАТД не превышало 4 : 1. Рассмотрим теперь подробнее влияние выбора значений Т и С для обыч-ного ПААГ на скорость миграции в нем биополимеров. Тормозящий эффект тре-ния о гель проявляется в снижении электрофоретической подвижности заряженных макромолекул вгеле (и’) по сравнению с их подвижностью в свободной жидкости с такими же, как у буфера геля, значениями рН и ионной силы раствора (u0). Электрофоретическую подвижность определяют как величину скорости миграции заряженных молекул(см/ч)при напряженности поля 1 В/см. Величина и0 зависит от соотношения суммарного электрического заряда макромолекулы(при данном рН) и ее массы. Сила, действующая на молекулу в электрическом поле, пропорциональна заряду, а противодействующая миграции вдоль силовых линий поля сила трения о жидкость пропорциональна линейному размеру молекулы, а следовательно, кубическому корню из ее массы. Для ориентировки заметим, что электрофоретическая подвижность большинства кислых белков в свободной жид-кости при рН 8,8 лежит в пределах 0,1 — 0,5 см/ч на 1 В/см. Прямой корреляции между массой молекулы и величиной и0, очевидно, быть не должно. В геле трение существенно возрастает, причем тем сильнее, чем больше масса молекул и меньше средний размер пор, т. е. чем больше величина Т (для малых значений С).
Показано, что имеет место соотношение: ln(и’/и0) = — kRT. Величина коэффициента торможения kR (порядка 0,1— 0,4) зависит от среднего радиуса молекулы R и степени сшивки геля С, слабо увеличиваясь с ростом последней в пределах от 1 до 7. Для глобулярных белков R лежит в диапазоне от 1,57 нм для лактальбумина(M = 12400) до 3,61 нм для церулоплазмина (M = 151 000). Для эффективного разделения белков при электрофорезе в ПААГ соотношение u’/u0 должно составлять 0,1 — 0,2. Отсюда следует, что оптимальная электрофорети-ческая подвижность белков в ПААГ лежит в пределах 0,01— 0,1 см/ч на 1 В/см. При напряженности поля 10 — 20 В/см этому соответствуют скорости миграции белков в диапазоне 0,1 — 2 см/ч. Таким образом, прирабочей длине геля 10см за 5ч электрофореза наиболее быстрые белки могут достигнуть конца геля, в то время как наименее подвижные продвинутся лишь на 0,5 см. Цифры эти — сугубо приближенные и приведены здесь лишь для общей ориентировки. В конкретных случаях возможны существенные отклонения от них. Например, если заранее известно, что разделяемые белки сильно различаются между собой по заряду или размерам, то можно вести электрофорез в условиях более высоких подвижностей (и’), т. е. в более крупно пористых гелях, и тем сократить время фракционирования в 2 — 3 раза. Выбор значения Т зависит от природы различия электрофоретических подвижностей белков в геле. Если сильно различаются размеры молекул, а отноше-ние заряда к массе у них более или менее одинаково, то имеет смысл выбрать Т максимальным. Разделение в этом случае будет происходить только за счет трения о гель, причем тем эффективнее, чем больше Т, хотя при этом в связи с увеличени-ем продолжительности электрофореза усилится диффузия белков. Если же компо-ненты анализируемой смеси имеют различные отношения заряда к массе, то может оказаться выгодным вести разделение в крупнопористом геле при малых значениях Т), т.е. как бы в свободной жидкости, почти не используя эффект трения молекул о гель. По крайней мере, это обеспечит выигрыш во времени фракционирования.
2.5. Миграция белков в геле.
Отличие и’ от uо является сила трения о гель, которая зависит от соотно-шения линейных размеров макромолекул и пор геля, а следовательно, от молеку-лярных масс белков и концентрации ПААГ. Молекулярные массы подавляющего большинства индивидуальных белков не превышают 500 000. Поэтому исполь-зование гелей агарозы оказывается нецелесообразным, кроме тех случаев, когда разделение белков хотят вести только по величине отношения заряда к массе. Как правило, электрофорез белков проводят в ПААГ, содержащем 5 — 20% акриламида. Белки являются, цвиттерионами. Их суммарным зарядом, а следовательно и отношением заряда к массе, можно управлять путем изменения рН буфера, в котором полимеризуют ПААГ и ведут электрофорез и который далее будем именовать рабочим. Очевидно, что оптимальное значение рН рабочего буфера обусловливает не максимальный заряд, а максимальное различие зарядов разных белков, состав-ляющих исходную смесь. Поэтому в большинстве случаев нецелесообразно ис-пользовать экстремальные величины рН рабочего буфера, слишком удаленны не от изоэлектрических точек всех белков смеси. Для обычных кислых белков оптималь-ные значения рН буфера оказываются в нейтральной или слабощелочной области; миграция белков идет в направлении от катода к аноду. Для щелочных белков (гистонов, белков рибосом и др.) целесообразно использовать слабокислые буферы (рН 4 — 5). Эти белки различаются по величине суммарного положительного заряда и мигрируют в направлении от анода к катоду. Отметим, что эффект трения о гель зависит не только от молекулярной массы, но и от конфигурации и жесткости белковой макромолекулы. Глобулярные белки, неспособные к агрегации или диссоциации на субъединицы, ведут себя более или менее одинаково, хотя их размеры зависят от плотности упаковки глобу-лы. Рыхлые глобулярные и, особенно, фибриллярные белки могут деформировать-ся при взаимодействии с гелем и тем самым облегчать себе миграцию между его нитями. Этот эффект особенно сильно выражен у высокомолекулярных нуклеино-вых кислот. Для однозначного определения молекулярной массы белка по скорости его миграции при электрофорезе бывает целесообразно распрямить полипептидную цепочку белка и придать ей жесткость. Именно такой прием используется при электрофорезе белков, обработанных додецилсульфатом натрия.
- Красители используемые для проявления белков. Для наблюдения за ходом электрофореза в исходный препарат вносят краситель, мигрирующий в том же направлении, что и фракционируемые белки. Он не должен заметным образом связываться с белками, а скорость его продвиже-ния по гелю должна быть заведомо больше, чему наиболее быстро мигрирующего белка. Вместе с тем краситель не должен слишком сильно отрываться от белков, чтобы его прохождению до конца пластины или трубки соответствовало исполь-зование большей частинаходящегося в них геля для фракционирования белков. В щелочных и нейтральных буферах, когда кислые белки заряжены отрицательно и мигрируют к аноду, а также для любых белков в комплексе с ДДС-Na используют отрицательно заряженные красители. Наибольшее распространение получил Бромфеноловый синий, имеющий достаточно сложную структуру; в его состав, в частности, входят два дибромфенольных остатка. Иногда используют еще более сложно построенный краситель — ксиленцианол, электрофоретическая подвижность которого примерно вдвое ниже, чем бромфенолового синего, поэтому его используют при фракционировании крупных белков и нуклеиновых кислот. Для характеристики электрофоретической подвижности белка в данных условиях электрофореза принято указывать отношение расстояния, пройденного белковой полосой от начала рабочего геля, к аналогичному расстоянию до полосы красителя в этом же геле. Это отношение, как и в хроматографии, обозначают Rf В качестве положительно заряженного красителя для электрофореза в кислой среде, когда белки мигрируют в направлении катода, используют метиловый зеленый или пиронин.
В ходе работы был изучен метод электрофореза белков. Использование метода электрофореза в полиакриламидном геле для анализа и разделения сложных смесей белков и нуклеиновых кислот значительно расширило наши знания о белках. Электрофорез в полиакриламидном геле имеет ряд преимуществ перед другими аналитическими методами: он отличается простотой в исполнении, хорошей воспроизводимостью результатов и не требует сложного оборудования.
Все цели и задачи которые были поставлены – изучены.
Список использованных источников.
источник
