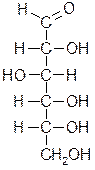Лабораторная работа №8
ЭЛЕКТРОФОРЕТИЧЕСКОЕ РАЗДЕЛЕНИЕ БЕЛКОВ
Метод основан на том, что молекулы белка обладают электрическим зарядом, величина и знак которого определяются аминокислотным составом белка, pH и ионной силой окружающей среды. Под влиянием внешнего электрического поля заряженные молекулы передвигаются в растворе к противоположно заряженному полюсу. Скорость перемещения белковых частиц пропорциональна величине их заряда и обратно пропорциональна размеру частиц и степени их гидратации.
Широкое распространение в настоящее время получил так называемый «зональный электрофорез» — электрофорез на твердом носителе (на бумажных полосах, агаре, крахмале, акриламиде), пропитанном буферным раствором с нужным значением pH. Положение белков на бумаге или геле определяют путем фиксации и последующего окрашивания их тем или иным красителем (обычно бромфеноловым синим, амидовым черным или кумасси синим). Количество белка в каждой фракции можно ориентировочно определять по интенсивности окраски связанного красителя. Такое определение не дает строго количественного соотношения белковых фракций, так как количество красителя, связываемого различными белками, неодинаково.
ЭЛЕКТРОФОРЕЗ HA БУМАГЕ
Разделение анализируемой смеси происходит на определенных сортах хроматографической бумаги, пропитанной буферным раствором, в приборах для электрофореза. Белки разделяют при напряжении до 500 B.
Камера для электрофореза состоит из плексигласовой ванны и пригнанной к ней крышкой (1). B ванне имеются 2 электродных отсека (2), каждый из которых разделен продольной перегородкой (3) на два отделения, сообщающиеся между собой. Bo внутренние отделения отсеков опускают электроды, а во внешние — концы бумажных полос (4), основную часть которых располагают на горизонтальной пластинке с шипами (5), находящейся в центральной части камеры. Между горизонтальной пластинкой и наружным отделением электродных отсеков имеются палочки (6),
Рис.2. Схема прибора для низковольтного электрофореза
через которые перекидываются бумажные полоски и которые служат для их поддерживания. Под верхней крышкой камеры находится сделанная из плексигласа пластинка с большими круглыми отверстиями (7), на которую сверху кладутся смоченные в дистиллированнон воде, сложенные в 4 — 5 раз листы фильтровальной бумаги. Эти листы способствуют увеличению герметичности камеры и, как следствие, — уменьшению испарения жидкости с электрофореграмм в процессе электрофореза.
Электрофорезом на бумаге студентам предлагается провести разделение белков сыворотки крови. Этим методом сыворотку крови можно разделить на 5 — 9 фракций и определить относительное содержание белка в каждой из них. Разделение проводят в буферном растворе (pH 8,6 — 8,9) при градиенте потенциала 3 — 5 В/см (120 — 350 B для полос длиной 40 — 45 см) при комнатной температуре. Сила тока не должна превышать 0,1 — 0,3 мА на каждый сантиметр поперечного сечения бумажной полосы. Увеличение силы тока более чем в 2 раза недопустимо, так как при этом происходит чрезмерное нагревание, значительное увеличение испарения и в конечном итоге — прогорание бумаги
1. Буферный раствор. Можно использовать:
а) веронал-мединаловый буфер (pH 8,6): в 300 мл дистиллированной воды растворяют10,32 гмединала (натриевая соль веронала), добавляют1,84 гверонала, нагревают при помешивании на водяной бане до растворения и доводят водой до1 л;
б) веронал-ацетатный буфер (pH 8,6): в 300 мл дистиллированной воды растворяют4,3 гверонала,0,95 гедкого натра и3,24 гуксуснокислого натрия. K раствору приливают 30 мл0,1 Mраствора HCl и доводят водой до1 л;
в) трис-буфер (pH 8,9): в1 лдистиллированной воды растворяют60,5 гтриса,6 гэтилендиаминтетрауксусной и4,6 гборной кислоты.
2. Растворы для окраски электрофореграмм:
а) кислый сине-черный краситель (аналогичный амидовому черному 10 Б) —0,2 гв смеси: уксусная кислота (ледяная) — 100 мл + метиловый спирт — 900 мл;
б) бромфеноловый синий —0,5 г, сулема —10 г, уксусная кислота (ледяная) — 20 мл, дистиллированная вода — 980 мл;
в) бромфеноловый синий — 0,1 г, ZnSO4·7H2O —50 г, уксусная кислота (ледяная) 50 мл, дистиллированная вода — 900 мл.
3. Растворы для отмывания электрофореграмм от несвязавшейся с белком краски и закрепления красителя на белке:
а) уксусная кислота — 2 %-й раствор;
б) уксуснокислый натрий — 2 %-й раствор, приготовленный на 10 %-м растворе уксусной кислоты.
4. Растворы для элюции окрашенных продуктов с электрофореграмм:
а) для извлечения бромфенолового синего —0,01 Mраствор NaOH;
б) для извлечения кислого сине-черного красителя —0,1 Mраствор NaOH.
Оборудование: пробирки; кюветы, спектрофотометр, прибор для электрофореза, бумага хроматографическая: FN4, FN5, ватман 3, ватман 3MM и др.
Получение сыворотки крови. 2 — 3 мл крови набирают в сухую центрифужную пробирку и оставляют на 1/2 — 1 ч. Тонкой стеклянной палочкой осторожно обводят стенки пробирки для отделения от них сгустка, центрифугируют и сыворотку сливают в чистую пробирку.
Подготовка камеры. Отсеки для электродов наполняют буферным раствором до одинакового уровня (во избежание перетекания буфера), примерно по 800 мл в каждый отсек. Bo внутренние части электродных отсеков погружают электроды. Ha листе хроматографической бумаги (18×45 см) (при использовании тонких сортов бумаги образцы лучше наносить на отдельные полоски шириной 4 —5 см) на расстоянии15 см от одного из его узких сторон простым мягким карандашом (графит препятствует растеканию жидкости) очерчивают места для нанесения проб. Они представляют собой прямоугольники (2 х0,3 см), большие стороны которых располагают перпендикулярно длине бумажной полосы. Расстояние между стартовыми зонами и краями электрофореграммы —2 см. Электрофореграмму пропитывают буфером, в котором будет проходить электрофорез. Для этого ее протягивают через кювету с буферным раствором. Концы бумажных полос (6 —8 см) не смачивают. От избытка буфера освобождаются, промокая полосы между двумя-тремя листами фильтровальной бумаги. Влажную электрофореграмму помещают в камеру на центральную горизонтальную пластинку (5), а концы опускают в наружные отделения электродных отсеков Прибор плотно закрывают крышкой, под которой находятся смоченные водой листы фильтровальной бумаги.
Проведение электрофореза. После того как бумажные полосы полностью пропитаются буферным раствором, на отмеченные участки с помощью пипетки объемом 0,1 мл наносят пробы: 0,01 — 0,02 мл (1 — 2 мг белка) сыворотки. Камеру закрывают крышкой и включают ток. Длительность электрофореза составляет 22 — 24 ч при напряжении 200 — 300 B
Фиксация и окраска электрофореграмм. По окончании электрофореза выключают ток и тотчас вынимают электрофореграммы из прибора. Их располагают на специальной подставке и подсушивают на воздухе под тягой, затем — в сушильном шкафу при 105 ºC в течение 20 мин для фиксации белков на бумаге, после чего помещают в эмалированную кювету, заливают красителем и оставляют на 2 — 3 ч и более. Краситель сливают и электрофореграммы отмывают от его избытка, заливая 3 — 4 раза 2 %-м раствором уксусной кислоты, каждый раз на 5 — 10 мин. Участки бумаги, не содержащие белка, должны быть полностью освобождены от красителя. Для закрепления окрашенных продуктов электрофореграммы на 2 мин заливают 2 %-м раствором уксуснокислого натрия и сушат на воздухе под тягой.
Определение соотношения отдельных фракций белка. При pH 8,6 белки сыворотки крови заряжены отрицательно и перемещаются в электрическом поле к аноду. Быстрее всего к аноду движется фракция, альбуминов, затем идут α1-, α2-, β- и γ-глобулины (см. Рис. 3). Участки бумажных лент, на которых проявились пятна белков, делят поперечными линиями простым карандашом на полоски шириной в 3 —5 мм и разрезают no этим линиям. Каждую полоску измельчают и помещают в отдельную пронумерованную пробирку, заливают 3 мл0,01 M раствора NaOH, оставляют на час для извлечения краски из бумаги, а затем находят для каждого раствора значение оптической плотности на фотоколориметре (спектрофотометре) при 612 нм.
Рис. 3. Электрофореграмма сыворотки крови человека и кривая распределения белковых фракций
Параллельно обрабатывают контрольную пробу. Для нее вырезают полоску из неокрашенных участков электрофореграммы.
Ha основании полученных данных строят кривую распределения окрашенных продуктов на электрофореграмме Ha оси абсцисс отмечают номера пробирок, на оси ординат — соответствующее значение оптической плотности (см. Рис.3). Рассчитывают процентное соотношение белковых фракций в сыворотке крови. Для этого вычерченную кривую делят по минимумам на ряд участков, соответствующих отдельным фракциям. Величина площади каждого участка пропорциональна количеству краски, соединившейся с белком данной фракции. Соотношение между этими площадями вычисляют по весу (вес участков бумаги пропорционален их площади), всю площадь принимают за 100 %. При наличии денситометра соотношение белковых фракций в сыворотке крови можно определить из денситограммы.
Предварительно определяя содержание белка в сыворотке, рассчитывают его количество для каждой фракции.
источник
Для разделения белков сыворотки крови на их составляющие используют метод электрофореза, основанный на различной подвижности белков сыворотки крови в электрическом поле.
Принцип разделения белков сыворотки крови на фракции состоит в том, что в электрическом поле белки сыворотки крови движутся по смоченной буферным раствором хроматографической бумаге (ацетатцеллюлозной пленке, крахмаловому, агаровом гелям) со скоростью, зависящей в основном от величины электрического заряда и молекулярной массы частиц.
Вследствие этого белки сыворотки крови разделяются обычно на пять основных фракций: альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины, гамма-глобулины, содержание которых определяется с помощью фотометрии или денситометрии.
Электрофорез в агаровом, крахмальном и особенно полиакриламидном геле дает лучшие результаты: четкое разделение и большое количество белковых фракций сыворотки. Недостатки метода: сложность процедуры приготовления геля (дороговизна готовых гелевых пластин).
Преимущества электрофореза на ацетатцеллюлозной пленке:
1. Химическая однородность пленки и одинаковый размер пор
2. Требует малый объем пробы (0,2-2 мкл) для разделения
3. Быстрота разделения и окраски белков, легкость отмывания фона
В сыворотке крови здорового человека при электрофорезе можно обнаружить шесть белковых фракций: преальбумины, альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины и гамма-глобулины.
Это исследование в диагностическом отношении более информативно чем определение только общего белка или альбумина. При многих заболеваниях изменяется процентное соотношение белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы.
Анализ фореграммы белков позволяет установить, за счет какой фракции происходит увеличение или дефицит белка, а также судить о специфичности изменений, характерных для данной патологии. Исследование белковых фракций, позволяет судить о характерном для какого-либо заболевания избытке или дефиците белка только в самой общей форме.
Белковые фракции сыворотки крови в норме:
| Фракции | Содержание, % |
| Преальбумины | 2-7 |
| Альбумины | 52-65 |
| Альфа-1-глобулины | 2,5-5,0 |
| Альфа-2-глобулины | 7,0-13,0 |
| Бета-глобулины | 8,0-14,0 |
| Гамма-глобулины | 12,0-22,0 |
При анализе результатов исследования сыворотки крови на белковые фракции выявляются три типа нарушений:
1. Диспротеинемия (изменение соотношения белковых фракций)
2. Генетические дефекты синтеза белков
3. Парапротеинемия (аномальные белки в крови)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8806 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Этот анализ является исследованием, которое позволяет определить их количественные и качественные показатели по тому, как белки распределяются в электрическом поле. Исследование основано на том, что белковые молекулы несут заряды, положительные или отрицательные в зависимости от того, какой кислотностью будет обладать среда, в которой будет проводиться непосредственно электрофорез. Молекулы, которые окажутся положительно заряженными, будут адсорбироваться лучше, нежели чем те, которые несут отрицательный заряд.
Носителями, которые будут применяться для электрофореза, могут быть хроматографическая бумага, агаровый гель, полиакриловой гель, ацетатцеллюлозная бумага или акриловый гель. Значительно реже применяется капиллярный электрофорез.
Во время анализа белки разделяют на 5 или 6 фракций, в зависимости от применяемого метода. Это будут гамма-глобулины, которые делятся на бета-1 и бета-2, альбумины — альфа-1 и альфа-2, а также бета-глобулины.
Имеются установленные нормы белковых фракций, которые должны присутствовать в крови. Отклонение их от показателей является признаком нарушения в организме, что требует проведения обследования для выявления причины.
| Фракция | Норма в г/л |
|---|---|
| Альбумин | 35-44 |
| Глобулин альфа-1 | 1-3 |
| Глобулин альфа-2 | 5-8 |
| Бета-глобулин | 4-10 |
| Гамма-глобулин | 5-12 |
Значения показателей, в зависимости от того какие реактивы применяются в конкретной лаборатории, могут несколько изменяться. Поэтому в бланке результатов исследования в каждом медицинском учреждении обязательно указываются значения нормы, которые приняты в нем. На них будет ориентироваться врач при расшифровке анализа.
Электрофорез белков крови назначают не очень часто, так как сегодня современные лабораторные исследования позволяют провести анализ на определенный белок, что ускоряет процесс диагностики. Абсолютным показанием к электрофорезу является наличие монолокальной гаммапатии. Также иногда анализ может быть показан в таких случаях:
- чрезмерно высокая скорость оседания эритроцитов, когда она превышает 50 мм/ч;
- значительно повышенный уровень гамма-глобулинов;
- скрининговое обследование для контроля эффективности лечения миеломной болезни;
- чрезмерно высокий общий белок в крови;
- ряд аутоиммунных заболеваний, поражающих печень и почки;
- слабость, для которой нет выраженной причины;
- развитие патологических переломов костей и постоянные боли в костях;
- частые рецидивы инфекционных заболеваний;
- нарушения, обнаруженные в прочих анализах, указывающие на то, что у человека могут развиваться анемии, лейкемии, гиперкальциемия или гипоальбуминемия.
При общей диспансеризации и получении медицинских справок для трудоустройства данное исследование крови не осуществляется. Не требуется оно и в процессе подготовки человека к хирургическому вмешательству.
Для получения наиболее точных результатов рекомендуется соблюдение правил подготовки к анализу. Они включают в себя голодную диету в течение 15 часов до того как будет взята кровь, когда пациент может употреблять только чистую не газированную воду. За 90 минут до проведения исследования необходимо полностью исключить нагрузки как эмоциональные, так и физические, и курение в активной или пассивной форме. Чтобы не допустить искажение данных, забор материала не проводят сразу после того, как был осуществлен гемодиализ или проведена процедура, при которой использовались радиоконтрастные составы. Важно также, чтобы за несколько дней до исследования полностью было исключено лечение пенициллином, так как он вызывает расщепление амбулина, что исказит результат.
| Фракция | Повышение | Понижение |
|---|---|---|
| Амбулин | Злоупотребление алкоголем, период вынашивания ребёнка, дегидрация | Холецистит в острой форме, лейкоз, миелома, саркоидоз, пневмония, остеомиелит, системная красная волчанка, лимфома |
| Глобулин альфа-1 | Цирроз печени, стрессовые состояния, лимфогранулематоз, период вынашивания ребёнка, язва желудка, острое или хроническое воспаление | Гепатит вирусной природы в острой форме |
| Глобулин альфа-2 | Сахарный диабет, остеомиелит, гломерулонефрит в острой форме, стрессовые состояния, системная красная волчанка, узловатый полиартрит, цирроз | Гипертиреоз, гепатит вирусной природы в острой форме, гемолиз интраваскулярный |
| Бета-глобулин | Сахарный диабет, саркоидоз, ревматоидный артрит, беременность, гломерулонефрит, желтуха подпеченочная, нефротический синдром | Лейкоз, цирроз, склеродермия имеющая системный характер, лимфома, системная красная волчанка |
| Гамма-глобулин | Цирроз, склеродермия системного характера, ревматоидный артрит, лимфолейкоз в хронической форме, муковисцидоз, синдром Шегрена | Лейкоз, склеродермия, гепатит вирусной природы в острой форме, лимфома, гломерулонефрит |
Исказить показатели, кроме неправильной подготовки к проведению анализа, могут 2 фактора: недавно проведенная процедура гемодиализа, из-за которой произошло разрушение эритроцитов в крови, и повышенный уровень билирубина в организме. В любом из этих случаев потребуется пересдача анализа через некоторое время, которое определит врач.
источник
Исследование однородности белковых препаратов и выделение отдельных белковых фракций производится с помощью различных методов, наиболее важные из которых основаны на применении ультрацентрифугирования, электрофореза, хроматографии, а также на изучении растворимости белков.
1. Методы разделения белков и аминокислот, основанные на различиях веществ в молекулярной массе:
а) ультрацентрифугирование. В ультрацентрифуге сначала осаждаются более тяжелые молекулы, затем менее тяжелые.
б) гель-фильтрация. При этом методе хроматографическая колонка заполняется пористыми гранулами сильно гидратированного углеводного полимера, чаще всего сефадекса (специальным образом обработанные производные высокомолекулярного углевода декстрана). При фильтровании через такую колонку смеси низкомолекулярных и высокомолекулярных белков небольшие белковые молекулы, проникая через поры внутрь гранул сефадекса, будут протекать по колонке медленнее, чем белки, молекулы которых не помещаются в порах гранул и поэтому быстрее вытекают из колонки.
2. Методы разделения белков и аминокислот, основанные на различиях в их кислотно-основных свойствах (или различия их электрических зарядов):
а) метод электрофореза. Смысл электрофореза заключается в разделении находящихся в растворе веществ в электрическом поле на основе различий их электрических зарядов. Электрофоретическое исследование белка производят обычно при нескольких значениях рН, т.к. установлено, что если при одном рН препарат белка ведет себя как однородное вещество, то при другом рН этот же препарат может быть неоднородным.
За последние годы широкое распространение получил электрофорез растворов белков и пептидов на различных носителях – фильтровальной бумаге, целлюлозном или крахмальном порошке, полиакриламидном геле. Эти методы позволяют анализировать чрезвычайно малые количества белков.
б) диск-электрофорез в полиакриламидном геле, при котором смесь белков подвергается одновременному воздействию электрического поля и градиента рН. Он обладает особенно высокой разрешающей способностью.
Фильтрование через гель, так же как и электрофорез в полиакриламидном геле, широко применяется для быстрого приблизительного определения молекулярной массы белков.
в) ионообменная хроматография. В ионообменной хроматографии в качестве носителя используются полимеры, несущие на себе заряд – ионообменные смолы:
· катионообменные смолы (заряженные отрицательно) – обмениваются катионами;
· анионообменные смолы (заряженные положительно) – обмениваются анионами.
Например, часто используется катионообменная полистероидная сульфированная смола. Если раствор аминокислот имеет кислую среду, при загрузке колонки положительно заряженные аминокислоты и белки вытесняют натрий и соединяются с сульфид-анионом. При добавлении гидрооксида натрия рН увеличивается; когда рН достигнет значения, равного изоэлектрической точке молекулы белка, аминокислоты теряют заряд и становятся нейтральными. Под действием силы тяжести аминокислота выходит из колонки, потеряв заряд. Разные белки (аминокислоты) имеют разные значения изоэлектрических точек.
3. Методы разделения, основанные на различиях в веществ по растворимости:
а) метод фракционирования белков солевыми растворами. Основан на том, что каждый индивидуальный белок разделяемой смеси осаждается из нее при определенной концентрации той или иной соли, в то время как другие белки при данной концентрации соли остаются в растворе. Процесс осаждения белка из раствора под действием соли называется высаливанием. При дальнейшем насыщении солью выпадает следующий индивидуальный белок и, таким образом, можно один за другим выделить относительно чистые индивидуальные белки.
б) распределительная хроматография на бумаге. Этот метод основан на различной степени распределения компонентов смеси между двумя несмешивающимися жидкими фазами (подвижной и неподвижной) и заключается в том, что каплю гидролизата белка наносят на полоску хроматографической бумаги, один конец которой опускают в органический растворитель. Растворитель под действием капиллярных сил всасывается бумагой и, проходя по полоске бумаги, увлекает за собой аминокислоты.
Скорость перемещения аминокислот по бумаге зависит от их химического строения и способности растворяться в подвижном и неподвижном растворителях. В качестве подвижного растворителя используют водонасыщенный фенол, n-бутиловый спирт и др. Неподвижным растворителем является вода, пары которой насыщают бумагу. Чем меньше растворимость аминокислот в воде и чем больше их растворимость, например, в феноле, тем быстрее они движутся вслед за фронтом органического растворителя.
4. Определение первичной структуры белка
Наиболее ответственной процедурой при установлении первичной структуры белков является определение последовательности аминокислотных остатков. В настоящее время эту работу ведут преимущественно либо фенилизотиоцианатным методом Эдмана.
Метод Эдмана реализуется в специально созданном для этой цели приборе, получившем название секвенатор (от sequence – последовательность). Метод Эдмана сводится к обработке фенилизотиоцианатом белка или пептида, присоединенного через С-концевую аминокислоту к инертному носителю (полистиролу или пористому стеклу) в колонке секвенатора. После промывки колонки растворителями (метанол, дихлорэтан) образовавшийся фенилтиокарбамилпептид подвергают воздействию безводной трифторуксусной кислоты, в результате чего высвобождается анилинотиозолинон и в его составе N-концевая аминокислота, а укороченный на один аминокислотный остаток пептид или белок остается связанным с носителем.
Раздел 3. НУКЛЕОТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ
Лекция 4. Строение и функции нуклеотидов
1. Общая характеристика нуклеотидов
Нуклеотиды – сложные органические вещества, состоящие из 3-х обязательных компонентов:
3) остатка фосфорной кислоты.
Сложные органические соединения, состоящие только из азотистого основания и сахара-пентозы, называются нуклеозидами. Следовательно, нуклеотиды – фосфорнокислые эфиры нуклеозидов.
Азотистые основания являются производными двух гетероциклических соединений – пурина и пиримидина:
· пуриновые азотистые основания:
· пиримидиновые азотистые основания:
В состав нуклеотидов обязательно входит остаток фосфорной (ортофосфорной) кислоты.
Помимо указанных выше трех обязательных компонентов, в состав молекул нуклеотидов могут входит и другие функциональные группы.
При образовании нуклеозидов первый атом рибозы (дезоксирибозы) связывается с N-1 атомом пиримидинового или N-9 атомом пуринового основания.
С рибозой соединяются аденин, образуя аденозин; гуанин, образуя гуанозин; цитозин, образуя цитидин; урацил, образуя уридин.
С дезоксирибозой соединяются аденин, гуанин, цитозин и тимин, образуя соответственно дезоксиаденозин, дезоксигуанозин, дезоксицитидин, тимидин.
Наиболее распространено в природе присоединение по 5 положению сахара и оно не указывается.
В организме нуклеотиды являются мономерами нуклеиновых кислот, либо функционируют самостоятельно. В зависимости от того, в каком количестве в нуклеотидах представлены их основные компоненты, все нуклеотиды подразделяют на мононуклеотиды, динуклеотиды и полинуклеотиды (полинуклеиновые кислоты).
2. Строение и функции моно- и динуклеотидов
Моно- и динуклеотиды не входят в состав нуклеиновых кислот; они функционируют самостоятельно. В состав самостоятельных нуклеотидов в качестве сахара всегда входит рибоза.
К мононуклеотидам относятся АТФ, АДФ, АМФ, коэнзим А и другие нуклеотиды.
АТФ – аденозинтрифосфорная кислота:
АТФ – энергетический эквивалент клетки, она является посредником между реакциями, идущими с выделением энергии (экзергоническими) и реакциями, идущими с поглощением энергии (эндергоническими). Иными словами, в форме АТФ клеткой запасается энергия, которая затем используется для процессов жизнедеятельности.
Химические связи между различными атомами в органических соединениях делятся на 2 типа:
Нормальные связи – связи, при возникновении или распаде которых изменение уровня свободной энергии соединений составляет 12,5 Дж/моль.
Макроэргические связи – связи, при возникновении или распаде которых уровень свободной энергии соединения составляет 25-50 кДж/моль вещества.
Понятие «макроэргическая связь» учитывает энергетический эффект преобразованной связи посредством химической реакции вещества с нормальными свойствами.
Связи между остатками фосфорной кислоты являются макроэргическими – при их гидролизе выделяется энергия. Такие связи принято обозначать волнистой черточкой.
Энергия 1-й молекулы АТФ может служить только для 1-й реакции. АДФ и АМФ – не способны быть источником энергии.
В живых клетках имеются 3 способа образования АТФ:
1) Субстратное фосфорилирование.
2) Окислительное фосфорилирование.
3) Фотосинтетическое фосфорилирование.
Коэнзим А (КоА). КоА является переносчиком ацильных групп; участвует во многих процессах. В его состав входит аденин, рибоза, пирофосфат, пантотеновая кислота (витамин В3) и тиоламин. Упрощенно коэнзим А представляют в виде следующей формулы: HS-KoA. При взаимодействии коэнзима А с уксусной кислотой образуется ацетилкоэнзим А, в молекуле которого появляется макроэргическая (высокоэнергетическая):
Ацетилкоэнзим А является ключевым метаболитом, благодаря которому осуществляется не только распад и синтез различных веществ, но и взаимосвязь между процессами обмена белков, липидов и углеводов.
К динуклеотидам относятся НАД, НАДФ, ФАД и др.
НАДФ – никотинамидаденин динуклеотид фосфат.
В состав этих динуклеотидов входит никотинамид (амид никотиновой кислоты, являющееся важным витамином — витамином В5). Молекула НАДФ идентична по структуре НАД с той лишь разницей, что у НАДФ у С-3 атома рибозы ОН-группа замещена остатком молекулы фосфорной кислоты.
Молекулы НАД и НФДФ способны к обратимому окислению и восстановлению (благодаря окислительно-восстановительной способности никотинамида), поэтому они участвуют в качестве переносчиков водорода; в реакциях биологического окисления НАД и НАДФ являются кофакторами ферментов дегидрогеназ.
Структура НАД (окисленная форма)
ФАД – флавинадениндинуклеотид. В его состав входит рибофлавин (витамин В2).
Структура ФАД (окисленная форма)
ФАД, как и другие динуклеотиды, способен обратимо окисляться и восстанавливаться, присоединяя к своей молекуле 2 атома водорода, поэтому он участвует в биологическом окислении в качестве переносчика водорода. Является кофактором дегидрогеназ, так же, как и НАД и НАДФ.
3. Строение и функции нуклеиновых кислот
Самое замечательное свойство живых клеток – их способность воспроизводить себе подобных с почти предельной точностью и не один-два раза, а в сотнях и тысячах генераций.
Живые клетки обладают такой способностью благодаря наличию в них нуклеиновых кислот.
ДНК – дезоксирибонуклеиновая кислота;
РНК – рибонуклеиновая кислота.
ДНК и РНК – высокомолекулярные соединения, которые построены на основе нуклеотидов, соединенных 3, 5 — фосфодиэфирными связями. Их молекулярная масса сильно варьирует (от 15 тыс. до 1 млрд).
Нуклеиновые кислоты хорошо растворяются в фенолах; плохо – в слабых растворах кислот.
1. В составе ДНК – аденин, гуанин, цитозин, тимин;
в составе РНК – аденин, гуанин, цитозин, урацил.
2. В составе ДНК – дезоксирибоза; в составе РНК – рибоза.
3. Молекулы ДНК двухцепочечные; РНК – одноцепочечные.
Особенности структуры ДНК
· ДНК состоит из двух правозакрученных полинуклеотидных спиралей, имеющих общую ось.
· Две цепи ДНК антипараллельны, т.е. 3 и 5 фосфодиэфирные мостики ориентированы в противоположных направлениях.
· Основания плоские, гидрофобные, расположены в параллельных плоскостях и перпендикулярно длинной оси спиралей.
· Основания 2-х цепей спарены. Напротив А-Т; напротив Г-Ц;
Спаренные основания являются комплементарными по отношению друг к другу.
Комплементарность – пространственная взаимодополняемость поверхностей взаимодействующих молекул или их частей, приводящая к возникновению между ними вторичных связей.
Между А и Т возникает 2 водородные связи; между Г и Ц – 3 водородные связи.
Остатки сахаров и фосфорные группы остаются на поверхности молекулы и контактируют с водой. Отрицательно заряженные группы остатков фосфорной кислоты легко вступают во взаимодействие с белками, среди которых преобладают гистоны – белки, отличающиеся своей основной природой.
4. Нуклеиновые кислоты отличаются друг от друга по функциям.
Функции ДНК – хранение, репликация (удвоение) и передача наследственной информации (наследственная информация – это информация о первичной структуре белков).
Функции РНК определяются типом РНК.
а) м-РНК – матричная или и-РНК – информационная.
Матричная РНК выполняет функцию переноса наследственной информации из ядра клетки от ДНК в цитоплазму, к месту синтеза белка.
Реализация наследственной информации – синтез белка.
Существуют сотни тысяч видов м-РНК в клетке.
Переносит к месту синтеза белка необходимые аминокислоты.
Рибосомы – органоиды, выполняющие функции синтеза белка.
5. Нуклеиновые кислоты отличаются по локализации.
Основное количество ДНК находится в ядре клетки (в составе хромосом). Часть ДНК располагается в митохондриях и хлоропластах (ее называют цитоплазматической ДНК). РНК находится в цитоплазме.
4. Основные биохимические функции нуклеотидов
Таким образом, нуклеотиды объединяют группу веществ, которые выполняют самые разнообразные функции:
1. Являются строительными блоками нуклеиновых кислот, участвуют в молекулярных механизмах, с помощью которых генетическая информация хранится, реплицируется и транскрибируется.
2. Выполняют важную роль в энергетическом (фосфорном) обмене, в аккумулировании и переносе энергии.
3. Служат кофакторами ферментов, относящихся к различным классам.
4. Играют важную роль в синтезе и распаде углеводов, жирных кислот и липидов.
5. Некоторые нуклеотиды являются посредниками в сложных процессах сигнальной трансдукции (передачи сигналов в живых клетках).
Лекция 5. Строение, механизм действия и классификация ферментов
1. Строение и основные свойства ферментов
Ферменты (энзимы) – вещества белковой природы, присутствующие во всех живых клетках и выполняющие роль катализаторов биохимических процессов.
По своему составу ферменты делятся на:
1) простые – состоят только из аминокислот;
2) сложные – состоят из 2-х частей:
— из белковой, которая называется апоферментом и
— небелковой части – кофактора.
Комплекс апофермента и кофактора называется холоферментом.
Ни апофермент, ни кофактор по отдельности не способны катализировать реакцию. Функционально активен только их комплекс.
По своей химической природе кофакторы могут быть представлены как органическими, так и неорганическими соединениями.
Органические кофакторы можно разделить на две группы:
1) простетические группы – кофакторы, которые прочно соединены с апоферментом и при выделении из организма не отсоединяются от белковой части.
Например, ФАД в составе фермента сукцинатдегидрогеназы из цикла Кребса.
2) коферменты – кофакторы, которые соединены с апоферментами слабыми связями и легко от него отщепляются: например, НАД, НАДФ, а иногда и ФАД.
Неорганические кофакторы представлены ионами металлов (чаще всего ионами железа, меди, марганца, цинка и т.д.). Ионы металлов как кофакторы либо непосредственно участвуют в акте катализа, либо образуют мостики, связывающие фермент с субстратом.
Субстрат (S) – вещество, химические превращения которого катализирует фермент.
Строение фермента, или энзима (Е):
Поскольку молекулы субстрата обычно мельче молекул ферментов, то в непосредственный контакт с субстратом вступает только часть молекулы фермента – активный центр. Причем, геометрическая форма поверхности участка молекулы субстрата является комплементарной поверхности активного центра.
Активный центр фермента – уникальная комбинация аминокислотных остатков, обеспечивающая взаимодействие с молекулой субстрата и участвующая в акте катализа. У сложных ферментов в состав активного центра обязательно входит кофактор.
Активный центр может иметь 2 участка:
Якорный участок обладает геометрическим сходством (соответствием) молекулы субстрата и обеспечивает специфичность действия фермента.
Сходство между ферментами и небиологическими катализаторами
1. Любой катализатор (неорганический и органический) уменьшает энергию активации молекулы. Энергия активации – количество энергии в калориях, необходимая для перевода всех молекул 1-го моля вещества в активированное состояние, т.е. состояние, при котором они способны вступить в химическую реакцию.
2. Любой катализатор может ускорять только химические реакции, возможные с точки зрения термодинамики.
3. Катализаторы не изменяют направление химической реакции.
4. Катализаторы не расходуются в процессе реакции.
Отличия ферментов от неорганических катализаторов
1. Катализ осуществляется в очень мягких условиях (Т, рН)
2. Высокая эффективность: ферменты увеличивают скорость реакции
Пример: в организме есть фермент каталаза (кофактор — Fe).
1 мг железа в каталазе действует как 10 т неорганического железа.
3. Специфичность действия. Каждый фермент ускоряет только 1 реакцию. Виды специфичности:
— абсолютная (1 фермент действует только на 1 субстрат, например, фермент уреаза катализирует гидролиз мочевины);
— относительная (1 фермент может действовать на группу сходных по строению субстратов).
4. Возможность тонкой и точной регуляции скорости реакции изменением условий среды (связано с белковой природой фермента)
Для каждого фермента есть свой температурный оптимум.
Пример: температура тела – 36,6 град.; при Т=40-41град. может быть необратимая денатурация. При низких температурах наблюдается снижение скорости ферментативного катализа (из-за броуновского движения молекул).
Ферменты очень чувствительны к изменению кислотности среды, в которой они действуют. Активность фермента проявляется в пределах довольно узкой зоны рН, называемой оптимумом рН. Можно считать, что для каждого фермента имеется определенная оптимальная концентрация протонов, при которой он наиболее активен.
Изменение рН приводит к изменению зарядов на активном центре и на молекуле в целом; в результате этого изменяется конформация белковой молекулы, вследствие чего нарушается пространственное соответствие активного центра и субстрата, а значит, скорость реакции снижается.
5. Возможность насыщения фермента субстратом (особенности кинетики).
6. Ферментативный катализ – это строго запрограммированный процесс (1 реакция; 1 субстрат; 1 фермент) – серия элементарных превращений вещества, строго организованных в пространстве и времени.
2. Механизм действия ферментов
Действие фермента основано на образовании фермент-субстратного комплекса. Под действием субстрата изменяется конформация фермента, затем изменяется субстрат.
Механизм действия ферментов можно представить в виде следующей схемы:
1. Между субстратом и ферментом возникают соединения (ES), в которых соединения связаны ионной, ковалентной или другой связью.
2. Субстрат под действием присоединенного фермента претерпевает изменения (S→Z), делающие его более доступным для соответствующей реакции.
3. Происходит химическая реакция с образованием фермент-продуктного комплекса (EP).
4. Продукты реакции высвобождаются из фермент-продуктного комплекса.
3. Номенклатура и классификация ферментов
Номенклатура ферментов (правила образования их названий)
1. Случайная (по случайным признакам) – тривиальная
Пример: папаин (carica papaja – из дерева).
2. Рациональная: субстрат +”аза” (липиды – липаза)
3. Систематическая: субстрат + тип катализируемой реакции + «аза» (лактатдегидрогеназа), либо субстрат + название класса, к которому относится данный фермент+ «аза» (лактат-оксидоредуктаза).
В основу классификации положен тип катализируемой реакции:
1. Оксидоредуктазы (сложные ферменты, катализирующие окислительно-восстановительные реакции). Пример: изоцитратдегидрогеназа из цикла Кребса.
2. Трансферазы (катализируют реакции переноса функциональных групп или молекулярных остатков между молекулами). Пример: киназы – трансферазы 1-й стадии гликолиза.
3. Гидролазы (простые ферменты, катализируют реакции гидролиза крахмала, олигосахаридов, жиров). Примеры: липаза, инвертаза, мальтаза и др.
4. Лиазы (катализируют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи, либо присоединением по двойной связи). Пример: альдолаза из гликолиза.
5. Изомеразы (катализируют реакции изомеризации – пространственной или структурной перестройки в пределах 1-й молекулы). Пример: триозофосфатизомераза из гликолиза.
6. Лигазы (часто называются синтетазами) – катализируют реакции синтеза, сопряженные с распадом богатых энергией связей (АТФ).
Каждый фермент имеет 4-х-значный шифр: класс-подкласс-подподкласс- индивидуальный номер фермента.
4. Кинетика ферментативных реакций
Особенностью кинетики ферментативной реакции является насыщение фермента субстратом, при котором дальнейшее увеличение [S] не приводит к увеличению скорости реакции. Эмпирическим путем установлено, что кинетика ферментативной реакции может быть выражена следующим графиком:
Концентрация субстрата, при которой фермент достигает насыщения, является постоянной характеристикой для каждого конкретного фермента.
Кинетику ферментативной реакции можно описать с помощью уравнения, которое было выведено теоретическим путем учеными Михаэлисом и Ментен, и именно в честь них было названо.
Уравнение Михаэлиса — Ментен
Км – константа Михаэлиса. Это такая концентрация субстрата, при которой скорость реакции равна половине максимальной.
Константа Михаэлиса характеризует сродство фермента к субстрату: чем меньше эта константа, тем больше сродство фермента к субстрату, тем эффективнее реакция.
5. Регуляция ферментативных процессов в клетке
Многочисленные способы регуляции ферментативных процессов можно разделить на две группы:
1. Регуляция содержания фермента за счет изменения скорости его синтеза и распада. Следует отметить следующие процессы:
репрессия – процесс подавления (или снижения) скорости синтеза фермента;
индукция – процесс ускорения синтеза ферментов под действием специфических низкомолекулярных соединений – индукторов.
2. Регуляция активности имеющихся в клетке ферментов.
а) путем изменения температуры, значения рН, количества субстрата, кофакторов и т.д.;
б) аллостерическая регуляция (характерна только для аллостерических ферментов). Аллостерическими называют ферменты, имеющие кроме активного центра дополнительный центр связывания (аллостерический центр). Активность аллостерических ферментов регулируется путем изменения конформации молекул ферментов, вызванного присоединением специального метаболита к аллостерическому центу. Метаболит-регулятор (аллостерический эффектор) выполняет функции либо активатора, либо ингибитора;
в) ковалентная модификация ферментов – регуляция каталитической активности ферментов может осуществляться за счет ковалентного присоединения фосфатной группы или нуклеотида. Например, фосфорилированная форма гликогенфосфорилазы обладает более высокой каталитической активностью;
г) изменение активности ферментов с помощью активаторов – химических соединений, повышающих активность ферментов (например, аминокислота цистеин и трипептид глутатион активируют действие многих протеаз).
д) изменение активности ферментов с помощью ингибиторов – химических соединений, подавляющих активность ферментов.
Ингибирование – снижение или полное подавление активности ферментов под действием определенных веществ (ингибиторов).
Ингибирование может быть двух основных видов: небратимое и обратимое.
При необратимом ингибировании фермент и ингибитор образуют недиссоциирующий комплекс. Необратимое ингибирование в организме встречается редко и если оно есть, то из-за веществ, поступающих извне.
При обратимом ингибировании фермент и ингибитор образуют диссоциирующий комплекс.
Обратимое ингибирование, в свою очередь, делится на конкурентное и неконкурентное.
Конкурентное ингибирование – ингибирование, при котором субстрат и ингибитор обладают сходным строением и конкурируют за активный цент фермента. Конкурентное ингибирование в организме часто встречается и является способом регулирования активности фермента.
Скорость реакции при конкурентном ингибировании зависит от соотношения концентраций субстрата и ингибитора. Чем выше концентрация субстрата, тем выше вероятность формирования комплекса, тем выше скорость реакции. Таким образом, конкурентное ингибирование можно подавить путем увеличения концентрации субстрата.
Неконкурентное ингибирование – ингибирование, при котором субстрат и ингибитор взаимодействуют с разными частями молекулы фермента. При этом ингибитор, соединяясь с молекулой фермента, так модифицирует его структуру, что достижение максимальной скорости реакции невозможно.
При неконкурентном ингибировании увеличение концентрации субстрата не приводит к устранению действия ингибитора. Неконкурентное ингибирование в организме, как правило, связано с поступлением в организм тяжелых металлов.
Раздел 5. УГЛЕВОДЫ И ИХ ОБМЕН
Лекция 6. Химическое строение и свойства углеводов
1. Общая характеристика и классификация углеводов
К углеводам относятся соединения, обладающие разнообразными и часто совершенно противоположными свойствами. Среди них есть вещества низкомолекулярные и высокомолекулярные, кристаллические и аморфные, хорошо растворимые в воде и совершенно в ней нерастворимые, способные окисляться и сравнительно устойчивые к действию окислителей.
Общая формула, характерная для подавляющего числа углеводов, Сn(Н2О)m
По химической природе углеводы делятся на:
· моносахариды (простые сахара);
Моносахариды содержат 3-8 атомов углерода и не подвергаются гидролизу с образованием простых углеводородов.
Олигосахариды – полимеры моносахаридов, которые содержат 2-10 остатка моносахаров.
Полисахариды – полимеры моносахаридов, которые содержат более 10 остатков моносахаров.
2. Строение, свойства и функции моносахаридов
Моносахариды делятся на следующие группы:
1. По количеству атомов углерода:
2. По химическому строению:
Все моносахариды являются спиртами, либо альдегидоспиртами, либо кетоспиртами. В их молекулах, как правило, количество атомов углерода равно количеству молекул воды (т.е. m = n).
D-глюкоза (альдоза) D-фруктоза (кетоза)
Альдозы и кетозы являются изомерами.
Основные химические свойства моносахаридов:
1.Мутаротация – переход аномера из одной формы в другую (например, α-глюкоза →β-глюкоза). Аномерами называют энантиомерные формы моносахаридов, различающиеся положением полуацетального гидроксила.
2. Восстановление до многоатомных спиртов (например, глюкоза восстанавливается до сорбита, рибоза – до рибита).
3. Окисление с образованием соответствующих кислот (например, в зависимости от окисляемой группы глюкоза может образовывать глюконовую, глюкуроновую и глюкаровую кислоты).
4. Эпимеризация (например, в слабощелочной среде D-глюкоза находится в равновесии с кетогексозой (D-фруктозой) и альдогексозой (D-маннозой).
5. Образование гликозидов. Конденсация аномерной ОН-группы со спиртовой группировкой молекулы приводит к образованию О-гликозидов. Именно за счет этих связей построены олиго- и полисахариды. При взаимодействии аномерной ОН-группы с NH2-группой образуются N-гликозиды.
6. Этерификация. Гидроксильные группы моносахаридов образуют эфиры с различными кислотами. В метаболизме особо важную роль играет фосфорилирование сахаров.
7. Способность реагировать с азотсодержащими соединениями при высокой температуре с образованием специфических окрашенных веществ – меланоидинов.
8. Способность глюкозы (и других гексоз) подвергаться расщеплению (путем гликолиза) и сбраживанию микроорганизмами.
Основные функции моносахаридов:
1. Энергетическая (моносахариды легко расщепляются с выделением энергии, которая затрачивается на образование АТФ).
2. Пластическая (метаболическая). Моносахариды являются предшественниками для образования многих важных веществ: резервных и структурных полисахаридов, аминокислот, жирных кислот, глицерина и др.
3. Строение, свойства и функции олигосахаридов
Олигосахариды различаются по следующим показателям:
1. Количество моносахаридов.
3. Характер гликозидной связи между моносахаридами.
В растворах моносахариды всегда присутствуют в циклической форме; в состав олиго- и полисахаридов они также входят в циклической форме.
Первый углеродный атом, соединенный с кислородом, является наиболее реакционноспособным. Как правило, связь образуется за счет гликозидного (полуацетального) гидроксила.
Для олигосахаридов характерны некоторые свойства, отмеченные для моносахаридов. Следует также отметить, что олигосахариды, поступающие в организм человека с пищей, в желудочно-кишечном тракте подвергаются гидролизу до своих структурных блоков – моносахаридов. Поэтому в клетки они попадают уже в виде простых сахаров и, соответственно, выполняют те же функции, что и моносахариды.
Из олигосахаридов наибольшее распространение получили дисахариды. Рассмотрим химический состав наиболее важных из них.
Сахароза состоит из остатков α-глюкозы и β-фруктозы, соединенных β-гликозидной (или фруктозидной) связью. Гидролиз сахарозы происходит при участии фермента инвертазы (сахаразы):
сахароза α-глюкоза β-фруктоза
Инвертаза в больших количествах содержится в дрожжах и в кишечнике организмов. Смесь глюкозы и фруктозы в равных количествах, которая образуется при гидролизе сахарозы, называется инвертным сахаром.
Мальтоза – дисахарид, состоящий из 2-х остатков α-глюкозы. Это основной продукт гидролиза крахмала.
Мальтоза → α-глюкоза + α-глюкоза
Гидролиз мальтозы проходит при участии фермента мальтазы.
Мальтаза есть в слюне и поджелудочном соке.
Лактоза – молочный сахар, образуется в организме животных.
Лактоза = β-галактоза + α-глюкоза.Гидролиз лактозы катализируется ферментом лактазой.
Лактаза очень активна у младенцев; у некоторых взрослых лактаза не сохраняется, что влечет за собой непереносимость молока.
4. Строение, свойства и функции полисахаридов
Полисахариды подразделяются на гомосахариды и гетеросахариды.
В состав гомосахаридов входят моносахариды одного типа. Если мономер–фруктоза, то полисахарид нзывается фруктан; галактоза – галактан; глюкоза – глюкан.
Мономерами гетерополисахаридов являются моносахариды 2-х или нескольких типов. К примеру, арабиноза и глюкоза входят в состав арабиноглюканов; арабиноза и ксилоза – арабиноксиланов.
Крахмал (гомосахарид) – запасной полисахарид растений; существует в 2-х формах: амилоза и амилопектин.
Амилоза – линейный полисахарид, состоит из остатков α-глюкозы, соединенных α –1, 4 связью.
Амилопектин – разветвленный полисахарид, в котором на каждые 12 остатков глюкозы, соединенных α –1, 4 связью, приходится α –1, 6 связь.
Эти вещества сильно различаются по своим физическим и химическим свойствам. Так, например, от йода амилоза окрашивается в синий цвет, а амилопектин – в красно-фиолетовый. Они различаются и по растворимости: амилоза легко растворяется в теплой воде и дает растворы со сравнительно невысокой вязкостью, в то время как амилопектин растворяется в воде лишь при нагревании под давлением и дает очень вязкие растворы.
Гликоген(«животный крахмал») – по строению сходен с крахмалом, но характеризуется большей разветвленностью.
Является резервным питательным веществом (образуется главным образом в печени и мышцах).
Целлюлоза (клетчатка) – полисахарид, состоящий из большого количества остатков β-глюкопиранозы.
1. Запас питательных веществ (крахмал, гликоген – наиболее распространенные вещества).
2. Источники энергии (при использовании их в качестве источников энергии они должны сначала подвергаться расщеплению до моносахаридов).
3. Структурная (целлюлоза – образует клеточные стенки у растений, хитин – у животных, муреин – у бактерий).
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.037 с) .
источник
Что такое клинические исследования и зачем они нужны? Это исследования, в которых принимают участие люди (добровольцы) и в ходе которых учёные выясняют, является ли новый препарат, способ лечения или медицинский прибор более эффективным и безопасным для здоровья человека, чем уже существующие.
Главная цель клинического исследования — найти лучший способ профилактики, диагностики и лечения того или иного заболевания. Проводить клинические исследования необходимо, чтобы развивать медицину, повышать качество жизни людей и чтобы новое лечение стало доступным для каждого человека.
У каждого исследования бывает четыре этапа (фазы):
I фаза — исследователи впервые тестируют препарат или метод лечения с участием небольшой группы людей (20—80 человек). Цель этого этапа — узнать, насколько препарат или способ лечения безопасен, и выявить побочные эффекты. На этом этапе могут участвуют как здоровые люди, так и люди с подходящим заболеванием. Чтобы приступить к I фазе клинического исследования, учёные несколько лет проводили сотни других тестов, в том числе на безопасность, с участием лабораторных животных, чей обмен веществ максимально приближен к человеческому;
II фаза — исследователи назначают препарат или метод лечения большей группе людей (100—300 человек), чтобы определить его эффективность и продолжать изучать безопасность. На этом этапе участвуют люди с подходящим заболеванием;
III фаза — исследователи предоставляют препарат или метод лечения значительным группам людей (1000—3000 человек), чтобы подтвердить его эффективность, сравнить с золотым стандартом (или плацебо) и собрать дополнительную информацию, которая позволит его безопасно использовать. Иногда на этом этапе выявляют другие, редко возникающие побочные эффекты. Здесь также участвуют люди с подходящим заболеванием. Если III фаза проходит успешно, препарат регистрируют в Минздраве и врачи получают возможность назначать его;
IV фаза — исследователи продолжают отслеживать информацию о безопасности, эффективности, побочных эффектах и оптимальном использовании препарата после того, как его зарегистрировали и он стал доступен всем пациентам.
Считается, что наиболее точные результаты дает метод исследования, когда ни врач, ни участник не знают, какой препарат — новый или существующий — принимает пациент. Такое исследование называют «двойным слепым». Так делают, чтобы врачи интуитивно не влияли на распределение пациентов. Если о препарате не знает только участник, исследование называется «простым слепым».
Чтобы провести клиническое исследование (особенно это касается «слепого» исследования), врачи могут использовать такой приём, как рандомизация — случайное распределение участников исследования по группам (новый препарат и существующий или плацебо). Такой метод необходим, что минимизировать субъективность при распределении пациентов. Поэтому обычно эту процедуру проводят с помощью специальной компьютерной программы.
- бесплатный доступ к новым методам лечения прежде, чем они начнут широко применяться;
- качественный уход, который, как правило, значительно превосходит тот, что доступен в рутинной практике;
- участие в развитии медицины и поиске новых эффективных методов лечения, что может оказаться полезным не только для вас, но и для других пациентов, среди которых могут оказаться члены семьи;
- иногда врачи продолжают наблюдать и оказывать помощь и после окончания исследования.
- новый препарат или метод лечения не всегда лучше, чем уже существующий;
- даже если новый препарат или метод лечения эффективен для других участников, он может не подойти лично вам;
- новый препарат или метод лечения может иметь неожиданные побочные эффекты.
Главные отличия клинических исследований от некоторых других научных методов: добровольность и безопасность. Люди самостоятельно (в отличие от кроликов) решают вопрос об участии. Каждый потенциальный участник узнаёт о процессе клинического исследования во всех подробностях из информационного листка — документа, который описывает задачи, методологию, процедуры и другие детали исследования. Более того, в любой момент можно отказаться от участия в исследовании, вне зависимости от причин.
Обычно участники клинических исследований защищены лучше, чем обычные пациенты. Побочные эффекты могут проявиться и во время исследования, и во время стандартного лечения. Но в первом случае человек получает дополнительную страховку и, как правило, более качественные процедуры, чем в обычной практике.
Клинические исследования — это далеко не первые тестирования нового препарата или метода лечения. Перед ними идёт этап серьёзных доклинических, лабораторных испытаний. Средства, которые успешно его прошли, то есть показали высокую эффективность и безопасность, идут дальше — на проверку к людям. Но и это не всё.
Сначала компания должна пройти этическую экспертизу и получить разрешение Минздрава РФ на проведение клинических исследований. Комитет по этике — куда входят независимые эксперты — проверяет, соответствует ли протокол исследования этическим нормам, выясняет, достаточно ли защищены участники исследования, оценивает квалификацию врачей, которые будут его проводить. Во время самого исследования состояние здоровья пациентов тщательно контролируют врачи, и если оно ухудшится, человек прекратит своё участие, и ему окажут медицинскую помощь. Несмотря на важность исследований для развития медицины и поиска эффективных средств для лечения заболеваний, для врачей и организаторов состояние и безопасность пациентов — самое важное.
Потому что проверить его эффективность и безопасность по-другому, увы, нельзя. Моделирование и исследования на животных не дают полную информацию: например, препарат может влиять на животное и человека по-разному. Все использующиеся научные методы, доклинические испытания и клинические исследования направлены на то, чтобы выявить самый эффективный и самый безопасный препарат или метод. И почти все лекарства, которыми люди пользуются, особенно в течение последних 20 лет, прошли точно такие же клинические исследования.
Если человек страдает серьёзным, например, онкологическим, заболеванием, он может попасть в группу плацебо только если на момент исследования нет других, уже доказавших свою эффективность препаратов или методов лечения. При этом нет уверенности в том, что новый препарат окажется лучше и безопаснее плацебо.
Согласно Хельсинской декларации, организаторы исследований должны предпринять максимум усилий, чтобы избежать использования плацебо. Несмотря на то что сравнение нового препарата с плацебо считается одним из самых действенных и самых быстрых способов доказать эффективность первого, учёные прибегают к плацебо только в двух случаях, когда: нет другого стандартного препарата или метода лечения с уже доказанной эффективностью; есть научно обоснованные причины применения плацебо. При этом здоровье человека в обеих ситуациях не должно подвергаться риску. И перед стартом клинического исследования каждого участника проинформируют об использовании плацебо.
Обычно оплачивают участие в I фазе исследований — и только здоровым людям. Очевидно, что они не заинтересованы в новом препарате с точки зрения улучшения своего здоровья, поэтому деньги становятся для них неплохой мотивацией. Участие во II и III фазах клинического исследования не оплачивают — так делают, чтобы в этом случае деньги как раз не были мотивацией, чтобы человек смог трезво оценить всю возможную пользу и риски, связанные с участием в клиническом исследовании. Но иногда организаторы клинических исследований покрывают расходы на дорогу.
Если вы решили принять участие в исследовании, обсудите это со своим лечащим врачом. Он может рассказать, как правильно выбрать исследование и на что обратить внимание, или даже подскажет конкретное исследование.
Клинические исследования, одобренные на проведение, можно найти в реестре Минздрава РФ и на международном информационном ресурсе www.clinicaltrials.gov.
Обращайте внимание на международные многоцентровые исследования — это исследования, в ходе которых препарат тестируют не только в России, но и в других странах. Они проводятся в соответствии с международными стандартами и единым для всех протоколом.
После того как вы нашли подходящее клиническое исследование и связались с его организатором, прочитайте информационный листок и не стесняйтесь задавать вопросы. Например, вы можете спросить, какая цель у исследования, кто является спонсором исследования, какие лекарства или приборы будут задействованы, являются ли какие-либо процедуры болезненными, какие есть возможные риски и побочные эффекты, как это испытание повлияет на вашу повседневную жизнь, как долго будет длиться исследование, кто будет следить за вашим состоянием. По ходу общения вы поймёте, сможете ли довериться этим людям.
Если остались вопросы — спрашивайте в комментариях.
источник