В 1807 г. профессор Московского университета Ф.Ф. Рейсс открыл два явления – электрофорез и электроосмос, связанные с нарушением электрохимического равновесия в двойном ионном слое на поверхности твердой фазы, граничащей с водной средой при помещении систем в электрическое поле. Принцип опыта Рейсса заключался в следующем. В кусок влажной глины были воткнуты две полые стеклянные трубки без дна. Чтобы вода при заливании в эти трубки не замутилась при размывании глины, на поверхность глины помещался кварцевый песок, после чего по стенке осторожно заливалась дистиллированная вода. Затем в воду помещали два угольных электрода, закрепленных на пробках, к которым подводился постоянный ток. По истечении некоторого времени было обнаружено, что частицы глины стали двигаться под действием электрического поля к положительно заряженному электроду. Значит, частицы глины оказались заряженными отрицательно. Это явление движения частиц твердой фазы в электрическом поле было названо электрофорезом. Одновременно с этим во второй трубке поднялся уровень жидкости, но помутнения не было. Вода оказалась положительно заряженной, поэтому она стала перемещаться к отрицательно заряженному электроду. Это явление получило название электроосмоса. Таким образом, под действием электрического тока может происходить движение либо твердого тела, либо жидкой фазы. Эти явления называют электрокинетическими, так как они проявляются при перемещении одной фазы относительно другой, и в настоящее время достаточно хорошо изучены. Кроме электроосмоса и электрофореза существуют еще два электрокинетических явления. Перечислим явления, наблюдаемые под влиянием взаимного движения двух фаз:
1) электрофорез — движение диспергированных частиц в дисперсионной среде под действием электрического потенциала, приложенного извне;
2) потенциал движущихся частиц, открытый в 1880 г. Дорном, потенциал седиментации (оседания) — возникновение потенциала под влиянием движущихся частиц относительно неподвижной жидкости или приоседании частиц;
3) электроосмос — движение жидкости относительно неподвижных стенок капилляров или пористой мембраны под действием электрического потенциала, приложенного извне;
4) потенциал протекания (открыт Квинке в 1859 г.) — возникновение электрического потенциала при механическом продавливании жидкости через капилляры или пористую мембрану, независим от площади и толщины мембраны, но пропорционален разности давлений, вызывающих течение.
Рис. 1.38.Схема прибора Кёна-Бертона
Для экспериментального исследования электрокинетических явлений были предложены различные приборы. В частности, электрофорез можно наблюдать с помощью простейшего прибора Кёна, который представляет собой U-образную трубку с двумя кранами, имеющими отверстия, равные внутреннему диаметру трубки.
В качестве боковой жидкости обычно применяют ультрафильтрат после ультрафильтрации исследуемой дисперсии. В боковую жидкость погружают два электрода, подключенные к источнику постоянного тока, после чего открывают краны. В таком случае получается достаточно резкая граница золя (латекса) с боковой жидкостью. Под действием электрического тока граница движется к какому-либо электроду. По тому, к какому электроду движется граница золя определяют знак заряда его частиц, а по скорости движения — величину электрокинетического потенциала. У прибора Бертона вместо кранов имеется трубка, через которую наливается вначале боковая жидкость, а затем золь. Приливание ведется очень осторожно — так, чтобы граница «золь — боковая жидкость» была ясновыраженной. Для количественной характеристики заряда частиц методом макроэлектрофореза удобнее применять прибор Кёна-Бертона с делениями. Трубки такого прибора градуированы. Вместо угольных электродов применяют солевые мостики, опущенные в стаканчики с раствором электролита, чаще всего сернокислой меди, в которые помещены электроды из меди. Схема такого прибора в современной модификации приведена на рис. 1.38. На этом рисунке 1 – калиброванные трубки с делениями; 2 – краны с отверстиями 3, равными диаметру трубок 1; 4 – нижняя трубка, через которую заливают золь; 5 – нижний кран; трубка 6, соединяет прибор с сосудом 7, в котором находится золь; 8 – отверстия в обойме 9 для крепления прибора на стенде; 10 – солевые мостики; 11 – электроды из меди; 12 – сосуды с раствором CuSO4.
Рис. 1.39. Схема прибора Думанского
Прибор Думанского используется для определения знака заряда волокон, например, целлюлозы, хлопка, синтетических и искусственных волокнистых материалов. Принцип действия достаточно прост (рис. 1.39.) — волокно (4), установленное в зажим (2) помещают между двумя электродами (3), опущенными в воду или и в раствор (1). В водной среде на поверхности волокна формируется двойной ионный слой, целостность которого нарушается в электрическом поле. Заряженное волокно отклоняется к противоположно заряженному электроду, что позволяет определить знак и, в известной мере, величину заряда. По крайней мере, можно определить изоэлектрическую точку волокон, изменяя рН cреды.
В последнее время широкое распространение получили приборы для микроэлектрофореза. На рис. 1.40 показана схема вертикально ориентированной ячейки. Здесь 1, 7 — покровные стекла, 2 – пробки, 3 – медные электроды, 4 – исследуемый золь, 5 – боковая жидкость, 6 – CuSO4.
Рис. 1.40. Схема плоской ячейки для микроэлектрофореза
Приборы для микроэлектрофореза состоят из открытой или закрытой плоской или круглой камеры, которую освещают боковым светом и рассматривают перемещение частиц с помощью микроскопа по рассеянному частицами свету. В микроскопе можно увидеть направление движения частиц и определить скорость их движения, что позволяет рассчитать величину электрокинетического потенциала. В последнее время были созданы более сложные и точные приборы для электрофореза [6].
Добавление электролитов к золям (латексам) оказывает большое влияние на скорость электрофореза. Таким путем можно сильно замедлить перемещение частиц и даже полностью его прекратить. Это состояние, когда частицы не несут на своей поверхности заряда и в электрическом поле не перемещаются, называется изоэлектрической точкой. Некоторые поливалентные ионы в результате сверхэквивалентной специфической адсорбции могут перезарядить поверхность частиц и заставить их перемещаться обратно первоначальному движению.
Рис. 1.41. Схема прибора для изучения электроосмоса
Существующие теории электрофореза, развитые в работах Смолуховского, позволяют рассчитать электрокинетический потенциал по скорости макроэлектрофореза с достаточной степенью достоверности. Метод электрофореза не позволяет определить потенциал волокон без их дополнительного диспергирования, что способно исказить результат. Кроме того, на результатах расчета может отразиться процесс седиментации частиц, особенно с высокой плотностью. Для таких систем используют электроосмос или измерение потенциала протекания. На рис. 1.41 приведена схема прибора Перрена для количественного определения скорости электроосмоса. В горизонтальную трубку А помещают исследуемое вещество. Затем присоединяют боковые трубки с электродами Е из платины, заливают раствор или воду и подключают постоянный электрический ток. Определяя по перемещению мениска М в капилляре С скорость движения жидкости при известной разности потенциала (Е1— Е2) можно рассчитать величину электрокинетического потенциала волокон.
Рис. 1.42. Схема установки для определения потенциала протекания
Однако более точное измерение поверхностного потенциала можно получить с помощью метода измерения потенциала протекания.
Схема прибора для определения потенциала протекания показана на рис. 1.42. Основную часть установки составляет измерительная ячейка (9), выполненная из оргстекла. Делается это для исключения прохождения тока по поверхности ячейки. Внутри ячейки помещают мембрану из исследуемого волокна (1), с обоих концов которой расположены платиновые сетчатые электроды (3), подключенные к цифровому вольтметру (5). Поместив в ячейку мембрану из волокна, закрывают ячейку, с помощью силиконовых трубок подсоединяют ее к емкости для исходного раствора (6) и к приемной емкости (4), а с помощью резиновых трубок – к водному дифманометру (8) для измерения давления жидкости. Затем наливают в емкость исходный раствор, закрывают емкость и подключают к ней микронасос (7).
При включении микронасоса жидкость из емкости под давлением воздуха поступает в измерительную ячейку, а из нее — в приемную емкость. Давление жидкости регистрируется на водном дифманометре, а потенциал течения — на табло цифрового вольтметра. Показания приборов снимают только после того, как установятся постоянные их значения. Температуру измеряют с помощью термометра (2). Если при определенном давлении продавливать воду или раствор через систему капилляров или мембрану из волокна, то при помощи чувствительного прибора можно измерить возникающий при этом потенциал, соответствующий потенциалу поверхности раздела фаз «твердое тело-жидкость».
источник
Электрокинетический (дзета) потенциал – потенциал, возникающий на границе скольжения фаз при их относительном перемещении в электрическом поле.
Положение плоскости скольжения (линия АВ) в ДЭС не известно. Полагают, что плоскость скольжения проходит на расстоянии толщины плотной части ДЭС, и в этом случае ζ = φd; либо смещена в жидкую фазу, тогдаζ 2 /В·с; U – линейная скорость движения границы золь – боковая жидкость, м/с; H – напряженность электрического поля, В/м.
Электрокинетический потенциал связан с электрофоретической (электроосмотической) подвижностью, уравнением Гельмгольца – Смолуховского:
, (4.3)
где ζ – величина электрокинетического потенциала, В; η – вязкость дисперсионной среды, Н·с/м 2 ; ε – диэлектрическая проницаемость среды, для водной среды равная 81 (безразмерная величина); – электрическая константа (диэлектрическая проницаемость вакуума), равная 8,85·10 –12 Ф/м; U – линейная скорость движения границы золь-боковая жидкость, м/с; H – напряженность электрического поля, В/м.
Линейную скорость движения границы золь-боковая жидкость рассчитывают как отношение смещения границы раздела за время электрофореза:
, (4.4)
где h – смещение границы золь-боковая жидкость за время электрофореза, м; t – время электрофореза, с.
Напряженность электрического поля (градиент потенциала) рассчитывают как отношение приложенной разности потенциалов к расстоянию между электродами:
, (4.5)
где Е – приложенная разность потенциалов, В; l – расстояние между электродами, м.
Тогда уравнение Гельмгольца – Смолуховского для электрофорезазапишется:
. (4.6)
Расчет электрокинетического потенциала при электроосмосе ведут по уравнению:
, (4.7)
где – величина электрокинетического потенциала, В; – вязкость среды, Н·с/м 2 ; – диэлектрическая проницаемость среды, для водной среды равная 81 (безразмерная величина); – электрическая константа (диэлектрическая проницаемость вакуума), равная 8,85·10 –12 Ф/м;
– удельная электрическая проводимость, Ом –1 м –1 ; – объемная скорость электроосмоса, м 3 /с; I – сила тока, А.
Объемная скорость электроосмоса ( ) – скорость перемещения объема раствора V,(м 3 ) в единицу времени t, с:
. (4.8)
Потенциал течения – возникновение разности потенциалов при продавливании через пористую диафрагму жидкости под действием внешней силы (давления).
Потенциал течения не зависит от площади и толщины диафрагмы, от количества протекающей жидкости, а зависит от давления, поддерживающего течение по уравнению:
, (4.9)
где – потенциал течения, В; – величина электрокинетического потенциала, В; – вязкость среды, Н·с/м 2 ; – диэлектрическая проницаемость среды, для водной среды равная 81 (безразмерная величина); – электрическая константа (диэлектрическая проницаемость вакуума), равная 8,85·10 –12 Ф/м; – удельная электрическая проводимость, Ом –1 м –1 ; р – давление, приводящее жидкость в движение, Н/м 2 .
Пример 4.1.Вычислите величину электрокинетического потенциала для латекса полистирола, если при электрофорезе смещение цветной границы за 60 мин составляет h = 2,6 см. Напряжение, приложенное
в электродам Е = 115 В. Расстояние между электродами l = 55 см. Диэлектрическая проницаемость воды ε = 81, вязкость среды η = 1·10 –3 Н·с/м 2 .
Решение. Для расчета электрокинетического потенциала воспользуемся уравнением (4.6):
.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Согласно современной теории строения двойного электрического слоя получили объяснение электрические явления, а также проблемы строения и устойчивости коллоидных частиц лиофобных золей. Установлено, что при относительном движении жидкой и твердой фаз в электрическом поле плоскость скольжения их лежит на некотором расстоянии от твердой фазы. При этом слой жидкой фазы толщиной в 2-3 молекулы при движении фаз остается неподвижным вместе с твердой фазой. Иными словами, непосредственно у поверхности коллоидной частицы образуется адсорбционный слой, включающий не только ПОИ, но и часть противоионов, которые в обычных условиях считаются неподвижными и при движении твердой фазы перемещаются вместе с ней. Остальная часть противоионов составляет диффузный слой, в котором концентрация ионов по мере удаления от поверхности коллоидной частицы постепенно убывает. Между адсорбционным и диффузным слоями идет непрерывный обмен противоионами.
Разность потенциалов между подвижной (диффузной) и неподвижной (адсорбционной) частями двойного электрического слоя называется электрокинетическим потенциалом. Этот потенциал обозначается греческой буквой ζ(дзетта) и потому называется дзетта-потенциалом (ζ-потенциал).
Полное падение потенциала от его значения на твердой поверхности (заряженной отрицательно) до минимального значения соответствует максимальной разности потенциалов между твердой поверхностью и всеми вместе взятыми противоионами. Эту максимальную разность потенциалов называют термодинамическим потенциалом y (рис. 20.3). ζ-потенциал или электрокинетический потенциал составляет часть термодинамического потенциала y и показывает скачок потенциала в диффузной части двойного электрического слоя.
Рис. 20.4 Схема строения ДЭС и кривая падения потенциала
(металл заряжен отрицательно)
Вычисление электрокинетического потенциала ζ определение его знака на практике производят, пользуясь данными электрофореза и электроосмоса, а также потенциала течения, по следующей формуле:
(20.1)
где К – постоянная, зависящая от формы коллоидно-дисперсных частиц (для сферических частиц К=6, цилиндрических – К=4),
h – вязкость дисперсионной среды,
D – диэлектрическая постоянная,
e – градиент напряжения поля,
u – средняя скорость передвижения частиц под действием электрического поля.
Установлено, что величина ζ-потенциала тесно связана с толщиной диффузного слоя противоионов. Чем больше размыт этот слой, тем больше величина электрокинетического потенциала.
Если слой противоионов предельно сжат, ζ-потенциал = 0. Наоборот, разбавление золя способствует увеличению толщины диффузного слоя за счет перехода противоионов из адсорбционного в диффузный слой и приводит к возрастанию значения ζ-потенциала.
Так как ζ-потенциал в некоторых случаях является величиной, характеризующей устойчивость коллоидной системы, необходимо учитывать влияние на него таких факторов, как введение в систему электролитов, изменение pH, концентрации раствора, температуры и т.д.
Индифферентные электролиты (электролиты, не имеющие ионов, способных достраивать кристаллическую решетку коллоидной системы) не могут существенно изменить общий скачок потенциала коллоидных частиц, а электрокинетический потенциал снижается в результате увеличения концентрации противоионов и сжатия двойного электрического слоя.
При введении в коллоидный раствор индифферентных электролитов различают два случая:
1) в систему вводится электролит, один из ионов которого одинаков с противоионами;
2) в систему вводится электролит, не имеющий общих ионов с электролитом – стабилизатором.
В первом случае по мере увеличении содержания в системе такого электролита, очевидно, толщина двойного электрического слоя стремится стать равной толщине адсорбционного слоя за счет сжатия диффузного слоя. В результате электрокинетический потенциал понижается, пока не станет равным 0, что будет отвечать так называемому изоэлектрическому состоянию системы.
Второй случай отличается от первого только тем, что здесь имеет место явление обмена противоионов коллоидной частицы на эквивалентное число одинаковых по знаку ионов введенного электролита.
Значение pH дисперсионной среды может сильно сказываться на электрокинетическом потенциале коллоидных частиц, т.к. водородные и гидроксильные ионы обладают высокой способностью адсорбироваться; первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы; вторые – из-за большого дипольного момента.
Дата добавления: 2014-01-07 ; Просмотров: 3227 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Тема: Электрокинетический потенциал и методы его определения
Электрокинетические явления были открыты профессором Московского университета Ф.Ф.Рейсом в 1808г. при исследовании электролиза воды.
Явление перемещения жидкости в пористых телах под действием электрического поля получило название электроосмоса, а явление перемещения частиц – электрофореза.
В 1859г. Квинке обнаружил явление, обратное электроосмосу, т.е. при течении жидкости через пористое тело под действием перепада давлений возникает разность потенциалов. Возникновение разности потенциалов Квинке наблюдал при течении воды и водных растворов через разнообразные пористые материалы (глина, дерево, графит и др.). Это явление получило название потенциала течения (или потенциала протекания).
Количественное исследование эффекта, обратного электрофорезу, впервые было выполнено Дорном в 1878г. Он измерял возникающую разность потенциалов при седиментации частиц суспензии кварца в центробежном поле. Явление возникновения разности потенциалов при осаждении дисперсной фазы получило название потенциала седиментации (или потенциала оседания).
Таким образом, по причинно-следственным признакам электрокинетические явления в дисперсных системах делят на две группы. К первой группе относят явления, при которых относительное движение фаз обусловлено электрической разностью потенциалов; это электроосмос и электрофорез. Ко второй группе электрокинетических явлений принадлежат потенциал течения и потенциал седиментации, при которых относительное движение фаз вызывает возникновение электрической разности потенциалов.
Наибольшее практическое применение получили электрофорез и электроосмос.
Электрокинетические явления в течение длительного времени не находили объяснения. Теперь, на основании рассмотренных представлений об электрических свойствах границы раздела, причиной этих явлений можно считать существование двойного электрического слоя (ДЭС). Действительно, разноименность зарядов фаз приводит в случае неподвижного пористого тела в электрическом поле к перемещению подвижных противоионов вместе с жидкой фазой к соответствующему полюсу (одноименного с твердой фазой знака). Действие же внешней механической силы (давление) вызывает вынос подвижного заряда диффузного слоя и, следовательно, возникновение разности потенциалов. Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называется электрокинетическим потенциалом или ζ-потенциалом. Дзета-потенциал, отражая свойства двойного электрического слоя, характеризует природу фаз и межфазного взаимодействия.
Из этого качественного рассмотрения видно, что действующая электрическая сила (в явлениях электроосмоса и электрофореза), равная произведению заряда на градиент потенциала, тем больше, чем больше зарядов диффузного слоя оказывается в подвижной части жидкости. От этих зарядов зависит и величина конвективного тока и, следовательно величины потенциалов течения и оседания.
Таким образом, все эти явлении должны быть развиты тем сильнее, чем больше подвижный заряд диффузного слоя и ζ-потенциал границы скольжения. Отсюда следует, что ζ-потенциал есть мера интенсивности элетрокинетических явлений. С другой стороны, измеряя параметры этих явлений, можно вычислить ζ-потенциал на основе теории, связывающей его с этими параметрами.
Рис. 1. Изменение потенциала ψ и скорости u с расстоянием от поверхности.
Рассмотрим бесконечно тонкий слой жидкости толщиной dx (δ
Электрическая сила действует на отдельные ионы, но, согласно закону Ньютона, она уравновешивается силой трения, возникающей в жидкости. Таким образом, в стационарном состоянии и в ламинарном режиме суммарная сила, действующая на каждый слой, равна нулю и каждый слой жидкости толщиной dx движется с постоянной скоростью параллельно границе скольжения. Это означает, что электрическая сила, действующая на объемный заряд, должна уравновешиваться силами трения соседних слоев, равными η (du/dx), на единицу площади боковой поверхности
где ρ – объемная плотность заряда; η – коэффициент вязкости; u – линейная скорость движения жидкости.
Исходя из принципа суперпозиции полей и учитывая уравнение Пуассона
В результате интегрирования, выполняемого при граничных условиях
где uэо – электроосмотическая скорость; знак минус означает, что жидкость движется против поля, если ζ > 0
где R – сопротивление; к – удельная электропроводность жидкости; l и A – эффективные длина и площадь сечения пор.
Подстановка значений uэо и Х в уравнение (3) дает:
Это уравнение носит название уравнения Гельмгольца – Смолуховского для электроосмоса.
Таким образом, движение ионов диффузного слоя под действием электрического поля увлекает вследствие внутреннего трения всю массу жидкости, которая заполняет капилляры или поры, со скоростью Q в направлении поля.
Весьма существенно, что уравнение (5) не включает геометрических параметров системы (l, A); все величины, входящие в правую часть уравнения, измеримы на опыте. Зависимость Q от I, изученная экспериментально для многих систем, оказалась линейной, подтверждая уравнение (5).
Таким образом, экспериментальное определение Q и I позволяет вычислить ζ-потенциал.
Рис. 2. Прибор для измерения электроосмоса в мембранах.
Для измерений применяют установки различного типа; пример одной из них приведен на рис. 2. Пористая мембрана 1, зажатая между фланцами 2 и 3, разделяет два симметричных сосуда 4 с отсчетными капиллярными трубками 5 и неполяризующими электродами (Сu/CuSO4 – агар) 6. Ячейку заполняют раствором электролита так, чтобы мениски жидкости находились в средней части градуированных трубок. Соединяя электроды с внешним источником тока, измеряют объем V жидкости, перемещающийся за время t в капиллярных трубках вследствие электроосмоса в мембране 1. Для расчетов используют среднее значение скорости Qср = (V + V’)2t, нивелируя таким образом изменения V, связанные с тепловым расширением. Измерения повторяют несколько раз, меняя направление тока. Значение I среднее за период измерения определяют по амперметру, а значения η, ε и к берут из таблиц. При выполнении измерений необходимо, чтобы уровни жидкости находились на одной высоте; это исключает влияние гидростатического давления.
Можно проводить опыт по-иному, предоставив жидкости подниматься в одном из колен сосуда. В этом случае установится равновесие, в котором электрическая сила равна гидростатической (весу столба жидкости). Используя выражения (3) и (4) и формулу Пуазейля:
где Q – расход жидкости (поток) в единицу времени; Р – дпаление; r и l- радиус и длина капилляра; К – константа, определяемая геометрическими параметрами, получаем:
Измеряя равновесную высоту поднятия h, и, следовательно, гидростатическое давление P = gdh, можно найти ζ, если известен радиус пор r.
Движение частиц дисперсной фазы в постоянном электрическом поле в жидкой среде схематически изображено на рис. 3.
Рис. 3. Схема электрофореза
Отрицательно заряженная частица вместе с плотным слоем ионов внешней обкладки приобретает направленное движение в сторону положительного полюса, тогда как ионная атмосфера (диффузный слой) перемещается в противоположном направлении. При выборе системы координат, неподвижно связанной с частицей, получается картина, принципиально идентичная электроосмосу, и, следовательно, уравнение (3) должно быть применимым к электрофорезу (с обратным знаком). В отличие от электроосмоса здесь можно непосредственно измерить линейную скорость движения частиц u, а также поле X = E/l, гдн E – разность потенциалов на электродах; l – расстояние между ними.
источник
При подготовке к лабораторной работе повторите материалы гл. 5, обратив особое внимание на параграф 5.2.
Цель работы. Определение электрокинетического потенциала золя берлинской лазури по скорости электрофореза.
Реактивы и оборудование. Растворы для приготовления золя: K4[Fe(CN)6] нас., FeCl3nac., NaCl 0,01 М, дистиллированная вода.
Установка для определения ^-потенциала золей методом электрофореза (методом подвижной границы), источник постоянного тока, линейка, секундомер, стакан химический мерный объемом 500 мл, пипетка мерная объемом 1 мл, резиновая груша, стеклянная палочка.
Методические указания. В лаборатории для определения ^-потенциала золей методом электрофореза используют установку, показанную на рис. Л.4.
В нижнюю часть U-образной трубки заливают окрашенный золь (например, золь берлинской лазури), сверху — воду, так чтобы между золем и водой была отчетливая ровная граница. При включении напряжения окрашенные частицы твердой фазы золя начнут сдвигаться в сторону одного из электродов в зависимости от знака заряда коллоидной частицы. Скорость сдвига зависит от величины электрокинетического потенциала коллоидной частицы, напряженности электрического поля, вязкости и диэлектрической проницаемости среды.
Рис. Л.4. Установка для определения ^-потенциала методом электрофореза
Заполнение прибора проводят в следующей последовательности:
- 1) в U-образную трубку залить дистиллированную воду примерно на 1 /3 объема;
- 2) соединяющийся с трубкой сосуд наполнить изучаемым окрашенным золем до самого верха;
- 3) медленно открывая кран между U-образной трубкой и сосудом, выпустить пузырьки воздуха, который мог остаться в месте соединения, а затем заполнить нижнюю часть U-образной трубки золем. При этом имеющаяся в трубке вода поднимется вверх, а между водой и золем образуется четкая граница раздела.
Электроды погружают в воду, как показано на рис. Л.4, они не должны доходить до границы золя на несколько сантиметров.
Проведение измерений. Отметив положение границы в обоих коленах, подключают напряжение. Электрофорез проводят на постоянном токе с напряжением 20—30 В (регулируется с помощью источника питания). В процессе измерений записывают расстояние /, на которое сдвинулась окрашенная граница, и время т, за которое произошел сдвиг. Электрокине- тический потенциал вычисляют по уравнению Гельмгольца — Смолухов- ского, записанному относительно электрокинетического потенциала:
где отношение //т представляет собой скорость электрофореза v, м/с; напряженность внешнего поля ?вн, В/м, задается приложенным напряжением (разностью потенциалов на электродах) U, В, и расстоянием между ними L, м, Еш = U/L. Расстояние между электродами измеряют следующим образом: располагают нитку от конца одного электрода до другого вдоль U-образной трубки и затем измеряют ее длину, приложив нитку к линейке.
Приготовление исходных золей.
Золь берлинской лазури (-): 1,5 мл насыщенного раствора желтой кровяной соли K4[Fe(CN)6] разбавляют водой до 300 мл. К разбавленному раствору добавляют при перемешивании 2—3 капли насыщенного раствора FeCl3. Образуется прозрачный золь берлинской лазури FeK|Fe(CN)6|3 интенсивного синего цвета.
Золь берлинской лазури ( + ): 0,3 мл насыщенного (47%) раствора FeCl3 разбавляют водой до 300 мл. В разбавленный раствор при перемешивании вводят 2—3 капли насыщенного (20%) раствора желтой кровяной соли K4[Fe(CN)6]. Образуется прозрачный золь берлинской лазури FeK[Fe(CN)6]3 интенсивного синего цвета.
Приготовление золей с добавлением электролита
Для приготовления золя с заданным содержанием электролита Сэл к 50 мл исходного золя добавляют рассчитанный объем раствора электролита исходной концентрацией С®л (обычно добавляют NaCl с концентрацией С®л= 0,01 М). Для вычисления добавляемого объема Удоб следует воспользоваться формулой
В ходе работы проводят измерение электрокинетического потенциала исходного золя и золя с добавлением электролита.
Полученные данные записывают в таблицу (табл. Л.4).
Данные для расчета ^-потенциала золя методом электрофореза
Концентрация электролита Сэл, моль/л
источник
Тема 2. Свойства дисперсных систем,
Их устойчивость и коагуляция
Электрические свойства дисперсных систем
1. Электрокинетический потенциал.
2. Теории строения двойного электрического слоя.
1. Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. – М.: Высш. шк., 2006. – С. 139 – 154, 172 – 190.
2. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия. – СПб.: «Лань», 2003. – С. 106 – 116.
НАГЛЯДНЫЕ ПОСОБИЯ И ПРИЛОЖЕНИЯ:
1. Cвойства дисперсных систем.
2. ДЭС по теории Гельмольца-Перрена.
3.. ДЭС по теории Гуи-Чэпмена.
5. Факторы, влияющие на дзета-потенциал.
6. Электрокинетический потенциал.
Мы продолжаем изучение темы № 2 «Свойств дисперсных систем, их устойчивость и коагуляция». На прошлых лекциях были рассмотрены молекулярно-кинетические, оптические, а также электрические свойства дисперсных систем, которые проявляются в виде электрокинетических явлений (рисунок 1).
Рис. 1. Свойства дисперсных систем
Сегодня мы продолжим рассмотрение электрических свойств, ознакомимся с понятием электрокинетический потенциал, детально рассмотрим строение двойного электрического слоя и, как следствие, изучим строение коллоидной мицеллы. Материал сегодняшней лекции является основополагающим для рассмотрения вопроса устойчивости дисперсных систем и их разрушения – одного из центральных вопросов физики поверхности.
ЭЛЕКТРОКИНЕТИЧЕСКИЙ ПОТЕНЦИАЛ
Как мы показали на прошлой лекции на частицах дисперсной фазы, помещенных в жидкую дисперсионную среду, практически всегда возникает заряд (рисунок 2).
1.Избыток КСI 2. Избыток AgNO3
Рисунок 2. Возникновение заряда на поверхности частиц
Возникновение заряда на поверхности твердого тела приводит к тому, что на границе раздела фаз (между твердой частицей и раствором) возникает электрический потенциал. Его обозначают через j и называют термодинамическим или электрохимическим потенциалом. Ионы, из-за которых на поверхности частиц возникает заряд, называются потенциалобразующими (или потенциалопределяющими).
Однако в электрокинетических явлениях проявляется потенциал меньше, чем термодинамический. Электрокинетическим или дзета-потенциалом называют потенциал, который проявляется на границе скольжения при перемещении частиц дисперсной фазы относительно дисперсионной среды (например, в электрическом поле). Его обозначают буквой z (дзета). Было установлено, что частица дисперсной фазы при движении увлекает за собой часть жидкости, которая перемещается вместе с частицей, и z- потенциал возникает на границе скольжения. Граница скольжения отделяет неподвижную, связанную с твердой частицей жидкую фазу от остальной жидкой фазы, относительно которой происходит перемещение дисперсных частиц (рисунок 3).
 |
Рис. 3. Граница скольжения между дисперсной частицей
(вместе с прилегающим слоем) и дисперсионной средой
Расстояние от поверхности частицы до границы скольжения определяется в первую очередь вязкостью дисперсионной среды. Таким образом, термодинамический потенциал возникает на границе между частицей и дисперсионной средой, а электрокинетический — на границе скольжения.
Электрокинетический потенциал – важная характеристика дисперсной системы. Он определяет скорость перемещения дисперсной фазы и дисперсионной среды, интенсивность электрокинетических явлений, устойчивость золей и разрушение их электролитами. Величину электрокинетического потенциала можно достаточно точно измерить по данным электрофореза или электроосмоса. Его знак определяется знаком заряда потенциалопределяющего слоя: если слой формируется анионами, то z- потенциал будет отрицательным, если он образуется из катионов, то отрицательным.
1. Расчет z- потенциала по данным электрофореза.

где u – скорость перемещения частиц дисперсной фазы, м/с
(можно наблюдать визуально и измерить);
h – коэффициент вязкости среды, н . с/ м 2 ;
y – коэффициент, учитывающий форму частиц (для сферических –
0,66; для цилиндрических – 1);
e – относительная диэлектрическая проницаемость среды;
eо – абсолютная диэлектрическая проницаемость вакуума
Е – напряженность внешнего электрического поля, В/м.
Таким образом, электрокинетический потенциал довольно просто определить экспериментально по скорости перемещения дисперсной фазы в электрическом поле с известным значением напряженности. Электрокинетический потенциал обычно не превышает 100 мВ.
2. Расчет z- потенциала по данным электроосмоса.

где Q – oбъемная скорость электроосмоса, м 3 /с
(объем раствора, протекающего через пористую мембрану
h – коэффициент вязкости среды, н . с/ м 2 ;
c – удельная электропроводность, См/м;
e – относительная диэлектрическая проницаемость среды;
eо – абсолютная диэлектрическая проницаемость вакуума
I – сила тока, при которой проводился осмос, А.
Таким образом, чтобы определить величину электрокинетического потенциала z по данным электроосмоса надо экспериментально определить объем жидкости, перенесенной через пористую мембрану, удельную электропроводность раствора и силу тока, при которой проводился электроосмос.
Величина электрокинетического потенциала влияет на устойчивость дисперсных систем, на скорость электрофореза и электроосмоса. Величину z- потенциала можно изменить в соответствии с поставленными целями. Для этого необходимо знать факторы, влияющие на z- потенциал.
Факторы, влияющие на z- потенциал
1. Величина термодинамического потенциала j (чем больше j, тем больше z);
2. Концентрация индифферентного электролита в растворе (z- потенциал может сильно уменьшиться, даже до 0, или переменить знак на противоположный);
3. рН раствора (в некоторых случаях).
Чтобы понять причины влияния этих факторов на z- потенциал, необходимо рассмотреть строение двойного электрического слоя.
источник
Согласно современной теории строения двойного электрического слоя получили объяснение электрические явления, а также проблемы строения и устойчивости коллоидных частиц лиофобных золей. Установлено, что при относительном движении жидкой и твердой фаз в электрическом поле плоскость скольжения их лежит на некотором расстоянии от твердой фазы. При этом слой жидкой фазы толщиной в 2-3 молекулы при движении фаз остается неподвижным вместе с твердой фазой. Иными словами, непосредственно у поверхности коллоидной частицы образуется адсорбционный слой, включающий не только ПОИ, но и часть противоионов, которые в обычных условиях считаются неподвижными и при движении твердой фазы перемещаются вместе с ней. Остальная часть противоионов составляет диффузный слой, в котором концентрация ионов по мере удаления от поверхности коллоидной частицы постепенно убывает. Между адсорбционным и диффузным слоями идет непрерывный обмен противоионами.
Разность потенциалов между подвижной (диффузной) и неподвижной (адсорбционной) частями двойного электрического слоя называется электрокинетическим потенциалом. Этот потенциал обозначается греческой буквой ζ(дзетта) и потому называется дзетта-потенциалом (ζ-потенциал).
Полное падение потенциала от его значения на твердой поверхности (заряженной отрицательно) до минимального значения соответствует максимальной разности потенциалов между твердой поверхностью и всеми вместе взятыми противоионами. Эту максимальную разность потенциалов называют термодинамическим потенциалом y (рис. 20.3). ζ-потенциал или электрокинетический потенциал составляет часть термодинамического потенциала y и показывает скачок потенциала в диффузной части двойного электрического слоя.
Рис. 20.4 Схема строения ДЭС и кривая падения потенциала
(металл заряжен отрицательно)
Вычисление электрокинетического потенциала ζ определение его знака на практике производят, пользуясь данными электрофореза и электроосмоса, а также потенциала течения, по следующей формуле:
(20.1)
где К – постоянная, зависящая от формы коллоидно-дисперсных частиц (для сферических частиц К=6, цилиндрических – К=4),
h – вязкость дисперсионной среды,
D – диэлектрическая постоянная,
e – градиент напряжения поля,
u – средняя скорость передвижения частиц под действием электрического поля.
Установлено, что величина ζ-потенциала тесно связана с толщиной диффузного слоя противоионов. Чем больше размыт этот слой, тем больше величина электрокинетического потенциала.
Если слой противоионов предельно сжат, ζ-потенциал = 0. Наоборот, разбавление золя способствует увеличению толщины диффузного слоя за счет перехода противоионов из адсорбционного в диффузный слой и приводит к возрастанию значения ζ-потенциала.
Так как ζ-потенциал в некоторых случаях является величиной, характеризующей устойчивость коллоидной системы, необходимо учитывать влияние на него таких факторов, как введение в систему электролитов, изменение pH, концентрации раствора, температуры и т.д.
Индифферентные электролиты (электролиты, не имеющие ионов, способных достраивать кристаллическую решетку коллоидной системы) не могут существенно изменить общий скачок потенциала коллоидных частиц, а электрокинетический потенциал снижается в результате увеличения концентрации противоионов и сжатия двойного электрического слоя.
При введении в коллоидный раствор индифферентных электролитов различают два случая:
1) в систему вводится электролит, один из ионов которого одинаков с противоионами;
2) в систему вводится электролит, не имеющий общих ионов с электролитом – стабилизатором.
В первом случае по мере увеличении содержания в системе такого электролита, очевидно, толщина двойного электрического слоя стремится стать равной толщине адсорбционного слоя за счет сжатия диффузного слоя. В результате электрокинетический потенциал понижается, пока не станет равным 0, что будет отвечать так называемому изоэлектрическому состоянию системы.
Второй случай отличается от первого только тем, что здесь имеет место явление обмена противоионов коллоидной частицы на эквивалентное число одинаковых по знаку ионов введенного электролита.
Значение pH дисперсионной среды может сильно сказываться на электрокинетическом потенциале коллоидных частиц, т.к. водородные и гидроксильные ионы обладают высокой способностью адсорбироваться; первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы; вторые – из-за большого дипольного момента.
Дата добавления: 2014-01-07 ; Просмотров: 3228 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Определение знака и величины электрокинетического потенциала гидрозоля полистирола (латекса) электрофоретическим методом; исследование влияния добавок электролита на » />-потенциал.
1. По скорости перемещения границы раздела фаз гидрозоль полистирола — контактная жидкость рассчитывают электрофоретическую подвижность и по ней — электрокинетический потенциал ( » />-потенциал).
2. Определяют » />-потенциал гидрозоля полистирола в присутствии постороннего электролита (количество электролита устанавливает лаборант или преподаватель).
Электрокинетические явления — электрофорез, электроосмос, потенциал течения и потенциал оседания (см. главу 8 методического указания [2]) обусловлены существованием на границе раздела дисперсной фазы и дисперсионной среды двойного электрического слоя (ДЭС).
Современные представления о строении ДЭС базируются на теории Штерна. Согласно этой теории, ДЭС состоит из заряженной поверхности с потенциалом » /> и противоположно заряженной части слоя, в которой находятся противоионы. Одна часть противоионов примыкает непосредственно к заряженной поверхности, образуя плотный (адсорбционный) слой — слой Гельмгольца. Другая часть противоионов под действием теплового движения распространяется вглубь фазы, образуя так называемый диффузный слой или слой Гуи.
Суммарный заряд противоионов адсорбционного слоя не полностью компенсирует заряд поверхности частицы и на границе раздела адсорбционного и диффузного слоев существует заряд, обуславливающий существование потенциала Штерна » />-потенциала.
При относительном перемещении фаз происходит разрыв двойного электрического слоя по плоскости скольжения. Разрыв ДЭС может произойти даже вследствие броуновского движения частиц дисперсной фазы. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остается в дисперсионной среде. В результате дисперсионная среда и дисперсная фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называют электрокинетическим потенциалом или » /> (дзета)-гютенциалом. В общем случае » />-потенциал всегда меньше » /> потенциала, но для упрощения обычно принимают, что плоскость скольжения делит адсорбционную и диффузную части ДЭС и » /> = » />.
Значение электрокинетического потенциала определяют, изучая электрокинетические явления (обычно электроосмос и электрофорез). Дзета-потенциал, возникающий при электроосмосе или электрофорезе, рассчитывают по уравнению Гельмгольца-Смолуховского
где » /> — вязкость среды; » /> — линейная скорость движения фаз; Е — напряженность электрического поля; » /> — электрофоретическая подвижность, она равна:
Здесь L — расстояние между электродами; V — разность потенциалов; а — сдвиг границы золь — контактная жидкость за время t.
Для изучения электрофореза удобно использовать гидрозоль гидроксида железа или синтетические латексы. Латекс (обычно полистирольный) — это золь, в котором дисперсионной средой является вода, дисперсной фазой — полистирол, стабилизатором — олеат натрия ( » />). Строение мицеллы золя полистирола может быть описано уравнением (8.6), приведенным в методическом указании [2]. Видно, что гранулы таких мицелл имеют отрицательный заряд, и под действием электрического поля они двигаются к положительному электроду (аноду).
Для определения » />-потенциала экспериментально находят скорость движения заряженных частиц дисперсной фазы в электрическом поле, для этого измеряют перемещение за определенное время границы раздела фаз золь — контактная жидкость, в качестве которой используют либо дисперсионную среду золя, либо раствор электролита, электропроводность которого близка к электропроводности золя. Определив сдвиг а границы раздела фаз золь — контактная жидкость за время t, рассчитывают электрофоретическую подвижность по уравнению (8.3).
Электрофорез проводят в U-образной градуированной стеклянной трубке 1 ( рис. 8.1 ). Заполнение трубки производится следующим образом: при закрытом кране 7 в баллончик 6 наливают испытуемый золь. Трубку снимают со стенда, отвинтив зажим 8 обоймы 9, опустив трубку ниже уровня жидкости, находящейся в баллончике, открывают кран 7 и краны 2. Жидкость заполняет трубку 1. Движением трубки 1 вверх и вниз, прижимая рукой каучуковую трубку 3, удаляют задержавшиеся здесь пузырьки воздуха. Затем поднимают трубку так, чтобы уровень золя установился в ней на 1-1.5 см выше кранов 2. Краны 2 и 7 закрывают и, опрокинув трубку 1, выливают из нее золь, находящийся выше кранов 2, в подставленный под прибор лоток.
После этого в трубку 1 с помощью пипетки вливают чистую воду и несколько раз прополаскивают верхнюю часть трубки, далее укрепляют её на стенде, затянув зажимы 8. С помощью пипетки заполняют трубку 1 контактной жидкостью. Контактная жидкость (боковая жидкость) служит проводником тока между электродами и испытуемым золем. Её вливают примерно до половины трубки 1. Затем в верхние отверстия трубки 1 вводят агар — агаровые сифончики 8, один конец которых погружают в электрофоретическую трубку, другой — в небольшой стаканчик 9, наполненный раствором сернокислой меди. На один из концов сифончиков надето резиновое кольцо.
Именно этим концом надо опускать их в раствор сернокислой меди, которая при частом употреблении сифончика пропитывает агар — агаровый студень. Если такой конец, содержащий сернокислую медь в студне, опустить в контактную жидкость, то электролит, диффундируя в золь, может вызвать коагуляцию латекса.
В стаканчики 9 опущены медные пластины 10, соединяющие трубки с электрической цепью. После погружения сифончиков открывают оба крана 2 (одновременно). Задача заключается в том, чтобы границу золя поместить в градуированную часть трубки 1. Для этого осторожно открывают кран 7, и граница золя начинает медленно передвигаться вверх, вместе с ней начинает двигаться и уровень контактной жидкости. Как только уровень контактной жидкости покроет концы сифончиков, кран 7 закрывают. Граница золя теперь расположена в градуированной части трубки. При неосторожном проведении опыта граница может размыться или появятся на ней завихрения. Как только появится тенденция золя к такому завихрению, следует закрыть кран 7 и некоторое время выждать, пока граница вновь не установится. Опыт этот капризен, и его надо проводить очень осторожно, не допуская сотрясений и резких движений.
Сначала проводят определение » />-потенциала полистирольного латекса (или золя гидроксида железа) без добавок постороннего электролита. Для этого заполняют U-образную трубку так, как это описано в 8.4. Записывают в табл. 8.1. положение границы золя в правом и левом колене трубки. Затем на стенд подают постоянный ток от выпрямителя, и засекают это время. Напряжение V измеряют по вольтметру на выпрямителе. Граница золя начинает медленно передвигаться в одном колене вверх, а в другом — вниз. Фиксируют время, необходимое для того, чтобы в трубке с золем (без электролита) перемещение границы золя (сдвиг) произошло на 0,5-1 см (
30 мин). Строго говоря, сдвиг в правом и левом коленах трубки 1 должен быть одинаковым, однако на практике это бывает не всегда. Поэтому берут среднюю величину; если в одном колене граница несколько размывается, то её показания не принимают в расчёт.
После окончания опыта ток выключают. Затем, взяв нить или проволоку, измеряют расстояние между электродами (длину трубки 1), начиная от уровней погружения сифончиков. Длину нити измеряют линейкой. По уравнению (8.3) рассчитывают электрофоретическую подвижность » />. Для водных дисперсионных сред константа уравнения (8.2) равна 140, тогда » />-потенциал можно рассчитать по уравнению:
» /> (в Вольтах)
Далее проводят опыт, аналогичный описанному, но с добавкой постороннего электролита (количество его задает лаборант или преподаватель). Результаты наблюдений и расчетов сводят в табл. 8.1. Делают выводы по работе.
Результаты опытов и расчетов по электрофоретическому определению электрокинетического потенциала
источник
Электрокинетические явления и причины их возникновения.
Электрокинетические явления были открыты профессором Московского университета Ф.Ф.Рейсом в 1808 г. Рейс исследовал явление электролиза воды (недавно открытое Фарадеем).
Электроосмос– явление перемещения жидкой дисперсионной среды относительно неподвижной дисперсной фазы под действием электрического поля.
Электрофорез – явление перемещения дисперсной фазы относительно жидкой дисперсионной среды под действием электрического поля.
Потенциал течения – возникновение разности потенциалов при движении дисперсионной среды относительно неподвижной дисперсной фазы.
Потенциал оседания (седиментации) – возникновение разности потенциалов при движении дисперсной
фазы относительно дисперсионной среды.
Электрокинетическими явления – это явления, в которых существует связь между скоростью протекания (кинетикой) и электрическим полем.
Причиной электрокинетических явлений является наличие на границе раздела фаз двойного электрического слоя (ДЭС).
Электрокинетический потенциал и методы его определения.
Электрокинетический (дзета) потенциал – потенциал, возникающий на границе скольжения фаз при их относительном перемещении в электрическом поле. Электрокинетический потенциал отражает свойства ДЭС и определяется экспериментально из электрокинетических явлений.
Электрокинетический потенциал является важнейшей характеристикой коллоидной системы, ее двойного электрического слоя, поскольку он не зависит от параметров системы, в которой находится золь (радиус, длина, форма пор диафрагмы). Электрокинетический потенциал является однозначной характеристикой электрических свойств данной границы раздела и определяется экспериментально из электрокинетических явлений, связанных с относительным перемещением фаз. Порядок величин ζ в зависимости от состава фаз и концентрации электролита обычно составляет 0,01÷0,1 В.
Скорость, как электрофореза, так и электроосмоса, при постоянной разности потенциалов пропорциональна величине ζ потенциала. Поэтому, определяя скорость перемещения заряженных частиц или скорость перемещения жидкости, можно вычислить величину электрокинетического потенциала.
Скорость перемещения коллоидной частицы в электрическом поле зависит:
— от свойств дисперсионной среды (вязкости η, диэлектрической проницаемости ε);
— от строения ДЭС коллоидной частицы — величины ζ,
— напряженности внешнего электрического поля Н.
Электрофоретической (электроосмотической) подвижностью (U0):
U
где U0 – электрофоретическая подвижность, м2/В·с; U – линейная скорость движения границы золь – боковая жидкость, м/с; H – напряженность электрического поля, В/м.
Электрокинетический потенциал связан с электрофоретической (электроосмотической) подвижностью, уравнением Гельмгольца – Смолуховского:
где ζ – величина электрокинетического потенциала, В; η – вязкость среды, Н·с/м2; ε – диэлектрическая проницаемость среды, для водной среды равная 81 (безразмерная величина);

Линейную скорость движения границы золь:
где h – смещение границы золь — боковая жидкость за время элетрофореза, м; t – время электрофореза, с.
Напряженность электрического поля (градиент потенциала) расчитывают как отношение приложенной разности потенциалов к растоянию между электродами:
где Е – приложенная разность потенциалов, В; l – расстояние между электродами, м.
Тогда уравнение Гельмгольца — Смолуховского для электрофореза запишется:
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.002 с) .
источник
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
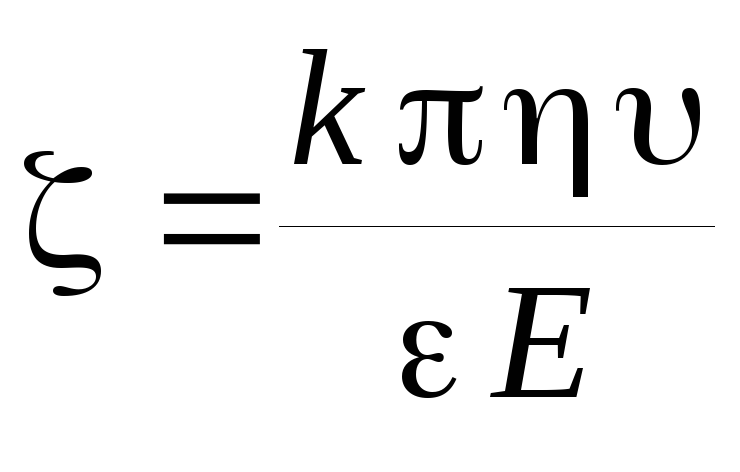
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
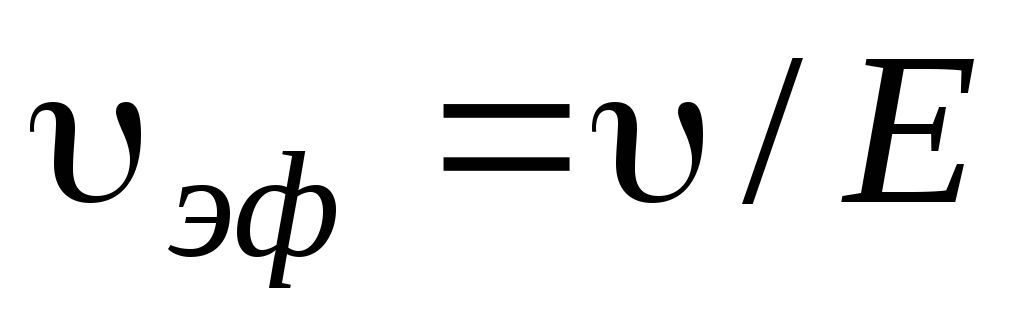
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
К осаждению дисперсной фазы — характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
лиофильные, обладающие термодинамической устойчивостью;
лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса G min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
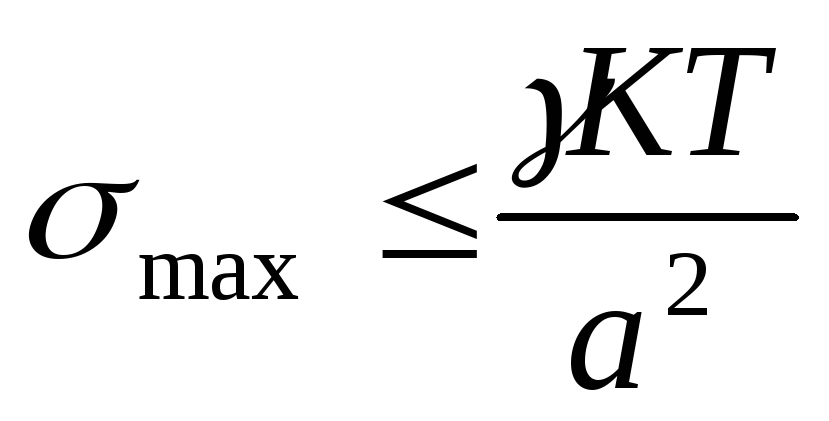
где ỵ езразмерный коэффициент;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,410 -7 до 1,410 -3 Дж/м 2 . Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Правила коагуляции электролитами. Порог коагуляции. Правило Шульце-Гарди. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия — явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
источник

