Электрокинетические явления
Влияние природы дисперсионной среды
Влияние рН среды
Введение в золь ионов Н + и ОН — может сильно сказываться на величине z-потенциала, так как эти ионы обладают высокой сорбционной способностью: первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы, вторые – из-за большого дипольного момента (большой поляризуемости).
Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью e и вязкостью m.
z-потенциал частиц золя тем больше, чем больше e (полярность растворителя).
Чем больше вязкость, тем толще слой дисперсионной среды, который прилипает к частице при разрыве мицеллы и, следовательно, тем меньше численное значение z-потенциала.
Электрокинетические явления – это явления, которые возникают при воздействии электрического поля на дисперсную систему (электрофорез, электроосмос), а также в результате перемещения частиц дисперсной фазы или дисперсионной среды (потенциал протекания, потенциал оседания).
Несмотря на различие электрокинетических явлений, все они связаны с наличием ДЭС на частицах дисперсной фазы. Интенсивность всех электрокинетических явлений определяется значением z-потенциала.
Электрофорез – направленное движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля.
При наложении внешнего электрического поля происходит разрыв мицеллы: частицы дисперсной фазы вместе с адсорбированными на них потенциалопределяющими ионами и противоионами адсорбционного слоя перемещаются к электроду, знак которого противоположен знаку заряда коллоидной частицы (z-потенциалу), а противоионы диффузионного слоя – к другому электроду. Например, если дисперсная фаза заряжена отрицательно, коллоидные частицы движутся к аноду (положительному электроду), а положительно заряженные противоионы диффузного слоя – к катоду (рис. 32).
Если дисперсная фаза заряжена положительно, направление движения частиц меняется на противоположное.
|
Скорость движения, или электрофоретическая скорость, зависит от величины электрокинетического потенциала z, напряженности электрического поля E/L и свойств сплошной среды – динамической вязкости μ и диэлектрической проницаемости e:
,
где u – электрофоретическая скорость; z – электрокинетический потенциал; e – диэлектрическая проницаемость среды; e – электрическая постоянная, e = 8,85×10 -12 Кл/(В×м); Е – разность потенциалов внешнего электрического поля; L – расстояние между электродами; E/L=H –напряженность, или градиент, внешнего электрического поля; m – динамическая вязкость сплошной среды; y – фактор формы.
Коэффициент y учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент y равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля – 1.
Скорость движения в расчете на единицу напряженности электрического поля Н называется электрофоретической подвижностью
.
Электрофоретическая подвижность зависит только от свойств дисперсной фазы и дисперсионной среды.
На подвижность коллоидной частицы оказывают влияние электрофоретический и релаксационный эффекты.
Электрофоретический эффект (эффект торможения): под действием внешнего электрического поля противоионы передвигаются в направлении, противоположном движению частицы. За счет гидратации противоионы увлекают за собой и окружающую их жидкость (дисперсионную среду). Это приводит к тому, что частица перемещаются в направлении, противоположном движению жидкости, скорость ее уменьшается.
Релаксационный эффект вызывается нарушением симметрии ДЭС вокруг частицы при ее движении. ДЭС деформируется и отстает от частицы. В результате возникает добавочное электрическое поле, которое действует на частицу, стремясь двигать ее в обратном направлении, и тем самым влияет на скорость электрофореза.
Для учета влияния этих факторов в уравнение для расчета электрофоретической скорости и вводится коэффициент y.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9438 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Электрофорезом называется движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля
Экспериментально электрофорез обнаруживается по выделению дисперсной фазы на одном из электродов или в приэлектродном пространстве, по смещению границы раздела коллоидная система — дисперсионная среда к одному из электродов (макроэлектрофорез), а также путем наблюдения за перемещением отдельных частиц с помощью микроскопа (микроэлектрофорез)
В теории электрофореза, разработанной Смолуховским, Гюккелем и другими авторами, движение частицы в электрическом поле рассматривается как результат действия на ее поверхностный заряд электрической силы F1 и силы сопротивления среды F2
В стационарных условиях, т е. когда F1+F2=0 и при ca>>1 (где c-параметр Дебая; a—радиус частицы), для скорости электрофореза получено уравнение
; (9)
Таблица 1 Зависимость функции f от ca
| ca | f |
| 0,1 | 1,0005 |
| 0,3 | 1,0040 |
| 1,0 | 1,0267 |
| 3,0 | 1,1005 |
| 5,0 | 1,1630 |
| 10,0 | 1,2500 |
| 20,0 | 1,3400 |
| 50,0 | 1,4200 |
| 100,0 | 1,4580 |
Если толщина ДЭС мала по сравнению с размером частицы, т.е. ca>>1, f®1.5,уравнение превращается в формулу (3), предложенную Смолуховским; если ca >1(тонкий ДЭС), а также в случае слабозаряженных частиц поправкой на электрическую релаксацию можно пренебречь.
Для сравнения способности к электрофорезу различных дисперсных систем пользуются электрофоретической подвижностью — линейной скоростью движения частиц при единичной напряженности электрического поля:
. (12)
Электрофорез широко применяют в практике для получения электрофоретических покрытий и электрокоагуляции суспензий.
Образование электрофоретического осадка на поверхности электрода представляет собой многостадийный процесс, в котором основными стадиями являются следующие:
1) подвод и концентрировать частиц у поверхности электрода;
2) стесненная коагуляция в приэлектродном пространстве.
При осаждении из коллоидных систем и суспензий, содержащих частицы размером меньше 1 мкм, подвод частиц и их концентрирование у поверхности электрода происходит в основном за счет сил, действующих на поверхностный заряд частиц.
Скорость подвода и масса образующегося на электроде осадка зависят от характера электрического поля. При осаждении в неоднородном электрическом поле, заданном системой двух соосных цилиндрических электродов, массу осадка m, образующегося на центральном электроде за время t, рассчитывают по формуле
, (13)
. (14)
Здесь e—диэлектрическая проницаемость; e = = 8,85-10 -12 Ф/м; z—электрокинетический потенциал; U— разность потенциалов; h—вязкость дисперсионной среды; l—длина покрытой части электрода; с — концентрация суспензии; ст — концентрация суспензии в приэлектродной зоне: г1 и г2—радиусы цилиндрических электродов.
При выводе этой формулы предполагалось, что лимитирующей стадией процесса является доставка частиц к электроду и, следовательно, стесненная коагуляция протекает быстро при достижении предельного значения ст.
При осаждении в однородном электрическом поле, образованном системой параллельно расположенных плоских электродов, массу электрофоретического осадка рассчитывают по формуле
, (15)
где uэф—электрофоретическая подвижность; Е — напряженность поля; с—концентрация суспензии; t—время осаждения; S — поверхность электрода.
Дата добавления: 2015-08-31 ; Просмотров: 1364 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Электрофорез — направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов. Это явление наблюдается в седиментационно устойчивых дисперсных системах. При наложении на такую систему внешней разности потенциалов происходит разрыв ДЭС по плоскости скольжения, в результате чего частица получает заряд и перемещается к соответствующему электроду.
Приведенные выше уравнения Гельмгольца — Смолуховского справедливы для электрофореза, в частности для электрокинетического потенциала используется уравнение (4.9). Отличие состоит только в системе координат: в одном случае рассматривается скорость жидкости, в другом — скорость движения частиц, которую обычно определяют по смещению цветной границы.
Электрофорез наблюдают в U-образном сосуде (см. лабораторный практикум). В нижнюю часть сосуда наливают золь, сверху — контактную (боковую) жидкость, имеющую одинаковую (или немного большую) с золем электрическую проводимость. Наблюдают за изменением уровня золя в обоих коленах трубки и по скорости перемещения частиц дисперсной фазы определяют линейную скорость электрофореза Wq :
где S — путь, пройденный золем за время г (время электрофореза).
При электрофорезе отношение линейной скорости к напряженности
электрического поля 
Напряженность электрического поля Е зависит от приложенной разности потенциалов на электродах U и расстояния между ними L:
Рассмотренные уравнения справедливы при допущениях: 1) частицы движутся в однородном электрическом поле; 2) частицы могут иметь любую форму и не проводят электрический ток; 3) толщина ДЭС много меньше размеров частиц золя.
Для расчета ^-потенциала частиц, находящихся в разбавленных водных растворах при 293 К, можно использовать простое соотношение:
в котором электрофоретическая подвижность и, выражена в(тогда
^-потенциал будет иметь размерность В).
Несовпадение экспериментальных и теоретических значений объясняется релаксационным эффектом и электрофоретическим торможением.
Релаксационный эффект проявляется в нарушении симметрии диффузионного слоя вокруг частицы при относительном перемещении фаз в противоположные стороны.
Электрофоретическое торможение обусловлено сопротивлением движению частицы обратным потоком противоионов, которые увлекают за собой жидкость. В некоторых случаях несовпадение можно учесть введением поправок, иногда этим несовпадением можно пренебречь.
Скорость электрофореза зависит нс только от приложенного напряжения, но и от радиуса частиц и других факторов. Это можно учесть введением в уравнение (4.8) поправочного коэффициента к:
Поправочный коэффициент определяется экспериментально в каждом отдельном случае электрофореза.
Для примера рассмотрим данные по электрофорезу в суспензиях глин Трошковского, Никольского и Слюдянского месторождений, микрофотографии которых приведены на рис. 1.1.
Электрокинетический потенциал определяли методом подвижной границы при электрофорезе и рассчитывали по уравнению:
где S — путь;
L — расстояние между электродами;
U — разность потенциалов между электродами;
г — преимущественный радиус частицы, определяемый обычно по максимуму на кривой распределения частиц но размерам;
/(к г) — поправочная функция, учитывающая эффекты электрофоретического торможения и релаксации (табл. 4.1);
к — параметр Дебая, равный обратной величине плотной части двойного электрического слоя, то есть к = 1/6.
источник
Направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов называется электрофорезом.
Электрофоретическое движение частиц в электролите имеет родственную электроосмосу природу: внешнее электрическое поле увлекает ионы подвижной части ДЭС, заставляя слои жидкости, граничащие с частицами, перемещаться относительно поверхности частиц. Однако в силу массивности объема жидкости и малости взвешенных частиц эти перемещения сводятся в отсутствие внешних сил к движению частицы в покоящейся жидкости. Для непроводящих частиц с плоской поверхностью в системах с тонкой диффузной частью ДЭС скорость электрофореза совпадает со скоростью электроосмотического скольжения, взятой с обратным знаком. Для проводящих сферических частиц скорость электрофореза м. б. рассчитана по уравнению:
где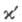
Эффект Дорна связан с конвективным переносом ионов диффузной части ДЭС при движении частицы в электролите. Конвективные потоки ионов поляризуют двойной слой, и частицы в целом приобретают дипольный момент. При этом силовые линии электрического поля выходят за пределы двойного слоя. При движении в электролите ансамбля частиц с дипольными моментами, имеющими одну и ту же ориентацию, порождаемые этими моментами электрического поля складываются, и в системе возникает однородное электрическое поле, направленное параллельно (или антипараллельно) скорости движения частиц (группу движущихся с одинаковой скоростью частиц можно рассматривать как своеобразную мембрану, сквозь которую протекает электролит). Если частицы движутся в пространстве между двумя электродами, то на последних возникает разность потенциалов, которая была измерена математически. В частном случае осаждения ансамбля частиц под действием сил гравитации эта разность потенциалов называется потенциалом оседания (седиментационным потенциалом).
Электрофорез и эффект Дорна м. б. описаны парой феноменологических уравнений неравновесной термодинамики с кинетическими коэффициентами l11, l12, l21 и l22:
где v — скорость движения частицы;
F — действующая на нее сила;
Е — напряженность внешнего электрического поля;
М — индуцированный на частице дипольный момент.
Кинетические коэффициенты, определяющие скорость электрофореза и дипольный момент в эффекте Дорна, удовлетворяют соотношению Онсагера:
2. Практическое использование электрокинетических явлений
Электрокинетические явления широко используются в науке и технике. Наибольшее их практическое применение связано с нанесением покрытий на различные поверхности электрофоретическим методом. Данный метод позволяет получать равномерные покрытия на деталях сложной конфигурации благодаря его высокой кроющей способности. При электрофоретическом методе нанесения покрытий, как правило, одним из электродов является покрываемая деталь, а другим ёмкость, заполняемая суспензией, дисперсная фаза которой наносится на поверхность детали. В зависимости от того, каким электродом является покрываемая деталь, различают анодофорез и катодофорез. В общем случае процесс электрофоретического нанесения покрытий состоит из ряда сопряженных стадий: направленное перемещение заряженных частиц, коагуляция их в приэлектродном пространстве, электродные химические реакции. После того как на электроде сформируется покрытие, как правило, наблядается электроосмос, в результате которого жидкость выходит из покрытия и оно становится более плотным.
В нашей стране эксплуатируются автоматические линии грунтовки кузовов автомобилей электрофоретическим методом. Применение таких линий позволило резко увеличить эффективность процесса грунтовки, улучшить качество окраски, сократить расход краски. Электрофоретический метод широко применяется для покрытия катодов радиоламп, полупроводниковых деталей, нагревателей и т. д. Электрофорез используется в медицине, в биологии при выявлении биохимической и физиологической роли различных высокомолекулярных соединений. Этот метод используется также для фракционирования полимеров различной природы и минеральных дисперсий.
Электрофорез лекарственный — это один из методов физиотерапии, который заключается в одновременном воздействии на организм постоянного электрического тока и вводимых им (через кожу или слизистые оболочки) ионов лекарственных веществ. Доказано, что при электрофорезе повышается чувствительность рецепторов к лекарственным веществам, которые полностью сохраняют свои фармакологические свойства. Основные особенности электрофореза — выраженное и продолжительное терапевтическое действие малых доз лекарственных веществ за счёт создания своеобразного кожного депо применяемых препаратов, а также возможность оказывать местное воздействие при некоторых патологических состояниях (например, при местных сосудистых расстройствах), затрудняющих поступление препарата в патологический очаг из крови.
При электрофорезе возможно одновременное применение нескольких лекарственных веществ. В ряде случаев для электрофореза используют также импульсный ток постоянного направления, что повышает лечебный эффект метода. Источники тока, а также правила проведения электрофореза такие же, как при гальванизации. Для электрофореза оба электрода с прокладками, смоченными раствором лекарственного вещества, располагают на коже либо один из них помещают в полости носа, уха, во влагалище и других; в некоторых случаях вместо прокладки используют ванночку с раствором лекарственного вещества, в которую опущен угольный электрод. Электрофорез применяют при заболеваниях центральной и периферической нервной системы, опорно-двигательного аппарата, гинекологических заболеваниях и др.
Практическое применение электроосмоса ограничено из-за большого расхода электроэнергии. Тем не менее, это явление используется для удаления влаги при осушке различных объектов (стен зданий, сыпучих материалов, при строительстве плотин, дамб и т. д.), для пропитки материалов различными веществами. При электроосмотической осушке в объект вводят электроды, представляющие собой полые металлические трубы с отверстиями. В замкнутой электрической цепи происходит электроосмотический перенос жидкости к определенному электроду, которая собирается в нем, и затем ее откачивают наносом. Все большее значение приобретает электроосмотическая фильтрация, сочетающая в себе два процесса: фильтрацию под действием приложенного давления и электроосмотический перенос жидкости в электрическом поле.
Итак, из данного реферата можно сделать следующие выводы: Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания). Перенос коллоидных частиц в электрическом поле называется электрофорезом, а течение жидкости через капиллярные системы под влиянием разности потенциалов – электроосмосом.
Также эти явления получили достаточно широкое практическое применение в медицине, строительстве, автомобилестроении и т. д. Так, например, с помощью электрофореза проводят формование различных изделий из тонких взвесей с последующим их спеканием. Метод электрофореза широко применяют для разделения, выделения и исследования биоколлоидов, особенно белков. А путём электроосмоса удаляют влагу из капиллярнопористых систем и понижают уровень грунтовых вод при возведении гидротехнических и других сооружений. Возникновение электрических полей при течении грунтовых вод нашло применение в геологической разведке полезных ископаемых и водных источников.
Список используемых источников
1. Глинка Н. Л., Общая химия, Л.,1985
2. Фролов Ю.Г., Курс коллоидной химии. Поверхностные явления и дисперсные системы, М., 1982
3. Кройт Г., Наука о коллоидах, пер. с англ., М., 1955
источник
Электрофорез — это процесс направленного движения частиц, диспергированных в жидкости в постоянном электрическом поле. Частицы одного и того же вещества несут одинаковые по знаку заряды. В электрическом поле положительно заряженные частицы перемещаются к отрицательному электроду — катоду, отрицательно заряженные частицы к положительному электроду — аноду. Движение частиц к катоду иногда называют катафорезом, к аноду — анафорезом. Скорость движения зависит от массы частиц, и их заряда в данных условиях, благодаря чему электрофорез позволяет разделять смеси веществ на составляющие их компоненты.
Различают следующие виды электрофореза. 1. Свободный (фронтальный) электрофорез. В этом случае электрофорез проводят в приборах, существенной частью которых является U-образная трубка (Рис. 1). Нижнюю часть трубки заполняют испытуемым объектом, например раствором белка, на который наслаивают растворитель. В растворитель погружают электроды, соединенные с источником постоянного тока. При этом электрически заряженные частицы белка перемещаются к одному из электродов, вследствие чего граница раздела между раствором и растворителем в одном колене поднимается (восходящая граница), а в другом опускается (нисходящая граница). Приборы для свободного электрофореза, снабженные устройством автоматической регистрации перемещения каждого компонента в исследуемом объекте, применяют при анализе дисперсных систем, выделении из них отдельных компонентов, а также при клиническом исследовании сыворотки крови.
2. Электрофорез на носителях (зональный электрофорез). В качестве носителей используют бумагу, гели крахмала, агара, полиуретанов и др. В клинических лабораториях особо широкое распространение для исследования сыворотки крови получил электрофорез на бумаге, который проводится следующим образом: на полоску специального сорта бумаги, пропитанной соответствующим буферным раствором (см.), наносят капельку сыворотки крови. Концы полоски опускают в чашечки, заполненные данным буферным раствором и снабженные электродами. При пропускания постоянного электрического тока отдельные белки сыворотки перемещаются вдоль полоски с разными скоростями, а иногда и в разных направлениях. По истечении определенного времени пропускание тока прекращают, полоску бумаги подсушивают и обрабатывают реактивом на белок. При этом на бумажной электрофореграмме выявляются окрашенные пятна. По числу пятен судят о количестве белковых фракций, а по интенсивности окраски пятен — о количественном содержании каждой белковой фракции в исследуемой сыворотке.
В последнее время широкое применение в исследовательской работе и в клинической диагностике находит электрофорез в тонких слоях гелей, нанесенных на стеклянные пластинки (дисковый электрофорез), а также помещенных в стеклянные трубочки.
Электрофоретические исследования. В клинической практике применяется зональный электрофорез для исследования белкового состава жидкостей организма. Чаще используют электрофорез на бумаге как наиболее простой по технике выполнения. Электрофорез в агаровом и крахмальном гелях используется в медицинской практике преимущественно в научных исследованиях.
При помощи электрофореза на бумаге разделяют в крови фракции белков, липопротеидов, глюкопротеидов, а также белковые фракции мочи, желудочного сока, экссудатов и т. п. В крови электрофорез выявляет 5 основных фракций белка: альбумины, альфа-1 (α1) альфа-2(α2)-, бета(β)- и гамма(γ)-глобулины. В норме их соотношение более или менее постоянно. При некоторых заболеваниях эти соотношения меняются, что может иметь диагностическое и прогностическое значение. Так, например, при острых воспалительных процессах увеличивается содержание в крови α2-глобулинов; в период выработки иммунитета нарастает содержание γ-глобулинов; при поражениях печени снижается содержание альбуминов и т. п. При некоторых заболеваниях (например, при миеломной болезни) в плазме крови появляются патологические белки (парапротеины), которые могут быть выявлены с помощью методов электрофореза, что имеет большое диагностическое значение.
Электрофорез — явление направленного движения ультрамикроскопических и микроскопических частиц под влиянием приложенной извне разности потенциалов, наблюдаемое в суспензиях, эмульсиях, коллоидных растворах, растворах высокомолекулярных соединений (например, белков нуклеиновых кислот, полисахаридов и др.).
Электрофорез объясняется наличием у микроскопических и ультрамикроскопических частиц электрических зарядов, которые возникают в результате избирательной адсорбции частицами ионов из окружающей их дисперсионной среды или вследствие диссоциации ионогенных групп, входящих в состав поверхности частиц. Знак электрического заряда частицы зависит как от природы самих частиц, так и от состава дисперсионной среды. Частицы одного и того же вещества могут заряжаться как положительно, так и отрицательно при изменении состава дисперсионной среды. Так, например, макромолекулы белка в растворах, рН которых меньше изоэлектрической точки данного белка (см. Амфолиты), заряжены положительно и перемещаются в электрическом поле к отрицательному полюсу — катоду, а в растворах, рН которых больше изоэлектрической точки белка, его макромолекулы заряжены отрицательно и движутся к положительному полюсу — аноду. Движение частиц к катоду иногда называют катафорезом, к аноду — анафорезом.
Для изучения электрофореза применяют несколько методов.
Наиболее точен фронтальный электрофорез, или метод подвижной границы. Приборы, применяемые для фронтального электрофореза, разнообразны по конструкции, но каждый из них включает электрофоретическую кювету — обычно U-образную трубку (рис. 1). Нижнюю часть трубки заполняют исследуемой жидкостью, например коллоидным раствором, на который наслаивают разбавленный раствор электролита с электропроводностью, равной электропроводности коллоидного раствора. В открытые колена трубки помещают неполяризующиеся электроды, соединенные с источником постоянного тока. При включении тока коллоидные частицы единым фронтом (так как частицы в данном коллоидном растворе имеют одинаковые но знаку электрические заряды) перемещаются к одному из электродов, в результате чего граница раздела между коллоидным раствором и раствором электролита в одном колене трубки поднимается (восходящая граница), а в другом колене соответственно опускается (нисходящая граница). Перемещение границы раздела легко наблюдать, если коллоидный раствор окрашен. Если коллоидный раствор бесцветен, границу раздела между ним и раствором электролита можно сделать видимой, освещая аппарат сбоку; при этом коллоидный раствор будет опалесцировать. Иногда для этой цели используют способность коллоидных растворов или растворов высокомолекулярных соединений флюоресцировать под действием ультрафиолетовых лучей.
Рис. 1. Электрофоретическая кювета (схема): 1 — исследуемая жидкость; 2 — разбавленный раствор электролита; 3 — электроды.
Скорость U электрофоретического перемещения связана с электрокинетическим потенциалом частиц (разность потенциалов, устанавливающаяся между границей скольжения частицы и дисперсионной средой) соотношением:
где D — диэлектрическая проницаемость дисперсионной среды, H — падение потенциала электрического поля на единицу длины, п — 3,14, η — вязкость дисперсионной среды и к — постоянная, зависящая от формы частиц (для малых сферических частиц к— С, для цилиндрических частиц к—4). Величину U/H, т. е. скорость электрофоретического перемещения частиц, рассчитанную для падения потенциала 1 в/см, называют электрофоретической подвижностью. Эта величина, имеющая размерность см 2 в-1 сек-1, для белков (вблизи изоэлектрической точки) равна 0,4—0,8·10 -4 , для эритроцитов различных животных — 1,0—1,7·10 -4 и т. п.
Совершенная техника фронтального электрофореза сложных смесей белков и других биополимеров была разработана в 1937 г. Тизелиусом (A. Tiselius). Прибор Тизелпуса и различные его модификации, дающие возможность автоматически регистрировать передвижение границы раздела каждого компонента в смеси при помощи специальных оптических устройств и особых диаграмм — электрофореграмм (рис. 2), получили широкое распространение для исследования нормальных и патологических сывороток, установления состава белковых смесей, определения чистоты белков.
Рис. 2. Электрофореграммы по Тизелиусу: 1 — нормальная сыворотка человека; 2 — плазма крови при множественной миеломе; 3 — сыворотка крови при нефрозе.
Зональный электрофорез проводится в среде какого-либо индифферентного носителя, например в гелях агара, крахмала, желатины, а также на специальных сортах фильтровальной бумаги. Особенно широкое распространение получил электрофорез на бумаге (бумажный электрофорез) при исследовании и разделении белков, нуклеиновых кислот, стеринов, аминокислот, жирных кислот и других биологически активных веществ. Электрофорез на бумаге проводится при падении потенциала порядка 15—20 В/см и силе тока 3—5 мА. Исследуемую смесь (обычно 0,01—0,04 мл раствора в буфере) наносят в виде линии на середину полоски бумаги, концы которой погружены в электродные растворы, снабженные неполяризующимися электродами. По окончании электрофореза бумагу высушивают, в случае необходимости обрабатывают специальным реактивом, окрашивающим отдельные компоненты смеси, которые образуют несколько полос в соответствии с числом компонентов. По интенсивности окраски полос электрофореграммы можно судить об относительном количестве каждого компонента в смеси.
Микроскопический метод электрофореза состоит в определении скорости передвижения в электрическом поле видимых в микроскоп частиц — бактериальных клеток, эритроцитов, частиц суспензий и эмульсий и др. Для микроэлектрофореза применяют специальные микрокюветы, снабженные электродами.
источник
Направленное перемещение частиц дисперсной фазы под действием электрического поля может наблюдаться в седиментационно-устойчивых дисперсных системах. При этом происходит разрыв ДЭС по плоскости скольжения, в результате частица приобретает определенный заряд и движется к соответствующему электроду.

Рис. 18. Схема движения коллоидных частиц в электрическом поле.
Линейная скорость (U) – движение частиц относительно мембраны при электроосмосе и движение частиц при электрофорезе:
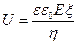
где 
При движении частиц дисперсной фазы они вынуждены взаимодействовать с противоионами дисперсионной среды, что вызывает электрофоретическое торможение, что уменьшает линейную скорость при электрофорезе.
Электрофоретическое торможение 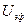
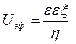
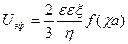
где f — параметр Дебая, α – диаметр частицы. Единицы измерения электрофоретического торможения 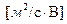
Характеристикой электрофореза является также электрофоретическая подвижность, которая характеризует электрофоретические свойства системы без учета влияния внешнего электрического поля и служит для сравнения способности к электрофорезу различных коллоидных систем.
При исследовании явления электроосмоса для практического применения при расчете электрокинетического потенциала удобнее использовать уравнение, в которое входят величины, измеряемые экспериментально. Выразим линейную скорость через объёмную:
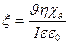
где r – радиус капилляра, l – длина капилляра, I – сила тока, ρ – удельное сопротивление, χv – удельная электрическая проницаемость жидкости, R – сопротивление.
Пи расчете электрокинетического потенциала и при выборе оптимального режима ряда технологических процессов (проведение электродиализа, определении пористости грунтов т.д.) необходимо учитывать поверхностную проводимость χs – это явление сводится к тому, что находящиеся около межфазной границы ионы изменяют состав среды, они являются причиной передвижения жидкости или частиц. Изменение состава среды ведёт к изменению электропроводности раствора у межфазной границы.
Поверхностная проводимость χs учитывается путём введения коэффициента эффективности диафрагмы α:
Путём электроосмоса удаляют влагу из капиллярнопористых систем и понижают уровень грунтовых вод при возведении гидротехнических сооружений.
Метод электрофореза применяют для формирования изделий из тонких взвей последующим спеканием для разделения, выделения и исследования биоколлоидов, особенно белков.
Возникновение электрических полей при течении грунтовых вод помогает в геологической разведке полезных ископаемых и водных источников.
источник
Все электрокинетические явления связаны с относительным перемещением дисперсной фазы и дисперсионной среды, осуществляемой по границе скольжения. Их интенсивность определяется значением ζ-потенциала. Поэтому данную величину используют для оценки электрокинетических явлений.
Двойной электрический слой можно рассматривать в качестве своеобразного конденсатора (рис. 7.9). Относительность движения дисперсной фазы и дисперсионной среды определяется силами f1и f2. Сила f1возникает в результате взаимодействия избытка зарядов потенциалобразующего слоя по отношению к адсорбционному слою; она характеризует заряд диффузного слоя и направлена параллельно границе скольжения (линия АА), противодействуя силе трения. Сила f1определяется по формуле
где Е — напряженность или градиент внешнего поля; qB— плотность заряда поверхности.
Сила f2определяет трение жидкости при ее перемещении:
где h — коэффициент трения; ω — скорость движения жидкости; h — расстояние между поверхностями (см. рис. 7.9).
При установившемся движении эти силы равны, т.е.
Формула (7.11) определяет скорость взаимного перемещения дисперсной фазы и дисперсионной среды. Удельный заряд qВможно связать с φ-потенциалом:
где εа— абсолютная диэлектрическая проницаемость.
Подставляя равенство (7.12) в формулу (7.11), получим
Скорость движения в расчете на единицу напряженности электрического поля называют электрофоретической подвижностью, которая определяется по формуле
С учетом формы частиц дисперсной фазы уравнения (7.13) и 7.14) принимают следующий вид:
(7.15) (7.16)
где v — скорость, м/с; vE— электрофоретическая подвижность, м 2 /с ∙ В, Ψ — коэффициент, зависящий от формы частиц; ζ — дзета-потенциал, В; Е — напряженность или градиент внешнего электрического поля, В/м.
Коэффициент Ψ учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент Ψ равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля — 1.
Абсолютная диэлектрическая проницаемость среды εа= ε ∙ ε, где ε — относительная диэлектрическая проницаемость; ε— абсолютная диэлектрическая проницаемость вакуума, или электрическая постоянная, равная 8,85∙10 —12 K 2 /H∙м 2 (8,85∙10 —12 Ф/м).
С учетом значения абсолютной диэлектрической проницаемости формулу (7.15) можно представить в виде
или (7.17)
Согласно формуле (7.17) величины, которые определяют интенсивность электрофореза и электроосмоса, зависят от свойств среды (η, ε), формы частиц (Ψ), напряженности внешнего электрического поля (Е) и электрокинетического потенциала (ζ), определяемого структурой ДЭС.
Электрофоретическую подвижность и электрокинетический потенциал довольно просто определить экспериментально по скорости перемещения дисперсной фазы; электрофоретическая подвижность обычно не превышает 5,0∙10 —8 м 2 /с∙В, а электрокинетический потенциал — 100 мВ.
В формулах (7.15) и (7.17) не учитывается ряд особенностей дисперсных систем, например электропроводность частиц дисперсной фазы, специфические свойства дисперсной системы в случае ее нахождения в щелях, каналах и капиллярах. Тем не менее, эти формулы являются основными для количественной характеристики электрокинетических явлений.
Для расчета потенциала течения Еткоторый осуществляется под внешним воздействием Р1(см. рис. 7.8), можно воспользоваться следующей формулой:
(7.18)
где ΔР = Р1— Р2— перепад давления при течении дисперсионной среды; χ — удельная электропроводность дисперсионной среды.
Заметим, что потенциал течения возникает на любой границе раздела фаз при перемещении дисперсной фазы или дисперсионной среды. Так, например, кровь организма человека является дисперсной системой. Сердце, как своеобразный насос, заставляет кровь двигаться по сосудам. Потенциал течения крови составляет примерно 1—2 мВ, т.е. незначителен. При движении нефти по трубопроводам потенциал течения намного выше и может привести к электрическому пробою, пожару или взрыву. По той же причине наливать бензин в полиэтиленовую емкость крайне опасно, так как при опорожнении канистры возникает потенциал течения, который может вызвать искру и воспламенить бензин.
Таким образом, электрокинетические явления и электрофоретическую подвижность можно рассматривать как следствие образования ДЭС на границе раздела фаз. Возможность и интенсивность относительного перемещения фаз определяется величиной z-потенциала, которая обусловлена структурой ДЭС.
1. Электрокинетический потенциал высокодисперсных частиц золя апельсинового сока равен 50 мВ. Определите скорость электрофореза и электрофоретическую подвижность частиц золя сферической формы, если относительная диэлектрическая проницаемость среды e равна 54,8, внешняя ЭДС — 120 В, расстояние между электродами h = 40 см, вязкость среды η= 4,5∙10—3Па ∙ с.
В соответствии с формулой (7.17) при Е = E1/h
2. Определите электрокинетический потенциал коллоидов 20%-го раствора сахарозы при градиенте внешнего электрического поля 400 В/м, относительной диэлектрической проницаемости ε = 69,1, вязкости η = 2,5∙10—3Па ∙ с и скорости электрофореза v = 13.5 мкм/с.
3. Найдите значения потенциала течения, если через мембрану продавливается 42,4%-й раствор спирта при следующих условиях: ΔР = 20∙10 —3 Па, удельная электропроводность χ = 1,3∙ 10—3См ∙ м —1 , относительная диэлектрическая проницаемость ε = 41,3, вязкость η = 0,9∙10 —3 Па∙с, электрокинетический потенциал ζ = 6∙10 —3 В.
4. Чему равен электрокинетический потенциал при протекании 0,01 М раствора КСl через керамический фильтр под избыточным давлением (ΔР) 3,1∙10 4 Па и потенциале течения Ет = 1,2∙10 —2 В. При 298 К вязкость раствора η = 8,94∙10 —4 Па∙с, удельная электропроводность χ = 0.141 См∙м —1 , относительная диэлектрическая проницаемость ε = 78,5.
источник
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
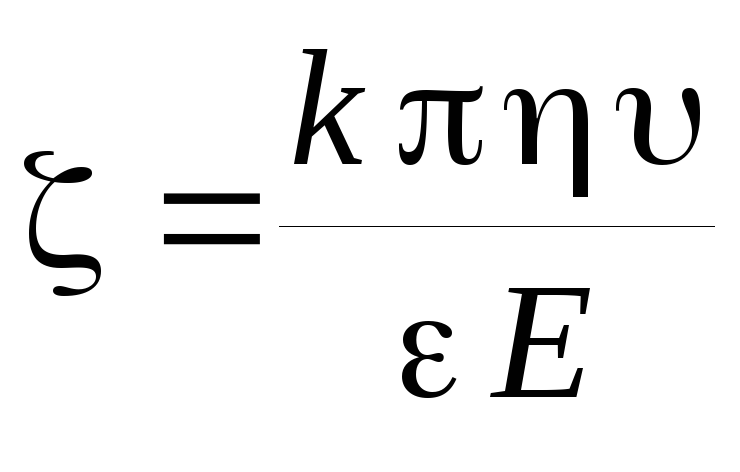
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
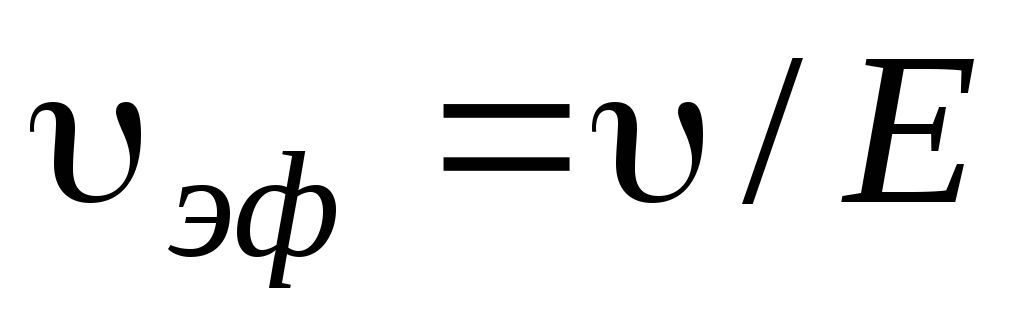
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
К осаждению дисперсной фазы — характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
лиофильные, обладающие термодинамической устойчивостью;
лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса G min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
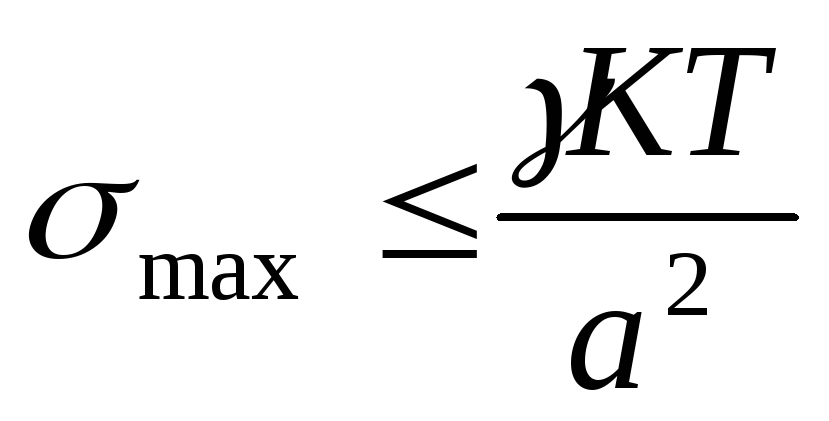
где ỵ езразмерный коэффициент;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,410 -7 до 1,410 -3 Дж/м 2 . Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Правила коагуляции электролитами. Порог коагуляции. Правило Шульце-Гарди. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия — явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
источник
Электрофорез — метод разделения веществ, основанный на явлении миграции заряженных микрочастиц в жидкой среде под действием внешнего электрического поля.
Существует три различных электрофоретических метода. Под собственно электрофорезом обычно понимают зональный электрофорез (ЗЭ), два других называют методами изоэлектрофокусирования (ИЭФ)и изотахофореза (ИТФ).Электрофорез применяют главным образом для разделения веществ, молекулы которых различаются по электрофоретической подвижности, т. е. отношению скорости электрофореза (скорости перемещения заряженных частиц вещества) к напряженности электрического поля, которое зависит от свойств заряженных частиц окружающей их среды. Путем изменения внешних условий (например, рН среды, температуры, силы тока, состава и концентрации буферного раствора или носителя) создают подходящие условия для разделения. Вследствие того что при разделении на молекулы действуют только электростатические силы, электрофорез считают «мягким» методом и поэтому часто применяют для работы с лабильными веществами.
Электрофорез можно проводить в растворе, но из-за неизбежного выделения теплоты и возникающей в связи с этим тепловой конвекции процесс, как правило, проводят на носителе. Вследствие некоторых сопутствующих явлений (адсорбция, несоизмеримость размеров высокомолекулярных соединений и пор носителя) введение носителя ограничивает область применения метода. Однако свойства носителя иногда используют для повышения эффективности разделения: например, при электрофорезе в градиенте полиакриламидного геля фракционирование осуществляется не столько за счет различной электрофоретической подвижности веществ, сколько за счет различия в их молекулярных массах.
Зональный электрофорез (ЗЭ) — это метод разделения заряженных частиц в электрическом поле, основанный на том, что частицы с разными соотношениями заряд/масса мигрируют с различными скоростями. В зависимости от знака заряда молекулы вещества мигрируют в электрическом поле по направлению к аноду или катоду.
Результаты этого процесса регистрируются на электрофореграфе (по аналогии с хроматографией).
Ранее использовали один и тот же буфер в слое носителя электродных камерах, т. е. разделение вели в непрерывной буферной системе. В настоящее время этот прием еще применяют при электрофорезе на бумаге и пластинках. Приэлектрофорезе в прерывистой буферной системе (различные буферы в слое носите электродных камерах) быстро мигрирующие вещества образую более узкие зоны. Электрофорез в прерывистой буферной системе используют главным образом в гель-электрофорезе. ЗЭ обычно проводят на бумаге, пластинках и в гелях в водных буферных растворах.
При электрофорезе в электродных камерах происходит электролиз раствора и вследствие этого изменяется состав буфера. Поэтому электроды располагают так, чтобы они не касались носителя, а контакт между ними осуществлялся при помощи полосок фильтровальной бумаги. Электродная камера разделена на два отсека, которые соединяются дополнительным мостиком из фильтровальной бумаги. Подбирая соответствующий объем электродных камер или перекачивая буфер насосом от анода к катоду, поддерживают постоянными концентрацию и значение рН буфера в двухкамерной системе. Рекомендуется также проводить деполяризации электродов после каждого электрофоретического разделения.
Материалы-носители подразделяются на две группы:
первая — бумага, целлюлоза, ацетилированная целлюлоза, агароза и материалы для ТСХ(например, силикагель);
вторая — крахмал и полиакриламид.
Эффективность разделения зависит не только от суммарного заряда молекул анализируемых веществ, но и от размеров молекул. Определяющим параметром является соотношение заряд — масса.
Носители первой группы относительно инертны и слабо влияют на эффективность разделения. Материалы второй группы обладают пористой структурой, что существенно влияет на качество разделения. Поскольку размеры пор соизмеримы с размером макромолекул, то можно разделять вещества с одинаковыми суммарными зарядами, но с разными молекулярными массами (например, при ионообменной хроматографии).
Электрофорез на бумаге позволяет экстрагировать вещества из соответствующих зон или пятен и использовать для дальнейшей работы; обнаруживать вещества, используемые в бумажной хроматографии; проводить фракционирование в двух направлениях.
Для электрофореза на бумаге используют специальные сорта бумаги, характеризующиеся следующими свойствами: достаточной механической прочностью; удовлетворительным для удерживания достаточного количества электролита и образца.
Наряду с камерами погружного типа применяют камеры для электрофореза в тонком слое с охлаждаемыми пластинами, в которых лист бумаги помещают между двумя изолирующими пленками.
Электрофорез в тонком слое проводят на стеклянных пластинках, покрытых слоем носителя. По сравнению с полосками бумаги пластины более удобны в обращении. Электрофорез на бумаге и в тонком слое применяют для исследования фракций, полученных при колоночной хроматографии, ферментативных гидролизатов белков, метаболитов, а также для разделения аминов, аминокислот, пептидов и белков, нуклеотидов, фенолов, нафтолов, фенолкарбоновых кислот, красителей, неорганических соединений.
Гель- электрофорез. Вместо целлюлозы и силикагеля можно использовать мягкие гели. Ниже приведены основные рабочие стадии проведения электрофореза в слое геля: приготовление гелей и подготовка образца ® электрофоретическое разделение ® детектирование ® анализ результатов и оформление их в рабочем журнале. Из множества гелей на практике применяют только два — гели агарозы и полиакриламида. В зависимости от способа приготовления геля и типа буферной системы различают несколько вариантов метода:
· электрофорез в геле полиакриламида (ПААГ);
· диск-электрофорез (диск-ПААГ) в прерывистой буферной системе;
· электрофорез в геле полиакриламида в присутствии додецилсульфата натрия (ДСН-ПААГ);
· электрофорез в градиенте пористого полиакриламидного геля.
Гель окрашивают красителем. Поскольку молекулы красителя заряжены, гель можно обесцвечивать электрофоретически при напряжении 50 В. В местах, не содержащих исследуемое вещество, гель обесцвечивается. Количественную оценку проводят спектрофотометрически при помощи сканирующего денситометра.
После усадки гелей в водном этаноле или ацетоне их высушивают между двумя листами целлофана в вакууме при слабом нагреве.
Гель-электрофорез применяют для разделения всех классов заряженных веществ, например белков, ферментных комплексов, вирусов, олигонуклеотидов и нуклеиновых кислот; определения молекулярных масс биополимеров; анализа белков на микроуровне (антигенов при количественном иммуноэлектрофорезе).
При электрофорезе в свободном потоке электролит (буфер) перемещается в вертикальном направлении (перпендикулярно направлению электрического поля). Заряженные частицы под действием электрического поля мигрируют в горизонтальном направлении и одновременно увлекаются потоком буфера. В итоге разделенные вещества распределяются в потоке в соответствии с их электрофоретической подвижностью и элюируются из прибора в различных фракциях. Электрофорез в свободном потоке применяют для препаративного разделения заряженных частиц, в том числе коллоидных, субклеточных частиц и клеток.
Изоэлектрическое фокусирование (ИЭФ). С помощью изоэлектрического фокусирования по изоэлектрическим точкам (ИЭТ) разделяют амфотерные вещества, в частности белки. Сущность метода заключается в том, что молекулы белков мигрируют под действием электрического поля в среде с линейным и стабильным градиентом рН до достижения области рН, соответствующей их ИЭТ.
Изоэлектрическое фокусирование отличается от зонального электрофореза тем, что разделение осуществляется не в буфере с постоянным значением рН, а в среде с линейным градиентом рН. Значение рН минимально вблизи анода, максимально — вблизи катода. Главное условие эффективного разделения белков — наличие стабильного градиента рН среды. В связи с тем что белки обладают амфотерными свойствами, необходимо, чтобы амфолиты – носители — вещества, с помощью которых формируется градиент рН, обладали высокой буферной емкостью. Амфолиты — носители представляют собой многокомпонентную смесь изомеров и гомологов алифатических полиаминополикарбоновых кислот, сульфокислот и фосфоновых кислот, изоэлектрические точки которых располагаются в широкой области значений рН.
ИЭФ применяют для аналитического разделения пептидов, белков, нуклеотидов, органических кислот, ионов металлов и препаративного разделения белков; накопления следовых количеств веществ из больших объемов пробы; определения электрофоретической подвижности.
Необходимым условием проведения ИЭФ является наличие высокого напряжения при низкой ионной силе раствора. Однако именно в этих условиях усиливается электроосмос. Отрицательное воздействие на эффективность разделения веществ оказывают так же примеси солей, занесенные вместе с реактивами (гели для ИЭФ следует готовить из особо чистых реактивов). Для проведения ИЭФ более всего подходит полиакриламидный гель с низкими электроосмотическими свойствами. Продолжительность эксперимента зависит от напряженность поля и характера изменения рН- градиента.
Препаративное изоэлектрическое фокусирование проводят в вертикальных колонках (в градиенте плотности сахарозы, глицерина, этиленгликоля) или в слое инертного материала. В качестве таких материалов используют гранулированные гели (рН градиент формируют с помощью амфолитов).
источник

