Электрофорез в агарозном геле проводят в горизонтальном направлении, так как при этом 1) гель с низкой концентрацией агарозы лучше держится, 2) получается меньшее перекашивание (коллапс) в процессе электрофореза и 3) меньше искажаются полосы ДНК. По-видимому, проще всего работать с системой, когда гель полностью покрыт слоем буфера для электрофореза толщиной около 1 мм. Сопротивление агарозы ненамного превышает сопротивление буфера, так что значительная часть тока течет через агарозу.
Во все буферы с нейтральными значениями рН можно добавлять 0,5 мкг/мл бромистого этидия.
В процессе электрофореза буфер у анода защелачивается, а у катода закисляется. Поэтому обычно пользуются буферной системой с высокой емкостью. Буферы не содержат ионов Cl — , так как последние не обладают буферной емкостью, и их присутствие может привести к тому, что ДНК в геле утратит биологическую активность.
- Трис-боратный буфер. Обладает высокой буферной емкостью. При его использовании, по-видимому, получаются наиболее узкие полосы. Основной раствор 10 × не зарастает, но при длительном хранении в нем образуется осадок, который растворим в щелочи. В присутствии бората агарозные гели не растворяются при высокой концентрации NaClO4 или KI.
- Трис-фосфатный буфер. Тоже обладает высокой емкостью. При его использовании получаются примерно такие же результаты, что и при использовании трис-боратного буфера. Основной раствор, однако, может зарастать. Его преимущество заключается в том, что такие гели можно растворять в концентрированном растворе NaClO4 или KI.
- Трис-ацетатный буфер. Обладает относительно низкой буферной емкостью, и при длительном электрофорезе может возникнуть необходимость в рециркуляции буфера в аппарате. Использование при электрофорезе высоких напряжений не вызывает нагрева. Исходные растворы могут зарастать. Гели в трис-ацетатном буфере можно растворять в концентрированном NaClO4 или KI. Этот буфер, по-видимому, используется наиболее широко.
- Щелочной буфер. Обладает очень низкой емкостью. Обычно при его использовании необходима рециркуляция буфера в аппарате. Наносимые образцы не должны содержать Mg 2+ , иначе ДНК выпадет в осадок. Ионы Mg 2+ необходимо удалять, добавляя избыточные количества ЭДТА.
Препараты агарозы значительно различаются по твердости, по разрешающей способности при разделении фрагментов ДНК, электрофоретической подвижности ДНК, легкости плавления, прозрачности и наличию вредных примесей. Наиболее вредной примесью являются, по-видимому, сульфонированные агарозы, подавляющие активность многих ферментов, работающих на нуклеиновых кислотах.
Обычно мы пользуемся агарозой фирмы МС/В. Агарозу растворяют в буфере для электрофореза, нагревая до кипения в микроволновой печи. Необходимо убедиться, что раствор стал гомогенным и что в нем не осталось твердых частиц агарозы. Перед тем как залить гель, раствор охлаждают до 50°С. Если заливать гель слишком горячей агарозой, то легко можно повредить аппарат для электрофореза
Лунки для образцов делают с помощью погруженной в расплавленный гель гребенки из оргстекла, полихлорвинила или тефлона. Гребенку устанавливают до заливки геля таким образом, чтобы кончики зубьев находились примерно в 0,5 мм от основания геля. Если лунки достанут дна, то образец может протечь под гель. Когда гель полностью застынет, гребенку вынимают и лунки заполняют буфером для электрофореза.
Г. Нанесение образцов и краски
Наносимые образцы содержат 5-10% глицерола или 5-10% сахарозы и 0,025% красителя, благодаря которому можно проследить за ходом электрофореза. Например, можно добавить в образец 1 /10 объема раствора, содержащего 50% глицерола и 0,25% красителя.
ДНК. Наносите около 10 нг ДНК в расчете на каждую ожидаемую полосу. Гель будет перегружен, если в полосе окажется более чем примерно 100 нг ДНК.
Бромфеноловый синий (распадается в щелочи).
Бромкрезоловый зеленый (обладает одинаковой подвижностью и в нейтральных, и в щелочных растворах). Ксиленцианол FF (распадается в щелочи; подвижность ниже, чем подвижность бромфенолового или бромкрезолового).
Образцы можно наносить, используя автоматическую пипетку и полипропиленовый наконечник или с помощью микрошприца, на который надет тонкий пластиковый шланг.
Подвижность небольших молекул ДНК может быть такой же или даже большей, чем подвижность используемого красителя. Чем ниже концентрация агарозы и (или) выше напряженность, тем больший фрагмент ДНК будет обладать такой же подвижностью, как и краситель. Краситель поглощает флуоресценцию связанного с ДНК бромистого этидия. Это приводит к тому, что в том месте геля, где находится краска, невозможно наблюдать слабые полосы ДНК. Образцы можно наносить и без краски.
источник
Установка для электрофореза в агарозном геле.На рисунке 7 представлены основные элементы для проведения горизонтального электрофореза в агарозном геле. Схематично, установку можно представить как емкость для электродного буфера, по краям которой расположены два электрода. В пространство между электродами заливается проводящий буфер, в котором проводится электрофорез, и помещают гель. При этом гель может быть залит непосредственно в камере, а может быть залит отдельно на специальном лотке, который помещается в камеру.
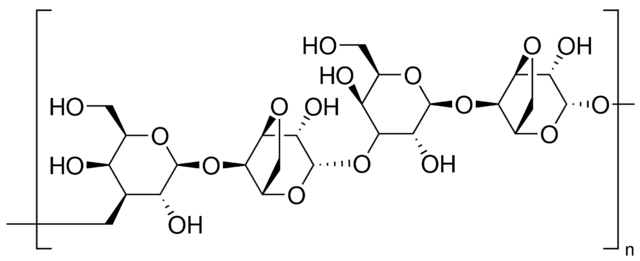
Агароза. Природный коллоид, который выделяют из морских водорослей, является линейным полисахаридом, образованным повторяющимся элементом ‒ агаробиозой, которая в свою очередь состоит из чередующихся элементов: галактозы и 3,6-ангидрогалактозы. Агароза очень хрупка, и легко разрушается при манипулировании. Агарозные гели имеют «поры» большого размера и используются преимущественно для разделения больших молекул.
Агарозные гели получают суспендированием сухого порошка агарозы в водном буфере, и кипячением смеси до того момента, когда агароза расплавится и образует прозрачный раствор. Затем раствор наливают на подложку и дают остыть до комнатной температуры, чтобы сформировался прочный гель. При застывании агароза формирует матрикс, плотность которого определяется концентрацией.
Буфер для электрофореза. На электрофоретическую подвижность ДНК воздействуют состав и ионная сила буфера для электрофореза. В отсутствии ионов, электропроводность минимальна, и перемещение ДНК происходит медленно. В буфере с высокой ионной силой электропроводность очень эффективна, и образуется значительное количество тепла. В худшем случае, гель расплавляется и ДНК денатурирует. Существует несколько буферов для электрофореза нативной двухцепочечной ДНК. Они содержат ЕОТА (рН 8,0) и Тгis-ацетат (ТАЕ), Тгis-борат (ТВЕ), или Тгis-фосфат (ТРЕ).
Маркерная ДНК. При заданном напряжении, концентрации агарозного геля и буфера, расстояние перемещения зависит от молекулярного веса исходного материала. Поэтому, маркерная ДНК известного размера должна наноситься на дорожки и с левого, и с правого края геля. Маркер обычно содержит определенный набор известных сегментов ДНК, которые облегчают определение размера исследуемой ДНК, если какое-либо систематическое искривление геля возникнет во время электрофореза.
Буфер для нанесения. Образцы ДНК, которые будут наноситься на агарозный гель, сначала смешивают с буфером для нанесения, обычно содержащим воду, сахарозу и краситель (например ксиленцианол, бромфеноловый синий, бромкрезол зеленый и другие).
Окраска и фиксация
Для анализа результатов электрофореза, после его завершения, требуется, прежде всего, визуализовать картину распределения полос в геле. С этой целью могут применяться два основных подхода. Первый способ состоит в окрашивании ДНК специфическими красителями. Для этой цели существует большое разнообразие красителей, способных специфически окрашивать двунитевые или однонитевые участки ДНК, ДНК в составе различных комплексов или в определённой конформации. К достоинствам такого подхода можно отнести высокую чувствительность, избирательность окрашивания и дешевизну метода. Среди недостатков можно упомянуть относительную трудоёмкость процедуры, невозможность следить за ходом электрофореза в реальном времени, токсичность некоторых из широко применяемых красителей, воздействие красителей на структуру ДНК, и необходимую иногда предварительную фиксацию ДНК в геле.
Другой путь основан на способности самой ДНК поглощать свет в УФ диапазоне. Поэтому можно просканировать гель в УФ-свете и определить местоположение ДНК в геле. В настоящее время промышленностью выпускаются специальные комплексы, позволяющие следить за миграцией ДНК в геле в автоматическом режиме непосредственно в ходе электрофореза и получать оцифрованное изображение в любой момент времени. При использовании этого подхода предварительная фиксация ДНК в геле не требуется. К недостаткам подхода можно отнести малую избирательность метода и относительную дороговизну оборудования.
Наиболее распространенным красителем ДНК в экспериментах по электрофорезу является бромистый этидий. Этот краситель относится к соединениям, способным интеркалировать между парами оснований ДНК. Вещество является сильным канцерогеном и мутагеном, способным проникать через кожу. По этой причине работа с ним требует особой осторожности и соблюдения повышенных мер безопасности. При работе с бромистым этидием всегда необходимо использовать перчатки и маску. Отходы, содержащие бромистый этидий, требуют специальной утилизации.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Для приготовления 1%-го геля ‒ смешайте 100 мл воды и 1 г агарозы и доведите раствор до кипения. Размешайте до ресуспендирования осевшей агарозы. В пластиковую кювету для геля установите гребенку под будущие лунки. Влейте агарозу в кювету. Агароза должна заполнить куветю полностью. Когда гель затвердеет, осторожно удалите гребенку.
2. Готовим камеру ‒ кладем пластиковую кювету с гелем в камеру, заливаем буфером так, чтобы гель скрылся под ним.
3. Вносим 5–10 мкл образца в лунки и закрываем верхней крышкой.
4. К черному штекеру присоединяем отрицательный полюс, а к красному положительный.
5. Включаем форез ‒ 120 В 20–30 мин. Возле электродов должны быть небольшие пузырьки, как индикатор, что форез пошел. ДНК двигается от минуса к плюсу, поэтому лунки с ДНК должны быть возле черного штекера (минуса).
6. Через 20–30 мин, выключаем прибор, открываем крышку и вытаскиваем кувету с гелем шипцапи или используем перчатки. В случае наличия в образце красителя, разделение можно будет увидеть невооруженным глазом, а при его отсутствии просматривают гель в УФ-свете на трансиллюминаторе и фотографируют.
Сделать вывод о проделанной работе. Зарисовать электрофореграмму.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте понятие электрофорезу.
2. Дайте понятие электрофорезу в агарозном геле.
3. Физические принципы электрофореза в агарозном геле.
4. Перечислите параметры, от которых зависит движение заряженных частиц в агарозном геле.
5. Перечислите компоненты, необходимые для электрофореза в агарозном геле.
6. Основные элементы установки для электрофореза в агарозном геле.
7. Объясните методы анализа результатов электрофореза, их достоинства и недостатки.
8. К какому полюсу происходит движение молекул ДНК при электрофорезе в агарозном геле и почему?
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
источник
Для визуализации результатов операций, проводимых с ДНК,таккак выделение, рестрикция,полимеразная цепная реакция(ПЦР),молекулярное клонирование, наиболее частоиспользуютэлектрофорез.
Электрофорез — метод разделения макромолекул (в том числе
молекул и фрагментов ДНК) в геле по размеру и заряду в постоянном электрическом поле. Существует два вида электрофореза: горизонтальный и вертикальный.
Для проведения горизонтального электрофореза используют пластину агарозного геля необходимой концентрации с добавлением специального красителя ДНК, например бромида этидия.
На скорость движения ДНК в геле в процессе электрофореза влияют несколько факторов.
Концентрация агарозы в геле.Агарозный гель — пористая струк-
тура, причем увеличение концентрации агарозы в геле приводит к
уменьшению размеров его пор. Это позволяет при помощи геля с
разной концентрацией агарозы разделять линейные молекулы
ДНКв широком диапазоне их размеров, вплоть до 60 тыс. пар
нуклеотидов (п. н.).
Существует зависимость длины разделяемых фрагментов ДНК
от концентрации агарозы в геле;
Концен- 0,3 0,5 0,6 0,7 0,8 0,9 1,0 1,2 1,5 2,0
Длина 5-60 1-30 1-20 0,8-12 0,6-10 0,5-8 0,5-7 0,4-6 0,2-3 0,1-2
Заряд молекулы.Поскольку каждый из нуклеотидов молекулы
ДНК несет остаток ортофосфорной кислоты со свободной гидроксильной группой, в нейтральной и особенно в слабощелочной
среде молекула ДНК приобретает отрицательный заряд и способность перемещаться в электрическом поле в направлении от катода (отрицательный электрод) к аноду (положительный электрод). Электрофоретическая подвижность молекулы ДНК существенно снижается с увеличением ее длины.
Напряженность электрического поля.На скорость движения заряженных молекул ДНК в геле влияет напряженность электрического поля, определяемая напряжением постоянного электрического поля, подаваемого на электроды. Данные, приведенные на
рисунке 1, свидетельствуют о наличии обратно пропорциональной зависимости между длиной пробега ДНК в геле и напряженностью электрического поля. Число полученных электрофореграмм различно, поэтому разделение фрагментов ДНК для
аналитических целей (только с целью детекции ДНК) с максимальным разрешением рекомендуют проводить при напряжении 10—15 В/см, а для препаративных (если ДНК будет в дальнейшем выделена из геля и использована, например, для клони-
рования) — при
Линейные молекулы ДНК одного размера движутся в геле с
одинаковой скоростью. Однако подвижность суперспирализованных и кольцевых молекул ДНК отличается от подвижности линейных молекул того же размера. Таким образом, методом элект-рофореза можно фракционировать три формы молекул ДНК бактерий:
• суперспирализованную (нативная молекула, стабилизированная белками);
•линейную (расщепленная рестриктазой кольцевая молекула).
Разделение трех типов молекул ДНК в одном геле выглядит следующим образом (по подвижности от катода к аноду):
Кольцевая молекула ДНК
Линейная молекула ДНК
Суперспирализованная молекула ДНК
При постановке электрофореза можно определить размер (молекулярную массу) только линейной ДНК. Для этого в одну из лунок геля наносят стандарт, в качестве которого используют специальные маркеры молекулярной массы (смесь фрагментов ДНК с
известными значениями молекулярных масс).
Для контроля скорости движения ДНК в геле, а также для определения времени окончания процесса электрофореза применяют краску-лидер (специальный краситель, например бромфеноловый синий), которая перемещается в геле, немного опережая макромолекулы ДНК, двигающиеся в процессе электрофореза.
Для визуализации результатов электрофореза используют краситель бромид этидия, который вносят в процессе приготовления геля. Данное вещество встраивается (интеркалирует) в молекулы ДНК плоскими ароматическими группами. После окончания
электрофореза, продолжающегося от 10 мин до 1 ч, гель помещают на светофильтр трансиллюминатора, пропускающего свет в диапазоне 254—400 нм. Краситель начинает флуоресцировать в оранжево-красной области видимого спектра (590 нм), при этом
становится видна ДНК.
Внимание! Используемый в качестве красителя бромид этидия является мутагенным веществом. При работе с ним необходимо использовать резиновые или латексные перчатки.
Методы вертикального и горизонтального электрофореза
принципиально сходны, однако в последнем случае вместо агарозного используют полиакриламидный гель (ПААГ) и процесс электрофореза проходит вертикально. Электрофорез в ПААГ характеризуется высокой разрешающей способностью.
Кроме того,акриламид является токсичным веществом. Приготовить ПААГ
значительно сложнее, чем агарозный гель. В связи с этим в работе
с ДНК преимущественно используют метод горизонтального
электрофореза в агарозном геле.
Цель работы. Ознакомиться с методом горизонтального электрофореза ДНК в агарозном геле.
Оборудование и материалы.1. Прибор для горизонтального электрофореза.
2. Источник постоянного тока. 3. Электрическая плитка или СВЧ-печь. 4. Гельдокументирующая видеосистема. 5. Автоматические дозаторы переменного объема с наконечниками. 6. Колба мерная вместимостью 1 л. 7. Колба коническая
вместимостью 0,5 л. 8. Цилиндр мерный вместимостью 250 мл. 9. Кристаллизатор.
10. Набор реагентов для электрофореза (например, производимый ООО «КОМПАНИЯ «БИОКОМ»)включает: смесь для приготовления электродного буфера;
навеску агарозы; раствор бромида этидия; раствор краски-лидера (бромфеноловый синий). 11. Проба исследуемой плазмидной ДНК. 12. ДНК-маркер молекулярных масс. 13. Перчатки резиновые или латексные неопудренные. 14. Теплоизолирующая рукавица. 15. Вода дистиллированная.
Ходработы.Приготовлениерабочегобуферногораствора для электрофореза. Содержимое пакета «Буфер для электрофореза» полностью переносят в мерную колбу, раство-ряют в 600—800 мл дистиллированной воды (для более быстрого
растворения следует подогреть раствор до 40—45 «С при постоян-
ном помешивании) и доводят объем полученного раствора до 1 л
дистиллированной водой.
Подготовка прибора для электрофореза к работе. Пользуясь встроенными уровнями и винтовыми ножками,
прибор устанавливают строго горизонтально. В рабочую камеру
наливают буфер для электрофореза. Для формирования гелевой
пластины собирают кювету, в нее помещают аппликатор (гребенку) для формирования лунок в толще геля (рис. 2). Регулируемую
высоту аппликатора выставляют таким образом, чтобы расстояние
от дна кюветы до каждого из зубцов составляло 1—2 мм. В зависимости от числа анализируемых проб одновременно можно установить одну, две или три гребенки.
Приготовление агарозного геля. Навеску агарозы,
необходимую для приготовления 1%-ного геля, полностью переносят в коническую стеклянную колбу вместимостью 250—500 мл,
добавляют 150 мл рабочего раствора буфера для электрофореза и
перемешивают. Суспензию агарозы в колбе доводят до кипения в
СВЧ-печи или на электроплитке, периодически помешивая (колбу
держать, только надев на руку теплоизолирующую рукавицу). Продолжают нагревание до тех пор, пока содержимое колбы не станет
совершенно прозрачным (обычно еще 1 мин). Расплав охлаждают
до 55—60 °С, добавляют 10 мкл раствора бромида этидия, перемешивают (работу проводят в латексных или резиновых перчатках) и
наливают на столик для заливки геля (см. описание к прибору для
электрофореза), не допуская образования воздушных пузырьков,
так, чтобы толщина слоя была не менее 5 мм, а зубцы гребенок
были погружены в гель не менее чем на 4 мм. Гель полностью застывает через 15—20 мин. Столик с готовым агарозным гелем и гре-
бенками переносят в камеру для электрофореза, в которую нали-
вают рабочий раствор буфера для электрофореза так, чтобы по-
крыть гелевую пластину слоем в 2—3 мм. Извлекают гребенки из
агарозного геля легким и плавным движением вверх, стараясь не
повредить образовавшиеся лунки.
Проведение электрофореза. В лунки застывшего агарозного геля осторожно вносят по 3 мкл раствора исследуемых образцов ДНК. В соседнюю лунку геля вносят 3 мкл маркера молекулярных масс фрагментов ДНК. В одну или
две (по краям пластины геля) свободные лунки вносят 2—3 мкл
краски-лидера. Закрывают крышку прибора для электрофореза и
подключают его к источнику постоянного тока, строго соблюдая
полярность электродов и учитывая, что движение фрагментов
ДНК происходит в направлении от катода к аноду (от «минуса» к
«плюсу»). На вольтметре источника постоянного тока устанавли-
вают напряжение 120—150 В. В таком режиме процесс электрофо-
реза продолжают около 30 мин, ориентируясь на фронт пробега
краски-лидера (приблизительно на 3 см). По окончании электро-
фореза источник напряжения отключают, снимают крышку при-
бора, пластину агарозного геля осторожно переносят на свето-
фильтр (просмотровый столик) УФ-трансиллюминатора для де-
текции Включают трансиллюми-
натор. Зоны ДНК, окрашенные бромидом этидия, светятся при
УФ-облучении.
Внимание! Во избежание повреждения сетчатки глаз ультрафиолетовым излучением наблюдать зоны ДНК следует только через за-щитное стекло из комплекта трансиллюминатора или защитные (стеклянные) очки. Полученные результаты регистрируют визуально или с использованием гель-документирующей видеосистемы,пользуясь инструкцией к ней.
Контрольные вопросы.1. Какой принцип лежит в основе метода электрофоре-
за? 2. Какая масса агарозы необходима для приготовления 150 мл 2,5%-ного геля?
3. Какой концентрации агарозный гель нужно использовать для разделения мето-
дом электрофореза фрагментов ДНК размером 350 и 150 п.н.? 4. В каком направ-
лении и почему движутся молекулы ДНК при проведении электрофореза? 5. От
каких факторов зависит скорость движения молекул ДНК в агарозном геле в про-
цессе электрофореза? 6. Почему нужно избегать образования в геле пузырьков
воздуха? 7. За счет чего происходит визуализация ДНК в геле? 8. Каким образом
можно контролировать движение молекул ДНК в геле во время электрофореза?
9. На каких этапах проведения электрофореза необходимо работать в перчатках и
почему?
Задания.1. Поместить схему или фотографию электрофореграммы в рабочий журнал, пронумеровать дорожки и сделать подписи к ним. 2. Определить и подписать размеры фрагментов ДНК-маркера (согласно описанию к нему). 3. По электрофореграмме определить электрофоретическую подвижность и рассчитать примерную молекулярную массу исследуемой плазмидной ДНК, используя маркеры молекулярных масс. 4. Определить, какой из ДНК нижеперечисленных плазмид соответствует исследуемая ДНК, если ДНК плазмиды РСЕМ-2Гимеет размер 3000 п.н.ДНК плазмиды рВК322 — 4361,а ДНК плазмидыр РСУ002—8560 п.н.
источник
Электрофорез ДНК
Теория электрофореза
Впервые явление электрофореза было открыто П. И. Страховым и Ф. Ф. Рейссом в 1809 году. В начале 70-ых годов было показано, что с помощью гель-электрофореза можно определить длину и чистоту молекул ДНК. Этот метод прост, так как каждый нуклеотид в молекуле нуклеиновой кислоты обладает отрицательным зарядом, который заставляет молекулы двигаться к положительному электроду. Были разработаны специальные полиакриламидные гели, с помощью которых удается разделить фрагменты ДНК длиной до 500 нуклеотидов, отличающиеся даже на один нуклеотид. Поскольку поры в полиакриламидном геле для больших молекул ДНК слишком малы, для их разделения по размеру были разработаны специальные гели на основе агарозы (полисахарид, выделяемый из морских водорослей). Оба эти метода разделения ДНК широко используются для аналитических и препаративных целей.
В 80-ых годах была предложена модификация гель-электрофореза в агарозном геле, названная электрофорезом в пульсирующем электрическом поле или пульс-электрофорез. С ее помощью удается разделять большие молекулы ДНК (от 10 т.п.н. до 10 млн.п.н.), к которым относятся хромосомные ДНК прокариот и низших эукариот. Обычный гельэлектрофорез не позволяет разделить такие молекулы ввиду постоянства электрического поля, которое придает молекулам змеевидную конфигурацию. Обладающие такой конфигурацией молекулы движутся в гелях с постоянной скоростью вне зависимости от длины молекул. Если же направление электрического поля будет часто меняться, скорость движения молекул будет определяться их способностью переориентироваться согласно этому изменению. Такой процесс у больших молекул занимает значительно больше времени, вследствие чего они будут отставать. На гелях после пульс-электрофореза целые хромосомы дрожжей выявляются в виде отдельных полос, и поэтому можно легко определить хромосомные перестройки.
Сейчас электрофорез занимает центральное место среди методов исследования нуклеиновых кислот. Метод позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как размеры (или молекулярная масса), пространственная конфигурация, вторичная структура и электрический заряд, причем эти параметры могут выступать как порознь, так и в совокупности.
Физический принцип метода заключается в следующем. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, величина и знак которого зависят от рН среды. Если через этот раствор, заключенный в канал из изолирующего материала начать пропускать электрический ток, то вдоль канала установится определенный градиент напряжения, т. е. сформируется электрическое поле. Его напряженность измеряется разностью потенциалов по концам рабочего канала (или его участка), отнесенной к его длине (В/см). Под действием поля макромолекулы в соответствии со своим суммарным зарядом мигрируют в направлении катода или анода, причем их трение об окружающую среду ограничивает скорость миграции. В зависимости от величины заряда и размеров молекулы приобретают разные скорости, и в этом – сущность процесса электрофореза. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны одинаковых молекул, мигрирующих с одной и той же скоростью. Со временем эти зоны распределяются по длине канала.
В современных приборах рабочий канал заполняют гелем. Достаточно чистая и хорошо смачиваемая (гидрофильная) пространственная сетка геля удерживает жидкость от вытекания и препятствует конвекции. Вместе с тем используемые гели содержат очень много жидкости (80-99,5 %), в которой (т.е. в рабочем буфере) и мигрируют макромолекулы. Наличие сетки геля вносит важную дополнительную деталь в картину электрофоретической миграции. Теперь фракционируемые макромолекулы любых размеров неизбежно сталкиваются с нитями полимера, образующего сетку геля, что увеличивает эффективное трение о среду, а следовательно, снижает скорость движения молекул. Очевидно, что препятствия для миграции становятся особенно серьезными, если средний диаметр пространственных ячеек геля оказывается соизмерим с размерами макромолекул. В этом случае решающее влияние на электрофоретическую подвижность различных макромолекул и степень разделения оказывает соотношение их линейных размеров. Возможна даже такая ситуация, когда особенно крупные молекулы нуклеиновых кислот вообще не смогут «протиснуться» через поры геля и их миграция прекратится.
В настоящее время почти исключительно используются полиакриламидные гели и гели агарозы. Варьируя концентрацию полимера, можно получать гели с очень широким диапазоном размеров пор. Кроме того, можно изменять электрические заряды макромолекул путем вариации рН буфера, а их конфигурацию путем введения в буфер денатурирующих агентов или детергентов. Все это придает методу электрофореза исключительную гибкость. Но есть, разумеется, и свои проблемы. Разделяемые макромолекулы все же находятся в растворе, поэтому возможна их диффузия, приводящая к размыванию зон. Это тем более серьезно, что протекание через жидкость электрического тока неизбежно связано с выделением тепла. К счастью, крупные молекулы нуклеиновых кислот диффундируют не слишком быстро.
Для визуализации результатов электрофореза проводят окрашивание зон путем вымачивания геля в растворе красителя, прочно связывающегося с нуклеиновой кислотой. Излишек красителя удаляют, а гель облучают ультрафиолетом, под действием которого связавшийся с двунитевой ДНК краситель флуоресцирует.
Электрофорез ДНК
Теория электрофореза
Впервые явление электрофореза было открыто П. И. Страховым и Ф. Ф. Рейссом в 1809 году. В начале 70-ых годов было показано, что с помощью гель-электрофореза можно определить длину и чистоту молекул ДНК. Этот метод прост, так как каждый нуклеотид в молекуле нуклеиновой кислоты обладает отрицательным зарядом, который заставляет молекулы двигаться к положительному электроду. Были разработаны специальные полиакриламидные гели, с помощью которых удается разделить фрагменты ДНК длиной до 500 нуклеотидов, отличающиеся даже на один нуклеотид. Поскольку поры в полиакриламидном геле для больших молекул ДНК слишком малы, для их разделения по размеру были разработаны специальные гели на основе агарозы (полисахарид, выделяемый из морских водорослей). Оба эти метода разделения ДНК широко используются для аналитических и препаративных целей.
В 80-ых годах была предложена модификация гель-электрофореза в агарозном геле, названная электрофорезом в пульсирующем электрическом поле или пульс-электрофорез. С ее помощью удается разделять большие молекулы ДНК (от 10 т.п.н. до 10 млн.п.н.), к которым относятся хромосомные ДНК прокариот и низших эукариот. Обычный гельэлектрофорез не позволяет разделить такие молекулы ввиду постоянства электрического поля, которое придает молекулам змеевидную конфигурацию. Обладающие такой конфигурацией молекулы движутся в гелях с постоянной скоростью вне зависимости от длины молекул. Если же направление электрического поля будет часто меняться, скорость движения молекул будет определяться их способностью переориентироваться согласно этому изменению. Такой процесс у больших молекул занимает значительно больше времени, вследствие чего они будут отставать. На гелях после пульс-электрофореза целые хромосомы дрожжей выявляются в виде отдельных полос, и поэтому можно легко определить хромосомные перестройки.
Сейчас электрофорез занимает центральное место среди методов исследования нуклеиновых кислот. Метод позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как размеры (или молекулярная масса), пространственная конфигурация, вторичная структура и электрический заряд, причем эти параметры могут выступать как порознь, так и в совокупности.
Физический принцип метода заключается в следующем. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, величина и знак которого зависят от рН среды. Если через этот раствор, заключенный в канал из изолирующего материала начать пропускать электрический ток, то вдоль канала установится определенный градиент напряжения, т. е. сформируется электрическое поле. Его напряженность измеряется разностью потенциалов по концам рабочего канала (или его участка), отнесенной к его длине (В/см). Под действием поля макромолекулы в соответствии со своим суммарным зарядом мигрируют в направлении катода или анода, причем их трение об окружающую среду ограничивает скорость миграции. В зависимости от величины заряда и размеров молекулы приобретают разные скорости, и в этом – сущность процесса электрофореза. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны одинаковых молекул, мигрирующих с одной и той же скоростью. Со временем эти зоны распределяются по длине канала.
В современных приборах рабочий канал заполняют гелем. Достаточно чистая и хорошо смачиваемая (гидрофильная) пространственная сетка геля удерживает жидкость от вытекания и препятствует конвекции. Вместе с тем используемые гели содержат очень много жидкости (80-99,5 %), в которой (т.е. в рабочем буфере) и мигрируют макромолекулы. Наличие сетки геля вносит важную дополнительную деталь в картину электрофоретической миграции. Теперь фракционируемые макромолекулы любых размеров неизбежно сталкиваются с нитями полимера, образующего сетку геля, что увеличивает эффективное трение о среду, а следовательно, снижает скорость движения молекул. Очевидно, что препятствия для миграции становятся особенно серьезными, если средний диаметр пространственных ячеек геля оказывается соизмерим с размерами макромолекул. В этом случае решающее влияние на электрофоретическую подвижность различных макромолекул и степень разделения оказывает соотношение их линейных размеров. Возможна даже такая ситуация, когда особенно крупные молекулы нуклеиновых кислот вообще не смогут «протиснуться» через поры геля и их миграция прекратится.
В настоящее время почти исключительно используются полиакриламидные гели и гели агарозы. Варьируя концентрацию полимера, можно получать гели с очень широким диапазоном размеров пор. Кроме того, можно изменять электрические заряды макромолекул путем вариации рН буфера, а их конфигурацию путем введения в буфер денатурирующих агентов или детергентов. Все это придает методу электрофореза исключительную гибкость. Но есть, разумеется, и свои проблемы. Разделяемые макромолекулы все же находятся в растворе, поэтому возможна их диффузия, приводящая к размыванию зон. Это тем более серьезно, что протекание через жидкость электрического тока неизбежно связано с выделением тепла. К счастью, крупные молекулы нуклеиновых кислот диффундируют не слишком быстро.
Для визуализации результатов электрофореза проводят окрашивание зон путем вымачивания геля в растворе красителя, прочно связывающегося с нуклеиновой кислотой. Излишек красителя удаляют, а гель облучают ультрафиолетом, под действием которого связавшийся с двунитевой ДНК краситель флуоресцирует.
Разделение ДНК в агарозном геле
Электрофорез в агарозном геле – стандартный метод, используемый для разделения, идентификации и очистки фрагментов ДНК. С помощью этой простой техники можно быстро разделить такие смеси фрагментов ДНК, которые не могут быть разделены другими способами, например центрифугированием в градиенте плотности. Кроме того, при разделении в геле прямо следят за положением ДНК, так как полосы ДНК в геле можно окрашивать флуоресцирующим и интеркалирующим в ДНК красителем – бромистым этидием в низкой концентрации. Просматривая прокрашенный гель в ультрафиолеотовом свете, можно заметить даже 1 нг ДНК.
Сочетание прочности и крупнопористости делает гели агарозы незаменимыми при электрофорезе особенно крупных макромолекул, в частности нуклеиновых кислот. Агароза – это особо чистая фракция природного линейного полисахарида агара, который извлекают из некоторых видов морских водорослей. Молекулярная масса ее составляет 10 4 –10 5 . Гелеобразование идет, как уже указывалось, путем связывания в пространственную сетку пучков нитей за счет водородных связей между ними. Некоторые виды агарозы образуют прочные гели уже при концентрации 0,3 %.
При температурах от 84 до 96 °С (а у специальных типов – уже при 70 °С) раствор агарозы переходит в прозрачную жидкость – «плавится». Растворы агарозы характеризуются ярко выраженным гистерезисом: они затвердевают, образуя гель, при значительно более низких температурах (36-42 °С). У легкоплавких типов агарозы эта температура снижается до 30°. Такая особенность облегчает манипуляции с расплавленной агарозой – можно не опасаться преждевременного ее застывания в гель. Более того, расплавленную на кипящей бане агарозу предварительно охлаждают до 50-55 °С уже при этой температуре дозируют и заливают в формы; это удобно и не связано с возникновением значительных тепловых деформаций.
Гели агарозы не вполне прозрачны, однако это обусловлено не наличием примесей, а своего рода «кристаллизацией» геля и свидетельствует, скорее, о чистоте агарозы. Затвердевший гель представляет собой не вполне равновесную систему: со временем он несколько уплотняется, выдавливая из себя жидкость. Этот процесс идет вначале довольно быстро, а потом – очень медленно. Тем не менее, гели агарозы перед опытом следует выдерживать в течение, по крайней мере, 12 ч (открытые пластины для горизонтального электрофореза выдерживают во влажной камере). Сжатие сильнее выражено у более концентрированных гелей агарозы.
Агароза для электрофореза выпускается обычно в виде лиофилизированного порошка. Для приготовления геля выбранной концентрации навеску порошка растворяют в соответствующем буфере и выдерживают на кипящей водяной бане или в термостате при 90-95 °С около 2 ч для образования истинного раствора полимера. Иногда раствор агарозы просто кипятят с обратным холодильником.
Разнообразные буферы, детергенты и другие добавки смешивают с раствором агарозы в горячем виде (при 50-60 °С). Впрочем, надо иметь в виду, что высокая концентрация агентов, диссоциирующих водородные связи, несколько затрудняет образование геля.
Плоские гели для горизонтального электрофореза готовят путем заливки дозированного объема расплавленной агарозы на строго горизонтальную пластинку нужного размера.
Выбор концентрации агарозы, т.е. пористости ее геля, диктуется размерами фракционируемых макромолекул. Средний размер пор 2%-ного геля агарозы приблизительно соответствует диаметру сферически упакованной молекулы биополимера с массой 50 млн. дальтон. Гели с более высоким содержанием агарозы используют для гель-фильтрации. При электрофорезе поры геля должны быть легко проницаемы для молекул биополимеров, чтобы лишь тормозить их миграцию в электрическом поле за счет трения, поэтому для электрофореза применяют агарозные гели с концентрацией 0,4–2 %. Ниже в таблице 8 для ориентировки представлены примерные концентрации гелей агарозы (в процентах) для некоторых распространенных образцов фракционирования:
| Количество агарозы в геле, % | Объекты |
| 0,4 | Высокомолекулярная ДНК вирусов и плазмид |
| 0,7 | Рестрикты ДНК (5–20 тыс. н.п) |
| 1,0 | мРНК, денатурированная обработкой метилртутью |
| 1,5 | Реовирусная двунитевая РНК (500–5000 н.п.) |
| 1,75 | Рибосомная РНК |
| 2,0 | Нативные мРНК; рестрикты ДНК (100–1000 н.п.) |
Перед заливкой в форму или на пластину раствор горячей агарозы охлаждают до 50 °С и выдерживают не менее 1 ч в термостате при данной температуре. Это необходимо для полного выравнивания температуры раствора по всему его объему, чем обеспечивается одновременное застывание всего геля и однородность его структуры.
Гель, полимеризованный на пластинке, помещают на столик открытой поверхностью кверху, поскольку препараты вносят в ряд специальных лунок, образованных опусканием в гель гребёнки и расположенных на некотором расстоянии от его края. Схема прибора для проведения горизонтального электрофореза показана на рисунке 29. Следует быстро вносить препараты в лунки и сразу же начинать электрофорез, так как образцы могут диффундировать в геле.
Рисунок 29 – Электрофорезная ванна, подложка и гребенки для горизонтального электрофореза ДНК в агарозном геле
Скорость миграции ДНК через агарозный гель при электрофорезе определяются пятью главными параметрами, рассмотренными ниже.
Размер молекул ДНК. Молекулы линейной двуцепочечной ДНК перемещаются в геле одним концом вперёд со скоростями, обратно пропорциональными десятичному логарифму их молекулярных масс.
Концентрация агарозы. Фрагменты ДНК данного размера перемещаются в геле, содержащем разные концентрации агарозы, с разными скоростями. Применяя гели разных концентраций, можно разделить большой набор фрагментов ДНК, различающихся по размеру (таблица 10).
Таблица 10 Зависимость разделения линейных молекул ДНК от концентрации агарозного геля
| Количество агарозы в геле, % | Область эффективного разделения линейных молекул ДНК, тыс. н.п. |
| 0,3 | 60–5 |
| 0,6 | 20–1 |
| 0,7 | 10–0,8 |
| 0,9 | 7–0,5 |
| 1,2 | 6–0,4 |
| 1,5 | 4–0,2 |
| 2,0 | 3–0,1 |
Конформация ДНК. ДНК, имеющие одинаковую молекулярную массу, но разные конформации, например кольцевая неповреждённая (форма I), кольцевая с одноцепочечным разрывом (форма II) и линейная (форма III), движутся в агарозном геле с разными скоростями (рис. 30).Относительная подвижность трёх указанных форм зависит главным образом от концентрации агарозы в геле, а также от таких факторов, как сила тока, ионная сила буфера или плотность сверхспиральных витков в форме I.
 |
I, II, III – конформации плазмидной ДНК (пояснения в тексте).
Рисунок 30 – Изображение электрофоретической подвижности препаратов ДНК: а) высокополимерной линейной ДНК, выделенной из молок лосося (IСN); б) ДНК фага l, расщепленной эндонуклеазой Hind III на линейные фрагменты с фиксированной длиной; в) плазмидной ДНК pUC19
Напряжённость электрического поля. При низких напряжённостях скорость перемещения фрагментов линейной ДНК пропорциональна приложенному напряжению. Однако с увеличением напряжённости электрического поля подвижность фрагментов ДНК с высокой молекулярной массой дифференциально возрастает. Следовательно, с увеличением напряжённости область эффективного разделения ДНК в агарозном геле снижается. Максимальное разделение фрагментов происходит при напряжённости, не превышающей 5 В/см.
Состав оснований и температура. Электрофоретическое поведение ДНК в агарозных гелях (в отличие от поведения в полиакриламидных гелях) слабо зависит от состава оснований ДНК или температуры геля. Обычно электрофорез проводят при комнатной температуре, однако следует отметить, что гели, содержащие менее 0,5 % агарозы, очень мягкие, поэтому с ними лучше работать при 4 ˚С.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы
источник
Электрофорез (от электро- и др.-греч. φορέω — «переношу») —метод разделения макромолекул, различающихся по размеру, молекулярной массе, пространственной конфигурацией, вторичной структурой или электрическому заряду. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
Молекулы в буферном растворе обладают электрическим зарядом, величина и знак которого зависят от pH среды. При пропускании электрического тока через раствор в нем формируется направленное электрическое поле, напряженность которого измеряется разностью потенциалов по концам емкости, в которой производится электрофорез. Под действием поля молекулы начинают движение в направлении катода или анода. Скорость движения зависит от величины заряда, размеров и трения окружающей среды. С течением времени смесь разделяется на фракции, состоящие из молекул, движущихся с одинаковой скоростью. В современных экспериментах рабочий канал приборов для электрофореза заполняют гелем, имеющим структуру сетки. В этом случае основное влияние на подвижность молекул и их степень разделения оказывают их линейные размеры. В некоторых случаях может возникнуть ситуация, при которой особо крупные молекулы не проходят через поры геля.
Бромфеноловый синий и ксиленцианол — могут заметно мешать наблюдению фрагментов под UV. Краситель Cresol red совместим с ферментативными реакциями, практически не мешает наблюдению под UV. OrangeG наиболее подвижный краситель, практически всегда находится вне «рабочей зоны». Заметен под UV. Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле.
Самое широкое применение агарозные гели имеют в исследованиях, связанные с разделением нуклиновых кислот. Последние имеют довольно значительные отрицательный заряд, величина которого слабо зависиот от pH раствора, вследствие чего разделение на фракции происходит в основном за счет различия в линейных размеров молекул. В таких экспериментах используют 0.089М Трис-боратный, 0.05 Трсфосфатный и Трис-ацетатный буфер. Стоит отметить, что при обычном электрофорезе в геле можно разделять фрагменты нуклеиновых кислот, размер которых менее 50 тыс п.н. Также часто из эксперимента нужно получить оценку размеров молекул. Для этого используются наборы молекул известной длины. Например, для регистрации продуктов амплификации ДНК применяется электрофорез в агарозном геле в присутствии бромистого эитидия, который образует с фрагментами ДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФ-излучением длиной волны 290-330 нм.
источник
Электрофорез в агарозном геле является методом гель — электрофореза , используемого в биохимии , молекулярной биологии , генетики и клинической химии , чтобы отделить смешанную популяцию макромолекул , таких как ДНК или белков в матрице из агарозы , один из двух основных компонентов агара . Белки могут быть разделены с помощью заряда и / или размером ( изоэлектрофокусирование электрофореза в агарозном, по существу , не зависит размер), а также ДНК и РНК — фрагменты длиной. Биомолекулы разделены путем применения электрического поля для перемещения заряженных молекул через матрицу агарозы, и биомолекулы отделены друг от друга размером в матрице агарозном геле.
Гель агарозов легко отливать, имеет относительно меньшее количество заряженных групп, и особенно подходит для разделения ДНК диапазона размеров наиболее часто встречающегося в лабораториях, на долю которого приходится популярности ее использование. Разделены ДНК может быть просмотрен с красителем, чаще всего под действием УФ-света, и фрагменты ДНК могут быть извлечены из геля с относительной легкостью. Большинство гели агарозы используются между 0.7-2%, растворенного в подходящем буфере для электрофореза.
Агарозном гель является трехмерный матрицей , составленной из спиральных молекул в агарозных суперспиральных пучках , которые объединяются в трехмерный структуры с каналами и порами , через которые могут проходить биомолекулы. Структура 3-D проводится совместно с водородными связями и , следовательно , может быть разрушена путем нагрева обратно в жидкое состояние. Температура плавления отличается от температуры желатинизации, в зависимости от источников, агарозный гель имеет температуру гелеобразования 35-42 ° C и температуру плавления 85-95 ° С. Низкое плавление и низкие желирующие агарозы , сделанные с помощью химических модификаций, также доступны.
Агарозном гель имеет большой размер пор и хорошую прочность геля, что делает его пригодным в качестве антиконвекции среды для электрофореза ДНК и крупных белковых молекул. Размер пор 1% геле была оценена от 100 нм до 200-500 нм, а его прочность геля позволяет гели в виде разбавленных в 0,15% с образованием сляба для гель — электрофореза. Низкая концентрация-гели (0,1-0,2%) , однако являются хрупкими и , следовательно , трудно управлять. Гель агарозы имеет более низкую разрешающую способность , чем полиакриламидный гель для ДНК , но имеет больший диапазон разделения, и поэтому используется для фрагментов ДНК обычно 50-20,000 п.н. в размере. Предел разрешения для стандартного электрофореза в агарозном геле составляет около 750 кб, но разрешение более 6 Мб возможны с электрофорезом геля импульсным поля (PFGE). Он также может быть использован для разделения больших белков, и это является предпочтительным матрица для гель — электрофореза частиц с эффективным радиусом больше 5-10 нм. 0,9% агарозный гель имеет поры достаточно большой для ввода бактериофага Т4 .
Агарозном полимер содержит заряженные группы, в частности пирувата и сульфата . Эти отрицательно заряженные группы создают поток воды в направлении, противоположном направлению движения ДНК в процессе , называемом electroendosmosis (РВЗ), и , следовательно , может замедлить движение ДНК и вызывает размывание полос. Более высокие концентрации гели будут иметь более высокий электроосмотический поток. Низкая РВЗ агарозу поэтому обычно предпочтительным для использования в агарозном гель — электрофореза нуклеиновых кислот , но высокая РВЗ агарозы может быть использована для других целей. Ниже , содержание сульфатов низкой РВЗ агарозы, в частности , низкой температурой плавления (LMP) агарозы, также полезно в тех случаях , когда ДНК экстрагировали из геля , которые будут использоваться для дальнейших манипуляций в присутствии загрязняющих сульфаты может влиять на некоторые последующие процедуры, такие , в качестве лигирования и ПЦР . Нулевые РВЗЫ агарозы однако являются нежелательными для некоторых применений , так как они могут быть сделаны путем добавления положительно заряженных групп и такие группы могут повлиять на последующие реакции фермента. Electroendosmosis является причиной агарозном используется в предпочтении к агар как агаропектин компонент в агар содержит значительное количество отрицательно заряженных сульфатов и карбоксильных групп. Удаление агаропектина в агарозе существенно снижает РВЗ, а также уменьшения неспецифической адсорбции биомолекул на гелевой матрице. Тем не менее, для некоторых приложений , таких как электрофорез белков сыворотки, высокая РВЗ может быть желательной, и агаропектин может быть добавлен в геле используется.
Ряд факторов может повлиять на миграции нуклеиновых кислот: размерность поры геля (концентрация геля), размер ДНК будучи электрофорез, напряжение используется, ионная сила буфера, а концентрация интеркалирования красителя, такие как бромид этидий если используется во время электрофореза.
Более мелкие молекулы движутся быстрее , чем более крупные молекулы в геле, и движется двухцепочечной ДНК со скоростью, обратно пропорциональна логарифму числа пар оснований. Это соотношение , однако ломается при очень больших фрагментах ДНК, и разделение очень больших фрагментов ДНК требует использования электрофореза импульсного геля — поля (PFGE), который применяет переменный ток с двух разных направлений и большие ДНК — фрагменты разделены , как они переориентироваться с изменение тока.
Для стандартного электрофореза в агарозном геле, более крупные молекулы разрешаются лучше, используя низкую концентрацию геля в то время как меньшие молекулы отделить лучше при высокой концентрации геля. Высокие концентрации геля, однако, требует больше времени запуска (иногда дней).
Движение ДНК может влиять на конформации молекулы ДНК, например, суперспирализовано ДНК , как правило , двигается быстрее , чем расслабленный ДНК , поскольку она плотно спиральная и , следовательно , более компактным. В нормальной подготовке плазмидной ДНК, множественные формы ДНК могут присутствовать. Гель — электрофорез плазмид обычно показывает отрицательно суперспиральную форму как основная полоса, в то время как зазубрины ДНК (открытая круговая форма) и расслаблена закрыт круглая форма появляются как незначительные полосы. Скорость , с которой различными формами перемещения , однако , может изменяться с использованием различных условий электрофореза, а подвижность большой кольцевой ДНК могут быть более сильно , чем влияние линейной ДНК размера пор гель.
Этидий бромид, который интеркалирует в кольцевую ДНК может изменить заряд, длину, а также superhelicity молекулы ДНК, поэтому его присутствие в геле при электрофорезе может повлиять на его движение. Например, положительный заряд бромистого этидия может уменьшить движение ДНК на 15%. Электрофорез в агарозном геле может быть использован для решения круговой ДНК с различной топологией суперспирализации.
Повреждение ДНК из — за увеличенное поперечное сшивание также приведет к уменьшению электрофоретической миграции ДНК в зависимости от дозы.
Скорость миграции ДНК пропорциональна приложенного напряжения, т.е. чем выше напряжение, тем быстрее движется ДНК. Разрешение больших фрагментов ДНК, однако ниже, при высоком напряжении. Подвижность ДНК может также изменяться в нестационарном поле — в поле, которое периодически обращено, подвижность ДНК определенного размера может значительно снижаться при определенной частоте езды на велосипеде. Это явление может привести к инверсии зоны в поле электрофореза гель инверсии (ФИГЕ), в результате чего более крупные фрагменты ДНК движутся быстрее, чем более мелкие.
- «смайлик» гели — это краевой эффект возникает, когда напряжение, приложенное слишком высоко для концентрации геля, используемой.
- Перегрузки ДНК — перегружать ДНК замедляет миграцию фрагментов ДНК.
- Загрязнение — наличие примесей, такие как соль или белки может влиять на движение ДНК.
Отрицательный заряд его остова ДНК перемещает в сторону положительно заряженного анода при электрофорезе. Тем не менее, миграция молекул ДНК в растворе, в отсутствии гелевой матрицы, не зависит от молекулярной массы при электрофорезе. Гелевая матрица, следовательно , отвечает за разделение ДНК по размерам в процессе электрофореза, а также ряд моделей существует , чтобы объяснить механизм разделения биомолекул в гелевой матрице. Широко принято одна модель Ogston , которая рассматривает матрицу полимера в виде сита. Шаровые белки или случайная катушка ДНК перемещается через взаимосвязанные поры, и движение больших молекул, более вероятно, будет затруднено и замедлены столкновениями с гелевой матрицей, и , следовательно , молекулы различных размеров могут быть отделенны в этом процессе просеивания ,
Модель Ogston однако ломается при больших молекул в результате чего поры значительно меньше , чем размер молекулы. Для молекул ДНК размера более 1 кб, А рептации модель (или его варианта) наиболее часто используется. Эта модель предполагает , что ДНК может сканировать в моде «змеиной» (отсюда «рептации») через пору в виде удлиненной молекулы. Необъективное модель рептаций применяется при более высокой напряженности электрического поля, в результате чего передний конец молекулы становится сильно предвзятым в прямом направлении и тянет остальную часть молекулы вместе. В режиме реального времени флуоресцентной микроскопии окрашенных молекул, однако, показали более тонкие динамики во время электрофореза с ДНК показывает значительную эластичность , как она попеременно растяжения в направлении приложенного поля , а затем договаривающуюся в шарик, или становится замкнув в U-образную форму когда он попадает на полимерных волокон.
Детали электрофорезом на агарозном геле эксперимента могут варьироваться в зависимости от методов, но большинство следовать общей процедуре.
источник
Метод гальванизации под названием электрофорез давно приобрел популярность и значимость среди остальных физиотерапевтических методиках лечения. Ощутить заметный результат от процедуры электрофореза можно практически в каждой клинике России. Этот метод физиотерапии может носить и другие названия – ионофорез, ионогальванотерапия, ионотерапия, гальванотерапия и т.д. Подобный метод физиотерапии был внедрен в общую практику медицины еще в 1802 году, а это значит, что свой неоценимый вклад в медицину он демонстрирует уже на протяжении более двухсот лет.
Суть этого метода проста, как и все уникальное, — при помощи попеременно воздействующих токов разной силы и длины лекарственные препараты доставляются в очаг поражения сквозь слои кожи.
Гель электрофорез – это разновидность ионофореза, который используется для распределения макромолекул в соответствии с их различиями в размерах, электрическом заряде и ряде других отличительных физических свойств. Само название «электрофорез» — обозначает способность заряженных частиц мигрировать в соответствии с воздействием электрического поля. В случае электрофореза в геле, молекулы, подвергаясь силе электрического тока, двигаются сквозь гелевую массу. Гель электрофорез используется для разделения следующих биологических макромолекул – пептиды, аминокислоты, белки, нуклеотиды, нуклеиновые кислоты и т.д. Эти макромолекулы содержат больше количество ионизированных групп, и могут существовать, как катионы или анионы в любом заданном рН. Электрофорез нуклеиновых кислот применяют при угнетении нормальной жизнедеятельности макроорганизма, что может проявляться при переизбытки токсинов и шлаков. Исходя из этого, выведение токсинов и шлаков из организма – это прямая профилактика предупреждения всех генерализованных заболеваний, а так как химический состав вредных токсинов близок к белковым соединениям и полипептидам, преимущественным выбором будет гель электрофорез с цинком. Хлористый цинк оказывает ощутимое дезинфицирующее действие, и при выполнении электрофореза проявляется прожигающими ощущениями и активацией рефлекторных реакций.
К примеру, самым популярным методом электрофореза с гелем является использование агарозного геля. Именно этот гель, как среду с определенным рН, используют в целях разделения, очищения и идентификации отдельных фрагментов ДНК. Почему эта методика стал столь популярна в современной генетике? Не все лабораторные методы могут разделить некоторые фрагменты ДНК, что мешает получить 100 %-нтный результат исследования. Гель электрофорез помогает выделить и разделить фрагменты дезоксирибонуклеиновой кислоты. За счет трений материалов, образующих гель, формируется «молекулярное сито», что помогает дифференцировать молекулы в соответствии с размером и зарядом. Скорость движения заряженных частиц ДНК через образованные поры в электрическом поле зависят от нескольких факторов:
- Силы образованного электрического поля;
- Диаметра и форм молекул;
- Относительной степени «боязни» воды образцов;
- Температурной кривой буфера и ионной силы.
Методика электрофореза с использованием агарозного геля должна учитывать, что «поры» для разделения макромолекул большого размера, и потому подходят только для молекул, молекулярная масса которых не меньше 200 кДа. К преимуществам агарозных гелей можно отнести относительно быстрое перемещение молекул, но полосы имеют ограниченное разрешение, так как склоны к быстрому размытию границ и распространению в разные стороны. Процедура электрофореза с гелем проводиться по следующим этапам:
- Во-первых, приготовление водного раствора, вид которого зависит от выбора электрофоретического буфера (например, трис – ацетатный, трис – фосфатный, трис – боратный). Конечная рН водного раствора должна составлять 8,0;
- Одновременно с приготовлением водного раствора выбранный буфер при помощи нагревания готовит расплав агарозы с концентрацией 0,4 – 2,0 %;
- Полученный расплав агарозы остужают до 50 градусов, после чего в него добавляют краситель – бромистый этидий в концентрации, которая требуется для дальнейшей визуализации дифференцированных молекул во время ультрафиолетового излучения. Длина волны УФ – света должна составлять 254 нм;
- В горизонтальную кювету помещается 50-ти градусный расплав агарозы, где в последующем за счет гребенки образуются углубления для внесения препаратов ДНК. В подобном состоянии расплав агарозы оставляется до момента достижения консистенции геля;
- После застывания гелеобразных лунок с добавленными препаратами ДНК, кювету помещают в электрофоретическую ванну;
- Одновременно приготавливается навеска гексилрезорцина, который включается в электрофоретический буфер до момента достижения высшей концентрации, составляющей 10 -3 М (0,194 г/л). Именно гексилрезорцин или С6 – алкилоксибензол проявляет наиболее выраженные фотопротекторные свойства;
- Буфер с содержанием указанного выше количества и концентрации С6 – алкилоксибензола, погружается также на на электрофоретическую ванну;
- Электрофоретическая ванна соединяется с источником света, на котором заранее установлены показатели режимов электрофореза;
- Источник тока отключается только после прошествии некоторого времени от разделения препаратов ДНК, что определяется получением частиц с разными характеристиками. После разделении молекул ДНК и отключения источника тока гелеобразную массу агарозы переносят на трансиллюминатор;
- На поверхности трансиллюминатора под воздействием УФ – излучения происходит детализации полученного разделения молекул ДНК, и создание документов при помощи цифровых устройств;
- Последним, заключающим этапом является, вырезание участка геля из агарозы с разделенным молкулами ДНК, для проведения последующих генно – инженерных исследований.
Ведущие клиники могут провести гальванотерапию с гелем с учетом самых высоких технологий, преследуя следующие цели:
- Разделение молекул, составляющих ДНК и РНК, по разнице в размерах. Размер молекул определяется по маркеру;
- Оценка ДНК, и вычисление ее примерного количества по яркости свечения;
- Для многочисленных лабораторных исследований вырезание определенного, требуемого участка ДНК из геля;
- Анализирование и оценка результатов теста ПЦР;
- Часто внедряется в научные исследования по клонированию, например, в течение операции с плазмидой, в ходе которой из плазмиды вырезается участок с использованием рестриктаз, для его последующего использования;
- Секвенирование по Сэнгеру, но в этом случае для электрофореза необходим полиакриламидный гель, который гарантирует разделение молекул самых небольших молекул ДНК, различающиеся на 1 нуклеотид.
Эффекты после проведения электрофореза с гелем:
- Разделение частиц разных размеров и форм;
- Отделение главного участка нуклеотидной цепи, который необходим для генетических исследований;
- Постановление верного диагноза, после проведения ПЦР и оценки результатов исследования;
- Ощутимый вклад в развитие медицинской практики в сфере клонирования;
Из всего вышеописанного можно сделать заключение, что при правильно выбранной клинике для проведения геля электрофореза, точность и грамотность выполнения будет на высоком уровне. В полученных результатах можно не сомневаться, и активно приниматься за полноценное лечение.
источник

