Лабораторная работа №8
ЭЛЕКТРОФОРЕТИЧЕСКОЕ РАЗДЕЛЕНИЕ БЕЛКОВ
Метод основан на том, что молекулы белка обладают электрическим зарядом, величина и знак которого определяются аминокислотным составом белка, pH и ионной силой окружающей среды. Под влиянием внешнего электрического поля заряженные молекулы передвигаются в растворе к противоположно заряженному полюсу. Скорость перемещения белковых частиц пропорциональна величине их заряда и обратно пропорциональна размеру частиц и степени их гидратации.
Широкое распространение в настоящее время получил так называемый «зональный электрофорез» — электрофорез на твердом носителе (на бумажных полосах, агаре, крахмале, акриламиде), пропитанном буферным раствором с нужным значением pH. Положение белков на бумаге или геле определяют путем фиксации и последующего окрашивания их тем или иным красителем (обычно бромфеноловым синим, амидовым черным или кумасси синим). Количество белка в каждой фракции можно ориентировочно определять по интенсивности окраски связанного красителя. Такое определение не дает строго количественного соотношения белковых фракций, так как количество красителя, связываемого различными белками, неодинаково.
ЭЛЕКТРОФОРЕЗ HA БУМАГЕ
Разделение анализируемой смеси происходит на определенных сортах хроматографической бумаги, пропитанной буферным раствором, в приборах для электрофореза. Белки разделяют при напряжении до 500 B.
Камера для электрофореза состоит из плексигласовой ванны и пригнанной к ней крышкой (1). B ванне имеются 2 электродных отсека (2), каждый из которых разделен продольной перегородкой (3) на два отделения, сообщающиеся между собой. Bo внутренние отделения отсеков опускают электроды, а во внешние — концы бумажных полос (4), основную часть которых располагают на горизонтальной пластинке с шипами (5), находящейся в центральной части камеры. Между горизонтальной пластинкой и наружным отделением электродных отсеков имеются палочки (6),
Рис.2. Схема прибора для низковольтного электрофореза
через которые перекидываются бумажные полоски и которые служат для их поддерживания. Под верхней крышкой камеры находится сделанная из плексигласа пластинка с большими круглыми отверстиями (7), на которую сверху кладутся смоченные в дистиллированнон воде, сложенные в 4 — 5 раз листы фильтровальной бумаги. Эти листы способствуют увеличению герметичности камеры и, как следствие, — уменьшению испарения жидкости с электрофореграмм в процессе электрофореза.
Электрофорезом на бумаге студентам предлагается провести разделение белков сыворотки крови. Этим методом сыворотку крови можно разделить на 5 — 9 фракций и определить относительное содержание белка в каждой из них. Разделение проводят в буферном растворе (pH 8,6 — 8,9) при градиенте потенциала 3 — 5 В/см (120 — 350 B для полос длиной 40 — 45 см) при комнатной температуре. Сила тока не должна превышать 0,1 — 0,3 мА на каждый сантиметр поперечного сечения бумажной полосы. Увеличение силы тока более чем в 2 раза недопустимо, так как при этом происходит чрезмерное нагревание, значительное увеличение испарения и в конечном итоге — прогорание бумаги
1. Буферный раствор. Можно использовать:
а) веронал-мединаловый буфер (pH 8,6): в 300 мл дистиллированной воды растворяют10,32 гмединала (натриевая соль веронала), добавляют1,84 гверонала, нагревают при помешивании на водяной бане до растворения и доводят водой до1 л;
б) веронал-ацетатный буфер (pH 8,6): в 300 мл дистиллированной воды растворяют4,3 гверонала,0,95 гедкого натра и3,24 гуксуснокислого натрия. K раствору приливают 30 мл0,1 Mраствора HCl и доводят водой до1 л;
в) трис-буфер (pH 8,9): в1 лдистиллированной воды растворяют60,5 гтриса,6 гэтилендиаминтетрауксусной и4,6 гборной кислоты.
2. Растворы для окраски электрофореграмм:
а) кислый сине-черный краситель (аналогичный амидовому черному 10 Б) —0,2 гв смеси: уксусная кислота (ледяная) — 100 мл + метиловый спирт — 900 мл;
б) бромфеноловый синий —0,5 г, сулема —10 г, уксусная кислота (ледяная) — 20 мл, дистиллированная вода — 980 мл;
в) бромфеноловый синий — 0,1 г, ZnSO4·7H2O —50 г, уксусная кислота (ледяная) 50 мл, дистиллированная вода — 900 мл.
3. Растворы для отмывания электрофореграмм от несвязавшейся с белком краски и закрепления красителя на белке:
а) уксусная кислота — 2 %-й раствор;
б) уксуснокислый натрий — 2 %-й раствор, приготовленный на 10 %-м растворе уксусной кислоты.
4. Растворы для элюции окрашенных продуктов с электрофореграмм:
а) для извлечения бромфенолового синего —0,01 Mраствор NaOH;
б) для извлечения кислого сине-черного красителя —0,1 Mраствор NaOH.
Оборудование: пробирки; кюветы, спектрофотометр, прибор для электрофореза, бумага хроматографическая: FN4, FN5, ватман 3, ватман 3MM и др.
Получение сыворотки крови. 2 — 3 мл крови набирают в сухую центрифужную пробирку и оставляют на 1/2 — 1 ч. Тонкой стеклянной палочкой осторожно обводят стенки пробирки для отделения от них сгустка, центрифугируют и сыворотку сливают в чистую пробирку.
Подготовка камеры. Отсеки для электродов наполняют буферным раствором до одинакового уровня (во избежание перетекания буфера), примерно по 800 мл в каждый отсек. Bo внутренние части электродных отсеков погружают электроды. Ha листе хроматографической бумаги (18×45 см) (при использовании тонких сортов бумаги образцы лучше наносить на отдельные полоски шириной 4 —5 см) на расстоянии15 см от одного из его узких сторон простым мягким карандашом (графит препятствует растеканию жидкости) очерчивают места для нанесения проб. Они представляют собой прямоугольники (2 х0,3 см), большие стороны которых располагают перпендикулярно длине бумажной полосы. Расстояние между стартовыми зонами и краями электрофореграммы —2 см. Электрофореграмму пропитывают буфером, в котором будет проходить электрофорез. Для этого ее протягивают через кювету с буферным раствором. Концы бумажных полос (6 —8 см) не смачивают. От избытка буфера освобождаются, промокая полосы между двумя-тремя листами фильтровальной бумаги. Влажную электрофореграмму помещают в камеру на центральную горизонтальную пластинку (5), а концы опускают в наружные отделения электродных отсеков Прибор плотно закрывают крышкой, под которой находятся смоченные водой листы фильтровальной бумаги.
Проведение электрофореза. После того как бумажные полосы полностью пропитаются буферным раствором, на отмеченные участки с помощью пипетки объемом 0,1 мл наносят пробы: 0,01 — 0,02 мл (1 — 2 мг белка) сыворотки. Камеру закрывают крышкой и включают ток. Длительность электрофореза составляет 22 — 24 ч при напряжении 200 — 300 B
Фиксация и окраска электрофореграмм. По окончании электрофореза выключают ток и тотчас вынимают электрофореграммы из прибора. Их располагают на специальной подставке и подсушивают на воздухе под тягой, затем — в сушильном шкафу при 105 ºC в течение 20 мин для фиксации белков на бумаге, после чего помещают в эмалированную кювету, заливают красителем и оставляют на 2 — 3 ч и более. Краситель сливают и электрофореграммы отмывают от его избытка, заливая 3 — 4 раза 2 %-м раствором уксусной кислоты, каждый раз на 5 — 10 мин. Участки бумаги, не содержащие белка, должны быть полностью освобождены от красителя. Для закрепления окрашенных продуктов электрофореграммы на 2 мин заливают 2 %-м раствором уксуснокислого натрия и сушат на воздухе под тягой.
Определение соотношения отдельных фракций белка. При pH 8,6 белки сыворотки крови заряжены отрицательно и перемещаются в электрическом поле к аноду. Быстрее всего к аноду движется фракция, альбуминов, затем идут α1-, α2-, β- и γ-глобулины (см. Рис. 3). Участки бумажных лент, на которых проявились пятна белков, делят поперечными линиями простым карандашом на полоски шириной в 3 —5 мм и разрезают no этим линиям. Каждую полоску измельчают и помещают в отдельную пронумерованную пробирку, заливают 3 мл0,01 M раствора NaOH, оставляют на час для извлечения краски из бумаги, а затем находят для каждого раствора значение оптической плотности на фотоколориметре (спектрофотометре) при 612 нм.
Рис. 3. Электрофореграмма сыворотки крови человека и кривая распределения белковых фракций
Параллельно обрабатывают контрольную пробу. Для нее вырезают полоску из неокрашенных участков электрофореграммы.
Ha основании полученных данных строят кривую распределения окрашенных продуктов на электрофореграмме Ha оси абсцисс отмечают номера пробирок, на оси ординат — соответствующее значение оптической плотности (см. Рис.3). Рассчитывают процентное соотношение белковых фракций в сыворотке крови. Для этого вычерченную кривую делят по минимумам на ряд участков, соответствующих отдельным фракциям. Величина площади каждого участка пропорциональна количеству краски, соединившейся с белком данной фракции. Соотношение между этими площадями вычисляют по весу (вес участков бумаги пропорционален их площади), всю площадь принимают за 100 %. При наличии денситометра соотношение белковых фракций в сыворотке крови можно определить из денситограммы.
Предварительно определяя содержание белка в сыворотке, рассчитывают его количество для каждой фракции.
источник
Принцип метода: Белки являются амфотерными электролитами. Направление движения белков в электрическом поле зависит от рН среды. Коллоидные частицы белка перемещаются в электрическом поле постоянного тока к аноду – в щелочной среде, к катоду – в кислой среде.
Разделение белков сыворотки обычно проводят в буферном растворе при рН 8,6 – 8,9. В качестве носителя используют пленки из ацетата целлюлозы. В этих условиях заряженные белки сыворотки крови перемещаются по смоченным пленкам из ацетата целлюлозы в направлении анода со скоростью, зависящей от величины заряда и относительной молекулярной массы белка. Этот след представляет собой дорожку, на которой после окрашивания ясно видны места концентрации белков различных фракций. Наиболее быстро движутся альбумины, затем a1-, a2-, b-глобулины, и, наконец, g-глобулины. По этим следам (дорожкам) можно определить содержание белка в различных белковых фракциях пробы. Методом электрофореза на пленках из ацетата целлюлозы можно получить 5 и более белковых фракций.
Нормальные величины белковых фракций зависят от вида применяемого красителя:
1) Аппарат для электрофореза;
2) Источник постоянного тока;
4) Веронал-мединаловый буфер, рН 8,6;
5) Раствор амидо черного для окрашивания электрофореграммы (амидо черный 250 мг в 100 мл 7% уксусной кислоты);
6) Раствор для отмывания (5-7% уксусная кислота)
7) Раствор для просветления пластинок из ацетата целлюлозы (смесь этанола, уксусной кислоты и глицерина);
Просветления пластинок из ацетата целлюлозы можно достигнуть также, погрузив пластинки на 2-3 минуты в глицерин или вазелиновое масло.
1. Сухие пластинки из ацетата целлюлозы помечают карандашом, а затем осторожно кладут на поверхность буфера для электрофореза так, чтобы они поглощали жидкость только снизу с помощью капиллярных сил. При быстром погружении пластинки в буфер в порах ацетата целлюлозы может остаться воздух.
2. Извлекают пластинки из буферного раствора и аккуратно зажимают их между листами плотной фильтровальной бумаги, не допуская высыхания пластинок. О высыхании свидетельствует появление белых пятен на поверхности пластинки. В этом случае пропитывание буфером следует повторить (см. пункт 1).
3. Влажную пластинку закладывают в рамку и помещают в электрофоретическую камеру.
4. С помощью апликатора на поверхность пластинки с катодного краю наносят образец – 0,2-0,4 мл сыворотки крови.
5. Сразу после нанесения образцов включают электрический ток.
Для кратковременного электрофореза на пленках из ацетата целлюлозы лучшие результаты получаются при стабильном напряжении. Как правило, для пластинок толщиной около 120 мкм сила тока не должна превышать 0,5 мА на 1 см ширины пластинки. Для более толстых пластинок (250-300 мкм) сила тока может достигать 1мА на 1 см ширины пластинки. Применив высокий градиент напряжения (30-40 В на 1 см) можно получить четкое разделение фракций белка за короткий промежуток времени (20-30 минут).
6. После отключения тока пластинки осторожно переносят в красящий раствор на 5 минут.
7. Затем пластинки отмывают до отбеливания фона в 5-7% растворе уксусной кислоты дважды по 3 минуты. Промывают 3 раза дистиллированной водой. Просушивают между листами фильтровальной бумаги.
8. Проводят просветление пластинок. Для этого помещают пластинки на 30 секунд в 90° этиловый спирт. Затем помещают их в осветляющий раствор на 30 секунд. Наклеивают на стекло и помещают в сухожаровой шкаф на 5 минут при температуре 100°С.
9. Высушенную пластинку сканируют на денситометре придлине волны 600 нм, характерной для красителя амидо черного.
Данные о содержании белка в белковых фракциях сыворотки крови могут быть представлены как в форме процентного распределения белка по фракциям, так и в форме содержания белка в отдельных фракциях в г/л (для этого предварительно в крови определяют содержание общего белка биуретовым методом).Результаты измерения заносят в таблицу:
источник
Белки крови. Отдельные белковые фракции, разделение методом электрофореза, характеристика. Небелковые компоненты крови. Возрастная динамика белковых фракций.
В плазме крови содержится 7% всех белков организма при концентрации 60 — 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
—Белки плазмы образуют важнейшую буферную систему крови и поддерживают рН крови в пределах 7,37 — 7,43.
—Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) вьшолняют транспортную функцию.
—Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
-Белки плазмы крови являются резервом аминокислот для организма.
—Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию.
Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55-65%), α1-глобулины (2- 4%), α2 -глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%)
Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16-17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций.
| Группа | Белки | Концентрация в сыворотке крови, г/л | Функция | ||||||||||||||||||||||||||||||||||||||||||
| Альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина | ||||||||||||||||||||||||||||||||||||||||||
| Альбумин | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | ||||||||||||||||||||||||||||||||||||||||||||
| α1-Глобулины | α1 -Антитрипсин | 2,5 | Ингибитор протеиназ | ||||||||||||||||||||||||||||||||||||||||||
| ЛПВП | 0,35 | Транспорт холестерола | |||||||||||||||||||||||||||||||||||||||||||
| Протромбин | 0,1 | Фактор II свёртывания крови | |||||||||||||||||||||||||||||||||||||||||||
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |||||||||||||||||||||||||||||||||||||||||||
| Кислый α1-гликопротеин | Транспорт прогестерона | ||||||||||||||||||||||||||||||||||||||||||||
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |||||||||||||||||||||||||||||||||||||||||||
| α2-Глобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза | ||||||||||||||||||||||||||||||||||||||||||
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |||||||||||||||||||||||||||||||||||||||||||
| Гаптоглобин | Связывание гемоглобина | ||||||||||||||||||||||||||||||||||||||||||||
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |||||||||||||||||||||||||||||||||||||||||||
| Ретинолсвязыва-ющий белок | 0,04 | Транспорт ретинола | |||||||||||||||||||||||||||||||||||||||||||
| Витамин D связывающий белок | 0,4 | Транспорт кальциферола | |||||||||||||||||||||||||||||||||||||||||||
| β-Глобулины | ЛПНП | 3,5 | Транспорт холестерола | ||||||||||||||||||||||||||||||||||||||||||
| Трансферрин | Транспорт ионов железа | ||||||||||||||||||||||||||||||||||||||||||||
| Фибриноген | Фактор I свёртывания крови | ||||||||||||||||||||||||||||||||||||||||||||
| Транскобаламин | 25×10 -9 | Транспорт витамина B12 | |||||||||||||||||||||||||||||||||||||||||||
| Глобулин связывающий белок | 20×10 -6 | Транспорт тестостерона и эстрадиола | |||||||||||||||||||||||||||||||||||||||||||
| С-реактивный белок | I группа- азотсодержащие небелковые компоненты. В состав небелкового азота крови входит азот промежуточных и конечных продуктов обмена простых и сложных белков. Раньше небелковый азот называли остаточный азот (остается после осаждения белков): 1.азот мочевины (50 %);2.азот аминокислот (25 %); 3.низкомолекулярные пептиды; 4.креатин; 5.креатинин; 6.билирубин; 7.индикан; 8.некоторые другие азотсодержащие вещества. При некоторых заболеваниях почек, а также при патологии, сопровождающейся массивным разрушением белков (например, тяжелые ожоги), может повышаться небелковый азот крови, т. е. наблюдается азотемия. Однако наиболее часто нарушается не общее содержание небелкового азота в крови, а соотношение между отдельными компонентами небелкового азота. Поэтому сейчас в плазме определяют азот отдельных компонентов. В понятие «остаточный азот» включают и низкомолекулярные пептиды. Среди низкомолекулярных пептидов есть много пептидов, обладающих высокой биологической активностью (например, гормоны пептидной природы). II группа -безазотистые органические вещества. К безазотистым (не содержат азот) органическим веществам плазмы крови относятся: 1)углеводы, липиды и продукты их метаболизма (глюкоза, ПВК, лактат, кетоновые тела, жирные кислоты, холестерин и его эфиры и др.); 2)минеральные вещества крови. С возрастом прослеживается четкая возрастная динамика биохимических показателей крови: с возрастом происходит повышение в сыворотке крови общего белка, общего кальция, неорганического фосфора. У плода эмбриоспецифические белки, т.е. белки, характерные только для плода и в норме не синтезирующиеся в организме матери, сохраняют большое диагностическое значение. К таким белкам в первую очередь следует отнести альфафетопротеин (АФП), ацетилхолинэстеразу, белки микроворсинок кишечника плода и стероидные гормоны. Дыхательная функция крови: механизм переноса кислорода и углекислого газа. Гемоглобин, структурная характеристика. Формы и производные гемоглобина. Механизм образования оксигемоглобина. Роль кооперативных взаимодействий. 2,3-дифосфоглицерат в регуляции сродства гемоглобина к кислороду. Эффект К. Бора и его роль в кислород-транспортной функции гемоглобина. Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканейк легким. Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давлениекислорода резко снижено, осуществляется отдача кислорода тканям. В крови здорового человека содержание гемоглобина составляет 120—165 г/л (120—150 г/л для женщин и 130—160 г/л для мужчин). Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула гемоглобинапостроена из 4 субъединиц (полипептидных цепей), каждая из которых связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4 гема, к которым может присоединяться кислород, при этомгемоглобин переходит в оксигемо-глобин. У человека имеются три основных типа нормального гемоглобина: эмбриональный U (uterus) , фетальный — F (faetus) и гемоглобин взрослого человека – А(adult). В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа. Затем формируется гемоглобин F. Его глобин представлен двумя цепями альфа и двумя гамма. Гемоглобин F обладает на 20—30 % большим сродством к О2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Количество HbF, превышающее 2% считается патологическим для взрослого человека и для детей старше 3 лет. Гемоглобин А представлен еще HbА2 , который представлен 2 альфа и 2 дельта цепями. На его долю приходится около 2% от общего Hb. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Однако гемоглобин F обладает меньшей стойкостью к разрушению и меньшей стабильностью в физиологически широком интервале pH и температур. В течение последнего триместра беременности и вскоре после рождения ребёнка гемоглобин F постепенно — в течение первых нескольких недель или месяцев жизни, параллельно увеличению объёма крови — замещается «взрослым» гемоглобином А (HbA), менее активным транспортёром кислорода, но более стойким к разрушению и более стабильным при различных значениях pH крови и температуры тела. Такое замещение происходит вследствие постепенного снижения продукции γ-цепей глобина и постепенного увеличения синтеза β-цепей созревающими эритроцитами. по уровню фетального гемоглобина можно судить о «степени созревания» недоношенного ребенка. Определение уровня фетального гемоглобина важно для проведения лечебных мероприятий при гемолитической анемии новорожденных, касающихся заменных переливаний крови. Гемоглобин, присоединивший О2, носит наименование оксигемоглобина(ННbО2); гемоглобин, отдавший О2, называется восстановленным, или редуцированным (ННb). Кроме того, часть гемоглобина через аминную группу связывается с СО2, образуя карбгемоглобин (ННbСО2), благодаря чему переносится от 10 до 20% всего транспортируемого кровью СО2. Путем непрерывного превращения оксигемоглобина в редуцированный гемоглобин и обратно, осуществляется перенос кислорода из легких к тканям. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, облегчая отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В12-дефицитной анемии, гипохромия — для железодефицитной анемии. Эффект Бора – в тканях много Н+. Он поступает в эритроцит и уменьшает сродсво гемоглобина к кислороду. Чем кислее среда, тем быстрее гемоглобин отдает кислород. источник Для разделения белков сыворотки крови на их составляющие используют метод электрофореза, основанный на различной подвижности белков сыворотки крови в электрическом поле. Принцип разделения белков сыворотки крови на фракции состоит в том, что в электрическом поле белки сыворотки крови движутся по смоченной буферным раствором хроматографической бумаге (ацетатцеллюлозной пленке, крахмаловому, агаровом гелям) со скоростью, зависящей в основном от величины электрического заряда и молекулярной массы частиц. Вследствие этого белки сыворотки крови разделяются обычно на пять основных фракций: альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины, гамма-глобулины, содержание которых определяется с помощью фотометрии или денситометрии. Электрофорез в агаровом, крахмальном и особенно полиакриламидном геле дает лучшие результаты: четкое разделение и большое количество белковых фракций сыворотки. Недостатки метода: сложность процедуры приготовления геля (дороговизна готовых гелевых пластин). Преимущества электрофореза на ацетатцеллюлозной пленке: 1. Химическая однородность пленки и одинаковый размер пор 2. Требует малый объем пробы (0,2-2 мкл) для разделения 3. Быстрота разделения и окраски белков, легкость отмывания фона В сыворотке крови здорового человека при электрофорезе можно обнаружить шесть белковых фракций: преальбумины, альбумины, альфа-1-глобулины, альфа-2-глобулины, бета-глобулины и гамма-глобулины. Это исследование в диагностическом отношении более информативно чем определение только общего белка или альбумина. При многих заболеваниях изменяется процентное соотношение белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы. Анализ фореграммы белков позволяет установить, за счет какой фракции происходит увеличение или дефицит белка, а также судить о специфичности изменений, характерных для данной патологии. Исследование белковых фракций, позволяет судить о характерном для какого-либо заболевания избытке или дефиците белка только в самой общей форме. Белковые фракции сыворотки крови в норме:
При анализе результатов исследования сыворотки крови на белковые фракции выявляются три типа нарушений: 1. Диспротеинемия (изменение соотношения белковых фракций) 2. Генетические дефекты синтеза белков 3. Парапротеинемия (аномальные белки в крови) Не нашли то, что искали? Воспользуйтесь поиском: Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8426 — 195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь. Отключите adBlock! источник Электорофорез белков плазмы (EPH) — распространенный диагностический метод в ветеринарии млекопитающих уже много лет. Развитие этого метода упростило процедуру анализа и сейчас требует очень небольших количеств плазмы, что позволяет использовать его в ветеринарии птиц (Cray, 2000) и рептилий (Zaias, Gray,2002). Техника электрофореза. Основной принцип EPH включает покрытие плазмы или сыворотки тонким агарозным гелем. Прохождение электрического тока через гель заставляет мигрировать белки, в результате чего образуются полосы, зависящие от заряда и размера белковых молекул. После этого гель фиксируют, окрашивают и анализируют полосы визуально или квалифицируют с помощью лазерного сканирования в денситометре. Коммерческие системы для EPH-диагностики упрощают процесс и требуют всего 10 мкл сыворотки или плазмы. После помещения микрообразца в гель его подвергают электрофорезу в течение 40 минут при 100V, высушивают, окрашивают и сканируют в денситометре при 600 нм. Относительный и абсолютный (г/дл) размер белковых фракций можно определить на основании данных об уровне общего белка, полученных методом рефрактометрии. Вопрос об использовании плазмы или сыворотки уже обсуждался несколькими авторами при исследовании разных видов птиц. Для птиц предпочтительнее использовать плазму. Общий белок плазмы в среднем на 1,7 г/дл, выше, чем в сыворотке из-за присутствия фибриногена. Так как фибриноген является острофазным белком, то есть индикатором острого воспаления, предпочтительнее включать эту фракцию в процесс EPH, как и при определении уровня общего белка. В остальном, сравнение результатов, полученных при EPH сыворотки или плазмы не показывает достоверных различий (Lumei and DeBruije, 1985). Основные фракции белков, выделенные с помощью EPH включают (слева направо) альбумин, a-1 глобулин, a-2 глобулин, β-глобулин, g-глобулин. На рис. изображена электрофоретограмма здоровой зеленой игуаны. Альбумины представляют максимальную порцию белков плазмы и являются наиболее гомогенной и различимой фракцией у здоровых млекопитающих, птиц и рептилий. Альбумины работают как транспортные белки и определяют приблизительно 75% осмотической активности плазмы. Иногда у здоровых птиц можно обнаружить преальбуминовую фракцию, но у здоровых млекопитающих она встречается редко. Предварительные результаты показывают, что преальбуминовая фракция может встречаться у некоторых видов здоровых черепах (Zaias, Gray, 2002). Значение этих белков не ясно, но скорее всего эта фракция представлена белками, близкими к альбуминам по свойствам (транспортные белки). Альфа-глобулины обычно встречаются у птиц в виде двух отдельных фракций: a-1 и a-2. Эти фракции включают белки острой фазы: a-липопротеин, a-1-антитрипсин и a-2-макроглобулин (Kaneko, 1997; Cray, 2000). Бета-глобулины являются белками острой фазы воспаления и включают фибриноген, трансферрин, бета-липопротеин и комплемент. Они могут выделяться в виде одной или двух отдельных полос или пиков на электрофоретограмме. Фракция гамма-глобулинов представлена циркулирующими иммуноглобулинами. Обычно выделяется один пик, но редко – два. Продукты деградации комплемента также могут мигрировать в эту область (Kaneko, 1997). В добавлении к оценке белковых фракций, из этих данных можно вычислить и использовать А/Г индекс для определения соотношения альбуминов и глобулинов. У птиц в норме концентрация глобулинов минимальна по сравнению с доминирующими глобулинами. У рептилий ситуация, наверно, похожа. Применяют следующую формулу подсчета А/Г индекса: (преальбумины (если имеются) + альбумины) : (a-1 + a-2 + b + g-глобулины). Анализ и интерпретация электрофоретограммы. Хотя нормальные значения этих фракций для рептилий пока не установлены, основы для интерпретации данных EPH можно почерпнуть из литературы о птицах и млекопитающих (Kaneko, 1997). Многие из белков плазмы, в том числе белки острой фазы и иммуноглобулины, заметно изменяются при заболевании. Фракционирование и определение индивидуальных фракций белков позволяет определить характер их повреждения. К примеру, белки острой фазы отвечают за локализацию повреждения и начало выздоровления. Концентрация многих из них повышается, что заметно по увеличению пиков альфа и бета-глобулинов, и часто это наиболее ранний симптом острого воспаления или инфекции. В дальнейшем возрастает фракция гамма-глобулинов в связи с продукцией антител к конкретному патогену. В качетсве примера на рисунке показана электрофоретограмма от больной игуаны с симптомами слабости, анорексии, фасцикуляцией мышц и нарушением формирования скелета. Биохимия крови показывает инверсию кальция и фосфора. На электрофоретограмме заметно резкое снижение альбуминов (19% вместо 43%) и повышение бета-глобулинов (58% вместо 19%). Эти данные говорят о хронической патологии печени или почек, как потенциальной причине или наоборот, следствии метаболических расстройств. На другом рисунке изображена электрофоретограмма плазмы нескольких игуан разного возраста и общего состояния. Наши предварительные результаты показывают, что помимо увеличения фракции острофазных белков, у больных животных может отмечаться исчезновение некоторых в норме присутствующих минорных фракций. Нарушенный А/Г индекс часто является первым симптомом диспротеинемии. Понижение этого показателя говорит о значительном повышении глобулинов, понижении альбуминов, или обоих процессах. Снижение индекса при нормальном уровне общего белка – важный симптом диспротеинемии, который без вспомогательного EPH-теста не определяется. Изменения на электрофоретограмме охарактеризованы пока только у птиц (Cray,1999): общий белок: Гиперпротеинемия указывает на дегидратацию; гипопротеинемия является нормой у птиц в возрасте до 8 месяцев, у взрослых это обычно указывает на гипергидратацию. альбумины: Гиперальбуминемия редко встречается без дегидратации; гипоальбуминемия может быть обусловлена потерей почками, печенью, ЖКТ или встречается при эндопаразитарных болезнях. Пониженный синтез альбуминов отмечают при болезнях печени, истощении и при хроническом воспалении. a1-глобулины: повышение этой фракции характерно при остром воспалении, паразитозах; a2–глобулины: повышение встречается при остром воспалении, гепатитах, нефритах, нефротическом синдроме. β-глобулины: повышение обычно при остром и хроническом воспалении, гепатите, нефритах, острых и хронических хламидиозах, аспергиллезе. g-глобулины: повышение обычно при остром воспалении, инфекционных болезнях, желточном перитоните, иммунных болезнях, опухолях ретикулоэндотелиальной системы. Физиологические влияния (возраст, гормоны, питание, стресс), не связанные с болезнью, могут изменять показания EPH, что необходимо учитывать при интерпретации. Впрочем, у птиц и млекопитающих эти факторы сами по себе влияют на результаты EPH в значительно меньшей степени, чем болезнь. Принципы, разработанные для птиц, скорее всего, подходят и для рептилий, а для амфибий таких работ пока не было выполнено. Как и в случае других лабораторных исследований, в результатах электрофоретограмм рептилий могут иметься значительные видоспецифические и сезонные вариации. Поэтому важно накопление первичной информации и установление стандартов для каждой конкретной лаборатории. Дата добавления: 2015-03-29 ; Просмотров: 1554 ; Нарушение авторских прав? ; Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет источник Этот анализ является исследованием, которое позволяет определить их количественные и качественные показатели по тому, как белки распределяются в электрическом поле. Исследование основано на том, что белковые молекулы несут заряды, положительные или отрицательные в зависимости от того, какой кислотностью будет обладать среда, в которой будет проводиться непосредственно электрофорез. Молекулы, которые окажутся положительно заряженными, будут адсорбироваться лучше, нежели чем те, которые несут отрицательный заряд. Носителями, которые будут применяться для электрофореза, могут быть хроматографическая бумага, агаровый гель, полиакриловой гель, ацетатцеллюлозная бумага или акриловый гель. Значительно реже применяется капиллярный электрофорез. Во время анализа белки разделяют на 5 или 6 фракций, в зависимости от применяемого метода. Это будут гамма-глобулины, которые делятся на бета-1 и бета-2, альбумины — альфа-1 и альфа-2, а также бета-глобулины. Имеются установленные нормы белковых фракций, которые должны присутствовать в крови. Отклонение их от показателей является признаком нарушения в организме, что требует проведения обследования для выявления причины.
Значения показателей, в зависимости от того какие реактивы применяются в конкретной лаборатории, могут несколько изменяться. Поэтому в бланке результатов исследования в каждом медицинском учреждении обязательно указываются значения нормы, которые приняты в нем. На них будет ориентироваться врач при расшифровке анализа. Электрофорез белков крови назначают не очень часто, так как сегодня современные лабораторные исследования позволяют провести анализ на определенный белок, что ускоряет процесс диагностики. Абсолютным показанием к электрофорезу является наличие монолокальной гаммапатии. Также иногда анализ может быть показан в таких случаях:
При общей диспансеризации и получении медицинских справок для трудоустройства данное исследование крови не осуществляется. Не требуется оно и в процессе подготовки человека к хирургическому вмешательству. Для получения наиболее точных результатов рекомендуется соблюдение правил подготовки к анализу. Они включают в себя голодную диету в течение 15 часов до того как будет взята кровь, когда пациент может употреблять только чистую не газированную воду. За 90 минут до проведения исследования необходимо полностью исключить нагрузки как эмоциональные, так и физические, и курение в активной или пассивной форме. Чтобы не допустить искажение данных, забор материала не проводят сразу после того, как был осуществлен гемодиализ или проведена процедура, при которой использовались радиоконтрастные составы. Важно также, чтобы за несколько дней до исследования полностью было исключено лечение пенициллином, так как он вызывает расщепление амбулина, что исказит результат.
Исказить показатели, кроме неправильной подготовки к проведению анализа, могут 2 фактора: недавно проведенная процедура гемодиализа, из-за которой произошло разрушение эритроцитов в крови, и повышенный уровень билирубина в организме. В любом из этих случаев потребуется пересдача анализа через некоторое время, которое определит врач. источник Разделение растворенных белков под действием постоянного электрического поля носит название белкового электрофореза (ЭФ). В качестве носителя для проведения электрофореза могут быть использованы различные материалы, выбор которых зависит от поставленной задачи. В настоящее время в диагностической практике в качестве поддерживающей среды используют ацетатцеллюлозную мембрану или гель агарозы (агароза отличается большей чувствительностью и лучшим разрешением, поэтому предпочтительна). Величина пор обоих этих носителей намного больше величины исследуемых молекул, в связи с чем даже высокомолекулярные белки мигрируют в них беспрепятственно. В щелочной среде (именно в щелочном буфере проводят диагностический электрофорез) белки биологических жидкостей имеют суммарный отрицательный заряд. Под действием электрического поля они перемещаются к аноду со скоростью, зависящей главным образом от величины заряда. После окончания фореза пластину с разделенными образцами окрашивают специальными красителями, а затем полученные электрофореграм-мы оценивают визуально и с помощью приборов. Электрофоретическое разделение нормальной сыворотки человека в геле агарозы позволяет выявить следующие фракции: преальбумин, альбумин и пять глобулиновых зон: а, (формируется в основном за счет а1-антитрипсина), а2 (ее образуют гаптоглобин и а2-макроглобулин), b1 (трансферрин), b2 (С3-компонент комплемента) и у (ее формирует в основном IgG). Если исследуют плазму, в быстрой у-зоне имеется дополнительно полоса фибриногена. Другие белки в норме содержатся в количествах, не позволяющих выявить их в виде отдельных зон, но при повышении их уровня могут давать дополнительные полосы в зоне своей миграции или приводить к усилению окраски уже существующих фракций. Это прежде всего орозомукоид и а-липопротеины (а,-зона), антихимотрипсин и церулоплазмин (а2-зона), фибронектин (граница а2- и b-зон), четвертый компонент комплемента — С4 (b-зона), С-реактивный белок и лизоцим (у-зона), поликлональные IgA (b2у1-зона) и IgM (у1-зона). Поликлональные иммуноглобулины, характерной особенностью которых является гетерогенность структуры и, следовательно, заряда молекул, отличаются разной подвижностью в электрическом поле, поэтому область их миграции (у-зона) представляет собой широкое диффузное пятно без четких границ. Структурная гомогенность моноклональных иммуноглобулинов обусловливает гомогенность изоэлектрических точек молекул внутри пула. На электрофореграмме моноклональные иммуноглобулины образуют, как правило, узкую, четко ограниченную полосу, называемую М-градиентом. Интенсивность окрашивания каждой из электрофоретических фракций пропорциональна количеству образовавшего ее белка: чем больше белковых молекул мигрирует в определенной зоне, тем больше красителя они связывают. Плотность окрашивания в каждой точке электрофореграммы оценивают с помощью специального прибора — денситометра, детектор которого регистрирует степень ослабления светового луча, перемещающегося вдоль трека перпендикулярно к поверхности последнего. Данные сканирования представляют в виде графика, на котором каждая белковая зона образует пик. Высота пика отражает интенсивность окраски зоны, а ширина—степень ее гетерогенности. По площади пиков автоматически рассчитывают относительное (в процентах) и абсолютное (в весовых единицах) содержание белка в электрофоретических фракциях. Для расчета в весовых единицах необходимо предварительно ввести в прибор данные о концентрации общего белка в образце. Качественно выполненный электрофорез является высокоинформативным методом. Он позволяет без больших затрат времени, сил и средств дать предварительную характеристику белков сыворотки и других биологических жидкостей. Один из основных недостатков метода — неспецифичность, т. е. невозможность во многих случаях сделать вывод о природе белковой полосы, выявленной на электрофореграмме. Это относится прежде всего к дополнительным зонам и фракциям, отсутствующим в нормальной сыворотке. Кроме того, если электрофоретическая подвижность двух разных белков совпадает, то на электрофореграмме они образуют одну полосу. Поэтому в случаях, когда на основании клинико-лабораторного симптомокомплекса можно предполагать заболевание, характеризующееся белковой патологией, электрофоретическое исследование сыворотки недостаточно: необходимо использовать дополнительно иммунохимические методы. Например, при дефиците IgA и IgM уровень электрофоретической у-фракции остается в пределах нормы, поскольку эта зона формируется в основном за счет IgG. Только иммунохимическое определение уровня иммуноглобулинов позволяет выявить иммунодефицитное состояние. источник В плазме человеческой крови находится множество белковых компонентов. Они различны по своему составу, строению и подвижности в определенной среде, проводящей электрический ток. На этом и строится разделение общего белка, который локализуется в плазме, на различные белковые фракции. При проведении электрофореза сыворотки крови выясняют количественное отношение отдельных белковых составляющих и структур. Это необходимо для определения наличия у человека различных патологических явлений, например инфекций или онкологии. Именно электрофорез белков сыворотки крови имеет большое значение при проведении диагностики различных болезней. Для расщепления белковых фракций применяют электрофорез сыворотки крови, принцип которого основан на разной подвижности белковых компонентов в созданном электрическом поле. Такой метод исследования является более точным и информативным, в отличие от стандартного общего анализа крови. Но при этом электрофорез показывает только количество определённой фракции белка, характер и степень патологического процесса в общей форме. Анализ проведенных исследований позволяет медицинским специалистам выяснить, какое именно соотношение белковых фракций наблюдается в организме человека, и определить специфику патологии, присущую конкретному заболеванию. Большую часть основной биологической жидкости человека, или крови, составляют белки. В общем количестве их норма находится в пределах 60-80 г/л. Для получения точного анализа проводится электрофорез сыворотки крови на бумаге. Это исследование является самым распространенным способом анализа. Основной средой является особая фильтровальная бумага. Главная ее особенность – высокая гигроскопичность. Такая бумага может поглотить воды больше своего веса в 130-200 раз. В зависимости от применяемого оборудования электрофорез на бумаге длится 4-16 часов. Происходит подразделение белковых структур. Затем полосы бумаги обрабатывают специальными красками для получения анализа. Такая методика является самой распространенной в работе медицинских лабораторий. За счёт воздействия электрического тока белковые фракции, заряженные отрицательно, двигаются в сторону положительно заряженного электрода. Благодаря этому белковые составляющие крови подразделяются на 5 известных фракций: Альбумины заряжены отрицательно, имеют маленькую, по сравнению с другими фракциями, молекулярную массу. За счет этого скорость их передвижения гораздо выше, чем у остальных фракций, и они дальше всех локализуются от участка старта. Первые три фракции глобулина передвигаются с более низкой скоростью из-за своей массы. Но самая маленькая скорость регистрируется у γ-глобулинов. Эти белки имеют большую массу и крупные, относительно других, размеры. Их заряд почти нейтрален, поэтому данная белковая фракция практически не сдвигается с линии старта. В настоящее время электрофорез сыворотки крови часто проводимый анализ для постановки точного диагноза болезни. Этот анализ могут назначить как терапевты, так врачи узкого профиля. Показаниями по проведению исследований будут:
Для того чтобы полученные результаты поведенных исследований были верными, не менее чем за 8 часов до сдачи крови необходимо отказаться от приёма еды. Кроме того, необходимо согласовать прием лекарственных средств, если таковые имеются, с лечащим врачом. Для того чтобы результаты не были по ошибке завышены, необходимо снизить до минимума возможность свертывания крови для определения показателя белковых фракций и общего белка. Электрофорез сыворотки крови проводится аккуратно, поскольку существует вероятность искажения полученных результатов из-за фибриногена. Он может прятать ненормальные белки или быть спутанным с ними. В течение суток после сдачи пробы будет готов анализ на электрофорез белков сыворотки крови. Норма полученных показателей по категориям у взрослых людей:
Изменение количества любой белковой фракции в большую или меньшую сторону может свидетельствовать о развитии той или иной патологии. Для получения достоверной информации об этом необходим электрофорез белков сыворотки крови. Расшифровка результатов облегчит медицинским специалистам постановку диагноза и выбор лечения. В самом начале при анализе полученных результатов определяют количество альбумина. Увеличение этой фракции может говорить об обезвоживании. Такое может произойти, если у больного отмечается затяжная рвота или нарушения в пищеварительной системе. Также увеличение альбумина происходит при ожогах большой площади кожного покрова. Гораздо опаснее, если в организме снижается количество альбуминов, это может говорить о следующих патологиях:
Незначительное уменьшение количества альбуминов может быть также:
Уменьшение количества a1-глобулинов регистрируется при недостатке α1-антитрипсина. Увеличение же отмечают при обострении воспалений в организме, нарушениях в работе печени, при тканевом распаде. Регистрируют его при сахарном диабете, воспалительных процессах в поджелудочной железе, у новорожденных детей при желтухе, при гепатитах токсического происхождения. Свидетельствует оно и о неправильном, несбалансированном питании. Происходит при наличии следующих заболеваний:
Кроме того, такое явление характерно для гемолиза крови в пробирке во время проведения исследования. Проявляется при гиперлипопротеидемии (увеличении количества липидов в крови), патологиях печени и почек. Можно обнаружить при открытой язве желудка, а также гипотиреозе (нарушение работы щитовидной железы). Снижение фракции регистрируют при гипобеталипопротеинемии (повышение в крови компонента беталипопротеин). Эта фракция включает в свой состав иммуноглобулины. Поэтому увеличение γ-глобулинов регистрируется при сбоях в иммунитете. Обычно это происходит при различных инфекциях, развитии воспалительного процесса, изменениях ткани и ожоговых поражениях. Рост γ-глобулинов отмечают у больных хронической формой гепатита. Практически такая же картина характерна для цирроза печени. При запущенных случаях данного заболевания количество белковой фракции γ-глобулинов значительно выше показателя альбуминов. При определенных болезнях могут возникать сбои в образовании γ-глобулинов, и происходит развитие измененных протеинов в крови – парапротеинов. Для выяснения характера такого развития производится дополнительное исследование – иммуноэлектрофорез. Такая картина характерна для миеломного заболевания и патологии Вальденстрема. Увеличение количества γ-глобулинов также присуще следующим патологиям:
Снижение показателя γ-глобулинов подразделяют на 3 вида:
Вторичное снижение регистрируется при развитии заболеваний, которые вызывают истощение иммунной системы. В последнее время в медицинской практике все чаще проводится анализ на определение количества преальбуминов. Обычно такое исследование проводят больным, находящимся в реанимации. Уменьшение количества преальбуминов очень важный и точный тест на определение недостаточности белковых структур в организме пациента. При проведении анализа на преальбумины выполняют коррекцию белкового метаболизма у таких пациентов. Принцип проведения подобного анализа схож с технологией выполнения электрофореза сыворотки крови. Проводят его для более точной постановки диагноза или обнаружения других патологий. Кроме того такой анализ поможет выявить у больного наличие протеинурии. Электрофорез сыворотки крови и мочи – важные методы в диагностике различных инфекционных заболеваний. Благодаря методике исследования и высокой точности они помогают определить вид патологии. Точный диагноз – верный путь к правильному лечению и полному выздоровлению. источник Белки плазмы крови, их биологическая роль. Методы разделения белков плазмы крови. Диспротеинемии. Выполнила студентка 6 курса МБФ Баёва Елена. — презентацияПрезентация была опубликована 6 лет назад пользователемОлег Селивановский Презентация на тему: » Белки плазмы крови, их биологическая роль. Методы разделения белков плазмы крови. Диспротеинемии. Выполнила студентка 6 курса МБФ Баёва Елена.» — Транскрипт:1 Белки плазмы крови, их биологическая роль. Методы разделения белков плазмы крови. Диспротеинемии. Выполнила студентка 6 курса МБФ Баёва Елена 2 В плазме крови содержится 7% всех белков организма при концентрации г/л. Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%.плазмы кровибелков Белки плазмы крови можно разделить на три группы: альбумины глобулины фибриноген Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2-4 г/л.альбуминовглобулиновфибриногена Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы 3 Физиологическая роль белков плазмы крови многогранна: 1. Белки поддерживают коллоидно-осмотическое давление и тем самым постоянный объем крови(белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла)Белки 2. Белки плазмы принимают активное участие в свёртывании крови 3. Белки плазмы определяют вязкость крови, которая играет важную роль в поддержании гемодинамических отношений в кровеносной системе. 4. Принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейших буферных систем. 5. транспортная функция — альбумин, транстиретин, транскортин, трансферрин (перенос веществ, лекарственных средств) 6. играют важную роль в процессах иммунитета (Иммуноглобулины) 7. В результате образования с белками недиализируемых комплексов поддерживается уровень катионов в крови. Например, 40– 50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки. 8. Белки плазмы могут служить резервом аминокислот 6 Методы разделения белков плазмы Используя метод высаливания нейтральными солями, обнаруживается три фракции : альбумины, глобулины и фибриноген В сыворотке крови здорового человека при электрофорезе на бумаге можно обнаружить 5 фракций: альбумины, α1-, α2-, β-, γ-глобулины. Методом электрофореза в агаровом геле в сыворотке выделяют 7– 8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле – до 16–17 фракций.альбуминыглобулиныфибриноген Еще большее число белковых фракций (свыше 30) можно получить методом иммуноэлектрофореза. Этот метод подразумевает проведение электрофореза и реакции преципитации в одной среде, т.е. непосредственно на гелевом блоке. При данном методе с помощью серологической реакции преципитации достигается значительное повышение аналитической чувстительности электрофоретического метода.электрофорезареакциипреципитацииреакциипреципитации 7 высаливание РастворимостьРастворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло- синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание).белковконцентрациисолейдистиллированной водебелкирастворимостьионовбелка При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.молекулыбелковбелкавысаливаниерастворимостисолейбелков 8 Диализ Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белкаиз-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные веществаравно мерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающемрастворе.диализмолекулыбелкаполупроницаемые мембранывеществамембранойрастворомраствораконцентрациясолейрастворе 9 Гель-фильтрация позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в). На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3)белкимолекулгеляполимерных материаловгелябелковгелембуферным раствороммолекулыгелябелкигелябелкамолекулярной массы 10 Электрофорез в ПАГ в присутствии додецилсульфата Na Метод основан на свойстве заряженных частиц перемещаться под действием электрического поля. Обычно скорость миграции зависит от величины молекул, формы молекул и суммарного заряда. Поэтому предварительнобелки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики (1).молекул белки денатурируютмолекулярной массынатриядетергентбелкибелкаденатурациитиолы ЭлектрофорезЭлектрофорез проводят в тонком слое полиакриламида (2). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотнибелков (а); выделенного из экстракта гомогенного белка (б); контрольной смеси белков с известными молекулярными массами (в).полиакриламидаэлектрофорезабелковкрасителябелковбелкабелковмолекулярными массами 12 Диспротеинемии Нарушения протеинограммы плазмы известны как диспротеинемии. К диспротеинемиям относятся увеличение концентрации белков плазмы (гиперпротеинемией), уменьшение этих концентраций (гипопротеинемии) и появление в плазме необычных белков, в норме не присутствующих там (парапротеинемии). Если изменения относятся только к глобулиновым фракциям, говорят о дисглобулинемиях. 13 Гиперпротеинемия Увеличение общего белка в сыворотке крови может быть относительным и абсолютным. Относительная гиперпротеинемия связана с уменьшением содержания воды в сосудистом русле, к чему могут приводить следующие состояния: тяжелые ожоги; генерализованный перитонит; непроходимость кишечника; неукротимая рвота; профузный понос; несахарный диабет; хронический нефрит; усиленное потоотделение; диабетический кетоацидоз. 14 Гиперпротеинемия Абсолютная гиперпротеинемия встречается редко. При этом увеличение общего белка в сыворотке крови может быть связано с синтезом патологических белков (парапротеинов), повышением синтеза иммуноглобулинов или усиленном синтезе белков острой фазы воспаления. Абсолютная гиперпротеинемия наблюдается при следующих заболеваниях: парапротеинемических гемобластозах (миеломная болезнь, болезнь Вальденстрема, болезнь тяжелых цепей) отмечается значительное до г/л — возрастание концентрации общего белка; болезни Ходжкина; хроническом полиартрите; активном хроническом гепатите; острых и хронических инфекциях; аутоиммунных заболеваниях; саркоидозе; циррозе печени без выраженной печеночно-клеточной недостаточности 15 Гипопротеинемия Снижение концентрации общего белка в сыворотке крови также может быть относительным и абсолютным. Относительная гипопротеинемия, как правило, связана с увеличением объема воды в кровеносном русле и наблюдается при следующих состояниях: водной нагрузке («водном отравлении»); прекращении отделения мочи (анурии); уменьшении диуреза (олигурии); внутривенном введении больших количеств раствора глюкозы больным с нарушенной выделительной функцией почек; сердечной декомпенсации; повышенной секреции в кровь антидиуретического гормона гипоталамуса — гормона, способствующего задержке воды в организме. 16 Гипопротеинемия Абсолютная гипопротеинемия, как правило, связана с гипоальбуминемией. При этом уменьшение концентрации общего белка в сыворотке крови возникает при: недостаточном поступлении белка в организм (голодание, недоедание, сужение пищевода, нарушение функции желудочно-кишечного тракта, например, воспалительного характера энтериты, энтероколиты и др.); подавлении биосинтеза белка, сопровождающем хронические воспалительные процессы в печени (гепатиты, циррозы печени, интоксикации, атрофия печени); врожденных нарушениях синтеза отдельных белков крови (анальбуминемия, болезнь Вильсона-Коновалова, другие дефектопротеинемии значительно более редко); повышенном распаде белка в организме (злокачественные новообразования, обширные ожоги, гиперфункция щитовидной железы (тиреотоксикоз), состояния после операции, длительная лихорадка, травмы, длительное лечение кортикостероидами); повышенной потере белка (нефротический синдром, гломерулонефрит, сахарный диабет, длительный (хронический) понос, кровотечения); перемещении белка в «третьи» пространства (асцит, плеврит). 17 Другие причины изменения концентрации белков плазмы крови Уменьшение концентрации общего белка в сыворотке крови отмечается и при некоторых физиологических состояниях, например, при длительной физической нагрузке, у женщин в последние месяцы беременности и в период лактации. На уровень общего белка в сыворотке крови может оказывать влияние прием некоторых лекарственных препаратов. Так, например, кортикотропин, кортикостероиды, мисклерон, бромсульфалеин и клофибрат способствуют повышению концентрации общего белка в сыворотке, а пиразинамид, эстрогены его снижению. На степень концентрации общего белка может оказывать влияние и положение тела: при изменении горизонтального положения тела на вертикальное концентрация общего белка повышается приблизительно на 10% в течение 30 минут. Пережатие сосудов во время взятия крови и «работа рукой» также могут привести к возрастанию концентрации общего белка в сыворотке крови. источник |
 | 7329 —
| 7329 —  или читать все.
или читать все. 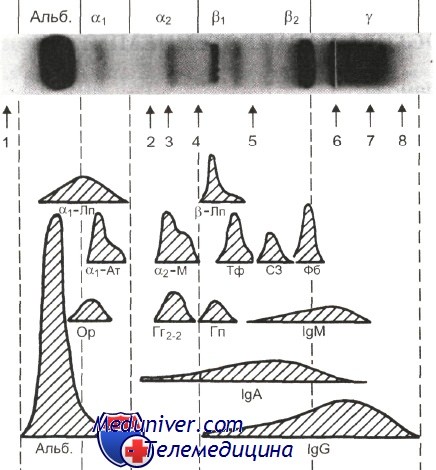 Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.
Электрофоретическое разделение плазмы здорового взрослого в геле агарозы.