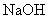Электрофорез в агарозном геле проводят в горизонтальном направлении, так как при этом 1) гель с низкой концентрацией агарозы лучше держится, 2) получается меньшее перекашивание (коллапс) в процессе электрофореза и 3) меньше искажаются полосы ДНК. По-видимому, проще всего работать с системой, когда гель полностью покрыт слоем буфера для электрофореза толщиной около 1 мм. Сопротивление агарозы ненамного превышает сопротивление буфера, так что значительная часть тока течет через агарозу.
Во все буферы с нейтральными значениями рН можно добавлять 0,5 мкг/мл бромистого этидия.
В процессе электрофореза буфер у анода защелачивается, а у катода закисляется. Поэтому обычно пользуются буферной системой с высокой емкостью. Буферы не содержат ионов Cl — , так как последние не обладают буферной емкостью, и их присутствие может привести к тому, что ДНК в геле утратит биологическую активность.
- Трис-боратный буфер. Обладает высокой буферной емкостью. При его использовании, по-видимому, получаются наиболее узкие полосы. Основной раствор 10 × не зарастает, но при длительном хранении в нем образуется осадок, который растворим в щелочи. В присутствии бората агарозные гели не растворяются при высокой концентрации NaClO4 или KI.
- Трис-фосфатный буфер. Тоже обладает высокой емкостью. При его использовании получаются примерно такие же результаты, что и при использовании трис-боратного буфера. Основной раствор, однако, может зарастать. Его преимущество заключается в том, что такие гели можно растворять в концентрированном растворе NaClO4 или KI.
- Трис-ацетатный буфер. Обладает относительно низкой буферной емкостью, и при длительном электрофорезе может возникнуть необходимость в рециркуляции буфера в аппарате. Использование при электрофорезе высоких напряжений не вызывает нагрева. Исходные растворы могут зарастать. Гели в трис-ацетатном буфере можно растворять в концентрированном NaClO4 или KI. Этот буфер, по-видимому, используется наиболее широко.
- Щелочной буфер. Обладает очень низкой емкостью. Обычно при его использовании необходима рециркуляция буфера в аппарате. Наносимые образцы не должны содержать Mg 2+ , иначе ДНК выпадет в осадок. Ионы Mg 2+ необходимо удалять, добавляя избыточные количества ЭДТА.
Препараты агарозы значительно различаются по твердости, по разрешающей способности при разделении фрагментов ДНК, электрофоретической подвижности ДНК, легкости плавления, прозрачности и наличию вредных примесей. Наиболее вредной примесью являются, по-видимому, сульфонированные агарозы, подавляющие активность многих ферментов, работающих на нуклеиновых кислотах.
Обычно мы пользуемся агарозой фирмы МС/В. Агарозу растворяют в буфере для электрофореза, нагревая до кипения в микроволновой печи. Необходимо убедиться, что раствор стал гомогенным и что в нем не осталось твердых частиц агарозы. Перед тем как залить гель, раствор охлаждают до 50°С. Если заливать гель слишком горячей агарозой, то легко можно повредить аппарат для электрофореза
Лунки для образцов делают с помощью погруженной в расплавленный гель гребенки из оргстекла, полихлорвинила или тефлона. Гребенку устанавливают до заливки геля таким образом, чтобы кончики зубьев находились примерно в 0,5 мм от основания геля. Если лунки достанут дна, то образец может протечь под гель. Когда гель полностью застынет, гребенку вынимают и лунки заполняют буфером для электрофореза.
Г. Нанесение образцов и краски
Наносимые образцы содержат 5-10% глицерола или 5-10% сахарозы и 0,025% красителя, благодаря которому можно проследить за ходом электрофореза. Например, можно добавить в образец 1 /10 объема раствора, содержащего 50% глицерола и 0,25% красителя.
ДНК. Наносите около 10 нг ДНК в расчете на каждую ожидаемую полосу. Гель будет перегружен, если в полосе окажется более чем примерно 100 нг ДНК.
Бромфеноловый синий (распадается в щелочи).
Бромкрезоловый зеленый (обладает одинаковой подвижностью и в нейтральных, и в щелочных растворах). Ксиленцианол FF (распадается в щелочи; подвижность ниже, чем подвижность бромфенолового или бромкрезолового).
Образцы можно наносить, используя автоматическую пипетку и полипропиленовый наконечник или с помощью микрошприца, на который надет тонкий пластиковый шланг.
Подвижность небольших молекул ДНК может быть такой же или даже большей, чем подвижность используемого красителя. Чем ниже концентрация агарозы и (или) выше напряженность, тем больший фрагмент ДНК будет обладать такой же подвижностью, как и краситель. Краситель поглощает флуоресценцию связанного с ДНК бромистого этидия. Это приводит к тому, что в том месте геля, где находится краска, невозможно наблюдать слабые полосы ДНК. Образцы можно наносить и без краски.
источник
Электрофорез (от электро- и др.-греч. φορέω — «переношу») —метод разделения макромолекул, различающихся по размеру, молекулярной массе, пространственной конфигурацией, вторичной структурой или электрическому заряду. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
Молекулы в буферном растворе обладают электрическим зарядом, величина и знак которого зависят от pH среды. При пропускании электрического тока через раствор в нем формируется направленное электрическое поле, напряженность которого измеряется разностью потенциалов по концам емкости, в которой производится электрофорез. Под действием поля молекулы начинают движение в направлении катода или анода. Скорость движения зависит от величины заряда, размеров и трения окружающей среды. С течением времени смесь разделяется на фракции, состоящие из молекул, движущихся с одинаковой скоростью. В современных экспериментах рабочий канал приборов для электрофореза заполняют гелем, имеющим структуру сетки. В этом случае основное влияние на подвижность молекул и их степень разделения оказывают их линейные размеры. В некоторых случаях может возникнуть ситуация, при которой особо крупные молекулы не проходят через поры геля.
Бромфеноловый синий и ксиленцианол — могут заметно мешать наблюдению фрагментов под UV. Краситель Cresol red совместим с ферментативными реакциями, практически не мешает наблюдению под UV. OrangeG наиболее подвижный краситель, практически всегда находится вне «рабочей зоны». Заметен под UV. Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле.
Самое широкое применение агарозные гели имеют в исследованиях, связанные с разделением нуклиновых кислот. Последние имеют довольно значительные отрицательный заряд, величина которого слабо зависиот от pH раствора, вследствие чего разделение на фракции происходит в основном за счет различия в линейных размеров молекул. В таких экспериментах используют 0.089М Трис-боратный, 0.05 Трсфосфатный и Трис-ацетатный буфер. Стоит отметить, что при обычном электрофорезе в геле можно разделять фрагменты нуклеиновых кислот, размер которых менее 50 тыс п.н. Также часто из эксперимента нужно получить оценку размеров молекул. Для этого используются наборы молекул известной длины. Например, для регистрации продуктов амплификации ДНК применяется электрофорез в агарозном геле в присутствии бромистого эитидия, который образует с фрагментами ДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФ-излучением длиной волны 290-330 нм.
источник
Электрофоретическая горизонтальная система, заливочный столик, встроенный источник питания, E-Gel Power Snap, Thermo FS
Электрофоретическая система E-Gel Power Snap позволяет разделять и отслеживать образцы в режиме реального времени на агарозных гелях E-Gel, предварительно окрашенных SYBR Safe или SYBR Gold II.
Особенности электрофоретической системы E-Gel Power Snap:
- разделение ДНК всего за 10 минут с помощью сухих готовых агарозных гелей E-Gel;
- визуализация электрофореза в режиме реального времени;
- небольшая площадь прибора для удобного использования на столе.
Проведение электрофореза всего за 10 минут с помощью готовых агарозных гелей E-Gel. Технология E-Gel с сухим агарозным гелем обеспечивает скорость и удобство, минимизируя время приготовления геля. Агарозные гели E-Gel доступны с различным процентным содержанием геля. Система идеально подходит для клонирования. Синий свет, излучаемый трансиллюминатором, обеспечивает максимально возможную безопасность для пользователя и приводит к повышению эффективности клонирования по сравнению с бромидом этидия/ультрафиолетом.
- Время работы LED лампы, ч — 50 000;
- рабочая зона визуализации геля, см — 9 × 11;
- источник освещения LED лампы голубого цвета с длинной волны 465 нм ± 10 нм;
- сенсорный LCD экран;
- дисплей LCD, см — 7,7 х 4,4;
- габариты, Ш × Г × В, см — 24 × 13 × 7;
- вес, кг — 1.
Готовые «сухие» гели:
- E-Gel EX — агарозные гели для быстрого результата с высокой чувствительностью;
- E-Gel SYBR Safe — гели для рутинной работы;
- E-Gel Go! – агарозные гели для небольшого количества образцов;
- E-Gel CloneWell II — для разделения фрагментов при клонировании;
- E-Gel Size Select II — для отбора фрагментов при NGS;
- E-Gel NGS — для отбора фрагментов высокого разрешения;
- E-Gel и E-Gel Double Comb — гели с бромидом этидия.
Доставка осуществляется по всей России и странам СНГ. Возможен самовывоз со склада по адресу Московская область, г. Мытищи, 7-й Ленинский переулок, д.13. Доставка по Москве и Московской области осуществляется бесплатно.
Вы можете выбрать способ доставки в личном кабинете, чтобы он автоматически указывался при оформлении всех последующих заказов. При выборе варианта «Транспортная компания по выбору клиента» укажите в комментариях транспортную компанию, с которой вы предпочитаете работать.
Точная стоимость доставки рассчитывается менеджером при подтверждении заказа в зависимости от весообъемных характеристик и дальности. Товары, требующие особого температурного режима, доставляются с соблюдением требуемых условий. Если в заказе есть прекурсоры, необходимо оформить официальное письмо об отпуске прекурсоров. (образец письма об отпуске прекурсоров)
Компания Диаэм работает с юридическими и физическими лицами. После оформления заказа продавец-консультант сформирует счет и направит его вам по электронной почте и на страницу заказа в Личном кабинете на сайте. Вы также можете сами сформировать счет из Корзины, авторизовавшись на сайте. Счет оплачивается через банк. Вы можете оплатить товар в кассе Диаэм или любом отделении банка.
Для получения товара необходимо предоставление доверенности организации, а для получения товара при оплате физическим лицом необходим паспорт.
источник
Автоматизированная система электрофореза в гелях агарозы Hydrasys 2 разработана для выполнения максимально широкого спектра исследований разнообразных биологических жидкостей. Регистрация и анализ результатов осуществляется с помощью встроенного слайд-сканера со специализированным программным обеспечением Phoresis. Разнообразие выпускаемых наборов и фасовок реагентов позволяет эффективно использовать систему Hydrasys 2 в лабораториях с самыми различными диагностическими задачами и производственными потоками.
Уникальная запатентованная система нанесения образцов на гель при помощи ультратонких микропористых аппликаторов требует минимального объема анализируемого образца (10 мкл) и обеспечивает превосходное разрешение и четкость ЭФ профиля;
Встроенные программы контроля за условиями миграции (температурой — элемент Пельтье, временем, напряжением, количеством нанесенного образца), окрашивания (все растворы находятся в закрытых флаконах, предотвращающих испарение, и автоматически подаются в анализатор) и сушки гелей делают результаты анализа воспроизводимыми, а работу оператора легкой.
Индивидуально упакованные гели агарозы и прочие компоненты наборов полностью готовы к использованию, не требуют холодильного хранения и имеют высокие сроки годности;
Разнообразие фасовок реагентов позволяет подобрать нужную конфигурацию, которая будет оптимально соответствовать потребностям именно Вашей лаборатории. В зависимости от потока и/ или специфики исследований можно выбрать фасовки с нанесением 1, 2, 3, 4, 5, 6, 9, 15, 18, 30, 45, 54 образцов на гель.
Базовая комплектация системы Hydrasys 2 может быть дополнена специализированными модулями:
- модуль для изоэлектрофокусирования, позволяющий выполнять миграцию при высоком напряжении (до 2000 В) и проводить исследование СМЖ и α-1-антитрипсина с высоким разрешением.
- модуль Assist – система автоматизации процедуры подготовки проб для электрофореза в гелях агарозы при высоких объемах исследований в лаборатории.
Перечень тестов, доступных для анализа на приборах серии Hydrasys 2:
- Белковые фракции сыворотки (с разделением на 5 или 6 фракций)
- Белковые фракции высокого разрешения;
- Белковые фракции мочи;
- Белковые фракции СМЖ;
- Иммунофиксация сыворотки и мочи;
- Иммунофиксация Penta
- Определение белка Бенс-Джонса
- Изоферменты (Фракции ЩФ, ЛДГ, КФК)
- Фракции Липопротеинов
- Фракции гемоглобина
- Фракции бета2-трансферрина
- Фракции альфа1-антитрипсина
- и др
Электрофорез в гелях агарозы
Материал для исследования
Сыворотка крови, моча (в т.ч. без концентрирования), цельная кровь, СМЖ (в т.ч. без концентрирования), назальные, ушные секреты, слезная жидкость
До 162 тестов в час – белковые фракции;
До 18 тестов в час – иммунофиксация.
До 54 образцов на 1 гель — белковые фракции;
До 15 образцов на 1 гель — белковые фракции с высоким разрешением, фракции гемоглобина;
До 9 образцов на 1 гель – иммунофиксация, белок Бенс-Джонса.
Одноразовые пластиковые аппликаторы;
Автоматическое нанесение проб на гель в процессе работы.
Автоматический контроль напряжения, силы тока, мощности;
Термостатирование посредством элементов Пельтье;
Автоматическая остановка миграции – по времени или вольт-часам;
Возможность хранения до 50 программ миграции.
Окрашивание и обработка геля
Закрытое отделение для окрашивания с тремя датчиками уровня жидкости;
Возможность использования до 8 реагентов в ходе одной процедуры (без переключения каналов);
Возможность хранения до 40 программ окрашивания.
Ведение базы данных, содержащей неограниченное количество результатов;
Вывод на экран миграционных кривых в реальном времени;
Выделение нераспознанных кривых (цветом);
Отображение и просмотр кривой с широкими возможностями редактирования;
Отображение состояния системы;
Статистический анализ, поиск данных;
Автоматическая детекция качественных и количественных аномалий;
Наложение кривых (пациент/ контроль, пациент/пациент);
Формирование и печать протоколов и отчетов (неограниченные возможности).
Встроенная программа самотестирования и контроля;
источник
Электрофорез в агарозном геле является методом гель — электрофореза , используемого в биохимии , молекулярной биологии , генетики и клинической химии , чтобы отделить смешанную популяцию макромолекул , таких как ДНК или белков в матрице из агарозы , один из двух основных компонентов агара . Белки могут быть разделены с помощью заряда и / или размером ( изоэлектрофокусирование электрофореза в агарозном, по существу , не зависит размер), а также ДНК и РНК — фрагменты длиной. Биомолекулы разделены путем применения электрического поля для перемещения заряженных молекул через матрицу агарозы, и биомолекулы отделены друг от друга размером в матрице агарозном геле.
Гель агарозов легко отливать, имеет относительно меньшее количество заряженных групп, и особенно подходит для разделения ДНК диапазона размеров наиболее часто встречающегося в лабораториях, на долю которого приходится популярности ее использование. Разделены ДНК может быть просмотрен с красителем, чаще всего под действием УФ-света, и фрагменты ДНК могут быть извлечены из геля с относительной легкостью. Большинство гели агарозы используются между 0.7-2%, растворенного в подходящем буфере для электрофореза.
Агарозном гель является трехмерный матрицей , составленной из спиральных молекул в агарозных суперспиральных пучках , которые объединяются в трехмерный структуры с каналами и порами , через которые могут проходить биомолекулы. Структура 3-D проводится совместно с водородными связями и , следовательно , может быть разрушена путем нагрева обратно в жидкое состояние. Температура плавления отличается от температуры желатинизации, в зависимости от источников, агарозный гель имеет температуру гелеобразования 35-42 ° C и температуру плавления 85-95 ° С. Низкое плавление и низкие желирующие агарозы , сделанные с помощью химических модификаций, также доступны.
Агарозном гель имеет большой размер пор и хорошую прочность геля, что делает его пригодным в качестве антиконвекции среды для электрофореза ДНК и крупных белковых молекул. Размер пор 1% геле была оценена от 100 нм до 200-500 нм, а его прочность геля позволяет гели в виде разбавленных в 0,15% с образованием сляба для гель — электрофореза. Низкая концентрация-гели (0,1-0,2%) , однако являются хрупкими и , следовательно , трудно управлять. Гель агарозы имеет более низкую разрешающую способность , чем полиакриламидный гель для ДНК , но имеет больший диапазон разделения, и поэтому используется для фрагментов ДНК обычно 50-20,000 п.н. в размере. Предел разрешения для стандартного электрофореза в агарозном геле составляет около 750 кб, но разрешение более 6 Мб возможны с электрофорезом геля импульсным поля (PFGE). Он также может быть использован для разделения больших белков, и это является предпочтительным матрица для гель — электрофореза частиц с эффективным радиусом больше 5-10 нм. 0,9% агарозный гель имеет поры достаточно большой для ввода бактериофага Т4 .
Агарозном полимер содержит заряженные группы, в частности пирувата и сульфата . Эти отрицательно заряженные группы создают поток воды в направлении, противоположном направлению движения ДНК в процессе , называемом electroendosmosis (РВЗ), и , следовательно , может замедлить движение ДНК и вызывает размывание полос. Более высокие концентрации гели будут иметь более высокий электроосмотический поток. Низкая РВЗ агарозу поэтому обычно предпочтительным для использования в агарозном гель — электрофореза нуклеиновых кислот , но высокая РВЗ агарозы может быть использована для других целей. Ниже , содержание сульфатов низкой РВЗ агарозы, в частности , низкой температурой плавления (LMP) агарозы, также полезно в тех случаях , когда ДНК экстрагировали из геля , которые будут использоваться для дальнейших манипуляций в присутствии загрязняющих сульфаты может влиять на некоторые последующие процедуры, такие , в качестве лигирования и ПЦР . Нулевые РВЗЫ агарозы однако являются нежелательными для некоторых применений , так как они могут быть сделаны путем добавления положительно заряженных групп и такие группы могут повлиять на последующие реакции фермента. Electroendosmosis является причиной агарозном используется в предпочтении к агар как агаропектин компонент в агар содержит значительное количество отрицательно заряженных сульфатов и карбоксильных групп. Удаление агаропектина в агарозе существенно снижает РВЗ, а также уменьшения неспецифической адсорбции биомолекул на гелевой матрице. Тем не менее, для некоторых приложений , таких как электрофорез белков сыворотки, высокая РВЗ может быть желательной, и агаропектин может быть добавлен в геле используется.
Ряд факторов может повлиять на миграции нуклеиновых кислот: размерность поры геля (концентрация геля), размер ДНК будучи электрофорез, напряжение используется, ионная сила буфера, а концентрация интеркалирования красителя, такие как бромид этидий если используется во время электрофореза.
Более мелкие молекулы движутся быстрее , чем более крупные молекулы в геле, и движется двухцепочечной ДНК со скоростью, обратно пропорциональна логарифму числа пар оснований. Это соотношение , однако ломается при очень больших фрагментах ДНК, и разделение очень больших фрагментов ДНК требует использования электрофореза импульсного геля — поля (PFGE), который применяет переменный ток с двух разных направлений и большие ДНК — фрагменты разделены , как они переориентироваться с изменение тока.
Для стандартного электрофореза в агарозном геле, более крупные молекулы разрешаются лучше, используя низкую концентрацию геля в то время как меньшие молекулы отделить лучше при высокой концентрации геля. Высокие концентрации геля, однако, требует больше времени запуска (иногда дней).
Движение ДНК может влиять на конформации молекулы ДНК, например, суперспирализовано ДНК , как правило , двигается быстрее , чем расслабленный ДНК , поскольку она плотно спиральная и , следовательно , более компактным. В нормальной подготовке плазмидной ДНК, множественные формы ДНК могут присутствовать. Гель — электрофорез плазмид обычно показывает отрицательно суперспиральную форму как основная полоса, в то время как зазубрины ДНК (открытая круговая форма) и расслаблена закрыт круглая форма появляются как незначительные полосы. Скорость , с которой различными формами перемещения , однако , может изменяться с использованием различных условий электрофореза, а подвижность большой кольцевой ДНК могут быть более сильно , чем влияние линейной ДНК размера пор гель.
Этидий бромид, который интеркалирует в кольцевую ДНК может изменить заряд, длину, а также superhelicity молекулы ДНК, поэтому его присутствие в геле при электрофорезе может повлиять на его движение. Например, положительный заряд бромистого этидия может уменьшить движение ДНК на 15%. Электрофорез в агарозном геле может быть использован для решения круговой ДНК с различной топологией суперспирализации.
Повреждение ДНК из — за увеличенное поперечное сшивание также приведет к уменьшению электрофоретической миграции ДНК в зависимости от дозы.
Скорость миграции ДНК пропорциональна приложенного напряжения, т.е. чем выше напряжение, тем быстрее движется ДНК. Разрешение больших фрагментов ДНК, однако ниже, при высоком напряжении. Подвижность ДНК может также изменяться в нестационарном поле — в поле, которое периодически обращено, подвижность ДНК определенного размера может значительно снижаться при определенной частоте езды на велосипеде. Это явление может привести к инверсии зоны в поле электрофореза гель инверсии (ФИГЕ), в результате чего более крупные фрагменты ДНК движутся быстрее, чем более мелкие.
- «смайлик» гели — это краевой эффект возникает, когда напряжение, приложенное слишком высоко для концентрации геля, используемой.
- Перегрузки ДНК — перегружать ДНК замедляет миграцию фрагментов ДНК.
- Загрязнение — наличие примесей, такие как соль или белки может влиять на движение ДНК.
Отрицательный заряд его остова ДНК перемещает в сторону положительно заряженного анода при электрофорезе. Тем не менее, миграция молекул ДНК в растворе, в отсутствии гелевой матрицы, не зависит от молекулярной массы при электрофорезе. Гелевая матрица, следовательно , отвечает за разделение ДНК по размерам в процессе электрофореза, а также ряд моделей существует , чтобы объяснить механизм разделения биомолекул в гелевой матрице. Широко принято одна модель Ogston , которая рассматривает матрицу полимера в виде сита. Шаровые белки или случайная катушка ДНК перемещается через взаимосвязанные поры, и движение больших молекул, более вероятно, будет затруднено и замедлены столкновениями с гелевой матрицей, и , следовательно , молекулы различных размеров могут быть отделенны в этом процессе просеивания ,
Модель Ogston однако ломается при больших молекул в результате чего поры значительно меньше , чем размер молекулы. Для молекул ДНК размера более 1 кб, А рептации модель (или его варианта) наиболее часто используется. Эта модель предполагает , что ДНК может сканировать в моде «змеиной» (отсюда «рептации») через пору в виде удлиненной молекулы. Необъективное модель рептаций применяется при более высокой напряженности электрического поля, в результате чего передний конец молекулы становится сильно предвзятым в прямом направлении и тянет остальную часть молекулы вместе. В режиме реального времени флуоресцентной микроскопии окрашенных молекул, однако, показали более тонкие динамики во время электрофореза с ДНК показывает значительную эластичность , как она попеременно растяжения в направлении приложенного поля , а затем договаривающуюся в шарик, или становится замкнув в U-образную форму когда он попадает на полимерных волокон.
Детали электрофорезом на агарозном геле эксперимента могут варьироваться в зависимости от методов, но большинство следовать общей процедуре.
источник
Установка для электрофореза в агарозном геле.На рисунке 7 представлены основные элементы для проведения горизонтального электрофореза в агарозном геле. Схематично, установку можно представить как емкость для электродного буфера, по краям которой расположены два электрода. В пространство между электродами заливается проводящий буфер, в котором проводится электрофорез, и помещают гель. При этом гель может быть залит непосредственно в камере, а может быть залит отдельно на специальном лотке, который помещается в камеру.
Агароза. Природный коллоид, который выделяют из морских водорослей, является линейным полисахаридом, образованным повторяющимся элементом ‒ агаробиозой, которая в свою очередь состоит из чередующихся элементов: галактозы и 3,6-ангидрогалактозы. Агароза очень хрупка, и легко разрушается при манипулировании. Агарозные гели имеют «поры» большого размера и используются преимущественно для разделения больших молекул.
Агарозные гели получают суспендированием сухого порошка агарозы в водном буфере, и кипячением смеси до того момента, когда агароза расплавится и образует прозрачный раствор. Затем раствор наливают на подложку и дают остыть до комнатной температуры, чтобы сформировался прочный гель. При застывании агароза формирует матрикс, плотность которого определяется концентрацией.
Буфер для электрофореза. На электрофоретическую подвижность ДНК воздействуют состав и ионная сила буфера для электрофореза. В отсутствии ионов, электропроводность минимальна, и перемещение ДНК происходит медленно. В буфере с высокой ионной силой электропроводность очень эффективна, и образуется значительное количество тепла. В худшем случае, гель расплавляется и ДНК денатурирует. Существует несколько буферов для электрофореза нативной двухцепочечной ДНК. Они содержат ЕОТА (рН 8,0) и Тгis-ацетат (ТАЕ), Тгis-борат (ТВЕ), или Тгis-фосфат (ТРЕ).
Маркерная ДНК. При заданном напряжении, концентрации агарозного геля и буфера, расстояние перемещения зависит от молекулярного веса исходного материала. Поэтому, маркерная ДНК известного размера должна наноситься на дорожки и с левого, и с правого края геля. Маркер обычно содержит определенный набор известных сегментов ДНК, которые облегчают определение размера исследуемой ДНК, если какое-либо систематическое искривление геля возникнет во время электрофореза.
Буфер для нанесения. Образцы ДНК, которые будут наноситься на агарозный гель, сначала смешивают с буфером для нанесения, обычно содержащим воду, сахарозу и краситель (например ксиленцианол, бромфеноловый синий, бромкрезол зеленый и другие).
Окраска и фиксация
Для анализа результатов электрофореза, после его завершения, требуется, прежде всего, визуализовать картину распределения полос в геле. С этой целью могут применяться два основных подхода. Первый способ состоит в окрашивании ДНК специфическими красителями. Для этой цели существует большое разнообразие красителей, способных специфически окрашивать двунитевые или однонитевые участки ДНК, ДНК в составе различных комплексов или в определённой конформации. К достоинствам такого подхода можно отнести высокую чувствительность, избирательность окрашивания и дешевизну метода. Среди недостатков можно упомянуть относительную трудоёмкость процедуры, невозможность следить за ходом электрофореза в реальном времени, токсичность некоторых из широко применяемых красителей, воздействие красителей на структуру ДНК, и необходимую иногда предварительную фиксацию ДНК в геле.
Другой путь основан на способности самой ДНК поглощать свет в УФ диапазоне. Поэтому можно просканировать гель в УФ-свете и определить местоположение ДНК в геле. В настоящее время промышленностью выпускаются специальные комплексы, позволяющие следить за миграцией ДНК в геле в автоматическом режиме непосредственно в ходе электрофореза и получать оцифрованное изображение в любой момент времени. При использовании этого подхода предварительная фиксация ДНК в геле не требуется. К недостаткам подхода можно отнести малую избирательность метода и относительную дороговизну оборудования.
Наиболее распространенным красителем ДНК в экспериментах по электрофорезу является бромистый этидий. Этот краситель относится к соединениям, способным интеркалировать между парами оснований ДНК. Вещество является сильным канцерогеном и мутагеном, способным проникать через кожу. По этой причине работа с ним требует особой осторожности и соблюдения повышенных мер безопасности. При работе с бромистым этидием всегда необходимо использовать перчатки и маску. Отходы, содержащие бромистый этидий, требуют специальной утилизации.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Для приготовления 1%-го геля ‒ смешайте 100 мл воды и 1 г агарозы и доведите раствор до кипения. Размешайте до ресуспендирования осевшей агарозы. В пластиковую кювету для геля установите гребенку под будущие лунки. Влейте агарозу в кювету. Агароза должна заполнить куветю полностью. Когда гель затвердеет, осторожно удалите гребенку.
2. Готовим камеру ‒ кладем пластиковую кювету с гелем в камеру, заливаем буфером так, чтобы гель скрылся под ним.
3. Вносим 5–10 мкл образца в лунки и закрываем верхней крышкой.
4. К черному штекеру присоединяем отрицательный полюс, а к красному положительный.
5. Включаем форез ‒ 120 В 20–30 мин. Возле электродов должны быть небольшие пузырьки, как индикатор, что форез пошел. ДНК двигается от минуса к плюсу, поэтому лунки с ДНК должны быть возле черного штекера (минуса).
6. Через 20–30 мин, выключаем прибор, открываем крышку и вытаскиваем кувету с гелем шипцапи или используем перчатки. В случае наличия в образце красителя, разделение можно будет увидеть невооруженным глазом, а при его отсутствии просматривают гель в УФ-свете на трансиллюминаторе и фотографируют.
Сделать вывод о проделанной работе. Зарисовать электрофореграмму.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте понятие электрофорезу.
2. Дайте понятие электрофорезу в агарозном геле.
3. Физические принципы электрофореза в агарозном геле.
4. Перечислите параметры, от которых зависит движение заряженных частиц в агарозном геле.
5. Перечислите компоненты, необходимые для электрофореза в агарозном геле.
6. Основные элементы установки для электрофореза в агарозном геле.
7. Объясните методы анализа результатов электрофореза, их достоинства и недостатки.
8. К какому полюсу происходит движение молекул ДНК при электрофорезе в агарозном геле и почему?
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
источник
Приготовление агарозного геля
Для приготовления 2%-й агарозы необходимо к 1 г агарозы добавить 50 мл 1 
Полученный раствор поместить в микроволновую печь (на 2-5 мин в зависимости от мощности печи — следить за интенсивностью кипения суспензии!) или прокипятить на водяной бане 15 мин до полного растворения агарозы.
Расплавленную агарозу охладить до 56 °С и добавить 5 мкл бромистого этидия (концентрация 10 мг/мл), тщательно перемешать.
Расплавленную агарозу с бромистым этидием разлить в подготовленную форму. Толщина геля 0,5-0,7 см.
Через 30-40 мин удалить гребенку. Готовый гель можно использовать сразу, можно хранить в 1 
Смешать в отдельной пробирке 2 мкл буфера для нанесения и 10 мкл реакционной смеси. Внести смесь в лунки геля. (Можно использовать соотношение буфер: реакционная смесь — 2:8). В одну из лунок (чаще в крайнюю) внести маркер молекулярной массы (можно 1000 b.р.).
Поместить заполненный гель в камеру для электрофореза, заполненную буфером 1 
В режиме постоянного напряжения 100 V электрофорез длится примерно 70-90 мин.
Гель (без формы) поместить на фильтр трансиллюминатора и посмотреть в проходящем ультрафиолетовом свете.
Документировать результат электрофореза — либо на фотопленку «Микрат Изопан» (изопанхроматическая фотопленка чувствительностью 3 ед. ГОСТ, фотографическая широта 10, разрешение — 300 линий/мм), либо при помощи гельдокументирующей системы на основе цифрового фотоаппарата или видеокамеры. Фотокопия геля должна быть приложена к отчету по идентификации (при цифровой съемке — распечатывается на принтере с разрешением не менее 300 dpi).
При оценке результата ПЦР ожидаемый размер продукта (относительно маркера) для В. hominis — 621 пара оснований (в.р.), для С. parvum — 451 в.р., для D. repens — 480 в.р., для D. immitis — 520 в.р.
Полимеразная цепная реакция и рестрикция (ПЦР) на идентификацию возбудителей лейшманиозов
Аппаратура, материалы, лабораторная посуда, реактивы для ПЦР-исследования и рестрикции
Необходимое оборудование и инструментарий для ПЦР и рестрикции
Амплификатор типа «Терцик МС-2» со скоростью нагрева/охлаждения активного элемента не менее 1,5 °С/с
Прибор для горизонтального электрофореза типа «Slab Cell GT System» с комплектом кювет и гребенок
Источник напряжения типа «Power Рас 300» с диапазоном регулируемого напряжения 50-300 В
Видеосистема типа «Gel Doc 2000 
Холодильники бытовые или холодильные шкафы с морозильной камерой, обеспечивающей температуру -20 °С
Микроцентрифуга настольная типа Эппендорф (частота вращения не менее 13000 об./мин)
Термостат типа «TERMO 24-15» под пробирки типа Эппендорф вместимостью 0,5 и 1,5 мл, диапазон температур от 15 до 120 °С, количество гнезд — не менее 20 каждого типа, точность поддержания температуры — 0,2 °С, разность температур между соседними ячейками — не более 0,5 °С
Аппарат для встряхивания типа «Вортекс», скорость вращения 250-3000 об./мин
Печь микроволновая (мощностью не менее 400 W)
Весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г
Анализатор потенциометрический, погрешность измерений рН=0,01
Стерилизатор паровой медицинский
Дистиллятор, обеспечивающий качество дистиллированной воды по ГОСТ 6709-72
Облучатель бактерицидный настенный ОБН-150 или других видов
Пипетки автоматические с переменным объемом дозирования:





Настольный кулер для пробирок
Лабораторная посуда и расходные материалы для ПЦР и рестрикции
Бумага фильтровальная лабораторная
Посуда химическая стеклянная: воронки, колбы мерные плоскодонные конические (25, 50, 100, 200, 1000 мл), цилиндры мерные (25, 100, 1000 мл), пестики
Пробирки микроцентрифужные типа Эппендорф (0,2; 0,5; 1,5 мл)
Наконечники полистироловые с фильтром для автоматических пипеток с переменным объемом дозирования до 10, 20, 200, 1000 мм
Химические реактивы (х.ч.): кислота соляная, кислота борная, гидроокись натрия, хлористый натрий, этилендиаминтетрауксусная кислота (ЭДТА)
Трис (оксиметил) аминометан
Этидий бромистый, спирт этиловый, спирт изопропиловый, вода дистиллированная, вода деионизированная, бидистиллированная вода, фенол-хлороформ-изоамиловый спирт (25:24:1, v/v), хлороформ-изоамиловый спирт (24:1, v/v), протеиназа К, Тритон Х-100, ацетат натрия, уксусная кислота, диметилсульфоксид (ДМСО)
Термостабильный фермент Taq-полимераза, оптимум работы в области 70-72 °С
Буфер для ПЦР с
Агароза для электрофореза (тип II)
Маркеры молекулярной массы ДНК (10-100 п.н. и 50-1000 п.н.)
Олигонуклеотиды (праймеры), заказывают в коммерческих лабораториях, специализирующихся на их синтезе
Рестриктаза Нае III с буфером
Минеральное масло для ПЦР
Раствор для внесения образцов в гель
Мембраны Millipore, размер пор 0,22 мкм
Примечание. Допускается использование реактивов других фирм с аналогичными характеристиками. Препараты импортного производства должны иметь международный сертификат качества ИСО 9 000 или EN 29 000.
Отбор, хранение и транспортирование клинического материала для ПЦР-исследования
1) Для диагностики висцерального лейшманиоза у людей и животных желательно использовать пунктат костного мозга, из которого на обезжиренном предметном стекле необходимо приготовить мазок. Также можно пунктировать лимфатический узел и селезенку. Возможно использование биоптатов других тканей (например, печень собак), которые следует поместить в стерильные пробирки.
2) При диагностике кожных лейшманиозов (ЗКЛ и АКЛ) необходимо приготовить мазки на обезжиренных предметных стеклах из содержимого кожных поражений: папул или язв у людей, ушных раковин у грызунов. У человека материал следует брать из периферии инфильтрата, избегая сильного травмирования язвы, что может привести к нежелательному попаданию в образец большого количества крови.
3) При широких эпидемиологических и эпизоотологических исследованиях допустимо использовать венозную кровь или кровь из пальца, которую можно собрать на предметное стекло (0,1 мл), стерильную фильтровальную бумагу (0,1 мл) или в стерильные пробирки (1-10 мл). В случае сбора крови в пробирки — использовать пробирки с цитратом натрия или ЭДТА. Недопустимо использовать пробирки с гепариновым антикоагулянтом! (гепарин ингибирует ПЦР).
4) Для исследования москитов на зараженность лейшманиями поместить их после сбора механическими ловушками или на липкие листы бумаги в чистые пробирки с 96%-м этиловым спиртом.
5) Стекла с мазками, пробирки с биоптатами, фильтровальную бумагу с кровью необходимо поместить в индивидуальный конверт, снабдить датой, а также сведениями о больном и иной необходимой информацией.
6) Образцы можно хранить при комнатной температуре (следует избегать прямых солнечных лучей) несколько суток. При необходимости более длительного хранения (2-3 недели) пробы необходимо поместить в холодильник с температурой 2-8 °С, в морозильной камере с температурой -20 °С пробы могут сохраняться до одного года.
Перевозка биологических образцов должна осуществляться в термосах или термоконтейнерах с соблюдением правил хранения образцов и правил транспортирования инфекционных материалов.
Приготовление необходимых растворов
1) Приготовление 1М ТРИС — 
В мерной колбе на 100 мл растворить 12,11 г Трис (оксиметил) аминометана (молекулярный вес 121) в 80 мл дистиллированной воды, довести рН до 7,5 концентрированной соляной кислотой, затем довести объем раствора до метки деионизованной водой, перемешать, хранить при комнатной температуре не более года.
Использовать для приготовления буфера Трис-ЭДТА и солевого буфера для фенол-хлороформного выделения.
2) Приготовление 30%-го раствора
Растворить 3 г натрия гидроокиси (молекулярный вес 40) в 7 мл дистиллированной воды. Раствор хранить при комнатной температуре в герметичном сосуде, блокирующем взаимодействие с 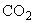
Использовать в приготовлении 0,5 М ЭДТА (рН 8,0).
3) Приготовление 0,5 М ЭДТА (рН 8,0)
В мерной колбе на 100 мл растворить 18,62 г этилендиаминтетрауксусной кислоты (молекулярный вес 372,2) в 80 мл дистиллированной воды. Довести: 30%-м раствором натрия гидроокиси рН раствора до 8,0; дистиллированной водой — объем раствора до метки, перемешать. Хранить при комнатной температуре до 1 года.
Приготовленный раствор фильтровать через мембраны Мilliроге 0,22 мкм.
Использовать в приготовлении буфера Трис-ЭДТА, 1 
4) Приготовление 70%-го раствора этилового спирта
Смешать 70 мл 96%-го этилового спирта с 26 мл деионизированной воды. Срок хранения при температуре от 4 до 5 °С — не более 2 месяцев.
Раствор использовать для преципитации ДНК.
5) Приготовление 1 
В мерной колбе на 1000 мл растворить 10,8 мг Трис (оксиметил) аминометана, 5,5 г борной кислоты и 0,92 г этилендиаминтетрауксусной кислоты, довести дистиллированной водой до метки, перемешать до полного растворения. Полученный 10 


Используют 0,5 
6) Приготовление 1 
В мерную колбу вместимостью 1000 мл внести 242 г Трис-основания, 57,1 мл ледяной уксусной кислоты, 10 мл 0,5 М ЭДТА, долить деионизованной водой до метки. Полученный 50 
Использовать 1 
Примечание. При проведении электрофореза использовать один из перечисленных буферов.
7) Приготовление раствора бромистого этидия — 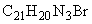
Растворить 1 г бромистого этидия в 100 мл дистиллированной воды. Срок хранения в посуде темного стекла (обязательно при температуре от 4 до 5 °С) не более 12 месяцев.
Раствор необходим для приготовления агарозного геля.
Внимание! Проявлять особую осторожность! Сильный канцероген! Работать только в резиновых перчатках! Избегать попадания на кожу и слизистые!
При попадании тщательно промыть соответствующий участок водой!
8) Приготовление солевого буфера
Растворить 1,46 г натрия хлористого в 10 мл ЭДТА (0,5 М, рН 8,0), добавить 25 мл трис- 
Солевой буфер использовать для выделения ДНК фенол-хлороформным методом.
9) Приготовление 3 М ацетата натрия (рН 5,2)
Растворить 40,83 г ацетата натрия (с массовой долей 136,1) в 50-60 мл дистиллированной воды. Концентрированной уксусной кислотой довести рН до 5,2. Довести объем до 100 мл дистиллированной водой. Стерилизовать автоклавированием. Хранить при комнатной температуре не более 6 месяцев.
Использовать для выделения ДНК фенол-хлороформным методом.
10) Приготовление буфера Трис-ЭДТА (рН 8,0)
Смешать 2 мл 1 М Трис- 

Буфер Трис-ЭДТА использовать для выделения ДНК фенол-хлороформным методом.
Дата добавления: 2019-02-12 ; просмотров: 91 ; ЗАКАЗАТЬ РАБОТУ
источник
Особенности работы с низкопроцентными (0.3%) гелями.
в плашку для электрофореза залить «подложку» — слой агарозы 1.5-2.0% толщиной
2-3 mm, дать застыть;
ВНИМАНИЕ! Работать в холодной комнате. Гель очень хрупкий, все манипуляции проводить только вместе с 2% подложкой; не лить буфер на поверхность геля. Низкопроцентные гели особенно чувствительны к перегрузке по количеству DNA на дорожку.
Разделение линейных молекул
Диапазон нормального разделения линейных dsDNA молекул для гелей с различной концентрацией агарозы:
|
Меньший предел определяется (в основном) диффузией полосы в геле. Т.е. в гелях с низкой концентрацией агарозы мелкие фрагменты вполне разделяются, но полосы не четкие.
Верхний предел сильно зависит от напряженности поля, при которой проводится форез. Чем меньше напряженность поля, тем более длинные молекулы можно эффективно разделить.
Разделение суперскрученных и кольцевых молекул
К сожалению относительная подвижность линейных и кольцевых молекул зависит от условий фореза: % геля, скорость фореза (в частности, это означает, что нельзя пользоваться линейным маркером для оценки размера кольцевых молекул).
Приведенная таблица дает некоторое представление о соотношении подвижностей при умеренной (
6V/cm) скорости фореза (в скобках — при более быстром разгоне):
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В присутствии 0.5 µg/ml EtBr разрешение релаксированной и суперскрученной pDNA увеличивается примерно в 20 раз при повышении ионной силы буфера до 4хТАЕ. Того же увеличения можно добиться понижая концентрацию EtBr.
На 1% агарозном форезе ssDNA бежит чуть быстрее (
10%), чем dsDNA того же размера. ssDNA окрашивается EtBr заметно слабее, чем ds (разница в
4-5 раз). Tо есть, чтобы полосы имели одинаковую интенсивность окраски, требуется взять
Чтобы разделить цепи, нужно либо непосредственно перед форезом прогреть
1′ 100 o C, либо добавить к образцу NaOH до 0.1 М, 5-10′ (NT или 37 o C);
При оценке напряженности поля для горизонтального фореза принято пренебрегать конкретной геометрией камеры и измерять расстояние непосредственно между электродами.
На рисунке показана схема форезов, при разном напряжении. Форезы проводились разное время, так, чтобы 0.5kb фрагмент прошел одинаковое расстояние. Видно, что проведение фореза при высоком напряжении эквивалентно уменьшению длины геля.
Разумный компромисс между скоростью и качеством фореза для высококачественных или препаративных форезов:
2V/cm(можно меньше для ON форезов). Для аналитических форезов приемлемое качество сохраняется до
DNA особенно легко теряет EtBr при повышенной температуре (что обычно случается, если гонять форезы при высоком напряжении).
EtBr при форезе движется от (+) к (-). Если хочется, чтобы он не уходил из геля, лучше ввести его и в форезный буфер.
Количество DNA, которое можно наносить на дорожку
Нижний предел определяется используемым методом детекции. Если применяется окрашивание EtBr, то не стоит надеяться увидеть 2 O; рабочая концентрация в 1х буфере
0.005-0.02%) могут заметно мешать наблюдению фрагментов под UV. По нашему опыту, элюция фрагмента в РEG вместе с любым из этих красителей не оказывает заметного влияния на меченье, лигирование и трансформацию.
Cresol red (Na соль) — (стоковый раствор 50mM в H 2 O; рабочая концентрация в 1х буфере
0.1mM) совместим с ферментативными реакциями, практически не мешает наблюдению под UV.
OrangeG — (стоковый раствор 1% в формамиде; рабочая концентрация в 1х буфере
0.01-0.05%) наиболее подвижный краситель, практически всегда находится вне «рабочей зоны». Заметен под UV.
Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле. Обычно приводимые в методиках
0.025% для бромфенолового синего и ксиленцианола (в 1х буфере) по нашему мнению слишком большое количество.
* буфера с различными красителями.
* различные разведения буфера для внесения (10х, 2х, 1х). При этом образец любого объема собирается из двух компонентов (буфер+образец), а не из трех (буфер+ вода + образец).
1x если объем образца 25-75%;
10x ==> 75%
Смотри также:
/ссылки на сетевые ресурсы/
| Дополнения, комментарии, вопросы Для оптимального разделения не очень больших фрагментов, можно пользоваться буфером для внесения по рецепту, указанному в каталоге MBI Fermentas: 6x Orange Loading Dye Solution (#R0631) При этом ксиленцианол мигрирует с > 4 kb, а оранжевый — с 50 bp. Такой подход позволяет оптимизировать рабочее напряжение, а, соответственно, и разделение. И еще — я человек в мол.биологии непросвещенный, а потому да простят меня профессионалы, если я скажу всем известную вещь: вносить образцы в лунки гораздо проще, если под камеру подложить листок темной (черной или синей) бумаги, чтобы оттеняла лунки. Люди, хелп! Если кто-нибудь знает что-то про технологию внесения биополимеров в гель под названием Shark Teeth, напишите, пожалуйста! А почему бы заодно не добавить в текст, что рабочая концентрация бромистого этидия, например, 0,5 мкг/мл и что его можно добавлять прямо в гель, что гель с добавленным в него EthBr спокойно стоит ночь под электродным буфером без заметного вымывания из него краски? Полезные, вобшем-то факты, хоть и мелкие, но, с моей точки зрения, вполне не лишние. Акульи зубы — не гель. а гребенка в виде этих самых зубок. Втыкается в гель, и не вынимается, а образец наносится тонким-тонким носом в дырки между зубами. См. инструкцию к Макрофору. Только это не про агарозный форез. 2Re: что это гребенка такая, я знаю. Только сейчас вижу, что по формулировке моего вопроса кажется, будто это гель так называется:) Все, спасибо, уже поздно:) Только по моим данным, это имено про форез. Не знаю уж, про агарозный или ПААГ, по-моему, в данном случае не суть важно Народ, а какова длина волны для визуализации ПЦР-фрагментов? народ, а как точно называется маркер мол веса (лестница)? и куда, как ее наносить? а почему в гел Этьбромид а не GelStar ? GelGreen ? GelRed ? SYBRSafe ? а почему ТБЕ ТАЕ а не SB (sodium borate) ? а почему UV а не Blue ( Safe Imager , Dark Reader , FlashGel) А ПОКОЧАНУ )))) ответ от радио Molbiol — Не выпендрюйся Василий Иваныч-слушай свои «Валенки» 1: Biotechniques. 2004 Feb;36(2):214-6. Links Erratum in: Johns Hopkins University School of Medicine, Baltimore, MD, USA. PMID: 14989083 [PubMed — indexed for MEDLINE] All: 1 1: Electrophoresis. 2001 Mar;22(5):814-28.Click here to read Links Clare Chemical Research, Inc, Denver, CO 80206, USA. mseville@clarechemical.com The Dark Reader optical system (Clare Chemical Research, Denver, CO, USA) uses relatively low intensity broad-band visible blue light in combination with broad-band optical filters to detect fluorescence with a level of sensitivity that often surpasses that of UV transilluminators and can rival that of laser-based scanners. Applications of DR (Clare Chemical Research) devices include the detection of DNA and SYBR-stained protein samples following, and also during, electrophoresis. Unlike laser-based imaging systems, the fluorescence is directly visible to the user as well as being fully compatible with charge-coupled device (CCD) and Polaroid camera-based detection and imaging. Additionally, the DR optical system functions well in multicolor fluorophor environments. Because the Dark Reader does not emit any UV light, the extent of DNA damage incurred when visualizing DNA samples is drastically reduced compared to the damage produced by a UV device and this can have a significant benefit on downstream cloning protocols. Furthermore, dye photobleaching is minimal, extending the length of time that a fluorescent sample is visible. The inherent flexibility of the DR optical system allows many different configurations of the Dark Reader to be constructed such as transilluminators, hand lamps and integrated transilluminator-electrophoresis units. PMID: 11332748 [PubMed — indexed for MEDLINE] Today’s Featured Review Until recently Sybr green had been our labs nucleic stain of choice. We have, however, recently migrated to Biotium’s GelRed. GelRed is a newer nucleic acid gel stain that is safer and more temperature stable than other dyes. GelRed is safer because it is non mutagenic and is diluted in water. It is more thermostable than Sybr dyes because it does not degrade with repeated freeze-thaws or long storage (couple months at RT) and can be stored at room temperature, and sensitivity seems to at least equal if not exceed Sybr green when visualized with UV transilluminator. The dye is used similarly to Sybr dyes with staining (available at 10,000X ) or direct sample additions. The technology is not particularly ground breaking or new but the safety profile of this product makes it a viable alternative to potentially more dangerous dyes. Review by Vitelli Using GelGreen ‘In-Gel’ Save even more Time. GelGreen Safety FlashGel™ DNA System The FlashGel System is the fastest way to separate DNA and the only way to watch DNA migration as it happens. This revolutionary new tool separates DNA in 2 – 7 minutes. Monitor gel runs right at the bench, without UV light. The highly sensitive system allows a 5X reduction in DNA levels – saving both time and money. * Get results in 5 minutes or less. The FlashGel System consists of enclosed, disposable, precast agarose gel cassettes and a combination electrophoresis and transilluminator unit. * FlashGel Cassettes contain precast, prestained agarose gels and buffer – no need for gel preparation, buffer addition or gel staining. это все называется «ДНК технология» — не путайте с одноименной фирмой всем привет. Здравствуйте! «. При этом ксиленцианол мигрирует с > 4 kb, а оранжевый — с 50 bp. « а при какой процентности геля? Я так понимаю, как мигрируют красители именно от этого и зависит Как лучше выделить днк 200п.н. из геля для последующей амплификации. Скорее всего малая концентрация? Спасибо —Заранее спасибо ответившим, особенно ответившим правильно —. При этом ксиленцианол мигрирует с > 4 kb, а оранжевый — с 50 bp. « —а при какой процентности геля? Я так понимаю, как мигрируют красители именно от этого и зависит. Вроде красители в агарозе мигрируют на одно и тоже Rf не зависимо от процентности. А вот фрагменты сильно зависимо от процентности. Берете 2 маркера 100b и 1000b и в разных процентностях агарозы гоните с красителями и очень хорошо определяете, что с чем бежит. 3 процентный агароз вам уже трудно будет растворить. Я так дУмаю-у Мне кажется это лишняя работа элюировать ДНК из геля для последующей амплификации. Срез геля в воду, заморозить-разморозить и 1-2 мкл на ПЦР. Вы реамплифицируете кг. Спасибо, попробую на следующей неделе. А что если уже выделил из геля с помощью QG и при исходнике с приблизительной количеством 50 нг получил 40 мкг в 40 мкл. На форезе 1,2% в 10 мкл пробы ясен перец ничего не видно, агароза супер. Поставил на ПЦР, отправил 20 мкл в смесь, жду результатов. Сколько приблизительно может быть продукта? Спасибо Вопрос 1: Может ли в реакции сильнее амплифицироваться плазмида, чем нужная вставка?? 1% агарозу (в 2% линейная ДНК идет очень близко к суперскрученной, в 0.7% — близко к релаксированной). Если требуется проконтролировать циклизацию 3kbp фрагмента, то надо использовать 2% агарозу. если у Вас не нарабатывается большое кол-во продукта (20 нг в мкл и выше), дело уж конечно не в пирофосфатах- откуда бы им взяться, коли буквы не включились в амплификат (его мало)? Скорее всего проблемы с праймерами- посмотрите, нет ли «бомбы» (димер праймеров) внизу, или полимераза дохнет, что вря ли. Если проблема не лечится «в лоб», то просто замешайте исходно большой объем смеси, грубо говоря, накопите продукт экстенсивным путем, и всех делов. Я наверное перегрелся на солнцепёке (отпуск все-таки) — не понимаю в чем проблема плазмида или вставка, одна пара праймеров. По классике в ПЦР сильнее амплифицмруется всегда более короткий фрагмент. Без бутылки не разберешься, дождусь вечера. Здравствуйте, подскажите чем красить агарозный гель после щелочного электрофореза? И на какой стадии (до или после фиксирования в кислоте). Обязательно ли сушить? -Здравствуйте, подскажите чем красить агарозный гель после щелочного электрофореза? Бромий этидием или сибирским зеленым и иже с ними -до или после фиксирования в кислоте. «если я скажу всем известную вещь: вносить образцы в лунки гораздо проще, если под камеру подложить листок темной (черной или синей) бумаги, чтобы оттеняла лунки» Чем тогда думали в Сигма, если сделали столик в камере для фореза из белого пластика, к тому же скользкого в первом случае можно наклеить синей изоленты под место, где карманы)) Но от скольжения избавиться сложно — гель частенько уплывает от любых дуновений во время фореза. хоть гвоздями прибивай Можно ли заменить ТВЕ-буфер на Трис-СІ+EDTA для фореза ДНК, и какой молярности? За Трис.НСI в форезном буфере ставлю кол. Борная кислота испорчена у нас. Похоже, это ко мне . Поставляем наборы готовых гелей для электрофореза ДНК, рассчитанные на использование в ПЦРных лабораториях. В каждый комплект входит пузырёк ТАЭх20 (50 мл) для приготовления литра электрофоретического буферного раствора (EtBr 0,5 мкг/мл). Если нужно, то эти пузырёчки можно продавать и без гелей . Если интересно, то пишите. Ели реклама здесь неуместна, то удалите. Размер:: 19.19к кол-во скачиваний: 1724 Ну как может испортиться борная кислота? Купите тогда в аптеке. Борная кислота старая и «Ч.» по квалификации чистоты. Надо заказывать новые реактивы. Могу отсыпать сухой (белый порошок) ТВЕ. И дам пропись как самому готовить. Но про Трис.НСI для фореза — забудь. Лучше водопроводную воду. Забудьте и про Трис-HCl, и про все прочие буферы на основе Триса. Наиболее продвинутые пользователи за бугром переходят на Li-борат и Li-ацетат. Давно хотел попробовать карбонатный буфер, но всё руки не доходили. Недавно дошли. Приготовили Li-карбонатный буфер. Форезы получаются отлично! При 10V/см ни перегрева, ни закисления или защелачивания. Очень рекомендую! * ubMed will retrieve 2 records. J Virol Methods. 2010 May 13. [Epub ahead of print]Fast short-fragment PCR for rapid and sensitive detection of shrimp viruses. Mrotzek G, Haryanti, Koesharyani I, Tretyakov AN, Sugama K, Saluz HP. Leibniz Institute for Natural Product Research and Infection Biology, Hans Knoell Institute, Beutenbergstrasse 11a, 07745 Jena, Germany; Friedrich-Schiller-University, Jena, Germany. This article describes a fast short-fragment PCR method for the detection of white spot syndrome virus (WSSV), infectious hypodermal and hematopoietic necrosis virus (IHHNV), and monodon baculovirus (MBV). Fast two-temperature (95 degrees C denaturation and 60 degrees C annealing/extension) PCRs were performed in 5-10mul volume samples in miniaturized microplates using a fast Peltier thermal cycler. 40 cycles were completed in 25-30min. Rapid high-resolution agarose gel electrophoresis of 70-150bp PCR fragments was performed in 10min. High sensitivity of PCR product detection (50-100pg) was obtained using ultra sensitive dyes such as GelStar(®) and a gel documentation system equipped with a blue-light transilluminator. This novel method is faster and more sensitive than its TaqMan(®) real-time PCR counterparts. Copyright © 2010. Published by Elsevier B.V. да уж сам себя не похвались как оплеванный ходишь. © источник |