Гастроэзофагиальная рефлюксная болезнь — это патология, которая развивается вследствие обратного тока содержимого желудка (рефлюкса) в пищевод или вне его, что приводит к возникновению тревожащих больного симптомов. Данная патология является очень распространенным заболеванием, и в последние годы частота ее встречаемости достигает 40 %. Мужчины болеют чаще в 2-3 раза, чем женщины.
- Ожирение.
- Курение.
- Особенности питания (предпочтение жирной, острой пищи, употребление алкоголя).
- Наличие у больного хронического холецистита, панкреатита, язвенной болезни, склеродермии.
- Метеоризм.
- Беременность.
- Употребление препаратов, которые понижают гладкомышечный тонус (например, бисопролол, карведилол, амлодипин, нитроглицерин и др.).
- Стрессы.
Повреждающими агентами выступают соляная кислота, желчные кислоты, пепсин. Чем длительнее их воздействие на слизистую пищевода, тем больше вероятность повреждения пищевода и развития осложнений. У больных ГЭРБ снижена способность пищевода обезвреживать и возвращать обратно кислое содержимое желудка, попавшее в него. В основе заболевания лежит недостаточность нижнего сфинктера пищевода, причиной которой является диафрагмальная грыжа.
- Эрозивная.
- Неэрозивная.
- Пищевод Баррета (состояние, при котором нормальный эпителий пищевода перерождается в кишечный, является предраковым, требует настороженности).
Типичные проявления – изжога (появляется после еды через полтора часа, после переедания, после наклонов, ночью) и отрыжка кислым. Если данные симптомы возникают на протяжении 4-8 недель не реже 2 раз в неделю, то диагноз ГЭРБ вероятен. При наличии рефлюкса кислота вместе с пищей может попадать в дыхательные пути, способствуя их повреждению. Атипичные симптомы: боль или жжение за грудиной, нарушение глотания, хронический кашель, осиплость голоса, повреждение эмали зубов и др.
При наличии вышеперечисленных жалоб проводится тест с блокаторами протонной помпы (назначается пробное лечение омепразолом, рабепразолом на 3-5 дней, оценивается результат).
Могут быть назначены дополнительные методы обследования: эндоскопическое исследование (для визуального осмотра слизистой, возможно, ее биопсии), рентгенологическое исследование (выявление сужений, грыж, опухолей), рН-мониторинг 24-часовой. Существуют так называемые тревожные симптомы (нарушение глотания, похудение, тошнота, рвота, желудочные кровотечения, низкий гемоглобин), при которых эндоскопия обязательна, при их отсутствии диагноз может выставляться на основе клиники.
- Коррекция образа жизни: диета (избегать жирной, острой пищи, пряностей, маринадов, кофе, алкоголя, газированных напитков, кислых соков, помидоров, цитрусовых, шоколада, чеснока, капусты, бобов), не переедать, не ложиться после еды, не употреблять пищу за 2 часа до сна, отказ от курения, похудение при ожирении, избегать наклонов (особенно после еды), тугих поясов и др. С целью уменьшения рефлюкса — головной конец кровати может быть поднят на 20 см.
- Медикаментозное лечение.
Препаратами выбора при данном заболевании являются ингибиторы протонной помпы (омепразол, пантопразол, рабепразол, эзомепразол, ланзопразол), лечение длительное, индивидуальное (в зависимости от выраженности повреждения слизистой пищевода, ответа пациента на лечение) от 4 недель до 6 месяцев с последующим переходом на поддерживающую терапию (назначаются низкие дозы препаратов). Могут быть назначены и другие препараты (маалокс, альмагель, гастал).
- Хирургическое вмешательство проводится при наличии осложнений, неэффективности консервативного лечения.
Лечение физическими факторами назначается с целью нормализации моторно-эвакуаторной функции желудочно-кишечного тракта и вегетативной регуляции тонуса пищеводного сфинктера.
При выраженных симптомах болезни, наличии болевого синдрома применяют противовоспалительные и седативные методы.
Методы, восстанавливающие нормальную работу вегетативной нервной системы:
- ТКЭА (ускоряет заживляющие процессы в пищеводе).
- Электросонтерапия (улучшает секреторную функцию органов пищеварения).
- Продолжительная аэротерапия.
- Электрофорез с использованием спазмолитиков (с дротаверином, папаверином).
- Гальванизация (оказывает антацидный эффект, обладает противоотечным действием).
- Интерференцтерапия (уменьшает отечность тканей).
- Ванны с натрия хлоридом (улучшают микроциркуляцию, работу иммунной системы).
- Местная криотерапия на область эпигастрия (обладает также кровеостанавливающим, спазмолитическим действием).
- УВЧ-терапия (улучшает кровообращение, стимулирует заживление).
Методы, улучшающие процессы заживления:
- Магнитотерапия низкочастотная (снижает моторику, улучшает вегетативную регуляцию).
- Лазеротерапия.
Лечение ГЭРБ должно назначаться на ранних стадиях с обязательным соблюдением рекомендаций по изменению образа жизни, с целью предупреждения грозных осложнений (кровотечение, сужение пищевода и др.) и улучшения качества жизни.
Телеканал ОТР, программа «Студия здоровье», выпуск на тему «Гастроэзофагеальная рефлюксная болезнь»:
Здоровьесберегающий канал, врач высшей категории Васильченко И. В. рассказывает о лечении ГЭРБ:
источник
Проблемы с мочеполовой системой в детском возрасте требуют регулярного контроля со стороны специалиста. Если ребенок жалуется на боль при мочеиспускании, дискомфорт в животе или пояснице, в моче заметны следы крови, повысилась температура тела, вполне возможно, что это симптомы пузырно-мочеточникового рефлюкса. Какое консервативное лечение практикуют, если диагноз подтвердится?
Чаще всего ПМР диагностируют у детей до двух лет
ПМР – достаточно частая и распространенная патология в детской категории. По статистике, 70 % детей, попавших в стационар отделения урологии с инфекциями мочевых путей, имеют пузырно-мочеточниковый рефлюкс, который обнаруживается при сопутствующем обследовании.
Если УЗИ плода во время беременности показало какую-либо патологию мочевой системы, с вероятностью в 30 % это будет ПМР. Среди детей, которые перенесли пиелонефрит, эта болезнь обнаруживается в 20-50 % случаев.
ПМР встречается примерно у 1 % новорожденных
Если на клапане, который препятствует попаданию мочи в мочеточник, изначально, с рождения ребенка, присутствует дефект, говорят о первичном рефлюксе. Иногда он проходит самостоятельно, требуя только лекарственной терапии и других мер по профилактике осложнений.
Причиной вторичного, в свою очередь, становится дисфункция мочевыводящих путей на фоне хронической инфекции или воспаления. В этом случае, если заболевание не перешло в последние стадии, с ним можно справиться консервативно.
Если моча регулярно возвращается назад, токсины из организма не выводятся в нужном объеме. Они скапливаются в почке и провоцируют развитие пиелонефрита. В органе сохраняется воспалительный процесс, происходит рубцевание тканей, которое рано или поздно приводит к нарушениям почечной функции. В ряде случаев рубцы вызывают повышение артериального давления – в организме начинаются серьезные сбои, устранить которые возможно только путем удаления почки.
Пузырно-мочеточниковый рефлюкс может привести к дисфункции почек
Заболевание классифицируют по тяжести протекания. При пузырно-мочеточниковом рефлюксе II, а иногда и III степени у детей допускается консервативное лечение – наблюдение, профилактика и симптоматическая терапия. Тяжелая, последняя стадия требует радикального подхода – хирургического удаления анатомического дефекта с помощью лапаротомии или посредством малоинвазивного эндоскопического вмешательства.
Как правильно вести себя родителям, если ребенку поставили диагноз пузырно-мочеточниковый рефлюкс? Советы педиатра:
- Диетотерапия. Рацион нужно дополнить овощами, фруктами и крупами, а количество белковой и жирной пищи – сократить. Употребление соли ограничивается 2-3 г в день.
- Прием гипотензивных препаратов для нормализации артериального давления.
- Прием антибиотиков, останавливающих рост бактерий (в целях профилактики назначают 50 % от терапевтической дозы).
- Программа принудительного мочеиспускания (с интервалом в каждые два часа независимо от потребностей организма).
- Катетеризация мочевого пузыря (периодически пациенту выпускают мочу через специальный катетер).
- Физиотерапия – преимущественно электрофорез.
При ПМР показан регулярный массаж поясницы и ЛФК
На ранних стадиях справиться с симптоматикой помогает консервативная терапия, включающая физиопроцедуры и профилактику инфекций мочевых путей, но даже при первой и второй степени так, к сожалению, происходит не всегда. Если заболевание переходит у детей в третью стадию со значительным расширением чашечно-лоханочной системы, часто рекомендуют эндоскопическую инъекционную коррекцию пузырно-мочеточникового рефлюкса, например, с помощью объемообразующего геля DAM™+.
Гелевый имплантат вводят во время цистоскопии в устья мочеточника через специальную тонкую иглу. Он распределяется в тканях и образует плотную «подушку», выполняющую стабильную антирефлюксную функцию. Густой гель способствует сужению просвета мочеточника и не допускает обратного оттока урины к почкам. Для достижения эффекта достаточно одной процедуры.
Гель DAM™+ устраняет рефлюкс в более чем 80-90 % случаев
Если вы заметили тревожные признаки у маленького ребенка – повышенную температуру тела без симптомов простуды, слабость (появляется на фоне скачка артериального давления), жалобы на боль при мочеиспускании, не затягивайте с визитом к урологу. Обследования и лабораторные анализы помогут поставить точный диагноз. Чем раньше это произойдет, тем выше шансы на успешное консервативное лечение.
источник
При выборе плана лечения пузырно-мочеточникового рефлюкса и его осложнений необходим тонко дифференцированный подход, ведь оперативное вмешательство на относительно незрелом пузырно-мочеточниковом сегменте может прервать естественный процесс созревания и отразится на функции органов мочевой системы в дальнейшем. К тому же сложна дифференциальная диагностика причин возникновения рефлюкса (порок развития, морфо-функциональная незрелость или воспаление), что особенно характерно для детей до трех лет.
Но необходимо помнить, что лечить пузырно-мочеточниковый рефлюкс следует с момента выявления патологии. Показаниями к оперативному лечению пузырно-мочеточникового рефлюкса принято считать пузырно-мочеточниковый рефлюкс 3 степени при неэффективности консервативной терапии в течение 6-12 мес; пузырно-мочеточниковый рефлюкс 4-5 степени.
Основными принципами терапевтического лечения пузырно-мочеточникового рефлюкса является профилактика инфекционных заболеваний органов мочевой системы, коррекция сопутствующей патологии органов мочевой системы, физиотерапевтическое лечение, профилактика склерозирования почечной ткани, мембранстабилизирующая терапия.
При консервативном лечении пузырно-мочеточникового рефлюксе необходимо учитывать фон, на котором протекает данное состояние. Так, при развитии пиелонефрита необходимо проведение более длительного дополнительного курса уросептиков.
При развитии пузырно-мочеточникового рефлюкса на фоне нейрогенного мочевого пузыря целесообразно проведение мероприятий, направленных на коррекцию нейрогенного мочевого пузыря.
При нейрогенной дисфункции мочевого пузыря по гипорефлекторномутипу рекомендуется:
- режим принудительных мочеиспусканий (через 2-3 часа);
- ванны с морской солью;
- курс адаптогенов (жень-шень, элеутерококк, лимонник, заманиха, родиола розовая, золотой корень по 2 капли настойки на год жизни в первой половине дня);
- глицин перорально 10мг/ кг в сут. в течение месяца;
- физиотерапия: электрофорез с прозерином, хлористым кальцием; ультразвук на область мочевого пузыря; стимуляция мочевого пузыря.
При нейрогенной дисфункции мочевого пузыря по гиперрефлекторномутипу целесообразно проведение следующих мероприятий:
- препараты валерианы, корня пиона, пустырника;
- препараты красавки (беллоид, беллатаминал);
- пантогам перорально по 0,025 мг 4 раза в день на 2-3 мес;
- пикамилон 5 мг/кг в сут. на 1 мес.
- физиотерапия: электрофорез на область мочевого пузыря атропина, папаверина; магнитотерапия (УВЧ-ДКВ); ультразвук на область мочевого пузыря; электростимуляция мочевого пузыря по расслабляющей методике.
При пузырно-мочеточниковом рефлюксе, для улучшения сократительной деятельности мочеточников рекомендовано назначение динамических токов на область мочеточников в количестве 10 процедур. Назначается ритм синкопа в течение 7-10 мин. Курс физиотерапии повторяют через 1,5 — 2 мес. 3-4 раза.
Для профилактики склерозирования почечной ткани рекомендуется прием рибоксина, стугерона. Из мембранстабилизирующих препаратов используется витамин В6, витамин Е.
Развитие рефлюкс-нефропатии при любой степени ПМР является показанием для проведения хирургической коррекции рефлюкса.
Перед проведением оперативного вмешательства необходимо провести курс антибактериальной терапии для предотвращения манифестации или обострения пиелонефритического процесса.
При развитии рефлюкс-нефропатии в до- или послеоперационный период необходимо учитывать, что это состояние возникает на фоне нарушений клеточной энергетики различной степени. Поэтому всем детям рекомендуется применение препаратов янтарной кислоты (янтовит, митамин) по 25 мг/сут., а при наличии данных о нарушении активности митохондриальных ферментов — применение расширенной схемы лечения с использованием препаратов, действие которых направлено на коррекцию состояния митохондрий. При развитии нефросклероза целесообразно применение противосклеротических препаратов (витамин В15, солкосерил, стугерон, цитохром С).
Основные препараты, используемые при комплексном лечении при наличии признаков митохондриальной недостаточности
источник
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна.
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна. Распространенность ПМР и последствия этого заболевания (хронический пиелонефрит, отставание в развитии, артериальная гипертензия, хроническая почечная недостаточность), неизбежно приводящие к инвалидизации, диктуют необходимость поиска путей улучшения лечебной тактики. Среди причин развития ПМР у мальчиков основное место занимают пороки развития устьев мочеточников, в то время как у девочек преобладают вторичные формы ПМР, обусловленные инфекцией мочевых путей и нейрогенными дисфункциями мочевого пузыря (НДМП). Так, на первом году жизни соотношение страдающих ПМР мальчиков и девочек составляет 6:1, а по мере взросления это соотношение изменяется с точностью до наоборот [2].
Чтобы понять причины развития ПМР, необходимо иметь представление о нормальном строении пузырно-мочеточникового сегмента (ПМС) (рис.). Анатомически замыкательная функция ПМС осуществляется благодаря определенному соотношению длины и ширины внутрипузырного отдела мочеточника (5:1), косому прохождению мочеточника через стенку мочевого пузыря. Длинный подслизистый тоннель является пассивным элементом уретеро-везикального «клапана». Активный элемент клапанного механизма представлен мышечно-связочным аппаратом мочеточника, который при сокращении детрузора смыкает устье.
К причинам антифизиологичного тока мочи относятся патологические состояния, приводящие к нарушению замыкательной функции ПМС и высокое внутрипузырное давление мочи. К первым можно отнести врожденные пороки ПМС и воспалительный процесс поверхностного и глубокого слоев треугольников мочевого пузыря (циститы), нарушающий работу детрузора или непосредственно самого ПМС.
Аномалии ПМС являются следствием неправильного развития мочеточникового выроста вольфова протока на 5-й неделе эмбриогенеза [3, 4]. Представить аномалии ПМС можно следующим образом:
- широкая постоянно зияющая форма устья мочеточника;
- расположение устья мочеточника вне зоны мочепузырного треугольника (латеропозиция);
- полное отсутствие или укорочение подслизистого отдела ПМС;
- нарушение морфологического нормального строения ПМС (дисплазия).
Утрата замыкательной функции ПМС встречается при воспалении стенки мочевого пузыря или зоны ПМС. Наиболее часто вторичный ПМР является следствием (осложнением) гранулярной, буллезной или фибринозной форм цистита. Инфекция мочевых путей встречается у 1–2% мальчиков и у 5% девочек. Чаще мочевые пути колонизируются условно-патогенной (кишечной) флорой, среди которой основное место занимает кишечная палочка (40–70%) [3].
В норме ПМС способен противостоять внутрипузырному давлению жидкости до 60–80 см водного столба [5]. Высокое гидростатическое давление является следствием интравезикальной обструкции или функциональных расстройств мочевого пузыря. Интравезикальная обструкция развивается при клапанах задней уретры, рубцовом фимозе у мальчиков, склерозе шейки мочевого пузыря (болезни Мариона), меатальном стенозе у девочек.
НДМП встречаются у 20% детей в возрасте 4–7 лет. К 14 годам число страдающих этими дисфункциями сокращается до 2% [6]. НДМП проявляют себя ирритативной или обструктивной симптоматикой. Основные формы НДМП: гиперактивность детрузора, гипотония детрузора и детрузорно-сфинктерная диссинергия. При этих состояниях ПМР также считается вторичным и является следствием повышения давления жидкости в мочевом пузыре. Гиперактивность детрузора характеризуется резкими скачками внутрипузырного давления и нарушением накопительной функции мочевого пузыря. Гипотония детрузора характеризуется снижением чувствительности стенки пузыря, его переполнением и нарастанием давления мочи в его просвете выше критических цифр. Детрузорно-сфинктерная диссинергия представляет собой нарушение синхронной работы детрузора и сфинктерного аппарата, приводящее к функциональной инфравезикальной обструкции при микции.
С возрастом отмечается тенденция к уменьшению встречаемости первичного и увеличению вторичного ПМР. При этом частота регрессии первичного ПМР находится в обратной зависимости от степени ПМР. При I и II степенях ПМР регрессия отмечается в 80%, а при III — всего в 40% случаев. Объяснение этому дает теория «матурации» ПМС (Hutch, 1961), которая приобрела себе сторонников позднее (Kellerman, 1967; King, 1974). Суть теории заключается в том, что с развитием ребенка происходит физиологическая трансформация ПМС — удлиняется внутрипузырный отдел мочеточника, уменьшается его диаметр относительно длины и изменяется угол впадения в мочевой пузырь.
Современная лечебная стратегия при ПМР включает в себя комплекс мероприятий (терапевтических и хирургических), направленных на устранение причины рефлюкса и ликвидацию его последствий. Выбор метода коррекции ПМР, безусловно, определяется его формой.
Суть консервативной терапии должна сводиться к эрадикации инфекции мочевых путей и устранению функциональных расстройств мочевого пузыря и профилактике гибели почечной паренхимы. По данным Ю. Ф. Исакова, эффективность консервативной терапии при I–III степени ПМР составляет 60–70%. Основными осложнениями (проявлениями) ПМР являются хронический пиелонефрит (50–70%) и рефлюксогенная нефропатия (60–70%) [2]. Этиологическая структура хронического пиелонефрита (по А. Ф. Возианову и др., 2002) представлена следующим образом: кишечная палочка — 40–60%, протей — 9–16%, клебсиелла — 7–20%, стрептококк — 4–10%, L-формы — 15%, микробные ассоциации — 10–15%, энтерококк — 2–5%, синегнойная палочка — 2–7%, энтеробактер — 5–15%, стафилококк — 5–14%.
Антимикробная терапия должна носить длительный характер (6–12 мес) и применяться по результатам посевов мочи. Наиболее удобными для детей являются препараты пероральных форм. При лечении в стационаре применяются внутримышечные или внутривенные формы. Для эрадикации возбудителя нашли применение следующие препараты:
- β-лактамные полусинтетические пенициллины:
– аугментин, 25–50 мг/кг/сут, перорально в течение 7–10 сут;
– амоксиклав, 20–40 мг/кг/сут, перорально в течение 7–10 сут;
цефалоспорины 2-го поколения:
– цефуроксим (зиннат), 20–40 мг/кг/сут (в два приема) в течение 7–10 сут;
– цефаклор (цеклор), 20–40 мг/кг/сут (в три приема) в течение 7–10 сут;
цефалоспорины 3-го поколения:
– цефиксим (супракс), 8 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
– цефтибутен (цедекс), 7–14 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
После использования бактерицидных препаратов (антибиотиков) длительным курсом назначается уросептическая терапия:
- производные нитрофурана: нитрофурантоин, 5–7мг/кг/сут, перорально, в течение 3–4 нед;
- производные хинолона (нефторированные):
– налидиксовая кислота — 60 мг/кг/сут, перорально, в течение 3–4 нед;
– пипемидовая кислота (пимидель, палин) — 200–400 мг/сут, перорально, в течение 3–4 нед;
– нитроксолин (5-НОК) — 10 мг/кг/сут, перорально, в течение 3–4 нед.
С целью купирования аллергического компонента назначаются десенсибилизирующие средства:
- тавегил 2 мг/сут, перорально, в течение 1–2 нед;
- кларитин 5–10 мг/сут, перорально, в течение 1–2 нед;
- фенистил 2–4 мг/сут, перорально, в течение 1–2 нед.
Важную роль играет применение лекарственных средств, улучшающих внутриклеточный обмен. С антиоксидантной целью назначаются:
- токоферола ацетат, 1–2 мг/кг/сут, перорально, в течение 3–4 нед;
- B-каротин — из расчета по 1 капле на 1 год жизни в сутки, перорально, в течение 3–4 нед;
С целью коррекции митохондриальной недостаточности применяются:
- янтарная кислота 25 мг/сут, перорально, в течение 3–4 нед;
- пиридоксин 2 мг/кг/сут, перорально, в течение 3–4 нед.
Обязательным компонентом консервативной терапии является применение фитопрепаратов: листья и плоды брусники, клюквы, смородины, кора дуба, зверобой, крапива, ромашка, черника, мать-и-мачеха и др.
Для повышения эффективности лечения циститов у детей старшего возраста применяется местная терапия — внутрипузырные инстилляции, к которым надо относиться с осторожностью у больных с высокими степенями ПМР. Важно помнить, что объем растворов не должен превышать 20–50 мл. Используются растворы: протаргол; солкосерил; гидрокортизон; хлоргексидин; фурациллин.
Курс лечения рассчитан на 5–10 инстилляций, при буллезном цистите повторяют 2–3 курса. Эффективно дополнение местной терапии физиотерапевтическим лечением.
Особое место в лечении инфекции мочевых путей у детей следует уделять нормализации функции кишечника. Нарушение нормального ритма опорожнения толстой кишки приводит к компрессии нижней трети мочеточника, нарушению васкуляризации, застою в области малого таза, инфицированию мочевых путей (лимфогенный путь).
НДМП наблюдается у пациентов с миелодисплазией и различными ее проявлениями: менингомиелоцеле, рахишизисе, Spina bifida (неполное закрытие позвоночного канала) и др. Лечению НДМП отводится важное звено в комплексной терапии. Устранение функциональных расстройств мочевых путей является сложнейшей задачей и требует длительного времени.
При гипорефлекторном детрузоре рекомендуются:
- режим принудительных мочеиспусканий (через 2–3 ч);
- ванны с морской солью;
- глицин 10 мг/кг/сут, перорально, в течение 3–4 нед;
- физиотерапия: электрофорез с прозерином, хлоридом кальция, ультразвук на область мочевого пузыря, электростимуляция;
- интермиттирующие стерильные катетеризации мочевого пузыря.
При гиперактивности детрузора назначаются:
- толтеродин (детрузитол) 2 мг/сут, перорально, в течение 3–4 нед;
- оксибутинина гидрохлорид (дриптан) 10 мг/сут, перорально, в течение 3–4 нед;
- троспия хрорид (спазмекс) 5 мг/сут, перорально, в течение 3–4 недели;
- тамсулозин (омник), доксазозин (кардура) 1 мг/сут, перорально, в течение 3–4 нед;
- никотинол-гамма-аминомасляная кислота (пикамилон) 5 мг/кг/сут, перорально, в течение 3–4 нед;
- имипрамин (мелипрамин) 25 мг/сут, перорально, в течение 3–4 нед;
- десмопрессин (минирин) 0,2 мг/сут, перорально, в течение 3–4 нед;
- биологическая обратная связь;
- физиотерапия: электрофорез с атропином, папаверином, ультразвук на область мочевого пузыря, электростимуляция мочевого пузыря по расслабляющей методике, магнитотерапия.
Физиотерапевтическое лечение носит вспомогательный характер, однако значительно повышает эффективность терапии. Этот метод применяется как при НДМП, так и при воспалительных заболеваниях мочевых путей.
Отдельное место в лечении ПМР отводится эндоскопическим методам. Так, согласно опросу, проведенному итальянскими урологами, 80% родителей выбирают эндоскопическое лечение в качестве альтернативы открытым операциям и длительной медикаментозной терапии [7].
Приоритет в медицинском применении тефлоновой пасты принадлежит отоларингологу Arnold, использовавшему ее с целью коррекции голосовой щели (1962). Внедрение в урологическую практику тефлона состоялось в 1974 г., когда V. Politano выполнил парауретральную инъекцию по поводу недержания мочи. Впервые о малоинвазивном эндоскопическом способе коррекции ПМР заявил Е. Маtouschek. В 1981 г. он с положительным результатом выполнил инсуфляцию тефлоновой пасты ребенку 8 лет в область устья рефлюксирующего мочеточника [8]. Впоследствии O. Donnel совместно с P. Puri (1984) описали методику эндоскопического лечения ПМР [9]. За 25 лет опробовано большое количество имплантируемых материалов, начиная с тефлона и заканчивая культурами аутогенных клеток [8–16]. Наиболее полная классификация инъецируемых материалов выглядит следующим образом [17]:
- ауто- и аллогенные: кровь, жир, хондроциты, клетки детрузора, коллаген человека;
- ксеногенные и синтетические: тефлон, силикон, декстраномер/гиалуроновая кислота, гидроксиапатит кальция, биостекловолокно, полинивинилспиртовая пена, гидроксиэтилметакрилат, бычий коллаген, дюрасферы (Durasphere B).
Первый опыт применения антирефлюксных имплантантов настораживал специалистов в связи с возможностью развития нежелательных побочных эффектов: возникновения в месте инъекции некроза, малигнизации, миграции материала с формированием гранулем в регионарных лимфатических узлах и/или паренхиматозных органах [18–20]. Современными экспериментальными и клиническими работами доказана инертность и гипоаллергенность, безопасность используемых в настоящее время биоматериалов [12, 13]. Положительные результаты эндоскопического лечения ПМР, по данным недавних исследований, (Chertin, 2003; Kirsch, 2004) достигают 70–90%.
Показаниями к эндоскопическому способу коррекции ПМР являются неэффективность консервативной терапии в сроки от 6 до 12 мес. Отсутствие острой фазы воспаления мочевого пузыря — обязательное условие для эндоколлагенопластики.
Эндоскопический способ коррекции ПМР благодаря простоте выполнения и достаточно высокой при этом эффективности прочно входит в алгоритм лечебной тактики. Несомненно, важная роль должна отводиться правильному выбору показаний к этому методу. Коллагенизация устья мочеточника оправдана при нормальном его строении, т. е. отсутствии зияния устья и латеральной дистопии. При IV и V степенях ПМР и снижении секреторной функции почки > 50% показано выполнение открытой реимплантации мочеточника.
Метод эндоскопического лечения, направленный на удлинение интрамурального отдела мочеточника и уменьшение диаметра устья, выполняется по следующей методике. Производится цистоскопия, в ходе которой определяется клинико-анатомическая картина мочевого пузыря: состояние мочепузырного треугольника, форма и расположение устьев мочеточника, наличие парауретральных дивертикулов и уретероцеле, воспалительных изменений. Через рабочий канал тубуса цистоскопа проводится длинный инъектор (диаметр 5Сh), присоединенный к шприцу с коллагеном. Коллаген представлен субстанцией в виде геля. Стандартный объем коллагена в шприце — 2 мл. Вкол иглы инъектора (длина 6 мм) осуществляется под устье мочеточника — на 6 ч условного циферблата, на всю глубину. Для профилактики осложнений перед коллагенопластикой возможна катетеризация устья мочеточниковым катетером 5Сh. При давлении на поршень шприца с коллагеном в зоне вкола иглы постепенно образуется валик. В зависимости от степени зияния устья и длины подслизистого отдела мочеточника, вводится от 1 до 2 мл субстанции. При этом устье мочеточника приобретает точечную или щелевидную форму, после чего инструмент удаляется. Мочевой пузырь на сутки дренируется двупросветным уретральным катетером Фоли 8–14Сh, баллон которого наполняется на 5 мл.
Самым эффективным способом коррекции ПМР остается оперативный — 93–97% случаев [21]. Известно более 80 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Принципиальным механизмом всех видов открытых вмешательств является удлинение интрамурального отдела мочеточника с целью создания клапанного механизма, способного пропускать мочу в одном направлении из мочеточника в мочевой пузырь. Наиболее удачной признана техника тоннельного анастомоза, благодаря способности тоннеля противостоять высокому гидростатическому давлению внутри мочевого пузыря (как при наполненном мочевом пузыре, так и при мочеиспускании), препятствуя рефлюксу мочи в мочеточник.
Показаниями к хирургическому лечению являются: рефлюксирующий мегауретер (при ПМР IV, V степени), рецидивирующий характер ПМР при более низких степенях и отсутствии положительного эффекта от консервативного или эндоскопического лечения, сочетание рефлюкса с обструктивным компонентом в зоне ПМС.
В послеоперационный период всем пациентам обязательно проводится профилактическая антибиотикотерапия в течение 3–4 сут с последующим переходом на уросептическую терапию в течение 2–3 нед.
Публикации, касающиеся первого опыта использования тоннельной техники уретероцистоанастомоза, принадлежат D. Williams и J. Hutch и появились они в 60-х годах прошлого столетия [3]. По разным данным, известны от 80 до 120 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Одни выполняются со вскрытием мочевого пузыря (операции Коэна, Политано-Лидбеттера и др.) [22], другие без цистотомии (операции Лича–Грегуара [23, 24], Барри [22]). В любом возрасте эти операции проводятся с применением эндотрахеального наркоза. Осложнения открытых операций в большинстве случаев общие — кровотечение, развитие стриктуры анастомоза, нарушение эвакуации мочи на уровне пузырно-мочеточникового соустья в результате ангуляции и как следствие развитие ретенции верхних мочевых путей, рецидив ПМР, послеоперационный цистит и пиелонефрит [25].
В России наиболее часто выполняются операции Коэна и Политано–Лидбеттера. Уретероцистоанастомоз по Коэну выполняется через разрез передней стенки мочевого пузыря и основан на принципе удлинения внутрипузырной части мочеточника путем его реимплантации во вновь сформированный подслизистый тоннель. Специфичными осложнениями данного способа являются кровотечение из мочепузырного треугольника (Льето) и юкставезикального отдела мочеточника, развитие послеоперационного цистита. Послеоперационное кровотечение из треугольника Льето связано с формированием подслизистого тоннеля в наиболее кровоснабжаемой зоне мочевого пузыря, что обусловлено анатомическими особенностями. Послеоперационное кровотечение из юкставезикального отдела мочеточника возникает вследствие разрыва регионарных артериальных и венозных сплетений во время его слепой тракции для проведения через подслизистый тоннель. Оба варианта кровотечений требуют повторной ревизии операционной раны, гемостаза и ухудшают результат реконструктивно-пластической операции. Из-за чреспузырного доступа, особенностями и слабыми сторонами уретероцистоанастомоза по Коэну являются пересечение всех слоев стенки мочевого пузыря с развитием рубца, препятствующего нормальной сократительной способности пузыря; невозможность расправления перегибов расширенного мочеточника и выполнения его моделирования перед реимплантацией, необходимость в которых возникает при IV и V степенях ПМР (на долю IV и V степеней приходится до 60% среди всех оперативных вмешательств).
В основе принципа уретероцистоанастомоза по Политано–Лидбеттеру лежит создание подслизистого тоннеля мочевого пузыря. Особенностью техники является широкое вскрытие мочевого пузыря и рассечение слизистой оболочки мочевого пузыря в трех местах для создания тоннеля, при этом отсечение мочеточника производится с внешней стороны мочевого пузыря, так как данный способ предполагает резекцию расширенного мочеточника. Специфичными осложнениями операции по Политано-Лидбеттеру являются развитие рубца в месте вскрытия пузыря; развитие ангуляции предпузырного отдела мочеточника из-за использования техники анастомозирования и образование стриктур пузырно-мочеточникового анастомоза, не поддающихся эндоскопической коррекции. Характерным рентгенологическим симптомом ангуляции мочеточника является его трансформация в виде рыболовного крючка. На практике это значительно снижает возможность катетеризации почки при возникающей необходимости (например, при мочекаменной болезни). Применение столь травматичного способа уретероцистоанастомоза при отсутствии расширения мочеточника ограничено или неоправданно.
Экстравезикальный способ уретероцистоанастомоза является максимально эффективным оперативным вмешательством у детей с ПМР (98%). В задачи уретероцистоанастомоза входит создание надежного клапанного механизма ПМС, формирование адекватного просвета мочеточника, не препятствующего свободному пассажу мочи. Экстравезикальная методика уретероцистоанастомоза в полной мере отвечает предъявляемым требованиям. Использование экстравезикальной методики позволяет избежать вскрытия мочевого пузыря (широкого рассечения детрузора) и в то же время дает возможность сформировать подслизистый тоннель на любом участке стенки мочевого пузыря, выбрав бессосудистую зону. Длина тоннеля также может быть выбрана хирургом произвольно.
Появление новых эффективных препаратов при фармакологическом консервативном лечении ПМР у детей, с одной стороны, и внедрение в практическую медицину новых оперативных способов лечения, включая лапароскопическую хирургию, робототехнику — с другой, безусловно, в будущем изменит значение обычных открытых способов коррекции ПМР. Но сегодня в стратегии лечения ПМР открытые оперативные вмешательства играют ключевую роль, так как они позволяют ликвидировать самые сложные формы ПМР.
В заключение хотелось бы подчеркнуть, что выбор метода коррекции ПМР должен быть строго индивидуальным и основываться на объективном анализе врачом данных обследования и оценке возможности применения всех имеющихся способов устранения ПМР у данного конкретного больного.
- Яцык П. К., Звара В. Пузырно-мочеточниковый рефлюкс у детей. М., 1990. С. 41–44.
- Коколина В. Ф., Румянцева А. Г. Практическое руководство по детским болезням. Нефрология детского возраста. М.: Медпрактика-М, 2005. Т. VI. С. 234, 240, 252.
- Лопаткин Н. А., Пугачев А. Г. Пузырно-мочеточниковый рефлюкс. М., 1990. С. 5, 119.
- Campbell M. Clinical Pediatric Urology. 1951; 164.
- Исаков Ю. Ф. Хирургические болезни у детей. М., 1998. С. 327.
- Вишневский Е. Л. Гиперактивный мочевой пузырь у детей/Актуальные вопросы диагностики и лечения урологических заболеваний у взрослых и детей. Тюмень, 2005. С. 324.
- Capozza N., Lais A., Matarazzo E. et al. Treatment of vesico-ureteric reflux: a new algoritm based on parental preference//BJU international. 2003; 92: 285–288.
- Matouschek E. Treatment of vesicoureteral reflux by transurethral teflon injection//Urologe A. 1981; 20: 263–264.
- Puri P., O’Donnell B. Correction of experimentally produced vesicoureteric reflux in the piglet by intravesical injection of Teflon//Br. Med. J. 1984; 289: 5–7.
- Неменова А. А., Чепуров А. Г. Эндоскопическая коррекция пузырно-мочеточникого рефлюкса инъецированием тефлоновой пасты//Урология и нефрология. 1993. № 2. С. 7–10.
- Puri P., Chertin B., Dass L. Treatment of vesicoureteral reflux by endoscopic injection of dextranomer/hyaluronic acid copolymer: preliminary results//The Journal of Urology. 2003; 170: 1541–1544.
- McPherson J. M., Wallace D. G., Piez K. A. Development and biochemical characterization of injectable collagen//J. Dermatol. Surg. Oncol. 1988; 14 (1): 13.
- Alkan M., Talim B., Ciftci A. O., Senocak M. E., Caglar M., Buyukpamukcu N. Histological response to injected gluteraldehyde cross-linked bovine collagen based implant in a rat model//BMC Urology. 2006; 6: 3.
- Paradysz A., Fryczkowski M., Krauze-Balwinska Z., Gajewski D. Comparison of effectiveness of endoscopic injection of autologous blood and conservative therapy in the treatment of bilateral primary vesicoureteral reflux//Wiad. Lek. 2002; 55 (7–8): 404–410.
- Киреева Н. Б., Хафизова Л. А., Паршиков В. В., Заугаров М. Ю., Алейник Д. Я. Эндоскопическая коррекция пузырно-мочеточникового рефлюкса у детей с использованием ауто- или аллофибробластов//Нижегородский медицинский журнал. 2003. № 3–4. С. 8–12.
- Бабанин И. Л., Казанская И. В., Коноплев В. Д. Эффективность эндоскопического лечения пузырно-мочеточникового рефлюкса у детей с использованием биоимплантатов: материалы X Российского съезда урологов. М., 2002. С. 698–699.
- Ander A. H. Endoscopic treatment of vesicoureteral reflux. Abstract Book from 8th Mediterranean video-endoscopic urology and European society of urological technology. 2006; 13–14.
- Larsson E., Stenberg L. et al. Injectable dextranomer-based implant: histopathology, volume changes and DNA-analysis//Scandinavian Journal of urology and Nephrology. 1999; 33 (6) 355–361.
- Mittleman R. E., Marraccini J. V. Pulmonary Teflon granulomas following periurethral Teflon injection for urinary incontinence//Arch. Pathol. Lab. Med. 1983, 107: 611–612.
- Aaronson I. A., Rames R. A., Greene W. B., Walsh L. G., Hasal U. A., Garen P. D. Endoscopic treatment of reflux: migration of Teflon to the lungs and brain//Eur. Urol. 1993, 23: 394–399.
- Лопаткин Н. А., Пугачев А. Г., Аполихин О. И. //Урология. М., 2002. С. 118.
- Хинман Ф. Оперативная урология. М., 2001. С. 811–819.
- Lich R., Jr., Howerton L. W., Davis L. A. Recurrent urosepsis in children//J Urol. 1961; 86: 554.
- Gregoir W. Le traitement chirurgical du reflux vesico-ureteral congenital// Acta. Chir. Belg. 1964; 63: 432.
- Поляков Н. В. Оценка эффективности реконструктивно-пластических операций на пузырно-мочеточниковом сегменте у детей: дис. . канд. мед. наук. М., 2003. С. 111–119.
А. Ю. Павлов, доктор медицинских наук
С. А. Маслов
Н. В. Поляков, кандидат медицинских наук
А. А. Лисенок, кандидат медицинских наук
Г. В. Симонян
НИИ урологии, Москва
источник

Зачастую, первым признаком рефлюкса может стать возникновение эпизодов острого пиелонефрита в самом раннем возрасте детей. При этом пиелонефриты дают яркую картину и протекают тяжело, характерны повышением температуры, стойким и упорным, плохо сбивающимся жаропонижающими, при этом нет признаков простуды – насморка, красноты в горле и т.д.
Проявления пиелонефрита можно заподозрить по изменениям в анализе мочи и крови – повышению уровня лейкоцитов, резкому ускорению СОЭ, в моче много лейкоцитов и микробов, может быть повышен белок, есть эпителий. С подозрением на инфекцию мочевой системы детей обычно госпитализируют в урологическое отделение детской больницы, где и проводится обследование и выявляется рефлюкс.
Иногда при приобретенном рефлюксе могут возникать жалобы на приступы болей в животе или спине, в области поясницы, больше со стороны поражения. У старших детей можно выявить положительный симптом Пастернацкого (поколачивание по пояснице дает приступ боли). Сложнее всего заподозрить проявления врожденного рефлюкса у детей раннего возраста и у новорожденных, ранее, до введения в массовую практику аппаратов УЗИ это было практически невозможно, сегодня все чаще рефлюкс обнаруживают в раннем возрасте и на ранних стадиях по данным УЗИ – обнаруживаются признаки прогрессирующей пиелоэктазии (расширения лоханки почки). Но, только наличия пиелоэктазии для установления диагноза мало – это лишь повод для прицельного и детального обследования, а не повод для паники. Пиелоэктазия часто бывает внутриутробно у плода, и по мере рождения и роста проходит бесследно и без осложнений.
Предварительный диагноз ставится на основании данных общих обследований – анализов крови и мочи, проведении ультразвукового исследования. Но в дальнейшем подтвердить диагноз необходимо при проведении особых исследований – основным из них считается внутривенная урография и микционная цистография. Это методы визуального осмотра и выполнения рентгеновских снимков при заполнении мочевого пузыря и частично мочеточников, на предмет деформаций и аномалий. А при микционной цистографии внутрь мочевого пузыря по катетеру, который ставится ребенку через мочеиспускательный канал, вводят раствор рентгено-контрастного вещества до того момента, как ребенку захочется помочиться. Затем проводят рентгеновский снимок с полностью наполненным мочевым пузырем, а второй – в момент, когда ребенок начнет мочиться.
По данным полученных снимков выявляют виды рефлюкса, уровень поражения и односторонний ли он или двусторонний. По уровню заполнения контрастным веществом мочеточника и почки выделяются ранее описанные нами степени рефлюкса – от самой легкой, первой степени до тяжелой, пятой, с глубокими деформациями. По данным, полученным в результате проведения микционной цистографии, важно выделить два вида рефлюксов:
— активный рефлюкс, происходящий во время мочеиспускания при повышении давления в мочевом пузыре,
— пассивный, который происходит даже вне мочеиспускания, когда давление внутри мочевого пузыря низкое.
Кроме того, микционная цистография позволяет обнаружить сам рефлюкс, его степень тяжести, а также помогает в выявлении состояния мочеиспускательного канала, нарушения в строении и функционировании самого мочевого пузыря, и выявить так называемый транзиторный мочеточниковый рефлюкс, который возникает периодически, из-за особых обстоятельств. Иногда, в сложных диагностических условиях встает необходимость в проведении дополнительных методов диагностики заболевания. Прибегают к внутривенной урографии, которая помогает визуально оценить расположение и структуру почек и мочевой системы, также применяется уродинамическое исследование работы мочевого пузыря, если необходимо – назначают цистоскопию – визуальный осмотр внутреннего строения мочевого пузыря через специальную трубку.
При необходимости проводят ряд дополнительных анализов мочи и крови, радиоизотопное сканирование почек с определением работы почки по выведению веществ. Эти исследования дают возможность врачам понять, возник ли рефлюкс как первичное заболевание, который является патологией в области впадения мочеточника, или это вторичное поражение области мочеточника из-за различных патологий мочеточника и мочевого пузыря.
Конечно, проще всего лечится вторичный рефлюкс, так как необходимо, прежде всего, исключение тех заболеваний, которые этот самый рефлюкс вызвали. Это обычно циститы, нейрогенная дисфункция мочевого пузыря, нарушения проходимости мочеиспускательного канала – клапаны уретры. По данным докторов в зависимости от состояния и его запущенности – рефлюкс исчезает от 20-до 70% патологий, чем раньше будет распознано – тем лучше. А вот самостоятельное исчезновение вторичных рефлюксов бывает крайне редко, особенно на фоне имеющихся других патологий. При запущенных состояниях или тяжелой стадии рефлюкса даже лечение основного заболевания не дает излечения, и необходима операция.
Первичный рефлюкс обычно возникает как дефект в области впадения мочеточника в толщу мочевого пузыря. Тогда врачам необходимо исправить ошибку природы хирургически, при помощи открытой операции или эндоскопической. Эти операции подразумевают восстановление функции клапанного аппарата мочеточников. Операции большой хирургии с открытым доступом детьми переносятся тяжело и в последнее время их применяют только при невозможности проведения эндоскопического вмешательства в силу объективных причин. В основном же детям показаны мало травмирующие операции по пластике клапанного аппарата мочеточника. Их проводят после цистосткопии и через этот же аппарат.
«Может ли рефлюкс исчезнуть без лечения и без операции, ведь операция – это так страшно?» — такой вопрос нередко задается родителями, но к сожалению однозначного ответа врачи дать не могут. Вероятность исчезновения рефлюкса зависит от его степени и колеблется в пределах 10-20%, но за время, пока рефлюкс будет существовать, особенно если он выше третьей степени, он может существенно нарушить функции и строение почки, что может привести в дальнейшем к ее потере. Рефлюкс выше третьей степени практически не излечивается самостоятельно. При первой-второй степени рефлюксы зачастую лечат консервативно, применяя активную тактику принудительных мочеиспусканий, общее лечение и защиту от инфекций. Также, рефлюкс стараются быстро прооперировать даже на 1-2 стадии, если при нем часто возникают рецидивы пиелонефритов. По возможности не делают операций полостных, отдавая предпочтение эндоскопии.
«Как поможет операция?» – ответ на этот вопрос проще, во время операции в области соединения мочеточника с мочевым пузырем делают особый канал, который за счет наполнения мочевого пузыря и растяжения его стенок как бы захлопывает выход в мочеточник и не дает моче забрасываться назад. Сделать это можно открытым доступом – снаружи пузыря, при классической операции, и эндоскопически – изнутри пузыря, при проведении цистоскопического вмешательства. Естественно, у классической операции много недостатков, но при этом эффективность метода достигает 98%. Основными сложностями операции являются обширные разрезы и травмирование тканей, действие длительного наркоза и длительное восстановление после операции в клинике, если же требуется несколько операций – каждая последующая затруднена из-за швов.
При эндоскопическом лечении происходит манипуляция внутри пузыря, без разрезов со стороны передней брюшной стенки. В выходной отдел мочеточника вводят особую пасту или белок коллаген, из него формируют особую выпуклость, которая при растяжении пузыря будет играть роль клапана. Эту процедуру делают под кратковременным и более безопасным масочным или внутривенным наркозом, используются современные аппараты и оборудование. В среднем операция длится около 15 минут плюс примерно до трех часов на выход из наркоза и приход в себя, выписка происходит через два-три дня, после контрольных анализов. Проводят профилактику инфекции антибиотиками и затем наблюдают полгода, обычно все проходит гладко.
Но выбор методики зависит от хирургов и степени рефлюкса – при начальных стадиях вполне подойдет эндоскопия, а вот в запущенных случаях больше подойдет полостная операция, так как необходима будет пластика мочеточника и оценка состояния почки как говорится «по факту», путем визуального осмотра и прощупывания.
В подавляющем большинстве случаев рефлюкс у детей устраним и излечим еще в раннем детстве, и к взрослому состоянию ребенок уже и не помнит о том, что у него когда-то были проблемы.
источник
Лечение. Неоперативное лечение ПМР эффективно в большинстве случаев (табл. 52-9) и состоит из четырех этапов: (1) диагностика, (2) профилактика инфекции, (3) лечение функциональных нарушений мочеиспускания и (4) наблюдение за больным. Диагностика была описана выше.
Следует подчеркнуть, что при ПМР абсолютно необходимо исключить функциональные нарушения мочеиспускания и обструкцию выходного отдела мочевого пузыря, а при их выявлении проводить соответствующее лечение. Пациенты, у которых есть подозрения на непроизвольные сокращения детрузора, должны получать супрессивную терапию.
С этой целью в большинстве случаев мы применяем у детей оксибутинин (oxybutynin hydrochloride). Нейровезикальная дисфункция с задержками мочи может потребовать периодической катетеризации мочевого пузыря. Достаточная гидратация, гигиена промежности и лечение заболеваний кишечника имеют у этих больных решающее значение. За исключением мальчиков старшего возраста с низкой степенью рефлюкса, большинство детей требуют антибиотикотерапии (см. табл. 52-5).
Как только разработан план консервативного лечения, больной должен быть поставлен на учет под длительное наблюдение, которое включает в себя прежде всего периодические посевы мочи. Лучевые методы обследования применяют каждые 6—12 месяцев, в зависимости от сроков установления диагноза и характера течения заболевания. При этом особое внимание следует обращать на рост почки и фокальное образование рубцов. Микционную цистоуретрографию производят ежегодно. Контролируют также рост и развитие ребенка, состояние функции почек и кровяное давление (см. табл. 52-9).
Выше подчеркивалось значение уродинамического обследования. Необходимость в цистоскопии возникает редко, если не считать тех больных, у которых планируется хирургическое лечение. Перед антирефлюксными операциями необходимо сделать цистоскопию, чтобы исключить воспаление уротелия и установить характер, положение и число устьев мочеточников.
В других ситуациях цистоскопия обычно производится лишь в сомнительных случаях для того, чтобы убедиться в целесообразности проведения именно консервативного лечения. Ценную информацию позволяет получить цистоскопия у больных, имеющих показания к хирургическому лечению, такие как ИМТ с прорывом гнойника, но без фебрильной лихорадки, наличие ко времени первых клинических проявлений уже значительного поражения почки, IV и V степени рефлюкса, пубертатный возраст и отсутствие эффекта от лечения, проводившегося в течение 4 лет.
Выявление при эндоскопии необратимых изменений в области устьев говорит о необходимости антирефлюксной операции. Если же состояние устьев позволяет предполагать благоприятный прогноз, то показано консервативное лечение.
В таблице 52-10 представлены показания к антирефлюксным операциям. Принятие решения об оперативном лечении должно быть строго индивидуальным. Высокая степень рефлюкса, сохраняющегося после 4 лет консервативного лечения, требует хирургического лечения.
Следующие принципы лежат в основе антирефлюксных реконструктивных операций: (1) тщательное выделение и мобилизация мочеточника, (2) очень скрупулезное сохранение кровоснабжения, (3) создание длинного свободного туннеля. Обычно соотношение длины туннеля и диаметра мочеточника должно составлять или превышать 5:1. Указанные цели могут быть достигнуты различными способами (рис. 52-15).
Основные и наиболее существенные различия между применяющимися при ПМР оперативными вмешательствами касаются следующих аспектов:
(1) создается или нет анастомоз мочеточника,
(2) характер ушивания детрузора, (3) характер ушивания уротелия, (4) формируется ли новое устье путем разреза (соответствующего размера) детрузора или ушивания его вокруг мочеточника.
Создание уретерального анастомоза увеличивает риск послеоперационной обструкции, в то время как ушивание детрузора увеличивает риск образования дивертикула. В таблице 52-11 отражены достоинства и недостатки некоторых антирефлюксных операций. Три наиболее распространенных метода, применяющихся в качестве первичного вмешательства при ПМР, представлены на рисунках от 52-16 до 52-18.
В таблице 52-12 отражена эффективность хирургических вмешательств. Большинство открытых операций дают прекрасные результаты. Хотя при эндоскопической коррекции процент успешных вмешательств ниже, зато частота осложнений меньше.
Осложнения при этом (образование грануломы и т. д.) обычно связаны со свойствами инъецируемого коллагена или силиконовой пасты. Кроме того, эндоскопическая коррекция рефлюкса требует, по сравнению с открытыми хирургическими вмешательствами, более длительного пребывания в стационаре, большего количества анестетиков и более частого применения МЦУР.
Мы отдаем предпочтение экстравезикальной детрузорорафии. Поскольку при этом просвет мочевого пузыря не вскрывается, то нет и послеоперационной гематурии, спазм мочевого пузыря минимальный, и длительность пребывания в стационаре небольшая. Мы не используем ни мочеточниковые стенты, ни надлобковые трубки. Катетер Фолея удаляется на 3-й день, а дренаж в тот же день несколько позже, и больной сразу выписывается из стационара.
Осложнения после реимплантации мочеточника возникают редко и обычно связаны с техническим выполнением вмешательства. К ним относятся: обструкция мочеточника, сохранение рефлюкса и образование дивертикула. Сохранение рефлюкса может быть обусловлено недостаточной длиной туннеля по отношению к диаметру мочеточника. Однако наибольший риск послеоперационного рефлюкса связан с высоким динамическим микционным давлением, обусловленным непроизвольным сокращением мочевого пузыря, детрузорно-сфинктерной диссинергией и задержкой мочи.
Обструкция мочеточника может возникать в результате его изгиба (в новом устье или из-за сдавления облитерированной пупочной артерией), слишком высокого расположения или узости нового устья, перекрута, стриктуры анастомоза, деваскуляризации и создания «тесного» туннеля. Если тщательно избегать технических интраоперационных ошибок и разумно выбирать метод вмешательства, ориентируясь на операции, сопровождающиеся наименьшим числом осложнений, то следует признать, что реимплантация мочеточника остается до настоящего времени наиболее безопасным и высокоэффективным методом.
источник
Пузырно-мочеточниковый рефлюкс (ПМР) — это ретроградный ток (заброс) мочи из мочевого пузыря в мочеточник. ПМР воздействует отрицательно на почку, создавая условия для активизации инфекции мочевых путей и хронического пиелонефрита, а также вызывает патологические изменения ткани почки со снижением её функции — рефлюкс нефропатию.
Моча, образуясь в ткани почки, далее попадает в почечную лоханку, из лоханки — в мочеточник, из мочеточника — в мочевой пузырь. В мочевом пузыря моча накапливается (фаза накопления мочи), и при сокращении мочевого пузыря выводится наружу через мочеиспускательный канал (фаза изгнания мочи).В норме, моча течёт только в направлении «от почки к мочеиспускательному каналу», что обеспечивается волнообразными сокращениями мышечных волокон лоханки и мочеточника, и наличием функционального клапана в месте впадения мочеточника в мочевой пузырь. Пузырно-мочеточниковый рефлюкс — заболевание, при котором ток мочи приобретает обратное направление, вследствие несостоятельности клапанного механизма пузырно-мочеточникового сегмента, т.е. моча забрасывается в мочеточник в фазу накопления мочи (пассивный рефлюкс), в фазу изгнания мочи (активный рефлюкс) или в обе фазы (смешанный рефлюкс).
Синонимами термина «пузырно-мочеточниковый рефлюкс» являются: пузырно-почечный рефлюкс и пузырно-лоханочный рефлюкс.
Основной опасностью существования пузырно-мочетоикового рефлюкса (ПМР) является рецидивирующая инфекция мочевыхпутей и рефлюкс- нефропатия, приводящие к ухудшению функции почки, или даже, в тяжёлых случаях, к потере функции почки.
Под термином «рефлюкс-нефропатия» понимают комплекс склеротических изменений в структуре почки, приводящих к замещению паренхимы почки — патологической соединительной тканью,неспособной выполнять почечную функцию.
Наиболее частым проявлением пузырно-мочеточникового рефлюкса является инфекция мочевых путей, в виде:
- лейкоцитурии (увеличение количества лейкоцитов в анализе мочи)
- пиелонефрита (повышение температуры тела, недомогание, увеличение количества лейкоцитов в анализе мочи, иногда боли в поясничной области)
Если у ребёнка любого возраста отмечается устойчивое увеличение количества лейкоцитов в анализе мочи — первое состояние, которое нужно диагностировать — ПУЗЫРНО-МОЧЕТОЧНИКОВЫЙ РЕФЛЮКС.
На первом этапе диагностики выполняется ультразвуковое исследование почек, мочеточников и мочевого пузыря. При расширении лоханки почки и мочеточника может быть заподозрен пузырно-мочеточниковый рефлюкс. При наличии признаков истончения паренхимы почек — требуется проведение дополнительного исслеования — ультразвуковой допплерографии почек. УЗДГ почек позволит выявить признаки рефлюкс-нефропатии.
Так же на начальном диагностическом этапе выявляются варианты дисфункции мочевого пузыря, которые могут быть причиной и(или) усугублять течение пузырно-мочеточникового рефлюкса, путём регистрации ритма спонтанных мочеиспуканий, выполнения УЗИ с полным и опорожнённым мочевым пузырём, функциональных исследований мочевого пузыря в случае необходимости.
Основным способом диагностики ПМР является микционная цистография.
Микционная цистография заключается в введении раствора, содержащего контрастное вещество в мочевой пузырь (через катетер) и выполнении рентгеновских снимков до и во время мочеиспускания. Если отмечен заброс контрастного вещества в мочеточник и лоханку почки — диагностируется ПУЗЫРНО-МОЧЕТОЧНИКОВЫЙ РЕФЛЮКС.
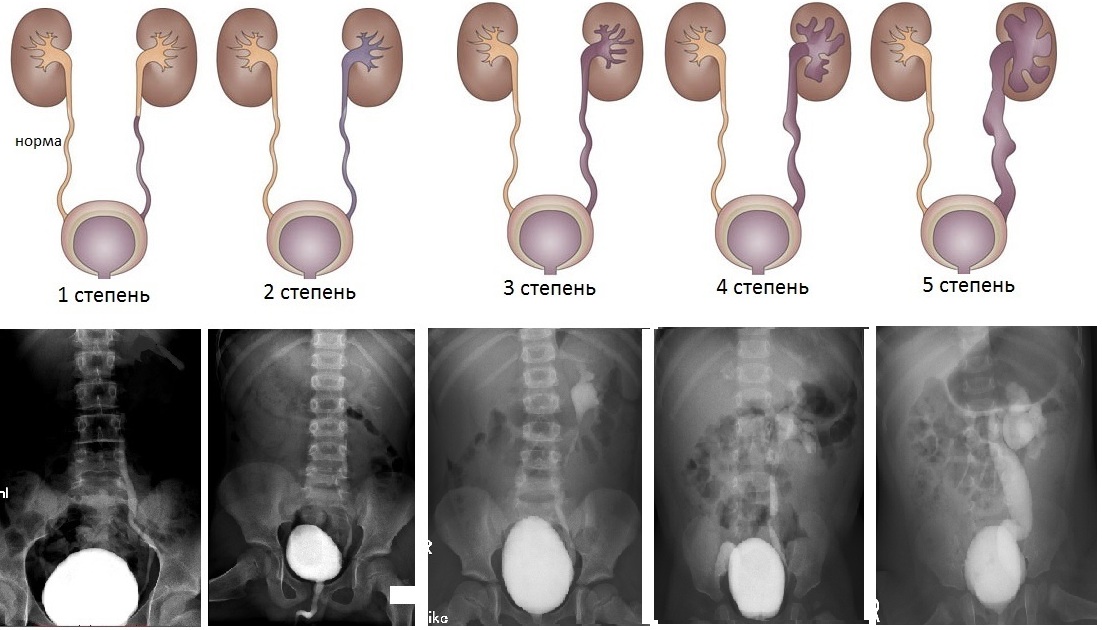
В зависимости от уровня ретроградного заброса контрастноговещества на цистографии и сопутствующих изменений размеров мочеточника и почечной лоханки разделяют 5 степеней ПМР (внутренняя ссылка):
- 1 степень — на цистографии контрастируется только нерасширенный мочеточник;
- 2 степень — контрастируется мочеточник и почечная лоханка, не расширены;
- 3 степень — мочеточник и лоханка незначительно расширены;
- 4 степень — контраст определяеся в умеренно извитом, расширенном мочеточнике и расширенной почечной лоханке;
- 5 степень — контрастируется коленообразно извитой, расширенный мочеточник и расширенная коллекторная система почки.
В ряде случаев, с целью исключения сопутствующих пороков верхних мочевых путей необходимо выполнение экскреторной урографии (введения контрастного вещества внутривенно и последующим выполнением серии рентгеновских снимков, с целью визуализации структуры лоханки почки и мочеточника и для выявления нарушения эвакуации контрастного вещества из верхних мочевых путей).
С целью оценки функции почек и выраженности рефлюкс-нефропатии выполняется радиоизотопное исследование почек — статическая нефросцинтиграфия.
Цистоскопия — инструментальное исследование, которое выполняется на этапе выбора тактики лечения. Технология выполнения цистоскопии: Через мочеиспускательный канал в полость мочевого пузыря вводится ЦИСТОСКОП — оптический прибор, имеющий вид стержня — трубки, диаметром от 1,2 до 4 мм (подбирается в зависимости от возраста), подключённый к видеокамере и экрану. Через цистоскоп осматривается полость мочевого пузыря, слизистая и устья мочеточников — отверстия, которыми открываются мочеточники в полость мочевого пузыря. Визуальная анатомия устьев мочеточников оказывает влияние на выбор тактики лечения пузырно-мочеточникового рефлюкса.
На выбор тактики лечения оказывает влияние степень рефлюкса, активность инфекции мочевых путей (как часто возникают изменения в анализе мочи и(или)обострение пиелонефрита), выраженность признаков рефлюкс-нефропатии и цистоскопическая анатомия устьев мочеточников.
При первой и второй степени рефлюкса показана консервативная терапия (средства направленные на профилактику инфекции мочевых путей, на улучшение трофики мочевого пузыря, физиотерапия). Только при неэффективности терапии и персистенции инфекции мочевых путей рассматривается вопрос об эндоскопической инъекционной коррекции ПМР.
При третьей степени рефлюкса частота перехода от консервативной терапии к инъекционной коррекции выше. У части пациентов с прогрессирующей нефропатией, рецидивирующей инфекцией мочевых путей и нарушением эндоскопической анатомии устьев мочеточников целесообразно выполнение хирургического вмешательства для ликвидации ретроградного заброса мочи — антирефлюксной операции — реимплантации мочеточников.
При четвёртой и пятой степени рефлюкса эффективность эндоскопической инъекционной коррекции существенно ниже, чем при меньших степенях и используется ограниченно, при невыраженных нарушениях эндоскопической анатомии устьев мочеточников. Наибольшее значение при высоких степенях ПМР приобретают варианты оперативного лечения — антирефлюксные операции Лич-Грегуара, Политано-Леадбеттера, Коэна, Барри.
Эндоскопическая инъекционная коррекция пузырно мочеточникового рефлюкса заключается в введении гелевого импланта через специальную иглу в область устья мочеточника во время цистоскопии.
Введённый имплант формирует «бугорок», который при отсутствии выраженных изменений анатомии устья обеспечивает «функциональный клапан» и препятствует забросу мочи из мочевого пузыря в мочеточник.
Существуют различные типы имплантов — биодеградируемые (рассасывающиеся), частично биодеградируемые и небиодеградируемые (нерассасывающиеся). При выборе импланта специалист руководствуется множеством различных факторов — активностью инфекции, возрастом, степенью рефлюкса, анатомией устьев — и осуществляет его (выбор) индивидуально дифференцированно.
Оперативное лечение пузырно-мочеточникового рефлюкса сохраняет свою актуальность для высоких степеней ПМР и в случае неудачных эндоскопических инъекционных коррекций, заключается в реимплантации мочеточников в мочевой пузырь с хирургическим формированием антирефлюксного механизма.
Предложено множество открытых оперативных методик формирования антирефлюксного механизма через разрез передней брюшной стенки и мочевого пузыря. Самые распространённые и часто используемые: уретероцистонеоимплантации по Коэну (Cohen), Лич-Грегуару (Lich-Gregoir), Политано-Леадбеттеру (Politano-Leadbetter), Барри (Barry).
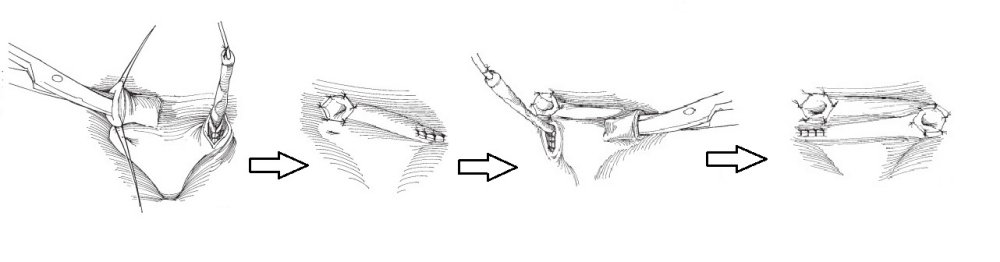
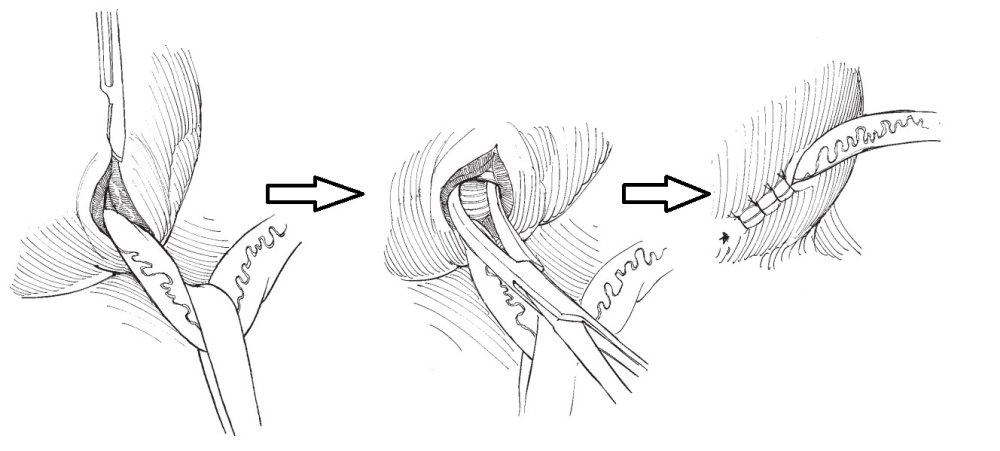
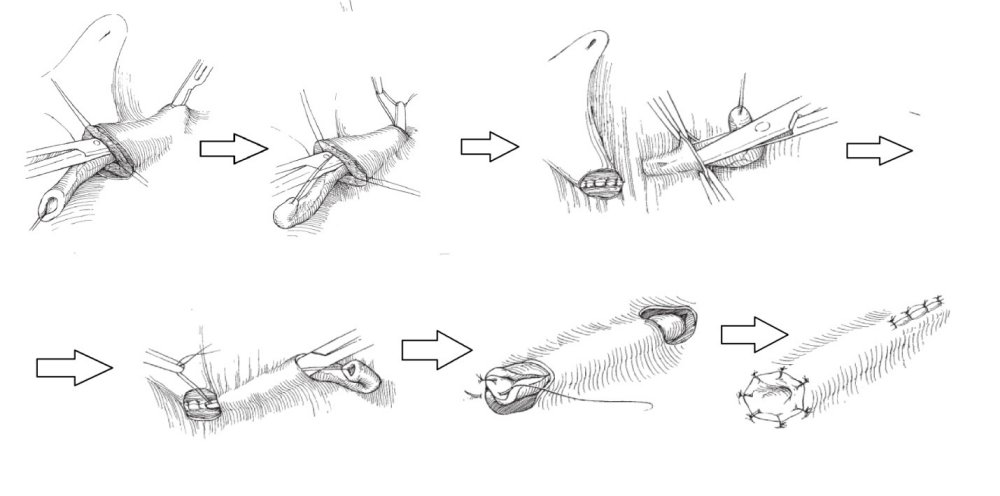
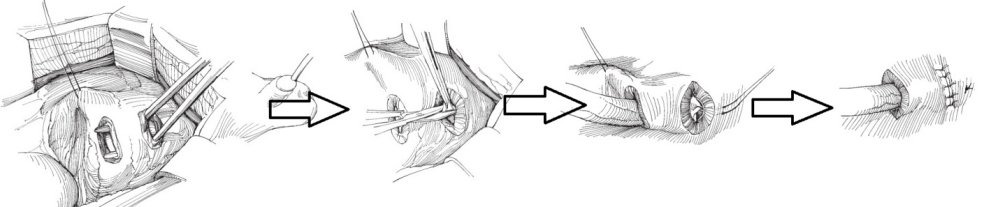
С ними Вы можете подробнее ознакомиться в любом руководстве по урологии. В нашей статье мы опишем своё «ноу-хау» — модификации открытых методик, которые мы выполняем лапароскопически или везикоскопически — через проколы передней брюшной стенки и мочевого пузыря, без больших разрезов, малотравматически.
Везикоскопическая уретроцистонеоимплантация по Коэну (Cohen). Выполняется в нашем отделении при высоких степенях рефлюкса с нарушением анатомии устья мочеточника, в том числе после неудачных инъекционных эндоскопических коррекций.
Через 3 прокола передней брюшной стенки в полость мочевого пузыря вводится лапароскоп и два эндоскопических инструмента. Мочеточник мобилизовывается в полости мочевого пузыря, затем формируется подслизистый тоннель в поперечном направлении. Длина тоннеля, согласно классическим представлениям, подтвердившим свою эффективность должна быть в 4 раза больше диаметра мочеточника. Мобилизованный отдел мочеточника перемещается в подслизистый тоннель. Неоустье (новое устье) фиксируется по окружности мочеточника 5-6 узловыми швами тонкой, саморассасывающейся нитью на атравматичной игле. Затем ушиваются оставшиеся дефекты слизистой мочевого пузыря, троакары удаляются.
Лапароскопическая операция выгодно отличается ототкрытой более лёгким протеканием послеоперационного периода, отличным косметическим эффектом (нет разреза) и более быстрой выпиской из стационара (5-8 дней).
Лапароскопическая операция Лич-Грегуара (Lich-Greoir). Выполняется в нашем отделении при 3 и 4 степени рефлюкса при неэффективности эндоскопических коррекций, типичной локализации устья мочеточника, когда требуется создание дополнительной антирефлюксной защиты.методика применяется преимущественно у мальчиков (у девочек расположение матки и её кровеносных сосудов может препятствовать применению способа).
Через три троакара в брюшную полость вводится лапароскоп и два эндоскопических инструмента. Мобилизуется дистальный отдел мочеточника, рассекается мышечный слой мочевого пузыря. На слизистую мочевого пузыря укладывавется мочеточник и над ним сшивается рассечённый мышечный слой мочевого пузыря — формируется антирефлюксный механизм.
Лапароскопическая модификация операция Политано-Леадбеттера подразумевает под собой сохранение направления хода мочеточника по направлению к шейке мочевого пузыря. Это делает её предпочтительной у пациентов с мочекаменной болезнью в анамнезе, так как предоставляет возможность для эндоскопического удаления или дробления камней в просвете мочеточника. В мочевой пузырь через переднюю брюшную стенку устанавливаются 3 троакара, мочеточник мобилизовывается внутрипузырно. Слизистая мочевого пузыря рассекается по направлению к шейке мочевого пузыря. На мышечный слой укладывается мочеточник, швами фиксируется устье, рассечённая слизистая мочевого пузыря сшивается над мочеточником — формируется антирефлюксная защита.
Лапароскопическая экстравезикальная уретероцистонеоимплантация (модификация операции Barry) незаменима при необходимости изолированной реимплантации рефлюксирующего мочеточника нижнего сегмента при удвоении почек. Методика предотвращает травматизацию мочеточника верхнего, неповреждённого сегмента.
В брюшную полость устанавливаются три тоакара, над дистальными отделами удвоенных мочеточников вскрывается брюшина и порочный мочеточник нижнего сегмента отделяется от нормального мочеточника верхнего сегмента. Со стороны брюшной полости мышечный слой мочевого пузыря рассекается в поперечном направлении до слизистой. В сформированное ложе укладывается дистальный отдел мочеточника, перфорируется слизистая, узловыми швами формируется устье, а мышечный слой сшивается над мочеточником — создаётся антирефлюксный механизм.
Все описанные оперативные методики являются ультрасовременными, и освоены далеко не во всех клиниках России и стран развитого капитализма. В нашем отделении выполнено более 30 подобных операций. Какую методику применить в конкретном случае мы каждый раз решаем коллегиально, оценивая данные обследования и все необходимые аспекты описанные Выше. На момент публикации этого текста у наших пациентов, перенёсших лапароскопические или везикоскопические антирефлюксные операции по поводу пузырно-мочеточникового рефлюкса РЕЦИДИВОВ или других осложнений, характерных для открытых методик, НЕТ.
Дети быстрее восстанавливаются, болевой синдром минимален, соответственно выписываются домой раньше.
Отделение плановой хирургии и урологии андрологии
Морозовская детская городская клиническая больница
Москва, 2014
источник
