Лабораторные инструменты, иглы, капилляры, предметные стекла, пробирки, меланжеры, счетные камеры, кюветы фотоэлектрометра, пипетки, наконечники, резиновые груши, баллоны и т.д., посуда после каждого использования должны подвергаться дезинфекции.
Использованные изделия промываются в ёмкости с водой. Промывные воды обеззараживаются кипячением в течение 30 минут или засыпают сухой хлорной известью, известью белильной термостойкой, нейтральным гипохлоритом кальция (НГК) в соотношении 200 г на 1 л воды, перемешивают и обеззараживают в течение 60 минут. Промытые изделия кипят в закрытой емкости в воде в течение 30 минут, или в 2% растворе соды, дальнейшая предстерилизационная очистка не проводится.
Лабораторные инструменты могут быть обеззаражены погружением в раствор с дезинфицирующим раствором.
| Основные характеристики различных групп дезинфицирующих средств [4] |
 |
Время обеззараживания – см. инструкцию.
Дезинфицирующие растворы используются однократно.
Емкости для проведения дезинфекции должны быть чётко маркированы, иметь крышки.
При дезинфекции изделий, имеющих внутренние каналы, растворы дезинфицирующего средства в объёме 5-10 мл пропускают через канал с помощью груши для удаления остатков крови, сыворотки и др., после чего изделия полностью погружают в дезинфицирующий раствор во вторую ёмкость.
При погружении инструментов в горизонтальном положении полости каждого инструмента должны быть заполнены дезинфицирующим раствором.
Каждая партия сухих хлорсодержащих дезинфектантов перед использованием должна подвергаться контролю на содержание активного хлора.
Посуда, соприкасающаяся с кровью или сывороткой и не предназначенная для последующего контакта с обследуемым после дезинфекции промывается под проточной водой для полного удаления дезинфектанта и проходит необходимую технологическую обработку.
Ёмкости кювет-анализатора ФП, кюветы измерительной аппаратуры, пластиковые пробирки и т.д. обеззараживаются только 6% раствором перекиси водорода и промываются проточной водой.
С предметных стёкол с фиксированным и окрашенным мазком крови после проведения микроскопии удаляются остатки иммерсионного масла, стёкла кипятятся в мыльном растворе не менее 15 минут до полного отхождения краски, затем промываются под проточной водой, подсушиваются на воздухе и протираются.
Остатки крови, мочи, спинномозговой жидкости и т.п., пробы, содержащие разведенную сыворотку без добавления кислот, щелочей сливают в специальную тару и обеззараживают сухой хлорной известью, известью белильной термостойкой, нейтральным гипохлоритом кальция в соотношении 1:5 в течение часа. При удалении сгустков следует предварительно отделить материал металлическим шпателем, который затем обеззараживается. Посуда из-под мочи, кала обрабатывается по описанной выше методике, но может не подвергаться стерилизации.
При загрязнении кровью или секретами мебели, инвентаря, приборов их следует немедленно дважды протереть ветошью, ватными или марлевыми тампонами, обильно смоченными дезинфицирующими растворами.
Использованную ветошь сбрасывают в специально выделенную ёмкость с дезраствором, маркированную: «Для дезинфекции использованной ветоши».
При загрязнении кровью или секретами спец. одежды, её снимают, предварительно обработав дезраствором участок загрязнения.
Для санитарной обработки помещений КДЛ можно применять только те дезинфицирующие средства, которые официально разрешены Департаментом госсанэпиднадзора Минздрава России, зарегистрированы в Бюро по регистрации лекарственных средств и имеют свидетельство о государственной регистрации, сертификат соответствия и методические указания по применению, утвержденные Департаментом госсанэпиднадзора Минздрава России.
Средства для дезинфекции поверхностей в помещениях КДЛ должны соответствовать следующим требованиям:
1. Обеспечивать гибель возбудителей внутрибольничных инфекций: бактерий, вирусов, грибов — при комнатной температуре;
2. Обладать моющими свойствами или хорошо совмещаться с моющими средствами;
3. Иметь относительно низкую токсичность (4-3 класс опасности) и быть безвредными для окружающей среды;
4. Быть совместимыми с различными видами материалов (не портить обрабатываемые поверхности);
5. Быть стабильными, неогнеопасными, простыми в обращении;
6. Не оказывать фиксирующего действия на органические загрязнения.
В настоящее время в России разрешены к применению 242 средства дезинфекции из различных химических групп, отличающиеся физико-химическими свойствами (форма применения, растворимость, стабильность, наличие моющего действия, значение рН растворов и т.д.), специфической биологической (антимикробной) активностью, токсичностью, назначением, сферой применения. Для достижения противоэпидемического эффекта дезинфекционного мероприятия необходимо правильно выбрать дезинфицирующее средство, соответствующее поставленной задаче. Для этого медицинский персонал должен хорошо знать основные свойства и особенности конкретных дезинфицирующих средств.
Анализ свойств современных дезинфицирующих средств, проведенный в соответствии с перечисленными критериями, показал, что для проведения дезинфекции поверхностей в помещениях КДЛ пригодны, в первую очередь, средства, относящиеся к группе катионных ПАВ (четвертичные аммониевые соединения, третичные амины, производные гуанидинов) и композиции на их основе. Приемлемо применение хлорактивных и кислородактивных средств при наличии у них моющих свойств или при возможности добавления к ним моющих средств непосредственно перед их использованием. Дезинфицирующие средства из других химических групп по тем или иным причинам для обработки поверхностей в помещениях менее пригодны.
Порядок проведения санитарной обработки поверхностей в помещениях (пол, стены, двери и др., жесткая мебель, поверхности аппаратов, приборов, оборудования и т.д.), необходимость использования моющих или дезинфицирующих средств, частота проведения обработок зависят от профиля КДЛ и функционального назначения конкретного помещения.
В помещениях КДЛ любого профиля, в соответствии с действующими нормативными документами, два раза в сутки проводится влажная уборка с применением моющих или моюще-дезинфицирующих средств.
Генеральная уборка диагностических лабораториях проводится 1 раз в неделю, в ванных комнатах, туалетах, подсобных и вспомогательных помещениях — 1 раз в 10-15 дней.
Прежде, чем приступить к работе, медицинский персонал, проводящий обработку, должен внимательно изучить методические указания по применению выбранного конкретного средства, обращая внимание на спектр антимикробного действия (обеспечит ли средство гибель имеющегося на поверхностях микроорганизма), параметры токсичности (можно ли применять средство в присутствии больных, какие использовать меры предосторожности при работе с ним и т.д.), обладает ли средство моющим действием, а также имеющиеся характерные особенности средства.
Растворы дезинфицирующих средств готовят в специальном помещении, оборудованном приточно-вытяжной вентиляцией или в вытяжном шкафу. Персонал, готовящий раствор, должен работать в спецодежде: халат, шапочка, марлевая повязка, резиновые перчатки, а если есть указания, то и респиратор определенной марки и защитные очки.
Растворы дезинфицирующих средств готовят путем смешивания дезинфицирующего средства с водопроводной водой в специальной технической посуде (емкости). Если средство обладает коррозионной активностью (хлорактивные, кислородактивные средства), для рабочих растворов используют емкости из коррозионностойкого материала (пластик, стекло, эмаль без повреждения). Более удобны для применения градуированные емкости, позволяющие дозировать смешиваемые ингредиенты. Необходимое для приготовления рабочего раствора количество дезинфицирующего средства в виде порошка взвешивают на весах или пользуются специальными мерными ложками, которые прилагаются к упаковке средства. Дезинфицирующие средства в виде водных или спиртовых концентратов для приготовления раствора отмеряют с помощью мерного градуированного стакана, пипетки или шприца. Иногда дезинфицирующие средства выпускаются во флаконах с вмонтированной в них или съемной (в виде второй крышки-колпачка) мерной емкостью или в емкостях с насосом.
Для получения нужной концентрации при приготовлении рабочего раствора важно соблюдать рекомендованное соотношение средства и воды (см. Методические указания по применению конкретного средства). Обычно при приготовлении рабочего раствора сначала в емкость наливают требуемое количество воды, затем добавляют к ней дезинфицирующее средство, размешивают и закрывают крышкой до полного растворения. Наиболее удобно готовить рабочие растворы дезинфицирующих средств, производимых в форме таблеток или в разовых упаковках.
В зависимости от химической природы рабочие растворы некоторых средств могут быть приготовлены впрок и храниться в закрытой емкости в специальном помещении до применения определенное время (сутки и более), другие должны быть использованы сразу после приготовления.
Поверхности в помещениях (пол, стены, двери и т.д.), жесткую мебель, поверхности аппаратов, приборов обеззараживают способом протирания ветошью, смоченной в растворе дезинфицирующего средства или способом орошения.
Для обработки поверхностей в помещениях КДЛ более приемлем способ протирания, позволяющий сочетать процесс дезинфекции с мытьем объекта. Для этих целей целесообразно использовать средства, обладающие наряду с антимикробными также моющими свойствами. Для дезинфекции небольших, трудно доступных поверхностей, а также для экстренной обработки небольших по площади поверхностей применяют дезинфицирующие средства способом распыления с помощью ручного распылителя типа «Росинка» или средства в аэрозольной упаковке. При необходимости проведения заключительной дезинфекции в КДЛ, при перепрофилировании кабинета, иногда при проведении генеральных уборок поверхности обрабатывают способом орошения из гидропульта или другого распыляющего устройства, позволяющего обработать помещение большого объема. При использовании для дезинфекции способа орошения медицинский персонал должен строго соблюдать все рекомендуемые меры предосторожности: защитную одежду, респиратор, защитные очки, резиновые перчатки. Такую обработку следует проводить в отсутствие больных.
Воздух и дополнительно поверхности в помещениях КДЛ обеззараживают ультрафиолетовым облучением с помощью бактерицидных облучателей, которые по месту расположения могут быть потолочными, настенными и передвижными, а по конструкции — открытого (применяют в отсутствие больных), закрытого (возможно применение в присутствии людей) и комбинированного типа. Разновидностью закрытого облучателя являются рециркуляторы воздуха с естественным или принудительным прохождением потока воздуха через камеру, внутри которой расположены бактерицидные облучатели, рекомендованные для непрерывного режима облучения в помещениях с постоянным пребыванием людей и высокими требованиями асептики. Режим дезинфекции зависит от мощности облучателя, объема помещения, критериев эффективности его обеззараживания, связанных с его функциональным назначением и определяется в соответствии с «Методическими указаниями по применению бактерицидных ламп для обеззараживания воздуха и поверхностей» №11-16/03-06, утвержденными Минздравмедпромом РФ 28.02.95 г.
Санитарно-техническое оборудование протирают ветошью или чистят щетками (ершами), смоченными в дезинфицирующем растворе или используют чистяще-дезинфицирующие средства в виде порошка, пасты, геля или другой готовой формы, рекомендованные для этих целей и обладающие наряду с дезинфицирующими свойствами хорошими потребительскими качествами (моющими, отбеливающими, чистящими, дезодорирующими). Чаще всего это хлорактивные или кислородсодержащие средства.
Уборочный инвентарь: ветошь, салфетки, губки, мочалки и т.д. — после уборки помещения и обработки объектов замачивают в дезинфицирующем растворе, по истечении экспозиции стирают или моют, прополаскивают водопроводной водой, высушивают и хранят в определенном месте. Использованные ветошь, салфетки и т.д. можно продезинфицировать также способом кипячения. Емкости, из которых производилась обработка помещений, освобождают от использованного дезинфицирующего раствора, моют и высушивают. Ерши, щетки замачивают в дезинфицирующем растворе на определенный срок, после чего споласкивают водопроводной водой. Все средства для уборки помещений должны находиться в отдельной комнате, каждое на своем, для него отведенном месте, и быть промаркированы в соответствии с тем, для обработки какого объекта и какого помещения они предназначены. Для каждого помещения и для отдельных объектов должен быть отдельный уборочный инвентарь.
Генеральные уборки в КДЛ проводятся в соответствии с планом-графиком. В каждом подразделении должно быть определенное количество наборов уборочного инвентаря, в зависимости от числа помещений, в которых должна проводиться уборка. Генеральную уборку проводят в отсутствие больных при открытых фрамугах. Сначала из помещения удаляют мусор и медицинские отходы, собранные в контейнеры. Мебель отодвигают от стен. Тщательно моют стены, двери и т.д., уделяя особое внимание выключателям, дверным ручкам, замкам. Ветошью, смоченной в дезинфицирующем растворе, протирают светильники, арматуру, отопительные батареи, мебель, поверхности аппаратов, приборов, освобождая их от пыли. Один раз в месяц моют изнутри окна (снаружи окна моют 1 раз в полгода). Заканчивают уборку мытьем пола, начиная из дальнего конца комнаты, тщательно вымывая углы, плинтуса и пол около них по всему периметру комнаты, затем моют ее центральную часть. В помещениях, требующих особо строгого соблюдения правил асептики после влажной уборки включают ультрафиолетовые облучатели (время облучения устанавливается в зависимости от различных факторов в соответствии с действующими методическими указаниями — см. выше). Если поверхности в помещениях обрабатывали способом орошения, по истечении дезинфекционной выдержки проводится влажная уборка.
При санитарной обработке КДЛ возможно также использование препаратов для обеззараживания воздуха. Таких как:
Триэтиленгликоль. Аэрозоль получают путем испарения триэтиленгликоля с металлических лотков (размер 20-15 см) при слабом подогреве (с помощью электрической плитки или горелки, помещенных под лотком на расстоянии 20-30 см). Испарение производят в течение 20-40 минут, за сутки до помещения больного в палату. Расход дезинфицирующего вещества 0,1 г на 1 куб.м воздуха.
Концентрированная пищевая молочная кислота. Испарение молочной кислоты производят в течение 20 минут, из расчета 0,01-0,015 мл на 1 куб.м воздуха с поверхности кружочка фильтровальной бумаги, положенного на кольцо
бунзеновского штатива над электрической плиткой на расстоянии 20 см (молочная кислота наносится на фильтровальную бумагу пипеткой).
Раствор перекиси водорода в 0,5% молочной кислоте. Распыление производят в течение 40-50 минут с помощью специальных аэрозольных генераторов или пульверизаторов, пылесоса со специальной насадкой (величина отверстия 0,3-0,5 мм). Расход дезинфицирующего раствора 5 мл на 1 куб.м воздуха.
Примечание: Обеззараживание воздуха палат раствором 3% перекиси водорода с 0,5% молочной кислотой можно проводить как накануне до помещения больного в палату, так и за 2 часа.
Распыление аэрозольного баллона «Букет» производят при расходе аэрозольной смеси 5 г на 1 куб. м воздуха.
Стирка спецодежды на дому категорически запрещается. Смена спецодежды должна осуществляться не менее 2 раз в неделю.
Перчатки после окончания работы обеззараживаются погружением в 3% раствор хлорамина или 6% раствор перекиси водорода на 1 час или кипячением в течение 30 минут.
Одноразовый инструментарий (плашки, наконечники автоматических пипеток и т.д.) обеззараживаются и утилизируются в паровом стерилизаторе при 2,0 кг/см2 (1320С) – 60 минут.
источник
Все отходы деятельности лаборатории по степени эпидемиологической и токсикологической опасности подразделяются на следующие классы (СанПиН 2.1.7.2527-09, СанПин 2.1.7.728-99):
— класс А (неопасные) – отходы, не имеющие контакта с зараженными или условно зараженными ПБА I-IV групп патогенности (различная макулатура, упаковочный материал, негодная мебель, строительный мусор и др.);
— класс Б (опасные) – биологические отходы вивариев, иммуноклиник, мусор из помещений лаборатории, где не проводится работа с живыми ПБА I-IV групп патогенности, стеклянная лабораторная посуда из препараторских, стерильные отработанные ватно-марлевые материалы, бумажная макулатура из письменных комнат и др.;
— класс В (чрезвычайно опасные) – медицинские отходы из лабораторий, работающих с ПБА I-IV групп патогенности: отработанные посевы, остатки диагностического материала (сыворотки, сгустки крови, трупный материал и др.), вскрытые биопробные животные, остатки их корма, подстилочный материал от экспериментальных животных, пипетки, шприцы, тест-контроли работы автоклавов, ампулы из-под лиофилизированных культур, ватно-марлевый материал, макулатура из письменных комнат и другой отработанный материал, зараженный или подозрительный на зараженность бактериальными и вирус содержащими ПБА;
— класс Г – просроченные медицинские и иммунобиологические препараты (МИБП), питательные среды с истекшим сроком годности, химические реактивы, ртутьсодержащие предметы, приборы, оборудование.
К отходам деятельности лаборатории, в зависимости от их класса, предъявляют различные требования по обеззараживанию, сбору, временному хранению, транспортированию и утилизации.
Отходы класса А (неопасные) не требуют специального обеззараживания. Их собирают в пластиковые пакеты белого цвета, герметично закрывают и в твердых емкостях (например, баках) с крышками переносят к мусороприемнику для дальнейшего вывоза на полигон твердых бытовых отходов (ТБО).
Отходы класса Б (опасные) подвергают обязательной дезинфекции на месте их образования в соответствии с действующими нормативными документами (СП I. 3.1285-03). Обеззараженные отходы собирают в одноразовую герметичную упаковку желтого цвета. Для твердых отходов, имеющих острые края (битая стеклянная посуда, пипетки и т.п.), используют твердую упаковку, для игл от шприцов испльзуют специальные одноразовые контейнеры. Одноразовые емкости желтого цвета с отходами класса Б маркируют надписью «Опасные отходы – «Класс Б» с указанием названия лаборатории, кода учреждения, даты, фамилии ответственного за сбор отходов лица. Заполненные емкости помещают во влагонепроницаемые баки желтого цвета с той же маркировкой, герметично закрывают крышкой и переносят к металлическим контейнерам, которые размещены на специальной площадке хозяйственного двора учреждения (лаборатории). Дальнейшую утилизацию отходов проводят централизовано специальным автотранспортом на полигон ТБО или децентрализовано к месту кремации, если учреждение имеет крематорий для сжигания отходов.
Использованные для переноса (перевоза), временного хранения многоразовые емкости (баки, контейнеры) дезинфицируют и моют.
Отходы класса В (чрезвычайно опасные) подвергают обязательной дезинфекции на месте их образования в соответствии с действующими нормативными документами (СанПиН 2.1.7.2527-09, СП 1.3.1285-03; СанПин 2.1.7.728-99). Обеззараживание отходов проводят автоклавированием или обработкой дезрастворами. Эффективность работы автоклавов контролируют с помощью химических (каждый цикл автоклавирования) или биологических (ежемесячно) тестов. Путем автоклавирования обеззараживают жидкие и плотные питательные среды с посевами ПБА I-IV групп патогенности и без посевов; вскрытые ампулы из-под лиофилизированных культур (предварительно обеззараженные в дезрастворе); пробирки, флаконы, колбы с бактериальными взвесями; сыворотки; лабораторную посуду; обгоревшие ватно-марлевые пробки и другой материал, инфицированный или подозрительный на зараженность ПБА I-IV групп.
Жидкие питательные среды с посевами микроорганизмов после обеззараживания автоклавированием разводят водопроводной водой 1:2 и сбрасывают в канализацию. Рабочие растворы отработанных дезсредств после экспозиции в течение не менее 24 ч разводят водопроводной водой 1:2 и сливают в канализацию.
Лабораторные отходы класса В (из блока для работы с инфицированными животными) после обеззараживания в дезрастворах могут содержать ватные и ватно-марлевые тампоны, салфетки, вскрытые трупы мелких экспериментальных животных, трупы отловленных в природе грызунов, остатки корма и подстилочный материал из садков, где содержались лабораторные животные до и после экспериментов, шприцы, ампулы и флаконы с остатками вакцинных препаратов, сколы концов пастеровских пипеток и ампул и др.
После обеззараживания отходы класса В собирают в одноразовую упаковку красного цвета. Одноразовая упаковка может быть мягкой (пакеты) и твердой (одноразовые емкости). Каждая упаковка маркируется надписью «Чрезвычайно опасные отходы – «Класс В» с указанием названия лаборатории, кода, даты и фамилии ответственного сотрудника. Бактериальные культуры, вирусологически опасный материал, различные острые предметы, экспериментальных животных складывают в твердую герметичную упаковку, нетвердые отходы – в герметичную мягкую упаковку.
Все заполненные емкости укладывают в маркированные водонепроницаемые металлические баки (контейнеры) с плотно закрывающимися крышками и хранят до кремирования в специально отведенном месте в пределах лаборатории. Транспортирование отходов класса В для утилизации осуществляют только в закрытых кузовах специально применяемых для этих целей автомашинах, которые после вывоза подвергают спецобработке.
Подготовку обеззараженных отходов лабораторной деятельности к утилизации (сбор, упаковка, герметизация, размещение в емкости для временного хранения) осуществляет ответственное лицо из числа работников лаборатории в средствах индивидуальной защиты (противочумный костюм III типа, дополненного при необходимостиреспиратором и прорезиненным фартуком).
Отходы лаборатории класса Г по степени токсичности делятся на следующие подклассы (Сан ПиН № 4286-87, Приказ МПР РФ от 02.12.2002 г. № 786):
1 – ртуть, термометры, лампы люминесцентные
2 – масла, серная кислота, электролиты
Использованные люминесцентные лампы, ртутьсодержащие приборы собирают в закрытые влагонепроницаемые емкости черного цвета с маркировкой «Отходы – «Класс Г» и хранят в специально выделенном помещении до утилизации, которая осуществляется в соответствии с действующими нормативными документами. Если во время работы повреждена целостность ртутьсодержащих приборов или термометров и ртуть вылилась, необходимо немедленно провести демеркуризацию.
Масла, минеральные (хлорводородная, азотная, серная) и сильные органические кислоты, щелочи утилизируют согласно действующим нормативным документам.
Вакцинные, диагностические и лекарственные препараты с истекшим сроком годности после обеззараживания путем автоклавирования измельчают, помещают в пакеты черного цвета и хранят до утилизации в водонепроницаемом герметически закрытом контейнере с маркировкой «Отходы – «Класс Г». В эти же контейнеры складывают ненужную картонную упаковку в мягких одноразовых маркированных пакетах черного цвета. Вывоз этих отходов на полигон ТБО осуществляют централизованно специализированным автотранспортом.
СРЕДСТВА ЗАЩИТЫ
Основным правилом работы в режимных лабораториях является эффективная первичная изоляция персонала от ПБА, которая обеспечивается использованием одного (или более) из перечисленных средств:
– средства индивидуальной защиты (СИЗ)
– боксы биологической безопасности (БББ)
– изоляты из гибкой пленки аналогичного боксам стандарта.
Любые лабораторные манипуляции с микроорганизмами приводят к их рассеиванию в большей или меньшей степени во внешнюю среду. В связи с этим все работники микробиологических и вирусологических лабораторий, вне зависимости от их устройства и оборудования, должны применять средства индивидуальной защиты. Это предполагает использование той или иной спецодежды: противочумного костюма, пневмокостюма (типа «Антибелок»), изолирующего костюма типа К3М-1 с противогазом, пневмошлема, различных респираторов и т.п. Тип применяемой спецодежды зависит от вида ПБА, с которым ведется работа, и характера выполняемых манипуляций.
Например, при работе в стационарных, полевых или передвижных лабораториях сотрудники надевают противочумные костюмы I-IV типов, изолирующие костюмы типа К3М-1 и другие, разрешенные к применению защитные средства (рис. 1,2). В стационарных максимально изолированных лабораториях при работе с ПБА I-II групп патогенности персонал использует пневмокостюмы типа «Антибелок-5», пневмосистемы (типа ЛИЗ) или их аналоги (рис. 3,4,5). При экстремальных ситуациях (например, авариях) работники применяют аварийный комплект защитной одежды типа Л-1, «Корунд» или их аналоги с фильтрующим противогазом (рис. 1,6).
Рис.1. Костюм изолирующий с Рис. 2. Одноразовый костюм «Тайкем»
автономным обеспечением подачи воздуха
Рис.3. Защитный костюм «Кварц» Рис.4. Комбинезон защитный и панорам ная
полумаска со сменными фильтрами
Рис.5. Защитный колпак с принудительной Рис.6. Защитный костюм «Л-1»
Существуют 4 основных типа противочумных костюмов:
I тип – комбинезон (пижама), носки, тапочки, большая противочумная косынка (120 х 120 х 150 см) или капюшон, противочумный халат, ватно-марлевая маска (из марли 125 х 50 см со слоем ваты 25х17х1,5 см весом 20 г) или противопылевой респиратор, или фильтрующий противогаз, плотно прилегающие очки-консервы или полимерная пленка одноразового использования (17 х 39 см с учетом 6 см с каждой стороны для привязывания тесёмок длиной по 30 см), резиновые перчатки, сапоги резиновые или водонепроницаемые бахилы, полотенце. При необходимости (вскрытие трупов людей или крупных животных) дополнительно надеваются прорезиненные фартук, нарукавники и вторая пара перчаток.
II тип – комбинезон (пижама), носки, тапочки, большая косынка (капюшон), противочумный халат, ватно-марлевая маска (респиратор), резиновые перчатки, сапоги (водонепроницаемые бахилы), полотенце. Отличается от костюма I типа отсутствием очков.
III тип — комбинезон (пижама), носки, тапочки, большая косынка, противочумный халат, резиновые перчатки, защитная обувь (глубокие галоши, сапоги или водонепроницаемые бахилы), полотенце.
IV тип – комбинезон (пижама), носки, тапочки, шапочка (малая косынка), противочумный (хирургический) халат.
Разработан порядок надевания и снятия противочумного костюма.
К работе в пневмокостюмах допускаются только лица, не имеющие медицинских противопоказаний к ношению этого типа защитной одежды, прошедшие специальное обучение, инструктаж по правилам работы и сдавшие зачёт. На централизованном специальном участке перед использованием пневмокостюм проверяют на целостность, а комплектные к ним фильтры ТОВ (В-0,4) – на оценку коэффициента проскока и фиксируют результаты в специальном журнале. Сотрудник лаборатории получает пневмокостюм под личную роспись и визуально проверяет его на целостность перед непосредственной работой. В соответствующих инструкциях регламентируется порядок надевания-снятия пневмокостюмов и правила работы в них.
После использования пневмокостюмы обрабатывают в дезинфицирующем душе, в парагазовых передаточных камерах и затем проверяют на целостность.
Для защиты органов дыхания надевают различные респираторы. Респираторы-капюшоны положительного давления представляют собой легкий капюшон из прозрачного материала, покрывающий голову, шею и плечи. Подача воздуха осуществляется из переносных баллонов со сжатым воздухом (запас воздуха на 15-20 мин) или через шланги, связанные с небольшим компрессором с ВД (высокого давления) — фильтрами, который питается от батарей. Продолжительность их работы (6-7 ч) зависит от качества фильтров.
Маска-респиратор закрывает большую часть лица, обеспечивая надежную защиту глаз и дыхательных путей. Маска может иметь одновременно биологический фильтр системы ВД и химический патрон. Наличие химического патрона не обязательно, если респиратор применяется при биологической защите. Маска-респиратор должна плотно прилегать к лицу, чтобы обеспечить необходимую герметичность. При слабом натяжении крепящих маску лент вдыхаемый воздух минует фильтрующие элементы и снижает защитную способность маски. В помещениях, где содержание кислорода не соответствует нормативам, не разрешается применять респираторы с химическим патроном.
Полумаска-респиратор не защищает глаза, прикрывая только рот и нос. Блок с фильтрами системы ВД, размещенный сбоку маски, обеспечивает лучшую видимость, чем в случае его расположения впереди. Наличие химического фильтра-патрона в полумаске-респираторе необязательно, если нет угрозы применения ОВ.
При необходимости защитить глаза можно использовать «очки-консервы», которые должны плотно прилегать к коже в области глаз.
Если нет опасности воздушной микробной инфекции для защиты глаз от химических веществ (в виде брызг) можно рекомендовать специальные козырьки (щитки). Козырьки должны полностью закрывать лицо и при необходимости легко откидываться назад.
Большинство лабораторных манипуляций, когда смешивают, встряхивают, измельчают или центрифугируют инфицированный материал, сопровождается образованием случайных аэрозолей. Неправильная работа бактериологической петлей, пипеткой также создают целый ряд возможностей образования аэрозолей. Использование современных защитных боксов при работе с инфицированными материалами обеспечит удержание и контролируемое удаление из рабочей зоны образовавшихся аэрозолей. Выбор конструкции защитного бокса определяется степенью опасности ПБА, с которым предстоит работа.
Различают боксы с частичным удержанием микроорганизмов (боксы I и II классов) и с полным их удержанием или изолирующие боксы (III класса).
Эффективность боксов биологической безопасности (БББ) контролируется проверкой работы фильтров, определением скорости потока воздуха, надежностью общей изоляции и других инженерно-технических характеристик.
БББ I класса – это открытая спереди рабочая камера с принудительным удалением через ВД-систему отработанного воздуха. Удаляемый воздух очищается от частиц аэрозоля в предфильтре и в специальном фильтре тонкой очистки (ФТО) и выводится в центральную вытяжную систему лаборатории. Скорость движения воздуха в проёме передней панели бокса должна составлять 0,5-1,0 м/с, а высота проёма ≈ 20 см. Снижение или повышение скорости движения воздуха в проёме недопустимо.
Боксы I класса предназначены для работы с агентами низкой (микроорганизмы, которые обычно не вызывают заболеваний человека или животных) или умеренной (микроорганизмы, которые могут вызывать не представляющее серьезной опасности заболевание человека или животного и риск распространения инфекции невысок) степени риска, согласно классификации ВОЗ.
Боксы II класса представляют собой защитные конструкции также с проёмом в передней панели для рук работающего. В этих боксах создается нисходящий вертикальный ламинарный воздушный поток благодаря рециркуляции части засасываемого в бокс воздуха. Рециркулируемый и выводимый из бокса воздух очищается в высокоэффективных аэрозольных фильтрах.
Разработано два типа БББ II класса: тип А и тип Б. В боксах типа А минимальная скорость поступающего воздуха через рабочий проём высотой 20 см составляет 0,4 м/с. Скорость вертикального нисходящего потока воздуха внутри камеры такая же. Конструкция обеспечивает рециркуляцию около 70 % всего воздуха. В боксах типа Б воздух поступает внутрь устройства через изменяемый по вертикали рабочий проём со скоростью 0,5 м/с, а средняя вертикальная скорость нисходящего потока воздуха внутри камеры равна 0,25 м/с. Эта конструкция обеспечивает удаление около 70 % всего воздуха, протекающего через рабочую зону, и является предпочтительней конструкции типа А, поскольку исключает накопление в высоких концентрациях опасных и токсичных агентов при работе с ними. Эффективная работа защитных боксов II класса достигается только при хорошо сформированном и тщательно поддерживаемом ламинарном потоке воздуха.
Все манипуляции в боксах проводятся ближе к задней стенке камеры на специальных поддонах с салфетками, смоченными дезинфицирующим раствором.
Работа с ПБА проводится в противочумном костюме IV типа, поскольку не исключается загрязнение рук экспериментатора, необходимо использование резиновых перчаток. После окончания работы все извлекаемые из боксов предметы и материалы подвергают предварительному обеззараживанию непосредственно в боксах путем протирания или погружения в соответствующие дезинфицирующие растворы и заключительной дезинфекции вне боксов. СИЗ после окончания работы помещают в контейнеры для последующего обеззараживания.
Защитные боксы II класса используют для работ с микроорганизмами низкой категории риска, если лабораторные манипуляции сопровождаются массовым образованием аэрозолей, или агентами с высоким уровнем риска для индивида и низким – для общества.
В боксах БББ II Б класса проводят диагностические исследования, связанные с изоляцией вирусов и риккетсий II группы патогенности. Если в помещении блока для работы с животными отсутствует приточно-вытяжная вентиляция или фильтры тонкой очистки на выходе вытяжной вентиляции, разрешается проводить работу с инфицированными (кроме вирусов I группы патогенности) животными в боксах БББ II (А, Б) класса, а исследование на чуму – в боксах БББ II Б или III класса.
Защитные боксы III класса – полностью изолированная воздухонепроницаемая камера, внутри которой создается пониженное давление (на 0,1-0,24 кПа ниже окружающего), что обеспечивает надежный барьер между инфицированным материалом и экспериментатором. Резиновые перчатки плечевого типа герметично заделаны в передней, а иногда и задней (при боксах двустороннего типа) панелях камеры. Засасываемый в бокс и выводимый из него вентилятором воздух очищается в предфильтре и в двух последовательно установленных высокоэффективных фильтрах. Жидкие отходы из бокса собирают в специальную емкость и подвергают термической обработке.
Для проведения специальных исследований боксы III класса можно объединять в защитные технологические линии. Эти линии оснащают изолированными от окружающей среды и друг от друга инкубаторами, центрифугами, измельчителями, гомогенизаторами, рефрижераторами и другим оборудованием и приборами. Возможно изолированное содержание подопытных животных. Соединение отдельных элементов в линии осуществляется с помощью камер-шлюзов.
Камеры-шлюзы могут быть оформлены в виде автоклавов проходного типа. Места ввода коммуникаций и соединения боксов между собой герметизируют, чтобы исключить возможность утечки аэрозолей, как при работающих вентиляторах, так и в случае их неисправности или перерыва в подаче электроэнергии.
Перед началом работы в боксе включают вентиляцию, проверяют наличие отрицательного давления по шкале боксового манометра, наличие запаса дезинфицирующих средств и загружают материал.
Время непрерывной работы ограничивают четырьмя часами, после которых устанавливают 30-60-минутный перерыв.
Защитные боксы III класса предназначены для работы с ПБА любого уровня опасности, являясь в этом отношении универсальными для всех современных микробиологических и вирусологических лабораторий.
Максимально изолированные лаборатории оборудуют боксами биологической защиты III класса. В них проводят исследование материала от больных людей с подозрением на особо опасное инфекционное заболевание, заражение культур ткани, членистоногих (на биомембране), биопробных животных (материалом из объектов окружающей среды, диких грызунов и членистоногих), заражение и вскрытие куриных эмбрионов, постановку серологических реакций с необеззараженными пробами. Исследование материала от больных с неясной этиологией, когда невозможно исключить наличие вирусов I группы патогенности, также проводят в БББ III класса.
В БББ III класса или отдельных боксированных помещениях проводят все манипуляции, связанные с высоким риском образования аэрозоля: центрифугирование, гомогенизация, измельчение, интенсивное встряхивание, обработка ультразвуком, вскрытие объектов с зараженным материалом, работа с большими объёмами и высокой концентрацией ПБА и др.
Микологические лаборатории также оборудуют БББ III класса, поскольку отдельные манипуляции при работе с возбудителями глубоких микозов требуют максимальной изоляции. Так, все манипуляции с культурами мицелиальной фазы, изучение выживаемости грибов во всех фазах проводят в БББ III класса. Не разрешается открывать пробирки и матрацы с посевами мицелиальной фазы грибов вне БББ.
При работе в БББ III класса сотрудники надевают противочумный костюм IV типа дополненный резиновыми перчатками.
Изоляторы отрицательного давления из мягкой пленки представляют собой в основном бокс биологической безопасности III класса. Эта конструкция выполнена в виде мешка из мягкой пленки, смонтированного и укрепленного на металлической раме. В переднюю стенку изолятора герметично заделаны резиновые перчатки плечевого типа. Ввиду недостаточной прочности его использование ограничено. Только хорошо обученный и опытный персонал может быть допущен к работе с этим оборудованием.
Последнее изменение этой страницы: 2016-12-30; Нарушение авторского права страницы
источник
УТВЕРЖДЕНА
Минздравом СССР
17 января 1991 года
С целью профилактики инфицирования медицинского персонала лечебно-профилактических учреждений особое значение имеет выполнение требований противоэпидемического режима.
Ответственность за организацию и соблюдение противоэпидемического режима при работе с потенциально опасным материалом возлагается на руководителя клинико-диагностической лаборатории (КДЛ).
Инструктаж среднего и младшего медицинского персонала проводится ответственным за технику безопасности не реже одного раза в квартал.
Инструкция составлена в соответствии с ГОСТом 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы», а также приказом Минздрава СССР (1989 год) «О мерах по снижению заболеваемости вирусным гепатитом в стране».
Медицинскому персоналу КДЛ следует избегать контактов кожи и слизистых оболочек с кровью и другими биологическими жидкостями, для чего необходимо:
1. Работать в медицинских халатах, шапочках, сменной обуви, а при угрозе забрызгивания кровью или другими биологическими жидкостями — в масках, очках, клеенчатом фартуке.
2. Работать с исследуемым материалом в резиновых перчатках, все повреждения кожи на руках должны быть закрыты лейкопластырем или напальчником. Избегать уколов и порезов.
3. Проводить разборку, мойку, прополаскивание лабораторного инструментария, посуды после предварительной дезинфекции в резиновых перчатках.
4. В случае загрязнения кожных покровов кровью или другими биологическими жидкостями следует немедленно обработать их в течение 2 мин тампоном, обильно смоченным 70% спиртом, вымыть под проточной водой с мылом и вытереть индивидуальным тампоном. При загрязнении перчаток кровью их протирают тампоном, смоченным 3% раствором хлорамина, 6% раствором перекиси водорода.
При подозрении на попадание крови на слизистые оболочки их немедленно обрабатывают струей воды, 1% раствором протаргола; рот и горло прополаскивают 70% спиртом, или 1% раствором борной кислоты, или 0,05% раствором перманганата калия.
5. Запрещается есть, пить, курить и пользоваться косметикой на рабочем месте.
6. Запрещается пипетирование крови ртом; следует использовать автоматические пипетки, а при их отсутствии — резиновые груши.
7. Поверхность рабочих столов в конце каждого рабочего дня подвергается дезинфекции, а в случае загрязнения биологическим материалом — немедленно.
Взятие крови следует проводить в резиновых перчатках, соблюдая правила асептики, обрабатывая перчатки 70% спиртом перед каждым взятием. Перед проколом кожу пальца обследуемого обрабатывают стерильным тампоном (шариком из ваты), смоченным 70% спиртом.
После взятия крови к раневой поверхности прикладывают новый стерильный тампон, смоченный 70% спиртом. Извлекать скарификаторы следует только с помощью пинцета, хранящегося в растворе дезинфекционного средства.
Стерильные тампоны хранятся в упаковке из бумаги, указанной в ГОСТе 42-21-2-85, в количестве не более 20 штук. Стерильные лабораторные инструменты хранятся в той же упаковке, в которой проводилась их стерилизация. Существует несколько вариантов взятия крови для гематологического исследования.
I вариант. После прокола пальца несколько капель крови (не менее 3-4), спускают на индивидуальное предметное (часовое) стекло, перемешивают и используют для работы.
II вариант. Кровь набирают в индивидуальные стерильные, предварительно выверенные капилляры объемом 20 мкл и капилляры Панченко непосредственно с поверхности кожи проколотого индивидуальным копьем пальца пациента.
III вариант. Кровь в количестве 40 мкл набирают стерильным индивидуальным капилляром Панченко, предварительно смоченным цитратом в соотношении цитрата и крови 1: 4 по объему.
IV вариант. После прокола кожи пальца 6-8 капель крови спускают в пластиковую пробирку, в которую предварительно внесено небольшое (на кончике глазной лопаточки) количество трилона Б.
Пробирку с кровью тщательно перемешивают, вращая ее между ладонями. Разлив крови пипетками по пробиркам осуществляется в лаборатории.
Количество компонентов для приготовления 1 л моющего р-ра
При механизированной очистке (струйный метод)
Раствор перекиси водорода:
При механизированной очистке (струйный метод, использование ультразвука) и ручной очистке
Моющее средство «Прогресс», «Айна», «Астра», «Лотос», «Лотос-автомат», «Маричка», г
При механизированной очистке с использованием ультразвука
Примечание. При использовании моющего средства, содержащего 0,5% перекиси водорода и 0,5% синтетического моющего средства «Лотос» и «Лотос-автомат», применяют ингибитор коррозии — 0,14% олеат натрия (1,4 г на 1 л раствора). В скобках указано количество питьевой воды в мл.
Процесс при проведении очистки
Замачивание в моющем растворе при полном погружении изделия при применении моющего средства «Биолот»
То же при применении моющего средства «Прогресс», «Астра», «Лотос», «Лотос-автомат», «Айна», «Маричка»
Мойка каждого изделия в моющем растворе при помощи ерша и ватно-марлевого тампона
Ополаскивание проточной водой:
— при применении моющего средства «Биолот»
Ванна, раковина с устройством для струйной подачи
— при применении моющего средства «Маричка», «Прогресс»
— при применении средств «Астра», Лотос», «Айна», «Лотос-автомат»
Ополаскивание дистиллированной водой
До полного исчезновения влаги
1. Температура раствора в процессе мойки не поддерживается.
2. Моющий раствор перекиси водорода с синтетическими моющими средствами, в том числе «Лотос», «Лотос-автомат», с ингибитором коррозии можно использовать в течение суток с момента изготовления, если цвет раствора не изменился. Неизмененный раствор можно подогревать до 6 раз, в процессе подогрева концентрация перекиси водорода существенно не изменяется.
3. Раствор моющего средства «Биолот», применяемый как при ручном, так и при механическом способе, используется однократно, так как при повторном использовании фермент, входящий в состав моющего средства, разрушается в процессе очистки.
Лабораторные инструменты, иглы, капилляры, предметные стекла, пробирки, меланжеры, счетные камеры, кюветы фотоэлектроколориметра, пипетки, наконечники, резиновые груши, баллоны и т.д., посуда после каждого использования должны подвергаться дезинфекции.
1. Использованные изделия промывают в емкости с водой. Промывные воды обеззараживают кипячением в течение 30 мин или засыпают сухой хлорной известью, известью белильной термостойкой, нейтральным гипохлоритом кальция (НГК) в соотношении 200 г на 1 л, перемешивают и обеззараживают в течение 60 мин. Промытые изделия кипятят в закрытой емкости в воде в течение 30 мин или в 2% растворе соды в течение 15 мин. (В случае кипячения изделий в 2% растворе соды дальнейшая предстерилизационная очистка не проводится.)
2. Лабораторные инструменты могут быть обеззаражены погружением в раствор с дезинфицирующим раствором.
В качестве дезинфицирующих используются следующие растворы: 3% раствор хлорамин, 6% перекись водорода, 6% перекись водорода с 0,5% моющего средства («Прогресс», «Астра». «Айна», «Лотос», «Лотос-автомат»), 4% формалин, 0,5% НГК, 0,5% сульфохлорантин; время обеззараживания 60 мин.
Дезинфицирующие растворы используются однократно.
Емкости для проведения дезинфекции должны быть четко маркированы, иметь крышки.
При дезинфекции изделий, имеющих внутренние каналы, растворы дезинфекционного средства в объеме 5-10 мл пропускают через канал с помощью груши для удаления остатков крови, сыворотки и пр., после чего изделия полностью погружают в дезинфицирующий раствор во вторую емкость.
При погружении инструментов в горизонтальном положении полости каждого инструмента должны быть заполнены дезинфицирующим раствором.
3. Каждая партия сухих хлорсодержащих дезинфектантов перед использованием должна подвергаться контролю на содержание активного хлора.
4. Посуду, соприкасающуюся с кровью или сывороткой и не предназначенную для последующего контакта с обследуемым, после дезинфекции промывают проточной водой для полного удаления дезинфектанта и проводят необходимую технологическую обработку.
5. Блоки кювет анализатора ФП, кюветы измерительной аппаратуры, пластиковые пробирки и т.д. обеззараживают только 6% раствором перекиси водорода и промывают проточной водой.
6. С предметных стекол с фиксированным и окрашенным мазком крови после проведения микроскопии удаляют остатки иммерсионного масла, стекла кипятят в мыльном растворе не менее 15 мин до полного отхождения краски, затем промывают проточной водой, подсушивают на воздухе и протирают.
7. Остатки крови, мочи, спинномозговой жидкости и т.д., пробы, содержащие разведенную сыворотку без добавления кислот, щелочей сливают в специальную тару и обеззараживают сухой хлорной известью, известью белильной термостойкой, НГК в соотношении 1:5 в течение 1 часа. При удалении сгустков следует предварительно отделить материал металлическим шпателем, который затем обеззараживают. Посуду из-под мочи, кала обрабатывают по описанной выше методике, но ее можно не подвергать стерилизации.
8. При загрязнении кровью или секретами мебели, инвентаря, приборов их следует немедленно дважды протереть ветошью, ватными или марлевыми тампонами, обильно смоченными дезинфицирующими растворами.
Использованную ветошь сбрасывают в специально выделенную емкость с дезинфицирующим раствором, маркированную «Для дезинфекции использованной ветоши».
9. При загрязнении кровью или секретами спецодежды ее снимают, предварительно обработав дезинфицирующим раствором участок загрязнения.
Стирка спецодежды на дому категорически запрещается. Смена спецодежды должна осуществляться не менее 2 раз в неделю.
10. Перчатки после окончания работы обеззараживают погружением в 3% раствор хлорамина или 6% раствор перекиси водорода на 1 час или кипячением в течение 30 мин.
11. Одноразовый инструментарий (плашки, наконечники, автоматические пипетки и т.д.) обеззараживают и утилизируют в паровом стерилизаторе при 2,0 кг/2 (132° С) в течение 60 мин.
После дезинфекции лабораторный инструментарий, соприкасающийся с раневой поверхностью или слизистыми оболочками обследуемого, подлежит обязательной предстерилизационной очистке и стерилизации.
Предстерилизационную очистку проводят с применением моющих растворов (табл.1 и 2).
Количество предстерилизационной очистки изделий оценивают на наличие крови путем постановки бензидиновой или амидопириновой пробы, на наличие остаточных количеств щелочных компонентов моющего вещества — путем фенолфталеиновой пробы.
Самоконтроль в КДЛ проводят ежедневно, контролю подвергают не менее 1% от одновременно обработанных изделий одного наименования, но не менее 3-5 единиц.
При положительной пробе на кровь или моющее средство всю группу контролируемых изделий подвергают повторной обработке до получения отрицательных результатов.
После дезинфекции и предстерилизационной очистки проводят стерилизацию игл, шприцев, пробирок, пипеток, стеклянных палочек, стекол, меланжеров и т.д.
источник
Для соблюдения санитарно – эпидемиологического режима в лаборатории я руководствуюсь следующими приказами:
1. Приказ ДОЗН АКО № 545 от 10.05.2011г. «О профилактике профессионального заражения ВИЧ-инфекцией и другими гемоконтактными инфекциями»;
2. Приказ МЗ СССР № 408 от 12.07.1989г. «О мерах по снижению заболеваемости вирусным гепатитом в стране»;
3. СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность»;
4. Приказ № 170 от 16.08.1994г. «О мерах по совершенствованию профилактики и лечения ВИЧ-инфекции в Российской Федерации»;
5. ОСТ 42-21-2-85 МЗ СССР от 10.06.1985г. «Стерилизация и дезинфекция изделий медицинского назначения, методы, средства и режимы»;
6. СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами»;
7. Приказ № 288 от 23.03.1976 года «Об утверждении инструкции санэпидрежима больниц и о порядке осуществления органами учреждения санэпидслужбы».
8. Приказ № 338/8 «Инструкция по регламенту работы в клинико-диагностических лабораториях лечебно-профилактических учреждений».
9. Приказ № 720 «Об улучшении медицинской помощи с гнойными хирургическими заболеваниями и усиление мероприятий по борьбе с внутрибольничными инфекциями».
10. Приказ МЗ РФ от 23.03.2003г № 109 «О совершенствовании противотуберкулёзных мероприятий в РФ»
В клинической лаборатории ведется документация: «Журнал учета проведения генеральных уборок», «Журнал учета дезинфицирующих средств», «Журнал работы бактерицидных установок», «Журнал учета спирта 70°, 95°, перевязочных средств: вата, бинты, марля».
Все биологические жидкости, поступающие в лабораторию на исследование, считаются потенциально опасными, поэтому они подвергаются обязательной дезинфекции. В лаборатории имеются дезинфицирующие средства в достаточном количестве. Все они хранятся в специально отведенном месте.
Я готовлю растворы для дезинфекции в спецодежде: маска, шапочка, очки, халат, фартук, перчатки, в концентрации, предусмотренной для гемоконтактных инфекций (гепатиты и ВИЧ — инфекция).
Емкости для дезинфекции имеют маркировку и литраж. На дезинфицирующее средство оформляю паспорт, где указываю: наименование, концентрацию, дата разведения, срок годности, подпись ответственного. В настоящее время в лаборатории имеется люмакс-хлор лайт. Используется для дезинфекции 0,1% раствор. Биологические жидкости засыпаются сухим хлорамином в соотношении 1:5.
Весь лабораторный инструментарий и посуда, соприкасающиеся с биологическими жидкостями, подвергаются дезинфекции в пластиковых контейнерах с крышками и устройствами для погружения. Качество предстерилизационной очистки медицинских изделий оценивается путем проведения азапирамовой пробы. Капилляры, предметные стекла стерилизуются в ЦСО больницы.
Одноразовые пробирки для анализов крови дезинфицируются в 0,1% растворе люмакс-хлор лайт в течение 1 часа, затем утилизируются согласно САН ПИН 2.1.7.2790-10, эпидемиологические опасные отходы класса «Б», в упаковке желтого цвета.
Согласно САН ПИН 2.1.3.2630-10 1 раз в месяц с целью контроля за соблюдением санитарно-гигиенических норм и состоянием асептики, бактериологическая лаборатория осуществляет контроль.
Ответственный лаборант берет смывы на бактериологические исследования, условно патогенную микрофлору в лаборатории. Все пробы были отрицательными за 2012-2013гг.
Вывод: отсутствие положительных бактериологических смывов говорит о хорошей организации санэпидрежима в лаборатории и строгом выполнении приказов.
По графику 1 раз в неделю я с санитаркой провожу генеральную уборку в кабинете забора крови в специальной одежде с применением дезинфицирующих, моющих средств и чистой тканевой ветоши. Весь инвентарь промаркирован, хранится в хозяйственной зоне.
По окончанию уборки проводится обеззараживание воздуха и поверхности бактерицидным облучателем согласно проведенным расчетам и регистрируется в «Журнале регистрации работы бактерицидной установки».
После проведения генеральной уборки делаю отметку в «Журнале генеральных уборок».
Дата добавления: 2015-04-29 ; Просмотров: 31080 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Так, объектами дезинфекции в лаборатории являются:
1. Руки и открытые участки кожи медперсонала;
2. Лабораторная посуда и инструментарий;
3. Поверхности мебели и лабораторного оборудования;
4. Поверхности помещения;
5. Биологический материал и твердые отходы.
Все лабораторные инструменты (иглы, шпатели и пр.) и лабораторная посуда (предметные стекла, пипетки, пробирки и пр.) после использования подвергают дезинфекционной обработке.
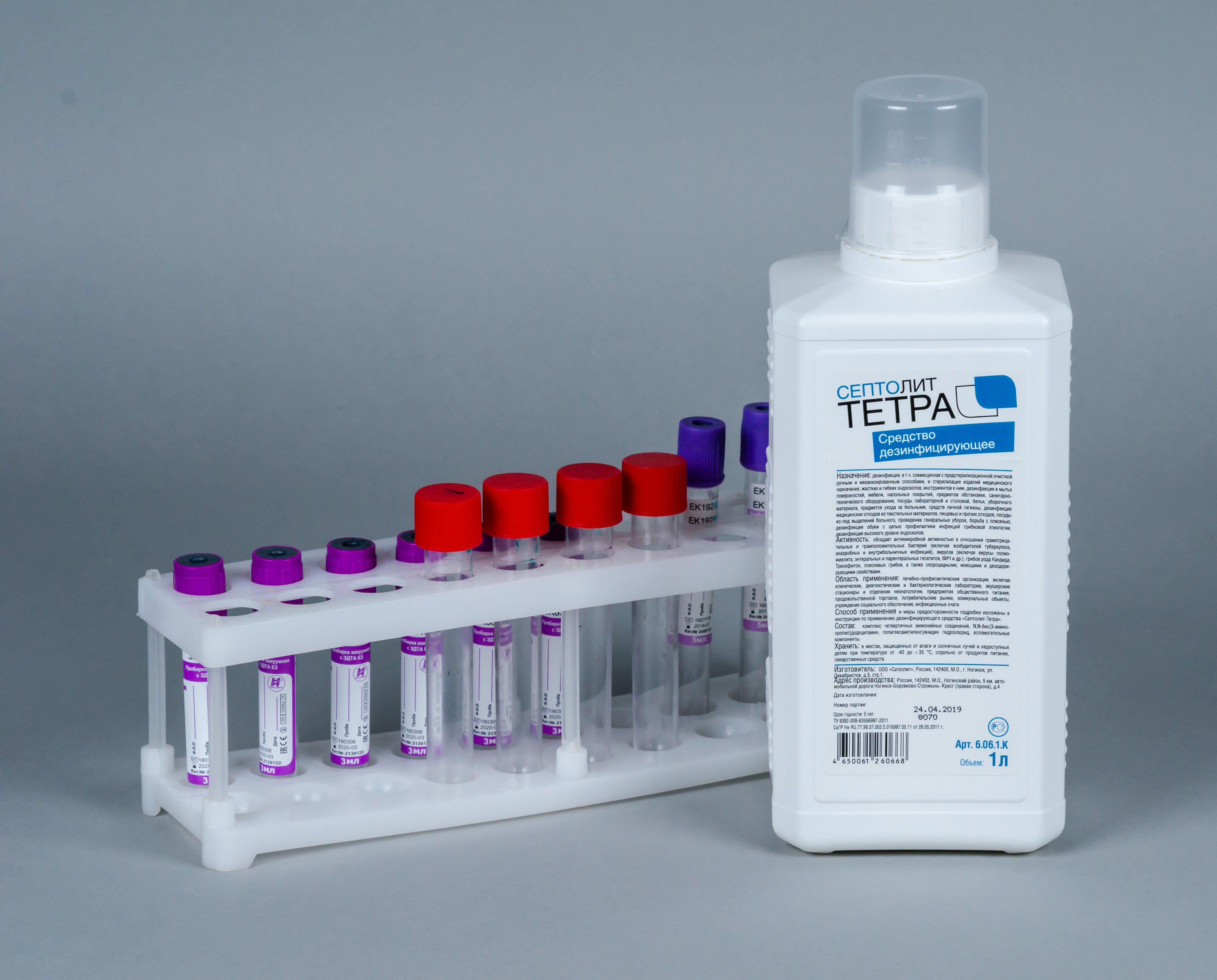
Для этого необходимо применять средства для дезинфекции изделий медицинского назначения, активные в отношении парентеральных вирусов, таковыми являются дезсредства «Септолит Тетра» и «Септолит ДХЦ».
Лабораторную посуду и инструменты дезинфицируют путем погружения в раствор дезсредства. По окончанию времени экспозиции проводят предстерилизационную очистку— путем очищения инструментов и посуды в растворе дезсредства с помощью щеточек. После этого изделия промывают проточной водой, просушивают. В завершении лабораторные изделия отправляют на стерилизацию паровым или воздушным методом.
Одноразовый инструментарий обеззараживают в растворе дезсредства, а затем утилизируют.
Отобранный биологический материал (кровь, моча, кал, мокрота) после проведения исследования подлежит дезинфекции. Для обеззараживания биоматериалов необходимо использовать хлорсодержащие дезсредства, например, дезсредство «Септолит ДХЦ». Рабочий раствор которого готовят путем растворения хлорных таблеток в воде.
Находящиеся в емкостях кал, рвотные массы, мочу заливают раствором «Септолит ДХЦ» в соотношении 1 к 2. По окончанию времени экспозиции выделения утилизируют. По такому же принципу в отдельных емкостях дезинфицируют и кровь.
Емкости, используемые под выделения также необходимо дезинфицировать, и делают это путем погружения их в раствор дезсредства. По окончанию дезобработки емкости ополаскивают водой.
Рабочие столы и оборудование в конце смены обязательно протирают ветошью, смоченной в дезсредство. Для дезинфекции мебели и медоборудования рекомендуем использовать такие современные средства дезинфекции:
1. Дезсредство с моющими свойствами «Септолит Лайт»;
2. Концентрированное дезсредство с моющими свойствами «Септолит Плюс»;
3. Хлорсодержащее дезсредство «Септолит ДХЦ».
При разлитии крови на стол необходимо моментально обработать его поверхность хлорсодержащим дезсредством, например, дезсредством «Септолит ДХЦ». Для этого пролившуюся кровь промокают ветошью, смоченной в растворе дезсредства. Использованную ветошь погружают в емкость с дезсредством. В завершении поверхность вытирают чистой ветошью, смоченной в дезсредстве.
Также медперсонал лаборатории должен четко знать, как нужно действовать в случае возникновения аварийных ситуаций. Так, в ситуации с разрушением пробирок с материалами во время центрифугирования к осуществлению аварийных мероприятий приступают спустя сорок минут, когда аэрозоль полностью осядет на поверхность оборудования.
В гнездо ротора центрифуги на один час заливают раствор дезсредства, а по истечению времени содержимое гнезда переливают в сосуд с дезсредством. Затем центрифугу полностью протирают ветошью, смоченной в растворе дезсредства.
Помещение лаборатории должно содержаться сотрудниками в чистоте. Так, минимум дважды в день в помещении должна проводиться влажная уборка с дезсредствами. Текущая уборка подразумевает мытье полов, стен, поверхностей мебели и оборудования, сантехники.
Каждый месяц в лаборатории медперсонал проводит генеральную уборку с дезсредствами. Во время генуборки моют все поверхности помещения (пол, стены, потолок), а также объекты, находящиеся в нем (всю мебель и оборудование). Такие мероприятия существенно снижают риски заражения медперсонала опасными инфекциями.
источник
Санэпидрежим. Форум медицинских сестёр
Сообщение Светл@на » 22 окт 2009, 17:19
Сообщение АЯКС » 26 окт 2009, 12:18
Сообщение Татьяна Викторовна » 06 ноя 2009, 21:59
Сообщение Сергей » 10 ноя 2009, 17:00
Сообщение Тамара » 12 ноя 2009, 20:22
Сообщение Светл@на » 19 ноя 2009, 10:01
Сообщение Светл@на » 30 ноя 2009, 09:34
Сообщение ВВС » 30 ноя 2009, 11:50
8 августа 2001 года N 128-ФЗ
О ЛИЦЕНЗИРОВАНИИ ОТДЕЛЬНЫХ ВИДОВ ДЕЯТЕЛЬНОСТИ
Сообщение Светл@на » 01 дек 2009, 07:41
ВВС, как всегда, спасибо за подсказку.
В нашей ситуации мне нужно разобраться с терминами, где то у меня были распечатки из ГОСТа что и как называется, нужно найти и вникнуть с суть.
Мы сами никакой утилизации не производим.
Что таким образом у нас есть?
Сбор — мы собираем своими силами, т. е. своим транспортом с ФАПов лампы бактерицидные и если где есть люминесцентные, отработанные и шприцы, и свозим их на место хранения в центральный склад хранения этих ламп и шприцов, а потом оттуда их уже вывозит раз в квартал специализированная компания.
Использование — мы используем шлак, образующийся после сжигания углей в одной котельной, шлак используем для засыпания ям на дорогах (да ещё вот так живём).
Обезвреживание — есть, это все комтаминированные материалы (шприцы, перчатки, одноразовое бельё и т. д.
Транспортировка — это когда мы собираем шприцы и лампы с ФАПов.
Размещение (хранение) — это то что мы квартал или полгода храним шприцы и лампы пока их не вывезет спецкомпания. Но вот мне в Ростехнадзоре сказали , что если хранится не более полгода, то хранение не лицензирования.
Патологоанатомические отходы вывозят на захоронение тоже фирма своим транспортом.
Вчера звонила в Роспотребнадзор, мне сказали что вышло какое то постановление, что медицинские учреждения не должны лицензироваться «до выхода новых регламентирующих документов», вот пришлют ссылочку, будет чем от прокуратуры отбиваться.
Сообщение ВВС » 01 дек 2009, 14:53
«Советник бухгалтера в здравоохранении», 2007, N 8
Вопрос: В ежемесячном научно-практическом журнале «Менеджер здравоохранения» N 2 за 2007 год в разделе «Юридический практикум» опубликован Ваш ответ по необоснованности требований органов Роспотребнадзора о получении лицензии по сбору, использованию, обезвреживанию, транспортировки опасных отходов (медицинских отходов). Комитет здравоохранения Читинской области приказом N 282 от 02.07.07 «О проведении мероприятий по лицензированию» требует «организовать мероприятия по получению лицензии на деятельность по сбору, использованию, обезвреживанию, транспортировке, размещению опасных отходов» на основании ФЗ РФ N 89 «Об отходах производства и потребления» (ст. 1, ст. 9), Постановления Правительства РФ от 26 августа N 524 «Об утверждении положения о лицензировании деятельности по отбору, сбору, использованию, обезвреживанию, транспортировке, размещению опасных отходов». Нашей больницей в текущем году предстоит лицензирование. Документы в лицензионный орган необходимо представить в сентябре 2007 года. Убедительно прошу дать Ваши разъяснения по этому вопросу.
Ответ: В соответствии с пунктом 1 «Положения о лицензировании деятельности по сбору, использованию, обезвреживанию, транспортировке, размещению опасных отходов», утвержденного Постановлением Правительства РФ от 26.08.2006 г. N 524, оно определяет порядок лицензирования деятельности по сбору, использованию, обезвреживанию, транспортировке, размещению опасных отходов, осуществляемой юридическими лицами и (или) индивидуальными предпринимателями. Таким образом, это Положение определяет порядок лицензирования деятельности специализированных предприятий, которые занимаются сбором, использованием, обезвреживанием, транспортировкой и размещением опасных отходов.
Следовательно, если больница самостоятельно не занимается такой деятельностью, а заключает договор на сбор и вывоз отходов со специализированной организацией, имеющей соответствующую лицензию, самой больнице лицензию на эту деятельность получать не нужно. При этом на территории больницы необходимо обеспечить выполнение требований действующих санитарных правил и норм, регламентирующих порядок обращения с отходами.
Директор юридической
компании «Юнико-94»
М.И.МИЛУШИН
11.08.2007
источник