Симптомы колоректального рака (КРР) не способствуют его ранней диагностике. Это обусловливает необходимость выполнения скрининговых программ, выверенных в отношении риска рака толстой кишки, для лиц в возрасте не старше 50 лет при отсутствии симптомов, а у лиц с высоким риском — в более раннем возрасте. Четкие критерии прекращения программы скрининга отсутствуют.
Эффективный скрининг:
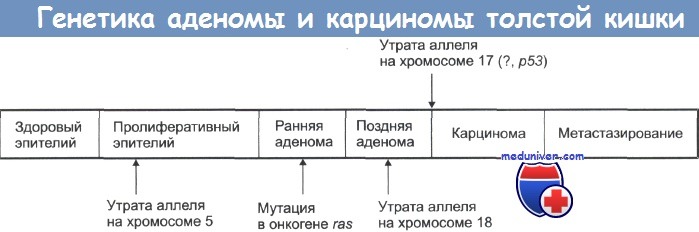
• Основан на понимании последовательности аденома — рак: от первых молекулярных изменений до клинической манифестации опухоли требуется 5-10 лет (внимание: более сжатые сроки при ННПРТК).
• Основан на индивидуальном, генетическом, возрастном или обусловленном заболеванием риске возникновения рака толстой кишки.
• Высоко чувствительный.
• Практичный, легкий для выполнения, недорогой.
Термин скрининг употребим только при отсутствии симптомов; исследование, выполняемое у лиц с симптомами, следует называть не «скрининг», а метод «диагностики».
Распространенность полипов: 20-30% среди лиц старше 50 лет в популяции среднего риска. Первая колоноскопия приносит наибольшую пользу при полипэкто-мии; риск развития КРР у больных с небольшими аденомами не выше, чем в популяции среднего риска. В настоящее время уровень охвата скринингом популяции среднего риска неприемлемо низок: 20-50%. Напротив, более 50% гастроэнтерологов и проктологов выполняют колоноскопию чаще, чем рекомендуется в руководствах — экономически невыгодно, отвлекает средства от первичного скрининга, приносящего большую пользу.
Дифференциальная оценка риска рака толстой кишки:
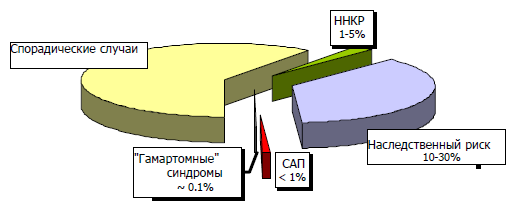
• Низкий и средний риск (65-75%): отсутствие факторов риска, отсутствие рака толстой кишки у родственников первой степени.
• Средний риск (20-30%): рак толстой кишки у одного родственника первой степени родства в возрасте моложе 60 лет или у 2 и более родственников первой степени любого возраста, наличие в анамнезе радикальной операции по поводу рака толстой кишки, крупного полипа (> 1 см) или множественных полипов толстой кишки любого размера.
• Высокий риск (6-8%): САТК, ННПРТК, ВЗК.
а) Анализ кала на скрытую кровь:
• За: неинвазивный, простой, удобный, безопасный метод.
• Против: осмотр толстой кишки не производится, низкая и средняя чувствительность/специфичность, положительный результат требует выполнения коло-носкопии или других исследований. Низкая специфичность: КРР выявляется только у 2% больных с положительным тестом на скрытую кровь, то есть, чтобы выявить одного больного с КРР необходимо выполнить 50 колоноскопий, а чтобы спасти одного больного требуется выполнить 100 колоноскопий.
• Меры предосторожности: необходимо повторять ежегодно, ограничения в диете (исключение красного мяса, хрена, витамина С и т.д.).
• Факты: ежегодный анализ кала на скрытую кровь снижает смертность от КРР на 20-33%; чувствительность в отношении крупных аденом и КРР составляет только 24%.
б) Фибросигмоидоскопия:
• За: более безопасна, чем колоноскопия, более удобна, не требует подготовки кишечника, обычно не требует седации.
• Против: не позволяет осмотреть всю толстую кишку, выявленные изменения требуют выполнения полной колоноскопий.
• Меры предосторожности: необходимо повторять каждые 5 лет.
• Факты: снижает смертность от КРР на 60%, от КРР дистальных отделов — на 70%; 2% больных с нормальной картиной при фибросигмоидоскопии имеют значимые изменения проксимальнее селезеночного изгиба.
Комбинация анализа кала на скрытую кровь и фибросигмоидоскопии. Факты: несмотря на теоретические преимущества, на практике польза от комбинации обоих методов остается неясной: более высокий уровень выявления, однако снижение смертности от КРР по сравнению с фибросигмоидоскопией не доказано.
в) Колоноскопия:
• За: «золотой» стандарт с полной визуализацией всей толстой кишки, лечебные возможности.
• Против: более высокий риск по сравнению с фибросигмоидоскопией, необходимость в подготовке кишки, седации больного.
• Меры предосторожности: необходимо повторять каждые 10 лет.
• Факты: Национальная программа исследований полипов выявила снижение заболеваемости КРР на 76-90% после колоноскопий и удаления всех видимых полипов в сравнении с предшествующим контрольным уровнем.
г) Ирригоскопия:
• За: полная визуализация толстой кишки даже при наличии частично или почти полностью обтурирующих образований, отсутствие необходимости в седации, лучше переносится.
• Против: отсутствие лечебных возможностей, чувствительность ниже, чем при колоноскопий, наличие образований или неясные находки требуют выполнения колоноскопий, по-прежнему необходима подготовка кишки.
• Меры предосторожности: необходимо повторять каждые 5 лет.
• Факты: чувствительность при колоректальном раке 80-85% и 50% при больших полипах (> 1 см).
д) КТ колонография:
• За: полная визуализация толстой кишки, отсутствие необходимости в седации.
• Против: отсутствие лечебных возможностей, по-прежнему необходима подготовка кишки, более выраженный дискомфорт (инсуффляция воздуха, отсутствие седации), дополнительные обследования/вмешательства при случайных находках.
• Меры предосторожности: интерпретация результатов и рекомендации точно не определены.
• Факты: необходимы дальнейшие подтверждения. Полученные данные противоречивы: имеются сообщения о чувствительности/специфичности в отношении крупных образований от сопоставимой с колоноскопией до умеренной.
е) Исследование ДНК в кале:
• За: неинвазивный, удобный, безопасный метод.
• Против: осмотр толстой кишки не производится, низкая и умеренная чувствительность/специфичность, положительный результат требует выполнения колоноскопии или других исследований.
• Меры предосторожности: необходимо повторять ежегодно.
• Факты: чувствительность выше, чем при анализе кала на скрытую кровь; 50% -при инвазивном КРР, 15-20% — при больших аденомах.
а) Начальный скрининг (при отсутствии находок) на рак толстой кишки
Цель: выявление и удаление образований-предшественников, выявление больных группы риска для стратификации частоты скрининга/дальнейшего наблюдения.
1. Лица среднего риска, без симптомов заболевания, не афроамериканцы => начало в возрасте 50 лет.
а. Колоноскопия каждые 10 лет (метод выбора).
б. Ежегодный анализ кала на скрытую кровь; если положительный => колоноскопия.
в. Скрининговая сигмоидоскопия каждые 5 лет.
г. Ирригоскопия с двойным контрастированием каждые 5 лет.
2. Лица с повышенным индивидуальным риском => специальные руководства:
а. Афроамериканцы: начало скрининга в возрасте 45 лет.
б. Наличие семейного анамнеза (группа повышенного риска): начало в возрасте 40 лет или на 10-15 лет раньше возраста наиболее молодого члена семьи с раком толстой кишки.
в. Язвенный колит: через 7 лет после начала заболевания ежегодная (дважды в год) колоноскопия с множественными биопсиями.
г. САТК: начало в подростковом возрасте (или генетическое тестирование).
д. ННПРТК: начало в возрасте около 25 лет (или генетическое тестирование); затем повторные колоноскопии каждые 1-3 года из-за более короткой последовательности «аденома — рак».
б) Повторная колоноскопия после полипэктомии для исключения рака толстой кишки
Цель: выявление и удаление аденом, пропущенных при первичном осмотре (10-20% полипов размером 6 мм остаются невыявленными); оценка предрасположенности к образованию новых аденом с неблагоприятными патоморфологическими признаками.
1. Короткий интервал (основанный на клиническом суждении):
а. Множественные аденомы.
б. Малигнизированные полипы (рак в полипе).
в. Большие сидячие полипы.
г. Неполная колоноскопия или неполное удаление.
2. Трехлетний интервал:
а. Большие или множественные полипы (>3).
3. Пятилетний интервал:
а. Один или два небольших полипа (тубулярная аденома).
4. Не требуется наблюдение:
а. Гиперпластические полипы (исключение: больные с гиперпластическими полипозными синдромами).
в) Повторная колоноскопия при спорадическом раке толстой кишки (не при ННПРТК/аттенуированном САТК)
Цель: выявление синхронного/метахронного рака толстой кишки; выявление истинных рецидивов в области анастомоза (риск полная колоноскопия должна быть выполнена в течение 6 месяцев.
2. Годичный интервал: а. После операции.
3. Трехлетний интервал:
а. Если ничего не выявлено при предоперационной или первой послеоперационной колоноскопии.
4. Пятилетний интервал
а. В дальнейшем, если ничего не выявлено. ННПРТК/АСАТК: ежегодное наблюдение за оставшимися отделами толстой кишки.
Наблюдение за пациентом в динамике:
— Результаты патоморфологического исследования.
— Побочные эффекты полипэктомии: полипэктомический синдром, перфорация, кровотечения.
— Операции по поводу больших полипов или рака. Профилактические операции?
— Вторичная профилактика?
источник
- повышенное потребление животных белков и жиров
- потребление рафинированных углеводов
- малое употребление клетчатки
- изменение секреции желчи и состава желчных кислот
- изменение кишечной флоры
- дефицит витаминов А и С
Роль наследственности в развитии рака ободочной кишки изучена недостаточно. Первичные генетические факторы являются значимыми у 5-10% больных.
- Полипозом толстой кишки
- Одиночными и групповыми полипами толстой кишки
- Язвенным колитом
- Болезнь Крона
- Предшествующая операция по поводу рака толстой кишки
- Предшествующая операция на молочной железе и яичниках
В настоящее время большинство исследователей выделяют 3 основные гистологические формы рака ободочной кишки: железистый рак, или аденокарциному (70-75% случаев), солидный рак (до 20%) и коллоидный или слизистый рак (8-17% случаев). В соответствии с классификацией ВОЗ по степени дифференцировки различают высоко дифференцированные (низкая степень злокачественности), среднюю степень дифференцировки и злокачественности и низко дифференцированные опухоли (высокая степень злокачественности).
Стадия 0 — Tis (рак in situ)
Стадия I — T1N0M0, T2N0M0
Стадия II — T3N0M0,T4N0M0
Стадия III — все значения T, N1-3M0
Стадия IV — все значения T и N, M1
Т1- опухоль прорастает слизистую оболочку и подслизистую основу кишки
Т2 — опухоль прорастает мышечный слой стенки кишки
Т3 — опухоль прорастает субсерозную ткань или неперитонезированные участки
кишки
Т4 — инвазия опухоли в периректальные ткани и соседние органы.
Тx — первичная опухоль не может быть оценена
N1 — один — три пораженных метастазами регионарных лимфатических узла
N2 — более трех пораженных лимфатических узла
N3 — поражение лимфатических узлов вдоль магистральных сосудов прямой кишки
M0 — отдаленных метастазов нет
M1 — есть отдаленные метастазы
Основным методом лечения рака ободочной кишки является хирургический . Он позволяет выполнить полное удаление опухоли в пределах здоровых тканей. Решить задачу подавления последующего опухолевого роста призваны лучевая , химио- , иммуномодулирующая терапии.
Хирургическое лечение
Хирургические операции в зависимости от распространенности опухоли и объема операции делятся на радикальные и паллиативные. Паллиативные операции могут выполняться в объеме радикальных резекций кишки или быть симптоматическими.
При радикальной операции удаляется пораженный опухолью отдел ободочной кишки одним блоком с регионарным лимфатическим аппаратом.
Паллиативные резекции выполняются при отдаленных метастазах рака и помогают предупредить в послеоперационном периоде такие осложнения, как выраженный болевой синдром, кровотечения из распадающейся опухоли, зловонные, раздражающие ткани кишечные выделения. Тем самым улучшается качество жизни запущенных онкологических больных.
Симптоматические операции без резекции кишки выполняются в объеме разгрузочных колостомий или обходных анастомозов у больных с далеко зашедшим опухолевым процессом по поводу осложнений рака.
По способу завершения различают операции с первичным восстановлением кишечной непрерывности и с наложением колостомы. Последние используются как первый этап в лечении рака, осложненного кишечной непроходимостью (с дальнейшим восстановлением) и при паллиативном лечении.
Химиотерапия
Одним из методов комбинированного лечения рака ободочной кишки является адьювантная (дополнительная) химиотерапия. Чувствительность рака ободочной кишки к ней выявлена у 25-30% больных. Адьювантная терапия проводится после операции при поражении опухолью регионарных лимфатических узлов.
Иммуномодулирующая терапия
В последнее время появляются сообщения о достоверном снижении количества рецидивов и отдаленных метастазов после проведения химиоиммунопрофилактики. Метод заключается в назначении пациентам после хирургического лечения при отсутствии метастазов в регионарных лимфоузлах в течение года еженедельно цитостатика и иммуномодулятора.
Лучевая терапия используется:
— Как предоперационный метод лечения рака прямой кишки (для уменьшения стадийности рака)
— Для послеоперационного облучения больных раком прямой кишки для сокращения частоты рецидивов
— Как основной метод лечения неоперабильного местнораспространенного рака прямой кишки.
Еще раз подчеркиваем, что только выявление колоректального рака на ранних стадиях позволяет максимально использовать весь спектр современных методов лечения и добиться хороших результатов. Рак на ранних стадиях может вызывать минимум жалоб и протекать под маской многих других проктологических и хирургических заболеваний. Поэтому своевременно обращайтесь к специалистам.
источник
Рассматриваемая онкопатология занимает третье место по шкале распространенности раковых заболеваний в мире. Кроме того, уровень смертности от указанного недуга, особенно в западных странах, достаточно высок. Чтобы исправить сложившуюся ситуацию, специалисты рекомендуют проводить скрининг колоректального рака лицам со средним и высоким уровнем риска.
Указанная процедура предусматривает две основных стратегии: исследование кала и эндоскопические методики. Такие мероприятия способствуют выявлению предраковых изменений у практически здоровых людей.
Показания к выполнению тестов на рак прямой кишки и толстой кишки – кому необходимо пройти колоректальный скрининг прямо сейчас?
Рассматриваемая процедура показана лицам с высоким риском развития колоректального рака.
- Пациенты, у которых в истории болезни имеются сведения о наличии аденоматозных полипов.
- Те, кто перенес полноценное хирургическое лечение раковой опухоли тонкого/толстого кишечника.
- Семейный анамнез колоректальных новообразований (опухоли, аденоматозные полипы) у родственников 1-й линии родства если указанная онкопатология была диагностирована у них до пересечения 60-летнего рубежа. К повышенной группе риска также относят лиц, у которых у двоих и более родственников первой линии не зависимо от их возраста был диагностирован КРР.
- Воспалительные заболевания кишечника: болезнь Крона и неспецифический язвенный колит.
- Наследственные синдромы. В первую очередь, это касается:
— Семейного аденоматозного полипоза.
— Синдрома Пейтца-Егерса. Помимо полипоза органов жкт, диагностируется также пигментация кожных покровов и слизистых оболочек.
— Наследственного неполипозного колоректального рака.
— Синдрома множественных гамартом. Указанные новообразования являются доброкачественными, и они могут располагаться в отделах жкт, щитовидке, головном мозге, органах мочевыделительной и репродуктивной системы.
Семейный анамнез и колоректальный рак
Противопоказания к колоноскопии, входящей в программу колоректального скрининга — кому не назначат это исследование?
Рассматриваемая процедура применяется только по отношению к здоровым людям. Если же у пациента недуг кишечника уже выявлен, надобности в проведении колоректального скрининга у него нет.
- Период вынашивания ребенка.
- Аллергические реакции, либо плохая переносимость анестетических средств.
- Патологии жкт, при которых у пациента наблюдается резкое беспричинное снижение веса за последние полгода, наличие крови в каловых массах согласно проведенным тестам, а также железодефицитная анемия.
- Болезни крови, что связанны с ее свертываемостью.
- Диагностирование у пациента сопутствующих недугов, при которых колоноскопия представляет опасность для здоровья и даже жизни. К подобным заболеваниям относят:
— Сахарный диабет, что сопровождается сосудистыми обострениями.
— Злоупотребления алкогольными напитками.
— Серьезные сбои в работе сердца и/или печени.
— Нарушение мозгового кровообращения, на фоне которого развивается кислородное голодание ГМ.
Кроме того, колоноскопию не назначают, если в течение года был сделан анализ кала на скрытую кровь, либо проводились следующие диагностические мероприятия:
Начало проведения скрининга, если речь идет о наследственном факторе, будет определяться возрастом самого пациента, а также возрастом родственников, у которых была выявлена та или иная патология кишечника:
- После 40-летнего возраста назначают колоноскопию, которую в дальнейшем повторяют раз в 5 лет при диагностировании колоректального рака у родителей, братьев/сестер, детей пациента до достижения ими 60 лет. Этот же принцип распространяется на тот случай, если указанная онкопатология была диагностирована у двух и более родственников первой степени не зависимо от их возраста. Доктор также может назначить прохождение скрининга пациенту на 10 лет раньше возраста, при котором колоректальный рак/аденоматозные полипы были выявлены у первого ближайшего родственника.
- После достижения 10-12 лет ежегодно рекомендуется проводить сигмоскопию при диагностировании — либо при повышенном риске развития — семейного аденоматозного полипоза.
- Начиная с 20-летнего возраста, каждые 2 года следует проводить колоноскопию в случае повышенного риска появления либо при генетическом/клиническом диагностировании наследственного неполипозного колоректального рака. Допускается также начинать проводить скрининг на 10 лет раньше возраста, при котором рассматриваемый тип онкопатологии был диагностирован у самого первого родственника.
- После пересечения 50-летнего рубежа при отсутствии отягощающего семейного анамнеза и иных факторов, что могут привести к увеличению степени риска развития КРР, колоноскопию проводят единожды в жизни. При наличии противопоказаний к указанной процедуре, выбор делают в пользу гибкой сигмоскопии (1 раз на протяжении жизни, если в ходе обследования не выявлено каких-либо дегенеративных изменений). Если же сигмоскопия также нежелательна, такой группе пациентов проводят ежегодное тестирование кала на скрытую кровь.
- Каждые 1-2 года в специализированных медицинских центрах проводят колоноскопию пациентам, у которых диагностирована болезнь Крона, либо неспецифический язвенный колит. Начинать скрининг рекомендуется через 8-10 лет после начала развития указанных патологий.
Периодичность проведения скрининговой колоноскопии у пациентов с колоректальными полипами будет зависеть от типа новообразования:
- Каждые 10 лет в случае выявления гиперпластического полипа. Начинать скрининг рекомендуется через 3-6 лет после полипэктомии. Исключением является гиперпластический полипозный синдром в анамнезе, — скрининг в подобных ситуациях проводят намного чаще.
- Каждые 5-10 лет при выявлении максимум двух тубулярных аденом, параметр которых не превышает 10 мм, и которые имеют низкую степень дисплазии. Периодичность проведения колоноскопии определяется доктором на основании предыдущих результатов диагностики. Первый скрининг следует проводить не позже, чем через 3 года после удаления аденомы.
- Раз в пять лет при наличии от 3 до 10 аденом, либо при наличии одного большого аденоматозного полипа (от 1 см в диаметре). При этом, первая колоноскопия проводится не позже чем через 3 года после хирургического удаления всех аденом.
- Каждые 3 года в случае выявления более 10 колоректальных полипов. В этом случае пациенту в обязательном порядке необходимо пройти генетическое тестирование на семейный аденоматозный полипоз!
В случае резекции толстого кишечника по поводу лечения КРР, первая колоноскопия проводится в течение года после хирургической манипуляции.
Этапы колоректального скрининга – все тесты, анализы и диагностические мероприятия на выявление рака прямой и толской кишки
Скрининговые тесты на предупреждение колоректального рака включают:
- Определение скрытой крови в кале. Дает возможность выявить указанную онкопатологию у бессимптомных пациентов. Зачастую прибегают к гваяковой пробе Вебера. Достоверность результатов данного теста повышается при его проведение каждые 1-2 года в течение длительного периода. Но в этом и заключается вся загвоздка: далеко не все лица согласны активно участвовать в проведении повторных анализов на протяжении длительного времени учитывая тот момент, что к обследованию нужно готовиться. Кроме того, данный анализ может давать как ложноположительные, так и ложноотрицательные результаты. В первом случае пациентов посылают на весьма инвазивную для организма колоноскопию, которая в конечном счете оказывается ненужной. Альтернативной гваяковой пробы является иммунохимический метод определения крови в кале (FIT). Положительная сторона таких тестов – отсутствие необходимости соблюдать диету при подготовке к обследованию. Как и предыдущий анализ FIT нужно повторять каждый год, а для большей информативности его следует сочетать с инструментальными методами диагностики.
- Анализ кала на содержание ДНК.
- Гибкая сигмоскопия. Исследуемая площадь составляет 60 см, начиная от анального отверстия и до толстого кишечника. С ее помощью доктор может осмотреть левую часть толстой кишки, прямую кишку, и при необходимости взять образец патологического элемента для лабораторного исследования. Подготовка к данной манипуляции несложная, а длится она меньше, чем колоноскопия.
- Колоноскопия. Является золотым стандартом в выявлении колоректального рака. Однако такая процедура требует тщательной и длительной подготовки, а риск развития осложнений после ее проведения значительно выше, чем при гибкой сигмоскопии.
- Ирригоскопия с двойным контрастированием (ИДК). К ней прибегают при невозможности применения более информативных методик исследования толстой кишки. Минусом данной процедуры является большое количество ложноположительных результатов: артефакты кишечника могут определяться как аденомы. Однако, в половине случаев посредством рассматриваемой манипуляции удается обнаружить большие полипы.
- Компьютерно-томографическая колонография (КТК). Дает возможность получения двух- и трехмерного изображения просвета толстого кишечника. Данная скрининговая процедура нечувствительна в отношении плоских новообразований. Ее эффективность также снижается при наличии в толстой кишке нескольких полипов, что отличаются по своим параметрам. Не самой лучшей перспективой является также получение пациентом в ходе КТК определенной дозы ионизирующего излучения. С целью минимизации радиоактивного излучения европейскими странами изучается возможность использования магнитнорезонансной колонографии.
- Гваяковая смола, что используется, как основной ингредиент при тестировании каловых масс на скрытую кровь, может реагировать на некоторые овощи, фрукты, красное мясо, что может спровоцировать ложноположительные результаты. В связи с этим, за несколько дней до анализа пациентам нужно придерживаться определенной диеты.
- Женской части населения иммунохимический тест кала на скрытую кровь следует проходить после завершения менструации.
- Также за несколько дней до тестирования следует отказаться от приема препаратов, способствующих разжижению крови: варфарина, аспирина и пр.
- Перед колоноскопией и компьютерно-томографической колонографией пациенту нужно принимать слабительные средства и ставить очистительные клизмы: требуется полная подготовка кишечника.

источник
Про онкомаркеры сейчас много споров — многие пишут о том, что неправильно использовать онкомаркеры для скрининга рака. А каким же образом тогда проводить раннее выявление злокачественных новообразований?
Важно отметить, что «проверки на рак» не существует, невозможно сделать один или много тестов и отмести вероятность онкологического заболевания.
Есть некоторые виды рака, которые можно и нужно выявлять на ранних стадиях с помощью проведения скрининга. А есть такие, попытки активного выявления которых приносят больше вреда, чем пользы.
Скрининг – это активный поиск заболевания в группах людей, которые не имеют каких-либо подозрительных симптомов, но входят в группы риска этих заболеваний. Скрининг проводят в тех случаях, когда его польза доказана и превышает вред от возможных ненужных обследований и вмешательств.
Целевая группа профилактических служб США (USPSTF) считает необходимым проведение скрининга на некоторые виды рака.
Ежегодный скрининг мелкоклеточного рака легких с помощью низкодозной компьютерной томографии у взрослых в возрасте от 55 до 80 лет, со стажем курения более 30 лет (при интенсивности курения около пачки в день), в том числе у бросивших курение менее 15 лет назад.
Скрининг рака легких не рекомендуется, если человек не курит в течение 15 лет. Скрининг также не рекомендуется, когда у человека появляются заболевания, существенно ограничивающие вероятную продолжительность жизни.
Врач может посоветовать скрининг рака легкого и в том случае, если имеются другие факторы риска — случаи рака легкого у близких родственников, хроническая обструктивная болезнь легких 3-4 степени, профессиональная вредность – работа с пылью, асбестом, радоном и прочим.
Рекомендуется обследовать всех людей в возрасте от 50 (в некоторых рекомендациях возраст начала скрининга сдвинулся до 45 лет) и до 75 лет на наличие колоректального рака.
Пациенты в возрасте от 76 до 85 лет должны проходить скрининг на индивидуальной основе с учетом их общего состояния здоровья и анамнеза.
Возможны альтернативы: использование ежегодного исследования кала на скрытую кровь, либо колоноскопии каждые 10 лет, либо КТ-виртуальной колонографии или гибкой сигмоидоскопии каждые 5 лет, а также сочетание исследования кала на скрытую кровь и какого-либо метода визуальной оценки.
Скрининг рака шейки матки рекомендуется проводить у женщин в возрасте от 30 до 65 лет с помощью цитологического исследования (мазок по Папаниколау) каждые 3 года, с тестированием на ВПЧ каждые 5 лет или с тестированием как на цитологию, так и на ВПЧ каждые 5 лет.
Женщинам в возрасте от 21 до 29 лет рекомендуется проводить скрининг только с использованием цитологического исследования материала из шейки матки каждые 3 года.
Скрининг на рак шейки матки не рекомендуется женщинам младше 21 года. Женщинам, у которых была гистерэктомия с удалением шейки матки, и у которых в анамнезе не было предракового поражения или рака шейки матки в анамнезе, скрининг рака шейки матки не требуется.
Для раннего выявления рака молочной железы рекомендуется проводить рентгеновскую маммографию каждые 2 года у женщин в возрасте от 50 до 74 лет.
Использование для скрининга УЗИ, МРТ или КТ молочных желез не оправдано. В некоторых ситуациях может потребоваться начало скрининга в более молодом возрасте.
USPSTF рекомендует на индивидуальной основе проводить скрининг рака предстательной железы у мужчин в возрасте 55-69 лет.
Изменение ранее существовавшего подхода о поголовном скрининге связано с тем, что при положительных результатах теста на ПСА, лечение проводится всем пациентам, тогда как на самом деле оно может потребоваться только половине из них.
Нередко высокие уровни ПСА выявляются при клинически незначимом раке: он не растет, не метастазирует, не приведет к смерти пациента, тогда как его лечение может привести к эректильной дисфункции, недержанию мочи, проблемам с контролем кишечника, небольшому риску смерти и серьезным осложнениям после операции.
Существуют также рекомендации по скринингу других видов рака (например, рака кожи), но они более индивидуальны.
Использовать различные методы для раннего выявления рака нужно и важно, только делать это нужно обоснованно, с оценкой рисков и пользы, с использованием профильных клинических рекомендаций.
В России работает замечательная организация под названием «Фонд профилактики рака», специалисты которой разработали информативный тест на основании подробного опросника, который поможет определиться с конкректными рекомендациями по скринингу некоторых видов рака в зависимости от пола, возраста, факторов риска.
Это бесплатный тест, и его можно пройти здесь.
источник
Под термином «колоректальный рак» скрывается очень опасный недуг, чаще всего поражающий эпителиальные ткани, выстилающие стенки ободочной и прямой кишок.
На локализацию злокачественных новообразований указывает само название болезни, образованное слиянием латинских обозначений этих отделов толстого кишечника: «колон» – ободочная, а «ректум» – прямая кишка.
Злокачественные новообразования, обозначаемые термином «колоректальный рак», представляют достаточно большую и весьма разнородную группу опухолей, характеризующихся различной локализацией, формой и гистологическим строением тканей.
Помимо толстой (ободочной) и прямой кишки злокачественные эпителиальные опухоли, именуемые колоректальным раком, могут поражать стенки слепой кишки и анального канала.
Колоректальный рак относится к числу невероятно распространенных недугов, с каждым десятилетием поражающих все большее количество пациентов.
Ещё два десятилетия назад ему принадлежало шестое место в структуре российских онкологических заболеваний. Сейчас он переместился на четвертую позицию в женской онкологии и на третью – в мужской.
К регионам, наиболее подверженным распространению колоректального рака, относятся страны Северной Америки, Новая Зеландия, Австралия и разные части Европы.
Онкологи Японии, население которой до недавнего времени не было подвержено этому недугу, утверждают, что к концу этого столетия колоректальный рак может стать главной причиной смертности граждан этой страны.
Характер роста злокачественных новообразований при колоректальном раке позволяет разделить их на три формы:
- экзофитные, распространяющиеся в просвет пораженной кишки;
- эндофитные, прорастающие кишечную стенку и развивающиеся в толще ее тканей;
- блюдцеобразные, имеющие плоское дно, приподнятые края и овальную форму, вытянутую вдоль кишки.
Многообразие клеточного строения злокачественных опухолей, поражающих ткани ободочной кишки, дает основание для подразделения их на:
- аденокарциномы (встречающиеся в 80% случаев колоректального рака);
- слизистые аденокарциномы, представленные мукоидным, коллоидным и слизистым раком (составляют 12% от числа всех опухолей);
- мукоцеллюлярный (перстневидно-клеточный) рак;
- рак недифференцированного типа (имеющий трабекулярные и медуллярные формы);
- рак неклассифицируемого типа.
Злокачественные опухоли прямой кишки помимо вышеперечисленных типов представлены структурами, имеющими:
Колоректальный рак является полиэтиологическим заболеванием, способным развиться вследствие воздействия целого ряда причин (как внешних, так и внутренних):
- Генетической предрасположенности. Выявление колоректального рака у одного из ближайших родственников автоматически относит к группе риска всех членов его семьи.
- Наличия предраковых состояний:синдромов Гарднера и Тюрко, болезни Крона, семейного аденоматозного полипоза, неспецифического язвенного колита. Чем продолжительнее воспалительный процесс – тем выше вероятность его малигнизации (озлокачествления).
- Принадлежности к возрастной категории старше пятидесяти лет.
- Наличия ожирения и сахарного диабета.
- Приверженности к употреблению мяса и продуктов, почти не содержащих растительных волокон. В сочетании с малоподвижным образом жизни этот фактор является виновником замедления перистальтики кишечника. Вследствие этого увеличивается время воздействия канцерогенных веществ, попавших в кишечник, на слизистую его стенок, провоцирующее развитие рака.
- Пристрастия к курению и употреблению алкогольных напитков.
- Ослабления иммунитета, обусловленного наличием хронических заболеваний.
- Недостатка кальция и выраженного гиповитаминоза.
Скринингом колоректального рака принято называть комплекс диагностических процедур, выполняемых с целью активного выявления пациентов с бессимптомно протекающим заболеванием или имеющих высокий риск его развития вследствие влияния генетического фактора.
Фото скрининга на колоректальный рак
Обнаружить колоректальный рак на ранних стадиях помогают скрининг тесты, состоящие в:
- исследовании кала на скрытую кровь;
- обследовании стенок прямой кишки с использованием сигмоидоскопа (сигмоидоскопия);
- выполнении процедуры колоноскопии;
- ректальной пальпации стенок прямой кишки;
- выполнении общего анализа крови;
- во взятии пробы крови на онкомаркеры, помогающие определить количество раковых клеток в тканях кишечника.
Колоректальный рак на начальных стадиях своего развития чаще всего протекает бессимптомно. По мере роста злокачественного новообразования появляются следующие признаки:
- необычная слабость, вялость, ощущение постоянного недомогания;
- расстройство сна;
- повышенная раздражительность;
- понижение аппетита;
- появление неприятного запаха в ротовой полости;
- боли в брюшной полости, степень интенсивности и характер которых обусловлены локализацией опухолевого процесса;
- ощущение желудочно-кишечного дискомфорта (наличие отрыжки, частая рвота и тошнота, ощущение тяжести в подложечной области, урчание и вздутие живота);
- нерегулярный характер стула, характеризующийся чередованием поносов и запоров.
Несмотря на достаточно широкий спектр проявлений, ранняя симптоматика колоректального рака не дает специфической картины.
На поздних стадиях колоректальный рак, характеризующихся нарушением работы многих внутренних органов и систем, присоединяется ряд общих симптомов:
- Появление патологических выделений (крови, гноя и слизи) из заднего прохода.
- Разная степень нарушения кишечной проходимости (от хронической до острой), чреватая развитием запоров.
- Развитие анемии, приводящей к сухости и бледности кожи, хрупкости ногтей и ломкости волос.
- Ухудшение общего состояния пациентов, проявляющегося в повышенной слабости, частых головокружениях, головной боли и значительном снижении работоспособности.
- Полная утрата аппетита.
- Резкое снижение массы тела.
- Повышение температуры тела до субфебрильных значений.
Колоректальный рак дает метастазы:
- В печень. Это – основной (не менее 50% случаев) путь метастазирования раковых клеток, обусловленный особенностями кровоснабжения печени, получающей большую часть крови из воротной вены, питаемой внутренними органами. У пациента с метастазами в печени наблюдается высокая степень истощения, постоянная тошнота и рвота, выраженная желтушность и зуд кожных покровов, наличие асцита (скопления жидкости в животе) и сильные боли в животе.
- В брюшину – пленку из соединительной ткани, покрывающую поверхность всех внутренних органов и выстилающую стенки брюшной полости. Раковые клетки, проросшие сквозь стенки пораженной кишки, сначала образуют очаги на отдельных участках брюшины, а захватив ее целиком, распространяются на покрытые ею соседние органы.
- В легкие. Больной с метастазами в легких страдает от одышки, боли в легких, постоянного кашля, сопровождаемого кровохарканьем.
Анализ на скрининг колоректального рака проводится при помощи:
- Пальцевого обследования прямой кишки. Этот простейший метод позволяет обнаружить до 70% локализованных в ней карцином.
- Ректороманоскопии. Использование жесткого ректороманоскопа позволяет исследовать состояние стенок прямой кишки и дистального отдела сигмовидной кишки. При обнаружении подозрительных новообразований выполняют биопсию их тканей.
- Ирригоскопии – процедуры, состоящей в выполнении бариевой клизмы и нагнетании воздуха для расширения просвета исследуемой кишки. Рентгеновские снимки, сделанные в ходе этого обследования, позволяют обнаружить полипы и злокачественные новообразования.
- Фиброколоноскопии. Использование гибкого фиброколоноскопа, оснащенного волоконной оптической системой, позволяет исследовать состояние толстого кишечника на всем его протяжении. Будучи самой точной и дорогой методикой исследования, фиброколоноскопия проводится на заключительном этапе обследования пациента.
Помимо вышеперечисленных методов обследования, считающихся основными, по отношению к пациенту применяют ряд дополнительных методик:
При колоректальном раке в сыворотке крови заболевшего человека чаще всего обнаруживают два опухолевых маркера:
- Маркер СА-19-9, имеющий прогностическое значение. Уровень, превышающий 37 нг/мл, указывает на то, что риск летальных исходов у прооперированных пациентов с таким результатом в 4 раза выше, чем у больных с более низким или отрицательным показателем.
- РЭА (раковоэмбриональный антиген). Как правило, повышенный уровень РЭА отмечается при уже запущенном заболевании, а высокий – при метастазировании опухоли в печень.
- Местом локализации колоректальной опухоли I стадии, занимающей меньшую часть окружности пораженной кишки, является ее слизистая оболочка и подслизистый слой. Метастазы в лимфоузлы отсутствуют.
- Злокачественное новообразование IIа стадии занимает примерно половину просвета кишки и ограничивается пределами ее стенок. Регионарные лимфоузлы при этом не поражены.
- Опухоль, достигшая IIб стадии и проросшая всю толщу кишечной стенки, начинает метастазировать в ближайшие регионарные лимфоузлы.
- Злокачественная опухоль III стадии занимает более половины кишечного просвета и дает множественные метастазы в лимфатические узлы.
- Опухоль IV стадии носит название метастатический колоректальный рак и характеризуется значительным размером и отдаленным метастазированием.
- Путем хирургического вмешательства, состоящего в удалении злокачественного новообразования (в ходе операции колэктомии или гемиколэктомии) и пораженных лимфоузлов (операция лимфаденэктомии). Операции могут быть открытыми, то есть выполненными путем разрезания брюшной стенки, и лапароскопическими – осуществленными через микроразрезы (при использовании манипуляторов и миниатюрных видеосистем).
- Методом химиотерапии – использования медикаментозных средств, способных приостановить деление раковых клеток. Химиотерапия при колоректальном раке кишечника может предварять операцию, ее нередко используют в послеоперационном периоде. Если опухоль неоперабельна, химиотерапия остается единственным методом лечения, способным улучшить качество жизни пациента.
- Методом радиотерапии, использующей силу рентгеновских лучей для уничтожения раковых клеток. Радиотерапию применяют и в качестве самостоятельного метода лечения, и в комплексе с химиотерапией.
Прогноз при колоректальном раке находится в прямой зависимости от стадии, на которой было выявлено злокачественное новообразование.
- Лечение опухолей, застигнутых в самом начале образования, заканчивается пятилетней выживаемостью 95% пациентов.
- Колоректальный рак III стадии, метастазировавший в лимфатические узлы, характеризуется пятилетней выживаемостью 45% больных.
- Злокачественная опухоль кишечника, удаленная на IV стадии, дает шанс на выживание менее 5% пациентов.
Первичная профилактика колоректального рака предусматривает:
- Рациональное питание, содержащее большое количество фруктов, овощей и продуктов с высоким содержанием пищевых волокон.
- Ограниченное употребление красного мяса и животных жиров.
- Отказ от употребления алкоголя и курения.
- Активный образ жизни.
- Контроль массы тела.
С чего начать лечение метастатического колоректального рака, расскажет следующее видео:
источник
«Колоректальный рак» — собирательное понятие для рака (опухоли) различных отделов толстой (colon) и прямой (rectum) кишки. Среди множества онкологических заболеваний эта патология остается наименее освещенной и наиболее покрытой мифами и страхами пациентов, но, тем не менее, современные возможности ранней диагностики дают основания считать КРР на

В России колоректальный рак занимает одну из ведущих позиций. Среди мужчин, заболевших злокачественными новообразованиями, КРР находится на 3-м место после рака легкого и желудка, а у женщин, соответственно, после рака молочной железы и рака кожи. Тревожным фактом является высокий уровень летальности на 1-м году жизни после установления диагноза, обусловленный тем, что при первичном обращении пациентов к врачу запущенные формы рака (III-IV стадии) уже имеют более 70% пациентов с раком ободочной кишки и более 60% пациентов с раком прямой кишки, при этом хирургическому лечению подвергается около 40% больных.
В США ежегодно регистрируется приблизительно 140 000 новых случаев болезни и около 50 000 летальных исходов по поводу КРР. Удивительно, но именно в США отмечается медленная, но постоянная тенденция снижения заболеваемости КРР, а показатели выживаемости при КРР – одни из самых высоких в мире. Данные отчетности Национального института рака США показывают, что 61% пациентов с данным диагнозом преодолел пятилетнюю выживаемость.
В США и многих других западных странах улучшение результатов достигнуто, в частности, своевременным обнаружением и удалением полипов толстой кишки, диагностикой КРР на ранней стадии и более эффективным лечением. К сожалению, во многих странах с ограниченными ресурсами и иной инфраструктурой здравоохранения, особенно в Центральной и Южной Америке и Восточной Европе, смертность от КРР продолжает расти.
Колоректальный рак чаще всего развивается как перерождение аденоматозных (железистых) полипов.
Несмотря на то, что наследственная предрасположенность значительно увеличивает риск развития КРР, большинство случаев является спорадическими (иными словами — непредсказуемыми, эпизодическими), а не семейными: приблизительно 80-95 % случаев спорадических против 5-20%, имеющих наследственную причину. Но среди всех других видов рака у человека КРР проявляет наибольшую связь с семейной заболеваемостью. Исследования молекулярных механизмов развития колоректального рака выявили ряд генетических нарушений, большинство из которых наследуется по аутосомно-доминантному типу и значительно повышает риск развития рака. Семейный аденоматозный полипоз и синдром Линча (наследственный неполипозный колоректальный рак) являются наиболее распространенными из семейных видов рака с изученными генетическими дефектами, вместе на их долю приходится лишь около 5% случаев колоректального рака.
Из других наиболее известных предрасполагающих факторов стоит отметить воспалительные заболевания кишечника (язвенный колит, болезнь Крона) — риск рака увеличивается с продолжительностью течения этих заболеваний. Общая заболеваемость колоректального рака начинает увеличиваться примерно через 8 –10 лет после возникновения воспалительного заболевания кишечника и возрастает до 15-20% через 30 лет. Главными факторами риска являются длительность заболевания, распространенность поражения, молодой возраст и наличие осложнений.
Возраст является значимым фактором риска: колоректальный рак является редкостью до 40 лет, однако частота колоректального рака увеличивается в каждом последующем десятилетии и достигает максимума в 60-75 лет.
Существуют факторы, которые повышают риск развития колоректального рака. Установлено, что популяции людей, в которых заболеваемость колоректального рака высока, употребляют пищу, бедную клетчаткой, но при этом с высоким содержанием животного белка, жира и рафинированных углеводов. Ожирение примерно в 1,5 раза увеличивает риск развития колоректального рака, причем в большей степени у мужчин. Избыточное употребление алкоголя и курение также находятся в числе факторов, повышающих спорадическую заболеваемость полипозом толстого кишечника и колоректального рака, и значительно увеличивают риск рака у пациентов с наследственными заболеваниями толстого кишечника (например, с синдромом Линча).
Это методы активного выявления лиц с факторами риска развития КРР или с бессимптомно протекающим КРР, основанные на применении специальных методов диагностики. Скрининговые исследования при колоректальном раке помогают значительно уменьшить вероятность его развития, так как позволяют выявить предраковое заболевание кишечника или рак на ранней стадии и своевременно оказать лечебную помощь.
В первую очередь скринингу подлежат лица, у которых среди родственников первой линии (у детей, родителей, братьев и сестер) имеются случаи рака толстой или прямой кишки, аденомы и воспалительные заболевания кишечника. Наличие у родственника такого диагноза увеличивает риск примерно в 2 раза по сравнению с популяцией в целом.
Рекомендации ряда научных сообществ по изучению колоректального рака (American College of Gastroenterology, Multisociety Task Force on Colorectal Cancer from the American Cancer Society, American College of Radiology) содержат указания по срокам проведения первой колоноскопии у следующих пациентов:
раннее, до 40 лет, у пациентов, имеющих ближайших родственников с аденомой кишечника, диагностированной в возрасте до 60 лет;
в срок на 10-15 лет раньше, чем был выявлен самый «молодой» КРР в семье, и/или этот диагноз был установлен в 60 лет и моложе.
Сроки скрининговых исследований могут быть изменены, если пациент имеет дополнительные факторы риска КРР: радиационные облучения брюшной полости в раннем возрасте по поводу рака, диагноз акромегалии (при котором возможно развитие аденоматоза толстой кишки), перенесенная трансплантация почки (как причина долгосрочной иммуносупрессивной терапии).
Правый отдел толстой кишки имеет большой диаметр, тонкую стенку и ее содержимое – это жидкость, поэтому закупорка просвета кишки (обтурация) развивается в последнюю очередь. Чаще пациентов беспокоит желудочно-кишечный дискомфорт, обусловленный расстройствами функций соседних органов — желудка, желчного пузыря, печени, поджелудочной железы. Кровотечение из опухоли обычно скрытое, и утомляемость и утренняя слабость, вызванные анемией, могут быть единственными жалобами. Опухоли иногда становятся достаточно большими, что позволяет прощупать их через брюшную стенку, прежде чем появятся другие признаки.
Левый отдел толстой кишки имеет меньший просвет, каловые массы в нем — полутвердой консистенции, и опухоль имеет тенденцию по кругу суживать просвет кишки, вызывая кишечную непроходимость. Застой кишечного содержимого активирует процессы гниения и брожения, что сопровождается вздутием кишечника, урчанием в животе. Запор сменяется обильным жидким, зловонным стулом. Больного беспокоят коликообразные боли в животе. Стул может быть смешан с кровью: кровотечение при раке толстой кишки наиболее часто связано уже с распадом или изъязвлением опухоли. У некоторых пациентов наблюдаются симптомы прободения кишки с развитием перитонита.
При раке прямой кишки основным признаком является кровотечение при дефекации. Всякий раз, когда наблюдается кровотечение или выделение крови из заднего прохода, даже при наличии выраженного геморроя или дивертикулярной болезни, должен быть исключен сопутствующий рак. Могут присутствовать позывы на дефекацию и ощущение неполного опорожнения кишечника. Боль появляется при вовлечении тканей, окружающих прямую кишку.
В ряде случаев, еще до появления кишечных симптомов у пациентов могут обнаруживаться признаки метастатического поражения – распространения опухоли в другие органы, например, увеличение печени, асцит (скопление жидкости в брюшной полости), увеличение надключичных лимфатических узлов.
Нарушение общего состояния больных может наблюдаться и на ранних стадиях и проявляется признаками анемии без видимого кровотечения, общим недомоганием, слабостью, иногда повышением температуры тела. Эти симптомы характерны для множества заболеваний, но их появление стать поводом для немедленного обращения к врачу общей практики.
У колоректального рака существует много «масок», поэтому следует обратиться к врачу за консультацией:
при повышенной утомляемости, одышке, нехарактерной для пациента бледности, если ранее их не было;
при длительных запорах или поносах;
при частых/постоянных болях в области живота;
при наличии видимой крови в кале после дефекации;
при наличии скрытой крови в анализе кала.
При острой боли в области живота, при вздутии или асимметрии живота, при отсутствии отхождения стула и газов следует вызвать «скорую помощь» или срочно обратиться за медицинской помощью.
Как только диагностирован рак, пациентам необходимо выполнить компьютерную томографию брюшной полости и грудной клетки с целью выявления метастатических поражений, а также лабораторные исследования для оценки выраженности анемии.
У 70 % пациентов с колоректальным раком наблюдается повышение уровня раково-эмбрионального антигена сыворотки (РЭА) и онкомаркера СА19.9. В дальнейшем мониторинг РЭА и СА19.9 может быть полезным для ранней диагностики рецидива опухоли. По показаниям исследуются и другие маркеры колоректального рака.
Основным скрининговым исследованием у пациентов старше 50 лет со средней степенью риска является колоноскопия. При наличии полипов или другой патологии в толстой и прямой кишке регулярность исследований может возрастать до ежегодных или каждые 3-10 лет. Оценивая степень риска развития колоректального рака у пациентов с заболеваниями кишечника, врач принимает решение о частоте проведения исследований индивидуально для каждого больного.
Лишь только такая активная позиция врачей по поводу ранней диагностики полипов и профилактике опухолей толстой и прямой кишки привела к замедлению темпов роста заболеваемости колоректального рака в США.
Хирургическое лечение колоректального рака может быть проведено у 70-95 % пациентов без признаков метастатической болезни. Хирургическое лечение заключается в удалении сегмента кишки с опухолью с местным лимфатическим аппаратом с последующим соединением концов кишки (созданием анастомоза) для сохранения естественной способности к опорожнению кишечника. При раке прямой кишки объем операции зависит от того, на каком расстоянии от анального отверстия расположена опухоль. Если необходимо полностью удалить прямую кишку, формируется постоянная колостома (хирургически созданное отверстие в передней брюшной стенке для выведения кишки), через которую содержимое кишечника будет опорожняться в калоприемник. Учитывая современные достижения медицины и приспособления для ухода за колостомой, негативные последствия этой операции сводятся к минимуму.
При наличии метастазов в печени у неистощенных пациентов рекомендуется удаление ограниченного числа метастазов в качестве дальнейшего метода хирургического лечения. Эта операция выполняется, если первичная опухоль была полностью удалена, метастаз печени находится в одной доле печени и отсутствуют внепеченочные метастазы. Выживаемость после операции в течение 5 лет составляет 6- 25 %.
Эффективность лечения колоректального рака зависит от того, на какой стадии болезни пациент обратился к врачу. Только ранняя диагностика колоректального рака позволяет максимально использовать весь спектр современных методов лечения и добиться удовлетворительных результатов.
Внимательное отношение к своему организму и своевременное обращение за квалифицированной медицинской помощью увеличивает шансы на продолжение активной жизни даже при таком серьезном онкологическом заболевании.
источник
Рак прямой кишки — вторая по встречаемости причина смерти в Соединенных Штатах, он же занимает второе место как причина смертности — 150 тысяч новых случаев в год и 61 тысяча смертей в год. В среднем клинически диагносцированные раки отнимают у своих жертв 6—7 лет жизни. По оценкам, 10-летнее выживание отмечается у 74% пациентов с локализованным поражением, у 34% лиц с местными метастазами и только у 5% с обширными метастазами.
Наряду с высокой смертностью рак прямой кишки является еще очень тяжелым заболеванием; резекции, колоноскопии, химиотерапия и облучение связаны с огромными неудобствами для пациента и изменением его жизненных привычек. Основные факторы риска рака прямой кишки включают семейный анамнез рака прямой кишки, polyposis col раковый синдром в семье, поражение эндометрия, яичников, грудной железы; наличие в анамнезе хронического язвенного колита, аденоматозных полипов или предшествовавшего рака прямой кишки.
Основным скрининговым тестом на определение рака прямой кишки у асимптоматичных пациентов является мануальное проктологическое обследование выявление скрытой крови в стуле и сигмоидоскопия. Пальцевая проверка прямой кишки имеет ограниченное применение как скрининговый тест на рак прямой кишки. Длина пальца всего 7—8 см, т. е. он не всегда достает до слизистой прямой кишки, длина которой составляет 11 см. Считается, что всего 10% раков прямой кишки можно пальпировать мануально.
Второй вариант скрининга — это определение скрытой крови в стуле. Положительная реакция на картонку, пропитанную гваяком —, наиболее употребительная форма такого теста, может сигнализировать о наличии кровотечений из предраковых аденом и раков прямой кишки на раннем этапе. Гваяковый тест может дать также ложно-положительные результаты: потребление пищи, содержащей пероксидазу соединения железа, содержание в пище веществ, вызывающих раздражение желудка, таких, как салицилаты и другие антивоспалительные агенты, также могут дать ложно-положительные результаты неоплазии.
Желудочно-кишечные кровотечения могут возникнуть и по другим поводам, а не только в связи с аденомами прямой и ободочной кишки или раком, например, геморрой, воспаление дивертикула, язва двенадцатиперстной кишки. В результате при выполнении теста на скрытую кровь в стуле у асимптоматичных лиц большинство положительных результатов на самом деле в отношении неоплазии ложно-положительны.
Если тест на выявление скрытой крови в стуле проводится на группах асимптоматичных пациентов в возрасте старше 50 лет, положительное прогностическое значение для карцином составляет всего 5—10% и для аденом 30%. Это большая доля ложно-положительных результатов бросает тень на всю процедуру в связи с неудобствами, расходами и временными осложнениями, связанными с последующими диагностическими тестами — такими, как введение бария клизмой и колоноскопия.
Тест на скрытую кровь в стуле может также упустить случаи, особенно небольшие аденомы и злокачественные изменения в прямой кишке, которые не дают кровотечения либо кровоточат лишь время от времени. Для того, чтобы дать стойкий положительный результат на картонку, пропитанную гваяком, ежедневная потеря крови должна составлять около 20 мл. Другие случаи ложно-отрицательных результатов включают разбросанное распределение крови в стуле, антиоксиданты, такие, как аскорбиновая кислота, которые мешают реагентам дать правильную реакцию, задержка в анализе проб стула.
Чувствительность сохраняемых слайдов можно улучшить за счет их дегидратации, но это увеличивает также число ложно-положительных реакций. Точная чувствительность теста на скрытую кровь в стуле у асимптоматичных лиц неизвестна; имеющиеся в отдельных работах данные 50—92% основаны на изучении лиц с известными злокачественными заболеваниями прямой кишки и их нельзя применять относительно всего населения.
Чувствительность у асимптоматичных лиц определяется от 20—25% в одних исследованиях (которые методологически были построены не так, чтобы могли правильно определять чувствительность) до 75% по предварительным данным работ, которые выполняются в настоящее время.
В качестве наиболее чувствительного и специфического теста определения скрытой крови в стуле предложено использовать «хемоквант» — тест количественного определения гемоглобина в стуле, предложенный фирмой «Смит Клайн Дайегностикс, Саннивейл». Он не только дает количественную информацию, но и менее подвержен наличию пероксидазы в пище, условиям хранения пробы, гидратации, аскорбиновой кислоте и кровотечению из верхнего отдела желудочно-кишечного тракта.
Однако повышенная чувствительность по крови может отразиться на снижении специфичности по определению неоплазии. Помимо этого, тест значительно дороже, чем обычные гваяковые картонки. Поскольку однозначные критерии определения оптимального теста еще не выработаны, можно сказать, что тест «хемоквант» не годится для широкого использования в клинике.
Третьим способом определения колоноректального рака является сигмоидоскопия. Скрининг с помощью сигмоидоскопии у асимптоматичных больных позволяет выявлять 1—4 случая рака на 1000 обследований. Однако чувствительность и диагностический результат этой формы скрининга очень зависят от типа используемого инструмента, то ли это жесткий сигмоидоскоп (25 см), то ли короткий (35 см) гибкий сигмоидоскоп с волоконной оптикой, то ли длинный (60 или 65 см) гибкий сигмоидоскоп с волоконной оптикой.
Поскольку только 30% раков прямой кишки происходят в 20 дистальных сантиметрах кишки и только 50—60% в сигмовидной кишке или дистально к ней, длина сигмоидоскопа непосредственным образом влияет на обнаружение рака. Жесткий сигмоидоскоп со средней длиной введения около 20 см позволяет обследовать только участки, лежащие как раз над соединением сигмовидной кишки с прямой, т. е. позволяет обнаружить всего 25—30% раков прямой кишки. В то же время гибкий сигмоидоскоп длиной 35 см позволяет увидеть 50—75% сигмовидной кишки.
Более длинные приборы длиной 60 или 65 см могут достичь проксимальный конец сигмовидной кишки в 80% всех исследованиях и таким образом обнаружить 50—60% всех раков прямой кишки. Недавно была проверена возможность введения гибкого сигмоидоскопа длиной 105 см в условиях осмотра домашним врачом, однако пока непонятно, действительно ли повышенная длина позволит заметно увеличить число выявления предраковых или злокачественных поражений.
Сигмоидоскопия может дать также «ложно-положительные» результаты, прежде всего при определении полипов, которые обычно во время жизни пациента злокачественными не становятся. Данные вскрытий показали, что 10—33% пожилых людей имели к моменту смерти полипы в прямой кишке, но только 2—3% — раки прямой кишки. В зависимости от типа аденоматозного полипа 5—40% становятся злокачественными причем этот процесс занимает в среднем 10—15 лет.
Таким образом, можно сделать вывод, что большинство асимптоматичных пациентов, у которых при рутинной сигмоидоскопии были обнаружены полипы прямой кишки, так и останутся с полипами, которые в течение их жизни не разовьются в злокачественные образования. Для таких лиц профилактические меры, которые обычно следуют за обнаружением полипа (например, биопсия, полипэктомия, частые колоноскопии — процедуры дорогие, неприятные для пациента и потенциально опасные), похоже, не дают какого-либо заметного клинического эффекта.
По-видимому, лица, у которых рак прямой кишки был диагносцирован на ранней стадии, живут дольше, чем лица с запущенной болезнью. 10-летний срок выживания составляет 74% у лиц с локализованными поражениями (А или В по Дьюксу), 36% для раковых заболеваний с местными метастазами (С по Дьюксу) и 5% для обширных метастазов (D по Дьюксу).
В то же время мало информации относительно того, насколько продолжительность наблюдения и наблюдение в условиях заданного результата сказываются на этих показаниях, а также относительно того, действительно ли асимптоматичные лица, у которых болезнь была обнаружена при скрининге, имеют более низкую смертность, чем в тех случаях, когда болезнь проявилась уже симптомами.
В настоящее время проводятся два контрольных исследования в Соединенных Штатах и три дополнительных контрольных работы в Европе, которые, как ожидается, предоставят необходимую информацию прежде всего по определению скрытой крови в стуле. Однако окончательные результаты станут известны только через несколько лет.
Часто приводят ссылки на рандомизированную контрольную работу по мультифазным обследованиям, из которой следует, что скрининг с помощью сигмоидоскопа может снизить смертность от рака прямой кишки. Лиц, принимавших участие в этом исследовании, уговаривали раз в год подвергнуться многопрофильному обследованию, лиц в контрольной группе ни к чему подобному не побуждали.
В числе многих профилактических мер в этом многоаспектном обследовании лицам в возрасте 40 лет и старше предлагали провести обследование жестким сигмоидоскопом. После 16-годичного наблюдения исследователи обнаружили, что в группе, в которой проводилось обследование, была значительно снижена смертность от рака прямой кишки, вполовину уменьшились случаи злокачественного поражения дистальной части кишечника, увеличилось число локализованных опухолей и снизилось количество летальных случаев.
Авторы советовали, однако, с осторожностью интерпретировать эти результаты, поскольку в исследовании не ставилась задача конкретно установить эффект сигмоидоскопии, а скорее проводилась просто многоаспектная проверка здоровья. Помимо этого, вопрос о роли сигмоидоскопии встал недавно снова, когда анализ данных показал очень небольшую разницу между исследованными и контрольными группами, одна из которых исследовалась с помощью сигмоидоскопии и где определялись показатели обнаружения и удаления полипов.
В пользу сигмоидоскопии приводят также результаты двух больших скрининговых программ. В обеих работах было показано, что лица, которых периодически обследовали жестким сигмоидоскопом, обнаруживали меньший прогресс заболевания и лучшие данные выживания, нежели лица с раком прямой кишки, который типичен для общей популяции. В одной программе было осуществлено 21 150 первичных обследований и 92 650 последующих сигмоидоскопии, частота рака прямой кишки в ней оказалась 85%, а в общей массе популяции в этом штате 65,66.
Однако участников этих исследований брали не на рандомизированной основе, и их изначально нельзя сравнивать со средними показателями населения в смысле риска рака прямой кишки. Поскольку ни в одной из этих работ не было контрольных групп, трудно с уверенностью делать вывод, что благоприятный клинический результат, наблюдаемый в этом исследовании, действительно следует отнести на счет сигмоидоскопического скрининга, а не на счет методологических моментов программы скрининга, либо состава ее участников. В недавно опубликованных работах были высказаны и другие соображения, критикующие методологию упомянутых исследований.
Важным соображением, которым нужно руководствоваться, оценивая эффективность сигмоидоскопического скрининга, является потенциальный ятрогенный риск, присущий этой процедуре. Осложнения при сигмоидоскопии у асимптоматичных пациентов довольно редки, но они могут оказаться серьезными. При использовании жесткого сигмоидоскопа в одном случае на 5—7 тысяч бывают перфорации. Хотя по гибкой сигмоидоскопии данных меньше, осложнения здесь встречаются также редко, как при жесткой сигмоидоскопии или еще реже.
Даже если скрининг дает эффект в смысле снижения смертности от рака прямой кишки, имеется мало информации относительно того, каков оптимальный возраст, когда следует начинать скрининг или с какой частотой его следует проводить. Теоретически положительный эффект должен увеличиваться, начиная с возраста 50 лет, поскольку частота раковых заболеваний прямой кишки с этой поры удваивается каждые семь лет.
При отсутствии прямых сведений по имеющимся работам была сделана попытка оценить эффективность различных процедур скрининга, используя математические модели; в одном таком исследовании высказано предположение, что задержка с началом скрининга на 10 лет (т. е. начинать в 50, а не в 40 лет) для лиц с семейным анамнезом рака прямой кишки приводит к снижению эффективности на 5—10%.
В том же исследовании подсчитывается, что продление интервала скрининга до 3—5-летнего вместо ежегодного даст сохранение эффективности обнаружения рака у лиц с семейным анамнезом рака прямой кишки на уровне 70—90%. Еще в одном модельном исследовании было обнаружено, что интервал в два-три года позволяет обнаружить 95% полипоидных поражений диаметром больше 13 мм.
Американское раковое общество рекомендует проводить ежегодную пальцевую проктологическую проверку для всех взрослых, начиная с 40-летнего возраста, и определять скрытую кровь в стуле, начиная с 50 лет; с 50-летнего же возраста рекомендуется также каждые 3—5 лет проводить сигмоидоскопию. Сходные рекомендации были опубликованы Национальным раковым институтом, Американской гастроэнтерологической ассоциацией, Американским обществом желудочно-кишечной эндоскопии и другими группами.
Канадский комитет не упоминает сигмоидоскопию, но рекомендует ежегодно проводить тест на, выявление скрытой крови в стуле для лиц повышенной группы риска старше 45 лет. Другие эксперты по вопросам массовых периодических проверок здоровья высказываются против рутинной сигмоидоскопии, но выступают за тест на скрытую кровь в стуле каждые два года в возрасте 40—50 лет и затем ежегодно.
Важным моментом, лимитирующим эффективность скрининга рака прямой кишки, является необходимость выдерживать условия тестирования пациентом и врачом. Пациенты могут не выдерживать теста на определение скрытой крови в стуле по целому ряду причин, однако все же этот тест для них проще, чем сигмоидоскопия. Хотя введение гибкого инструмента с волоконной оптикой сделало эту процедуру более приемлемой для больного, процедура эта остается неудобной, малоприятной и дорогой, поэтому многие пациенты склонны избегать данного теста.
В недавнем исследовании, в котором были включены пациенты в возрасте старше 50 лет, оказалось, что только 13% человек высказывали пожелание подвергнуться сигмоидоскопии после того, как их информировали, что тест надо будет повторять каждые 3—5 лет. Среди причин, по которым пациенты отказывались от теста, чаще всего упоминали стоимость (31 %), дискомфорт (12%), опасения (9%).
В одном исследовании, где сигмоидоскопия рекомендовалась повторно, только 31 % согласился на эту процедуру, в то время, как в эти годы сигмоидоскопия была типична для данного теста. Лишь 6—12% соглашались на процедуру. Врачи также неохотно выполняют эту процедуру на асимптоматичных больных.
Было показано, что типичный домашний врач, у которого имеется 3 тысячи активных пациентов (треть из них старше 50 лет) должен был бы выполнять ежедневно до пяти сигмоидоскопии в качестве первоначального скрининга и два раза для последующего тестирования. К тому же обследования, в которых используется более эффективный длинный (60 или 65 см) гибкий сигмоидоскоп, занимают больше времени и требуют большего навыка, чем более короткий инструмент.
Другим лимитирующим фактором является цена. Хотя соотношение расходов на скрининг с теми экономическими преимуществами, которые дает эффективный метод определения рака прямой кишки предметом рассмотрения данной главы не является, все же следует отметить, что расходы, связанные с массовым выполнением теста на скрытую кровь в стуле и сигмоидоскопию, весьма значительны. Одно только исследование с помощью гибкого сигмоидоскопа стоит от 100 до 200 долларов.
Программа рутинного использования сигмоидоскопии и теста на определение скрытой крови в стуле для всех жителей Соединенных Штатов старше 50 лет (т. е. больше 62 миллионов человек) обошлась бы стране более чем в миллиард долларов только прямых расходов. Есть и другие подсчеты, согласно которым только выполнение скрининга тестом «хемокульт» (фирма «Смит Клайн Дайегностикс», Саннивейл, Калифорния) ежегодно выльется в сумму от 500 миллионов до 1 миллиарда долларов.
Выполнение скрининговых тестов на большой части населения Америки было бы оправдано, если бы скрининг позволял предотвратить заболеваемость и смертность от рака прямой кишки, но убедительных доказательств в пользу этого пока нет. Подытоживая аргументы за и против скрининга асимптоматичных пациентов по поводу рака прямой кишки, нельзя утверждать, что такой скрининг значительно снижает смертность от этого заболевания, следует дождаться завершения проводимых в настоящее время клинических исследований.
При отсутствии однозначных доказательств широкое распространение скрининга асимптоматичных пациентов на полипы или рак прямой кишки представляется преждевременным. Необходимо иметь в виду и те технические трудности, с которыми столкнулось бы выполнение теста на определение скрытой крови в стуле и сигмоидоскопии на больших массах населения Соединенных Штатов, и активное неприятие теста и объем расходов на выполнение скрининга и последующие наблюдения.
Наконец, нельзя сбрасывать со счетов и возможные нежелательные последствия массового тестирования, в частности, ложно-положительные результаты, которые заставляют дополнять тест дорогими и небезопасными диагностическими процедурами. Скрининг лиц, относящихся к группе риска по раку прямой кишки, может быть клинически оправданным, но прямых доказательств его положительного эффекта также нет.
В настоящее время нет достаточных доказательств, которые однозначно свидетельствовали бы за или против выполнения теста на определение скрытой крови в стуле или сигмоидоскопии как эффективном скрининговом тесте на рак прямой кишки у асимптоматичных пациентов. В то же время не существует и убедительных основании, чтобы прекратить проводить такую форму скрининга, если она уже практикуется, или отказывать в нем лицу, которое хотело бы выполнить тест.
С клинической точки зрения целесообразно предложить подобный скрининг лицам старше 50 лет, у которых имеются ближайшие родственники с раковыми заболеваниями прямой кишки, либо в собственном анамнезе уже были раковые заболевания эндометрия, яичников, груди, предшествовавшее воспалительное поражение кишечника, аденоматозные полипы, рак прямой кишки.
Этих пациентов необходимо проинформировать о современных взглядах медиков на преимущества и риски определения скрытой крови в стуле и сигмоидоскопии, а также на недостаточную определенность в этом вопросе. При проведении теста на скрытую кровь в стуле надо придерживаться рекомендаций относительно диеты, сбора пробы и ее хранения. Сигмоидоскопию должны выполнять опытные врачи.
При выборе подходящего инструмента следует руководствоваться опытом исследователя и удобством пациента. Оптимальные интервалы выполнения скриниговых тестов на рак прямой кишки неизвестны и оставляются на усмотрение врача. Для всех лиц, у которых в семейной анамнезе имеются polyposis coli или раковый синдром, рекомендуется периодически выполнять колоноскопию.
Г. И. Гаева, И. В. Левандовского, А. И. Спирина
источник