Обнаружение микобактерий туберкулеза (M. tuberculosis – M. bovis complex) (в крови; моче; мокроте; мазке из зева; ПЦР)
Ключевые слова: микобактерия палочка Коха микобактериальная инфекция туберкулезный комплекс МБТ
Обнаружение микобактерий туберкулеза (M. Tuberculosis — M. bovis complex) в биологических жидкостях (крови, моче, мокроте, плевральной жидкости) — показатель инфицирования микобактериями туберкулеза. Определяется методом обнаружения ДНК в полимеразной цепной реакции (ПЦР). Основные показания к применению: диагностика туберкулеза различной локализации, контроль за лечением.
Выявление микобактерий туберкулеза методом ПЦР является перспективным способом диагностики инфицирования, поскольку тест имеет высокую чувствительность и специфичность и позволяет использовать разнообразный биологический материал. Считается, что для обнаружения ДНК достаточно 10 микобактерий в исследуемом образце. Микробиологические способы диагностики длятся в течение нескольких недель (4-8 недель или на высокоселективных средах с течение 2-х недель) и обладают низкой чувствительностью. Следует учитывать, что в настоящее время ПЦР анализ не заменяет использование бактериологического метода. Одновременное использование серологических методов диагностики и ПЦР позволяют быстрее проводить исследование и контролировать эффективность лечения.
Туберкулез вызывается микобактериями туберкулеза и передается от инфекционного источника по воздуху к другим людям, предрасположенным к этому заболеванию. При кашле или чихании, частицы (1 — 5 микрон),содержащие микобактерии, распыляются в воздухе. Они могут оставаться в воздухе в течение нескольких часов. При вдыхании другим человеком часть частиц оседает в верхних дыхательных путях, некоторые частицы проникают и в нижние отделы легких. Первоначально, туберкулезные палочки размножаются в альвеолярных макрофагах. Некоторое количество бактерий распространяется через лимфатические пути к регионарным лимфатическим узлам и по кровеносным сосудам к другим органам. В течение нескольких недель иммунная система способна приостанавливать размножение туберкулезных палочек. В это время, большинство инфицированных людей имеет положительную реакцию на туберкулиновый тест. Туберкулез может развиться как болезнь, когда туберкулезные палочки начинают размножаться. Люди с иммунносупрессией (ослабленным иммунитетом) наиболее подвержены риску заболеть туберкулезом. Всего известно около 70 видов микобактерий, но только 5 из них вызывают заболевание туберкулезом, которые объединяются в туберкулезный комплекс — M.tuberculosis complex:
- 1. M.tuberculosis humanus (M.tuberculosis) — человеческий тип, вызывающий до 85% случаев туберкулеза (по другим данным до 92 %).
- 2. M.tuberculosis bovinus (M.bovis) — бычий тип, вызывающий 10-15% случаев туберкулеза (по другим данным до 5%).
- 3. M.tuberculosis africanus (M.africanus) — африканский тип, вызывающий до 90% случаев туберкулеза в Южной Африке.
- 4. M.tuberculosis microti (M. microti) — мышиный тип, редко вызывает заболевание.
- 5. M.tuberculosis bovinus (M. bovis BCG) — вакцинный штамм, применяющийся для специфической профилактики от туберкулеза.
Существует целый ряд условно-патогенных нетуберкулезных микобактерий (НТМБ), в частности относящихся к комплексу MAIS (M. avium, intracellulare, M. scrofulaceum), которые могут вызвать микобактериозы, определяемые как «болезнь компрометированного хозяина».
Наиболее чато при туберкулезе поражаются легкие (около 85% всех случаев туберкулеза). Туберкулез может вызывать также поражение костей, почек, лимфатической системы, мочеполовой системы, центральной нервной системы. Внелегочный туберкулез часто обнаруживается у ВИЧ-инфицированных пациентов.
Специфичность определения составляет 98%, чувствительность определения не менее 80 днк-копий в 5 мкл прошедшей обработку (выделение ДНК) пробе.
источник
Определение специфического участка ДНК Mycobacterium tuberculosis методом полимеразной цепной реакции (ПЦР) в мокроте или плевральной жидкости.
Туберкулёз (от лат. tuberculum — бугорок) – инфекционное заболевание, вызываемое мико-бактериями туберкулёза и характеризующееся развитием клеточной аллергии, специфических гранулём в различных органах и тканях и полиморфной клинической картиной. Характерно поражение лёгких, лимфатической системы, костей, суставов, мочеполовых органов, кожи, глаз, нервной системы. При отсутствии лечения болезнь прогрессирует . Болеют им и животные. Возбудитель туберкулёза открыт Р. Кохом в 1882 г. Это кислотоустойчивые аэробные бактерии (74 вида) рода mycobacterium, широко распространённые в почве, воде и у животных. У человека чаще всего возбудителем является Mycobacterium tuberculosis. Они очень устойчивы ко многим факторам внешней среды, а в организме очень долго остаются жизнеспособными и могут вызвать заболевание через многие годы после заражения. Очень важно, что микобактерии туберкулёза могут образовывать так называемые L-формы. Сохраняясь в организме, они создают противотуберкулёзный иммунитет.
Очень высока заболеваемость туберкулезом у людей с ослабленной иммунной системой. В эту группу риска входят люди, инфицированные ВИЧ, диабетики и больные, принимающие иммуносупрессанты. Кроме этого, в группу риска входят больные с хроническими заболеваниями легких, а также недоедающие люди, живущие в перенаселенных и антисанитарных условиях. В основном, самыми предрасположенными к заболеванию туберкулезом группами населения являются старики и дети.
При развитии первоначальной инфекции могут появиться следующие симпотомы (у большинства людей они отсутствуют):
По мере прогрессирования болезни обычно в течение 2–6 недель появляются другие симптомы, но прогрессирование может идти и намного быстрее. Поздние симптомы включают:
— персистируюший кашель с зеленоватой или желтоватой мокротой, в которой иногда видны прожилки крови;
— боль в груди при глубоком вдохе;
— плохой аппетит и потеря веса;
— обильная потливость ночью;
При отсутствии лечения легочного туберкулеза возможно распространение инфекции в ткани перикарда. Помимо этого, через кровь инфекция может проникнуть в головной мозг, кости и другие органы.
Длительное время туберкулёз может протекать скрыто и обнаруживаться случайно при проведении рентгенологических исследований, хотя нередко уже проявляются такие симптомы, как слабость, быстрая утомляемость, субфебрильная температура, ночная потливость, а в крови – анемия и лейкопения.
Существует много методов лабораторной диагностики туберкулёза: микроскопия мазка (чаще всего для этого используют мокроту), классический культуральный метод, ИФА. Всем им присущи достоинства, но и определённые недостатки, в частности, обнаружение микобактерий только в случае их достаточного количества.
В последние годы для диагностики используют полимеразную цепную реакцию (ПЦР). Её высокая чувствительность позволяет обнаружить в исследуемом материале единичные клетки и даже их фрагменты ДНК. Метод исключает перекрёстные реакции и специфичность достигает 100%. ПЦР позволяет дифференцировать ограниченные и диссеминированные формы туберкулёза, особенно у детей даже при отрицательных результатах микробиологических исследований.
Аналитические показатели:
- определение специфического участка ДНК Mycobacterium tuberculosis методом полимеразной цепной реакции (ПЦР) в мокроте или плевральной жидкости;
- специфичность определения — 98%;
- чувствительность определения не менее 100 днк-копий в 5 мкл прошедшей обработку (выделение ДНК) пробе.
- Бронхиты, бронхопневмонии сопровождающиеся резким увеличением прикорневых лимфатических узлов.
- Кровохарканье на фоне общего астенического состояния.
- Острые воспаления верхних и нижних дыхательных путей, сопровождающиеся продуктивным кашлем при наличии длительного контакта с больным туберкулёзом в анамнезе.
Единицы измерения: тест качественный. Результат выдаётся в терминах «обнаружено» или «не обнаружено».
Референсные значения: не обнаружено.
Положительный результат:
- инфицирование Mycobacterium tuberculosis;
- ложноположительный результат: обнаружение фрагментов ДНК нежизнеспособных микобактерий туберкулёза (эффективная терапия).
Отрицательный результат:
- отсутствие инфицирования;
- недостаточное количество детектируемых частиц.
источник
Полимеразная цепная реакция (далее ПЦР) — это высокоточный метод молекулярно-генетического исследования материла, который позволяет выявить у человека различные инфекционные заболевания и установить генотип возбудителя.
ПЦР для выявления различных заболеваний стала применяться в самом конце прошлого века. Первооткрывателем этого метода исследования является американский биохимик Кэри Муллис. Свое открытие он сделал в 1983 году. Но еще несколько лет понадобилось, чтобы доработать метод.
С помощью ПЦР-диагностики можно обнаружить фрагменты чужеродного ДНК в любой жидкой среде организма. На анализ могут быть взяты такие жидкости:
- Кровь.
- Слюна.
- Мокрота.
- Выделения из половых органов.
- Смывная жидкость бронхов.
- Желудочный сок.
Лечащий врач сам определяет, какую биологическую жидкость лучше взять на анализ при конкретном заболевании.
ПЦР-диагностика позволяет не только обнаружить микрофрагменты чужеродной ДНК, но и определить к какому конкретному виду она относится. То есть с помощью ПЦР можно не только точно установить возбудителя заболевания, но и выяснить к какому виду он принадлежит.
Процесс анализа ПЦР — очень сложный. Он состоит из нескольких этапов:
- Сначала нужно обнаружить фрагменты вредоносной ДНК в предоставленном образце.
- Копирование фрагмента ДНК. Маленького участка ДНК для анализа недостаточно, поэтому его копируют. Нуклеиновая кислота может копироваться в пробирке с помощью фермента полимеразы (вне живого организма). В пробирке образуется множество клонов, то есть происходит цепная реакция. Весь процесс происходит в три этапа под воздействием различных температур.
- Когда генетического материала становится достаточно для исследования, тогда возбудитель определяется обычными методами.
Метод ПЦР очень точен и может выявить наличие любого возбудителя по небольшому фрагменту ДНК или РНК.
ПЦР-анализ на туберкулез является самым информативным методом диагностирования этого заболевания. Относительно туберкулеза этот метод позволяет не только установить наличие микобактерий в организме, но и определить к какому виду они принадлежат.
Результат ПЦР диагностики может быть простой и расширенный. В простом результате указывается только наличие/отсутствие микобактерии. Расширенный результат дает представление о дополнительных параметрах протекания заболевания. Правильно понять, что написано в результате анализа ПЦР может только фтизиатр.
ПЦР-диагностика туберкулеза не проводится всем без исключения. Это объясняется дороговизной реактивов и недоступностью проведения исследования в некоторых отдалённых районах (в таких местах пользуются другими методами диагностики).
Показаниями для проведения ПЦР-исследования являются:
- Длительный контакт с больным туберкулезом.
- Беременность. ПЦР крови на туберкулез является самым быстрым и безопасным методом для беременной женщины.
- Экстренная ситуация. Например, необходимость срочного оперативного вмешательства, при котором нужно точно установить наличие/отсутствие туберкулеза в организме.
- Аллергическая реакция на туберкулиновые пробы.
- ВИЧ-инфекция.
- Невозможность диагностирования заболевания другими способами, при наличии явных признаков туберкулеза.
- Неоднозначные симптомы, которые не позволяют создать четкую клиническую картину заболевания (болезни верхних дыхательных путей, сопровождающиеся большим количеством мокроты, кровохарканьем и пр.).
Метод ПЦР, при всей своей сложности и дороговизне, проводится и расшифровывается в течение нескольких часов. Что делает этот метод золотым стандартом при диагностике туберкулезной инфекции.
Забор материала — это первый этап при выполнении ПЦР-исследования. Для того, чтобы выполнить качественный анализ, нужно соблюдать определенные правила по сбору материла:
- Для ПЦР мокроты на туберкулез нужно тщательно провести туалет полости рта. Делать это нужно вечером и утром перед анализом. Все это время не есть. Вечером выпить муколитическое средство для лучшего отхождения мокроты.
- Перед сдачей крови на ПЦР нужно не употреблять пищу в течение 8 часов. Лучше всего производить забор крови утором натощак. Курить перед забором крови также нельзя. Кровь берется из вены на локтевом сгибе руки в стерильную пробирку. В эту же емкость добавляется антикоагулянт, чтобы кровь оставалась жидкой. Смешивать антикоагулянт с кровью нужно очень аккуратно, не делая резких движений. Если кровь была взята не в лабораторных условиях, то она должна быть предоставлена лаборанту до истечения пятичасового срока. Иначе результат может быть не точным.
- Моча собирается в стерильную емкость утром, до приема пищи. Перед сбором мочи необходим тщательный туалет промежности.
- Остальные виды жидкостей (смывы с бронхов, спинномозговая жидкость) может собрать только специалист в условиях стационара.
- Перед забором жидкостей на ПЦР-исследование запрещено принимать некоторые препараты (например, прием некоторых антибиотиков нужно прекратить за две недели до забора материала).
- Требования к лаборатории, в которой проводится забор анализов на ПЦР очень строгие. Лаборатория должна быть стерильна, чтобы не произошло перекрестное загрязнение материала. В этом случае результаты могут быть ложноположительными.
ПЦР-тест на туберкулез — высокоточный информативный анализ. И требования к его проведению крайне строгие. Чтобы анализ получился, нужно соблюдать регламент.
Для работы в ПЦР-лаборатории приглашаются специально обученные врачи: бактериологи, вирусологи, микробиологи. Все они прошли дополнительное обучение для работы на сложном оборудовании.
Лаборатория должна иметь лицензию на выполнение работ связанных с бактериологически-опасными вирусами и бактериями.
В самой лаборатории должны быть выделены такие рабочие зоны:
- Зона приемки и сортировки проб.
- Зона подготовки проб. В этом помещении выделяются нуклеиновые кислоты из образцов материала.
- Зона проведения реакционных проб.
- Зона для учета результатов и расшифровки анализов.
Все помещения располагают последовательно. Допуск в эти зоны разрешен только работающим там сотрудникам, которые при входе соблюдают правила личной защиты от бактерий и вирусов.
Лучше, если есть возможность расположить лабораторию в отдельно стоящем здании с собственной системой вентиляции.
В лаборатории соблюдаются стерильные условия работы, чтобы избежать перекрестного загрязнения проб. Даже если один фрагмент чужеродной ДНК попадет в исследуемый материал, ПЦР его размножит, и анализ получится ложноположительным.
В каждой зоне лаборатории имеется свой набор оборудования и посуды для проведения исследований. Также имеются свои холодильники, которые не могут быть использованы в других целях, кроме хранения материала конкретной зоны исследований.
Использованные расходные материалы и остатки биологического материала уничтожаются специальными способами, в соответствии с инструкциями.
ПЦР-тест на туберкулез имеет множество плюсов, которые делают этот метод диагностики все более востребованным:
- Срок проведения. Несмотря на сложность проведения анализа, он готовится намного быстрее других лабораторных методов диагностики туберкулеза (около пяти часов). Это свойство анализа ПЦР становится особенно важным, когда анализ необходимо провести экстренно.
- Анализ ПЦР абсолютно безопасен и может проводиться беременным женщинам и детям.
- ПЦР-исследование можно сделать, когда по каким-то причинам нельзя выполнить другие методы диагностики.
- С помощью ПЦР-диагностики можно провести исследование любой биологической жидкости на выбор. В некоторых случаях это имеет большое значение.
- Позволяет обнаружить возбудителя на любой фазе заболевания. Даже после проведенного лечения, сохранившиеся остатки ДНК мертвых микобактерий будут обнаружены.
- Высочайшая чувствительность этого метода позволяет обнаруживать в биологическом материале даже единичные фрагменты ДНК микроорганизмов.
- Метод ПЦР позволяет не только обнаружить присутствие заболевания, но и может определить генотип возбудителя, отличив его от похожих микроорганизмов.
- ПЦР-исследование очень эффективно при рецидивирующем течении заболевания.
- Благодаря высочайшей чувствительности, анализ ПЦР может распознать микобактерии в организме человека, когда он только недавно инфицировался туберкулезом, задолго до появления клинических симптомов.
Казалось бы, метод ПЦР-диагностики содержит в себе только плюсы, но это не так.
Минусы этого метода исследования тоже существенны. При выборе метода исследования туберкулеза это также стоит учитывать:
- Это дорогостоящий метод исследования. Для проведения ПЦР-диагностики нужна специально-оборудованная лаборатория. Оборудование для таких исследований стоит очень дорого, и не во всякой лаборатории оно имеется. В крайнем случае, можно обратиться в платную лабораторию.
- Сразу же после проведенного лечения метод ПЦР применять не рекомендуется. В крови пациента некоторое время сохраняется небольшое количество живых и мертвых микобактерий. Если провести анализ в этот период, он покажет ложноположительный результат.
- При мутациях микобактерий, анализ будет недостоверным, так как нормальная ДНК не сможет синтезироваться.
- Для ПЦР-исследования имеет значение правильный выбор биологической жидкости на анализ.
- Сверхчувствительность. Это тот случай, когда достоинство метода становится его недостатком. Если при проведении анализа в биологический материал каким-то образом попадет даже единичный фрагмент чужеродного ДНК, то ПЦР его размножит, и будет получен ложный результат.
ПЦР-лаборатория имеется только в крупных противотуберкулезных диспансерах и диагностических центрах.
Объясняется это высокой стоимостью оборудования и высокими требованиями к содержанию лаборатории (реактивы, обработка).
Медицинские чиновники не сильно переживают из-за отсутствия ПЦР-лаборатории в каком-то конкретном населенном пункте, поскольку анализы на туберкулёз можно провести другими методами (культивирование микобактерий, микроскопическое исследование).
Если в населённом пункте нет бесплатной ПЦР-лаборатории, пациент по желанию может обратиться в платное учреждение.
В последнее время ПЦР-диагностика занимает все более прочные позиции в диагностике туберкулеза и других заболеваний, отодвигая на задний план другие методы диагностики.
источник

Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ).
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
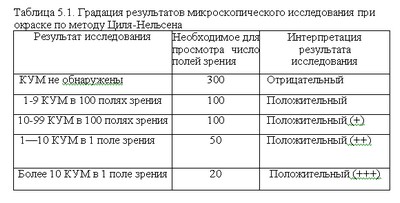
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице:
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Интенсивность роста МБТ определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++» 21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бактериовыделение).
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Система ВАСТЕС MGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями 02. В процессе роста МБТ поглощают 02, что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов, основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
источник
Для выявления палочки Коха в организме человека, используют разные диагностические методы. Благодаря ним патологию можно обнаружить даже на начальном этапе, что увеличивает шансы больного на выздоровление. Анализ мокроты на туберкулез – это методика, которая наиболее ценится, так является достаточно эффективной. Что она собой представляет и сколько стоит такой анализ?
ПЦР расшифровывается как полимеразная цепная реакция. Данный способ эффективен по отношению к инфекционным болезням. Чтобы установить четкий диагноз не нужно собирать большое количество биоматериала и ждать много времени, как при бак-посеве мокроты.
В основе методики лежит получение ДНК частиц микроорганизма. Далее молекулярно-генетическое исследование определит, к какому типу микроорганизмов стоит отнести имеющийся материал. В пробирочных условиях за несколько часов специалист синтезирует молекулы бактерий и делает соответствующие выводы.
Анализ мокроты на микобактерии туберкулеза эффективен тогда, когда палочка Коха поразила органы дыхания. В таком случае без труда можно выявить болезнь, даже в первые часы инфицирования.
Но, анализ мокроты не покажет достоверного результата, если присутствует туберкулез:
- костей;
- головного, спинного мозга;
- нервной системы;
- суставов и пр.
Определить вид заболевания сможет фтизиатр, учитывая присутствующую симптоматику и опираясь на полученные результаты общих и иных анализов.
Также нецелесообразен такой метод исследования в том случае, когда нужно провести контрольный анализ после терапевтического лечения заболевания. Результат будет положительным, так как в организме в любом случае еще имеются живые или мертвые МБК. Тут лучше отдать предпочтение другой диагностической процедуре.
Как таковых противопоказаний для исследования мокроты на туберкулез при помощи ПЦР нет. Есть ограничения. Как уже говорилось выше, нет надобности в его проведении после лечения туберкулеза. Полученные результаты не принесут пользы. Тут желательно прибегнуть к иной диагностике.
Кроме этого, нет никаких иных препятствия для проведения этой диагностики. Исследовать мокроту можно в любой возрастной категории и при любых сопутствующих заболеваниях. Даже если нет обильного выхода мокроты, анализ можно сделать путем забора слизи с помощью бронхоскопии.
У рассматриваемого метода масса плюсов, к ним относится:
- Высокая специфичность и чувствительность. Выявляется только возбудитель туберкулеза. Ложного ответа быть не может, если учтены все нюансы проведения процедуры. Микобактерии обнаруживаются даже тогда, когда их минимальное количество. Даже если в собранном материале 10 патологических клеток, инфекция будет выявлена.
- Быстрота получения ответа. Сколько делается анализ? Уже через 3-5 часов можно получить результат. Тут не нужно делать посев мокроты на туберкулез, и это сужает сроки.
- Выявить можно как скрытую инфекцию, так и ту, которая находится в острой форме.
- Нет абсолютных противопоказаний. Это дает возможность проводить процедуру всем без исключения (даже маленьким детям) и особенно тогда, когда другие методы неразрешены.
- При помощи ПЦР-диагностики изучается различный биоматериал (урина, кал, кровь, слюна, спинномозговая жидкость и др.).
- Метод выявляет туберкулез и на ранних стадиях, в первые часы после заражения.
к содержанию ↑
Помимо положительных сторон, есть и отрицательные. Это:
- Анализ на ПЦР – дорогое «удовольствие». Кроме этого, оборудование, необходимое для его проведения имеется не в каждом медицинском центре. В поликлиниках оно присутствует редко, так как его стоимость также велика. Если говорить о частных клиниках, то да, найти такой вид диагностики можно. Позволить его себе, к сожалению, может не каждый.
- Показывает ложноположительный результат у тех людей, которые недавно прошли курс противотуберкулезного лечения.
- Если МБК мутировали, то метод может также дать ложные результаты.
- Если материал собран неправильно, или специалист, который проводит исследование, имеет недостаточный квалификационный уровень, то также возможен сбой. В некоторых случаях повторять процедуру придется несколько раз и каждый раз оплата повторяется.
к содержанию ↑
Чтобы материал был качественным, его нужно собрать правильно и подготовиться к этому как следует.
Существуют определенные правила сбора мокроты на туберкулез. Алгоритм действий заключается в следующем:
- Еще накануне, вечером человеку нужно выпить отхаркивающее средство (если мокрота плохо отходит). Если даже это не помогло, следует провести ингаляцию на основе лекарственного разжижающего и отхаркивающего препарата. При отсутствии мокроты пациента нацеливают на то, что будет производиться бронхоскопия. Именно во время этой процедуры и берется материал для исследования.
- Заранее приобрести специальную емкость. Она стерильная и герметичная, поэтому ничего лишнего туда помещать нельзя, также как и открывать заранее.
- Помещение, где будет собираться мокрота должно хорошо вентилироваться. Нужно открыть окна, двери, включить вытяжку. Еще один неплохой вариант – выйти на свежий воздух (например, на балкон или во двор).
- Непосредственно перед процедурой нужно всех предупредить, чтобы никто не входил в комнату, где будет все происходить. Никаких лишних микрочастиц в биоматериале быть не должно – это важно.
- Принимать пищу до сбора не рекомендуется.
- Рот и глотка полощутся.
- Слюна выплевывается. Ее в емкость должно попасть минимальное количество.
- Путем откашливания человек выводит мокроту наружу и сплевывает ее в подготовленный контейнер. После окончания процедуры нужно плотно закрыть крышку и отвести образец в лабораторию.
Как правильно собрать мокроту должен рассказать врач. Если больной не решается сделать это самостоятельно, то на помощь приходят медработники. Во время манипуляции они надевают специальную защитную маску. Собирать мокроту будут в специальном кабинете, куда нет хода посторонним. Если прийти в клинику больной не может, то специалист приезжает к нему на дом и помогает осуществить сбор слизи.
Если делается бронхоскопия, то больному вводят в трахею прибор – бронхоскоп. Именно с его помощью и производится забор материала.
Для достоверности целесообразно сдать анализ трижды, а именно:
- в утренние часы натощак;
- после первого раза через 4-5 часов;
- через 24 часа после первого исследования и тоже до приема пищи.
к содержанию ↑
Сдать анализ мокроты на туберкулез – это только часть работы. Основное впереди. Многое зависит от того, как подготовлен специалист.
Ход исследования следующий:
- Специалист приступает к разрушению первичной структуры ДНК (денатурации). Тут имеется две цепочки. При высокой температуре они разъединяются.
- На следующем этапе производится снижение температуры (отжиг). Это необходимо для связи нити ДНК с праймером.
- Третий этап – элонгация. Тут синтезируются нужные молекулы.
к содержанию ↑
Микобактерии туберкулеза в мокроте методом ПЦР могут быть обнаружены или же нет. Положительный результат основан тем, что в биоматериале имеется ДНК палочки Коха. Это говорит о том, что человек заражен. При отрицательном – 98% того, что обследуемый не является инфицированным.
По показателям можно судить о том:
- в какой фазе патология (латентной или активной);
- насколько организм поражен;
- эффективно ли выбранное лечение в конкретном случае.
Имейте в виду, что ничто не досконально. Поэтому и тут может быть ложноположительный или ложноотрицательный результат. Чтобы убедиться в его правильности, рекомендованы иные диагностические процедуры или же прохождение ПЦР дважды (трижды).
Сдать мокроту на ПЦР можно в разных клиниках. Приведем примеры нескольких популярных московских центров с ценовой политикой.
| Наименование медицинского центра | Адрес | Цена за анализ |
| Медицинская лаборатория Биотест | Москва, Куркино, Родионовская улица, 3 | 600 рублей |
| Медицинская лаборатория Дитрикс Медикал | Москва, Чертаново Южное, Кировоградская улица, 38, к. 1 | 810 рублей |
| Медицинская лаборатория Инвитро | Москва, Алексеевский, Кулаков переулок, 13 | 845 рублей |
Кроме вышеуказанных адресов имеются и другие. Узнать о месторасположении всех лабораторий можно на их сайте. Из приведенных примеров видно, что стоимость анализа велика, но если учитывать его результативность, то это того стоит.
ПЦР-диагностика – это один из эффективных диагностических методов, активно используемых в современной медицине. Сбор мокроты на микобактерии туберкулеза может осуществляться как самостоятельно в домашних условиях, так и при помощи специалиста. Если мокрота не отходит, то делают бронхоскопию. Важна предварительная подготовка. Правильно сдать биоматериал – это уже полдела. Мокрота при туберкулезе будет иметь в себе микобактерии, обнаружить которые при ПЦР не составит труда, даже если их там небольшое количество. Огромный плюс данного способа – это выявление заболевания в первые часы после заражения. Использовать в диагностических целях можно как у взрослых, так и у детей.
Даже внушительная сумма не может остановить человека получить достоверную информацию касательно здоровья близкого человека или его собственного.
источник
Туберкулез — серьезное инфекционное заболевание, передающееся воздушно-капельным путем. Чаще всего заражение происходит, когда человек вдыхает болезнетворные бактерии.
Первыми признаками болезни являются снижение веса, повышение температуры и регулярный кашель с усиленным выделением мокроты (в норме секрет лишь смазывает слизистую, обильно не выделяясь).
В мокроте заболевшего присутствуют микробактерии туберкулеза, поэтому исследование слизистых выделений легких позволяет быстро выявить инфицирование.
Кроме того, при данной форме можно обнаружить так называемые рисовые тельца (линзы Коха), представляющие беловатые или желтоватые вкрапления, в составе которых дендрит, эластичные волокна и зараженные микробактерии.
Выделения происходят обильные, могут иметь неприятный, гнилостный запах.
Макроскопическое обследование. Секрет больного, зараженного туберкулезом, имеет гнойный характер, в нем присутствуют бактерии Коха, наблюдается небольшое вкрапление кровяных прожилок. Кровяные примеси возникают в случае нарушения целостности сосудов и чаще всего отмечаются у больных с кавернозной формой.
Кроме того, при данной форме можно обнаружить так называемые рисовые тельца (линзы Коха), представляющие беловатые или желтоватые вкрапления, в составе которых дендрит, эластичные волокна и зараженные микробактерии. Выделения происходят обильные, могут иметь неприятный, гнилостный запах.
Бактериоскопическое обследование. Готовится специальный препарат, который окрашивают методом Циля-Нельсона карболовым раствором фуксина. После осветления добавляют 3% раствор солянокислого спирта, 5% раствор серной кислоты, после чего окрашивают 0, 25% раствором метилена синего. По результатам определяют наличие палочки Коха. Все материалы препарата, кроме бацилл туберкулеза, приобретают синий цвет.
Данный метод анализа мокроты при туберкулезе легких чрезвычайно чувствителен. При первом обследовании чувствительность составляет около 80%, при повторном: 85-90%. Если образцы исследуются более трех раз, чувствительность возрастает до 97%. Для определения вируса в 1 мл материала должно быть более 100 000 микробактерий.
Фото 1. Врач проводит исследование мокроты на туберкулез: это быстрый и точный способ определить наличие микобактерий
Если имеются признаки и симптомы заболевания мокроту лучше тестировать не менее трех раз
Важно! Первый отрицательный результат не означает полного исключения диагноза. Часто образцы могут содержать меньше бактерий, чем необходимо для исследования.
Обследование начинается с внешнего осмотра. При наличии инфекции в слизистых выделениях встречаются инородные вкрапления или тромбы, части кальцинированных камней бронхов. При разрушении легочной ткани обнаруживаются эластичные волокна.
При обнаружении микробактерий секреция клеток дыхательных путей повторно исследуется, в клинику отправляется утренний сбор (как минимум, на протяжении трех дней). Обследование проводится как до начала лечения, так и во время.
Количество микробактерий в образцах должно уменьшаться, что свидетельствует о ремиссии заболевания.
Количество обнаруженных микобактерий позволяет разделить пациентов на две группы:
Первая группа классифицируется как активные выделители зараженных бацилл, имеющие прогрессирующий воспалительный процесс в легких.
Внимание! Эта группа опасна для окружающих и требует немедленной изоляции в условиях тубдиспансера.
После соответствующей противотуберкулёзной терапии и подтверждения того, что человек не является бактериостатическим агентом, пациент ставится на учет в поликлинику и тубдиспансер. При получении нескольких стерильных образцов без болезнетворных бактерий, после повторного и дополнительного обследования, пациент снимается с учета.
При отсутствии в выделениях болезнетворных бактерий или их незначительном количестве человек причисляется к группе BК-. Не представляя опасности для других, пациент должен быть также изолирован для предотвращения развития болезни и ее перехода в открытую форму.
Лечение осуществляется курсом. Назначается комплекс препаратов различного воздействия на палочку Коха, которые имеют одну общую цель: уничтожить её.
Дополнительно показаны физиотерапия, дыхательная гимнастика, иммунопрофилактика. Пациент регулярно сдает анализы.
источник
Для подтверждения диагноза туберкулеза основное значение имеет микробиологическое исследование. В противотуберкулезном диспансере повторяют двукратную микроскопию мокроты на КУБ, если эти исследования не были сделаны в учреждениях общей лечебной сети или их результаты были отрицательными. В качестве биологического материала обычно используют мокроту, а при ее отсутствии – промывные воды бронхов и желудка.
1. Микроскопия мазков мокроты, окрашенных по Цилю–Нильсену, является наиболее простым методом выявления туберкулеза. Более информативными являются методы флотации (обогащения) и люминесцентной микроскопии, которые позволяют повысить точность бактериологического исследования.
2. Достоверным методом верификации туберкулезной этиологии процесса является культуральное исследование или посев исследуемого материала на твердую питательную среду Левенштейна–Йенсена, что позволяет идентифицировать МБТ на основании характерного внешнего вида колоний, темпа их роста и условий выращивания. Культуральное исследование выполняется только в противотуберкулезных учреждениях, так как для его проведения необходимы специально оснащенные и аттестованные бактериологические лаборатории. Культуральное исследование позволяет обнаружить МБТ даже в том случае, если в 1 мл исследуемого материала содержится всего 100 микробных тел. Недостатком культурального исследования на твердой среде Левенштейна–Йенсена является его длительность – рост колоний МБТ происходит в течение 4-8 недель.
3. Для более быстрого бактериологического исследования мокроты и другого биологического материала в лабораториях противотуберкулезных диспансеров применяется аппарат ВАСТЕС, который позволяет получить рост туберкулезных микобактерий уже через 1-2 недели. Исследуемый материал помещают в специальные пробирки с жидкой питательной средой, на дне пробирок содержится кислородзависимый флюорохромный краситель. Микобактерии размножаются и поглощают кислород, в результате чего его концентрация в пробирке снижается, и свечение красителя усиливается. Таким образом, рост МБТ вызывает усиление флюоресценции, которая становится видимой при облучении пробирки ультрафиолетовым светом. Для регистрации роста измеряют интенсивность свечения специальными фотодатчиками, встроенными в прибор. Интенсивность свечения регистрируют в единицах роста.
4. Современным методом является исследование при помощи теста Xpert MBT/RIF, который еще называют GeneXpert MTB/RIF.Это – новый генетически-молекулярный тест, который позволяет одновременно подтвердить диагноз туберкулеза в результате идентификации микобактериальной ДНК и определить устойчивость МБТ к рифампицинупутем выявленияихгенетических мутаций, связанные с устойчивостью к этому препарату. Исследование проводится в специализированных противотуберкулезных учреждениях. Для теста используется образец мокроты, результаты могут быть получены менее, чем за 2 часа. Устойчивость к рифампицину свидетельствует об очень высоком риске мультирезистентного туберкулеза (МРТБ).
Исследование мокроты генетически-молекулярным тестом на ТБ и МРТБ проводится:
1. Больным, у которых в мокроте найдены КУБ (М+);
2. Всем ВИЧ-инфицированным лицам;
4. Лицам, которые контактировали с больным МРТБ.
Высоко чувствительной является биологическая проба, когда материалом, выделенным от больного, заражают лабораторных животных (гвинейскую свинку). Эта проба может подтвердить наличие даже одной микобактерии туберкулеза в отобранном для исследования материале. Однако биологическая проба дорогостоящая и трудоемкая, поэтому в настоящее время не используется.
Обнаружение КУБ в мазке мокроты при отсутствии изменений в легких на рентгенограммах может быть единственным проявлением туберкулеза бронха, в таких случаях необходимо выполнить бронхоскопию.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8333 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Уточнению диагноза туберкулеза органов дыхания способствует проведение лабораторных анализов мокроты и плеврального выпота на микобактерии туберкулеза (МБТ). Мокрота для исследования собирается утром в стерильную баночку, которая хранится закрытой. Если мокроты мало, необходимо предложить больному собирать ее при откашливании в течение суток.
При отсутствии мокроты используются раздражающие ингаляции или получают промывные воды бронхов. Чтобы выявить микобактерии туберкулеза, мокроту исследуют троекратно до назначения противотуберкулезных препаратов. При этом используются бактериоскопический, культуральный и биологический методы выявления МБТ.
Бактериоскопией микобактерии туберкулеза выявляются при наличии их не менее 100 000 в 1 мл. Анализ мокроты в лаборатории начинается с макроскопического описания. Микроскопия нативного мазка позволяет выявить в мокроте эритроциты, эластические волокна (ЭВ) из легочной ткани, коралловидные волокна (волокна Коппена—Джонса), кристаллы Шарко—Лейдена, спириллы Куршмана, клетки сердечных пороков.
В мокроте больных туберкулезом вместе с микобактериями туберкулеза можно обнаружить темные зерна различной величины. Они попадают в мокроту из старых, распадающихся очагов. При этом С. Л. Эрлих объединил все это в так называемую «тетраду», которая включает четыре признака:
1) микобактерии туберкулеза (МБТ) при микроскопии;
3) кристаллическая или аморфная известь;
Обнаружение этих признаков в мокроте свидетельствует об обострении в легочной ткани старого туберкулезного процесса. Дальнейшее исследование мокроты проводится методом отбора. Собранную мокроту переливают в чашку Петри, которую устанавливают на черную бумагу.
Деревянной палочкой отбирают гнойные комочки и переносят на предметное стекло. Другим таким же стеклом комочки растирают. Один препарат исследуют в нативном виде, другой исследуют на МБТ при световой или люминесцентной микроскопии после специальной окраски. При световой микроскопии окраску проводят по Цилю—Нильсену: карболовый фуксин, 3 % раствор солянокислого спирта, 0,25 % раствор метиленового синего.
Препараты микроскопируют с иммерсией. МБТ в них окрашиваются в красный цвет и бывают расположенными внутри или внутриклеточно. Эффективность бактериоскопии возрастает до 30 % при использовании люминесцентной микроскопии. Для этого препараты окрашивают аурамином или родамином. При микроскопии микобактерии туберкулеза (МБТ) на темном фоне ярко сверкают золотисто-зеленым или золотисто-фиолетовым светом.
В тех случаях, когда микобактерии туберкулеза (МБТ) не удалось выявить методом отбора, дальнейшие исследования мокроты на микобактерии туберкулеза (МБТ) проводят методом флотации (обогащения) исследуемого материала. На первом этапе флотации проводится гомогенизация 15—20 мл мокроты путем добавления щелочи, встряхивания и подогревания, а на втором — собственно обогащение.
Обогащение осуществляется центрифугированием или флотацией. При флотации в гомогенизированный материал добавляют до 180 мл дистилированную воду, 2 мл органического растворителя (бензин, бензол, ксилол) и производят встряхивание на специальном аппарате в течение 20 мин. После этого в сосуд доливают доверху воду. Из флотационного кольца готовят препараты и исследуют их в микроскопе после соответствующей окраски. Флотация повышает чувствительность бактериоскопии в 10 раз.
Широкое использование в клинических условиях культурального и биологического методов выявления микобактерий туберкулеза (МБТ) повышает эффективность микробиологической диагностики.
Все, что Вы хотите знать о туберкулезе
В.Ю. Мишин
Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ) .
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице:
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Интенсивность роста МБТ определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++» 21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бактериовыделение).
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Система ВАСТЕС MGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями 02. В процессе роста МБТ поглощают 02, что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов , основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
источник