Уточнению диагноза туберкулеза органов дыхания способствует проведение лабораторных анализов мокроты и плеврального выпота на микобактерии туберкулеза (МБТ). Мокрота для исследования собирается утром в стерильную баночку, которая хранится закрытой. Если мокроты мало, необходимо предложить больному собирать ее при откашливании в течение суток.
При отсутствии мокроты используются раздражающие ингаляции или получают промывные воды бронхов. Чтобы выявить микобактерии туберкулеза, мокроту исследуют троекратно до назначения противотуберкулезных препаратов. При этом используются бактериоскопический, культуральный и биологический методы выявления МБТ.
Бактериоскопией микобактерии туберкулеза выявляются при наличии их не менее 100 000 в 1 мл. Анализ мокроты в лаборатории начинается с макроскопического описания. Микроскопия нативного мазка позволяет выявить в мокроте эритроциты, эластические волокна (ЭВ) из легочной ткани, коралловидные волокна (волокна Коппена—Джонса), кристаллы Шарко—Лейдена, спириллы Куршмана, клетки сердечных пороков.
В мокроте больных туберкулезом вместе с микобактериями туберкулеза можно обнаружить темные зерна различной величины. Они попадают в мокроту из старых, распадающихся очагов. При этом С. Л. Эрлих объединил все это в так называемую «тетраду», которая включает четыре признака:
1) микобактерии туберкулеза (МБТ) при микроскопии;
3) кристаллическая или аморфная известь;
Обнаружение этих признаков в мокроте свидетельствует об обострении в легочной ткани старого туберкулезного процесса. Дальнейшее исследование мокроты проводится методом отбора. Собранную мокроту переливают в чашку Петри, которую устанавливают на черную бумагу.
Деревянной палочкой отбирают гнойные комочки и переносят на предметное стекло. Другим таким же стеклом комочки растирают. Один препарат исследуют в нативном виде, другой исследуют на МБТ при световой или люминесцентной микроскопии после специальной окраски. При световой микроскопии окраску проводят по Цилю—Нильсену: карболовый фуксин, 3 % раствор солянокислого спирта, 0,25 % раствор метиленового синего.
Препараты микроскопируют с иммерсией. МБТ в них окрашиваются в красный цвет и бывают расположенными внутри или внутриклеточно. Эффективность бактериоскопии возрастает до 30 % при использовании люминесцентной микроскопии. Для этого препараты окрашивают аурамином или родамином. При микроскопии микобактерии туберкулеза (МБТ) на темном фоне ярко сверкают золотисто-зеленым или золотисто-фиолетовым светом.
В тех случаях, когда микобактерии туберкулеза (МБТ) не удалось выявить методом отбора, дальнейшие исследования мокроты на микобактерии туберкулеза (МБТ) проводят методом флотации (обогащения) исследуемого материала. На первом этапе флотации проводится гомогенизация 15—20 мл мокроты путем добавления щелочи, встряхивания и подогревания, а на втором — собственно обогащение.
Обогащение осуществляется центрифугированием или флотацией. При флотации в гомогенизированный материал добавляют до 180 мл дистилированную воду, 2 мл органического растворителя (бензин, бензол, ксилол) и производят встряхивание на специальном аппарате в течение 20 мин. После этого в сосуд доливают доверху воду. Из флотационного кольца готовят препараты и исследуют их в микроскопе после соответствующей окраски. Флотация повышает чувствительность бактериоскопии в 10 раз.
Широкое использование в клинических условиях культурального и биологического методов выявления микобактерий туберкулеза (МБТ) повышает эффективность микробиологической диагностики.
Все, что Вы хотите знать о туберкулезе
В.Ю. Мишин
Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ) .
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице:
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Интенсивность роста МБТ определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++» 21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бактериовыделение).
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Система ВАСТЕС MGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями 02. В процессе роста МБТ поглощают 02, что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов , основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
источник
Лабораторная диагностика обеспечивает выполнение главной задачи диагностики и лечения туберкулеза — выявление у больного МБТ. В лабораторную диагностику на современном этапе входят следующие методики:
1) сбор и обработка мокроты;
2) микроскопическая идентификация МБТ в выделяемых субстанциях или тканях;
4) определение резистентности к препаратам;
5) серологические исследования;
6) использование новых молекулярно-биологических методов, включая полимеразную цепную реакцию (ПЦР) и определение полифиморфизма длин рестрикционных фрагментов (ПДРФ).
, проводится в специально подготовленном помещении больницы или в амбулаторных условиях. Собранные образцы должны быть немедленно отосланы для микробиологического исследования.
Для этого необходимо использовать специальные контейнеры. Они должны быть прочными, устойчивыми к разрушению, иметь широкую горловину с герметически завинчивающейся пробкой, чтобы предотвратить случайное вытекание из нее содержимого.
При сборе образцов риск инфицирования очень большой, особенно когда больной выкашливает мокроту. В связи с этим процедуру необходимо проводить как можно дальше от посторонних лиц и в специальном помещении.
Бронхоскопия. В том случае, если другие методы не сумели обеспечить постановку диагноза, применяется сбор материала непосредственно из бронхов, через бронхоскоп. Биопсия выстилающих бронхи тканей может иногда содержать типичные для туберкулеза изменения, выявляемые при гистологическом исследовании.
Плевральная жидкость. В плевральной жидкости МБТ могут быть выявлены с помощью флотации, но обычно обнаруживаются только в культуре. Чем большее количество жидкости используется для культурального Исследования, тем вероятней положительный результат.
Биопсия плевры. Биопсия плевры может быть полезна в тех случаях, когда имеется плевральный выпот. Для ее проведения необходимы обученный персонал, средства для проведения гистологического исследования, специальная биопсийная игла.
Биопсия легкого. Биопсия легкого должна выполняться хирургом в стационарных условиях. Диагноз может быть сделан на основе гистологического исследования или обнаружения МБТ в секционном материале.
Уже более 100 лет существует самый простой и быстрый метод выявления кислотоустойчивых микобактерий (КУБ) — микроскопия мазка. КУБ — это микобактерий, способные оставаться окрашенными даже после обработки кислотными растворами. Они могут быть выявлены с помощью микроскопа в окрашенных образцах мокроты. Микобактерий отличаются от других микроорганизмов характерным составом своей клеточной стенки, состоящей из миколовых кислот. Кислоты благодаря своим сорбционным свойствам обеспечивают способность окрашиваться по методикам, выявляющим КУБ.
Резистентность к стандартным методам окрашивания и способность МБТ сохранять раннее окрашивание является следствием высокого содержания липидов во внешней оболочке клетки. Вообще грамположительные бактерии в своем составе имеют приблизительно 5% липидов или воска, грамотрицательные организмы — около 20% и МБТ — примерно 60%.
Бактериоскопия мокроты или другого отделяемого проводится «простым» методом и методом флотации.
При простом методе мазки приготавливают из комочков мокроты или капель жидкого вещества (экссудата, промывных вод и др.). Материал помещают между двумя предметными стеклами. Один из мазков окрашивают по Граму на общую флору, другой — на туберкулезные микобактерии.
Основным методом окрашивания является карбол-фуксиновый (метод Циля-Нильсена). Главный принцип этого метода — в способности наружной оболочки МБТ адсорбировать карбол-фуксин. Поглощая красный карбол-фуксин, наружная мембрана МБТ настолько прочно связывает краску, что ее нельзя удалить обработкой серной кислотой или солянокислым спиртом. Затем образец обрабатывается метиленовым синим. При эмерсионной микроскопии МБТ появляются в виде красных палочек на синем фоне.
Начиная с 1989 г., в современных лабораториях флюоресцентная микроскопия в значительной степени вытеснила старые методы, основанные на кислотоустойчивости микобактерии. Этот метод базируется на тех же свойствах МБТ, связанных со способностью наружной мембраны МБТ, богатой липидами, удерживать соответствующий краситель, в данном случае — аурамин-родамин. МБТ, поглощая это вещество, одновременно устойчивы к обесцвечиванию солянокислым спиртом. При этом МБТ, окрашенные аурамин-родамином, флюоресцируют под воздействием ультрафиолета или других световых спектров, выделенных соответствующими фильтрами. Под воздействием ультрафиолета МБТ проявляются как ярко-желтые палочки на черном фоне.
При поступлении в современную лабораторию диагностического материала с возможным содержанием МБТ проводятся следующие диагностические манипуляции:
- Обработка материала миколитическими разжижающими веществами с целью удаления белковых масс.
- Деконтаминация образца для удаления сопутствующей бактериальной флоры.
- Встряхивание смеси и ее отстаивание.
- Холодное центрифугирование.
- Содержимое центрифужной пробирки используется для микроскопии посева на:
5.1. плотную яичную среду (Левенштейна-Йенсена или Финна III);
5.2. агаровые среды (7Н10 и 7Н11);
5.3. автоматизированную систему бульонного культивирования (МВ/ВасТ или ВАСТЕС MGIT 960).
Расшифровка генома МБТ открыла неограниченные перспективы в разработке генетико-молекулярных тестов, в том числе в изучении и выявлении МБТ и диагностике в организме человека.
Классические методы, применяемые для обнаружения в организме микобактерий туберкулеза, такие, как бактериоскопия, культуральный, иммуноферментный, цитологический, весьма эффективны, но отличаются или недостаточной чувствительностью, или длительностью выявления МБТ. Развитие и совершенствование молекулярно-диагностических методов открыло новые перспективы для быстрого выявления микобактерий в клинических образцах.
Этот метод основан на амплификации особых фрагментов бациллярной ДНК, которая обнаруживается в диагностических образцах. Тест предназначен для выявления МБТ в мокроте или идентификации разновидности бактерий, которые произрастают в культуральной среде.
Реакция ПЦР позволяет проводить идентификацию МБТ в диагностическом материале за 5-6 ч (включая обработку материала) и обладает высокой специфичностью и чувствительностью (в диапазоне от 1-10 клеток в образце).
источник
Уточнению диагноза туберкулеза органов дыхания способствует проведение лабораторных анализов мокроты и плеврального выпота на микобактерии туберкулеза (МБТ). Мокрота для исследования собирается утром в стерильную баночку, которая хранится закрытой. Если мокроты мало, необходимо предложить больному собирать ее при откашливании в течение суток.
При отсутствии мокроты используются раздражающие ингаляции или получают промывные воды бронхов. Чтобы выявить микобактерии туберкулеза, мокроту исследуют троекратно до назначения противотуберкулезных препаратов. При этом используются бактериоскопический, культуральный и биологический методы выявления МБТ.
Бактериоскопией микобактерии туберкулеза выявляются при наличии их не менее 100 000 в 1 мл. Анализ мокроты в лаборатории начинается с макроскопического описания. Микроскопия нативного мазка позволяет выявить в мокроте эритроциты, эластические волокна (ЭВ) из легочной ткани, коралловидные волокна (волокна Коппена—Джонса), кристаллы Шарко—Лейдена, спириллы Куршмана, клетки сердечных пороков.
В мокроте больных туберкулезом вместе с микобактериями туберкулеза можно обнаружить темные зерна различной величины. Они попадают в мокроту из старых, распадающихся очагов. При этом С. Л. Эрлих объединил все это в так называемую «тетраду», которая включает четыре признака:
1) микобактерии туберкулеза (МБТ) при микроскопии;
2) кристаллы холестерина;
3) кристаллическая или аморфная известь;
4) коралловидные волокна.
Обнаружение этих признаков в мокроте свидетельствует об обострении в легочной ткани старого туберкулезного процесса. Дальнейшее исследование мокроты проводится методом отбора. Собранную мокроту переливают в чашку Петри, которую устанавливают на черную бумагу.
Деревянной палочкой отбирают гнойные комочки и переносят на предметное стекло. Другим таким же стеклом комочки растирают. Один препарат исследуют в нативном виде, другой исследуют на МБТ при световой или люминесцентной микроскопии после специальной окраски. При световой микроскопии окраску проводят по Цилю—Нильсену: карболовый фуксин, 3 % раствор солянокислого спирта, 0,25 % раствор метиленового синего.
Препараты микроскопируют с иммерсией. МБТ в них окрашиваются в красный цвет и бывают расположенными внутри или внутриклеточно. Эффективность бактериоскопии возрастает до 30 % при использовании люминесцентной микроскопии. Для этого препараты окрашивают аурамином или родамином. При микроскопии микобактерии туберкулеза (МБТ) на темном фоне ярко сверкают золотисто-зеленым или золотисто-фиолетовым светом.
В тех случаях, когда микобактерии туберкулеза (МБТ) не удалось выявить методом отбора, дальнейшие исследования мокроты на микобактерии туберкулеза (МБТ) проводят методом флотации (обогащения) исследуемого материала. На первом этапе флотации проводится гомогенизация 15—20 мл мокроты путем добавления щелочи, встряхивания и подогревания, а на втором — собственно обогащение.
Обогащение осуществляется центрифугированием или флотацией. При флотации в гомогенизированный материал добавляют до 180 мл дистилированную воду, 2 мл органического растворителя (бензин, бензол, ксилол) и производят встряхивание на специальном аппарате в течение 20 мин. После этого в сосуд доливают доверху воду. Из флотационного кольца готовят препараты и исследуют их в микроскопе после соответствующей окраски. Флотация повышает чувствительность бактериоскопии в 10 раз.
Широкое использование в клинических условиях культурального и биологического методов выявления микобактерий туберкулеза (МБТ) повышает эффективность микробиологической диагностики.
источник
Исследование мокроты на МБТ имеет важное эпидемиологическое и клиническое значение.
Мокроту лучше собирать утром. Предварительно больной должен прополоскать рот, чтобы в мокроте было меньше слюны. При малом количестве мокроты ее собирают в течение суток. При отсутствии мокроты следует вызвать ее появление раздражающими ингаляциями аэрозоля гипертонического раствора поваренной соли с содой. Исследуют также промывные воды бронхов, получаемые после введения через трахею 10—12 мл теплого изотонического раствора хлорида натрия.
Исследование мокроты начинают с ее осмотра. У больных туберкулезом легких в мокроте могут быть прожилки или сгустки крови, кусочки обызвествленных камней бронхов — бронхиолитов. При микроскопическом исследовании окрашенных мазков мокроты у больных с деструкцией легочной ткани выявляются эластические волокна. Иногда встречаются так называемые коралловые волокна, которые образуются в результате отложения на эластических волокнах жирных кислот, а также покрытые известью эластические волокна и аморфные известковые частицы. Для выявления в мокроте МБТ ее исследуют неоднократно, направляя в лабораторию утреннюю порцию не менее 3 дней подряд. В ряде случаев МБТ могут быть обнаружены в мокроте и при отсутствии рентгенологических изменений в легких, в этом случае нельзя исключить язвенный туберкулез бронха. Проводить исследования мокроты необходимо до начала противотуберкулезной химиотерапии.
Выявление МБТ в патологическом материале осуществляется бактериоскопическим, бактериологическим (культуральным) и биологическим методами. Кроме мокроты, объектами исследования на МБТ могут быть также моча, кал, спинномозговая жидкость, экссудат из полостей, биоптаты различных тканей.
Основным методом выявления МБТ является бактериоскопический. Во многих развивающихся странах он широко применяется не только для диагностики, но и для выявления больных туберкулезом при массовых обследованиях населения.
При прямой бактериоскопии препарат окрашивают по методу Циля—Нильсена: вначале карболовым раствором фуксина, а затем после обесцвечивания 5 % раствором серной кислоты или 3 % раствором солянокислого спирта докрашивают 0,25 % раствором метиленового синего. Окрашенные препараты микроско-пируют с иммерсионной системой. МБТ окрашиваются в красный, а окружающий фон и некислотоустойчивые микроорганизмы — в синий цвет (рис. 5).
Разрешающая способность бактериоскопического метода выявления МБТ увеличивается на 14—30 % при применении люминесцентной микроскопии. Для окраски препарата используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00, родамин С. Препарат исследуют с помощью люминесцентного микроскопа. МБТ светятся золотисто-желтым цветом на темном фоне (рис. 6).
Для обнаружения бактериоскопическим методом МБТ в препарате необходимо, чтобы в 1 мл мокроты содержалось не менее 100 000 микробных тел. При меньшем числе микобактерий исследование может дать ложноотрицательный результат. Для увеличения количества МБТ в единице исследуемого объема мокроты используют методы флотации и седиментации, особенно при отрицательных результатах прямой бактериоскопии.
Наибольшее распространение получил метод флотации, основанный на том, что после встряхивания водной суспензии с углеводородом МБТ всплывают вместе с образующейся пеной на поверхность. В качестве углеводорода используют бензин, бензол, ксилол. Образующееся на поверхности сливкообразное (флотационное) кольцо из частиц углеводорода с микобактериями служит материалом для приготовления препаратов. При использовании метода флотации положительные результаты бактериоскопии увеличиваются на 10 %.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты на питательные среды. Перед посевом мокроту обрабатывают с целью подавления роста неспецифической мокрофлоры. Стандартной питательной средой для выращивания МБТ служит твердая яичная среда Левенштейна—Йенсена. Существуют также полужидкие и жидкие питательные среды. Рост культуры МБТ происходит за 14—90 дней.
Для выделения культуры МБТ достаточно 20—100 микробных клеток в 1 мл мокроты. Получение чистой культуры микобактерий позволяет определить их жизнеспособность, вирулентность, а также чувствительность к лекарственным препаратам.
Нередко определяемые при бактериоскопии микобактерии не растут на питательных средах вследствие утраты способности к размножению под влиянием химиопрепаратов. По данным бактериологического исследования проводится количественная оценка бактериовыделения: скудное — до 10 колоний на среде, умеренное — от 10 до 50 и обильное — более 50 колоний.
Биологический метод заключается в заражении мокротой морских свинок, которые обладают высокой чувствительностью к МБТ. Перед заражением морской свинки мокроту обрабатывают серной кислотой с целью уничтожения неспецифической микрофлоры и центрифугируют. Осадок в изотоническом растворе хлорида натрия вводят свинке подкожно в паховую область, внутрибрюшинно или в яичко. С целью снижения резистентности морской свинки к МБТ ей ежедневно вводят большие дозы кортизона. Примерно через месяц после заражения у свинки увеличиваются лимфатические узлы и развивается генерализованный туберкулез.
Среди методов выявления МБТ и диагностики туберкулеза биологический метод до последнего времени считался наиболее чувствительным, так как туберкулез у морских свинок может быть вызван при введении мокроты, содержащей менее 5 микробных тел в 1 мл. В настоящее время доказана возможность потери МБТ вирулентности. Такие микобактерии жизнеспособны, могут расти на питательных средах, но не вызывают заболевания экспериментальных животных. Поэтому для выявления в патологическом материале МБТ необходимо применять различные методы микробиологического исследования.
Исследование крови. В крови больных туберкулезом обычно наблюдаются небольшие изменения. Гипохромная анемия определяется лишь у больных с распространенным процессом и выраженной интоксикацией или при повторяющихся легочных кровотечениях. СОЭ увеличивается в периоды обострения туберкулезного процесса. Изменения числа лейкоцитов и лейкоцитарной формулы крови происходят главным образом при острых процессах и распаде легочной ткани. Могут наблюдаться лейкоцитоз, увеличение палочкоядерных нейтрофилов, лимфопения, моноцитоз, эозинопения.
Для оценки состояния больного, его неспецифическои и специфической реактивности, а также для определения активности туберкулезного процесса и выбора оптимальной лечебной тактики существенное значение имеет определение некоторых биохимических и иммунологических показателей.
У больных туберкулезом, выделяющих большое количество мокроты, с обильным гнойным плевральным экссудатом, амилои-дозом почек может иметь место гипопротеинемия, в отличие от больных с другими формами туберкулеза. При остром туберкулезном воспалении уменьшается альбумин-глобулиновый коэффициент, увеличивается содержание в плазме фибриногена и сиаловых кислот, появляется С-реактивный белок.
Для контроля функционального состояния печени в крови исследуют содержание аланиновой и аспарагиновой аминотрансфераз, щелочной фосфатазы, билирубина, определяют уровень остаточного азота, мочевины, креатинина, с сывороткой крови ставят коагуляционные пробы — тимоловую, сулемовую. С целью исключения часто сочетающегося с туберкулезом сахарного диабета в крови определяют содержание сахара.
Для подтверждения туберкулезной этиологии заболевания используют иммуноферментный метод, основанный на реакции антиген—антитело. При подозрении на иммунодефицит в сыворотке крови определяют содержание иммуноглобулинов. Для диагностики иммунодефицита и контроля за его течением определяют количество В- и Т-лимфоцитов.
При активном туберкулезе все иммунологические реакции положительны, причем их выраженность зависит от фазы туберкулезного процесса. У больных с благоприятным течением туберкулеза наиболее выражена реакция бласттрансформации лимфоцитов, а с прогрессирующим — реакция торможения миграции лейкоцитов в присутствии туберкулина ППД. При вспышке процесса снижается число Т-розеткообразующих лимфоцитов и повышается число В-розеткообразующих лимфоцитов, одновременно уменьшается содержание G- и А-иммуноглобулинов.
Иммунологические тесты используют для дифференциальнои диагностики туберкулеза. Например, при раке и саркоидозе в отличие от туберкулеза отмечается подавление активности Г-лимфоцитов в реакции бласттрансформации с ФГА, у большинства больных отмечаются отрицательные реакции бласттрансформации лимфоцитов и миграции лейкоцитов с ППД.
Исследование мочи. У больных туберкулезом легких анализ мочи обычно не дает существенной диагностической информации, но иногда выявляет серьезные осложнения основного заболевания. При туберкулезе почек в моче обнаруживают белок, лейкоциты, нередко эритроциты, а также МБТ. При осложнении легочного туберкулеза амилоидозом наблюдаются стойкая протеинурия, микрогематурия. По выделению с суточной мочой 17-кетостероидов и 17-оксикортикостероидов судят о функциональном состоянии коры надпочечников.
источник
Мокрота (sputum) — патологический секрет, образующийся при поражении трахеи, бронхиального дерева и легочной ткани. Ее выделение наблюдается не только при заболеваниях органов дыхания, но и сердечно-сосудистой системы. Общий анализ мокроты включает в себя макроскопическое, химическое, микроскопическое и бактериоскопическое определение ее свойств.
Увеличение количества мокроты может расцениваться как признак ухудшения состояния больного, если оно зависит от обострения, например нагноительного процесса; в других случаях, когда увеличение количества мокроты связано с улучшением дренирования полости, оно расценивается как положительный симптом. Уменьшение количества мокроты может являться следствием стихания воспалительного процесса или, в других случаях, результатом нарушения дренирования гнойной полости, часто сопровождаясь при этом ухудшением состояния больного.
Слизистая мокрота выделяется при острых бронхитах, хронических бронхитах, бронхиальной астме, при пневмониях, бронхоэктатической болезни, раке легкого. Слизисто-гнойная мокрота выделяется при хронических бронхитах, пневмониях, бронхоэктатической болезни, абсцессе легкого, при нагноившемся эхинококке легкого, актиномикозе легких, при раке легкого, сопровождающемся нагноением. Чисто гнойная мокрота обнаруживается при абсцессе легкого, нагноившемся эхинококке легкого, прорыве эмпиемы плевры в бронх, бронхоэктатической болезни.
Кровянистая мокрота, состоящая почти из чистой крови, наиболее часто отмечается при туберкулезе легких. Появление кровавой мокроты может быть при раке легкого, бронхоэктатической болезни, абсцессе легкого, при синдроме средней доли, инфаркте легкого, при травме легкого, актиномикозе и сифилисе. Кровохарканье и даже примесь крови к мокроте встречаются в 12—52% инфарктов легких. Примесь крови в мокроте определяется при опухолях легкого, при инфаркте легкого, при крупозной и очаговой пневмониях, силикозе легких, при застойных явлениях в легких, сердечной астме и отеке легких. Серозная мокрота выделяется при отеке легких.
Слизистая и серозная мокрота бесцветна или беловата. Присоединение гнойного компонента к мокроте придает ей зеленоватый оттенок, что характерно для абсцесса легкого, гангрены легкого, бронхоэктатической болезни, актиномикоза легкого.
Мокрота ржавого или коричневого цвета, указывает на содержание в ней не свежей крови, а продуктов ее распада (гематин) и встречается при крупозной пневмонии, при туберкулезе легких с творожистым распадом, застое крови в легких, отеке легких, при легочной форме сибирской язвы, инфаркте легкого.
Грязно-зеленый или желто-зеленый цвет может иметь мокрота, отделяющаяся при различных патологических процессах в легких, сочетающихся с наличием у больных желтухи. Желто-канареечный цвет имеет иногда мокрота при эозинофильных пневмониях. Мокрота цвета охры отмечается при сидерозе легкого. Черноватая или сероватая мокрота бывает при примеси угольной пыли. При отеке легких серозная мокрота, выделяющаяся нередко в большом количестве, бывает равномерно окрашенной в слабо-розовый цвет, что обусловлено примесью эритроцитов. Вид такой мокроты иногда сравнивают с жидким клюквенным морсом. Могут окрашивать мокроту некоторые лекарственные вещества. Так, например, антибиотик рифампицин окрашивает ее в красный цвет.
Гнилостный (трупный) запах мокрота приобретает при гангрене и абсцессе легкого, бронхоэктатической болезни, гнилостном бронхите, раке легкого, осложнившимся некрозом.
Примесь к мокроте только что принятой пищи отмечается при сообщении пищевода с трахеей или бронхом, что может возникать при раке пищевода.
При прорыве эхинококка легкого в бронх в мокроте могут быть обнаружены крючья или редко сколекс эхинококка. Очень редко в мокроте можно обнаружить зрелых аскарид, которые заползают в дыхательные пути у ослабленных больных, и личинок аскарид, попадающих в дыхательные пути при миграции их в легкие. Яйца легочной двуустки появляются в мокроте при разрыве кисты, образующейся в легком при паразитировании легочной двуустки. При гангрене и абсцессе легкого в мокроте могут обнаруживаться кусочки некротизированной ткани легкого. При опухоли легкого с мокротой иногда выделяются кусочки опухолевой ткани.
Фибринозные свертки, состоящие из слизи и фибрина, встречаются при фибринозном бронхите, при туберкулезе, пневмониях.
Рисовидные тельца (чечевицы) или линзы Коха состоят из детрита, эластических волокон и МБТ и встречаются в мокроте при туберкулезе.
Пробки Дитриха, состоящие из продуктов распада бактерий и легочной ткани, кристаллов жирных кислот, встречаются при гнилостном бронхите и гангрене легкого. При хронических тонзиллитах из миндалин могут выделяться пробки, напоминающие по внешнему виду пробки Дитриха. Пробки из миндалин могут выделяться и при отсутствии мокроты.
Свежевыделенная мокрота имеет щелочную или нейтральную реакцию. Разложившаяся мокрота приобретает кислую реакцию.
Определение белка в мокроте может явиться подспорьем при дифференциальной диагностике между хроническим бронхитом и туберкулезом: при хроническом бронхите в мокроте определяются следы белка, в то время как при туберкулезе легких в мокроте содержание белка больше, и он может быть определен количественно (до 100—120 г/л).
Желчные пигменты могут обнаруживаться в мокроте при заболеваниях дыхательных путей и легких, сочетающихся с желтухой, при сообщении между печенью и легким (при прорыве абсцесса печени в легкое). Помимо этих состояний, желчные пигменты могут быть обнаружены при пневмониях, что связано с внутрилегочным распадом эритроцитов и последующими превращениями гемоглобина.
Встречающиеся в мокроте клетки плоского эпителия диагностического значения не имеют. Клетки цилиндрического эпителия (как единичные, так и в виде скоплений) могут быть обнаружены при бронхиальной астме, бронхите, бронхогенном раке легкого. Вместе с тем появление клеток цилиндрического эпителия в мокроте может быть обусловлено и примесью слизи из носоглотки.
Альвеолярные макрофаги — клетки ретикулоэндотелия. Макрофаги, содержащие в протоплазме фагоцитированные частицы (так называемые пылевые клетки), встречаются в мокроте людей, находящихся в длительном контакте с пылью. Макрофаги, содержащие в протоплазме гемосидерин (продукт распада гемоглобина), называют «клетками сердечных пороков». «Клетки сердечных пороков» встречаются в мокроте при застое в легких, митральном стенозе, инфаркте легкого.
Лейкоциты в небольшом количестве встречаются в любой мокроте. Большое количество нейтрофилов отмечается в слизисто-гнойной и особенно в гнойной мокроте. Эозинофилами богата мокрота при бронхиальной астме, эозинофильной пневмонии, гельминтозах легких, инфаркте легкого, туберкулезе и раке легкого. Лимфоциты встречаются в большом количестве при коклюше. Увеличение содержания лимфоцитов в мокроте возможно при туберкулезе легких.
Обнаружение единичных эритроцитов в мокроте диагностического значения не имеет. Появление большого количества эритроцитов в мокроте отмечается при состояниях, сопровождающихся кровохарканьем и легочным кровотечением. При наличии свежей крови в мокроте определяются неизмененные эритроциты, если же с мокротой отходит кровь, задержавшаяся в дыхательных путях в течение длительного времени, то обнаруживают выщелоченные эритроциты.
Эластические волокна появляются в результате распада легочной ткани при туберкулезе, абсцессе, гангрене легкого, раке легкого. При гангрене легкого эластические волокна обнаруживают не всегда, так как под действием ферментов, находящихся в мокроте, они могут растворяться. Спирали Куршмана — особые трубчатые тела, обнаруживаемые при микроскопическом исследовании, а иногда видимые невооруженным глазом. Обычно спирали Куршманна определяются при бронхиальной астме, туберкулезе легких и пневмонии. Кристаллы Шарко—Лейдена обнаруживаются в мокроте, богатой эозинофилами при бронхиальной астме, эозинофильной пневмонии.
Вскрытие петрифицированного туберкулезного очага в просвет бронха может сопровождаться одновременным обнаружением в мокроте обызвествленных эластических волокон, кристаллов ХС, МБТ и аморфной извести (так называемая тетрада Эрлиха) — 100%.
Исследование мокроты на микобактерии туберкулеза (МБТ) производится в специально окрашенном мазке. Установлено, что обычное исследование окрашенного мазка на МБТ дает положительный результат только при содержании МБТ не менее 50 000 в 1 мл мокроты. По количеству обнаруженных МБТ судить о тяжести процесса нельзя.
При бактериоскопии мокроты больных с неспецифическими заболеваниями легких могут быть обнаружены:
- при пневмониях — пневмококки, диплококки Френкеля, бактерии Фридлендера, стрептококки, стафилококки — 100%;
- при гангрене легкого — веретенообразная палочка в сочетании со спирохетой Венсана — 80%;
- дрожжеподобные грибы, для выяснения вида которых необходим посев мокроты — 70%;
- при актиномикозе — друзы актиномицета — 100%.
Объем трахеобронхиального секрета в норме колеблется от 10 до 100 мл/сут. Все это количество здоровый человек обычно проглатывает, того не замечая. В норме количество лейкоцитов в мокроте небольшое. В норме исследование окрашенного мазка на МБТ дает отрицательный результат.
При абсцессе легкого выделяется большое количество мокроты. Увеличение количества мокроты расценивается как признак ухудшения состояния больного. Мокрота может быть слизисто-гнойной, чисто гнойной, кровавой. Запах мокроты — гнилостный (трупный). Наличие гноя придает мокроте зеленоватый оттенок. При стоянии гнойная мокрота обычно разделяется на 2 слоя. При прорыве абсцесса печени в легкое из-за сообщения между печенью и легким в мокроте могут обнаруживаться желчные пигменты. В результате распада легочной ткани при абсцессе в мокроте появляются эластические волокна.
При бронхоэктатической болезни выделяется большое количество мокроты. Увеличение количества мокроты расценивается как признак ухудшения состояния больного. Мокрота может быть слизистой, слизисто-гнойной, чисто гнойной, кровавой. Наличие гноя придает мокроте зеленоватый оттенок. Запах мокроты — гнилостный (трупный). При стоянии гнойная мокрота обычно разделяется на 2 слоя.
При гангрене легкого выделяется большое количество мокроты. Увеличение количества мокроты расценивается как признак ухудшения состояния больного. Наличие гноя придает мокроте зеленоватый оттенок. Запах мокроты — гнилостный (трупный). Гнилостная мокрота часто разделяется на 3 слоя (верхний — пенистый, средний — серозный, нижний — гнойный). В мокроте могут встречаться пробки Дитриха, состоящие из продуктов распада бактерий и легочной ткани, кристаллов жирных кислот; эластические волокна, появляющиеся в результате распада легочной ткани. При гангрене легкого эластические волокна обнаруживают не всегда, так как под действием ферментов, находящихся в мокроте, они могут растворяться. При бактериоскопии мокроты могут быть обнаружены веретенообразная палочка в сочетании со спирохетой Венсана (80%).
При прорыве эмпиемы плевры в бронх мокрота чисто гнойная.
При абсцессе легкого выделяется большое количество мокроты. Увеличение количества мокроты расценивается как признак ухудшения состояния больного. Мокрота может быть слизисто-гнойной, чисто гнойной, кровавой. Запах мокроты — гнилостный (трупный). Наличие гноя придает мокроте зеленоватый оттенок. При стоянии гнойная мокрота обычно разделяется на 2 слоя. При прорыве абсцесса печени в легкое из-за сообщения между печенью и легким в мокроте могут обнаруживаться желчные пигменты. В результате распада легочной ткани при абсцессе в мокроте появляются эластические волокна.
При раке легкого выделяющаяся мокрота слизистая, кровавая. Слизисто-гнойная мокрота выделяется при раке легкого, сопровождающимся нагноением. При раке легкого, осложнившимся некрозом, мокрота приобретает гнилостный (трупный) запах. При бронхогенном раке легкого могут быть обнаружены клетки цилиндрического эпителия (как единичные, так и в виде скоплений). При раке легкого в мовроте могут быть обнаружены эозинофилы, опухолевые клетки, эластические волокна.
При сообщении пищевода с трахеей или бронхом, что может возникать при раке пищевода, в мокроте отмечается примесь только что принятой пищи.
В начале приступа бронхиальной астмы отделяется небольшое количество мокроты, в конце приступа ее количество увеличивается. Мокрота при бронхиальной астме слизистая. В ней могут быть обнаружены клетки цилиндрического эпителия (как единичные, так и в виде скоплений), эозинофилы, спирали Куршманна, кристаллы Шарко—Лейдена.
При острых бронхитах отделяется небольшое количество мокроты. Мокрота — слизистая. В ней могут быть обнаружены клетки цилиндрического эпителия (как единичные, так и в виде скоплений).
При хронических тонзиллитах из миндалин могут выделяться пробки, напоминающие по внешнему виду пробки Дитриха. Пробки из миндалин могут выделяться и при отсутствии мокроты.
При туберкулезном процессе в легком, сопровождающемся распадом ткани, особенно при наличии каверны, сообщающейся с бронхом, может выделяться много мокроты. Кровянистая мокрота, состоящая почти из чистой крови, наиболее часто отмечается при туберкулезе легких. При туберкулезе легких с творожистым распадом мокрота ржавого или коричневого цвета. В мокроте могут обнаруживаться фибринозные свертки, состоящие из слизи и фибрина; рисовидные тельца (чечевицы, линзы Коха); эозинофилы; эластические волокна; спирали Куршманна. Увеличение содержания лимфоцитов в мокроте возможно при туберкулезе легких. Определение белка в мокроте может явиться подспорьем при дифференциальной диагностике между хроническим бронхитом и туберкулезом: при хроническом бронхите в мокроте определяются следы белка, в то время как при туберкулезе легких в мокроте содержание белка больше, и он может быть определен количественно (до 100—120 г/л).
При силикозе легких в мокроте определяется примесь крови.
При коклюше в мокроте в большом количестве встречаются лимфоциты.
При туберкулезном процессе в легком, сопровождающемся распадом ткани, особенно при наличии каверны, сообщающейся с бронхом, может выделяться много мокроты. Кровянистая мокрота, состоящая почти из чистой крови, наиболее часто отмечается при туберкулезе легких. При туберкулезе легких с творожистым распадом мокрота ржавого или коричневого цвета. В мокроте могут обнаруживаться фибринозные свертки, состоящие из слизи и фибрина; рисовидные тельца (чечевицы, линзы Коха); эозинофилы; эластические волокна; спирали Куршманна. Увеличение содержания лимфоцитов в мокроте возможно при туберкулезе легких. Определение белка в мокроте может явиться подспорьем при дифференциальной диагностике между хроническим бронхитом и туберкулезом: при хроническом бронхите в мокроте определяются следы белка, в то время как при туберкулезе легких в мокроте содержание белка больше, и он может быть определен количественно (до 100—120 г/л).
При острых бронхитах мокрота слизистая. В ней могут быть обнаружены клетки цилиндрического эпителия (как единичные, так и в виде скоплений).
При легочной форме сибирской язвы мокрота может быть ржавой или коричневого цвета, что указывает на содержание в ней не свежей крови, а продуктов ее распада (гематин).
При пневмониях отделяется небольшое количество мокроты. По характеру она может быть слизистой, слизисто-гнойной. Примесь крови в мокроте определяется при крупозной и очаговой пневмониях. Мокрота ржавого или коричневого цвета, указывает на содержание в ней не свежей крови, а продуктов ее распада (гематин) и встречается при крупозной пневмонии. Желто-канареечный цвет имеет иногда мокрота при эозинофильных пневмониях. В мокроте могут быть обнаружены фибринозные свертки, состоящие из слизи и фибрина; желчные пигменты, что связано с внутрилегочным распадом эритроцитов и последующими превращениями гемоглобина; эозинофилы (при эозинофильной пневмонии); спирали Куршманна; кристаллы Шарко—Лейдена (при эозинофильной пневмонии); пневмококки, диплококки Френкеля, бактерии Фридлендера, стрептококки, стафилококки (100%).
Отмечается много свежих эритроцитов, сидерофагов, гемосидерина.
источник
Туберкулез – это микробная, специфическая и хронически протекающая инфекция.
Вопреки распространенному мнению, что туберкулез поражает только легкие, он опасен для всех тканей тела, за исключением волос и ногтей. Но легочные формы инфекции наиболее распространены, поэтому для диагностики этой формы применяют посевы мокроты.
Но это не единственная методика определения болезни. Нередко туберкулез протекает скрыто, его принимают за ОРВИ, бронхиты, пневмонии и другие проблемы здоровья, важно вовремя его определить, так как лечение длительное, сложное и многоэтапное, подавить бактерии непросто.
Чтобы определить наличие патогенных бактерий в организме больного, можно использовать несколько методов исследования. К ним относят микроскопию мокроты (метод Циля-Нильсена), люминисцентное исследование, посев мокроты (или бактериоскопия) и метод ПЦР-реакции.
Все эти тесты обнаруживают наличие микобактерий туберкулеза в образцах мокроты, собранной по всем правилам и немедленно доставленной в лабораторию.
Чтобы результаты были достоверными, берется не одна, а три пробы мокроты, из каждой берется необходимый объем материала для исследования.
Результаты считают положительными, если хотя бы в одной из трех проб обнаруживаются микобактерии туберкулеза – кислотоустойчивые микробы. Для всех этих исследований берут мокроту, которую получают при откашливании или за счет отсасывания из бронхов или бронхоскопии.
Данный метод на сегодняшний день, наряду со всеми другими, относится к ведущему методу диагностики туберкулеза. Он помогает визуально определить микобактерии, и сделать выводы о том – есть он в образцах или нет. Этот метод, хотя он простой и примитивный, не уступает многим другим более сложным и дорогим методикам в точности. Исследование проводится после получения образца мокроты при откашливании:
Мазок окрашивается специальными красителями;
Методика доступная и простая, экономичная и может применяться в любой клинике. Однако, нет строгой специфичности исследования, она выявляет любые микобактерии, даже те, что не приводят к воспалению легких и поражениям.
Для этого исследования мокрота готовится так же, как для обычной микроскопии, но используется особый микроскоп, который выявляет свечение микобактерий желтым цветом, когда весь фон при этом окрашен в синий цвет. При помощи этой методики определяется еще и количество возбудителей, и по нему можно говорить о тяжести состояния и длительности туберкулеза.
Это современный высокоинформативный метод выявления бактерий. Он определяет ДНК микобактерий, которая специфична для каждого типа возбудителей. В лаборатории воспроизводят копирование участка ДНК бактерий, что позволяет определить его затем за счет определенных реактивов и методов идентификации. Метод точно выявляет туберкулез.
Это один из стандартов исследования на туберкулез, он проводится всем пациентам после забора материала. Посевы проводят на специальные питательные среды, и достаточно даже небольшого количества живых туберкулезных палочек для их идентификации. Рост бактерий длительный, посевы готовят долго, могут быть сроки от 3 до 12 недель.
Колонии туберкулезных бактерий имеют специфичный вид, по которому их можно распознать. При помощи данной методики можно определить еще и бактериовыделение (когда пациент особенно опасен).
Оценка результатов проводится в баллах. Нормативом будет отрицательный посев, не обнаруживающий роста бактерий. Положительные результаты трактуют как:
- 1 балл – скудная картина туберкулезной инфекции;
- 2 балла – умеренное выделение бактерий;
- 3 балла – обильное бактериовыделение.
При результате 3 балла пациент опасен для окружающих, у него туберкулез имеет активное течение, микробы вредят его здоровью.
Также в результате исследования определяют еще и чувствительность посеянных бактерий к антибиотикам и химиотерапевтическим препаратами. После выращивания колоний на питательных средах проводят тест на препараты и по его результатам вносят коррективы в лечение.
Мокрота выделяется легкими при различных патологиях, в том числе и при туберкулезе. Она может иметь различный характер – слизистая, кровянистая, гнойная. Отделение мокроты происходит при кашле, поэтому можно собрать ее как при откашливании, так и за счет аспирации из бронхов. Чтобы результаты были максимально достоверными, важна правильная методика забора материала:
- Мокрота сдается утром после сна, строго натощак;
- Перед сдачей анализа не нужно чистить зубы;
- Важно заранее прополоскать полость рта теплой водой;
- Мокроту стимулируют к отделению за счет серии из трех глубоких вдохов;
- За счет кашлевых толчков откашливается комочек мокроты, который собирается в стерильную емкость, которую сразу же закрывают и доставляют в лабораторию. При сборе мокроты краев емкости не касаются, это может привести к искаженным результатам.
Особенностями сбора именно на туберкулез являются некоторые дополнительные пункты в сборе. Так, процедуру проводят в отдельном помещении, где активно вентилируются комнаты, либо есть открытое окно, в отсутствии посторонних или членов семьи, чтобы не распространять бактерии. Затем комната, где был больной и собирал мокроту, тщательно проветривается.
Материал собирают трижды, каждое утро, используя новый контейнер. Если мокрота плохо откашливается, проводят ингаляцию с физраствором для стимуляции и откашливания.
Хотя сегодня туберкулез можно выявлять различными методами – флюорография, пробы Манту и Диаскинтест, для подтверждения инфекции необходимо обнаружение бактерий. Учитывая, что данные посева оценивают в совокупности с ПЦР, бактерископией, это дает максимально точный результат. Помимо этого, определяется еще и наличие бактериовыделения – то есть заразной стадии инфекции. Помимо прочего, посевы дают возможности определить необходимые лекарства, к которым чувствительны бактерии, что помогает в лечении туберкулеза. При закрытой форме туберкулеза мокрота не будет обнаруживать наличие бактерий.
Парецкая Алена, врач, медицинский обозреватель
3,547 просмотров всего, 8 просмотров сегодня
источник
Сбор мокроты.
Мокрота(sputum) — это патологическое отделяемое из дыхательных путей — легких, бронхов, трахеи, гортани, выделяется при кашле или отхаркивании. В состав мокроты могут входить слизь, серозная жидкость, клетки крови и дыхательных путей.
Сбор мокроты желательно осуществлять утром (так как она накапливается ночью) и до еды. Анализ мокроты будет достоверней, если пациент предварительно почистил зубы щёткой и прополоскал рот кипячёной водой, что позволяет уменьшить бактериальную обсеменённость полости рта.
Анализ мокроты следует проводить подготовленному и обученному пациенту:
Мокрота лучше отходит и её образуется больше, если накануне исследования пациент употреблял больше жидкости;
Сбор мокроты проходит эффективней, если пациент предварительно выполняет три глубоких вдоха с последующим энергичным откашливанием. Необходимо подчеркнуть, что важно получить именно мокроту, а не слюну.
Сбор мокроты выполняют в стерильный разовый герметичный флакон (контейнер) из ударостойкого материала с навинчивающимся колпачком или плотно закрывающейся крышкой. Флакон должен иметь ёмкость 20-50 мл и широкое отверстие (не менее 35 мм в диаметре), чтобы пациент мог легко сплёвывать мокроту внутрь флакона. Для возможности оценки количества и качества собранной пробы флакон должен быть изготовлен из прозрачного материала.
Если сбор мокроты проходит в присутствии медицинского работника, то последнему необходимо одеть перчатки (взятие материала и его отправку следует осуществлять в перчатках). Учитывая, что при энергичном кашле мокрота в виде капель может разбрызгиваться, с профилактической целью следует одеть маску, а при необходимости закрыть глаза очками или сразу всё лицо защитным щитком. Лучше вообще находиться за спиной пациента, выбирая свое положение таким образом, чтобы направление движения воздуха было от медработника к пациенту.
Для провокации кашля, а так-же если мокрота отделяется плохо пациенту проводят в течение 10-15 минут ингаляцию 30-60 мл подогретого до 42-45 градусов Цельсия раствора (в 1 л стерильной дистиллированной воды растворяют 150 г хлорида натрия и 10 г бикарбоната натрия). У большинства пациентов после подобной ингаляции ещё в течение нескольких часов наблюдается остаточная гиперсекреция бронхиального содержимого. Для исследования достаточно 3-5 мл мокроты, но анализ можно проводить и при меньших объёмов. Анализ мокроты необходимо проводить не позднее, чем через 2 часа после сбора. Если собранная мокрота подлежит транспортировке в другое учреждение, то до момента отправки в лабораторию герметично закрытые флаконы с материалом хранятся в холодильнике не более 2-3 суток. При более длительном хранении необходимо применить консервирующие средства. Во время транспортировки мокрота должна быть защищена от воздействия прямых солнечных лучей и тепла.
Факторы, влияющие на результат исследования:
1. Неправильный сбор мокроты.
2. Мокрота несвоевременно отправлена в лабораторию. В несвежей мокроте размножается сапрофитная флора, разрушаются форменные элементы.
3. Анализ мокроты проведён уже после назначения антибактериальных, противогельминтных средств.
Анализ мокроты.
Если мокрота отделяется в виде небольших плевков, то — это защитная реакция. Если много — это патология. При хроническом бронхите выделяется слизистая или гнойная мокрота до 250 мл в сутки. При бронхоэктазах (расширение бронхов или их отделов), абсцессе лёгкого — мокрота обильная, гнойная, с запахом, до 500 мл/сут.
Утренний кашель с мокротой характерен в первую очередь для курильщиков с хроническим бронхитом. Ночью мокрота скапливается в бронхах, а утром после подъёма с постели вследствие перемены положения тела перемещается, раздражая рефлексогенные зоны и вызывая кашель. Кашель с мокротой в течение дня у подростков, скорей всего будет обусловлен гайморитом, а не хроническим бронхитом.
По положению больного, при котором мокрота отделяется лучше всего, можно получить условное представление о локализации полости или бронхоэктазов в лёгком. При расположении бронхоэктазов в левом лёгком выделение мокроты с кашлем будет облегчаться при нахождении на правом боку, и наоборот. При бронхоэктазах в передних отделах лёгких, мокрота лучше отходит в положении лёжа на спине, в задних отделах — на животе. Данное обстоятельство используется для постурального дренажа лёгких (пациент 3-4 раза в день занимает определённое положение на 10-20 минут для облегчения отхождения мокроты под влиянием силы тяжести).
В исследования физических свойств входят: характер, цвет и консистенция.
Анализ мокроты начинают с её внешнего осмотра в чашке Петри, которую ставят попеременно на чёрный и белый фон.
Общее правило: прозрачная слизь — это обычная защитная мокрота; мутная мокрота — идёт воспалительный процесс.
Слизистая мокрота — бесцветная (прозрачная), вязкая, практически не содержит клеточных элементов. Встречается при многих острых и хронических заболеваниях верхних и нижних дыхательных путей.
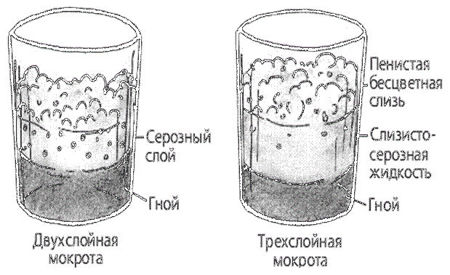
Серозная мокрота — бесцветная, жидкая, пенистая. Выделяется при отёке лёгких.
Гнойная (или гнилостная) мокрота содержит гной. Цвет мокроты — жёлтый или зелёный. Чисто гнойная мокрота встречается, например, при прорыве абсцесса лёгкого в бронх; чаще наблюдается смешенная — слизисто-гнойная мокрота. Гнойная (или гнилостная) мокрота содержит гной. Цвет мокроты — жёлтый или зелёный. Чисто гнойная мокрота встречается, например, при прорыве абсцесса лёгкого в бронх; чаще наблюдается смешенная — слизисто-гнойная мокрота.
Зелёный цвет мокроты — это вообще любая патология, связанная с задержкой оттока (гаймориты, бронхоэктазы, посттуберкулёзные нарушения и пр) У подростков при зелёной мокроте в первую очередь надо исключать лор-патологию, а не предполагать хронический бронхит.
Мокрота янтарно-оранжевого цвета отражает эозинофильную реакцию и свидетельствует об аллергии.
Кровянистая — мокрота с примесью крови. Может быть чисто кровяной на фоне легочных кровотечений, так и смешанной, например, слизисто-гнойной с прожилками крови при бронхоэктазах. Если кровь задерживается в дыхательных путях, то гемоглобин превращается в гемосидерин, и цвет мокроты приобретает оттенок ржавчины (ржавая мокрота). Кровь в мокроте (даже единичные прожилки) — всегда настораживающий признак, требующий тщательного обследования (см. файл Кровохарканье).
Жемчужная мокрота содержит округлые опалесцирующие включения, состоящие из атипичных клеток и детрита. Жемчужная мокрота наблюдается при плоскоклеточном раке бронхов.
При отстаивании мокрота может расслаиваться. Трёхслойная мокрота — это обильная, гнойная мокрота, которая при отстаивании разделяется на три слоя: верхний — серозный, пенистый; средний — слизистый, бесцветный, прозрачный; нижний — грязного серо-зелёного цвета, содержащий гной и остатки некротизированных тканей. Наблюдается при гангрене лёгкого.
Из отдельных элементов, различимых простым глазом можно обнаружить:
Спирали Куршмана в виде небольших плотных извитых беловатых нитей.
«Чечевицы» — небольшие зеленовато-жёлтые плотные комочки, состояние из обызвествлённых эластических волокон, кристаллов холестерина. Встречаются при туберкулёзе.
Пробки Дитриха. Макроскопически имеют вид мелких желтовато-серых зернышек с неприятным запахом, содержатся в гнойной мокроте. Микроскопически представляют собой детрит, бактерии, кристаллы жирных кислот в виде игл и капелек жира. Образуются при застое мокроты в полостях, главным образом при абсцессе легкого, бронхоэктазах.
Друзы актиномицетов в виде мелких желтоватых зёрнышек, напоминающих манную крупу.
Мокрота чаще не имеет запаха. Зловонный запах мокроты зависит либо от распада ткани (гангрена, раковая опухоль) либо от разложения белков самой мокроты при задержке её в полостях (абсцесс, бронхоэктазы).
Реакция мокроты, как правило, имеет щелочной характер. Кислой она становится при разложении мокроты (длительное стояние) и от примеси желудочного сока (что помогает дифференцировать кровохарканье от кровавой рвоты).
Бактериоскопия и посев мокроты
Для бактериоскопического исследования предварительно готовят препарат. Вначале растирают комок мокроты между двумя предметными стёклами; затем высохший мазок фиксируют над пламенем горелки и окрашивают: для поисков микобактерий туберкулёза по Цилю-Нильсену, в других случаях — по Грамму.
Чувствительность бактериоскопического метода напрямую зависит от кратности обследования пациента. Например, согласно исследованиям, однократный анализ мокроты на микобактерии туберкулёза имеет чувствительность 80-83%, двукратный анализ мокроты (в течение двух дней) — на 90-93% больше и при исследовании трёх проб мокроты (в течение трёх дней) — 95-98%. Таким образом, при подозрении на туберкулез органов дыхания необходимо исследовать не менее трёх проб мокроты.
Отрицательный результат микроскопического исследования не исключает диагноз той или иной инфекции, так как мокрота пациента может содержать меньше микробов, чем может выявить микроскопическое исследование.
Когда бактериоскопическое исследование не обнаруживает предполагаемого возбудителя, прибегают к посеву мокроты на питательные среды. Посев мокроты производят не позднее 2-х часов после сбора. Если подозревается туберкулёз, то сбор мокроты осуществляют в течение 3-х последовательных дней.
Бактериологическое исследование позволяет идентифицировать вид микробов и определять их антибиотикочувствительность.
Обычно у здоровых лиц в мокроте при посеве выявляются альфа-гемолитический стрептококк, Neisseria spp., дифтероиды. Обнаружение лишь нормальной микрофлоры ещё не означает отсутствие инфекции. Результат посева следует интерпретировать с учётом клинической картины и общего состояния пациента.
Критерием этиологической значимости возбудителя будет выявления микроба в концентрации 106в 1 мл и выше. Но к выявлению микобактерий туберкулёза в любом количестве следует отнестись со всей серьёзностью.
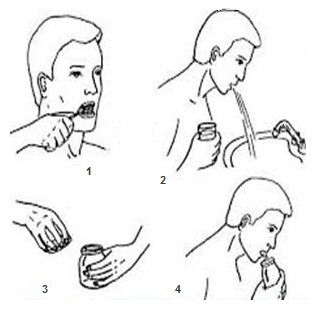
СБОР МОКРОТЫ НА МИКОБАКТЕРИИ ТУБЕРКУЛЕЗА
Цель: обеспечить качественный сбор мокроты, содержащей достаточное количество микобактерии туберкулеза, если они выделяются.
Оснащение: карманная плевательница для сбора мокроты или чистая, стеклянная широкогорлая банка из темного стекла с крышкой, направление в лабораторию.
| Этапы | Примечание |
| Подготовка к процедуре | |
| 1. Предупредить и объяснить пациенту смысл и необходимость предстоящего исследования. | |
| 2. Объяснить, что необходимо ежедневно, в течение 3 дней подряд собирать мокроту для исследования в емкость из темного стекла. | На свету микобактерии погибают и лизируются. |
| 3. Обеспечить, направлением. | |
| 4.Обучить технике сбора мокроты: — предупредить, что собирают мокроту только при кашле, а не при отхаркивании. | Если пациент испытывает трудности при обучении, оставьте ему письменные рекомендации. |
| 5. Объяснить, что необходимо соблюдать правила личной гигиены до и после сбора мокроты. | |
| 6. Объяснить, что вечером необходимо почистить зубы, а утром прополоскать рот и глотку кипяченой водой непосредственно перед сбором. | Можно собирать мокроту, которая отходит ночью. |
| ВЫПОЛНЕНИЕ ПРОЦЕДУРЫ | |
| Утром откашлять и собрать мокроту в чистую банку в количестве не менее 15-20 мл. Закрыть крышку; | При скудном отделении мокроты она собирается в течение 1— 3 дней в карманную плевательницу из темного стекла. Хранить в прохладном месте, затем перелить в банку для анализа. |
| ОКОНЧАНИЕ ПРОЦЕДУРЫ | |
| Прикрепить направление и доставить банку в клиническую лабораторию |
Список использованной литературы
1. Лабораторные и инструментальные исследования в диагностике: Справочник / Пер. с англ. В.Ю. Халатова; под. ред. В.Н. Титова. — М.: ГЭОТАР-МЕД, 2004. — 960 с.
2. Kincaid-Smith P., Larkins R., Whelan G. Problems in clinical medicine. — Sydney: MacLennan and Petty, 1990, 105-108.
3. Лабораторные методы исследования в клинике: Справочник. Под ред. проф. Меньшикова В.В. — М.: «Медицина», 1987. — 368 с.
4. Пропедевтика внутренних болезней. Под ред. В.Х. Василенко, А.Л. Гребнёва. — М.: «Медицина», 1982. — 640 с.
5. Справочник по клиническим лабораторным методам исследования. Под ред. Е.А. Кост. — «Медицина», 1975 — 383 с.
источник
