Туберкулёз древнейшее заболевание, которое подтверждают археологические находки египетских мумий с пораженным позвоночником. Но причина заболевания была выявлена позже в середине девятнадцатого века Робертом Кохом, палочка которого названа его именем.
Для подтверждения связи с туберкулёзом, великий ученый провел несколько действий, которые используются для идентификации бацилл в настоящее время. Анализ мокроты при симптомах на туберкулёз и выращивание чистой культуры.
Возбудитель туберкулёза является чем-то средним между бактерией и грибком.
Бацилла неуловимая под микроскопом благодаря восковой оболочке, которая не дает окрасить бактерию и делает ее неуязвимой для существования без жидкости и питания при низких температурах. Она просто погружается в анабиоз.
Палочка не способна передвигаться самостоятельно. Попав в организм с потоками воздуха, оседает в легких. На месте внедрения начинается активное размножение.
Первое время организм не проявляет реакции на проникновение инородного белка, этому препятствует капсула.
Когда происходит реакция к чужеродным белкам, к ним устремляются фагоциты, которые стараются поглотить начальную инфекцию. Но оказавшись внутри фагоцитов, палочка Коха перестраивает свою деятельность, сохраняя и используя жизнедеятельность этих клеток. Так формируется очаг инфекции.
Иммунная система локализует место поражения, которое покрывается соединительным материалом. Если иммунитет ослаблен, то капсула вокруг бациллы не формируется.
Без терапии происходит распад ближайших клеток и поражение туберкулезом других органов. Бацилла распространяется воздушно-капельным путем, реже через продукты питания.
Исследование микробактерий туберкулёза стало классикой это рентген и реакция Манту. Проводятся исследования мокроты и других выделений больного пациента.
Для туберкулёзного инфицирования обязательным признаком является мокрота, которая имеет гнойно-слизистый цвет с небольшими кровяными краплениями. Кристаллы, волокна, белковые соединения и кровь характерны для кавернозного туберкулеза.
Анализ мокроты берется при подозрении на туберкулёз легких и применяется для диагностики заболевания.
Если воспалительный процесс затронул другие важные органы, то объектом исследования может служить жидкость плевральной и брюшной области, спинномозговая жидкость и полостей костных соединений.
Веществом для анализа могут быть куски материала повреждённого органа, пункции лимфатических узлов и костного мозга.
При туберкулёзе мочевой системы для исследования берется утренняя урина.
Бактериоскопическая оценка является быстрым методом обнаружения бактерий туберкулёза, но при условии наличия 10 тыс. микробов в 1 мл материала.
Метод посева биоматериала более восприимчивый, МТБ можно выявить даже если их насчитывается больше сотни. Но время получения результата от трех до восьми недель.
Метод ПРЦ самое высокочувствительное исследования позволяет обнаружить МТБ в любом биоматериале. Это важно при диагностировании внелёгочного вида туберкулёза.
Автоматизированный способ культивирования бактерий сокращает время обнаружения.
Лаборатория проводит общий анализ, который включает макроскопическое, химическое, микроскопическое и бактериоскопическое исследование. При макроскопическом анализе устанавливают количество, характер, цвет, запах, слоистость, примеси.
Химический анализ дает показатели реакции, белка, желчных пигментов.
Микроскопическое исследование выявляет эпителиальные клетки, альвеолярные макрофаги, лейкоциты, эритроциты, эластические волокна, опухолевые клетки.
Мокрота является слизью без запаха и цвета, которая выводится специальными ворсинками, покрывающими ткань бронхов. Собранный секрет после попадания в ротовую полость инстинктивно проглатывается и отправляется в желудок.
Если человек здоров, то подобные слизистые выделения не образуются. Патологическая слизь образуется при заболеваниях бронхиального дерева, легких, трахеи.
Если при рентгене будут обнаружены уплотнения больше 1 см, то врач обязательно направляет на обследование. Сбор мокроты для анализа на микобактерии туберкулёза осуществляется в утреннее время сразу после сна. Перед процедурой следует полоскать горло и рот.
Если отхаркивания мокроты проблематичные, то необходимо заранее употреблять средство Бромгексин. Мокроту необходимо собирать в стерильный контейнер, который выдают в лаборатории. Посев мокроты проверяют не позже двух часов после сбора.
Бактериоскопический анализ мокроты проводят при подозрении на туберкулёз в специально окрашенном мазке. Исследование предусматривает одно правило быстро сдать мокроту в лабораторию.
Как правильно собрать мокроту. Больной делает несколько глубоких вздохов, глядя в окно, затем делает последний глубокий вдох и максимальный выдох. Такие движения грудной клетки вызывают кашель. Отхаркивающуюся мокроту сплевывает в контейнер.
Сколько времени хранится посев. Слизь, выделяемая бронхами, долго не хранит бактерии туберкулёза. При попадании в неблагоприятную среду они могут впасть в состояние анабиоза или погибнуть.
После сбора готовится средство, с помощью которого будет рассматриваться анализ под микроскопом. Часть мокроты на бк посев распределяется между стеклами, затем устанавливают над двумя горелками. После этого окрашивают специальным раствором по методу Гросса или Циля-Нильсона и используют микроскоп для изучения.
Сколько длится проверка анализов. Больше времени занимает культуральное исследование, выращивание бактерий в искусственной обстановке в течение месяца. Достоинством такого анализа является точность и дешевизна.
ПЦР и автоматизированный способ культивирования не требуют много времени и результаты могут быть готовы на следующий день.
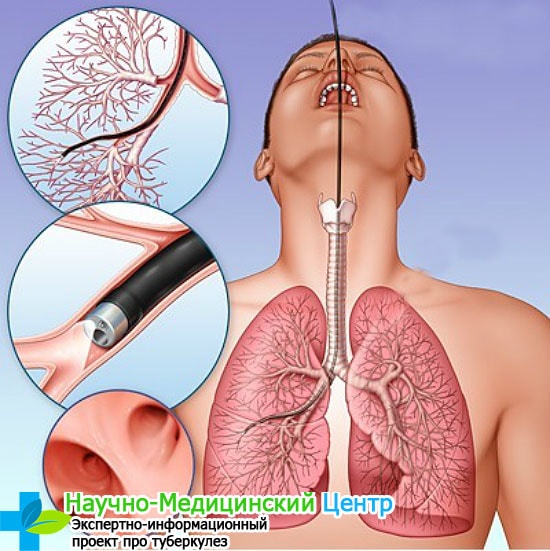
Как сдавать анализ, если мокрота самостоятельно не выделяется для исследования на туберкулёз. В этом случае используют бронхоскопию. Этим способом можно оценить состояние мокроты, взять ее для анализа и извлечь.
Таким методом мокрота исследуется на туберкулёз с помощью бронхоскопа. Это не легкая процедура и делается с применением местной анестезии. Перед этим пациент 6 часов не должен кушать и пить.
Мокрота при исследовании на туберкулёз может выявить не только бациллу, но и сказать какая форма заболевания открытая или закрытая. Анализ мокроты на туберкулёз расшифровки не требует, ответом будет наличие возбудителей или их отсутствие.
Кроме самой палочки Коха можно отследить патологические процессы в легких. Кровь или бурый оттенок свидетельствуют о кровотечении в результате сильнейшего повреждения тканей. Ихорозные накопления сообщают о многочисленном крушении клеток. Обилие мокроты свидетельствует об уровне повреждения.
Несмотря на то, что данное исследование анализа мокроты на туберкулёз наиболее точное, оно имеет недостатки. Не дает результатов на первоначальном этапе болезни и при закрытом виде туберкулеза, при нем МТБ не выходят со слизью. Такое исследование назначают лицам, у которых диагноз подтверждён.
Мокрота для анализа на туберкулёз позволяет обнаружить бактерии разными способами и исследование зависит от формы заболевания.
источник
Уточнению диагноза туберкулеза органов дыхания способствует проведение лабораторных анализов мокроты и плеврального выпота на микобактерии туберкулеза (МБТ). Мокрота для исследования собирается утром в стерильную баночку, которая хранится закрытой. Если мокроты мало, необходимо предложить больному собирать ее при откашливании в течение суток.
При отсутствии мокроты используются раздражающие ингаляции или получают промывные воды бронхов. Чтобы выявить микобактерии туберкулеза, мокроту исследуют троекратно до назначения противотуберкулезных препаратов. При этом используются бактериоскопический, культуральный и биологический методы выявления МБТ.
Бактериоскопией микобактерии туберкулеза выявляются при наличии их не менее 100 000 в 1 мл. Анализ мокроты в лаборатории начинается с макроскопического описания. Микроскопия нативного мазка позволяет выявить в мокроте эритроциты, эластические волокна (ЭВ) из легочной ткани, коралловидные волокна (волокна Коппена—Джонса), кристаллы Шарко—Лейдена, спириллы Куршмана, клетки сердечных пороков.
В мокроте больных туберкулезом вместе с микобактериями туберкулеза можно обнаружить темные зерна различной величины. Они попадают в мокроту из старых, распадающихся очагов. При этом С. Л. Эрлих объединил все это в так называемую «тетраду», которая включает четыре признака:
1) микобактерии туберкулеза (МБТ) при микроскопии;
3) кристаллическая или аморфная известь;
Обнаружение этих признаков в мокроте свидетельствует об обострении в легочной ткани старого туберкулезного процесса. Дальнейшее исследование мокроты проводится методом отбора. Собранную мокроту переливают в чашку Петри, которую устанавливают на черную бумагу.
Деревянной палочкой отбирают гнойные комочки и переносят на предметное стекло. Другим таким же стеклом комочки растирают. Один препарат исследуют в нативном виде, другой исследуют на МБТ при световой или люминесцентной микроскопии после специальной окраски. При световой микроскопии окраску проводят по Цилю—Нильсену: карболовый фуксин, 3 % раствор солянокислого спирта, 0,25 % раствор метиленового синего.
Препараты микроскопируют с иммерсией. МБТ в них окрашиваются в красный цвет и бывают расположенными внутри или внутриклеточно. Эффективность бактериоскопии возрастает до 30 % при использовании люминесцентной микроскопии. Для этого препараты окрашивают аурамином или родамином. При микроскопии микобактерии туберкулеза (МБТ) на темном фоне ярко сверкают золотисто-зеленым или золотисто-фиолетовым светом.
В тех случаях, когда микобактерии туберкулеза (МБТ) не удалось выявить методом отбора, дальнейшие исследования мокроты на микобактерии туберкулеза (МБТ) проводят методом флотации (обогащения) исследуемого материала. На первом этапе флотации проводится гомогенизация 15—20 мл мокроты путем добавления щелочи, встряхивания и подогревания, а на втором — собственно обогащение.
Обогащение осуществляется центрифугированием или флотацией. При флотации в гомогенизированный материал добавляют до 180 мл дистилированную воду, 2 мл органического растворителя (бензин, бензол, ксилол) и производят встряхивание на специальном аппарате в течение 20 мин. После этого в сосуд доливают доверху воду. Из флотационного кольца готовят препараты и исследуют их в микроскопе после соответствующей окраски. Флотация повышает чувствительность бактериоскопии в 10 раз.
Широкое использование в клинических условиях культурального и биологического методов выявления микобактерий туберкулеза (МБТ) повышает эффективность микробиологической диагностики.
Все, что Вы хотите знать о туберкулезе
В.Ю. Мишин
Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ) .
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице:
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Интенсивность роста МБТ определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++» 21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бактериовыделение).
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Система ВАСТЕС MGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями 02. В процессе роста МБТ поглощают 02, что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов , основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
источник
В здоровом организме бронхи вырабатывают слизь без цвета и запаха, которая необходима для того, чтобы очищать дыхательные пути от попадающих туда микроскопических частичек пыли, вдыхаемого мусора и микробов. Механизм очищения органов дыхания очень прост: реснички эпителия, устилающего их, поднимают слизь наверх вместе с чужеродными частицами. В норме такой мокроты вырабатывается очень мало, поэтому здоровый человек не замечает ее отделения, и она проглатывается вместе со слюной.
Но на фоне любого воспалительного процесса, сопровождающего, какое-либо заболевание дыхательных путей, в том числе и туберкулеза, количество продуцируемой бронхами мокроты значительно возрастает. Это связано, в первую очередь, с раздражением бокаловидных клеток, а также, при присоединении воспалительного процесса, когда клетки иммунной системы организма начинают поглощать патогенные микроорганизмы, образуются гнойные массы. Они также формируют отделяемое в виде мокроты при заболеваниях дыхательных путей. С помощью кашля организм выводит эту жидкость – именно с помощью нее диагностируются многие бронхо — легочные патологии и выявляется степень и характер течения воспалительного процесса.
Количество выделяемой при влажном кашле мокроты также указывает на некоторые особенности течения заболевания. При этом она может, не выводится посредством кашля совсем (трудноотделяемая мокрота) или, наоборот, биоматериал можно собрать без каких-либо трудностей. Два самых распространённых исследования этого отделяемого – это бактериоскопия и посев: именно эти два этапа позволяют провести точную диагностику заболевания, вызвавшего повышенное отделение мокроты и как следствие, влажный кашель с рядом сопутствующих симптомов.
- Для начала необходимо позаботиться о контейнере – его можно купить в любой аптеке. Это специализированная емкость для сбора мокроты: она стерильна, с широким горлышком и крышкой. Также контейнер могут выдать в медицинском учреждении. Необходимый объем биоматериала для исследования – 5мл, поэтому емкость должна быть соответствующая.
- Самым подходящим временем для сбора мокроты являются утренние часы, поскольку за время ночного сна скапливается достаточное количество и собрать ее гораздо легче. Однако бывают такие обстоятельства, когда мокрота забирается в любое время суток.
- Перед тем, как приступить к сбору мокроты на анализ, тщательно прополоскать ротовую полость, при этом чистить зубы перед этим нельзя.
- Биоматериал для анализа собирается следующим образом: сделав максимально глубокий вдох, задержать дыхание, после чего медленно выдохнуть – повторить еще раз. Сделав третий глубокий вдох, резко выдохнуть, как бы выталкивая воздух из лёгких, и как следует откашляться. Во время этого рот должен быть прикрыт марлевой повязкой.
- Контейнер необходимо придерживать у нижней губы — сплюнуть в него все содержимое, которое получилось откашлять и плотно закрыть стерильную баночку крышкой.
- Если после одного раза мокроты отошло очень мало, то процедуру следует повторить, для того чтобы собрать необходимое для исследования количество(5-7 мл.)
Для начала можно попробовать поменять положение тела при откашливании: облегчают отхождение мокроты наклоны вниз, положения, лежа на боку или на животе.
Если такие меры не привели к положительному результату, то можно принять отхаркивающие средства или сделать ингаляцию. Отхаркивающие препараты назначает лечащий врач, и начинать принимать их необходимо за сутки до сбора мокроты (бромгексин, амбробене и другие традиционные препараты). Совместно с приемом таких препаратов необходимо употреблять достаточно большое количество жидкости для облегчения отхождения мокроты.
Ингаляцию для этой цели делают на основе раствора соды и соли. Вдыхать такую смесь следует через небулайзер 10-15 минут(40-60 мл.). Если начинается усиленное слюноотделение, то ее нужно сплюнуть, только потом собирать мокроту.
Если не удается собрать мокроту всеми вышеперечисленными способами, то пациенту назначается процедура бронхоскопии. Еще такое исследование проводится в случаях, когда необходимо собрать секрет мокроты с бронхов, без примесей слюны и носоглоточной микрофлоры.
Процедура проводится посредством двух методик:
- В бронхи вводится 100-200 мл. физ. раствора через вставленный катетер, после чего полученная жидкость посредством аспирации выводится обратно.
- В просветы бронхиального дерева вводят катетер для прямой аспирации слизи.
Пациенту необходимо пройти подготовку к этой процедуре: не употреблять пищу и жидкость в течение 6 часов, как правило, она назначается на утреннее время, чтобы пациенту было легче выдержать такой интервал времени. А после нее не употреблять аспириносодержащие препараты, которые обладают способностью разжижать кровь.
И промывные воды, и непосредственно мокрота, полученные таким способом, используются для всех видов исследований на данном биоматериале.
Если сдача мокроты проводится в условиях стационара, то медицинский работник предоставляет пациенту специально оборудованную процедурную, консультирует по поводу процедуры сдачи и контролирует весь процесс. Также медработник подписывает контейнер с биоматериалом и отправляет его на исследование.
Анализ мокроты на туберкулез позволяет выявить легочный тип развития заболевания. Основными показаниями для его проведения являются:
- Кашель затяжного характера (влажный или сухой);
- Выявленные затемнения на снимках рентгена;
- Повышенная температура тела.
Для постановки диагноза туберкулез легких, анализ мокроты является обязательным в спектре исследований, проводимых при подозрении на данное заболевание. Обязательным исследование на инфицирование туберкулезом считается в тех случаях, когда больной больше трех месяцев страдает от сухого кашля, который не поддается никаким видам лечения.
В связи с тем, что биоматериал для исследования на микобактерии берется не только при помощи непосредственного отхаркивания, но и путем бронхоскопии, данное исследование имеет противопоказания. При процедуре бронхоскопии вводится трубка в верхние органы дыхания под общей или местной анестезией. Поэтому, такая методика забора анализа противопоказана:
- пациентам, страдающим аллергией на обезболивающие медикаменты;
- людям с тяжелой дыхательной недостаточностью;
- с нарушениями свертываемости крови;
- пациентам, в ближайшие пол года перенесшим инфаркт миокарда или инсульт;
- с такими заболеваниями, как эпилепсия и шизофрения.
Детям до 18 лет процедура бронхоскопии назначается и делается только с согласия родителей. Сама процедура является безопасной и осложнения вызывает крайне редко, но препараты, предназначенные для общей и местной анестезии, могут вызывать непереносимость и аллергические реакции. Этот вопрос необходимо обязательно обсудить перед процедурой с лечащим врачом.
Самым весомым плюсом этого анализа является стопроцентная точность диагностики и возможность выявления туберкулеза на ранних этапах заражения. Тест включает в себя забор нескольких проб, которые способны однозначно указать присутствие или отсутствие возбудителя в легких пациента.
Сам анализ вариативен, и проводить его можно удобным для пациента способом; данная методика выполняется в короткие сроки, и доставляет минимум дискомфорта пациенту.
Такой метод сбора анализа на микобактерии не имеет побочных воздействий на организм пациента. Нет необходимости вводить медицинские препараты или сдавать анализы крови, мочи. По сути, сбор анализа на микобактерии происходит естественно, без особых трудностей и дискомфорта для пациента. Часто это становится актуально, когда речь идет о малолетних детях, которые весьма негативно переносят такие диагностические процедуры.
С помощью такого информативного метода, как бронхоскопия, медики имеют возможность выявить и другие патологии небактериального характера на ранних сроках (бронхиальная астма, рак легких и т.д.). Расширенное исследование качественного состава мокроты позволяет произвести диагностику на любом этапе развития заболевания . Таким образом, анализ может не только подтвердить или опровергнуть диагноз туберкулез, но и установить причину возникновения тревожной симптоматики.
К минусам можно отнести достаточно долгое ожидание результата анализа. На это есть две главные причины: многостороннее обследование биоматериала, включающее в себя бактериологический анализ и посев мокроты на питательные типы сред, который и является самым долгосрочным видом исследования. Время ожидания может растянуться от 3 недель до двух месяцев.
К отрицательной стороне также можно отнести многократное проведение бронхоскопии при подозрении на заражение туберкулезом, при отсутствии главного симптома – кашля.
После того как биоматериал поступил на исследование в лабораторию, специалист в первую очередь, занимается его визуальной оценкой. При тяжелых формах туберкулеза, например, в мокроте наблюдаются вкрапления крови или кровяные сгустки. Но такое отделяемое не является стопроцентным показателем заражения туберкулезом – наличие крови в мокроте может говорить и о крупозной пневмонии, и об опухолевых процессах, о бронхоэктатической болезни.
Если все же речь идет о туберкулезном заражении, то при дальнейшем исследовании в мокроте будут обнаружены микобактерии. В современной медицине используются две основных проверенных временем методики лабораторного исследования мокроты: бактериоскопическая и культуральная (биологическая).
Бактериоскопия применяется в диагностике туберкулеза уже более ста лет. Она включает в себя макроскопическое описание, микроскопическое исследование – при нем выявляются эритроциты, волокна легочной ткани, коралловидные, спириллы Куршмана и т.д. В мокроте зараженного туберкулезом пациента обнаруживаются, помимо микобактерий, темные фрагменты (зерна) – это частицы старых, распадающихся очагов.
Этот метод используется не только для выявления и диагностики такого коварного заболевания, как туберкулез, также он помогает в выборе рациональных схем химиотерапии и оценке их клинической эффективности.
Бактериологическая диагностика проводится в таком порядке:
- Обработка материала, поступившего в лабораторию.
- Микроскопическое исследование мокроты.
- Посев мокроты на туберкулез.
- Идентификация микроорганизма при помощи бактериологического и биохимического тестирования.
- Определение лекарственной чувствительности туберкулезной палочки.
Проводится исследование мокроты на туберкулез с помощью двух методов: обычная (простая) бактериоскопия и метод флорации. Простой метод включает в себя приготовление мазков из комочков мокроты – их помещают между двумя предметными стеклами. Затем одна часть биоматериала окрашивается по Грамму на общую флору, а другая – на микобактерии туберкулеза.
С начала 90-х годов многие современные лаборатории стали использовать в диагностике туберкулеза флюоресцентную микроскопию, основанную на кислотоустойчивости микобактерии. Под воздействием ультрафиолетового излучения туберкулезные палочки проявляются в ярко-желтом цвете на черном фоне.
Культуральный метод включает в себя такие диагностические процедуры:
- Удаление белковых масс путем обработки мазка разжижающими веществами.
- Удаление сопутствующей бактериальной формы с помощью деконтаминации образца.
- Встряхивание.
- Отстаивание смеси.
- Помещение в холодную центрифугу.
- После этого содержимое пробирки отбирается на посев:
- агаровой среды,
- плотной яичной среды,
- бульонного культивирования автоматизированного типа.
Культуральный посев мокроты повышает точность исследования в разы — при более легких степенях развития заболевания, при которых бактериологический метод может показать отрицательный результат. Однако работа таким методом требует хорошо оснащенных, современных лабораторий, которых, к сожалению, не имеют многие небольшие города и поселки городского типа.
Самыми быстрыми и точными видами анализов на обнаружение туберкулезной палочки являются молекулярно-генетические методы диагностики. Это современные комплексы анализов, включающие в себя расшифровку генома микобактерии туберкулеза. Такие молекулярно-диагностические методы открыли в современной медицине хорошие перспективы на последующее развитие эффективных методик борьбы с этим коварным заболеванием. Наиболее часто используется способ полимеразной цепной реакции – это тест предназначен для выявления микобактерии в мокроте или установления вида бактерий в культуральных средах.
Что имеет первостепенное значение в постановке диагноза — это время: вместе с обработкой материала, идентификация туберкулезной палочки занимает всего 5-6 часов. Кроме того, реакция ПЦР обладает высокой чувствительностью и специфичностью, что является залогом стопроцентно точного результата.
источник
Цель: обнаружение микобактерий туберкулеза, научить пациента самостоятельно собрать мокроту. 11оказание: заболевания органов дыхания.
Приготовьте:
-три плевательницы многоразовые или одноразовые или контейнеры с герметично завинчивающимися крышками; чистую -сухую широкогорлую банку из прозрачного стекла 50-200 мл с крышкой;
напишите и наклейте направление (ФИО пациента, год рождения, дата забора, идентификационный номер пациента, направление ф. ТБ- 05).
Алгоритм действия:
1. Проведите инструктаж с пациентом о правилах сбора мокроты на исследование.
2. Проводите забор мокроты в отсутствие посторонних лиц на открытом воздухе, либо в специально отведенной для этих целей отдельной комнате, хорошо проветриваемой, с открывающимися окнами, с наличием вытяжной вентиляции и кварцевой лампы.
3. Наденьте маску, клеенчатый фартук, резиновые перчатки.
4. Собирайте мокроту рано утром до приема пищи 3 дня подряд. Выдайте пациенту открытую плевательницу или контейнер.
5. Попросите пациента почистить зубы и прополоскать полость рта и зев водой или раствором соды.
6. Встаньте за спиной пациента и попросите его поднести ко рту плевательницу или контейнер.
7. Попросите пациента накрыть рот платком или тканью и сделать 3 глубоких вдоха и выдоха и в конце сильно откашлянуться и сплюнуть мокроту в количестве 3-5 мл в плевательницу или контейнер, не касаясь ее краев.
8. Закройте плевательницу (контейнер) крышкой.
9. Осмотрите мокроту и убедитесь, что мокрота содержит плотные гнойные частицы, а не слюну.
10.Отправьте собранную утреннюю пробу мокроты в лабораторию в течение суток.
11.Оформите бланк направление ф. ГЬ-05.
Примечание: при сборе мокроты для бактериоскопииеского исследования в условиях поликлиники, амбулатории, ФАПа мокроту собирают согласно выше описанных правил. Особенностью сбора мокроты вне стационара является сбор мокроты в два приема.
Первая проба мокроты собирается при обращении пациента в поликлинику утром под наблюдением медработника.
Вторая проба — утром следующего дня дома и доставляется в лабораторию. Третья проба собирается пациентом в этот же день в поликлинике под наблюдением медработника ( т.е. 2-3 пробы собираются в один день).
— сбор мокроты проводится обязательно под контролем медработника;
— многоразовые плевательницы и контейнеры подлежат дезинфекции и стерилизации;
одноразовые плевательницы после использования подлежат уничтожению.
1.105. Стандарт «Сбор мокроты для бактериологического исследования»
Цель: диагностическая: выявление возбудителя заболевания.
Показания: туберкулез и другие инфекционные заболевания.
Приготовьте: стерильную сухую плевательницу или стеклянную чистую сухую широкогорлую банку с плотно закрывающейся крышкой, бикс, чашку с кипяченой водой (остуженной), салфетку, бланки направлений, ручку, стеклограф, перчатки, маску, емкость с дезраствором, КБУ.
Алгоритм действия:
1. Собирайте мокроту в день исследования утром натощак.
2. Пронумеруйте плевательницу или банку.
3. Оформите направление в бактериологическую лабораторию.
4. Проведите деконтаминацию рук на гигиеническом уровне, наденьте перчатки, маску.
5. Установите доверительные отношения с пациентом и объясните ход и цель процедуры.
6. Проведите инструктаж с пациентом о правилах сбора мокроты.
7. Предупредите пациента, что он должен собрать мокроту при глубоком кашле, а не при отхаркивании и чтобы он не касался краев посуды руками или ртом.
— почистить зубы утром за 2 часа до сбора мокроты; прополоскать полость рта и глотку остуженной кипяченой водой;
— открыть крышку плевательницы;
— накрыть рот платком или тканью, сделать 3 глубоких вдоха, в конце 3-го выдоха сильно откашлянуть мокроту из более глубоких отделов легких в плевательницу, при этом пациент должен держать ее у нижней губы и тщательно сплюнуть мокроту, не касаясь краев плевательницы.
9. Закройте плевательницу плотной крышкой.
10.Обработайте наружную поверхность плевательницы салфеткой, смоченной в дезрастворе.
11.Осмотрите собранную мокроту, упакуйте плевательницу в металлический бикс.
12.Доставьте мокроту в бактериологическую лабораторию.
13.Снимите маску, перчатки, поместите в КБУ.
14. Вымойте и просушите руки.
Примечание:
— при затруднении отделения мокроты ее взятие следует провести после назначения отхаркивающих средств;
— мокроту собирают до назначения антибиотиков;
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8391 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Туберкулез — серьезное инфекционное заболевание, передающееся воздушно-капельным путем. Чаще всего заражение происходит, когда человек вдыхает болезнетворные бактерии.
Первыми признаками болезни являются снижение веса, повышение температуры и регулярный кашель с усиленным выделением мокроты (в норме секрет лишь смазывает слизистую, обильно не выделяясь).
В мокроте заболевшего присутствуют микробактерии туберкулеза, поэтому исследование слизистых выделений легких позволяет быстро выявить инфицирование.
Кроме того, при данной форме можно обнаружить так называемые рисовые тельца (линзы Коха), представляющие беловатые или желтоватые вкрапления, в составе которых дендрит, эластичные волокна и зараженные микробактерии.
Выделения происходят обильные, могут иметь неприятный, гнилостный запах.
Макроскопическое обследование. Секрет больного, зараженного туберкулезом, имеет гнойный характер, в нем присутствуют бактерии Коха, наблюдается небольшое вкрапление кровяных прожилок. Кровяные примеси возникают в случае нарушения целостности сосудов и чаще всего отмечаются у больных с кавернозной формой.
Кроме того, при данной форме можно обнаружить так называемые рисовые тельца (линзы Коха), представляющие беловатые или желтоватые вкрапления, в составе которых дендрит, эластичные волокна и зараженные микробактерии. Выделения происходят обильные, могут иметь неприятный, гнилостный запах.
Бактериоскопическое обследование. Готовится специальный препарат, который окрашивают методом Циля-Нельсона карболовым раствором фуксина. После осветления добавляют 3% раствор солянокислого спирта, 5% раствор серной кислоты, после чего окрашивают 0, 25% раствором метилена синего. По результатам определяют наличие палочки Коха. Все материалы препарата, кроме бацилл туберкулеза, приобретают синий цвет.
Данный метод анализа мокроты при туберкулезе легких чрезвычайно чувствителен. При первом обследовании чувствительность составляет около 80%, при повторном: 85-90%. Если образцы исследуются более трех раз, чувствительность возрастает до 97%. Для определения вируса в 1 мл материала должно быть более 100 000 микробактерий.
Фото 1. Врач проводит исследование мокроты на туберкулез: это быстрый и точный способ определить наличие микобактерий
Если имеются признаки и симптомы заболевания мокроту лучше тестировать не менее трех раз
Важно! Первый отрицательный результат не означает полного исключения диагноза. Часто образцы могут содержать меньше бактерий, чем необходимо для исследования.
Обследование начинается с внешнего осмотра. При наличии инфекции в слизистых выделениях встречаются инородные вкрапления или тромбы, части кальцинированных камней бронхов. При разрушении легочной ткани обнаруживаются эластичные волокна.
При обнаружении микробактерий секреция клеток дыхательных путей повторно исследуется, в клинику отправляется утренний сбор (как минимум, на протяжении трех дней). Обследование проводится как до начала лечения, так и во время.
Количество микробактерий в образцах должно уменьшаться, что свидетельствует о ремиссии заболевания.
Количество обнаруженных микобактерий позволяет разделить пациентов на две группы:
Первая группа классифицируется как активные выделители зараженных бацилл, имеющие прогрессирующий воспалительный процесс в легких.
Внимание! Эта группа опасна для окружающих и требует немедленной изоляции в условиях тубдиспансера.
После соответствующей противотуберкулёзной терапии и подтверждения того, что человек не является бактериостатическим агентом, пациент ставится на учет в поликлинику и тубдиспансер. При получении нескольких стерильных образцов без болезнетворных бактерий, после повторного и дополнительного обследования, пациент снимается с учета.
При отсутствии в выделениях болезнетворных бактерий или их незначительном количестве человек причисляется к группе BК-. Не представляя опасности для других, пациент должен быть также изолирован для предотвращения развития болезни и ее перехода в открытую форму.
Лечение осуществляется курсом. Назначается комплекс препаратов различного воздействия на палочку Коха, которые имеют одну общую цель: уничтожить её.
Дополнительно показаны физиотерапия, дыхательная гимнастика, иммунопрофилактика. Пациент регулярно сдает анализы.
источник

Бактериологический (культуральный) метод имеет ряд преимуществ перед микроскопическим и другими методами. Основное преимущество состоит в возможности обнаружения скудного количества жизнеспособных МБТ в клиническом материале: положительные результаты получают при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако ему свойственны и недостатки, обусловленные длительностью сроков появления видимых колоний микобактерий туберкулеза. В тоже время возможность получения чистой культуры возбудителя, которая может быть подробно исследована, позволяет решать вопросы изучения ее лекарственной чувствительности, вирулентности и других биологических свойств (типовой принадлежности).
Для нормального развития МБТ требуются специальные питательные среды, содержащие углерод, азот, водород, кислород, фосфор, магний, калий, а также железо, хлор, натрий, серу. Кроме того, для полноценного развития МБТ, как и других микроорганизмов, необходимо наличие факторов роста, которые в минимальных количествах улучшает рост бактерий на средах. Факторы роста не входят в состав ферментных систем клетки, но используются для их построения. Известны факторы роста, родственные по своей природе витаминам группы В, ряд аминокислот, органических кислот и липидов. Все эти факторы содержаться в разных количествах в питательных средах – яичных, кровяных, картофельных. Следует отметить, что потребности микробов в ростовых веществах весьма вариабельны и существенно зависят от условий культивирования. Имеющиеся в литературе сведения по этому вопросу немногочисленны и зачастую противоречивы.
В популяции МБТ обычно встречаются быстро и медленно растущие, персистирующие и лекарственно-устойчивые штаммы микобактерий. В зависимости от преобладания тех или иных штаммов МБТ с разными свойствами, меняется скорость и характер их роста на питательных средах, а при снижении жизнеспособности МБТ их рост на среде может не только замедлиться, но даже и не появиться. Первичные культуры микобактерий, выделенные из патологического материала, особенно чувствительны к отсутствию факторов роста. По-видимому, при вегетировании в тканях организма они теряют способность самостоятельно синтезировать такие вещества. Следовательно, для таких культур необходимы полноценные питательные среды.
По составу среды можно разделить на 3 группы:
- среды, содержащие глицерин;
- белковые среды (сывороточные, яичные);
- синтетические (безбелковые) среды.
- смешанные среды, которые являются более полноценными.
По консистенции среды делят на твёрдые, полужидкие и жидкие. Для культивирования и дифференциации микобактерий туберкулёза используется большое количество разнообразных по составу и консистенции питательных сред.
Питательные среды, используемые для получения культур микобактерий можно разделить на три группы:
- яичные (Левенштейна-Йенсена, Финна, Петраньяни и др.);
- агаровые (Миддлбрука 7Н10, 7Н11 и др.);
- бульонные или жидкие (Миддлбрука 7Н9, 7Н12, Дюбо, Школьниковой и др.).
Для культивирования МБТ используют различные питательные среды: жидкие, полужидкие и плотные. Жидкие и полужидкие среды используются редко, в связи с возможностью возникновения аварийных ситуаций и внутрилабораторного заражения персонала. Стандартной плотной средой, рекомендуемой ВОЗ для выделения возбудителя и определения его лекарственной чувствительности является яично-солевая среда Левенштейна-Йенсена. Она выпускается в виде порошка, который разводится, разливается в пробирки и подогреваясь, приобретает плотную консистенцию, за счет сворачивания яичного белка. Предварительно, перед сворачиванием, среда подкрашивается бриллиантовым зеленым для облегчения в последующем идентификации колоний МБТ.
Существуют другие варианты плотных яичных сред: Финна II (L-аспарагин заменен на глутамат), Аникина (без аспарагина), Гельберга (приготовленная на картофельном отваре). Однако они имеют ряд недостатков: высокая стоимость с учетом широкого распространения бактериологического исследования в противотуберкулезных учреждениях, относительно медленный рост МБТ, особенно при их пониженной жизнеспособности, что особенно часто встречается в условиях химиотерапии. Разработка новых плотных питательных сред, позволяющих ускорить выделение микобактерий, повысить интенсивность их роста, а также, что весьма важно, снизить себестоимость в условиях массового применения, является несомненно актуальной проблемой, заслуживающей серьезного внимания.
Диагноз туберкулеза у пациента подтверждается на основании лабораторного исследования при обнаружении в диагностическом МБТ при параллельных микроскопических и культуральных исследованиях. Именно поэтому исследования в микробиологических лабораториях противотуберкулезной службы, помимо микроскопии мазков из клинического материала, должны обязательно включать культуральные исследования, направленные на идентификацию кислотоустойчивых микобактерий и определение их принадлежности к виду M. tuberculosis или к другим видам нетуберкулезных микобактерий, а также определение чувствительности микобактерий к лекарственным препаратам.
Бактериологический метод является более чувствительным и достоверным, он позволяет выявить МБТ, если их содержится около 100 в 1 мл. материала. Важным преимуществом этого метода является возможность выделения возбудителя и изучение его видовой принадлежности, вирулентности, лекарственной чувствительности.
Недостатками бактериологического метода можно считать:
- сложность – выполним только в специализированной бактериологической лаборатории.
- высокую стоимость исследования.
- длительность исследования может составить 20-90 дней, в зависимости от типа роста микобактерии.
МБТ – очень требовательные гетеротрофы, нуждающиеся в глутаминовой и особенно аспарагиновой кислоте и глицерине (источнике углеводов) Стимулятором роста является лецитин, содержащийся в больших количествах в яичном желтке.
В связи с ограничением объема массовых флюорографических обследований должны проводится бактериологические исследования на туберкулез у лиц из контингентов повышенного риска заболевания туберкулезом:
- с остаточными туберкулезными изменениями.
- больных хроническими неспецифическими болезнями органов дыхания
- больных с хроническими заболеваниями мочеполовой системы (хронический пиелонефрит, цистит, простатит, мочекаменная болезнь, осложненная пиелонефритом, лица с неясными болями в поясничной области, расстройством мочеиспускания, находящиеся на гемодиализе, после пересадки почки)
- перенесшие туберкулез любой локализации и имеющих урологические жалобы с дизурией, гематурией и альбуминурией
- женщин с бесплодием и хроническими воспалительными заболеваниями гениталий
- работников из неблагоприятных по туберкулезу крупного рогатого скота хозяйств
- с гиперэргическими реакциями Манту и имеющих контакт с больным туберкулезом
- нетранспортабельных больных
- при подозрении на туберкулез легких, туберкулез лимфатических узлов, костно-суставной и туберкулез других локализаций
- бактериологическое обследование на туберкулез производятся у всех лиц при обращении в поликлинику за медицинской помощью с субфебрильной температурой неясной этиологии, грудной симптоматикой и простудными заболеваниями
- рентгенположительные лица обследуются при наличии отягощающих факторов (перенесенные тяжелые заболевания, длительное лечение кортикостероидными препаратами и др.)
Бактериологическому исследованию подвергается самый разнообразный материал: мокрота, промывные воды бронхов, желудка, экссудат, отделяемое ран, моча, ликвор, биопсийный и секционный материал и др.
Результативность бактериологического обследования зависит от правильности сбора патологического материала, хранения и его доставки, особенно от больных с бронхолегочными заболеваниями. При необходимости транспортировки патологического материала на дальние расстояния (особенно в летний период) необходимо применять консерванты, которыми должна снабжать специализированная баклаборатория. В качестве консервантов употребляют стерильные: 10% раствор трехзамещенного фосфорнокислого натрия, 10% раствор глицерина на дистиллированной воде и 2-3% раствор борной кислоты на дистиллированной воде. Патологический материал заливается в соотношении 1:1, вязкая мокрота 1:2, 1:3. В случае использования консерванта допускается более длительное хранение патологического материала (до 2-3 суток в условиях холодильника).
Материал доставляется в лабораторию в стерильной, хорошо закрытой посуде. С целью максимально гомогенизировать материал и подавить рост неспецифической гнилостной и гноеродной флоры, при отсутствии предварительной консервации, материал обрабатывается 10% трехзамещенным фосфорнокислым натрием (фосфат натрия), или 2%-6% стерильным водным раствором серной кислоты (метод Гона).
Для повышения информативности метода целесообразно исследовать патологический материал 3-кратно, в течение одной недели. Такая мера повышает чувтвительность метода на 3,4-5,8%. Рядом авторов установлено, что максимальный прирост высеваемости МБТ у вновь выявленных пациентов наблюдается при 6-кратных посевах (36-37%).
Для повышения результативности культурального метода рекомендуют посев осуществлять одновременно на две-три различные по составу питательные среды, чаще на среду Левенштейна-Йенсена и на среду Финна II. Посевы просматриваются каждые 7 дней, рост МТ появляется на 3-6 неделе. Большинство посевов дает рост МТ в течение 2-х месяцев. Однако, отдельные штаммы растут до 90 дней, поэтому необходимо инкубировать посевы до 3-х месяцев. При отсутствии роста к этому времени посев считается отрицательным.
Вирулентные культуры МБТ растут на плотных питательных средах в виде R-колоний (шероховатых) различной величины. Колонии чаще сухие, морщинистые, цвета слоновой кости, иногда с розоватым или желтоватым оттенком. Гладкие колонии (S-формы) характерны для микобактерий бычьего типа, которые в посдедние годы встречаются крайне редко. Следует помнить, что гладкие колонии с влажным ростом могут вырастать после курса проведенной химиотерапии больному туберкулезом. В виде S-форм с ярко оранжевой или желтой пигментацией растут сапрофиты и атипичные микобактерии.
Положительный ответ дают только после микроскопии мазка из выросших колоний по Цилю-Нильсену, подтверждения их кислотоустойчивости. В мазках обнаруживаются интенсивно прокрашенные красные палочки, лежащие одиночно или скоплениями, переплетаясь в виде «кос» (благодаря наличию корд-фактора), в длительно растущих культурах видны темные зерна. Далее проводится количественная оценка результатов посева. Существуют различные системы оценки. Общепринятой в РБ считается трехбалльная система.
Результаты учитывают путем ежедневного, начиная с третьего дня инкубации, сравнения сроков появления роста на питательной среде и оценки интенсивности роста колоний МБТ.
Интенсивность роста оценивалась путем подсчета колоний по 3-х бальной системе (колониеобразующие единицы – КОЕ):
- (1+) – от единичных до 20 КОЕ – «скудное» бактериовыделение, бактериоскопически микобактерии не определяются;
- (2+) – от 21 до 100 КОЕ – «умеренное» бактериовыделение,
- бактериоскопически определяются единичные микобактерии в каждом поле зрения или единичные в препарате;
- (3+) – более 100 КОЕ – «обильное» бактериовыделение, бактериоскопически определяются 10 и более микобактерий в каждом поле зрения.
источник
Палочки размножаются в лёгких, образуют там колонии, выделяются при кашле, именно поэтому исследование мокроты – важный диагностический этап. Лабораторная диагностика делается в основном микроскопическим, микробиологическим методом, бактерии культивируют на плотных средах Левенштейна-Йенсена или Финна-II, окрашивание выполняют по Цилю-Нильсену. Есть и другие технологии, но все они не идеальны, имеют свои преимущества и недостатки.
Туберкулёз легких называют ещё чахоткой, что является устаревшим названием. Возбудитель – различные представители вида Mycobacterium tuberculosis complex, которых ещё называют палочками Коха (в честь первооткрывателя). Бактерии туберкулёза поражают в основном лёгкие, где образуют многочисленные колонии. Именно поэтому можно исследовать мокроту на наличие возбудителя. Также они формируют туберкулы – полые узелки из соединительной ткани, внутри которых находится гной и масса бактерий.
Лабораторное исследование мокроты довольно редко проводится для обнаружения людей, заражённых туберкулёзом. Чаще применяется для подтверждения диагноза, анализа состояния пациента, подстройки лечения, дозировки при химиотерапии, контроля результатов терапии. То есть оценка мокроты является постоянным необходимым способом исследования.
К лабораторной диагностике относится множество методов:
- макроскопия;
- микроскопия;
- иммуноферментный анализ;
- флуоресцентная микроскопия;
- полимеразная цепная реакция;
- культивирование.
Показанием к исследованию мокроты лабораторными методами являются признаки туберкулёза:
- гипертермия;
- длительный продуктивный кашель;
- затемнения на флюорографии.
К достоинствам технологии относят следующие факты:
- результат можно получить достаточно быстро при ПЦР и микроскопии;
- установить точный штамм бактерии;
- проконтролировать влияние химиотерапии или антибиотиков.
Минусы анализа мокроты следующие:
- при скрытой форме туберкулёза бактерии не выделяются при кашле, из-за чего результат лабораторной диагностики будет отрицательным;
- мокроту довольно трудно собрать, для этого нужна специальная герметичная ёмкость;
- некоторые методы (культивирование) довольно длительные – более месяца.
Можно брать экссудат следующего рода:
- материал после ингаляции небулайзером;
- промыванием бронхов специальными растворами;
- мокрота из альвеол;
- получение слизи при бронхоскопии;
- взятие биоптата их трахеи, бронхов или плевры;
- мокрота из бронхов;
- мазки с гортани.
Мокроту собирают в плотно закрывающиеся стерильные и герметичные ёмкости. Это нужно для снижения вероятности занесения микробов в окружающий мир.
Ёмкости должны соответствовать следующим требованиям:
- делаться из ударопрочного материала;
- иметь хорошую прозрачность для возможности визуальной оценки качества и количества мокроты;
- расплавляться при температуре 40-45 градусов;
- иметь объём не меньше 40-50 мл;
- отверстие должно быть шире 3 см.
Результативность и достоверность исследования мокроты зависит от правильности её сбора, соблюдения рекомендаций, которые должны минимизировать вероятность загрязнения материала. Кроме того, откашливание производится в герметичной комнате, так как данная процедура опасна для всех окружающих.
При сборе материала нужно соблюдать ряд правил:
- откашливание мокроты во флакон делается до начала химиотерапии;
- также его проводят обязательно с утра, до завтрака и приёма препаратов;
- при исследовании берут 3 пробы (каждый раз откашливая в новую ёмкость) в течение 3 суток подряд;
- материал сразу же отвозят в лабораторию (в течение часа). В идеале она должна находиться в одном здании с туберкулёзным стационаром;
- при невозможности это сделать пробу ставят в холодильник при +4оС, но держать там можно не более 2 суток;
- крайне важно следить за целостностью ёмкостей. Нарушение герметичности приводит не только к порче пробы, но и к опасному заражению окружающей среды;
- объём одной пробы должен составлять 3-5 мл;
- медицинский работник обязательно одевает халат, шапку, медицинскую маску, резиновые перчатки и специальный фартук;
- больному нужно откашливать не слюну или слизь из носа и глотки, а именно мокроту из нижних отделов бронхов. Для создания продуктивного кашля можно сделать 2-3 глубоких вдоха;
- перед откашливанием рот тщательно промывают водой, чтобы удалить естественную микрофлору и кусочки пищи;
- ёмкость держат у самых губ, после откашливания мокроту сразу сплёвывают;
- медицинский работник стоит сзади больного, чтобы мокрота не попала на него. Его задача – контролировать правильность сбора материала;
- после сбора слизи флаконы сразу герметично запечатывают;
- если больному трудно откашливать мокроту, то накануне вечером, а также рано утром перед сбором слизи пациенту даёт отхаркивающие препараты.
Режим сбора материала для лабораторного анализа на туберкулёз легких зависит от стадии развития и лечения заболевания:
- При первом поступлении в течение 3 суток делают по 3 пробы ежедневно.
- Во время лечения ежемесячно собирают 3 пробы за раз.
- На долечивании каждые 2-3 месяца берут 2 пробы мокроты.
Исследование мокроты делается множеством способов. У каждого метода есть свои преимущества и недостатки, выбор технологии диагностики зависит от решения врача и оснащения больницы.
Характер мокроты зависит от стадии туберкулёза лёгких:
- При инфицировании на латентной стадии мокроты может не быть, или она имеется, но в минимальном количестве и обладает белым цветом или прозрачностью.
- При развитии клинической стадии мокрота приобретает выраженный гнойный характер, оттенок меняется на серый, жёлтый или зелёный, появляется неприятный запах.
- На более поздних стадиях, при появлении рецидивов в мокроте обнаруживаются прожилки крови.
Наиболее быстрый, простой и дешёвый способ оценки материала на туберкулёз легких. За счёт этого может применяться для постановки диагноза, однако он не имеет достаточно высокой надёжности, поэтому его сочетают с флюорографией. Используется для оценки состояния больного в процессе лечения.
- Прямая микроскопия. Материал готовится непосредственно из мокроты.
- Микроскопия осадка. Материал концентрируется с помощью центрифугирования.
Для 50% достоверности метода нужно минимум 5000 бактерий на мл мокроты.
Для увеличения надёжности способа исследуют минимум 3 пробы материала. Получение отрицательного результата не означает отсутствие туберкулёза, так как мокрота может содержать очень малое количество возбудителей из-за закрытой формы.
Окраска делается по Цилю-Нельсену:
- В материал вносится карболовый фуксин при повышенной температуре и протравливании фенолом, который проникает во все бактерии препарата.
- Препарат обесцвечивается 25% серной кислотой и 3% солянокислым спиртом. Из-за восково-липидной мембраны палочки Коха не подвергаются воздействию кислот, поэтому они сохраняют окраску.
- Остальные микробы подкрашиваются 0,3% метиленовой синью. Бактерии туберкулёза не восприимчивы к анилиновым краскам, из-за этого цвет у них не меняется.
В итоге палочки Коха приобретают красный цвет, а все остальные клетки – синий. Препарат надо рассматривать через световой бинокулярный иммерсионный микроскоп с тысячекратным увеличением. Для постановки диагноза обычно хватает 100 полей зрения. При отсутствии бактерий рекомендуется просмотреть ещё 200 полей.
Метод основан на реакции антигена и антитела. Антитела – специфические иммуноглобулины, которые образуются в ответ на проникновение бактерий и вирусов. Антиген – протеины, вызывающие выработку иммуноглобулинов.
- Берётся антитело, меченное каким-либо веществом. Оно добавляется в материал, где присутствует антитело. В ходе реакции образуется единый комплекс.
- Добавляется фермент, который меняет цвет меченных комплексов антиген-антитело. Интенсивность окраски материала указывает на количество иммуноглобулинов.
ВАСТЕС MGIT960 – автоматизированный прибор на 960 проб, который самостоятельно проводит исследование материала. Суть метода состоит в следующем:
- В ёмкость вносится флюоресцирующий материал, флуоресцентные свойства которого блокируются с помощью кислорода.
- Бактерии при своей жизнедеятельности поглощают кислород, уменьшают его количество.
- Из-за снижения концентрации усиливаются флуоресцентные свойства материала. Оно регистрируется в автоматическом режиме.
Первые результата регистрируются на 4-5 день, а для достижения максимума нужно 11 суток.
Люминесценция позволяет поднять результативность исследования на 10-15%, а требуемое время на это снизить в 2-3 раза. Применяют флуоресцентные краски: аурамин и родамин. Их действие связано со способностью вступать в реакцию с воскоподобными веществами бактериальной мембраны возбудителя. При облучении ультрафиолетом окрашенные таким способом палочки Коха начинают светиться оранжевым или красным цветом, при том, что остальной материал имеет чёрный или тёмно-зелёный оттенок.
Важно! Недостатком является сравнительно высокая стоимость метода.
Из-за того, что бактерии в препарате становятся очень яркими и контрастными, то можно уменьшить расширение микроскопа в 4-10 раз, сократив тем самым необходимое время на исследование материала. К тому же флуоресцентная окраска при соотнесении с окрашиванием по Цилю-Нельсену может дать информацию, сколько бактерий потеряло кислотоустойчивые свойства вследствие химиотерапии.
Метод основан на увеличении количества ДНК возбудителя в материале в 100-110 раз за счёт специальных ферментов. Данный способ применим лишь для тех микробов, у которых точно установлен состав нуклеотидной последовательности. В отличие от копирования ДНК в результате деления клеток при ПЦР создаются лишь обрывчатые короткие участки ДНК.
Метод имеет множество преимуществ:
- для положительного результата достаточно 10-100 бактерий в пробе;
- абсолютная специфичность, так как метод применяется для конкретной ДНК;
- результат становится известным через 4-5 часов.
Тем не менее, из-за высокой чувствительности метода возможны ложноположительные результаты, что является существенным минусом. Диагностика проводится с помощью амплификатора – специального прибора, в котором проходит реакция. Он создаёт условия для ПЦР и может использоваться для хранения препарата.
Для культивирования рекомендуется плотная среда. На западе используется состав Левенштейна-Йенсена, который даёт колонии через 15-25 суток. В России применяют среду Финна-II, которая уменьшает срок получения результата на 2-3 дня и увеличивает вероятность появления колонии на 6-8%. Однако при любой среде рекомендуется посев минимум 2-3 материалов. Связано это с тем, что даже при нескольких пробах нет точной гарантии достоверности результата. Установлено, что при 6 посевах вероятность обнаружения туберкулёза увеличивается на 7-8%.
Исследование мокроты при лечении туберкулёза – обязательное условие для контроля состояния пациента. Сбор слизи должен соответствовать всем требованиям, иначе будет портиться материал, появиться опасность заражения. Анализ можно проводить разными методами, каждый из которых имеет свои плюсы и минусы. При исследовании желательно сочетать сразу несколько технологий, чтобы повысить достоверность.
источник