Кашель: эпидемиология, классификация, клиническая картина
Кашель занимает второе место среди причин обращения за амбулаторной медицинской помощью [1] и первое среди симптомов, обусловленных патологией респираторной системы. Кашель как симптом характерен более чем для 50 нозологических форм [2].
Для правильной диагностики и лечения основного заболевания, ставшего причиной кашля, необходимо сформулировать синдром кашля, патогномоничный для конкретной нозологической формы. Для этого устанавливаются:
время возникновения кашля;
По длительности выделяют острый кашель (до трех недель), подострый (от трех до восьми – десяти недель) и хронический кашель (более восьми недель) (рис. 1) [1, 3, 4]. Однако такое разделение в значительной степени условно, поскольку указанные характеристики кашля не взаимоисключают друг друга.
Развившийся в результате острой респираторной вирусной инфекции (ОРВИ) кашель (первоначально определяемый как острый) в отдельных случаях может продолжаться более трех недель. Если воспалительный процесс распространяется на всю слизистую оболочку нижних дыхательных путей, наблюдается гиперпродукция бронхиальной слизи и гиперреактивность бронхов, то кашель приобретает подострое течение и классифицируется как постинфекционный [5]. Гиперпродукция вязкой бронхиальной слизи, гиперреактивность дыхательных путей приводят к значительным нарушениям мукоцилиарного клиренса, затруднениям экспекторации мокроты, мукостазу, бактериальной колонизации дыхательных путей. Часто наблюдаются лихорадка, астения, мокрота желто-зеленого цвета.
У больных хроническим бронхитом/хронической обструктивной болезнью легких (ХОБЛ) в периоды обострения на фоне ОРВИ/гриппа при правильном лечении выраженный кашель может продолжаться всего две-три недели, неоднократно рецидивируя в течение года. При этом в период ремиссии данный симптом может отсутствовать.
В то же время острый кашель может быть симптомом таких тяжелых заболеваний, как тромбоэмболия легочной артерии, отек или рак легкого. Это наиболее распространенный симптом, связанный с обострениями и неизбежной госпитализацией больных, страдающих бронхиальной астмой и ХОБЛ [3].
Хронический кашель чаще является симптомом серьезных хронических респираторных заболеваний, но может быть и единственным признаком внелегочной патологии, в частности заболеваний верхних дыхательных путей или желудочно-кишечного тракта [6].
Продуктивный кашель наблюдается при воспалительных/инфекционных поражениях нижних дыхательных путей, которым сопутствует гиперпродукция бронхиальной слизи. Продуктивный кашель, как правило, влажный, сопровождается экспекторацией мокроты – вязкой бронхиальной слизи, гноя, продуктов тканевого распада и др. В свою очередь отсутствие экспекторации мокроты – сухой кашель – может быть как следствием неэффективности продуктивного кашля, так и результатом непродуктивного кашля, например при постназальном затеке, гастроэзофагеальной рефлюксной болезни и других заболеваниях, при которых не происходит гиперпродукции мокроты.
Следует отметить, что эффективность продуктивного кашля (экспекторация мокроты) зависит от многих причин: фазы заболевания (при пневмонии продуктивный кашель в течение определенного времени остается сухим, при хроническом бронхите, бронхиальной астме нарастание бронхиальной обструкции может сопровождаться прекращением экспекторации мокроты), локализации процесса (например, при различной локализации злокачественного процесса или туберкулеза легких – в паренхиме легкого, бронхах, плевре) и др. В то же время может наблюдаться ложная продуктивность – например, при постназальном затеке у больных с ринитами и/или синуситами откашливается назальная слизь.
Среди причин неэффективности продуктивного кашля выделяют [7]:
недостаточно выраженный кашлевой рефлекс (у стариков, новорожденных и др.);
малую мощность воздушной струи во время кашлевого толчка, обусловленную ригидностью грудной клетки, малой податливостью легких или нарушениями бронхиальной проходимости;
недостаточно глубокое дыхание (продвижение секрета в бронхах пропорционально глубине дыхания).
Кроме того, в определенных ситуациях (при переломе ребер, других травматических повреждениях грудной клетки, после перенесенных хирургических вмешательств на органах грудной клетки и брюшной полости и др.) больные непроизвольно противятся кашлю (табл. 1) [8].
Следует отметить, что проблема острого кашля изучена недостаточно, равно как и возможности его медикаментозной терапии [9]. После установления причин кашля должно проводиться этиотропное и патогенетическое лечение основного заболевания. Параллельно – симптоматическое:
противокашлевое – для предотвращения, управления и/или подавления кашля;
прокашлевое – для большей эффективности кашля.
Противокашлевая терапия при остром кашле, связанном с инфекцией дыхательных путей, не показана. Неспецифическая противокашлевая терапия рекомендована только в том случае, если кашель не способствует очистке дыхательных путей и является скорее симптоматическим. Применяется преимущественно в случаях безуспешной специфической терапии, например при неоперабельном раке легкого [10, 11].
Прокашлевая терапия патогенетически обоснована, если кашель выполняет защитную функцию и его необходимо стимулировать – при бронхитах, пневмонии и др.
В настоящее время известно большое количество лекарственных средств, которые, воздействуя на вязкость, эластичность и адгезивность бронхиальной слизи, облегчают ее экспекторацию. Эти препараты получили название мукоактивных. Одни мукоактивные препараты применяются уже не одно столетие (их относят к средствам народной медицины), другие – специально синтезированные – стали широко применяться только с середины XX в. В зависимости от преобладающего механизма действия выделяют четыре класса мукоактивных препаратов: отхаркивающие (экспекторанты), мукорегуляторы, муколитики и мукокинетики (табл. 2) [12].
Это деление в некоторой степени условно, поскольку и мукокинетик амброксол и мукорегулятор карбоцистеин обладают способностью расщеплять межмолекулярные связи мукополисахаридов бронхиальной слизи, а муколитик ацетилцистеин – антиадгезивными свойствами. В то же время врачи должны знать особенности механизмов действия наиболее часто и успешно применяемых лекарственных средств – амброксола, карбоцистеина, ацетилцистеина и эрдостеина, чтобы осознанно делать выбор в каждом конкретном случае.
Далее рассмотрим подробно препараты, наиболее часто применяемые при лечении острого кашля при ОРВИ, остром бронхите, пневмонии и др.
Карбоцистеин (Бронкатар, Флюдитек и др.), лизиновая соль карбоцистеина (Флуифорт) обладают прежде всего мукорегулирующим эффектом (табл. 2). Механизм их действия связан с активацией сиаловой трансферазы – фермента бокаловидных клеток слизистой оболочки бронхов. Карбоцистеин уменьшает количество нейтральных гликопептидов и увеличивает количество гидроксисиалогликопептидов. В результате нормализуется вязкость и эластичность слизи. Под действием препарата происходят регенерация слизистой оболочки, восстановление ее структуры, уменьшается (нормализуется) количество бокаловидных клеток, особенно в терминальных бронхиолах, а значит, и количество вырабатываемой слизи. Кроме того, восстанавливается секреция IgA (специфическая защита) и число сульфгидрильных групп (неспецифическая защита), улучшается мукоцилиарный клиренс (потенцируется деятельность реснитчатых клеток). Противовоспалительный эффект характерен для всех препаратов тиоэфирной группы, воздействующих на активные формы кислорода [13]. При риновирусных инфекциях карбоцистеин подавляет воспалительный процесс в слизистой оболочке дыхательных путей путем снижения продукции цитокинов [14].
В среднем к третьему дню приема карбоцистеина увеличивается объем мокроты, в последующие два-три дня она становится менее вязкой и легче откашливается. Хороший и стабильный муколитический эффект отмечается к седьмым – девятым суткам лечения.
Добавление лизина к молекуле карбоцистеина способствовало повышению эффективности лечения. Так, при ОРВИ уже через четыре дня возможно прекращение приема препарата. При этом активность мукоцилиарного клиренса и нормальная вязкость бронхиальной слизи сохраняются еще в течение восьми дней [15].
Карбоцистеин одинаково эффективен во всех отделах дыхательных путей и среднего уха, имеющих сходное строение эпителия и реснитчатые клетки. Ввиду противовоспалительного, мукорегенераторного, муколитического действия карбоцистеин может быть показан при острых ринитах, риносинуситах, трахеитах.
Карбоцистеин эффективен только in vivo, поэтому его препараты выпускаются в виде таблеток, капсул, сиропа. В виде сиропа применяется у детей с пяти лет.
Бромгексин – синтетическое производное алкалоида вазицина. Является пролекарством, так как в печени превращается в активный метаболит – амброксол. Действие препарата начинается через 24–48 часов после приема. Особенностями бромгексина являются его самостоятельное противокашлевое действие и способность провоцировать бронхиальную обструкцию. Последнее отмечается при использовании эффективных доз (8–16 мг), что ограничивает прием препарата. Именно поэтому бромгексин рекомендуется применять только в составе комбинированных препаратов (Бромгексин 8, Бронхосан, Аскорил и др.) [10].
Амброксол (Лазолван, Амбробене, Халиксол и др.) уменьшает вязкость секрета бронхиальных желез, оказывает муколитическое (секретолитическое) и отхаркивающее действие, что связано с деполимеризацией и разрушением кислых мукопротеинов и мукополисахаридов мокроты (табл. 2). Кроме того, амброксол стимулирует выработку нейтральных полисахаридов и, воздействуя на бронхиальные железы, вызывает высвобождение лизосомальных ферментов. Однако наиболее важной является способность препарата стимулировать альвеолярными пневмоцитами второго порядка и клетками Клара синтез сурфактанта и двигательную активность ресничек мерцательного эпителия, что приводит к восстановлению мукоцилиарного клиренса. Кроме того, препарат активизирует образование трахеобронхиального секрета пониженной вязкости через изменение химизма мукополисахаридов мокроты. В результате разжижается вязкая бронхиальная слизь, уменьшается ее адгезивность и облегчается ее продвижение по дыхательным путям [16].
Амброксол в большей степени, чем бромгексин, способствует повышению синтеза, секреции сурфактанта и предотвращению его распада. Это делает амброксол необходимым у больных, находящихся на длительной ингаляционной терапии, в частности оксигенотерапии (при которой разрушается сурфактант), или искусственной вентиляции легких. Таким образом, амброксол опосредованно повышает мукоцилиарный транспорт (уменьшая адгезию бронхиальной слизи), что в сочетании с усилением секреции гликопротеинов (мукорегуляторное действие) обусловливает выраженный отхаркивающий эффект. Препарат достоверно влияет на вязкость мокроты, ее гнойность и проходимость [17]. Амброксол одинаково эффективен и в условиях in vivo, и в условиях in vitro, что позволяет назначать его перорально, парентерально и ингаляционно. Этим объясняется большое разнообразие лекарственных форм: таблетки, растворы для приема внутрь и ингаляций, капсулы ретард для приема один раз в день, ампулы для инъекций и ингаляций. Препарат начинает действовать через 36–72 часа. В случае необходимости быстрого разжижения чрезмерно вязкой мокроты одновременно с пероральным возможно ингаляционное введение препарата [17].
Препарат показан и при ОРВИ, и для профилактики обострений хронических заболеваний, например, бронхиальной астмы, ХОБЛ. Амброксол проникает через плацентарный барьер и выделяется с грудным молоком, поэтому он не рекомендуется к применению в первом триместре беременности и при кормлении грудью [18].
N-ацетил-L-цистеин (Флуимуцил, АЦЦ Лонг и др.), производное L-цистеина (табл. 2), относится к группе тиолов. Содержащиеся в его молекуле реактивные тиоловые сульфгидрильные (SH) группы разрывают дисульфидные связи мукополисахаридов мокроты, оказывая прямое муколитическое действие. В результате деполимеризации макромолекул мокрота, в том числе гнойная, становится менее вязкой и адгезивной. К разжижению мокроты приводит и стимуляция деятельности мукозных клеток, секрет которых способен лизировать фибрин, кровяные сгустки, гной [10, 12].
В 1989 г. O.T. Auroma и соавт. обнаружили мощный антиоксидантный эффект N-ацетил-L-цистеина, как прямой (нейтрализация свободных радикальных групп), так и непрямой (увеличение синтеза глутатиона) [19]. Это свойство N-ацетил-L-цистеина широко используется при лечении передозировки парацетамола [20]. Кроме того, на антиоксидантном эффекте основываются противовоспалительные свойства N-ацетил-L-цистеина [21]. Кроме того, N-ацетил-L-цистеин косвенно влияет на продукцию бронхиальной слизи, оказывая мукорегуляторное действие. Однако антиоксидантный эффект препарата проявляется в дозах, значительно превышающих рекомендованные, – 1200–1800 мг.
N-ацетил-L-цистеин одинаково эффективен как в условиях in vivo, так и в условиях in vitro. Многообразие лекарственных форм (таблетки, порошок, растворы, ампулы для инъекций) позволяет варьировать пути введения препарата и индивидуализировать терапию. Средняя суточная доза – 600 мг. Препарат начинает действовать через 30–90 минут. Следует отметить, что пероральный прием N-ацетил-L-цистеина может инактивировать действие антибиотиков, поэтому между приемами препаратов должно пройти не менее двух часов [16].
Необходимо также учитывать, что ингаляции N-ацетил-L-цистеином могут вызвать бронхиальную обструкцию при бронхиальной астме. К редким нежелательным явлениям относятся нерезко выраженные диспепсические расстройства. Прием препарата при сухом непродуктивном кашле скорее неоправдан, поскольку способствует усилению тяжелого надсадного кашля. С осторожностью N-ацетил-L-цистеин следует назначать больным с пониженным кашлевым рефлексом во избежание «затопления» легких из-за чрезмерного уменьшения вязкости и эластичности бронхиальной слизи (лицам старших возрастных групп, детям) [10].
Эрдостеин (Эрдомед) был синтезирован в 1990-е гг. Химическая структура – N-(карбокси-метил-тиоацетил) гомоцистеин тиолактон. Является пролекарством. Имеет две блокированные тиоловые группы. При первичном прохождении через печень метаболизируется с образованием как минимум трех активных метаболитов, главную роль из которых играет N-тиодигликолил-гомоцистеин (метаболит 1) (рис. 2).
Эрдостеин обладает муколитическим, антиоксидантным, противовоспалительным, антиадгезивным и мукорегуляторным действием [22].
Тиоловые группы метаболита разрывают дисульфидные мостики, которые связывают волокна гликопротеинов, что приводит к уменьшению эластичности и вязкости бронхиальной слизи. Эрдостеин усиливает и ускоряет освобождение дыхательных путей от секрета, улучшает секреторную функцию эпителия и увеличивает эффективность мукоцилиарного клиренса в верхних и нижних отделах дыхательных путей [12].
Благодаря наличию сульфгидрильных групп эрдостеин оказывает выраженное антиоксидантное действие, как прямое, так и непрямое. Прямой антиоксидантный эффект заключается в снижении продукции активных форм кислорода, таких как гипохлорная кислота, гидроген пероксид, супероксид анион и пероксинитрит [23]. Непрямой эффект подразумевает предотвращение тканевого повреждения в результате воздействия продуктов окислительного стресса [24], увеличивает уровень глутатиона в жидкости бронхоальвеолярного лаважа [25] и печени, повышает активность альфа-1-антитрипсина в легких курильщиков [26]. Антиоксидантный эффект, как прямой, так и непрямой, наблюдается при приеме средней терапевтической дозы. Выраженный антиоксидантный эффект эрдостеина позволяет рекомендовать его пациентам с хроническими бронхолегочными заболеваниями, а также активным и пассивным курильщикам.
Противовоспалительное действие эрдостеина заключается в снижении уровеня маркеров воспаления (альбумина, IgG, дезоксирибонуклеиновой кислоты) и повышении уровня противовоспалительных медиаторов (IgA, лактоферрина, лизоцима) [27].
Антиадгезивное действие эрдостеина заключается в снижении бактериальной адгезии к клеткам организма хозяина [28]. Препарат блокирует микрофиламенты и микрофимбрии бактерий: посредством своих тиоловых (SH) групп разрушает белок (пилин) в микрофимбриях бактерий. В результате адгезия бактерии к клетке организма хозяина становится невозможной.
Кроме того, эрдостеин увеличивает концентрации антибиотиков (амоксициллина, ципрофлоксацина) в бронхиальной слизи, обеспечивая эффект последействия, усиливает антиадгезивный эффект кларитромицина и других антибиотиков и увеличивает период последействия антибиотика до восьми часов. При этом препарат повышает концентрацию антибиотика в мокроте, не уменьшая сывороточные концентрации [29].
Таким образом, препарат потенцирует действие антибиотиков при респираторных инфекциях, а также применяется при вирусном генезе заболевания, предупреждая их назначение.
Помимо муколитического действия, характерного для тиолов, эрдостеин усиливает мукорегуляторное действие эпителия дыхательных путей и стимулирует их моторную функцию. Вследствие прямого влияния на функциональное состояние реснитчатого эпителия дыхательных путей повышает эффективность мукоцилиарного клиренса (мукокинетическое действие). При этом препарат обладает умеренным противокашлевым действием.
Эрдостеин быстро абсорбируется в желудочно-кишечном тракте и метаболизируется в печени до трех активных метаболитов. Период полувыведения – более пяти часов. Прием пищи не влияет на фармакокинетические параметры. Максимальная концентрация – 3,46 мкг/мл, время до достижения максимальной концентрации – 1,48 часа, площадь под кривой «концентрация – время» от 0 до 24 часов – 12,09. 64,5% эрдостеина связывается с белками плазмы крови. Препарат выводится в виде неорганических сульфатов через почки и кишечник [16].
Назначается взрослым с 18 лет. Применяется перорально (капсулы 300 мг № 20 и гранулы для приготовления суспензии 35 мг/мл).
Применение препарата показано при развитии кашля с трудноотделяемой мокротой при ОРВИ, остром бронхите, пневмонии, для профилактики пневмонии и частичного ателектаза после хирургических вмешательств. Клинические эффекты (снижение частоты и выраженности кашля, положительная динамика аускультативных данных: жесткое дыхание и хрипы) наблюдаются уже к окончанию первых суток приема препарата [30]. У пациентов с обострением хронического бронхита на фоне терапии эрдостеином было достигнуто значительное разжижение бронхиальной слизи и хорошая экспекторация ее ко второму дню терапии [31].
Обратите внимание: в отличие от других вышеописанных мукоактивных препаратов эрдостеин хорошо переносится при сухом непродуктивном кашле, характерном для большинства ОРВИ. Это обусловлено прежде всего противокашлевым эффектом препарата [12].
Немаловажную роль играет и непрямой антиоксидантный эффект препарата – повышение уровня глутатиона в печени – в связи с широко распространенным приемом парацетамола при ОРВИ. Повышение уровня глутатиона препятствует развитию печеночной недостаточности при абсолютной или относительной передозировке парацетамола.
Эффективность эрдостеина в комплексной терапии обострений ХОБЛ показана в нескольких рандомизированных плацебоконтролируемых исследованиях. Так, в международном мультицентровом рандомизированном плацебоконтролируемом двойном слепом исследовании в параллельных группах был отмечен синергизм эрдостеина с амоксициллином у пациентов с инфекционным обострением ХОБЛ [32]. Контролируемое рандомизированное исследование EQUALIFE подтвердило эффективность эрдостеина при лечении больных ХОБЛ – количество обострений уменьшилось на 32%, госпитализаций – на 44%, объем форсированного выдоха за первую секунду вырос на 14% [33].
Препарат не оказывает повреждающего воздействия на желудочно-кишечный тракт. Возможна кумуляция метаболитов при почечной недостаточности. Противопоказан при нарушении функции печени, почечной недостаточности, гомоцистеинурии, фенилкетонурии. Прием препарата в период беременности и лактации возможен только по очень строгим показаниям.
Эрдостеин – новый эффективный мукоактивный препарат с выраженной антиадгезивной активностью. Эрдостеин потенцирует действие антибиотиков при респираторных инфекциях, а также применяется при вирусном генезе заболевания во избежание их назначения. Эрдостеин назначается с целью более раннего и стойкого регресса респираторных симптомов и снижения риска бактериальных осложнений пациентам в группе риска (пожилые, иммунокомпрометированные, активные и пассивные курильщики), а также в следующих случаях:
при кашле с трудноотделяемой мокротой;
патологии желудка и двенадцатиперстной кишки;
борьбе с зависимостью от табака и отказе от курения.
источник
Болезни органов дыхания являются одной из наиболее важных проблем в педиатрии, поскольку до настоящего времени, несмотря на достигнутые успехи, по данным официальной статистики, они занимают одно из первых мест в структуре детской заболеваемости. Одним из основных факторов патогенеза респираторных заболеваний является нарушение механизма мукоцилиарного транспорта, что связано чаще всего с избыточным образованием и/или повышением вязкости бронхиального секрета. Застой бронхиального содержимого приводит к нарушению вентиляционно-респираторной функции легких, а неизбежное инфицирование — к развитию эндобронхиального или бронхолегочного воспаления. Кроме того, у больных с острыми и хроническими болезнями органов дыхания продуцируемый вязкий секрет, помимо угнетения цилиарной активности, может вызвать бронхиальную обструкцию вследствие скопления слизи в дыхательных путях. В тяжелых случаях вентиляционные нарушения сопровождаются развитием ателектазов.
Следовательно, мукоцилиарный транспорт является важнейшим механизмом, обеспечивающим санацию дыхательных путей, одним из основных механизмов системы местной защиты органов дыхания и обеспечивает необходимый потенциал барьерной, иммунной и очистительной функций респираторного тракта. Очищение дыхательных путей от чужеродных частиц и микроорганизмов происходит благодаря оседанию их на слизистых оболочках и последующему выведению вместе с трахеобронхиальной слизью, которая в нормальных условиях обладает бактерицидным эффектом, т.к. содержит иммуноглобулины и неспецифические факторы защиты (лизоцим, трансферрин, опсонины и др.). Повышение вязкости слизи не только нарушает дренажную функцию бронхов, но и снижает местную защиту дыхательных путей. Было показано, что при увеличении вязкости секрета в нем снижается содержание секреторного Ig А и других иммуноглобулинов.
Таким образом, для воспалительных заболеваний респираторного тракта характерно изменение реологических свойств мокроты, гиперпродукция вязкого секрета и снижение мукоцилиарного транспорта (клиренса). Как следствие, развивается кашель, физиологическая роль которого состоит в очищении дыхательных путей от инородных веществ, попавших извне (как инфекционного, так и неинфекционного генеза) или образованных эндогенно. Следовательно, кашель — это защитный рефлекс, направленный на восстановление проходимости дыхательных путей. Однако защитную функцию кашель может выполнять только при определенных реологических свойствах мокроты.
Лечение кашля у детей следует начинать с устранения его причины, следовательно, эффективность терапии прежде всего зависит от правильно и своевременно установленного диагноза заболевания. Однако необходимость лечения собственно кашля, то есть назначения так называемой противокашлевой терапии возникает только тогда, когда он нарушает самочувствие и состояние больного (например, при непродуктивном, сухом, навязчивом кашле). Особенностью этого кашля является отсутствие эвакуации скопившегося в дыхательных путях секрета, при этом не происходит освобождения рецепторов слизистой респираторного тракта от раздражающего воздействия, например, при ирритативном, инфекционном или аллергическом воспалении.
Очевидно, что у детей необходимость в подавлении кашля с использованием истинных противокашлевых препаратов возникает крайне редко, применение их, как правило, с патофизиологических позиций неоправданно. К противокашлевыми препаратам относят лекарственные средства как центрального действия (наркотические — кодеин, дионин, морфин и ненаркотические -глауцин, окселадин, бутамират), так и периферического действия (преноксдиазин).
Следует подчеркнуть, что у детей, особенно раннего возраста, непродуктивный кашель чаще обусловлен повышенной вязкостью бронхиального секрета, нарушением «скольжения» мокроты по бронхиальному дереву, недостаточной активностью мерцательного эпителия бронхов и сокращения бронхиол. Поэтому целью назначения противокашлевой терапии в подобных случаях является прежде всего разжижение мокроты, снижение ее адгезивных свойств и усиление тем самым эффективности кашля, то есть усиление кашля при условии перевода его из сухого, непродуктивного во влажный, продуктивный.
Лекарственные препараты, улучшающие откашливание мокроты, можно разделить на средства, стимулирующие отхаркивание, и муколитические (или секретолитические) [1-3]. По составу они могут быть как природного происхождения, так и полученными синтетическим путем. Отхаркивающие препараты увеличивают бронхиальную секрецию, разжижают мокроту и облегчают отхаркивание. Муколитические препараты (ацетилцистеин, бромгексин, амброксол, карбоцистеин, и др.) эффективно разжижают мокроту, не увеличивая существенно ее количество.
Весьма эффективно увеличивает водную часть бронхиального секрета обильное питье, наилучшими являются щелочные минеральные воды. Эффективным у детей может оказаться обильное питье минеральной воды типа «Боржоми», особенно в сочетании со щелочными ингаляциями. При наличии респираторного заболевания полезно и увлажнение окружающего воздуха, особенно в зимний период в помещении с батареями центрального отопления.
Средства, стимулирующие отхаркивание, предназначены для увеличения объема бронхиального секрета. К этой группе относятся препараты растительного происхождения (термопсис, алтей, солодка и др.) и препараты резорбтивного действия (натрия гидрокарбонат, йодиды и др.). Использование отхаркивающих средств рефлекторного действия наиболее эффективно при острых воспалительных процессах в дыхательных путях, когда еще нет выраженных изменений в бокаловидных клетках и мерцательном эпителии, при наличии сухого малопродуктивного кашля. Весьма эффективно их сочетание с муколитиками. Однако препараты данной группы не рекомендуется сочетать с антигистаминными и седативными средствами, а также применять у детей с бронхообструктивным синдромом.
Известно, что средства, стимулирующие отхаркивание (преимущественно фитопрепараты), достаточно часто используются при лечении кашля у детей. Однако это не всегда оправдано. Во-первых, действие этих препаратов непродолжительно, необходимы частые приемы малых доз (каждые 2-3 ч). Во-вторых, повышение разовой дозы вызывает тошноту и в ряде случаев рвоту. Так, препараты ипекакуаны способствуют значительному увеличению объема бронхиального секрета, усиливают или вызывают рвотный рефлекс. Усиливает рвотный и кашлевой рефлексы трава термопсиса. Анис, солодка и душица обладают хорошо выраженным слабительным эффектом и не рекомендуются при наличии у больного ребенка диареи. Ментол вызывает спазм голосовой щели, приводящий к острой асфиксии. В-третьих, лекарственные средства этой группы могут значительно увеличить объем бронхиального секрета, который маленькие дети не в состоянии самостоятельно откашлять, что приводит к так называемому «синдрому заболачивания», значительному нарушению дренажной функции легких и реинфицированию.
По мнению профессора В.К. Таточенко, отхаркивающие фитосредства имеют сомнительную эффективность и у маленьких детей могут вызывать рвоту, а также аллергические реакции (вплоть до анафилаксии). Таким образом, их назначение, скорее, традиция, чем необходимость. Следует также отметить, что растительное происхождение лекарственного средства еще не означает его полной безопасности для ребенка: успех фитотерапии зависит от качества сырья и технологии его переработки.
Муколитические (или секретолитические) препараты в подавляющем большинстве случаев являются оптимальными при лечении болезней органов дыхания у детей. К муколитикам относятся производные цистеина: N-ацетилцистеин (АЦЦ, флуимуцил, Н-АЦ-ратиофарм), карбоцистеин; производные бензиламина: бромгексин, амброксол, а также дорназе, протеолитические ферменты (дезоксирибонуклеаза) и др. Необходимо отметить, что упоминание протеолитических ферментов имеет, скорее, историческое значение, в настоящее время они не используются, т.к. могут спровоцировать бронхоспазм, кровохарканье, аллергические реакции. Исключение составляет рекомбинантная а-ДНК-аза (дорназе), которую в последние годы назначают больным с муковисцидозом.
Муколитические препараты воздействуют на гель-фазу бронхиального секрета и эффективно разжижают мокроту, не увеличивая существенно ее количество. Некоторые из препаратов этой группы имеют несколько лекарственных форм, обеспечивающих различные способы доставки лекарственного вещества (оральный, ингаляционный, эндобронхиальный и др.), что чрезвычайно важно в комплексной терапии болезней органов дыхания у детей.
Общепринятым при выборе муколитической терапии является характер поражения респираторного тракта. Муколитики могут быть широко использованы в педиатрии при лечении заболеваний нижних дыхательных путей, как острых (трахеиты, бронхиты, пневмонии), так и хронических (хронический бронхит, бронхиальная астма, врожденные и наследственные бронхолегочные заболевания, в том числе муковисцидоз). Назначение муколитиков показано и при болезнях ЛОР-органов, сопровождающихся выделением слизистого и слизисто-гнойного секрета (риниты, синуситы).
В то же время механизм действия муколитиков отличен, поэтому они обладают разной эффективностью.
Ацетилцистеин (АЦЦ и др.) является одним из наиболее активных и часто используемых муколитических препаратов. Механизм действия его основан на эффекте разрыва дисульфидных связей кислых мукополисахаридов мокроты. Это приводит к деполяризации мукопротеинов, способствует уменьшению вязкости слизи, ее разжижению и облегчению выведения из бронхиальных путей, существенно не увеличивая объема мокроты. Освобождение бронхиальных путей, восстанавливая нормальные параметры мукоцилиарного клиренса, способствует уменьшению воспаления в слизистой бронхов. Муколитический эффект ацетилцистеина выраженный и быстрый, препарат хорошо разжижает вязкую густую мокроту, облегчает ее отхождение с кашлем. Причем ацетилцистеин активен в отношении любого вида мокроты, в т.ч. и гнойной, так как в отличие от других муколитиков обладает способностью разжижать гной.
Эффективность ацетилцистеина в отношении любого вида мокроты особенно важна при бактериальных инфекциях, когда следует быстро уменьшить вязкость мокроты с гнойными включениями, чтобы дать возможность эвакуировать ее из дыхательных путей и предотвратить распространение инфекции. Кроме того, ацетилцистеин тормозит полимеризацию мукопротеидов, снижает вязкость, адгезивность, тем самым оптимизирует функцию мукоцилиарного транспорта и уменьшает степень повреждения бронхиального эпителия.
Ацетилцистеин обладает способностью ингибировать адгезию бактерий на эпителии верхних дыхательных путей, достоверно уменьшая частоту инфекционных осложнений ОРВИ у детей, т.к. снижает колонизацию бактериями и вирусами слизистых оболочек, тем самым предотвращая их инфицирование. Препарат также стимулирует синтез секрета мукозных клеток, лизирующих фибрин и кровяные сгустки, что, безусловно, повышает его эффективность при инфекционном воспалении в дыхательных путях.
Высокая эффективность ацетилцистеина обусловлена его уникальным тройным действием: муколитическим, антиоксидантным и антитоксическим. Антиоксидантное действие связано с наличием у ацетилцистеина нуклеофильной тиоловой SH-группы, которая легко отдает водород, нейтрализуя окислительные радикалы. Препарат способствует синтезу глутатиона — главной антиокислительной системы организма, что повышает защиту клеток от повреждающего воздействия свободнорадикального окисления, свойственного интенсивной воспалительной реакции. Как результат, уменьшается воспаление бронхов, выраженность клинических симптомов, повышается эффективность лечения воспалительных заболеваний бронхолегочной системы. С другой стороны, прямое антиоксидантное действие ацетилцистеина оказывает существенный протективный эффект в отношении агрессивных агентов, поступающих в организм с дыханием: табачного дыма, городского смога, токсических дымов и прочих загрязнителей воздуха. Антиоксидантные свойства ацетилцистеина обеспечивают дополнительную защиту органов дыхания от повреждающего воздействия свободных радикалов, эндо- и экзотоксинов, образующихся при воспалительных заболеваниях респираторного тракта.
Ацетилцистеин обладает выраженной неспецифической антитоксической активностью — препарат эффективен при отравлении различными органическими и неорганическими соединениями. Детоксикационные свойства ацетилцистеина используются при лечении отравлений. Ацетилцистеин — основной антидот при передозировке парацетамола. I. Ziment описал предотвращение повреждений печени не только при передозировке парацетамола, но и при геморрагических циститах, вызванных алкилирующими веществами (в частности, циклофосфамидом).
Имеются литературные данные о иммуномодулирующих [Droge W.] и антимутагенных [De Flora S.] свойствах ацетилцистеина, а также результаты пока еще немногочисленных экспериментов, свидетельствующих о его противоопухолевой активности [Остроумова М.Н. и соавт.]. В этой связи высказываются предположения, что ацетилцистеин представляется наиболее перспективным при лечении не только острых и хронических бронхолегочных заболеваний, но также для предупреждения неблагоприятных воздействий ксенобиотиков, промышленной пыли, курения [Moldeus P.]. Отмечают, что потенциально важными являются свойства ацетилцистеина, связанные с его способностью влиять на некоторые метаболические процессы, включая утилизацию глюкозы [Ammon H.P.], перекисное окисление липидов [Van Surell C.] и стимулировать фагоцитоз [Ohman J.].
Ацетилцистеин оказывается эффективным при приеме внутрь, парентерально, при эндобронхиальном и при сочетанном введении. Действие препарата начинается через 30-60 мин. и продолжается в течение 4-6 ч. Очевидно, что использование ацетилцистеина показано в первую очередь в случаях непродуктивного кашля, обусловленного вязкой, густой и трудноотделяемой мокротой. Особенно препарат эффективен в терапии острых респираторных заболеваний у жителей больших городов, курильщиков и др., т.е. в случае высокого риска развития осложнений или хронизации воспаления органов дыхания. В отоларингологии также широко используют выраженное муколитическое действие препарата при гнойных синуситах для улучшения оттока содержимого пазух носа.
Показанием к применению ацетилцистеина являются острые, рецидивирующие и хронические заболевания респираторного тракта, сопровождающиеся образованием вязкой мокроты. Это острые и хронические бронхиты с малопродуктивным кашлем, в т.ч. бронхиты курильщика. Применение ацетилцистеина необходимо пациентам, постоянно подвергающимся воздействию неблагоприятных факторов: работающим на вредных производствах, живущим в крупных городах, рядом с промышленными предприятиями, курильщикам. Также ацетилцистеин назначают при проведении интратрахеального наркоза с целью профилактики осложнений со стороны дыхательных путей.
Высокая безопасность ацетилцистеина связана с его составом — препарат является производным аминокислоты. Было показано, что у больных с заболеваниями дыхательных путей частота побочных эффектов, требующих прекращения терапии, не превышает таковую при приеме плацебо [4].
В литературе имеются указания, что ацетилцистеин рекомендуют с осторожностью использовать у больных бронхиальной астмой, т.к. некоторые авторы иногда отмечали усиление бронхоспазма у взрослых астматиков. Однако у детей усиление бронхоспазма при приеме ацетилцистеина не отмечено. Установлено, что бронхоспазм при применении ацетилцистеина возможен только при гиперактивности бронхов и в единичных случаях (это отмечено в инструкции). При этом бронхоспазм может иметь место в основном при ингаляционном введении препарата, что говорит не о свойствах самого ацетилцистеина, а о способе его введения. Данные многочисленных клинических исследований и наш собственный опыт свидетельствуют, что ацетилцистеин успешно применяется при лечении бронхиальной астмы.
Муколитики, в том числе и ацетилцистеин, не вызывают синдрома «заболачивания легких», поскольку эти препараты не увеличивают объем бронхиального секрета, а делают его менее вязким, тем самым улучшая эвакуацию. Исключение составляют лишь дети первых месяцев жизни: при ингаляционном введении препарата достаточно редко, но может наблюдаться увеличение объема мокроты. Не рекомендуется применение любых муколитиков в сочетании с лекарствами, угнетающими кашлевой рефлекс (кодеин, окселадин, преноксдиазин и другие): это может привести к застою в легких большого количества мокроты (феномен «заболачивания легких»). Поэтому совместное применение таких препаратов противопоказано. Особенно внимательно надо использовать препараты этого класса у детей первого года жизни, имеющих несовершенный кашлевой рефлекс, и у склонных к быстрому ухудшению мукоцилиарного клиренса. Следует отметить, что «заболачивание легких» при применении муколитиков является крайне редким явлением. Однако этот феномен может развиться при нарушении у пациента мукоцилиарного транспорта, слабом кашлевом рефлексе, при нерациональном использовании отхаркивающих препаратов.
В многолетней клинической практике, как у взрослых, так и у детей, хорошо зарекомендовал себя и широко используется препарат ацетилцистеина — АЦЦ. Показанием к его применению являются острые, рецидивирующие и хронические заболевания респираторного тракта, сопровождающиеся образованием вязкой мокроты. Это острые и хронические бронхиты с малопродуктивным кашлем, в т.ч. бронхиты курильщика. Применение АЦЦ необходимо пациентам, постоянно подвергающимся воздействию неблагоприятных факторов: работающим на вредных производствах, живущим в крупных городах, рядом с промышленными предприятиями, курильщикам. По сравнению с другими муколитиками (в т.ч. амброксолом) секретолитическое действие АЦЦ развивается быстрее, что делает выбор препарата предпочтительнее при острых респираторных инфекциях, особенно у городских жителей. Кроме того, терапевтический эффект усиливают и антиоксидантные свойства АЦЦ. Оптимальным является назначение АЦЦ и пациентам со слизисто-гнойной или гнойной мокротой.
АЦЦ можно применять у детей с 2-летнего возраста без рецепта, а у младенцев до 2 лет — только по рекомендации врача (рецептурно). АЦЦ выпускается в гранулах и шипучих таблетках для приготовления напитка, в т.ч. горячего, в дозировках 100, 200 и 600 мг и применяется 2-3 раза/сут. Дозы зависят от возраста больного. Обычно рекомендуют детям от 2 до 5 лет 100 мг препарата на прием, старше 5 лет — по 200 мг, обязательно после еды. АЦЦ 600 (Лонг) назначают 1 раз/сут., но только детям старше 12 лет. Длительность курса зависит от характера и течения заболевания и составляет при острых бронхитах и трахеобронхитах от 3 до 14 дней, при хронических заболеваниях — 2-3 недели. При необходимости курсы лечения могут быть повторены. Инъекционные формы АЦЦ могут быть использованы для внутривенного, внутримышечного, ингаляционного и эндобронхиального введения. Длительность курса зависит от характера и течения заболевания и составляет при острых бронхитах и трахеобронхитах от 3 до 14 дней, при хронических заболеваниях — 2-3 недели. При необходимости курсы лечения могут быть повторены.
Хорошо известно, что методы доставки, органолептические свойства и даже внешний вид лекарственного средства в педиатрии не менее важны, чем само лекарство. Именно от метода доставки во многом зависит эффективность препарата. Препараты ацетилцистеина для приема внутрь ранее были представлены только в форме шипучих таблеток и гранул для приготовления раствора, что не совсем подходило для лечения детей младшего возраста и поэтому ограничивало применение этих высокоэффективных муколитиков. Поэтому появление новой безрецептурной формы ацетилцистеина в наиболее востребованной в педиатрии лекарственной форме АЦЦ (гранулы для приготовления сиропа: 100 мг ацетилцистеина в расчете на 5 мл сиропа) представляет несомненный интерес.
Преимущества новой формы АЦЦ очевидны: препарат не содержит сахара и спирта, его отличают приятные органолептические свойства, имеется возможность дозирования АЦЦ для детей младше 2 лет. Практичная упаковка рассчитана на полный курс лечения.
Способ применения и дозировка АЦЦ: в лекарственной форме гранулы для приготовления сиропа. Применять после еды. Детям в возрасте менее 2 лет рекомендован прием 2-3 раза/сут. по 2,5 мл (1/2 мерной ложки), детям в возрасте 2-5 лет — 2-3 раза/сут. по 5 мл (1 мерная ложка), детям в возрасте 6-14 лет — 3-4 раза/сут. по 5 мл (1 мерная ложка).
Обсуждая вопрос рационального применения муколитиков необходимо отметить, что наиболее широкое применение в педиатрической практике имеют препараты на основе ацетилцистеина и амброксола. Сравнительные клинические исследования эффективности и безопасности муколитических препаратов свидетельствуют о бесспорном преимуществе ацетилцистеина и амброксола по сравнению с бромгексином как при острых, так и при хронических бронхолегочных заболеваниях [K.J. Weissman, P. Careddu, G. Zavattini].
Амброксол относится к муколитическим препаратам нового поколения, является метаболитом бромгексина и дает более выраженный отхаркивающий эффект. В педиатрической практике в комплексной терапии органов дыхания предпочтительнее использовать препараты амброксола, имеющие несколько лекарственных форм: таблетки, сироп, растворы для ингаляций, для приема внутрь, для инъекций и эндобронхиального введения.
Амброксол оказывает влияние на синтез бронхиального секрета, выделяемого клетками слизистой оболочки бронхов. Секрет разжижается путем расщепления кислых мукополисахаридов и дезоксирибонуклеиновых кислот, одновременно улучшается выделение секрета. Важной особенностью амброксола является его способность увеличивать содержание сурфактанта в легких, блокируя распад и усиливая синтез и секрецию сурфактанта в альвеолярных пневмоцитах 2 типа. Имеются указания на стимуляцию синтеза сурфактанта у плода, если амброксол принимает мать.
Амброксол не провоцирует бронхообструкцию. Более того, K.J. Weissman и соавт. [5]. показали статистически достоверное улучшение показателей функций внешнего дыхания у больных с бронхообструкцией и уменьшение гипоксемии на фоне приема амброксола. Сочетание амброксола с антибиотиками безусловно имеет преимущество перед использованием одного антибиотика. Амброксол способствует повышению концентрации антибиотика в альвеолах и слизистой оболочке бронхов, что улучшало течение заболевания при бактериальных инфекциях легких [6-8].
Применяют амброксол при острых и хронических болезнях органов дыхания, включая бронхиальную астму, бронхоэктатическую болезнь, респираторный дистресс-синдром у новорожденных. Можно использовать препарат у детей любого возраста, даже у недоношенных. Возможно применение у беременных женщин во 2 и 3 триместрах беременности.
При изучении эффективности амброксола и ацетилцистеина при хронических заболеваниях легких было показано некоторое преимущество амброксола, особенно при необходимости ингаляционного введения препарата, однако про остром инфекционном процессе более высокая эффективность АЦЦ была очевидна (прежде всего за счет более быстрого муколитического действия и наличия у препарата антиоксидантных и антитоксических свойств).
При каких случаях предпочтительно назначать АЦЦ детям и, в частности, АЦЦ в форме сиропа? Во-первых, если необходимо быстро добиться эффекта разжижения и соответственно выведения мокроты из дыхательных путей. Именно АЦЦ благодаря своему прямому действию на реологические свойства мокроты действует быстро и эффективно. Амброксол, обладая в основном мукорегулирующим действием, воздействует на реологические свойства мокроты в сторону уменьшения ее вязкости через более продолжительное время. Во-вторых, АЦЦ обладает способностью расщеплять гнойную мокроту, что не является свойством амброксола, а это очень важно при бактериальных инфекциях, когда необходимо достаточно быстро помочь эвакуации гнойной мокроты из дыхательных путей и предотвратить распространение инфекции. Поэтому при назначении антибиотиков при бактериальных инфекциях респираторного тракта в качестве препарата для лечения кашля рационально выбрать АЦЦ.
С целью оценить безопасность и эффективность муколитиков, в том числе с разными методами доставки, нами в течение 3 лет проводилось сравнительное исследование некоторых отхаркивающих и муколитических препаратов у детей различных возрастных групп, страдающих острыми и хроническими бронхолегочными заболеваниям [3]. Работа осуществлялась под руководством сотрудников кафедры детских болезней РГМУ на трех клинических базах г. Москвы: ДКБ № 38 ФУ МЕДБИОЭКСТРЕМ, Морозовской ГДКБ, родильного дома приГКБ№15.
Всего в исследование были включены 259 детей с острой и хронической бронхолегочной патологией в возрасте с первых дней жизни до 15 лет. Из них 92 ребенка получали ацетилцистеин-гранулят (торговое название АЦЦ-100, 200), 117 детей — амброксол в виде таблеток, сиропа, ингаляционно и инъекционно, 50 пациентов составили группу сравнения (из них 30 больным был назначен бромгексин, 20 — мукалтин). Методы введения препаратов зависели от характера респираторной патологии и возраста ребенка. Препараты использовали в обычных терапевтических дозировках, длительность терапии составила от 5 до 15 дней. Оценивали сроки появления продуктивного кашля, уменьшение его интенсивности и сроки выздоровления. Кроме того, оценивалась вязкость мокроты.
Критерием исключения из исследования являлось применение других муколитиков, отхаркивающих или противокашлевых препаратов менее чем за 14 дней до начала исследования.
В результате проведенных наблюдений было установлено, что наилучший клинический эффект у детей с острым бронхитом был получен при применении ацетилцистеина. Так, на 2-е сутки после назначения АЦЦ кашель несколько усиливался, но становился более продуктивным, на 3-й день лечения отмечалось ослабление кашля и его исчезновение на 4-5-й день применения препарата. При назначении амброксола у половины детей интенсивность кашля значительно уменьшалась на 4-е сутки терапии, на 5-6-е сутки, как правило, ребенок выздоравливал. Бромгексин в нашем исследовании продемонстрировал неплохой муколитический эффект, однако способствовал улучшению реологических свойств мокроты и уменьшению интенсивности кашля в среднем на 1-2 суток позже амброксола и на 2-3 суток позже ацетилцистеина. При назначении мукалтина кашель был достаточно выраженным 6-8 дней и выздоровление наступало к 8-10-му дню от начала заболевания. Нежелательных эффектов и побочных реакций в нашей работе выявлено не было.
Таким образом, в результате проведенного исследования было установлено, что у детей с острым бронхитом наилучший клинический эффект был достигнут при использовании АЦЦ. При назначении бромгексина и амброксола также отмечался выраженный муколитический эффект, но в более поздние, чем у ацетилцистеина, сроки от начала лечения. Наименьшей клинической эффективностью обладал мукалтин.
Одной из групп наблюдения в нашем исследовании стали больные с бронхиальной астмой (БА) в возрасте от 3 до 15 лет. В приступном периоде БА при назначении АЦЦ в комплексной терапии наилучший эффект был достигнут у детей младшей возрастной группы. В то же время назначение АЦЦ детям в постприступном периоде бронхиальной астмы при развитии бронхита, осложненного бактериальной инфекцией, безусловно, способствовало скорейшему разрешению заболевания у всех наблюдаемых пациентов. Усиления бронхообструктивного синдрома у детей с БА мы не отмечали.
В результате проведенного исследования было установлено, что у детей первых трех лет жизни, имеющих бронхолегочные заболевания, наилучший клинический эффект был достигнут при использовании ацетилцистеина. При назначении бромгексина и амброксола также отмечался выраженный муколитический эффект, но в более поздние, чем у ацетилцистеина, сроки от начала лечения. Наименьшей клинической эффективностью обладал мукалтин.
У детей старшего возраста при наличии бронхоспазма наилучший клинический эффект был получен при назначении амброксола или бромгексина в сочетании с β2-адреномиметиками. Оптимальным явилось сочетание ингаляционного и перорального приемов амброксола. Назначение ацетилцистеина не было столь эффективно в терапии бронхообструктивных заболеваний. В тоже время у детей старшей возрастной группы, страдающих респираторной патологией, протекающей без бронхообструктивного синдрома, ацетилцистеин имел наилучший клинический эффект.
При изучении эффективности амброксола и ацетилцистеина при хронических заболеваниях легких было показано некоторое преимущество амброксола, особенно при необходимости ингаляционного и/или эндобронхиального введения препарата.
Таким образом, в комплексной терапии болезней органов дыхания у детей наиболее часто используемыми являются муколитические препараты, однако их выбор должен быть строго индивидуальным и необходимо учитывать механизм фармакологического действия лекарственного средства, характер патологического процесса, преморбидный фон и возраст ребенка. Препараты ацетилцистеина и амброксола широко используются в педиатрической практике во всем мире. Опыт клинического применения ацетилцистеина при лечении детей продемонстрировал его эффективность при острых респираторных заболеваниях, а также при заболеваниях органов дыхания, сопровождающихся накоплением слизистого или слизисто-гнойного секрета в дыхательных путях. Однако в педиатрической практике, особенно у детей раннего возраста, при острых респираторных заболеваниях предпочтительнее АЦЦ в лекарственной форме гранулы для приготовления сиропа, высокая эффективность которого, хорошие органолептические свойства и удобство упаковки увеличивают комплайенс терапии. Можно рекомендовать более широко использовать АЦЦ в форме сиропа в терапии бронхолегочных заболеваний у детей.
источник
выделяемый при отхаркивании патологически измененный трахеобронхиальный секрет с примесью слюны и секрета слизистой оболочки носа и придаточных (околоносовых) пазух.
В норме трахеобронхиальный секрет состоит из слизи, вырабатываемой серозными и слизистыми железами, бокаловидными клетками слизистой оболочки трахеи и крупных бронхов, и клеточных элементов (преимущественно альвеолярных макрофагов и лимфоцитов). Так же, как слюна и носовая слизь, он обладает бактерицидными свойствами. Трахеобронхиальный секрет способствует выведению ингалированных частиц, продуктов метаболизма и клеточного детрита за счет механизма мукоцилиарного клиренса (очищения), обеспечиваемого деятельностью реснитчатого эпителия. Объем трахеобронхиального секрета в норме колеблется от 10 до 100 мл в сутки; все это количество здоровый человек обычно проглатывает.
Появление М. связано с увеличением количества и изменением состава трахеобронхиального секрета (например, при инфекционном или аллергическом воспалении слизистой оболочки бронхов, действии раздражающих факторов вдыхаемого воздуха), а также с нарушением механизмов его удаления. При воспалительных заболеваниях бронхов меняются реологические свойства трахеобронхиального секрета, что в сочетании с увеличением количества продуцируемой слизи и ослаблением функции реснитчатого эпителия ведет к застою и инфицированию слизи в бронхах.
Характер, состав и свойства мокроты. Количество М. при различных патологических процессах колеблется от нескольких миллилитров до 1—1 1 /2л в сутки.
Цвет М. определяется ее составом. Она может быть бесцветной или иметь желтоватый оттенок, особенно при примеси гноя; зеленоватый цвет свидетельствует о застое гнойной мокроты. М. ярко-желтого, так называемого канареечного цвета бывает при наличии в ней большого количества эозинофилов, например при эозинофильном инфильтрате легкого, бронхиальной астме. Ржавый цвет М. чаще наблюдается при крупозной пневмонии в связи с появлением гематина, который освобождается при распаде эритроцитов, проникших в просвет альвеол путем диапедеза. Черная М. возможна при пневмокониозах, обусловленных вдыханием содержащей частицы угля пыли. Некоторые лекарственные средства (например, рифампицин) окрашивают М. в красноватый цвет. Обычно М. не имеет запаха. Гнилостный запах она приобретает при абсцессе и гангрене легкого в результате развития гнилостной микрофлоры.
По консистенции различают жидкую, густую и вязкую мокроту, по характеру — слизистую, слизисто-гнойную, гнойную и кровянистую. Слизистая М. — бесцветная, обычно вязкой консистенции; особенно тягучей и прозрачной (стекловидной) она бывает после приступа бронхиальной астмы. Слизисто-гнойная М. образуется при многих заболеваниях бронхов и легких (в т. ч. при обструктивном бронхите, инфекционно-аллергической форме бронхиальной астмы), густая слизисто-гнойная М. может отходить при кашле в виде слепков бронхов, особенно густая и вязкая слизисто-гнойная М. выделяется при муковисцидозе. Гнойная М. наблюдается редко, например при прорыве эмпиемы плевры в просвет бронха. Кровянистая М., содержащая прожилки или сгустки крови либо алую пенистую кровь, является признаком легочного кровотечения.
В состав М., как и в состав нормального трахеобронхиального секрета, входят белки, преимущественно гликопротеины, углеводы, нуклеотиды и липиды. Большинство биохимических компонентов диффундирует из плазмы, но некоторые синтезируются в легких и бронхах, в частности сурфактант, секреторный иммуноглобулин А и муцин. Муцины с высоким содержанием сиаловых кислот во многом определяют эластические свойства М. Вода составляет 89—95% трахеобронхиальной слизи и находится большей частью в структурном комплексе с гликопротеинами. В трахеобронхиальной слизи содержатся электролиты — ионы натрия, хлора, кальция.
Иммунологические свойства трахеобронхиального секрета, а также М. определяются такими веществами, как лактотрансферрин, секретируемый клетками слизистых желез бронхов (бактерицидное действие лактотрансферрина объясняется его способностью связывать железо, необходимое для размножения микроорганизмов), лизоцим, интерферон, секреторный иммуноглобулин А.
Максимальное количество секреторного иммуноглобулина А содержится в секрете трахеи и крупных бронхов. Основное защитное действие его проявляется способностью агглютинировать бактерии, препятствовать их прилипанию к мембране эпителиальных клеток, тормозить рост и размножение бактерий. Секреторный иммуноглобулин А имеет значение и в защите организма от вирусов.
В мокроте постоянно присутствуют ингибиторы протеаз: α1-антитрипсин в свободной форме и в комплексе с протеолитическими ферментами лейкоцитов, α2-макроглобулин, антихимотрипсин, а также низкомолекулярные «ингибиторы с широким спектром антипротеазной активности. Комплекс ингибиторов протеаз трахеобронхиального секрета предотвращает действие протеолитических ферментов бактериального, лейкоцитарного и макрофагального происхождения, освобождающихся в процессе воспаления.
Гнойная М. содержит значительное количество коллагеназы, эластазы и химотрипсиноподобных ферментов, которые способствуют расщеплению белковых макромолекул, улучшению реологических свойств М. и ее выделению; однако эти ферменты при их избытке могут повреждать слизистую оболочку бронхов, паренхиму и эластические структуры легкого.
Исследование мокроты. М. собирают утром натощак в стерильную плевательницу. Перед отхаркиванием необходимо, чтобы больной прополоскал рот слабым раствором антисептического средства, затем кипяченой водой, чтобы в М. было меньше примеси слюны. При невозможности получить М. обычным путем назначают раздражающие ингаляции с изотоническим раствором хлорида натрия. Для микробиологического и цитологического исследований также могут быть использованы материалы бронхоальвеолярного смыва (см. Лаваж бронхоальвеолярный), бронхиального смыва или аспират, полученные при бронхоскопии (Бронхоскопия).
Для изучения М. в клинической практике применяют макроскопическое, микроскопическое (в т.ч. цитологическое), микробиологическое, иногда биологическое и физико-химическое исследования.
Макроскопическое исследование включает определение суточного количества, цвета, запаха, консистенции и характера М. Обращают внимание также на расслоение М. при стоянии в стеклянной посуде. Слизистая и слизисто-гнойная М. не расслаивается, гнойная разделяется на два слоя (верхний — серозный и нижний — гнойный); иногда при гнойных процессах в легких М. может разделяться на три слоя (верхний — слизисто-гнойный, пенистый; средний — серозный; нижний — гной и продукты тканевого распада).
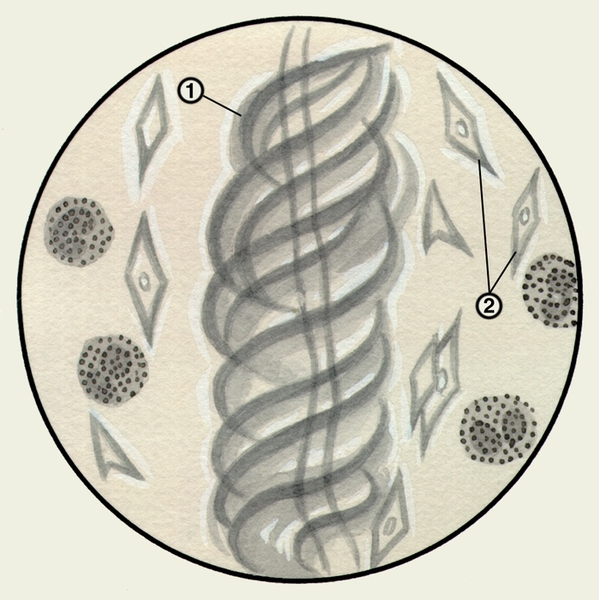
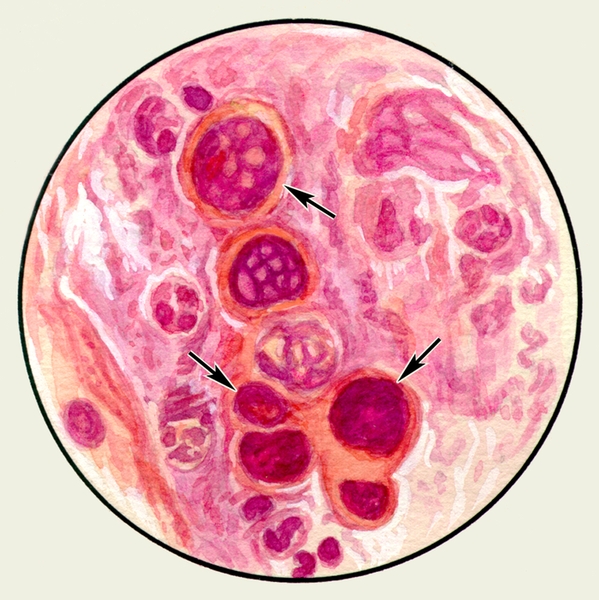
Микроскопическое исследование заключается в изучении неокрашенных (нативных) и окрашенных препаратов М. При малом увеличении микроскопа или под лупой в неокрашенных препаратах М. можно обнаружить спирали Куршманна (рис. 1) — беловатые прозрачные штопорообразные волокна, в центре которых находится извитая блестящая нить; их наличие указывает на спастическое состояние бронхов (например, при бронхиальной астме, обструктивном бронхите). При бронхиальной астме возможно выявление в М. кристаллов Шарко — Лейдена (рис. 1) — блестящих гладких бесцветных ромбов различной величины, образующихся вследствие распада эозинофилов.
При асбестозе легких (см. Пневмокониозы) иногда определяют так называемые асбестовые тела (асбестовые волокна, покрытые оболочкой из белка и гемосидерина), имеющие вид золотисто-желтых образований со вздутыми концами. Так называемые рисовидные тельца, или линзы Коха, — зеленовато-желтые, довольно плотные образования творожистой консистенции величиной от булавочной головки до небольшой горошины, характерные для деструктивных форм туберкулеза, при современных методах лечения туберкулеза встречаются в М. редко. Обнаружение большого количества эластических волокон в виде сильно преломляющих свет тонких нитей, окрашивающихся эозином в розовый цвет (рис. 2), свидетельствует о деструкции легочной ткани любой этиологии. При микроскопии М. могут быть выявлены крючья и пузыри эхинококка, выделяющиеся при свежем разрыве эхинококковой кисты легкого, а также различные микроорганизмы,
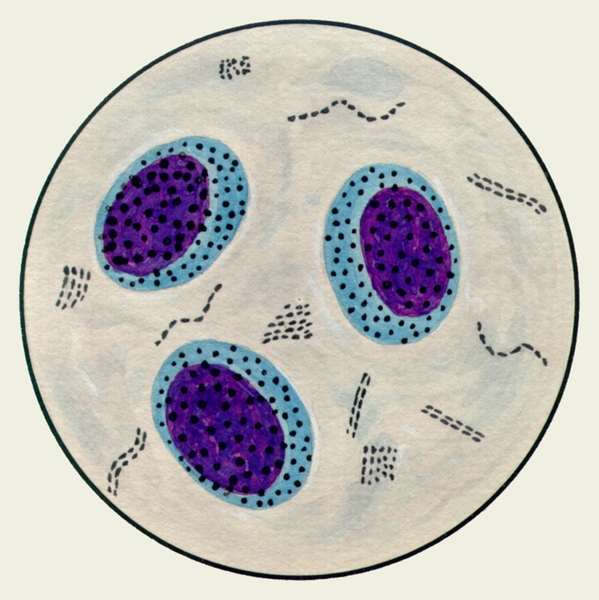
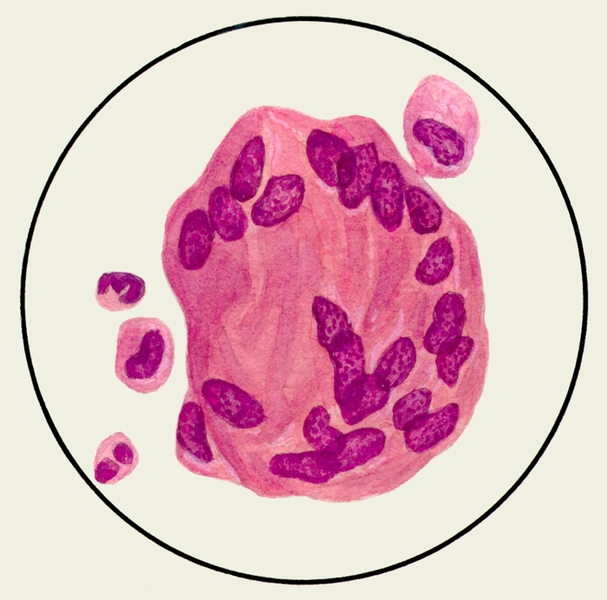
В мокроте могут обнаруживаться клетки, характерные для определенных заболеваний. Так называемые клетки сердечных пороков, или гемосидерофаги — альвеолярные макрофаги, содержащие в цитоплазме включения гемосидерина (рис. 3), встречаются при застойных явлениях в легких в связи с сердечной недостаточностью, при инфаркте легкого, идиопатическом гемосидерозе легких, кровохарканье любого генеза. Значительное количество эозинофилов в М. отмечается при бронхиальной астме. Клетки Пирогова — Лангханса (рис. 4) — многоядерные гигантские клетки (диаметром до 60 мкм) овальной или круглой формы — в М. определяются редко, они характерны для туберкулеза легких.
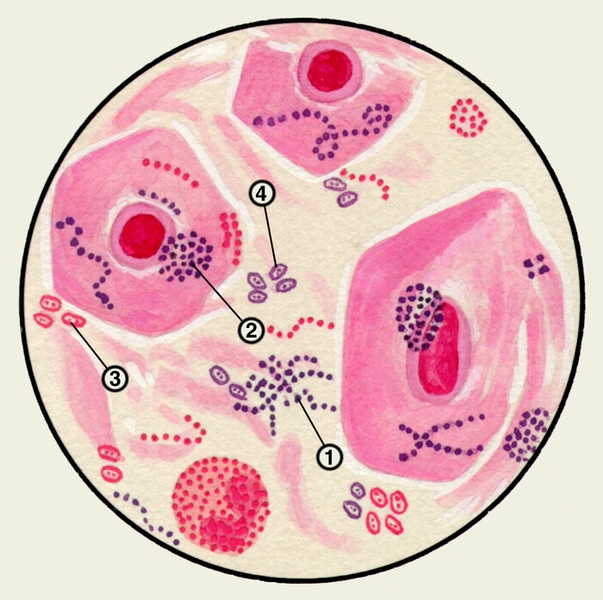
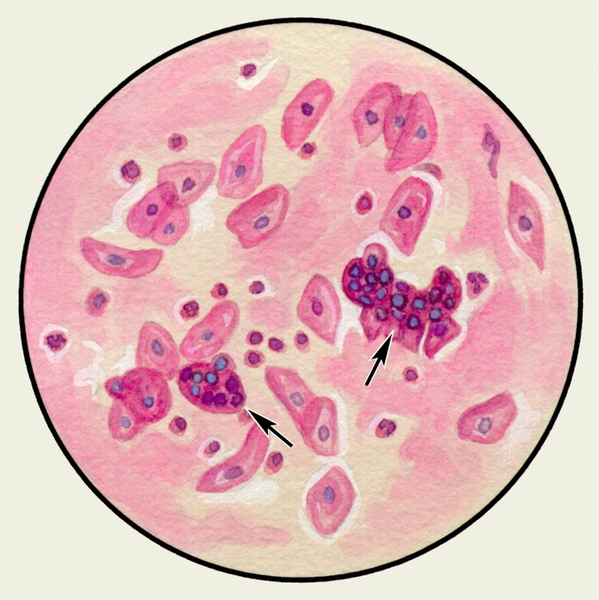
Цитологическое исследование М. с учетом соотношения ее клеточных элементов имеет значение для оценки активности заболеваний бронхов и легких, помогает установить преимущественность инфекционного или аллергического воспаления. Цитологические методы используют для диагностики бронхогенного рака легкого, особенно при профилактическом обследовании лиц, относящихся к группе повышенного риска. Обнаружение в М. опухолевых клеток (рис. 5, а, б), которые могут располагаться отдельно или образовывать большие скопления, дает возможность не только подтвердить диагноз злокачественной опухоли легких, но иногда и определить ее гистологический тип.
Микробиологическое исследование М. включает микроскопию (бактериоскопию), выделение чистых культур, определение чувствительности микрофлоры к различным лекарственным средствам и некоторые другие методы. Из трахеобронхиального секрета наиболее часто выделяют следующие микроорганизмы: патогенные — Streptococcus pneumoniae, Haemophilus influenzae; условно-патогенные — неклостридиальные анаэробы, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus hemolyticus, Klebsiella pneumoniae, Escherischia coli, Pseudomonas aeruginosa, Proteus, Candida, Streptococcus viridans, Streptococcus anhemolyticus, Neisseria catarrhalis.
В окрашенных и неокрашенных препаратах М. можно обнаружить дрожжеподобные грибки Candida в виде почкующихся клеток и нитей псевдомицелия, что, однако, не является достаточным основанием для диагноза кандидоза легких; выявление друз актиномицетов, окутанных гнойной массой, имеет диагностическое значение.
Бактериоскопия особенно важна для выявления микобактерий туберкулеза, которые при использовании метода Циля — Нельсена окрашиваются фуксином в красный цвет. Исследование окрашенного мазка М., подготовленного обычным способом, дает положительный результат при содержании более 100 000 микобактерий туберкулеза в 1 мл мокроты. В связи с этим при отрицательных результатах в случае подозрения на туберкулез прибегают к методам концентрации. Метод флотации дает возможность определить наличие микобактерий туберкулеза при их концентрации около 50 000 в 1 мл мокроты. 10—15 мл мокроты, собранной за 1—2 сут., гомогенизируют, встряхивая в течение 5—10 мин с равным объемом 0,5% раствора едкого натра, затем добавляют 100 мл дистиллированной воды и 0,5 мл бензина и снова встряхивают 5—10 мин. Примерно через 30 мин на поверхности образуется флотационное кольцо, состоящее из капелек бензина, содержащих микобактерии туберкулеза. Из материала флотационного кольца готовят препараты, которые исследуют методами световой и люминесцентной микроскопии (см. Микроскопические методы исследования).
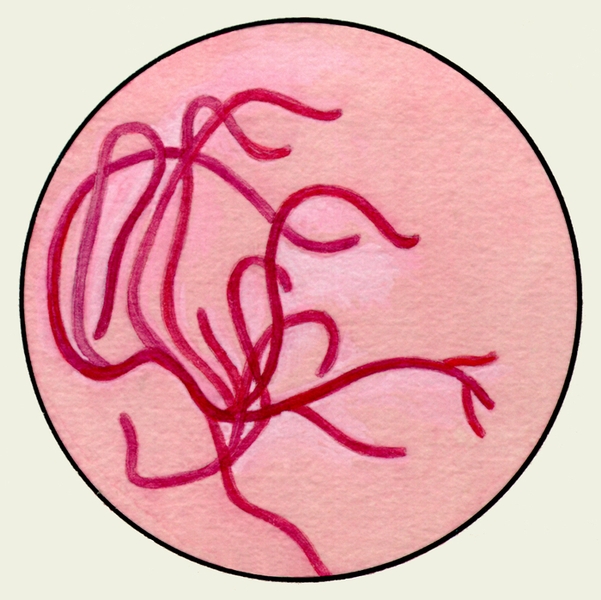
В мокроте, окрашенной по Граму, при микроскопии можно выявить стрептококки, образующие цепочки, стафилококки, часто соединяющиеся в виде гроздей винограда, диплобактерии Фридлендера, пневмококки (рис. 6). Бактериоскопическое исследование М. для установления причины неспецифических заболеваний бронхов и легких имеет, как правило, ориентировочное значение.
Для выявления возбудителей неспецифических воспалительных заболеваний бронхов и легких проводят посев мокроты и смывов из бронхов на соответствующие Питательные среды. Выросшие микробы идентифицируют (см. Микробиологическая диагностика) и определяют их чувствительность к антибактериальным препаратам. С целью установления роли выделенного из мокроты микроорганизма используют методы определения их количества, а также реакцию непрямой иммунофлюоресценции выделенной культуры с сывороткой больного.
Основными условиями эффективности микробиологических исследований являются получение патологического материала до начала антибактериального лечения, исследование его в ближайшие часы после получения, а также правильный выбор необходимых для данного случая технических приемов обработки. Динамическое изучение микрофлоры дает возможность проследить смену возбудителя. Наибольшее диагностическое значение имеет обнаружение при двух — трех последующих исследованиях большого количества одного и того же патогенного или условно-патогенного микроорганизма.
Биологическое исследование — наиболее чувствительный метод выявления микобактерий туберкулеза. Центрифугат М., обработанный серной кислотой для уничтожения неспецифической микрофлоры, вводят животному (обычно морской свинке) подкожно в паховую область или внутрибрюшинно. При наличии в М. микобактерий туберкулеза через 1—1 1 /2 мес. у животного может быть обнаружено специфическое туберкулезное воспаление. Применение биологического метода ограничено в связи с необходимостью длительного наблюдения за животными (при отсутствии признаков развивающегося туберкулеза оно продолжается 3 мес.).
Физико-химическое исследование. Для изучения вязкости и эластичности М. используют ротационный вискозиметр. Величину рН определяют с помощью рН-метра. Реакция М. во многом зависит от характера и интенсивности воспаления бронхов; как правило, она слабощелочная, кислой становится при разложении М., примешивании к ней желудочного содержимого.
Общее содержание белка, определяемое биуретовым методом, или методом Лаури, колеблется в очень широких пределах, т.к. во многом обусловлено степенью экссудации плазмы в просвет бронхов. В мокроте при пневмонии содержится 1—2% белка; много белка появляется в М. при отеке легкого.
Библиогр.: Лабораторные методы исследования в клинике, под ред. В.В. Меньшикова, с. 91, М., 1987; Руководство по пульмонологии, под ред. Н.В. Путова и Г.Б. Федосеева, с. 110, Л., 1978.
Рис. 6. Стрептококки (1), стафилококки (2), диплобактерии Фридлендера (3), пневмококки (4); окраска по Граму.
Рис. 3. Микропрепарат мокроты. Альвеолярные макрофаги, содержащие в цитоплазме включения гемосидерина темно-синего цвета; реакция Перльса.
Рис. 1. Микропрепарат мокроты. Спирали Куршманна (1), кристаллы Шарко — Лейдена (2) в неокрашенном препарате мокроты больного бронхиальной астмой.
Рис. 4. Микропрепарат мокроты. Клетка Пирогова — Лангханса в мокроте больного туберкулезом легких; окраска гематоксилином и эозином.
Рис. 5б). Микропрепарат мокроты. Опухолевые клетки — клетки аденокарциномы (указаны стрелками), окраска гематоксилином и эозином.
Рис. 5а). Микропрепарат мокроты. Опухолевые клетки — полиморфные клетки плоскоклеточного рака (указаны стрелками), окраска гематоксилином и эозином.
Рис. 2. Микропрепарат мокроты. Эластические волокна в виде тонких розовых нитей; окраска эозином.
патологическое отделяемое из дыхательных путей.
Мокрота гнилостная (s. putridum, s. foetidum) — гнойная М. с гнилостным запахом.
Мокрота гнойная (s. purulentum) — М., содержащая гной; наблюдается, например, при прорыве абсцесса легкого в просвет бронха.
Мокрота жемчужная — М. с округлыми опалесцирующими включениями, состоящими из атипичных клеток и детрита; наблюдается при плоскоклеточном раке бронхов.
Мокрота кровянистая (s. sanguinolentum) — М. с примесью крови; наблюдается, например, при кровотечении из стенок дыхательных путей.
Мокрота ржавая (s. rubiginosum) — кровянистая М., содержащая включения ржавого цвета, образующиеся в результате разложения гемоглобина в дыхательных путях: наблюдается, например, при пневмониях, туберкулезе.
Мокрота серозная (s. serosum) — жидкая пенистая М., выделяющаяся при отеке легких.
Мокрота слизистая (s. mucosum) — бесцветная, прозрачная, вязкая М., практически не содержащая клеточных элементов.
Мокрота трехслойная — обильная гнойная М., разделяющаяся при отстаивании на три слоя: верхний — сероватый пенистый, средний — водянистый прозрачный и нижний — грязного серо-зеленого цвета, содержащий гной и остатки некротизированных тканей; наблюдается при гангрене легких.
источник