Анализ мокроты — показание, как правильно собрать и сдавать, расшифровка результатов и показатели нормы
При бронхите и других воспалительных заболеваниях необходимо сдавать общий анализ мокроты, проанализировав результаты которого, врач сможет определить характер и причину развития патологического процесса. При поражениях дыхательных органов выделяется слизистый секрет, который несет в себе информацию о возбудителях, ставших катализаторами ухудшения состояния организма. Это могут быть микробактерии туберкулеза, клетки злокачественных опухолей, примеси гноя или крови. Все они влияют на количество и состав выделяемой пациентом мокроты.
Исследование мокроты является одним из самых эффективных методов, позволяющих определить характер заболевания дыхательных путей. Многие недуги представляют серьезную угрозу для жизни человека, например, такие болезни как актиномикоз, гнилостный бронхит, гангрена легкого, пневмония, бронхиальная астма, абсцесс легкого и т.д. Попадая в организм человека, вредоносные микроорганизмы способствуют развитию патологического процесса, который стимулирует выделение секрета из органов дыхания.
Чтобы диагностировать болезнь, врачи проводят общий анализ, который включает несколько этапов: бактериологический, макроскопический, химический и микроскопический. Каждое исследование содержит важную информацию о секрете, на основе чего происходит итоговое составление медицинского заключения. Анализы подготавливают около трех рабочих дней, в некоторых случаях возможны задержки на более длительный срок.
Микроскопия мокроты проводится среди пациентов, страдающих заболеваниями легких или других органов дыхания, с целью выявления причины недуга. Слизистый секрет выделяется только при наличии патологических отклонений в работе организма, поэтому при появлении выделений из дыхательных путей следует как можно скорее обратиться к врачу. Отхождение мокроты происходит во время кашля, микроскопический анализ слизи помогает получить всю необходимую информацию о локализации и стадии воспалительного процесса.
Цвет и консистенция мокроты могут быть разными в зависимости от болезни. Исходя из полученных данных, врачи определяют возбудителя патологии и подбирают рациональный курс лечения. Присутствие в секрете патогенных микроорганизмов способствует подтверждению или опровержению наличия злокачественных опухолей, что немаловажно при постановке окончательного диагноза.
Сдавать посев мокроты для проведения общего анализа необходимо тем пациентам, у которых присутствует подозрение на хронические или острые заболевания дыхательной системы. Например, бронхит, рак легкого, туберкулез, пневмония. Данная группа людей находится в категории риска, поэтому регулярные исследования секрета являются неотъемлемой частью комплексной терапии заболеваний. Собирать слизь приходится даже после прохождения курса лечения, поскольку некоторые недуги имеют тенденцию к временному прекращению активности.
Данная процедура требует от пациентов соблюдения определенных правил, которые гарантируют «чистоту» проведения исследования. Ротовая полость человека содержит особую флору, которая может смешиваться с патогенным секретом. Чтобы предоставить корректные данные медицинской комиссии, пациент должен придерживаться следующих рекомендаций:
- Пить много теплой воды.
- Принимать отхаркивающие средства.
- Почистить зубы и прополоскать рот перед процедурой.
Перед тем, как сдавать мокроту на анализ, ее необходимо собрать в домашних или амбулаторных условиях. Пациенту выдают стерильную баночку, которую следует открывать непосредственно перед процедурой. Лучше всего собирать секрет с утра, поскольку в это время суток он является самым свежим. Мокроту для исследования нужно постепенно выкашливать, но, ни в коем случае, не отхаркивать. Чтобы улучшить выделение слизи, врачи рекомендуют:
- Сделать 3 медленных вдоха и выдоха, задерживая дыхание между ними на 5 секунд.
- Откашляться и сплюнуть накопившуюся мокроту в баночку для анализов.
- Убедиться, что слюна из ротовой полости не попала в емкость.
- Повторять вышеуказанные действия до тех пор, пока уровень секрета не достигнет отметки 5 мл.
- В случае неудачи, можно подышать паром над кастрюлей с горячей водой для ускорения процесса отхаркивания.
Как только сбор мокроты завершен, баночку следует отвезти в лабораторию для проведения анализа. Важно, чтобы секрет был свежим (не более 2 часов), поскольку в человеческой слизи очень быстро начинают размножаться сапрофиты. Данные микроорганизмы мешают правильной постановке диагноза, поэтому все время от сбора до транспортировки емкость со слизью необходимо хранить в холодильнике.
Длительный кашель, который не прекращается на протяжении трех недель, считается показанием для исследования мокроты. Подозрение на туберкулез – серьезный диагноз, поэтому патогенную слизь собирают только под присмотром врача. Данный процесс может происходить в стационарных или амбулаторных условиях. Сдавать мокроту при подозрении на туберкулез приходится 3 раза.
Первый сбор проходит рано утром, второй – по прошествии 4 часов, а последний – на следующий день. Если пациент по какой-то причине не может самостоятельно прийти в больницу для сдачи анализов, к нему домой наведывается медсестра и доставляет полученный секрет в лабораторию. При обнаружении бактерий Коха (микробактерий туберкулеза) врачи ставят диагноз – открытая форма туберкулеза.
Расшифровка анализа мокроты состоит из трех этапов. Сначала лечащий врач проводит визуальный осмотр пациента, оценивает характер, цвет, слоистость и другие показатели патогенного секрета. Полученные образцы изучают под микроскопом, после чего наступает черед бактериоскопии. Завершающим исследованием является посев на питательные среды. Бланк с результатами выдается в течение трех дней по завершению сдачи анализов, исходя из полученных данных, специалист делает вывод о характере заболевания.
Чтобы правильно поставить диагноз пациенту, мокроту оценивают по трем разным показателям. Проводится макроскопический, бактериоскопический и микроскопический анализ, результаты по каждому исследованию дают четкое представление о состоянии человека. Цвет, консистенция, запах, деление на слои и наличие включений – это основные показатели макроскопического анализа секрета. Например, прозрачная слизь встречается у людей с хроническими заболеваниями дыхательных путей.
Ржавый оттенок секрета обусловлен кровянистыми примесями (распад эритроцитов), что часто свидетельствует о наличии туберкулеза, крупозной пневмонии, рака. Гнойная мокрота, которая образуется при скоплении лейкоцитов, характерна для абсцесса, гангрены или бронхита. Желтый или зеленый цвет выделений является показателем патологического процесса в легких. Вязкая консистенция секрета может быть следствием воспаления или приема антибиотиков.
Спирали Куршмана в мокроте, которые представляют собой белые извитые трубочки, свидетельствуют о наличии бронхиальной астмы. Результаты микроскопического и бактериоскопического анализа предоставляют информацию о содержании в слизи болезнетворных микроорганизмов или бактерий. К ним относятся: диплобациллы, атипичные клетки, стафилококки, эозинофилы, гельминты, стрептококки. Серозная мокрота выделяется при отеке легких, пробки Дитриха встречаются у пациентов, страдающих гангреной или бронхоэктазами.
У здорового человека железы крупных бронхов образуют секрет, который проглатывается при выделении. Данная слизь обладает бактерицидным эффектом и служит для очищения дыхательных путей. Однако появление даже незначительного количества мокроты свидетельствует о том, что в организме развивается патологический процесс. Это может быть застой в легких, острый бронхит или пневмония. Единственным исключением являются курильщики, поскольку у них слизь выделяется постоянно.
Наличие единичных эритроцитов при анализе секрета является нормой и не оказывает влияния на диагностические результаты. Объем ежедневно вырабатываемой трахеобронхиальной слизи у человека должен находиться в переделах от 10 до 100 мл. Превышение указанной нормы свидетельствует о необходимости проведения дополнительных анализов. При отсутствии отклонений мазок на МТБ должен показать отрицательный результат.
В норме у человека не должно происходить отхождение мокроты, поэтому при появлении слизи подозрительного характера необходимо сразу же обратиться за помощью к специалисту. С помощью бактериоскопического исследования определяется тип возбудителя, мазок с грамположительными бактериями окрашивается в синий цвет, а с грамотрицательными – в розовый. Микроскопический анализ помогает обнаружить опасные патологии, к которым относятся опухолевые клетки, эластичные волокна, альвеолярные макрофаги и т.д. Исходя из полученных результатов слизи, врач назначает терапию.
При микроскопическом исследовании мокроты часто встречаются клетки плоского эпителия, однако это никак не влияет результаты анализа. Обнаружение клеток цилиндрического эпителия может свидетельствовать о наличии таких недугов, как астма, бронхит или рак легкого. В большинстве случаев вышеупомянутые образования являются примесями слизи из носоглотки и не имеют диагностического значения.
Клетки ретикулоэндотелия можно обнаружить у людей, которые длительное время находились в контакте с пылью. Протоплазма альвеолярных макрофагов содержит фагоцитированные частицы, которые называют «пылевыми» клетками. Некоторые из вышеуказанных микроорганизмов включают продукт распада гемоглобина – гемосидерин, поэтому им было присвоено название «клетки сердечных пороков». Такие образования возникают у пациентов с диагнозами инфаркт легкого, митральный стеноз, застой легкого.
Любой секрет содержит небольшое количество лейкоцитов, однако скопление нейтрофилов свидетельствует о том, что имеются гнойные выделения. При бронхиальной астме у пациента можно обнаружить эозинофилы, что также характерно и для следующих заболеваний: рак, туберкулез, инфаркт, пневмония, гельминтоз. Большое число лимфоцитов встречаются у тех людей, которые болеют коклюшем. Иногда причиной повышения их количества выступает туберкулез легких.
Слизь человека может содержать единичное количество эритроцитов, что никак не влияет на состояние его здоровья. При развитии таких патологических процессов, как легочное кровотечение, количество эритроцитов сильно возрастает, что приводит к кровохарканью. Наличие свежей крови в слизистых выделениях говорит о наличии неизменных эритроцитов, но если кровь задерживалась в дыхательных путях, то по ней определяют выщелоченные клетки.
При распаде легочной ткани образуются так называемые эластичные волокна. Их появление в секрете свидетельствует о наличии абсцесса, туберкулеза, рака или гангрены легких. Последнее заболевание может протекать без присутствия эластичных волокон, поскольку они иногда растворяются под действием ферментов слизи. Отличительной особенностью бесцветных кристаллов Шарко-Лейдена является высокое содержание эозинофилов, что характерно для таких заболеваний как бронхиальная астма и эозинофильная пневмония.
Кристаллы Шарко-Лейдена – не единственный представитель эластичных волокон. В мокроте многих пациентов, страдающих заболеваниями дыхательных путей, часто встречаются спирали Куршмана. Они представляют собой трубчатые тела, которые иногда заметны даже невооруженным глазом. В остальных случаях кристаллы обнаруживают с помощью микроскопического исследования слизи. Трубчатые тела могут предвещать развитие пневмонии, бронхиальной астмы, туберкулеза легких.
Эозинофилы считаются признаками астмы, но данное утверждение верно лишь для некоторых случаев. Микроорганизмы этого типа содержат специфический белок, который способен не только защищать организм от паразитов, но и разрушать эпителий дыхательных путей. Эозинофилы считаются одной из главных причин развития патологии органов дыхания, однако исследования по данному вопросу все еще не завершены. Эти клетки невозможно полностью удалить из дыхательных путей, однако можно существенно снизить их количество при соответствующем лечении антителами.
источник
Чума – это высокозаразное заболевание, которое проявляется в виде острой пневмонии или в виде поражения лимфатических узлов, сопровождающегося лихорадкой.
Возбудитель заболевания – чумная палочка.
Первично чума поражает грызунов (крыс, мышей, барсуков, белок и др.). Заражение человека происходит через укусы блох, инфицированных от больных грызунов. От человека к человеку заболевание передается чаще всего при вспышках легочной чумы воздушно-капельным путем.
На протяжении нескольких тысячелетий люди страдали от эпидемий чумы, уносящих огромное количество жизней. На данный момент она встречается очень редко, в основном в развивающихся странах.
Лечениесостоит в приеме антибиотиков. Без лечения высок риск смерти больного.
Симптомычумы зависят от ее формы.
Бубонная чума проявляется обычно спустя 2-5 дней после заражения:
- резким повышением температуры до 40-41 °C, ознобом и головной болью;
- бубонами – болезненными, увеличенными лимфатическими узлами в паховой, подмышечной области, в области шеи, которые окружены зоной отека; примерно на второй неделе заболевания они могут нагноиться;
- мышечными болями, сильным истощением, слабостью, болями в животе, диареей.
Септическая чума возникает при заражении крови чумной палочкой. Общие симптомы сходны с проявлениями бубонной чумы, однако сами бубоны отсутствуют.
При легочной чуме через 2-3 дня после заражения появляются быстро прогрессирующие симптомы:
- высокая температура тела, слабость, головная боль;
- кашель с кровавой или гнойной мокротой;
- боль в груди, затруднение дыхания;
- тошнота и рвота.
Общая информация о заболевании
Чума – это высокозаразное заболевание, которое проявляется поражением легких или лимфатических узлов и сопровождается лихорадкой.
Возбудитель заболевания – чумная палочка.
Люди страдали от эпидемий чумы на протяжении нескольких тысячелетий, раньше погибало до 100 % жителей зараженных мест. На данный момент она встречается редко, как правило, в развивающихся странах.
Изначально чума поражает грызунов (крыс, мышей, кроликов, бурундуков, барсуков, белок, землероек и др.). Человек инфицируется через укусы блох, хозяином которых до этого было зараженное чумой животное.
Кроме того, заразиться можно от укусов и царапин кошек, при разделке тушек животных, воздушно-капельным путем от человека при эпидемиях легочной чумы, от животного путем вдыхания зараженной воздушной взвеси.
Попав с укусом блох в организм, бактерии мигрируют в близлежащие лимфатические узлы и размножаются внутри клеток. Так пораженные лимфоузлы превращаются в бубоны. Затем происходит разрушение структуры и отмирание тканей лимфатических узлов. Без лечения инфекция может распространиться на другие органы.
Выделяются три наиболее распространенных формы чумы.
- Бубонная чума – наиболее распространенная форма. Поражаются лимфатические узлы, чаще всего один. При адекватном лечении смертность от бубонной чумы составляет около 20 %. Больной не заразен для окружающих.
- Септическая чума – менее распространенная форма. Происходит заражение крови больного. Бубоны не образуются. При полноценном лечении летальность среди больных составляет примерно 25 %.
- Легочная чума является редкой формой заболевания, при которой поражаются легкие. При оказании больным медицинской помощи смертность от легочной чумы достигает 50 %.
Чума может приводить к следующим осложнениям:
- менингиту – воспалению оболочек головного и спинного мозга;
- гангрене (сгустки крови в кровеносных сосудах пальцев, образующиеся при чуме, могут нарушить приток крови к ним и привести к отмиранию конечностей);
- септическому шоку – состоянию, угрожающему жизни и характеризующемуся крайне низким кровяным давлением;
- смерти (при отсутствии лечения смертность от чумы составляет примерно 60 %).
Риск заболеть чумой достаточно низок. В группу риска входят:
- лица, контактировавшие с больным животным или человеком;
- те, кого часто кусают блохи;
- проживающие в местности, где наблюдались вспышки чумы;
- люди, чья пища может быть доступна грызунам;
- жители местности с плохими санитарными условиями и высокой численностью крыс;
- контактирующие с чумной палочкой по роду занятий (ученые, доктора, ветеринары).
При подозрении на чуму незамедлительно проводится взятие материала из пораженных органов и крови, выполняется рентгенография грудной клетки. Лечениеначинается до получения результатов исследований.
- Исследование под микроскопом мазков из мокроты, крови, пораженных лимфоузлов. С помощью специального окрашивания мазка визуально выявляют бактерии, вызывающие чуму (иерсиния пестис). Для подтверждения диагноза достаточно обнаружить хотя бы одного возбудителя.
- Посев крови, мокроты, жидкости из легких, из лимфоузлов на чуму. Исследование предполагает помещение отделяемого в питательную среду, где бактерии начинают размножаться и становятся доступными визуальной оценке. Рост чумной палочки в питательной среде происходит медленно.
- Исследование мазка методом иммунофлюоресценции. В ходе данного исследования в полученный материал добавляются меченые антитела (молекулы, специфически связывающиеся с чумной палочкой). Под воздействием ультрафиолетового излучения комплекс из бактерий, «скленных» с антителами, дает характерное зеленоватое свечение, что говорит о присутствии чумной палочки во взятом материале. Метод используется для экспресс-диагностики чумы, обладая относительно высокой специфичностью.
- Определение антител к возбудителю чумы. При заражении организма чумой иммунная системы больного начинает вырабатывать специфические молекулы для борьбы с инфекцией. Количество (титр) антител значительно повышается в течение 2-3 недель после инфицирования и снижается в течение нескольких месяцев или лет.
- Определение ДНК чумной палочки методом полимеразной цепной реакции (ПЦР). Метод основан на выявлении генетического материала чумной палочки в исследуемом материале.
В целях оценки общего состояния больного и состояния жизненно важных органов выполняются следующие анализы.
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
источник
Для лабораторной диагностики чумы используют бактериоскопический, бактериологический, биологический, серологические и молекулярно-генетические методы.
Диагноз чумы у человека ставится на основании выявления у него возбудителя – выделение и идентификация культуры, обнаружения специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
В качестве экспресс-методов используют иммунофлюоресцентный анализ (обнаружение микроба с помощью флюоресцирующих иммуноглобулинов), ПЦР (обнаружение микроба по наличию искомого участка ДНК в результате его многократного копирования), иммуносуспензионные методы – система 2-3 компонентных реакций с эритроцитарными диагностикумами или иммуноферментный анализ для обнаружения специфических антигенов чумного микроба. С этой же целью применяют и другие варианты иммуносуспензионных методов: дот-иммуноферментный анализ, радиоиммунный анализ. Все экспресс-методы выполняют после обеззараживания материала.
Обязательному лабораторному исследованию подлежит материал:
— от больных людей с симптомами болезни, сходными с клиническими проявлениями всех форм чумы;
— лиц, контактировавших с больными легочной чумой;
— лиц, участвовавших (без защитной одежды) во вскрытии трупов людей и верблюдов, погибших от чумы;
— лиц, участвовавших в прирезке и разделке туши больного чумой верблюда и других животных, обработке мяса в процессе приготовления пищи, употреблявших в пищу мясо больных чумой животных;
— лиц, совершивших аварию с разбрызгиванием заразного материала при работе с возбудителем чумы.
Материал от больных, как правило, целесообразно брать сразу при поступлении в лечебное учреждение и спустя 3 дня после окончания специфического лечения антибиотиками с интервалами между очередными исследованиями 24 ч до получения трех отрицательных результатов. Материал от лиц, контактировавших с больными или контаминированными объектами – при поступлении в изолятор и по окончании профилактического лечения, перед выпиской.
Исследованию подлежит: при легочной форме чумы – мокрота, при её отсутствии – мазок из зева, кровь из вены, моча; при септической форме – кровь, моча; при бубонной форме – пунктат бубона, кровь, моча; при кожной форме – отделяемое язвы, кровь, моча; при кишечной форме – кал, кровь, моча; при менингиальных явлениях – спинномозговая жидкость.
У лиц, контактировавших с больным легочной формой чумы, а также в других случаях, если есть подозрение, что заражение произошло аэрогенным путем, исследуют мазок из зева. В остальных случаях у контактных исследования не проводят.
Забор материала на исследование у больных с подозрением на чуму следует, как правило, проводить в условиях стационара до начала специфического лечения обученным квалифицированным медицинским персоналом под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГиЭ субъекта Российской Федерации. В случае невозможности забрать материал в первые 2 ч после возникновения подозрения, лечение начинают по клиническим показаниям до забора материала.
Забор материала у лиц, контактировавших с больными чумой и совершивших аварию, производят в изоляторе до начала профилактического лечения.
Исследование материала проводят специалисты территориальных противочумных учреждений на своей базе, а также на базе лабораторий отделов особо опасных инфекций ФГУЗ ЦГиЭ субъекта Российской Федерации, если они соответствуют требованиям действующих «Санитарных правил безопасности работы с микроорганизмами I-II групп патогенности». Специалисты отделов особо опасных инфекций проводят исследование обеззараженного материала экспресс-методами. Ведущим методом является люминесцентно-серологический. Определение антигена у больного возможно только при осложненной клинике в спинномозговой жидкости, в пунктате бубона – при тяжелом течении болезни, в моче – при всех формах болезни, начиная с 3-4 дня заболевания в низких титрах.
Методы забора материала – в приложении 8.
Запрещается давать окончательный (отрицательный или положительный) ответ на основании результатов экспресс-методов.
Исследование материала от больного чумой.
— приготовление мазков, окраска фиксированных мазков анилиновыми красителями, чумными флюоресцирующими иммуноглобулинами;
— полимеразная цепная реакция;
— посев на жидкие и плотные питательные среды со стимуляторами роста чумного микроба (кровь, моча, спинномозговая жидкость, пунктат бубона);
— посев на плотные питательные среды со стимулятором роста чумного микроба и ингибиторами посторонней флоры (мокрота, мазок из зева, субстрат из вскрывшегося бубона, отделяемое язвы, моча, испражнения);
— проба с диагностическими бактериофагами нативного материала на соответствующей плотной среде;
— проба на чувствительность к антибиотикам с нативным материалом на плотной среде методом дисков;
— поиск антигена FI иммуносуспензионными методами: реакция непрямой гемагглютинации, реакция нейтрализации антител, иммуноферментный анализ, дот-иммуноферментный анализ, радиоиммунный анализ (моча, спинномозговая жидкость, пунктат бубона); параллельно в качестве контроля ставят те же реакции с диагностикумами на другие инфекции (туляремия, бруцеллёз, холера и др.);
— заражение лабораторных животных (морские свинки, белые мыши) внутрибрюшинно и подкожно (кровь, пунктат бубона, спинномозговая жидкость), подкожно и накожно (мокрота, мазок из зева, вскрывшийся бубон, отделяемое язвы, моча, испражнения).
II этап (2-5 ч от начала исследования):
— выдача предварительного положительного ответа на основании наличия в мазках биополярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими чумными иммуноглобулинами, положительной ПЦР, положительных иммуносуспензионных реакций при отрицательных контролях.
— выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Высев культуры для дальнейшей идентификации на питательный агар и агар с содержанием дефибринированной крови (5 %) для определения продукции FI после инкубации при 37° С. Одновременно выдача предварительного ответа о чувствительности выделенной культуры к антибиотикам. Посев культуры на среды Гисса с рамнозой, глицерином, сахарозой, арабинозой, ЦДС или среду Ленской для определения уреазной активности (после накопления чистой культуры).
— выдача окончательного положительного ответа на основании выделения чистой культуры чумного микроба из посевов нативного материала, его идентификации по морфологическим, культуральным, биохимическим признакам, чувствительности к диагностическим бактериофагам, наличию специфических плазмид, а также на основании подтверждения диагноза выделением идентичных культур от павших или забитых лабораторных животных.
— выдача отрицательного ответа на основании отсутствия специфического роста на питательных средах при посеве нативного материала и органов забитых биопробных животных, отрицательной ПЦР, отрицательных иммуносуспензионных реакций с нативным материалом и органами забитых или павших биологических проб, отсутствия патологоанатомических изменений у последних, отсутствия в парных сыворотках больного специфических антител к чумному микробу.
Исследование материала от лиц, контактировавших с больными легочной формой чумы, а также лиц, присутствовавших при аварии с разбрызгиванием заразного материала.
Исследуемый материал – мазок из зева.
— приготовление мазков, окраска анилиновыми красителями, флюоресцирующими чумными иммуноглобулинами;
— полимеразная цепная реакция;
— посев на плотные селективные среды;
— заражение лабораторных животных подкожно и накожно.
— выдача предварительного положительного ответа на основании обнаружения специфически светящихся клеток в люминесцентном микроскопе, положительной ПЦР.
— выдача подтверждения предварительного положительного ответа на основании наличия характерных по морфологии колоний в посевах на плотной среде;
— пересев колоний на питательный слабощелочной агар, на селективный агар и на агар с кровью для дальнейшей идентификации (последний посев ставят в термостат с 37° С для последующего определения F1);
— при достаточном количестве колоний постановка пробы на чувствительность с диагностическими бактериофагами на плотной среде и пробы на чувствительность к антибиотикам методом дисков.
— выдача положительного ответа на основании выделения типичной по морфологии культуры, лизирующейся диагностическими бактериофагами;
— положительных иммуносуспензионных реакций на наличие антигена F1;
— дальнейшая идентификация выделенной культуры.
— вскрытие забитых биопроб, их исследование бактериологически и серологически;
— выдача окончательного положительного ответа на основании выделения и идентификации культуры чумного микроба, типичной по морфологическим, культуральным, биохимическим свойствам, фаголизабельности, наличию специфических плазмид, подтверждения диагноза выделением идентичной культуры от павших или забитых биопробных животных (схема идентификации выделенных культур – в приложении 9;
— выдача отрицательного ответа на основании отсутствия специфически светящихся клеток в мазках, окрашенных люминесцирующими чумными иммуноглобулинами, отрицательной ПЦР, отсутствия роста характерных по морфологии колоний на плотной среде, отсутствия характерных для чумы изменений в органах у биопробных животных и отсутствия специфического роста на плотной среде из посевов отпечатков их органов.
Исследование материала от трупа человека, погибшего от чумы.
Исследованию подлежат: кусочки паренхиматозных органов, легких из мест, где есть характерные для чумы изменения, лимфатические узлы, как регионарные к первичному аффекту, так и другие, увеличенные и имеющие изменения, сгустки крови из сердца и крупных сосудов, сыворотка крови, полученная из сгустков при их сокращении, участки любой ткани, имеющие изменения септического характера, спинномозговая жидкость, моча, содержимое кишечника, в случае наличия признаков загнивания трупа исследуют спинной и головной мозг.
Исследования ведут по этапам, как исследование материала от больного чумой человека.
Положительный предварительный диагноз может быть поставлен на любом этапе, так как при гибели от чумы все органы и ткани содержат большое количество возбудителя и его антигенов, в том числе FI. Поэтому весьма вероятен первый положительный ответ уже через 2 ч после исследования на основании наличия грамотрицательных биполярно окрашенных палочек, специфически светящихся в люминесцентном микроскопе при обработке мазков-отпечатков флюоресцирующим чумным иммуноглобулином, положительной ПЦР, высокого титра антигена FI в тканях и органах, наличия противочумных антител в сыворотке.
Высокая вероятность подтверждения диагноза через 24-48 ч после начала исследования на основании обнаружения типичных по морфологии колоний чумного микроба, положительной пробы с бактериофагом, которую следует ставить на селективном агаре во избежании зарастания пятна лизиса культуры посторонней флорой и отрицательного ответа в 2-5 часов исследований
Окончательный положительный ответ может быть поставлен через 48 ч – 6 сут. по результатам идентификации культуры чумного микроба и подтверждения ее выделением идентичной культуры от биопробного животного.
Окончательный отрицательный диагноз дают на 5-8 сутки, как и при исследовании материала от больного.
Запрещается выдавать отрицательный ответ по результатам ускоренного исследования и на основании результатов экспресс-методов.
Дата добавления: 2015-09-15 ; просмотров: 2752 . Нарушение авторских прав
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Диагностика чумы основана на клинико-эпидемиологических данных: выраженная интоксикация, наличие язвы, бубона, тяжёлой пневмонии, геморрагической септицемии у лиц, находящихся в природно-очаговой зоне по чуме, проживающих в местах, где наблюдались эпизоотии (падёж) среди грызунов или есть указание на регистрируемые случаи болезни. Каждый подозрительный больной должен быть обследован.

Консультации проводят, как правило, для уточнения диагноза. При подозрении на бубонную форму показана консультация хирурга, при подозрении на лёгочную форму — пульмонолога.
Картина крови характеризуется значительным лейкоцитозом, нейтрофилёзом со сдвигом формулы влево и увеличением СОЭ. В моче обнаруживают белок. При рентгенологическом обследовании органов грудной клетки кроме увеличения медиастинальных лимфатических узлов можно увидеть очаговую, лобулярную, реже псевдолобарную пневмонию, при тяжёлом течении — РДС. При наличии менингеальных знаков (ригидность мышц затылка, положительный симптом Кернига) необходима спинномозговая пункция. В спинно-мозговой жидкости чаще выявляют трёхзначный нейтрофильный плеоцитоз, умеренное увеличение содержания белка и снижение уровня глюкозы. Специфическая диагностика чумы основана на исследовании пунктата бубона, отделяемого язвы, карбункула, мокроты, мазка из носоглотки, крови, мочи, испражнений, спинно-мозговой жидкости, секционного материала. Правила забора материала и его транспортировки строго регламентированы «Международными медико-санитарными правилами». Забор материала осуществляют с использованием специальной посуды, биксов, дезинфицирующих средств. Персонал работает в противочумных костюмах. Предварительное заключение дают на основании микроскопии мазков, окрашенных по Граму. метиленовым синим или обработанных специфической люминесцентной сывороткой. Обнаружение овоидных биполярных палочек с интенсивным окрашиванием по полюсам (биполярная окраска) позволяет предположить диагноз чумы в течение часа. Для окончательного подтверждения диагноза, выделения и идентификации культуры производят посев материала на агар в чашке Петри или на бульон. Через 12-14 ч появляется характерный рост в виде битого стекла («кружева») на агаре или «сталактиты» в бульоне. Окончательную идентификацию культуры производят на 3-5-е сутки.
Диагноз можно подтвердить серологическими исследованиями парных сывороток в РПГА, однако этот метод имеет второстепенное диагностическое значение. Изучают патологоанатомические изменения у заражённых внутрибрюшинно мышей, морских свинок через 3-7 дней, с посевом биологического материала. Аналогичные методы лабораторного выделения и идентификации возбудителя применяют для выявления эпизоотии чумы в природе. Для исследования берут материалы от грызунов и их трупов, а также блох.
А20.0. Чума, бубонная форма. Осложнение: менингит. Тяжёлое течение.
Все больные с подозрением на чуму подлежат экстренной госпитализации на специальном транспорте в инфекционный стационар, в отдельный бокс с соблюдением всех противоэпидемических мер. Персонал, ухаживающий за больными чумой, должен носить защитный противочумный костюм. Предметы быта в палате, выделения больного подлежат дезинфекции.

источник
Возбудитель чумы – Yersinia pestis относится к высокопатогенным микроорганизмам (1 группы патогенности). Взятие, доставка материала при подозрении на чуму и работа с ним производятся в специализированных лабораториях с соблюдением особых правил предосторожности (в противочумном костюме, с применением специальных средств и устройств, предотвращающих попадание микроорганизма на кожу, слизистые оболочки и в дыхательные пути медицинского персонала, а также на различные объекты внешней среды).
В зависимости от способа заражения различают бубонную, легочную, кишечную формы, реже возникает септическая и кожная формы. Материал, подлежащий исследованию на чуму (см. схему 4), помещают в банки, которые герметично закрывают, обрабатывают снаружи 5% раствором лизола, наклеивают этикетку с указанием вида материала, даты и места его взятия, фамилии и инициалов больного, а также диагноза. Банки плотно укладывают в герметичную тару, на крышке которой указывают «Верх»; в банку вкладывают опись направляемых на исследование материалов. Материалы подлежат немедленной отправке в лабораторию на специальном транспорте с сопровождающим лицом. Перед исследованием тара с материалом и другие потенциально зараженные предметы обрабатываются дезинфицирующим раствором.
Лица, контактировавшие с материалом, подозрительным на содержание возбудителя чумы, подвергаются полной санитарной обработке.
Принципы микробиологической диагностики чумы отражены в схеме 4.
Бактериоскопический метод. Мазки, приготовленные из исследуемого материала, фиксируют в смеси Никифорова, окрашивают по Граму и метиленовым синим. С целью экспресс-диагностики мазки обрабатывают также меченой люминесцирующей сывороткой к Y. pestis (прямой ИФМ). Предварительный положительный ответ выдается в случае обнаружения в мазках биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой (рис.7), дающих специфическое свечение в РИФ.
В качестве других методов экспресс-диагностики чумы применяют РНГА с иммуноглобулиновым чумным диагностикумом, ИФА для индикации антигенов возбудителя.
Методы ускоренной и экспресс-диагностики дают возможность дать предварительный ответ через 4 ч от начала исследования, окончательный — через 18-20 ч.
Бактериологическое исследование. Кровь при подозрении на чуму засевают на МПБ во флаконах; содержимое бубона, отделяемое язвы, мокроту и другой материал — на МПА с цельной или гемолизированной кровью кролика или лошади в чашках Петри с антифаговой сывороткой для нейтрализации чумного фага, раствором генцианового фиолетового и сульфита натрия для подавления роста посторонней микрофлоры, находящейся в исследуемом материале. Применяют также селективную среду с антибиотиками — агар CIN. Посевы инкубируют при 25—28 °С. Через 16—20 ч на чашках под малым увеличением микроскопа обнаруживают рост колоний в виде скоплений осколков битого стекла, которые к 48 ч приобретают вид R-формы с компактным приподнятым центром и ажурной полупрозрачной периферией («кружевные платочки» — рис. 8). На поверхности МПБ через 24 ч образуется рыхлая пленка, от которой спускаются тяжи, напоминающие сталактиты.
Схема 4. Микробиологическая диагностика чумы
| |
|
|
а б
Рис. 7. Возбудитель чумы(Yersinia pestis). а — чистая культура, окраска метиленовым синим. Палочки овоидной формы, окрашенные биполярно.х 630. б– мазок из материала от больного, окраска по Граму. Грамотрицательные, биполярно окрашенные, капсулообразующие палочки овоидной формы. х1350
Типичные колонии пересевают на скошенный МПА, чистую культуру чумных бактерий идентифицируют по морфологическим, культуральным, ферментативным, антигенным свойствам (РА с использованием диагностических сывороток против высокоспецифичного капсульного и соматического антигенов), фаголизабельности, определяют ее чувствительность к антибиотикам. Возбудитель чумы восстанавливает нитраты в нитриты, ферментирует глюкозу, ксилозу, маннит с образованием кислоты (без газа). В отличие от многих других представителей семейства энтеробактерий имеет более низкий температурный оптимум роста и физиологической активности — 28 °С. В процессе идентификации возбудитель чумы необходимо дифференцировать с другими иерсиниями (табл. 6).
Биологическое исследование. Заражают морских свинок или мышей подкожно, внутрибрюшинно или накожно, материалом от трупов – методом скарификации.
Животные погибают на 2—7-е сутки. Одно из зараженных животных умерщвляют на 2—3-й день с целью выделения культуры иерсиний из крови и внутренних органов. В мазках из внутренних органов, крови, экссудата погибших животных обнаруживают большое количество грамотрицательных, биполярно окрашенных бактерий. После исследования трупы животных погружают в 5% лизол, а затем сжигают.
Рис. 8. Колонии возбудителя чумы(Yersinia pestis). х56
Таблица 6. Биологические свойства иерсиний
| Свойства | Y. pestis | Y. pseudotuberculosis | Y. enterocolitica |
| Подвижность при: 25 0 С 28-37 0 С | — — | + — | + — |
| Ферментация: рамнозы раффинозы инозита мочевины сахарозы | — — — — — | + + — + — | — — + + + |
| уреаза орнитиндекарбоксилаза | — — | — — | + — |
| Фракция 1 | + | — | — |
| Мышиный токсин | + | — | — |
| Пестицин 1 | + | — | — |
| Плазмокоагулаза | + | — | — |
| Фибринолизин | + | — | — |
| Чувствительность к чумному фагу | + | — | — |
| Вирулентная форма колоний | R | S | S |
Серологическое исследование проводится с целью ретроспективной диагностики чумы. Ставят РНГА с эритроцитами, на которых адсорбирован капсульный антиген возбудителя чумы, реакцию нейтрализации антигена (РНАг), ИФА и непрямую РИФ. Диагностический титр 1:40 и выше.
Генодиагностика. Разработана ПЦР для экспресс-диагностики чумы.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Микробиологическая диагностика чумы и туляремии
Перечень бактериологических лабораторий, проводящих исследования с особо опасными возбудителями заболеваний
1. Лаборатория отдела особо опасных инфекций центра ГосСанЭпидНадзора СПб. (Санкт-Петербург, Лиговский пр., 29)
2. Лаборатория особо опасных и вирусологических исследований (СПб, ул. Оборонная, д.35, лит.А).
3. Лаборатория особо опасных инфекций центр Гигиены и Эпидемиологии в Ленинградской области (Санкт-Петербург, ул. Ольминского, 27)
Перечень субъектов Российской Федерации, граничащих со странами,
на территории которых имеются активные природные очаги чумы – Республика Казахстан, Китайская Народная Республика, Монголия
| Субъект Российской Федерации | Страна, из которой существует угроза заноса чумы |
| Алтайский край Астраханская область Волгоградская область Курганская область Новосибирская область Омская область Оренбургская область Республика Алтай Самарская область Саратовская область Тюменская область Челябинская область | Республика Казахстан |
| Забайкальский край Республика Алтай Республика Бурятия Республика Тыва | Монголия |
| Амурская область Еврейская автономная область Забайкальский край Приморский край Хабаровский край | Китайская Народная Республика |
Правила взятия материала от больного с подозрением на чуму
Пунктат из бубона (везикул, пустул, карбункулов) берут шприцем емкостью не менее 5 мл. Кожу на участке, намеченном для прокола, обрабатывают 70 0 -ным спиртом, а затем смазывают 5%-ным раствором йода и вновь протирают 70 0 -ным спиртом. Иглу вводят с таким расчетом, чтобы ее острие достигло центральной части бубона, после чего, оттянув до отказа поршень, медленно вытягивают иглу. Так как экссудат в чумном бубоне расположен между плотными тканями, количество его, попадающее в шприц, как правило, незначительно и часто заполняет только просвет иглы. После извлечения иглы из бубона через нее набирают в шприц 0,5 мл стерильного питательного бульона (рН 7,2), содержимое выливают в стерильную пробирку и закрывают стерильной резиновой пробкой. Бульон можно набрать в шприц и до начала пункции. В качестве метода, повышающего возможность выделения культуры чумного микроба, и в случае невозможности получить материал, в бубон вводят 0,3-0,5 мл стерильного изотонического раствора натрия хлорида или питательного бульона. При вскрывшемся бубоне забирают материал отдельно из периферической плотной части и отделяемое свища. Обе порции исследуют раздельно.
При кожных поражениях иглу шприца вводят у края везикулы (пустулы) и затем продвигают к середине. У карбункулов и язв пунктируют плотный край.
Мокроту собирают в широкогорлые банки с притертой пробкой. Слизь из зева берут стерильным ватным тампоном по общепринятой методике.
Кровь забирают из локтевой вены в количестве 10 мл разовым шприцем и в нем доставляют кровь в лабораторию.
У больных чумой с локализацией первичных бубонов в области головы и шеи дополнительно забирают на исследование слизистое отделяемое ротовой полости и глотки стерильным ватным тампоном.
Посуду со взятым материалом обрабатывают снаружи марлей, смоченной в дезрастворе, обертывают вощеной бумагой, помещают в металлический бикс, перекладывают ватой. Тару с упакованным материалом опечатывают, на крышке указывают «верх» и отправляют в лабораторию с нарочным на специально выделенном транспорте.
К каждой пробе прикладывают направление с указанием сведений о материале (Ф.,И.,О. больного, наименование пробы, дата и час забора материала), а также сопроводительный документ, в котором содержатся сведения о больном (Ф.,И.,О., предполагаемый диагноз, получал ли больной до взятия материала антибиотики, какие и в каком количестве, какой материал направляется на исследование).
Время от момента взятия материала до начала исследования не должно превышать 5-6 ч, если нет условий для его хранения на холоде.
Материал для исследования:
· при легочной форме чумы — мокрота, при ее отсутствии — мазок из зева, кровь из вены, моча;
· при септической форме — кровь, моча;
· при бубонной форме — пунктат бубона, кровь, моча;
· при кожной форме — отделяемое язвы, кровь, моча;
· при кишечной форме — кал, кровь, моча;
· при менингиальных явлениях — спинномозговая жидкость.
· секционный материал (кусочки органов трупа, кровь);
· живые грызуны; трупы грызунов; блохи грызунов;
· вода, воздух, загрязненные вещи, посуда, белье и так далее.
Задача:В лабораторию поступил материал от пациентов со схожими симптомами – главным из которых, был — наличие бубонов в шейной области. Материал из бубонов обоих пациентов был доставлен в лабораторию особо опасных инфекций.
| Образец 1 | Образец 2 |
 |  |
| Опишите морфологию возбудителя. Окраска по Граму, х100 | Опишите морфологию возбудителя. Окраска по Граму, х100 |
| Морфология клеток Y.pestis вакцинный штамм EV, УТС, ув.х80000 | |
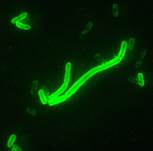 | 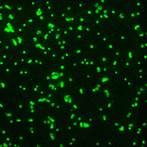 |
| Диагностикум с флюоресцирующими АТ к Y.pestis. Результат РИФ: | Диагностикум с флюоресцирующими АТ к Francisella tularensis. Результат РИФ: |
 Контроль(+) Образец 1 Образец2 Контроль(+) Образец 1 Образец2 | |
| Оцените результат реакции ПЦР |
Предположительный диагноз_________________________________________________
2 этап (2-5 часов от начала исследования):
выдача предварительного положительного ответана Y.pestis на основании наличия в мазках биполярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими иммуноглобулинами, положительной ПЦР.
Исследование Образца 1 (подозрение на Y.pestis)
 |  |
| Оцените посев на кровяной агар | Оцените характер роста на сердечно-мозговом бульоне |
 |  Образец Контроль(-) Образец Контроль(-) |
| Оцените результат пробы нативного материала с диагностическим бактериофагом Покровской и/или Л-413С к Y.pestis | Оцените результат латекс-агглютинационной тест-системы для выявления капсульного антигена F1 Y. pestis (при температуре 30 о С и выше Y.pestis синтезирует капсульный гликопротеид — фракцию 1 (антиген F1)). |
  Контроль (-) Образец Контроль (-) Образец | |
| Оцените результат биопрбы на животных (заражение внутрибрюшинно, подкожно и/или накожно). |
В качестве стимуляторов роста Y.pestis используют сульфит натрия в концентрации 1:4000 (1 мл 2,5 % раствора на 100 мл агара), гемолизированную кровь в концентрации 0,01-1 %, стимулятор роста чумного микроба из сарцин (стимулятор Карпузиди) согласно инструкции по применению препарата. В очагах, где циркулируют тиаминзависимые штаммы, в качестве стимулятора роста используют витамин B1 в концентрации 0,0001 мг на 100 мл среды или синтетическую среду 199 (3 мл на 100 мл среды).
Для подавления роста посторонней микрофлоры используют генцианвиолет в концентрации 1:100000-1:800000. Рабочую дозу определяют для каждой серии препарата перед обследовательским сезоном и указывают в паспорте на рабочий раствор генцианвиолета.
Помимо этого, для ингибирования посторонней флоры могут быть использованы теллурит калия в концентрации 1 300000, дезоксихолат натрия — 1 мг %, фосфомицин 50-100 мкг/мл.
3 этап (24-48 часов от начала исследования):
выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
 | Ферментация: Глюкоза + Сахароза – Лактоза – Рамиоза- Эскулин + Мочевина– |
| Чувствительность к АМП: | Проведите окончательную идентификацию культуры |
Диагноз чумы у человека ставится на основании выявления у него возбудителя — выделение и идентификация культуры, обнаружения специфического для Y.pestis антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
Дата добавления: 2017-01-21 ; просмотров: 1657 | Нарушение авторских прав
источник
Чума – высококонтагиозная бактериальная инфекция с множественными путями передачи и эпидемическим распространением, протекающая с лихорадочно-интоксикационным синдромом, поражением лимфоузлов, легких и кожи. Клиническому течению различных форм чумы свойственна высокая лихорадка, тяжелая интоксикация, возбуждение, мучительная жажда, рвота, регионарный лимфаденит, геморрагическая сыпь, ДВС-синдром, а также свои специфические симптомы (некротические язвы, чумные бубоны, ИТШ, кровохарканье). Диагностика чумы осуществляется лабораторными методами (бакпосев, ИФА, РНГА, ПЦР). Лечение проводится в условиях строгой изоляции: показаны тетрациклиновые антибиотики, дезинтоксикация, патогенетическая и симптоматическая терапия.
Чума представляет собой острое инфекционное заболевание, передающееся преимущественно по трансмиссивному механизму, проявляющееся воспалением лимфоузлов, легких, других органов, имеющим серозно-геморрагический характер, либо протекающее в септической форме. Чума относится к группе особо опасных инфекций.
Чума относится к группе особо опасных инфекций. В прошлом пандемии «черной смерти», как называли чуму, уносили миллионы человеческих жизней. В истории описаны три глобальных вспышки чумы: в VI в. в Восточной Римской империи («юстинианова чума»); в XIV в. в Крыму, Средиземноморье и Западной Европе; в к. XIX в. в Гонконге. В настоящее время благодаря разработке эффективных противоэпидемических мероприятий и противочумной вакцины регистрируются лишь спорадические случаи инфекции в природных очагах. В России к эндемичным по чуме районам относятся Прикаспийская низменность, Ставрополье, Восточный Урал, Алтай и Забайкалье.
Yersinia pestis представляет собой неподвижную факультативно-анаэробную грамотрицательную палочковидную бактерию из рода энтеробактерий. Чумная палочка может длительно сохранять жизнеспособность в отделяемом больных людей, трупах (в бубонном гное иерсинии живут до 20-30 дней, в трупах людей и павших животных – до 60 дней), переносит замораживание. К факторам внешней среды (солнечные лучи, атмосферный кислород, нагревание, изменение кислотности среды, дезинфекция) эта бактерия довольно чувствительна.
Резервуар и источник чумы – дикие грызуны (сурки, полевки, песчанки, пищухи). В различных природных очагах резервуаром могут служить разные виды грызунов, в городских условиях – преимущественно крысы. Резистентные к человеческой чуме собаки могут служить источником возбудителя для блох. В редких случаях (при легочной форме чумы, либо при непосредственном соприкосновении с бубонным гноем) источником инфекции может стать человек, блохи также могут получать возбудителя от больных септической формой чумы. Нередко заражение происходит непосредственно от чумных трупов.
Чума передается при помощи разнообразных механизмов, ведущее место среди которых занимает трансмиссивный. Переносчиками возбудителя чумы являются блохи и клещи некоторых видов. Блохи заражают животных, которые переносят возбудителя с миграцией, распространяя также блох. Люди заражаются при втирании в кожу при расчесах экскрементов блох. Насекомые сохраняют заразность около 7 недель (имеются данные о контагиозности блох на протяжении года).
Заражение чумой также может происходить контактным путем (через поврежденные кожные покровы при взаимодействии с мертвым животными, разделке туш, заготовке шкур и др.), алиментарно (при употреблении мяса больных животных в пищу).
Люди обладают абсолютной естественной восприимчивостью к инфекции, заболевание развивается при заражении любым путем и в любом возрасте. Постинфекционный иммунитет относительный, от повторного заражения не защищает, однако повторные случаи чумы обычно протекают в более легкой форме.
Чума классифицируется по клиническим формам в зависимости от преимущественной симптоматики. Различают локальные, генерализованные и внешнедиссеминированные формы. Локальная чума подразделяется на кожную, бубонную и кожно-бубонную, генерализованная чума бывает первично- и вторично-септической, внешнедиссеминированная форма подразделяется на первично- и вторично- легочную, а также – кишечную.
Инкубационный период чумы в среднем занимает около 3-6 суток (максимально до 9 дней). При массовых эпидемиях или в случае генерализованных форм инкубационный период может укорачиваться до одного – двух дней. Начало заболевания острое, характеризуется быстрым развитием лихорадки, сопровождающейся потрясающим ознобом, выраженным интоксикационным синдромом.
Больные могут жаловаться на боль в мышцах, суставах, крестцовой области. Появляется рвота (часто – с кровью), жажда (мучительная). С первых же часов больные пребывают в возбужденном состоянии, могут отмечаться расстройства восприятия (бред, галлюцинации). Нарушается координация, теряется внятность речи. Заметно реже возникают вялость и апатия, больные ослабевают вплоть до невозможности подняться с постели.
Лицо больных одутловато, гиперемировано, склеры инъецированы. При тяжелом течении отмечаются геморрагические высыпания. Характерным признаком чумы является «меловой язык» — сухой, утолщенный, густо покрытый ярким белым налетом. Физикальное обследование показывает выраженную тахикардию, прогрессирующую артериальную гипотензию, одышку и олигурию (вплоть до анурии). В начальный период чумы эта симптоматическая картина отмечается при всех клинических формах чумы.
Кожная форма проявляется в виде карбункула в области внедрения возбудителя. Карбункул прогрессирует, проходя последовательно следующие стадии: сначала на гиперемированной, отечной коже образуется пустула (выражено болезненная, наполнена геморрагическим содержимым), которая после вскрытия оставляет язву с приподнятыми краями и желтоватым дном. Язва склонна увеличиваться. Вскоре в ее центра образуется некротический черный струп, быстро заполняющий все дно язвы. После отторжения струпа карбункул заживает, оставляя грубый рубец.
Бубонная форма является наиболее распространенной формой чумы. Бубонами называют специфически измененные лимфатические узлы. Таким образом, при этой форме инфекции преимущественным клиническим проявлением выступает регионарный в отношении области внедрения возбудителя гнойный лимфаденит. Бубоны, как правило, единичны, в некоторых случаях могут быть множественными. Первоначально в области лимфоузла отмечается болезненность, спустя 1-2 дня при пальпации обнаруживаются увеличенные болезненные лимфатические узлы, сначала плотные, при прогрессировании процесса размягчающиеся до тестообразной консистенции, сливаясь в единый спаянный с окружающими тканями конгломерат. Дальнейшее течение бубона может вести как к его самостоятельному рассасыванию, так и к формированию язвы, области склерозирования или некроза. Разгар заболевания продолжается с течение недели, затем наступает период реконвалесценции, и клиническая симптоматика постепенно стихает.
Кожно-бубонная форма характеризуется сочетанием кожных проявлений с лимфаденопатией. Локальные формы чумы могут прогрессировать во вторично-септическую и вторично-легочную форму. Клиническое течение этих форм не отличается от их первичных аналогов.
Первично-септическая форма развивается молниеносно, после укороченной инкубации (1-2 дня), характеризуется быстрым нарастанием тяжелой интоксикации, выраженным геморрагическим синдромом (многочисленными геморрагиями в кожных покровах, слизистых оболочках, конъюнктиве, кишечными и почечными кровотечениями), скорым развитием инфекционно-токсического шока. Септическая форма чумы без должной своевременной медицинской помощи заканчивается смертью.
Первично-лёгочная форма возникает в случае аэрогенного пути заражения, инкубационный период при этом также сокращается, может составлять несколько часов или продолжаться о двух дней. Начало острое, характерное для всех форм чумы – нарастающая интоксикация, лихорадка. Легочная симптоматика проявляется ко второму – третьему дню заболевания: отмечается сильный изнуряющий кашель, сначала с прозрачной стекловидной, позднее — с пенистой кровянистой мокротой, имеет место боль в груди, затруднение дыхания. Прогрессирующая интоксикация способствует развитию острой сердечно-сосудистой недостаточности. Исходом этого состояния может стать сопор и последующая кома.
Кишечная форма характеризуется интенсивными резкими болями в животе при тяжелой общей интоксикации и лихорадке, вскоре присоединяется частая рвота, диарея. Стул обильный, с примесями слизи и крови. Нередко – тенезмы (мучительные позывы к дефекации). Учитывая широкое распространение других кишечных инфекций, в настоящее время так и не решен вопрос: является ли кишечная чума самостоятельной формой заболевания, развившейся в результате попадания микроорганизмов в кишечник, или она связана с активизацией кишечной флоры.
Ввиду особой опасности инфекции и крайне высокой восприимчивости к микроорганизму, выделение возбудителя производится в условиях специально оборудованных лабораторий. Забор материала производят из бубонов, карбункулов, язв, мокроты и слизи из ротоглотки. Возможно выделение возбудителя из крови. Специфическую бактериологическую диагностику производят для подтверждения клинического диагноза, либо, при продолжительной интенсивной лихорадке у больных, в эпидемиологическом очаге.
Серологическая диагностика чумы может производиться с помощью РНГА, ИФА, РНАТ, РНАГ и РТПГА. Возможно выделение ДНК чумной палочки с помощью ПЦР. Неспецифические методы диагностики — анализ крови, мочи (отмечается картина острого бактериального поражения), при легочной форме — рентгенография легких (отмечаются признаки пневмонии).
Лечение производится в специализированных инфекционных отделениях стационара, в условиях строгой изоляции. Этиотропная терапия проводится антибактериальными средствами в соответствии с клинической формой заболевания. Продолжительность курса занимает 7-10 дней.
При кожной форме назначают ко-тримоксазол, при бубонной – внутривенно хлорамфеникол со стрептомицином. Можно также применять антибиотики тетрациклинового ряда. Тетрациклином или доксициклином дополняется комплекс хлорамфеникола со стрептомицином при чумной пневмонии и сепсисе.
Неспецифическая терапия включает комплекс дезинтоксикационных мероприятий (внутривенная инфузия солевых р-ров, декстрана, альбумина, плазмы) в сочетании с форсированием диуреза, средства, способствующие улучшению микроциркуляции (пентоксифиллин). При необходимости назначаются сердечно-сосудистые, бронхолитические средства, жаропонижающие препараты.
В настоящее время в условиях современных стационаров при применении антибактериальных средств смертность от чумы довольно низка – не боле 5-10%. Ранняя медицинская помощь, предотвращение генерализации способствуют выздоровлению без выраженных последствий. В редких случаях развивается скоротечный чумной сепсис (молниеносная форма чумы), плохо поддающийся диагностированию и терапии, нередко заканчивающийся скорым летальным исходом.
В настоящее время в развитых странах инфекция практически отсутствует, поэтому основные профилактические мероприятия направлены на исключение завоза возбудителя из эпидемиологически опасных регионов и санацию природных очагов. Специфическая профилактика заключается в вакцинации живой чумной вакциной, производится населению в районах с неблагоприятной эпидемиологической обстановкой (распространенность чумы среди грызунов, случаи заражения домашних животных) и лицам, отправляющимся в регионы с повышенной опасностью заражения.
Выявления больного чумой является показанием к принятию срочных мер по его изолированию. При вынужденных контактах с больными используют средства индивидуальной профилактики – противочумные костюмы. Контактные лица наблюдаются в течение 6 дней, в случае контакта с больным легочной формой чумы производится профилактическая антибиотикотерапия. Выписка больных из стационара производится не ранее 4 недель после клинического выздоровления и отрицательных тестов на бактериовыделительство (при легочной форме – после 6 недель).
источник