Большинство красок, применяемых в микробиологии, принадлежат к производным бензола и добываются из каменноугольной смолы.
Красители применяемые в микробиологии, являются солями двух типов: 1) кислые красители – это те, у которых ион, придающий окраску (хромофор), является анионом (примером может служить эозин); 2) основные красители – те, у которых роль хромофора играет катион (примером может служить метиленовый синий).
Красители первого типа являются кислыми потому, что хромофор, будучи кислотой, при образовании придающей окраску соли, связывается с основанием (NaOH).
Красители второго типа называются основными потому, что хромофор, будучи основанием, при образовании соли связывается с кислотой (HCl)/
Как правило, кислые красители связываются более интенсивно с цитоплазменными (основными) компонентами клетки, а основные – с ядерными (кислыми).
Действие некоторых красителей не зависит от образования солей или других химических соединений с окрашиваемым материалом. Они просто покрывают поверхность, адсорбируясь, растворяясь или осаждаясь в материале.
В процессе окрашивания играют роль как физические, так и химические факторы
Существуют простые и сложные методы окрашивания микропрепаратов.
Для простого метода окрашивания микропрепаратов чаще всего пользуются основными анилиновыми красителями. Очень широко применяют метиловый синий, основной фуксин, кристаллический фиолетовый, тионин.
Простой метод окрашивания может быть применен как для окрашивания убитых микробных клеток в фиксированных микропрепаратах, так и для прижизненной окраски микроорганизмов.
Прижизненной окраской следует считать лишь такую, при которой окрашенные организмы длительное время остаются живыми и способными к размножению. Существует несколько способов прижизненной окраски, в том числе и способ Nakanischi.
При этом способе чистое предметное стекло обливают насыщенным водным раствором метиленовой сини, высушиваю и обтирают сухой тряпочкой до тех пор, пока налет краски не примет светло – голубого оттенка. На покровном стекле приготовляют мазок из исследуемых микробов, после чего не высохший до конца препарат накладывают на предметное стекло с красителем. При помощи микроскопа можно наблюдать, как микробы, оставаясь живыми, не теряя своей активной подвижности (если таковой обладают), постепенно окрашиваются в синий цвет.
Этот метод ценен тем, что при его применении отсутствует опасность образования искусственных продуктов обработки, в возможности выявления некоторых функциональных особенностей микробной клетки.
Среди простых методов окраски существуют как позитивные, так и негативные способы окрашивания.
К простым позитивным методам окраски относится окраска по методу Лнеффлера, а к негативным – окрашивание по методу Бури.
Для окраски по методу Леффлера (Loffler) можно применить раствор метиленового синего (краситель Леффлера), который позволяет выявить многие детали формы и структуры микроорганизмов. Краситель Леффлера представляет собой смесь двух растворов А и Б.
Раствор А: метиловый синий – 0,3г, этиловый спирт – 30,0мл.
Смесь хорошо сохраняется во флаконе с притертой стеклянной пробкой.
Для получения более чистых препаратов, краску можно наливать на мазок покрытый фильтровальной бумагой, или использовать фильтровальную бумагу заранее пропитанную красителем и высушенную. В таком случае на фиксированный мазок накладывают полоску сухой пропитанной красилелем фильтровальной бумаги, а затем на бумагу пипеткой наносят несколько дистиллированной воды и пинцетом или шпателем прижимают фильтровальную бумагу к стеклу. Краситель вымывается из бумаги и окрашивает мазок. По истечении времени окрашивания, фильтровальную бумагу снимают, препарат промывают осторожно струей воды, высушивают и микроскопируют.
В правильно окрашенном и хорошо промытом препарате поле зрения остается светлым и чистым, а окрашенными будут только микробные клетки.
Помимо позитивных способов окраски в некоторых случаях применяются негативные (контрастные) способы. В этом случае микроорганизмы, в которые краситель не проникает, выглядят как светлые частички на равномерно окрашенном фоне.
Очень часто для негативного окрашивания микропрепаратов пользуются жидкой черной тушью («негативный способ» Burri).
По способу Бури фон препарата заливают жидкой тушью. Тушь не является истинным красителем, поэтому тела микробов остаются неокрашенными; вследствие чего получается как бы негативное их изображение.
При этом способе тушь разбавляют водой в соотношении 1:9, 1:1 или 1:2.
Поскольку тушь сама по себе может содержать бактерии, ее стерилизуют, добавляя несколько капель формалина или автоклавируют 30 минут при 110 градусах. Перед употреблением подготовленная тушь (разбавленная и стерильная) должна в течение двух – трех недель сохраняться в спокойном состоянии, чтобы осели взвешенные в ней частицы. При приготовлении тушевых препаратов используется верхняя часть отстоявшейся жидкости.
Каплю черной туши наносят на предметное стекло и тщательно смешивают с каплей микробной взвеси. Смесь тонким слоем размазываю по поверхности предметного стекла краем покровного стеклышка. Когда темный слой высохнет, препарат фиксируют и исследуют с помощью микроскопа. Микробные клетки видны в виде бесцветных телец а темном фоне препарата.
Кроме жидкой туши для негативного окрашивания можно использовать водные растворы конгорот (3%0, нигрозина (10%) и некоторых других красителей. Окрашивание негативными красителями можно проводить двумя способами: либо раствор красителя наносить на сухой фиксированный мазок, после промывки водой и высушивания микроскопировать; либо каплю исследуемой суспензии микробов смешивают с красителем, накрывают покровным стеклом и микроскопируют. И в том, и в другом случае микробные клетки будут бесцветными.
Простой метод позитивного или негативного способа окраски микроорганизмов очень удобен для самых разнообразных целей (изучение формы и расположения клеток, определение размеров, обнаружение капсул у микробных клеток в мазках – отпечатках из органов инфицированного организма и пр.).
Однако простой метод окраски не позволяет дифференцировать микроорганизмы (в том числе и бактерии) сходные по форме и размерам, но принадлежащие к различным видам, простой метод окраски не позволяет обнаружить зрелые споры и цисты, высыпавшиеся из клетки в окружающуюся среду, простой метод окраски не позволяет обнаружить клетки со сложной структурой оболочки и пр.
В силу этого большую ценность представляют сложные методы окраски, позволяющие получить представление не только о форме, размерах, расположении клеток друг относительно друга, по позволяющие дифференцировать микробы и определять структурные детали микробных клеток.
Среди сложных методов окраски большую ценность представляет способ окраски разработанный датским ученым Граммом, позволяющий дифференцировать микроорганизмы на две большие группы, называемые «грамположительными» и «грамотрицательными», что имеет большое значение при идентификации микроорганизмов.
Этот способ окраски называют дифференциальной окраской. В основе дифференциации микробов по Грамму лежит свойство клеточной оболочки и цитоплазматической мембраны.
Основой клеточной стенки грамположительных и грамотрицательных микроорганизмов является пептидогликан. У грамположительных микробов пептидогликан имеет несколько слоев, у грамотрицательных — он однослоен.
У грамположительных микробов, обладающих плотным и многослойным пептидогликаном, образовавшийся комплекс при окраске кристаллическим фиолетовым и последующей обработке йодным раствором не вымывается спиртом, и клетки не обесцвечиваются и сохраняют фиолетовый цвет. В то время как грамотрицательные микробы, имея тонкий слой пептидогликана, обесцвечиваются спиртом. При дополнительной окраске фуксином или сапранином грамотрицательные клетки окрашиваются в сиреневато – красный цвет.
Микроорганизмы, которые сохраняют окраску, называются «грамположительными» и обозначаются «Г+», а обесцвеченные – «грамотрицательными» и обозначаются «Г-».
Показатели дифференциации грамположительных и грамотрицательных микроорганизмов:
Грамположительные микроорганизмы не чувствительны к действию желудочного сока, имеют не сложную структуру. Резистентные к щелочам, чувствительны к лизоциму, пенициллину, йоду. Иммуногенные свойства выражены слабо, оптимум роста при относительно высоком рН. В живом состоянии более проницаемы для красителей, чувствительны к электролитам. Могут быть кислотоустойчивыми и могут образовывать споры. Имеют многослойный пептидогликан и могут содержать тейхоевые кислоты. Клеточная стенка пористая, содержит мало белков, пептиды по составу аминокислот однообразны. Липидов мало, много гликопротеидов (99%).
Грамотрицательные микроорганизмы в большинстве случаев растворяются под действием желудочного сока, растворяются в 1% растворе КОН, чувствительны к кислотам. Малочувствительны к лизоциму, пенициллину, йоду. Хорошо выражены иммуногенные свойства. Оптимум роста при низком рН среды. В живом состоянии плохо проницаемы для анилиновых красителей. Резистентны к слабым электролитам, спор не образуют. Основой клеточной стенки является однослойный пептидогликан, тейхоевая кислота отсутствует. Клеточная стенка малопористая, имеет сложную структуру, содержит все аминокислоты. Липидов много (до 22%), гликопротеидов мало (5 – 9%).
Растворы для окраски по методу Грамма:
1. Раствор А – кристаллический фиолетовый – 2,0г, этиловый спирт 95% — 20,0мл.
2. Раствор Б – щавелевокислый аммоний – 0,8г, дистиллированная вода – 80,0 мл.
Раствор А разводят дистиллированной водой (1:5) и затем смешивают его с равным объемом раствора Б.
3. Раствор Люголя – йод кристаллический – 1г, йодистый калий – 2,5г, дистиллированная вода – 80,0мл. Эту смесь оставляют на 24 часа для растворения йода.
4. Раствор для дополнительной окраски – сапранин или фуксин (2,5% раствор в 95% спирте) – 25 мл. Дистиллированная вода – 75мл.
Методика окраски по методу Грамма:
1. Фиксированный мазок, содержащий микробные клетки, окрасить генцианвиолетом (2 минуты).
2. Слить генцианвиолет, после чего нанести на препарат раствор Люголя (2 минуты).
3. Осторожно слить раствор Люголя и промыть препарат 95% этиловым спиртом (30 секунд. Клетки с многослойным пептидогликаном останутся окрашенными генцианвиолетом, с однослойным пептидогликаном – обесцветятся).
4. Препарат осторожно промыть струей воды.
5. Мазок окрасить раствором фуксина или сапранина (1 – 2 минуты).
6. Препарат осторожно промыть струей воды, высушить на воздухе при комнатной температуре или в потоке теплого воздуха над пламенем горелки, или осторожно промокнуть фильтровальной бумагой.
7. Препарат исследовать при помощи микроскопа.
К сложным дифференциально – диагностическим методам окраски относится также и окраска по методу Циль – Нильсена (Ziehl – Naelsen), позволяющая отличить кислотоустойчивые микроорганизмы от других, не обладающих этим свойством.
Этот метод применяется главным образом для выявления кислотоустойчивых микроорганизмов, имеющих своеобразный химический состав, а именно – высокое содержание в клетке липидов. Окраска по Циль – Нильсену применяется для окраски микобактерий туберкулеза и родственных им микроорганизмов из рода Mycobacterium.
Приготовление и окраска микопрепарата по Циль – Нильсену проводится следующим образом:
1. Готовят обычным способом фиксированный мазок из исследуемого материала (мокрота больного или чистая культура).
2. На фиксированный мазок кладут фильтровальную бумагу и на нее наливают раствор карболового фуксина. Предметное стекло зажимают в пинцет Корне и препарат в течение 4-х минут нагревают над пламенем горелки (по мере испарения жидкости раствор красителя добавляется).
3. Через 4 минуты (по окончанию прогревания) фильтровальную бумагу осторожно снимают с препарата и на мазок на 30 секунд наносится 5 – 10% раствор серной или соляной кислоты приготовленный на 95% этиловом спирте.
4. Через 30 секунд препарат осторожно промывают струей холодной воды и дополнительно докрашивают раствором метиленовой сини.
Механизм окраски кислотоустойчивых микроорганизмов по Циль – Нильсену можно объяснить следующим образом: во время нагревания препарата воск, входящий в состав оболочки, размягчается, и благодаря этому краситель проникает в бактериальную клетку. Остывая, этот воск удерживает краситель, поэтому спирт, с кислотой вымывают краситель только из клеток, не обладающих кислотоустойчивостью. При дополнительной окраске метиленовым синим окрашиваются обесцвеченные клетки и на этом синем фоне будут отчетливо видны кислотоустойчивые бактерии, окрашенные в красный цвет.
Растворы для окраски по Циль – Нильсену:
1. Раствор А – основной фуксин – 0,3г, этилдовый спирт 95% — 10,0мл.
2. Раствор Б – фенол (расплавленные кристаллы) – 5,0г, дистиллированная вода – 95,о мл.
3. Раствор метиловой сини Леффлера или бриллиантовой зелени.
Растворы А и Б смешивают (карболовый фуксин). Смесь хорошо сохраняется.
В микроскопической практике при изучении мазков – отпечатков из органов, мазки из крови, при изучении спирохет, простейших, хламидий, культур тканей широко применяется еще один сложный метод окраски – окраска по Романовскому – Гимза.
Методика окраски по Романовскому – Гимза:
1. Препарат высушивается, фиксируется в жидком фиксаторе (метанол 3 – 5 минут).
2. Препарат высушивают и помещают в стаканчик с рабочим раствором красителя (экспозиция 20 25 минут при 37 градусах , концентрация раствора краски и экспозиция должны быть титрованы). Перекрашенный мазок дифференцируется этиловым спиртом (50 – 60 градусным), споласкивается осторожно водой, высушивается и микроскопируется.
Растворы красителей для окраски по Романовскому – Гимза:
1. Вариант А. Готовят раствор – 3,8г сухой краски, состоящей из смеси эозина и метиленовой сини, растворяют в 250 мл чистого метилового или этилового спирта. Раствор оставляют на несколько дней, часто взбалтывая для лучшего растворения краски. Затем добавляют 250 мл чистого глицерина и оставляют на 3 – 5 дней часто взбалтывая. Полученный раствор – краска Романовского – Гимза.
Перед употреблением краску оттитровывают в разведениях 1:1, 1:2, 1:3 и т.д., приготовленных на дистиллированной воде в течении 20 – 25 минут.
2. Вариант Б. Применяют окраску азур – эозином.
а) 1 г сухой краски Романовского – Гимза (азур и метиленовая синь) растворяют в одном литре дистиллированной воды.
б) 1 г эозина растворяют в одном литре дистиллированной воды.
Эти два раствора хранят отдельно в темном месте в стеклянных емкостях с притертыми пробками.
Для окрашивания препаратов ex tempore готовят рабочий раствор:
10 мл дистиллированной воды
4 мл раствора эозина
8 мл раствора краски Романовского
Необходимым условием для получения хорошей окраски препаратов является качество воды (рН воды должно быть нейтральным).
источник
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Предметные и покровные стекла.
- Чашки Петри.
- Зубоврачебные шпатель и игла.
- Черная и белая бумага.
- Микроскоп.
- Газовая или спиртовая горелка.
- Смесь Никифорова.
- Краска Романовского.
- Едкий натр.
- Эозин.
- Желтая кровяная соль.
- Концентрированная соляная кислота.
- Метиленовая синька.
- Вода.
- Спички.
Мокроту, помещенную в чашку Петри, распластывают с помощью шпателя и иглы до получения полупрозрачного слоя (шпатель и иглу захватывают правой и левой рукой в виде писчего пера); это делают очень осторожно, чтобы не разрушить имеющиеся в мокроте образования. Полупрозрачный слой мокроты изучают с целью выявления в нем линейных и округлых частиц и образований, клочков, отличающихся по цвету и консистенции. Для этого чашку Петри с мокротой располагают попеременно на белом и черном фоне. Найденные образования выделяют из основной массы (слизи, гноя, крови) режущими движениями инструментов, стараясь не повредить выделенные частицы. Полноценным приготовленный препарат будет лишь в том случае, если будут последовательно отобраны все интересующие исследователя частицы и образования. Отобранный материал помещают на предметное стекло. При этом более плотные по консистенции частицы помещают ближе к центру намечаемого препарата, а менее плотные, так же как и слизисто-гнойные, гнойно-слизистые, кровянисто окрашенные образования, — по периферии. Материал покрывают стеклом. Обычно на одном предметом стекле готовят два препарата, что обеспечивает максимальный просмотр отобранного материала. В правильно приготовленных препаратах мокрота не выходит за пределы покровного стекла.
Если мокрота вязкой или тягучей консистенции, то на покровное стекло слегка надавливают, чтобы равномернее распределить материал. Препараты, предназначенные для микроскопического исследования, изучают вначале под малым, а затем под большим увеличением микроскопа при опущенном конденсоре.
Важно уметь находить различные элементы мокроты не только при большом, но и при малом увеличении.
1. Слизь — волокнистая или сетевидная, вместе с форменными эле¬ментами (лейкоцитами, эритроцитами), сероватого цвета.
2. Эпителий — плоский, круглый (альвеолярные макрофаги), цилиндрический (мерцательный).
Плоский эпителий имеет форму полигональных бесцветных клеток с обильной цитоплазмой и одним ядром.
Эпителий цилиндрический, мерцательный (бронхов) (рис. 51, 3) представляет собой продолговатой формы клетки, один из концов которых сужен, а на другом — тупом — нередко видны реснички; ядро, круглой или овальной формы, расположено эксцентрично в широкой части клетки; цитоплазма содержит мелкую зернистость. Иногда (при бронхиальной астме) эпителий бронхов выявляется в виде железистоподобных образований, которые в свежевыделенной мокроте имеют движущиеся реснички.
Рис. 51. Клеточные элементы в мокроте и эластические волокна: лейкоциты (1), альвеолярные макрофаги (2), эпителий бронхов (3), миелин (4), эластические волокна простые (5), коралловидные (6), обызвествленные (7).
Альвеолярные макрофаги — это круглой формы клетки по размерам в несколько раз больше лейкоцитов, с выраженной зернистостью в цитоплазме, из-за которой в большинстве случаев не видно ядра. Зернистость обычно сероватого цвета. Подвергаясь, жировому перерождению, альвеолярные макрофаги становятся более темными, так как капли жира, накапливающиеся в клетке, сильнее преломляют лучи проходящего через них света.
При наличии угольного пигмента часть зернистости приобретает черный цвет. У курильщиков альвеолярные макрофаги содержат буровато-желтую зернистость. Золотисто-желтая зернистость обусловлена наличием в альвеолярных макрофагах кровяного пигмента, содержащего железо (гемосидерин). С целью обнаружения гемосидерина в мокроте используют химическую реакцию.
С препарата, в котором были обнаружены альвеолярные макрофаги с лимонно-желтой или золотисто-желтой зернистостью, снимают покровное стекло. Мокроту подсушивают на воздухе. На 8-10 минут на препарат наливают реактив (смесь равных объемов 3% раствора соляной кислоты и 5% раствора желтой кровяной соли). Через 8-10 минут реактив сливают. Препарат накрывают покровным стеклом и изучают под большим увеличением.
При наличии гемосидерина альвеолярные макрофаги окрашиваются в синий (голубой) цвет (рис. 52).
Рис. 52. Реакция на гемосидерин в мокроте. 1 — до окраски, 2 — после окраски.
3. Миелин (рис. 51, 4) — различной формы матово-серые образования, которые могут находиться в мокроте внеклеточно, а также внутри альвеолярных макрофагов.
Для отличия миелина от капелек жира используют микрореакцию: к материалу, в котором был обнаружен миелин, осторожно прибавляют одну каплю концентрированной H2SO4; при этом миелин окрашивается в оттенки от фиолетового до красного цвета.
4. Нейтрофилы . Морфологически нейтрофилы напоминают лейкоциты, встречающиеся в моче. В гнойной мокроте происходит разрушение лейкоцитов, поэтому в некоторых местах препарата находят зернистую бесструктурную массу (детрит).
5. Эозинофилы . Имеют ряд отличительных от нейтрофилов признаков. Они несколько больше их по размеру, содержат крупную зернистость, благодаря чему выглядят более темными. Их скопления при малом увеличении имеют желтоватый оттенок. Особенно много эозинофилов содержится в желтоватых рассыпчатых клочках мокроты больных бронхиальной астмой. Иногда среди эозинофилов находят кристаллы Шарко-Лейдена. Для более точного распознавания эозинофилов препарат окрашивают.
Техника окраски эозинофилов. Мокроту распределяют по предметному стеклу. Препарат высушивают на воздухе и фиксируют над пламенем горелки. Теплое стекло помещают на 3 минуты в 0,5% спиртовой раствор эозина, а затем промывают водой и красят в течение нескольких секунд 0,5-1% водным раствором метиленовой синьки. Вновь промывают водой, высушивают и изучают под микроскопом с иммерсией. В эозинофилах выявляют красную зернистость (рис. 53). Окрасить эозинофилы можно также способом Романовского. С этой целью препарат окрашивают точно так же, как мазки крови, но только меньше времени (8-10 минут).
Рис. 53. Эозинофильные лейкоциты в мокроте (масляная иммерсия).
6. Эритроциты — неизмененные выглядят так же, как и в моче. В бурых кровянистых частицах они обычно не обнаруживаются.
7. Жирно-зернистые клетки (рис. 54, 1) — округлой формы, в несколько раз больше лейкоцитов, содержат жировые капельки, сильно преломляющие свет.
8. Клетки злокачественных новообразований (рис. 54, 2) — разных размеров, жиро- и вакуольно-перерожденные. Встречаются отдельно и в виде тесных округлых групп или стержневидных образований, луковиц и пр.
Рис. 54. 1 — жирно-зернистые клетки; 2 — железистоподобная группа из атипического эпителия при железистом раке легкого. Нативный препарат. Увеличение 300х. Микрофотография.
9. Эластические волокна (см. рис. 51, 5, 6, 7):
а) простые эластические волокна — блестящие, тонкие, нежные двуконтурные образования, толщина которых равномерна на всем протяжении. Встречаются скоплениями среди гнойных частиц и в мелких плотноватых клочках, в виде обрывков и единичных волокон среди казеозного распада;
б) коралловидные эластические волокна. Представляют собой простые эластические волокна, покрытые мылами. В связи с этим они лишены блеска, грубее и толще простых эластических волокон;
в) обызвествленные эластические волокна. Они грубее и толще простых эластических волокон, часто фрагментированы, некоторые из них напоминают палочковидные образования. Наиболее часто этот вид волокон располагается среди аморфной массы солей извести и капелек жира, что называют обызвествляющим жировым казеозным распадом. Обызвествляющий жировой казеозный распад, обызвествленные эластические волокна, кристаллы холестерина и микобактерии туберкулеза называют тетрадой Эрлиха.
Элементы тетрады Эрлиха легче обнаружить, если при тщательном макроскопическом исследовании мокроты отобрать беловатые рассыпчатые клочки.
В некоторых случаях для отличия коралловидных волокон от обызвествленных используют микрохимическую реакцию. К исследуемому материалу добавляют 1-2 капли 10-20% раствора NaOH; мыла, покрывающие коралловидные волокна, растворяются, и из-под их покрова освобождаются простые эластические волокна; обызвествленные эластические волокна под влиянием воздействия щелочи не изменяются. При обнаружении в нативном препарате эластических волокон препарат обязательно окрашивают по Цилю-Нильсену. В некоторых случаях прибегают к обработке мокроты с целью обнаружения простых эластических волокон.
Техника обработки мокроты с целью выявления эластических волокон . К небольшому количеству мокроты прибавляют равный объем 10% раствора щелочи; смесь нагревают до растворения, а затем разливают в две центрифужные пробирки и центрифугируют, предварительно добавив по 5-8 капель 1% спиртового раствора эозина. Из осадка готовят препарат и рассматривают под микроскопом. Эластические волокна окрашиваются в оранжево-красный цвет (рис. 55).
Рис. 55. Эластические волокна в мокроте.
10. Фибрин — имеет форму тонких волоконец, расположенных параллельными пучками пли сетевидно.
11. Кристаллы гематоидина — ромбовидные или игольчатые, красновато-оранжевого цвета.
12. Холестерин — бесцветные таблички со ступенчатообразными уступами.
13. Кристаллы Шарко-Лейдена (рис. 56) — ромбовидные, бесцветные кристаллы, напоминающие стрелку магнитного компаса.
Рис. 56. Эозинофилы, кристаллы Шарко-Лейдена, спираль Куршмана.
14. Кристаллы жирных кислот (рис. 57) — имеют вид длинных слегка изогнутых серых игольчатых образований.
15. Спираль Куршмана (см. рис. 56) — слизистое, спиралевидное закругленное образование, имеющее центральную нить и мантию. В некоторых случаях спираль имеет либо центральную нить, либо мантию. Наряду со спиралью часто в одном и том же препарате обнаруживают эозинофилы и кристаллы Шарко-Лейдена.
16. Пробка Дитриха (см. рис. 57) — беловатого или желтовато-сероватого цвета комочки творожистой копсистенции, иногда со зловонным запахом, сходные по форме с зернами чечевицы. Состоят из кристаллов жирных кислот, нейтрального жира, детрита и скоплений бактерий.
Рис. 57. Пробка Дитриха. Иглы жирных кислот; жир нейтральный; детрит. Нативный препарат. Увеличение 280х.
17. Рисовидные тельца — округлые, плотные образования. Содержат скопления коралловидных волокон, продуктов жирового распада, мыла, кристаллы холестерина и большое количество микобактерий туберкулеза.
18. Друзы актином ицетов (рис. 58) — при малом увеличении представляют собой округлые образования с резко очерченными контурами, желтоватого цвета, с аморфной серединой и с более темной окраской по краям; при большом увеличении центр друзы представляет собой скопление лучистого грибка, нити которого на периферии заканчиваются колбовидными вздутиями. При окраске по Граму нити мицелия грибка грамположительны, а колбовидные вздутия грамотрицательны.
Рис. 58. Друзы актиномицетов.
19. Элементы эхинококка (рис. 59) — хитиновая оболочка эхинококкового пузыря (в тонких местах прозрачна и имеет нежную параллельную исчерченность), крючья и сколексы эхинококка.
Рис. 59. Элементы эхинококка. 1 — пленка эхинококкового пузыря, 2 — крючья эхинококка, 3 — сколексы
источник
выделяемый при отхаркивании патологически измененный трахеобронхиальный секрет с примесью слюны и секрета слизистой оболочки носа и придаточных (околоносовых) пазух.
В норме трахеобронхиальный секрет состоит из слизи, вырабатываемой серозными и слизистыми железами, бокаловидными клетками слизистой оболочки трахеи и крупных бронхов, и клеточных элементов (преимущественно альвеолярных макрофагов и лимфоцитов). Так же, как слюна и носовая слизь, он обладает бактерицидными свойствами. Трахеобронхиальный секрет способствует выведению ингалированных частиц, продуктов метаболизма и клеточного детрита за счет механизма мукоцилиарного клиренса (очищения), обеспечиваемого деятельностью реснитчатого эпителия. Объем трахеобронхиального секрета в норме колеблется от 10 до 100 мл в сутки; все это количество здоровый человек обычно проглатывает.
Появление М. связано с увеличением количества и изменением состава трахеобронхиального секрета (например, при инфекционном или аллергическом воспалении слизистой оболочки бронхов, действии раздражающих факторов вдыхаемого воздуха), а также с нарушением механизмов его удаления. При воспалительных заболеваниях бронхов меняются реологические свойства трахеобронхиального секрета, что в сочетании с увеличением количества продуцируемой слизи и ослаблением функции реснитчатого эпителия ведет к застою и инфицированию слизи в бронхах.
Характер, состав и свойства мокроты. Количество М. при различных патологических процессах колеблется от нескольких миллилитров до 1—1 1 /2л в сутки.
Цвет М. определяется ее составом. Она может быть бесцветной или иметь желтоватый оттенок, особенно при примеси гноя; зеленоватый цвет свидетельствует о застое гнойной мокроты. М. ярко-желтого, так называемого канареечного цвета бывает при наличии в ней большого количества эозинофилов, например при эозинофильном инфильтрате легкого, бронхиальной астме. Ржавый цвет М. чаще наблюдается при крупозной пневмонии в связи с появлением гематина, который освобождается при распаде эритроцитов, проникших в просвет альвеол путем диапедеза. Черная М. возможна при пневмокониозах, обусловленных вдыханием содержащей частицы угля пыли. Некоторые лекарственные средства (например, рифампицин) окрашивают М. в красноватый цвет. Обычно М. не имеет запаха. Гнилостный запах она приобретает при абсцессе и гангрене легкого в результате развития гнилостной микрофлоры.
По консистенции различают жидкую, густую и вязкую мокроту, по характеру — слизистую, слизисто-гнойную, гнойную и кровянистую. Слизистая М. — бесцветная, обычно вязкой консистенции; особенно тягучей и прозрачной (стекловидной) она бывает после приступа бронхиальной астмы. Слизисто-гнойная М. образуется при многих заболеваниях бронхов и легких (в т. ч. при обструктивном бронхите, инфекционно-аллергической форме бронхиальной астмы), густая слизисто-гнойная М. может отходить при кашле в виде слепков бронхов, особенно густая и вязкая слизисто-гнойная М. выделяется при муковисцидозе. Гнойная М. наблюдается редко, например при прорыве эмпиемы плевры в просвет бронха. Кровянистая М., содержащая прожилки или сгустки крови либо алую пенистую кровь, является признаком легочного кровотечения.
В состав М., как и в состав нормального трахеобронхиального секрета, входят белки, преимущественно гликопротеины, углеводы, нуклеотиды и липиды. Большинство биохимических компонентов диффундирует из плазмы, но некоторые синтезируются в легких и бронхах, в частности сурфактант, секреторный иммуноглобулин А и муцин. Муцины с высоким содержанием сиаловых кислот во многом определяют эластические свойства М. Вода составляет 89—95% трахеобронхиальной слизи и находится большей частью в структурном комплексе с гликопротеинами. В трахеобронхиальной слизи содержатся электролиты — ионы натрия, хлора, кальция.
Иммунологические свойства трахеобронхиального секрета, а также М. определяются такими веществами, как лактотрансферрин, секретируемый клетками слизистых желез бронхов (бактерицидное действие лактотрансферрина объясняется его способностью связывать железо, необходимое для размножения микроорганизмов), лизоцим, интерферон, секреторный иммуноглобулин А.
Максимальное количество секреторного иммуноглобулина А содержится в секрете трахеи и крупных бронхов. Основное защитное действие его проявляется способностью агглютинировать бактерии, препятствовать их прилипанию к мембране эпителиальных клеток, тормозить рост и размножение бактерий. Секреторный иммуноглобулин А имеет значение и в защите организма от вирусов.
В мокроте постоянно присутствуют ингибиторы протеаз: α1-антитрипсин в свободной форме и в комплексе с протеолитическими ферментами лейкоцитов, α2-макроглобулин, антихимотрипсин, а также низкомолекулярные «ингибиторы с широким спектром антипротеазной активности. Комплекс ингибиторов протеаз трахеобронхиального секрета предотвращает действие протеолитических ферментов бактериального, лейкоцитарного и макрофагального происхождения, освобождающихся в процессе воспаления.
Гнойная М. содержит значительное количество коллагеназы, эластазы и химотрипсиноподобных ферментов, которые способствуют расщеплению белковых макромолекул, улучшению реологических свойств М. и ее выделению; однако эти ферменты при их избытке могут повреждать слизистую оболочку бронхов, паренхиму и эластические структуры легкого.
Исследование мокроты. М. собирают утром натощак в стерильную плевательницу. Перед отхаркиванием необходимо, чтобы больной прополоскал рот слабым раствором антисептического средства, затем кипяченой водой, чтобы в М. было меньше примеси слюны. При невозможности получить М. обычным путем назначают раздражающие ингаляции с изотоническим раствором хлорида натрия. Для микробиологического и цитологического исследований также могут быть использованы материалы бронхоальвеолярного смыва (см. Лаваж бронхоальвеолярный), бронхиального смыва или аспират, полученные при бронхоскопии (Бронхоскопия).
Для изучения М. в клинической практике применяют макроскопическое, микроскопическое (в т.ч. цитологическое), микробиологическое, иногда биологическое и физико-химическое исследования.
Макроскопическое исследование включает определение суточного количества, цвета, запаха, консистенции и характера М. Обращают внимание также на расслоение М. при стоянии в стеклянной посуде. Слизистая и слизисто-гнойная М. не расслаивается, гнойная разделяется на два слоя (верхний — серозный и нижний — гнойный); иногда при гнойных процессах в легких М. может разделяться на три слоя (верхний — слизисто-гнойный, пенистый; средний — серозный; нижний — гной и продукты тканевого распада).
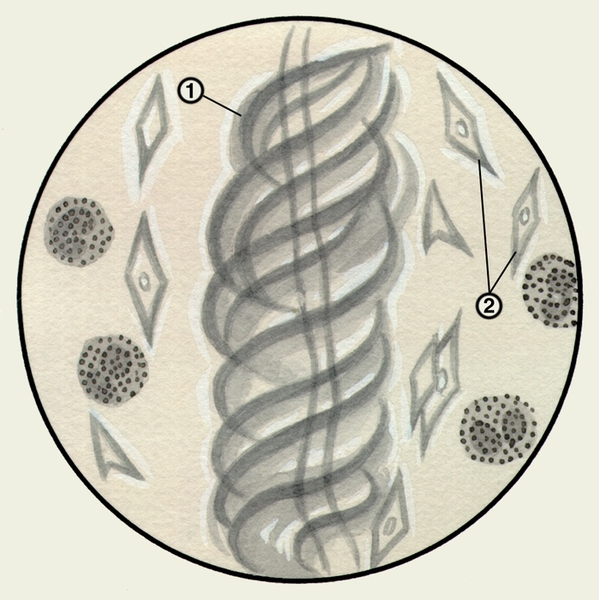
Микроскопическое исследование заключается в изучении неокрашенных (нативных) и окрашенных препаратов М. При малом увеличении микроскопа или под лупой в неокрашенных препаратах М. можно обнаружить спирали Куршманна (рис. 1) — беловатые прозрачные штопорообразные волокна, в центре которых находится извитая блестящая нить; их наличие указывает на спастическое состояние бронхов (например, при бронхиальной астме, обструктивном бронхите). При бронхиальной астме возможно выявление в М. кристаллов Шарко — Лейдена (рис. 1) — блестящих гладких бесцветных ромбов различной величины, образующихся вследствие распада эозинофилов.
При асбестозе легких (см. Пневмокониозы) иногда определяют так называемые асбестовые тела (асбестовые волокна, покрытые оболочкой из белка и гемосидерина), имеющие вид золотисто-желтых образований со вздутыми концами. Так называемые рисовидные тельца, или линзы Коха, — зеленовато-желтые, довольно плотные образования творожистой консистенции величиной от булавочной головки до небольшой горошины, характерные для деструктивных форм туберкулеза, при современных методах лечения туберкулеза встречаются в М. редко. Обнаружение большого количества эластических волокон в виде сильно преломляющих свет тонких нитей, окрашивающихся эозином в розовый цвет (рис. 2), свидетельствует о деструкции легочной ткани любой этиологии. При микроскопии М. могут быть выявлены крючья и пузыри эхинококка, выделяющиеся при свежем разрыве эхинококковой кисты легкого, а также различные микроорганизмы,
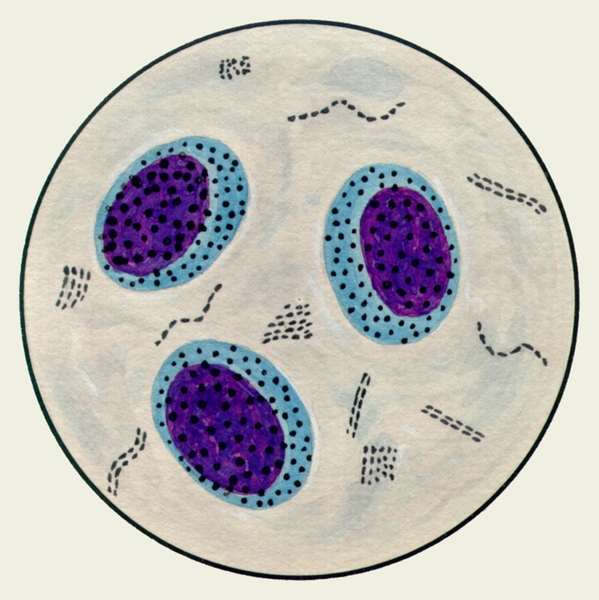
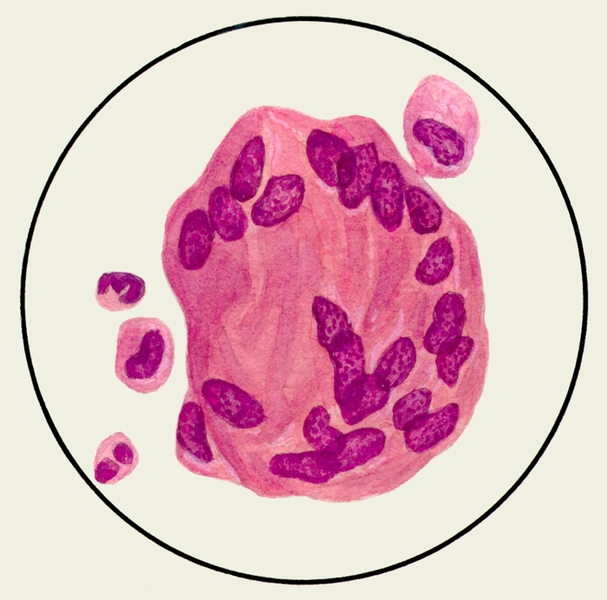
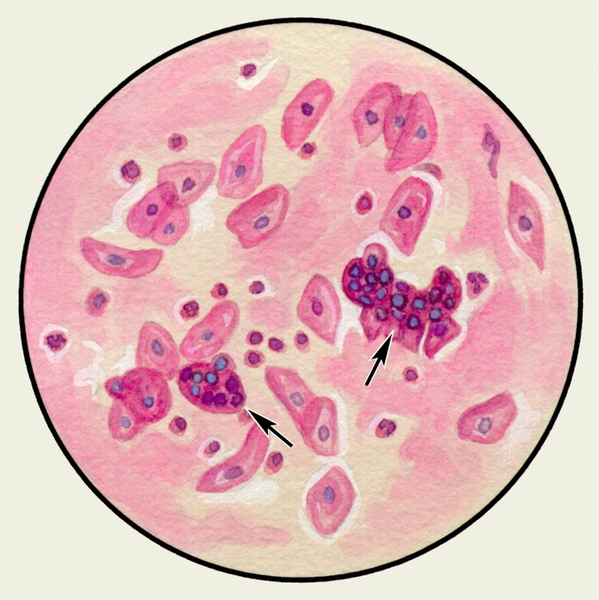
В мокроте могут обнаруживаться клетки, характерные для определенных заболеваний. Так называемые клетки сердечных пороков, или гемосидерофаги — альвеолярные макрофаги, содержащие в цитоплазме включения гемосидерина (рис. 3), встречаются при застойных явлениях в легких в связи с сердечной недостаточностью, при инфаркте легкого, идиопатическом гемосидерозе легких, кровохарканье любого генеза. Значительное количество эозинофилов в М. отмечается при бронхиальной астме. Клетки Пирогова — Лангханса (рис. 4) — многоядерные гигантские клетки (диаметром до 60 мкм) овальной или круглой формы — в М. определяются редко, они характерны для туберкулеза легких.
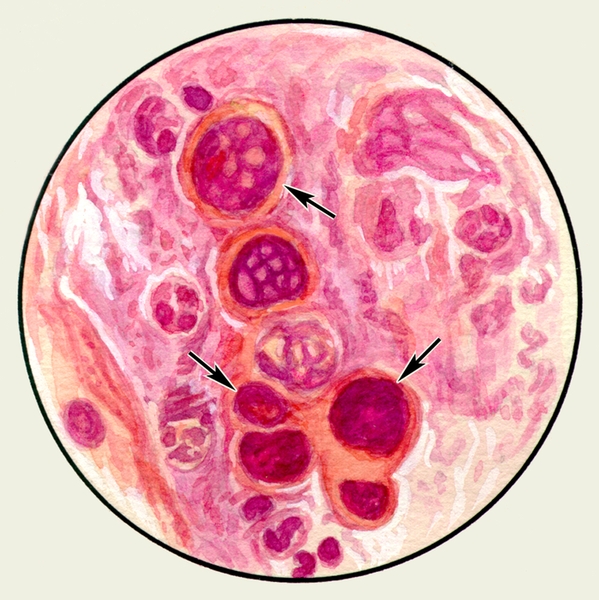
Цитологическое исследование М. с учетом соотношения ее клеточных элементов имеет значение для оценки активности заболеваний бронхов и легких, помогает установить преимущественность инфекционного или аллергического воспаления. Цитологические методы используют для диагностики бронхогенного рака легкого, особенно при профилактическом обследовании лиц, относящихся к группе повышенного риска. Обнаружение в М. опухолевых клеток (рис. 5, а, б), которые могут располагаться отдельно или образовывать большие скопления, дает возможность не только подтвердить диагноз злокачественной опухоли легких, но иногда и определить ее гистологический тип.
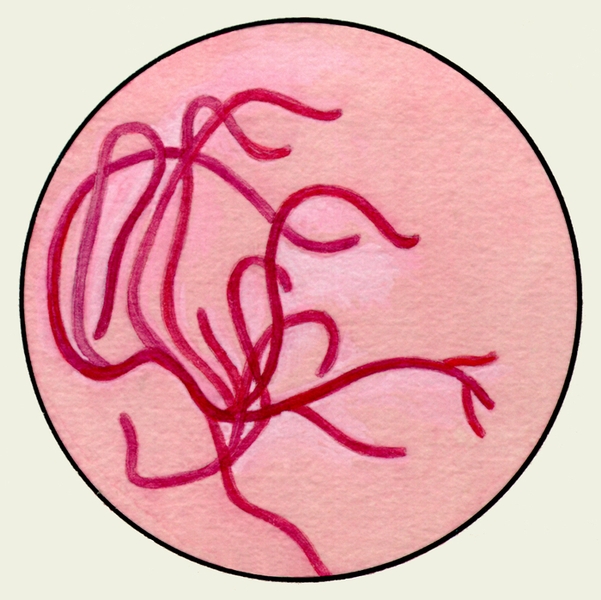
Микробиологическое исследование М. включает микроскопию (бактериоскопию), выделение чистых культур, определение чувствительности микрофлоры к различным лекарственным средствам и некоторые другие методы. Из трахеобронхиального секрета наиболее часто выделяют следующие микроорганизмы: патогенные — Streptococcus pneumoniae, Haemophilus influenzae; условно-патогенные — неклостридиальные анаэробы, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus hemolyticus, Klebsiella pneumoniae, Escherischia coli, Pseudomonas aeruginosa, Proteus, Candida, Streptococcus viridans, Streptococcus anhemolyticus, Neisseria catarrhalis.
В окрашенных и неокрашенных препаратах М. можно обнаружить дрожжеподобные грибки Candida в виде почкующихся клеток и нитей псевдомицелия, что, однако, не является достаточным основанием для диагноза кандидоза легких; выявление друз актиномицетов, окутанных гнойной массой, имеет диагностическое значение.
Бактериоскопия особенно важна для выявления микобактерий туберкулеза, которые при использовании метода Циля — Нельсена окрашиваются фуксином в красный цвет. Исследование окрашенного мазка М., подготовленного обычным способом, дает положительный результат при содержании более 100 000 микобактерий туберкулеза в 1 мл мокроты. В связи с этим при отрицательных результатах в случае подозрения на туберкулез прибегают к методам концентрации. Метод флотации дает возможность определить наличие микобактерий туберкулеза при их концентрации около 50 000 в 1 мл мокроты. 10—15 мл мокроты, собранной за 1—2 сут., гомогенизируют, встряхивая в течение 5—10 мин с равным объемом 0,5% раствора едкого натра, затем добавляют 100 мл дистиллированной воды и 0,5 мл бензина и снова встряхивают 5—10 мин. Примерно через 30 мин на поверхности образуется флотационное кольцо, состоящее из капелек бензина, содержащих микобактерии туберкулеза. Из материала флотационного кольца готовят препараты, которые исследуют методами световой и люминесцентной микроскопии (см. Микроскопические методы исследования).
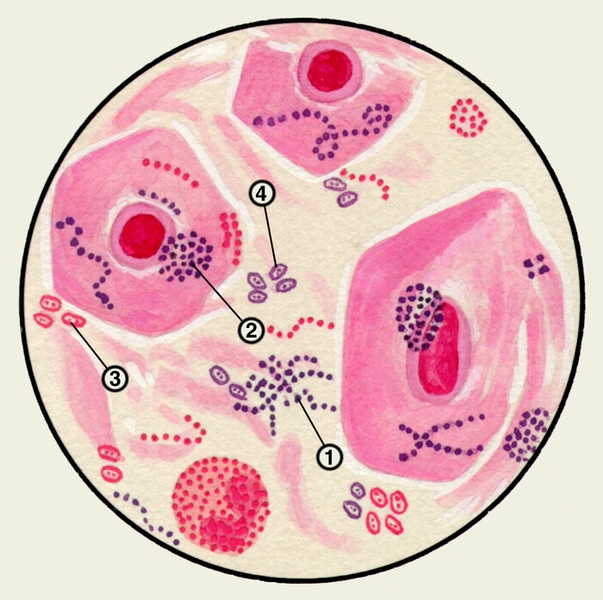
В мокроте, окрашенной по Граму, при микроскопии можно выявить стрептококки, образующие цепочки, стафилококки, часто соединяющиеся в виде гроздей винограда, диплобактерии Фридлендера, пневмококки (рис. 6). Бактериоскопическое исследование М. для установления причины неспецифических заболеваний бронхов и легких имеет, как правило, ориентировочное значение.
Для выявления возбудителей неспецифических воспалительных заболеваний бронхов и легких проводят посев мокроты и смывов из бронхов на соответствующие Питательные среды. Выросшие микробы идентифицируют (см. Микробиологическая диагностика) и определяют их чувствительность к антибактериальным препаратам. С целью установления роли выделенного из мокроты микроорганизма используют методы определения их количества, а также реакцию непрямой иммунофлюоресценции выделенной культуры с сывороткой больного.
Основными условиями эффективности микробиологических исследований являются получение патологического материала до начала антибактериального лечения, исследование его в ближайшие часы после получения, а также правильный выбор необходимых для данного случая технических приемов обработки. Динамическое изучение микрофлоры дает возможность проследить смену возбудителя. Наибольшее диагностическое значение имеет обнаружение при двух — трех последующих исследованиях большого количества одного и того же патогенного или условно-патогенного микроорганизма.
Биологическое исследование — наиболее чувствительный метод выявления микобактерий туберкулеза. Центрифугат М., обработанный серной кислотой для уничтожения неспецифической микрофлоры, вводят животному (обычно морской свинке) подкожно в паховую область или внутрибрюшинно. При наличии в М. микобактерий туберкулеза через 1—1 1 /2 мес. у животного может быть обнаружено специфическое туберкулезное воспаление. Применение биологического метода ограничено в связи с необходимостью длительного наблюдения за животными (при отсутствии признаков развивающегося туберкулеза оно продолжается 3 мес.).
Физико-химическое исследование. Для изучения вязкости и эластичности М. используют ротационный вискозиметр. Величину рН определяют с помощью рН-метра. Реакция М. во многом зависит от характера и интенсивности воспаления бронхов; как правило, она слабощелочная, кислой становится при разложении М., примешивании к ней желудочного содержимого.
Общее содержание белка, определяемое биуретовым методом, или методом Лаури, колеблется в очень широких пределах, т.к. во многом обусловлено степенью экссудации плазмы в просвет бронхов. В мокроте при пневмонии содержится 1—2% белка; много белка появляется в М. при отеке легкого.
Библиогр.: Лабораторные методы исследования в клинике, под ред. В.В. Меньшикова, с. 91, М., 1987; Руководство по пульмонологии, под ред. Н.В. Путова и Г.Б. Федосеева, с. 110, Л., 1978.
Рис. 6. Стрептококки (1), стафилококки (2), диплобактерии Фридлендера (3), пневмококки (4); окраска по Граму.
Рис. 3. Микропрепарат мокроты. Альвеолярные макрофаги, содержащие в цитоплазме включения гемосидерина темно-синего цвета; реакция Перльса.
Рис. 1. Микропрепарат мокроты. Спирали Куршманна (1), кристаллы Шарко — Лейдена (2) в неокрашенном препарате мокроты больного бронхиальной астмой.
Рис. 4. Микропрепарат мокроты. Клетка Пирогова — Лангханса в мокроте больного туберкулезом легких; окраска гематоксилином и эозином.
Рис. 5б). Микропрепарат мокроты. Опухолевые клетки — клетки аденокарциномы (указаны стрелками), окраска гематоксилином и эозином.
Рис. 5а). Микропрепарат мокроты. Опухолевые клетки — полиморфные клетки плоскоклеточного рака (указаны стрелками), окраска гематоксилином и эозином.
Рис. 2. Микропрепарат мокроты. Эластические волокна в виде тонких розовых нитей; окраска эозином.
патологическое отделяемое из дыхательных путей.
Мокрота гнилостная (s. putridum, s. foetidum) — гнойная М. с гнилостным запахом.
Мокрота гнойная (s. purulentum) — М., содержащая гной; наблюдается, например, при прорыве абсцесса легкого в просвет бронха.
Мокрота жемчужная — М. с округлыми опалесцирующими включениями, состоящими из атипичных клеток и детрита; наблюдается при плоскоклеточном раке бронхов.
Мокрота кровянистая (s. sanguinolentum) — М. с примесью крови; наблюдается, например, при кровотечении из стенок дыхательных путей.
Мокрота ржавая (s. rubiginosum) — кровянистая М., содержащая включения ржавого цвета, образующиеся в результате разложения гемоглобина в дыхательных путях: наблюдается, например, при пневмониях, туберкулезе.
Мокрота серозная (s. serosum) — жидкая пенистая М., выделяющаяся при отеке легких.
Мокрота слизистая (s. mucosum) — бесцветная, прозрачная, вязкая М., практически не содержащая клеточных элементов.
Мокрота трехслойная — обильная гнойная М., разделяющаяся при отстаивании на три слоя: верхний — сероватый пенистый, средний — водянистый прозрачный и нижний — грязного серо-зеленого цвета, содержащий гной и остатки некротизированных тканей; наблюдается при гангрене легких.
источник
Исследование мокроты предусматривает определение физических свойств мокроты, ее микроскопическое исследование в нативном мазке и бактериологическое исследование в окрашенных препаратах.
Мокроту, получаемую при откашливании утром до приема пищи, собирают в чистую сухую склянку. Перед исследованием больной должен почистить зубы и тщательно прополоскать рот водой.
Мокроту помещают в чашку Петри, рассматривают на светлом и темном фоне, описывают ее свойства. Количество мокроты за сутки при различных патологических процессах может быть различно: так например, при бронхите — скудное (5-10 мл), при абсцессе легкого, бронхоэктазах — большое количество (до 200—300 мл).
Деление на слои наблюдается в случаях опорожнения больших полостей в легком, например, абсцесса легкого. В этом случае мокрота образует 3 слоя: нижний слой состоит из детрита, гноя, верхний слой — жидкий, на поверхности его иногда имеется третий — пенистый слой. Такую мокроту называют трехслойной.
Характер: характер мокроты определяет содержание слизи, гноя, крови, серозной жидкости, фибрина. Характер ее может быть слизистый, слизисто-гиойный, слизисто-гнойно-кровянистый и т.п.
Цвет: зависит от характера мокроты, от выдыхаемых частиц, которые могут окрашивать мокроту. Так например, желтоватый, зеленоватый цвет зависит от наличия гноя, «ржавая» мокрота -от распада эритроцитов, встречается при крупозной пневмонии. Прожилки крови в мокроте или красная мокрота может быть при примеси крови (туберкулез, бронхоэктазы). Серый и черный цвет придает мокроте уголь.
Консистенция: зависит от состава мокроты, жидкая — в основном от наличия серозной жидкости, клейкая — при наличии слизи, вязкая — фибрина.
Запах: свежевыделенная мокрота обычно без запаха. Неприятный запах свежевыделенной мокроты обычно появляется при абсцессе легкого, при гангрене легкого — гнилостный.
Нативные препараты готовят, выбирая материал из разных мecт мокроты, берут также для исследования все частицы, выделяющиеся окраской, формой, плотностью.
Отбор материала производят металлическими палочками, помещают его на предметное стекло и покрывают покровным. Материал не должен выходить за покровное стекло.
Лейкоциты: всегда содержатся в мокроте, количество их зависит от характера мокроты.
Эозинофилы: распознаются в нативном препарате по более темной окраске и наличию в цитоплазме четкой, одинаковой, преломляющей свет зернистости. Часто располагаются в виде больших скоплений. Эозинофилы встречаются при бронхиальной астме, других аллергических состояниях, гельминтозе, эхинококке легкого, новообразованиях, эозинофильном инфильтрате.
Эритроциты: имеют вид дисков желтого цвета. Единичные эритроциты могут встречаться в любой мокроте, в большом количестве — в мокроте, содержащей примесь крови: новообразованиях легкого, туберкулезе, инфаркте легкого.
Клетки плоского эпителия: попадают в мокроту из полости рта, носоглотки, большого диагностического значения не тлеют.
Цилиндрический мерцательный эпителий: выстилает слизистую оболочку гортани, трахеи, бронхов. В большом количестве обнаруживается при острых катарах верхних дыхательных путей, бронхитах, бронхиальной астме, новообразованиях легкого, пневмосклерозе и др.
Альвеолярные макрофаги: большие клетки различной величины, чаще круглой формы, с наличием в цитоплазме включений черно-бурого цвета. Встречаются чаще в слизистой мокроте с небольшим количеством гноя. Обнаруживаются при различных патологических процессах: пневмонии, бронхитах, профессиональных заболеваниях легких и др. Альвеолярные макрофаги, содержащие гемосидерин, старое название — «клетки сердечных пороков», имеют в цитоплазме золотисто-желтые включения. Для их выявления применяют реакцию на берлинскую лазурь. Ход реакции: кусочек мокроты помещают на предметное стекло, прибавляют 2 капли 5% раствора соляной КИОЛОТЫ и 1-2 капли 5% раствора желтой кровяной соли. Перемешивают стеклянной палочной и по-крывают покровным стеклом. Гемосидерин, лежащий внутриклеточно, окрашивается в голубой или синий цвет. Эти клетки обнаруживаются в мокроте при застойных явлениях в легких, инфарктах легкого.
Жирное перерождение клетки (липофаги, жировые шары): чаще округлые, цитоплазма их заполнена жиром. При прибавлении к препарату судана Ш капли окрашиваются в оранжевый цвет. Группы таких клеток встречаются при новообразованиях легкого, актиномикозе, туберкулезе и др.
Эластические волокна: в мокроте имеют вид извзитых блестящих волокон. Как правило располагаются на фоне лейкоцитов и детрита. Наличие их указывает на распад ткани легкого. Обнаруживаются при абсцессе, туберкулезе, новообразованиях легкого.
Коралловые волокна: Грубые ветвящиеся образования с бугристыми утолщениями вследствие отложения на волокнах жирных кислот и мыл. Их обнаруживают в мокроте при кавернозном туберкулезе.
Обызвествленные эластические волокна — грубые, пропитанные солями извести палочковидные образования. Обнаруживают при распаде петрифицированного очага, абсцессе легкого, новообразованиях, Элемента распада петрифицированнго очага носят название тетрады Эрлиха: I) обызвествленные эластические волокна; 2)аморфные соли извести; 3) кристаллы холестерина; 4) микобактерии туберкулеза.
Спирали Куршмана_- уплотнены, закрученные в спираль слизевые образования. Центральная часть резко преломляет свет и выглядит спиралью, по периферии свободно лежащая слизь образует мантию. Спирали Куршмана образуются при бронхиальной астме.
Кристаллические образования: кристаллы Шарко-Лейдена, вытянутые блестящие ромбы, можно обнаружить в желтоватых кусочках мокроты, содержащих большое количество эозинофилов. Их образование связывают с распадом эозинофилов,
Кристаллы гематоидина: имеют форму ромбов и иголок золотистого цвета. Образуются при распаде гемоглобина при кровоизлияниях, распаде новообразований. В препарате мокроты видны обычно на фоне детирита, эластических волокон.
Кристаллы холестерина: бесцветные четырехугольники с обломанными ступенеобразным углом, обнаруживаются при распаде жирно перерожденных клеток, в полостях. Встречаются при туберкулезе, абсцессе легкого, новообразованиях.
Пробки Дитриха: мелкие желтовато-серые зернышки с неприятным запахом, содержатся в гнойной мокроте. Микроскопически представляют собой детрит, бактерии, кристаллы жирных кислот в виде игл и капелек жира. Образуются при застое мокроты в полостях при абсцессе легкого, бронхоэктазах.
Исследование на туберкулезные микобактерии: Препарат готовят из гнойных частиц мокроты, высушивают
на воздухе и фиксируют над пламенем горелки. Окрашивают по
Методика окрашивания: Реактивы:
2) 2% спиртовой раствор соляной кислоты,
3) водный раствор 0,5% метиленового синего.
1. На препарат кладут кусочек фильтровальной бумаги и наливают раствор карболового фуксина.
2. Препарат нагревают над пламенем горелки до появления паров, охлаждают и снова нагревают (так 3 раза).
3. С остывшего стекла снимают фильтровальную бумагу. Обесцвечивают мазок в солянокислом спирте до полного отхождения краски.
5. Докрашивают препарат метиленовнм синим 20-30 секунд.
6. Промывают водой и высушивают на воздухе. Микроскопируют с иммерсионной системой. Туберкулезные микобактерии окрашиваются в красный цвет,
все остальные элементы мокроты и бактерии — в синий. Туберкулезные микобактерии имеют вид тонких, слегка изогнутых палочек с утолщениями на концах или посередине.
При окраске по Цилю-Нильсону в красный цвет красятся также кислотоупорные сапрофиты. Дифференциальная диагностика туберкулезных микробактерий и кислотоупорных сапрофитов ведется методами посева и заражения животных.
Исследование мокроты может проводиться также методом флотации. Метод Потенжера: ход исследования:
1. Свежевыделенную мокроту (не более 10-15 мл) помещают в узкогорлую бутылку, приливают двойное количество едкой щелочи, смесь энергично встряхивают (10-15 мин).
2. Приливают I мл ксилола (можно бензина, толуола) и около 100 мл дистиллированной вода для разжижения мокроты. Снова встряхивают 10-15 мин.
3. Доливают дистиллированную воду до горлышка бутылки и оставляют стоять на 10-50 мин.
4. Образовавшийся верхний слой (беловатый) снимают по каплям пипеткой и наносят на предметные стекла, предварительно нагретые до 60°. Каждую последующую каплю наносят на подсохшую предыдущую.
5. Препарат фиксируют и красят по Цилю-Нильсону.
Исследование на другие бактерии:
Другие бактерии, встречающиеся в мокроте, например, стрептококки, стафилококки, диплобациллы и др. могут быть распознаны только методом посева. Бактериологическое исследование препарата в этих случаях имеет только ориентировочное значение. Препараты красят метиленовым синим, фуксином или по граму. Окраска по Граму: Реактивы: I) карболовый раствор генцианвиолета,
4) 40% раствор карболового фуксина.
1. На фиксированный препарат кладут полоску фильтровальной бумаги, наливают раствор генцианвиолета, красят 1-2 мин.
2. Бумажку снимают и препарат заливают раствором Люголя на 2 минуты.
3. Раствор Люголя сливают и прополаскивают препарат в спирте до серого цвета.
4. Промывают водой и окрашивают 10-15 секунд раствором фуксина.
| 5. МОКРОТА ПРИ РАЗЛИЧНОЙ ПАТОЛОГИИ ОРГАНОВ ДЫХАНИЯ | |||
| Нозологическая форма | Колич. Макрос. Хар-р изучен. | Микроскопия | |
| I | |||
| Бронхит | Скудное,за- | Цилиндрический эпи- | |
| тем боль- | телий ,лейкоциты,иног- | ||
| шое. Слизи — | да эритроциты,много | ||
| стая или | флоры,макрофаги . | ||
| слизисто- | |||
| гнойная | |||
| Бронхопневмо- | Большое | Цилиндрический эпите- | |
| ния | количество | лий, альвеолярный эпи- | |
| слизистой | телий, лейкоциты, | ||
| -или слизис- | пневмококки | ||
| ТО-ГНОЙНОЙ | |||
| Крупозная | Скудное,за- | Свертки | Макрофаги, лейкоциты, |
| пневмония | тем обиль- | фибрина, | эритроциты, кристал- |
| ное к-во | изменен- | лы гематоидина, | |
| ржавой мо- | ная | гемосидерин, пневмо- | |
| кроты | кровь | кокки | |
| Бронхиальная | Скудное, | Спирали | Цилиндрический эпи- |
| астма | слизистая | Куршмана | телий, кристаллы |
| Шарко-Лейдена, | |||
| эозинофилы | |||
| Бронхоэктати- | Обильное | Пробки | Лейкоциты сплошь, |
| ческая бо- | (утром- | Дитриха | кристаллы жирных |
| лезнь | полным | кислот,гематоидина, | |
| ртом) | холестерина, обильная разнообразная флора |
Приложение: посуда и оборудование: Препарат промывают водой и высушивают на воздухе. Смотрят с иммерсией.
2. Инструменты для отбора мокроты: металлические палочки с расплющенными концами, препаровальные иглы и др.
7. Дезинфицирующая жидкость.
Абсцесс легкого Обильное, гнойная, со зловонным запахом Обрывки ткани легкого. Сплошь лейкоциты, эластические волокна, кристаллы жирных кислот, гематоидина, хо-лестерша, разнообразная обильная флора
Различное, рисовидные тельца слизисто-гнойная, иногда с примесью крови Микобактерии туберкулёза, эластические волокна, различные кристаллы
Различное, слизисто-кровянистое Обрывки ткани. Атипические клетки.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9346 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Клинический анализ мокроты и бронхо-альвеолярной жидкости
Это патологическое отделяемое, выделяющееся с кашлем из органов дыхания при их заболеваниях.
Главные компоненты мокроты: слизь, серозная жидкость, клеточные элементы крови и дыхательных путей, фибрин, микробная флора.
Цель исследования мокроты: установить характер, локализацию, этиологию патологического процесса.
Требования к получению материала
Сбор материала: утро, после туалета полости рта. Получают мокроту путем откашливания, а не отхаркивания – в чистую сухую стеклянную широкогорлую банку или чашку Петри (в специализированных стационарах – в специальную плевательницу – градуированные стеклянные баночки с герметически закрывающимися крышками). Материал доставляют сразу, хранение нежелательно.
Особенности работы с мокротой
С мокротой работают как с заразным материалом:
v Чашки с материалом не взбалтывать во избежание образования инфицирующих аэрозолей.
v Готовить и окрашивать препараты необходимо в вытяжном шкафу.
v Все манипуляции выполнять на специальном лотке (дезинфекция каждый день огнем либо хлорамином). Столы смачивать дезраствором на 6 часов, а затем промывать теплым содовым раствором.
v По окончании работы остатки мокроты слить в специальную посуду и обеззаразить сухой хлорной известью в соотношении 1:5 в течение 1 часа.
v Микроскоп протереть 70 0 спиртом.
Клинический анализ мокроты
Ø определение физических свойств
Ø микроскопия нативного материала и окрашенных мазков
Физические свойства мокроты
Количество мокроты – определяется в мерной стеклянной посуде. Небольшое — при острых воспалительных заболеваниях бронхов и легких.
Большое (200-300 мл) — из полостей в легочной ткани.
Расслоение мокроты при стоянии (следствие разницы в относительной плотности составных частей):
на 3 слоя – пенистый, серозный, гнойный — при гнилостном бронхите, гангрене легких, бронхоэктазах.
на 2 слоя — серозный, гнойный — при абсцессе легкого: верхний – серозный.
Определяют, располагая чашку с мокротой на белом фоне.
v Слизистая и серозная бесцветная или беловато-серая.
v Гнойная- зеленовато-желтая.
v Разные оттенки красного — при появлении крови.
v Ржавая — при крупозной пневмонии, туберкулезе легких с распадом, инфаркте легкого.
Консистенцию определяют с помощью препаровальной иглы над чашкой Петри.
v Мокрота почти вся тянется за иглой — консистенция тягучая (гной).
v Тянется в виде толстой нити – вязкая (слизь, гной).
v Тянется в виде тонкой и быстроотрывающейся нити — умеренно вязкая (слизь, гной).
v Не приподнимается над чашкой – студенистая (примесь фибрина).
v полужидкая и жидкая консистенция (серозная).
v Запаха обычно не имеет. Зловонный, гнилостный при задержке в бронхах и при распаде легочной ткани.
Определяется при осмотре, зависит от соотношения различных компонентов:
Ø кровянисто-слизистая и т д.
Преобладающий субстрат ставят на первое место.
Дополнительные признаки при осмотре мокроты
v Наличие патологических примесей (кусочки ткани при распаде злокачественной опухоли, рисовидные зерна при туберкулезе)
v спирали Куршмана (плотные извитые нити — при бронхиальной астме)
v пробки Дитриха — небольшие беловато-сероватые комочки, при раздавливании издающие зловонный запах — при хроническом абсцессе, бронхоэктатической болезни. Состоят из детрита, бактерий, жирных кислот, капелек жира.
v друзы актиномицетов — желтоватые зернышки в виде крупы — при актиномикозе
Включает изучение нативных и окрашенных препаратов.
Подготовка к исследованию: Узким шпателем или иглой выбрать кусочек величиной с булавочную головку →на предметное стекло, накрыть покровным стеклом (материал не должен выходить за пределы покровного стекла).
Ø под малым увеличением (7х8) – обнаружение элементов, встречающихся в мокроте в небольшом количестве (эластические волокна, спирали Куршмана и т.д.)
Ø под большим (7х40) — детальное исследование мазка. При необходимости окрашивания покровное стекло сдвигают, отмечают на предметном интересующее место, затем препарат высушивают и окрашивают.
N.B! Необходимо исследовать все частицы, отличающиеся от фона мокроты.
Элементы нативного препарата мокроты
v волокнистые образования
v кристаллические образования
Клеточные элементы нативного препарата мокроты
v Плоский эпителий – из полости рта. Единичный встречается всегда. Большое количество — примесь слюны. Диагностического значения не имеет.
v Цилиндрический мерцательный эпителий — эпителий слизистой оболочки бронхов и трахеи — в больших количествах при бронхиальной астме и остром бронхите.
Клеточные элементы нативного препарата мокроты (продолжение)
Лейкоциты —встречаются в любой мокроте. В слизистой мокроте — едининичные, а в гнойной -сплошь покрывают поле зрения.
Эритроциты — единичные в любой мокроте, в большом количестве в кровянистой мокроте при застое, инфаркте легких.
Альвеолярные макрофаги — при бронхитах, пневмониях и профессиональных заболеваниях легких (пылевые клетки — кониофаги), застойных явлениях в легких (сидерофаги – Мф, содержащие гемосидерин, определяют реакцией на берлинскую лазурь). пороках сердца.
Опухолевые клетки попадают в мокроту при распаде опухоли в бронхах.
Волокнистые образования в нативном препарате мокроты
Эластические волокна – элементы соединительной ткани. Следствие деструкции ткани. Имеют вид извитых, блестящих, тонких волокон. Обнаруживаются при туберкулезе, абсцессе, гангрене, новообразованиях.
Обызвествленные эластические волокна – грубые, толстые, пропитанные солями палочковидные образования — при распаде петрифицированного туберкулезного очага.
Спирали Куршмана –образуются при спастическом состоянии бронхов и наличии в них слизи. Во время кашлевого толчка вязкая слизь выбрасывается в просвет более крупного бронха, закручиваясь спиралью. Появляются при БА, бронхитах, иногда при опухолях легкого, сдавливающих бронхи.
Кристаллические образования в нативном препарате мокроты
Кристаллы Шарко-Лейдена – образуются из распадающихся эозинофилов. Для выявления необходимо выдерживание мокроты в течение 24 часов. Встречаются при БА (и на высоте приступа и в межприступном периоде)., при глистных поражениях легких.
Кристаллы гематоидина – продукт распада гемоглобина. Образуются в глубине гематом и обширных кровоизлияний, в некротизированной ткани.
Кристаллы холестерина – образуются при распаде жироперерожденных клеток, при задержке мокроты в полостях — при туберкулезе, новообразованиях, абсцессе.
Тетрада Эрлиха – обызвествленный детрит, обызвествленные эластические волокна, кристаллы холестерина, микобактерии туберкулеза – при распаде обызвествленного первичного туберкулезного очага.
Окрашенные препараты мокроты
Приготовление: При необходимости окрашивания покровное стекло после микроскопии нативного препарата сдвигают, отмечают на предметном стекле интересующее место, затем препарат высушивают, окрашивают по Романовскому или Папенгейму.
Окрашенные препараты мокроты (продолжение)
Элементы окрашенных препаратов:
Нейтрофилы составляют основную массу лейкоцитов в окрашенном мазке. Могут быть дегенеративные — в гнойной мокроте.
Эозинофилы отдельные или скоплениями, сособенно при БА.
Гистиоциты встречаются постоянно в различных количествах.
Эпителиоидные клетки — клетки туберкулезной гранулемы — при туберкулезе, саркоидозе.
Клетки Пирогова-Ланхганса – гигантские многоядерные клетки, входят в состав туберкулезной гранулемы. В мокроте встречаются редко.
Плоский эпителий, эпителий бронхов, реснитчатые клетки, бокаловидные клетки – единичные.
Бактериоскопическое исследование мокроты
Ø микроскопия препаратов, окрашенных по Циль-Нильсену — для выявления микобактерий туберкулеза
Ø микроскопия препаратов, окрашенных по Граму — для изучения микрофлоры мокроты (стрептококки, стафилококки и т.д.).
Исследование мокроты на микобактерии туберкулеза
1-через 1-2 часа после сна (под наблюдением медицинского работника).
2 – в тот же день через несколько часов после взятия первой пробы.
Необходимое количество материала — 3-5 мл мокроты, мокроту откашливать из глубоких отделов легких!
Исследование мокроты на микобактерии туберкулеза (продолжение)
Подготовка препаратов: Выбрать плотные гнойные частицы мокроты из 4-6 разных мест, распределить по предметному стеклу тонким слоем (или растереть комочки между двумя предметными стеклами). Высушить на воздухе 15-30 мин, фиксировать над пламенем спиртовки.
Основные ошибки – слишком толстые препараты, плохая фиксация, фиксация плохо высушенных мазков, слишком длительная фиксация (обугливание мазков).
Окраска по Циль-Нильсену и микроскопия
Методика окрашивания (инструкция МЗ РБ): на мазки – фильтровальная бумага, сверху карболовый фуксин Циля → медленно нагреть над пламенем спиртовки до появления пара (но не закипания!) → выдержать 5 мин при комнатной температруе→ удалить фильтровальную бумагу → ополоснуть стекло под проточной водой до полного удаления краски → обработать 25% раствором серной кислоты до полного отхождения краски → смыть → фиксировать 96 0 этиловым спиртом 5 мин → промыть водой → докрасить 0,3% водным раствором метиленового синего 60 сек →промыть, высушить, микроскопировать.
Окраска по Циль-Нильсену и микроскопия (продолжение)
Микроскопия: Просмотр не менее 100 полей зрения под иммерсией. Если не обнаружены – еще 100 полей. В сомнительных случаях – весь мазок. Микробактерии окрашиваются в красный цвет (тонкие, слегка изогнутые палочки), остальные элементы мокроты и бактерии – в синий. Подсчитывают количество на 100 полей.
Выражение результата бактериоскопии
1-9 на 100 полей – указать число
После просмотра мазки обрабатывают толуолом или ксилолом для удаления иммерсионного масла. Мазки с обнаруженными микобактериями туберкулеза хранят в течение года.
Исследование мокроты методом флотации
Метод накопления (флотации) – метод Поттенджера — применяется при подозрении на туберкулезный процесс в легких после трехкратного отрицательного исследования мокроты на микобактерии туберкулеза обычным способом.
Методика — мокроту обрабатывают ксилолом или бензолом, встряхивают → возбудитель в связи с гидрофобностью всплывает с пеной →из пены готовят мазок и окрашивают по Цилю-Нильсену.
Микроскопия препаратов мокроты, окрашенных по Грамму
Используется для выявления другой бактериальной флоры в мазке. Грамположительные бактерии (стрептококки, стафилококки, пневмококки, дифтерийные палочки и др.) – фиолетового цвета.
Грам-отрицательные (диплобациллы Фридлендера — пневмобациллы, палочки брюшного тифа, катаральные микрококки и т.д.) – красного цвета.
Стрептококки (в виде цепочек), стафилококки (грозди винограда) – при гнойных заболеваниях легких. Пневмобациллы – при пневмониях и других легочных заболеваниях. Пневмококки – возбудители крупозного воспаления легких. Исследование по Граму имеет ориентировочное значение – далее следует делать посев.
Мокрота при различных заболеваниях
Слизисто-гнойная или гнойно-слизистая. Небольшое количество лейкоцитов, единичные эритроциты. В значительном количестве клетки эпителия бронхов. При хроническом – с дегенеративными изменениями.
Мокрота скудная, слизистая, вязкая, бесцветная. Много эозинофилов, единичные эритроциты, клетки эпителия бронхов, разное количество лейкоцитов, кристаллы Шарко-Лейдена, спирали Куршмана.
Мокрота при различных заболеваниях (продолжение)
Мокроты много (при прорыве в бронх), при стоянии расслаивается на 2 слоя. Микроскопия – лейкоциты, эритроциты, фибрин, эластические волокна (признак деструкции ткани легкого), кристаллы гематоидина, микробная флора.
Мокроты много с гнилостным запахом, расслаивается на 3 слоя. Микроскопия – много лейкоцитов в стадии распада, эластические волокна, кристаллы гематоидина.
Мокроты много по утрам (переход из лежачего положения), чаще гнойного характера, иногда с гнилостным запахом. Небольшое количество лейкоцитов, единичные эритроциты, пробки Дитриха. Эластических волокон не содержит.
Мокрота при различных заболеваниях (продолжение)
v в начальной стадии: мокроты мало – слизистая, вязкая с примесью отдельных гнойных комочков. Лейкоцитов и альвеолярного эпителия мало. Микобактерий может на быть.
v в поздней стадии – обызвествленные эластические волокна, признаки казеозного распада (крошковатые белые массы), кристаллы холестерина, микобактерии.
Наиболее часто плоскоклеточный (45-60%), недифференцированный (20-40%), аденокарцинома (9-12%). В мокроте – клеточные элементы рака со слизью, гноем, кровью, комплексы атипичных клеток с признаками злокачественности.
Общеклиническое исследование бронхиального и бронхоальвеолярного смыва
Бронхиальный смыв: с помощью фибробронхоскопа вводят в просвет бронха 50 мл изотонического раствора хлористого натрия с последующей аспирацией. Бронхоаьвеолярный смыв: с помощью фибробронхоскопа катетер продвигают на 6-7 см внутрь сегментарного бронха, дробно вводя 4 порции по 50 мл изотонического раствора хлористого натрия с последующей аспирацией. Эти смешанные порции – бронхоальвеолярный смыв.
Состав бронхиального смыва в норме
| Клетки | Содержание, % |
| Бронхиальный эпителий | 5 — 20 |
| Цилиндрический эпителий | 4 – 15 |
| Плоский эпителий | 1 — 5 |
| Макрофаги | 64 — 68 |
| Нейтрофилы | 5 — 11 |
| Лимфоциты | 2 — 4 |
| Тучные клетки | 0 – 0,5 |
| Эозинофилы | 0 – 0,5 |
Состав бронхоальвеолярного смыва в норме
| Клетки | Содержание % | Клетки | Содержание % |
| Общее кол-во клеток, шт. | 10 — 15 | Эозинофилы | |
| Макрофаги | 84 — 99 | Эритроциты | |
| Лимфоциты | 1 — 14 | Недифференцированные лимфоциты | |
| Полиморфно-ядерные | 0,1 — 4 | Дифференцированные лимфоциты: Т-клетки: — хелперы — супрессоры | |
| Реснитчатые | 1 — 5 | ||
| В — клетки | 5 — 10 |
Клинико-диагностическое значение исследования БС и БАС
Показания: оценка уровня и характера воспаления в трахеобронхиальном дереве. Клинические возможности: Установление характера и оценка динамики эндобронхита
| Тип эндобронхита | Цитоз (Ц), •10 9 /л | Альвео-лярные макро-фаги, % | Нейтрофи-лы (НЛ), % | Лимфо-циты, % | Микро-флора, % |
| Нет эндобронхита | 0,3 | 88,1 | 5,6 | 5,1 | |
| Катаральный | 1,9 | 32,2 | 48,0 | 20,6 | |
| Катарально-гнойный | 2,5 | 2,4 | 82,5 | 15,6 | |
| Гнойный | 23,6 | 3,1 | 94,2 | 2,5 |
Оценка динамики альвеолита
Дифференциальная диагностика неспецифической легочной патологии
| Клетки | норма | БА | ЭП | ГП | С | ИФА | ХБ |
| Макрофаги | |||||||
| Лимфоциты | |||||||
| Нейтрофилы | 0,5 | ||||||
| Эозинофилы | 0,5 |
Условные обозначения: БА – бронхиальная астма; ЭП – эозинофильная пневмония; ГП – гиперчувствительный пневмонит; С – саркоидоз; ИФА – идиопатический фиброзирующий альвеолит; ХБ – хронический бронхит
Дата добавления: 2014-01-11 ; Просмотров: 3494 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник