Техника приготовления препарата синовиальной жидкости для микроскопического исследования
Препараты для микроскопического исследования (нативные и окрашенные) могут быть приготовлены как непосредственно из СЖ без центрифугирования, так и из осадка, полученного путем центрифугирования образца СЖ (например, для определения кристаллов).
Если СЖ мутная с низкой вязкостью, ее можно сразу наносить на предметное стекло.
Для приготовления нативного препарата капля СЖ наносится на предметное стекло и покрывается покровным.
Мазок для последующей окраски готовится аналогично мазку крови: на край предметного стекла наносят каплю СЖ, шлифованным краем другого стекла (или пластикового шпателя) под углом 45 ◦ выравнивают каплю по стеклу и эатем быстрым движением с небольшим нажимом, чтобы предотвратить разрушение клеток, распределяют по стеклу, не доходя до края стекла на 1 – 1,5 см.
Для получения большей концентрации клеток в микроскопическом препарате можно использовать приготовление мазка на основе толстой капли. На стекло наносится большая (толстая) капля СЖ, которая распределяется по нему шлифованным стеклом медленно и без нажима. Высушивают, фиксируют и окрашивают азур-эозином.
Методика забора крови из пальца, подсчет количества эритроцитов в периферической крови.
Методика подсчета эритроцитов в камере Горяева. Развести образец исследуемой крови в 200 раз в 0,9% растворе NaCl или растворе Гайема (берется 20 мкл крови и 4 мл раствора). Камеру и покровное стекло насухо протереть марлей. Недопускается использование для протирки ватных тампонов из-за остающихся на стекле волокон. Аккуратно притереть покровное стекло к камере, слегка надавливая на него до появления цветных колец Ньютона. Заполнить камеру разведенной кровью и выдержать 1 минуту для прекращения движения клеток. При малом увеличении (окуляр ×10, объектив ×8) посчитать эритроциты в 5 больших квадратах разделенных на 16 малых (т.е. в 80 малых квадратах). Рекомендуется считать клетки в квадратах, расположенных по диагонали. Расчет числа эритроцитов осуществляют, исходя из разведения крови (200) и числа малых квадратов (80), по формуле: X = (a×4000×200) / 80, где Х – число эритроцитов в 1 мкл крови; а – число эритроцитов, посчитанных в 80 малых квадратах камеры Горяева. Практически, после сокращений в формуле, количество посчитанных эритроцитов умножают на 10 000.
Техника окраски препарата мокроты по Цилю-Нильсону.
Метод используется для окраски спор и кислотоустойчивых бактерий (микобактерии туберкулеза). Кислотоустойчивость связана с наличием в клеточной стенке мяколовых кислот. Метод Циль-Нильсена основан на использовании концентрированных красителей прогревания.
1. Фиксированный мазок покрывают плоской фильтровальной бумагой и наливают на неё феноловый фуксин Циля. Мазок подогревают над пламенем горелки до появления паров, затем отводят для охлаждения и добавляют новую порцию красителя. Подогревание повторяют 2—3 раза. После охлаждения снимают фильтровальную бумагу и промывают препарат водой.
2. Препарат обесцвечивают путем погружения или нанесения на него 5%-го раствора серной кислоты и промывают несколько раз водой.
3. Окрашивают препараты водно-спиртовым раствором метиленового синего 3—5 минут, промывают водой и высушивают.
При окраске по методу Циля — Нельсена кислотоустойчивые бактерии приобретают интенсивно красный цвет, остальная микрофлора окрашивается в светло-синий цвет.
источник
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Предметные и покровные стекла.
- Шпатели и иглы.
- Смесь Никифорова.
- Газовая или спиртовая горелка.
- Пастеровская пипетка с резиновым баллончиком.
- Водяная баня с мостиком.
- Иммерсионное масло.
- Микроскоп.
- Фильтровальная бумага.
- Пинцеты Корне.
- Бумажки Синева.
- Основной фуксин.
- 96° этиловый спирт.
- Фенол.
- Глицерин.
- Концентрированная соляная кислота.
- Метиленовая синька.
- Дистиллированная вода.
- Генцианвиолет.
- Реактив Люголя.
- Едкий натр (NaOH).
- Бензин или ксилол.
Для бактериоскопического исследования готовят обычно два препарата: один для обнаружения микобактерий туберкулеза и другой для обнаружения прочих микроорганизмов. Для первого препарата отбирают те же частицы, которые были предназначены для микроскопии, для второго — гнойные частицы. Взятый материал распределяют по предметному стеклу до получения достаточно тонкой ажурной сеточки (материал на первом стекле распределяют на 2/3 его поверхности, на втором — в центре).
Оба препарата фиксируют троекратным проведением над пламенем горелки. Первый препарат окрашивают по Цилю — Нильсену, второй — по Граму.
Для окраски препаратов по Цилю-Нильсену необходимы следующие краски и реактивы:
- Фуксин Циля: основного фуксина 1 г, глицерина 4 капли, этилового спирта 96° 10 мл, карболовой кислоты (5% раствор фенола) 5 мл, дистиллированной воды 90 мл. К фуксину, помещенному в фарфоровую ступку, прибавляют глицерин, хорошо растирают, постепенно приливают карболовую кислоту, спирт и воду. Фильтруют.
- 3% раствор солянокислого спирта: 3 мл концентрированной соляной кислоты удельного веса 1,19 и 97 мл 96° этилового спирта.
- 0,2 % водный раствор метиленовой синьки — 1 г метиленовой синьки растворяют в 500 мл дистиллирован- вой воды.
Техника окраски . На фиксированный препарат кладут полоску фильтровальной бумаги (уже и короче предметного стекла), на которую наливают в избытке фуксин Циля. Затем препарат нагревают до появления паров (достаточно троекратно медленно провести его над пламенем горелки), дают ему остыть в течение 3-5 минут, сбрасывают с помощью пинцета бумажку, промывают препарат водой и наливают на него 3% раствор солянокислого спирта для обесцвечивания на 20 секунд. После этого препарат промывают водой и вновь повторяют обесцвечивание. Материал должен быть серовато-розового цвета. Затем на препарат на 20-30 секунд наливают 1: 500 водный раствор метиленовой синьки, краску сливают, препарат промывают водой и высушивают, установив в вертикальном положении на полоску фильтровальной бумаги.
Высушенный препарат рассматривают под микроскопом с иммерсией, с поднятым конденсором.
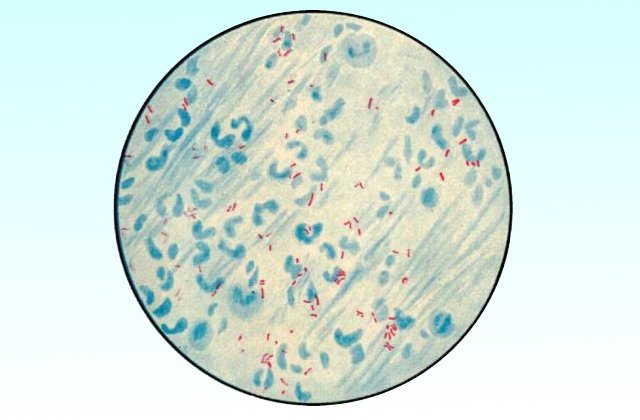
В препарате микобактерии туберкулеза (рис. 60) красного цвета, нежные, тонкие, слегка изогнутые, иногда зернистые. Иногда обнаруживают микобактерип туберкулеза в виде так называемых осколков (в составе тетрады Эрлиха).
Рис. 60. Микобактерии туберкулеза в мокроте. 1 — окраска по Цилю-Нильсену, 2 — в люминесцентном микроскопе.
Все остальные элементы, в том числе и другие микроорганизмы, окрашены в синий цвет. С целью обнаружения мпкобактерий туберкулеза препарат тщательно исследуют, продвигая от одного продольного края к другому и поперек мазка. Во всех сомнительных случаях рекомендуют обработать препараты жавелевой водой
Результат исследования оформляют, используя следующую формулировку: «микобактерип туберкулеза не обнаружены» или «микобактерип туберкулеза обнаружены», и отмечают приблизительное их количество, например, «единичные в препарате», «единичные в поле зрения» и т. д.
В настоящее время находит все большее распространение люминесцентный способ обнаружения микобактерий туберкулеза в мокроте. Микобактерип туберкулеза имеют золотисто-желтое свечение на черном фоне препарата (рис. 60, 2).
В тех случаях, когда количество микобактерий туберкулеза в мокроте незначительно, для их обнаружения применяют метод обогащения (флотация), который состоит в следующем. В бутылку с нешироким горлышком (емкостью 250 мл) помещают 12-20 мл мокроты, добавляют равный объем 0,5% раствора КОН и встряхивают 5-10 минут. Затем приливают около 10 мл дистиллированной воды и 0,5-1 мл бензина или ксилола, взбалтывают 10-15 минут и доливают дистиллированную воду гак, чтобы горлышко бутылки было заполнено. Смесь оставляют на 1-2 часа до образования на поверхности жидкости сливкообразного слоя. На два предметных стекла, заранее расположенных на мостике над водяной баней, нагретой до 60-65°, каплями, с помощью пастеровской пипетки, 5-6 раз наносят сливкообразный слой, каждый раз после подсыхания предыдущей капли. Мазки окрашивают фуксином Циля на водяной бане (без дополнительной фиксации) в течение 10 минут, промывают водой, 3-4 минуты обесцвечивают 3% раствором солянокислого спирта, вновь обмывают водой, докрашивают 0,2% водным раствором метиленовой синьки, высушивают и исследуют под микроскопом.
Для окраски препаратов по Граму требуются следующие краски и реактивы:
- Разведенный фуксин Циля (фуксин Пфейффера): 1 часть фуксина Циля + 9 частей дистиллированной воды.
- Реактив Люголя.
- 1 % спиртовой раствор генцианвиолета — 1 г генцианвиолета растворяют в 100 мл 96° этилового спирта. Этот раствор краски можно заменить бумажкой, приготовленной по методу Синева (белую фильтровальную бумажку пропитывают 1% спиртовым раствором генцианвиолета, затем высушивают и разрезают на мелкие квадратики соответственно размеру мазка).
Техника окраски . На фиксированный препарат накладывают бумажку Синева и смачивают ее водой (при отсутствии бумажки Синева ее заменяют белой фильтровальной бумажкой, на которую наносят несколько капель 1% спиртового раствора генцианвнолета). Через 1-2 минуты бумажку сбрасывают и на препарат наливают 1-2 капли реактива Люголя. Через 1-2 минуты препарат обесцвечивают 1-2 каплями 96° этилового спирта до появления бледно-серой окраски материала, смывают водой, на 10-15 секунд наносят сруксин Пфейффера, после чего вновь смывают водой и высушивают. В препаратах могут быть обнаружены (рис. 61) стафилококки, стрептококки, диплококки, палочки Пфейффера, спирохеты Плаута-Венсана, актиномицеты и другие микроорганизмы.
Рис. 61. Различные микроорганизмы в мокроте: диплококки (1), палочки Пфейффера (2), стрептококки (3), стафилококки (4), диплобациллы Фридлендера (5), симбиоз Венсана (6), мицелий актиномицет (7).
После проведенного исследования мокроту сжигают или обеззараживают. Последнее достигается следующими способами: а) автоклавированием в течение одного часа при 1,5 атм.; б) кипячением в течение одного часа в 1-2% растворе соды; в) обработкой 5% раствором лизола, карболовой кислоты или смесью, состоящей из равных объемов 5% раствора хлорамина и 5% раствора сернокислого аммония, в течение 12-24 часов. После обеззараживания посуду тщательно моют водой и высушивают.
Металлические предметы (шпатели, иглы) обеззараживают прокаливанием над огнем. Во избежание переноса микроорганизмов из одной порции мокроты в другую шпатель и иглу немедленно прокаливают после отбора соответствующих частиц.
Покровные стекла опускают в небольшую плоскую чашечку с 40% раствором серной кислоты на 12-24 часа. Затем кислоту сливают, а стекла неоднократно промывают водопроводной и дистиллированной водой. Вымытые стекла высушивают и используют для последующих исследований.
источник
Один из наиболее широко используемых способов диагностики туберкулёза лёгких — это окрашивание мазка мокроты по Цилю-Нильсену. В чём суть этого метода? Почему этот анализ назначают при туберкулёзе? Насколько достоверны его результаты?
Окрашивание по Цилю-Нильсену позволяет окрасить бактерии, которые устойчивы к воздействию кислот. К таким относятся возбудители туберкулёза, в том числе легочных форм, и лепры. При данной диагностической пробе их окраска получается контрастной по отношению к остальной части мазка.
Сначала подготовленный мазок обрабатывают фуксином Нильсена, нагревают на горелке. Это повторяют несколько раз, добавляя краситель. Затем излишки фуксина смывают водой и обесцвечивают мазок раствором серной кислоты. Следующий этап — окраска метиленовым синим, к которому чувствительно всё, кроме кислотоустойчивых бактерий и структур.
Для диагностики туберкулёза лёгких используют различные методы исследования мокроты, которая выделяется при кашле у пациентов с этой патологией. Этот способ диагностики позволяет дифференцировать болезнь и подтвердить факт выделения микобактерий в окружающую среду.
Это далеко не единственная методика, но она используется практически во всех лабораториях, где происходит определение микобактерий. Обычно анализ проводят перед началом противотуберкулёзной терапии и несколько раз во время лечения.
Для наиболее точного результата первый забор материал для исследования должен происходить до начала приёма медикаментов, контейнеры для мокроты можно брать только стерильные. Также крайне нежелательно, чтобы между моментом забора материала и его исследованием прошло более часа, особенно летом.
Необходимо следить за тем, чтобы мокрота как можно меньше контактировала с ротовой полостью. В таком случае результат может получиться искаженным. Перед окраской по Цилю-Нильсену проводится обработка диагностического мазка по Грамму. Если количество лейкоцитов и эпителиальных клеток высокое, что является признаком того, что мокрота из носоглотки, а не нижних дыхательных путей, стоит повторить забор материала.
При окраске по методике Циля-Нильсена микобактерии туберкулёза окрашиваются контрастно по отношению к остальной части мазка.
Признаки положительного результата:
Длина, интенсивность, толщина палочек немного зависит от их возраста (растущие или взрослые формы) и метода выделения (выращенная на питательной среде, от больного до или после терапии).
Но в любом случае внешний вид микобактерий достаточно специфичен, что сводит к минимуму вероятность ложного положительного результата.
Основным минусом диагностики туберкулёза лёгких окраской по Цилю-Нильсену является то, что при начальных стадиях болезни в мокроте содержится слишком маленькое для обнаружения количество микобактерий или они вообще не выделяются.
- Исследование проходит очень быстро, результаты готовы через несколько часов после сдачи диагностического материала.
- Используются доступные для большинства лабораторий реактивы.
- Метод даёт возможность сделать вывод о том, выделяется ли палочка наружу, то есть определить степень заразности (открытая или закрытая форма туберкулёза).
- Помогает быстро и недорого диагностировать тяжелые формы с неблагоприятным прогнозом.
- Материал для исследования можно взять быстро и безболезненно и у взрослых, и у детей, кроме самых маленьких.
Проведение нескольких проб у одного пациента повышает вероятность выявления микобактерий в мазке, если он болен. Результат считается позитивным, даже если палочка туберкулёза была обнаружена только в одном из 3 исследований. В сомнительных ситуациях назначаются дополнительные анализы.
источник
Метод Грама (Gram). Относится к сложным методам окраски и позволяет дифференцировать грамположительные и грамотрицательные бактерии, что является важным таксономическим признаком. Результат окраски определяется особенностями строения клеточной стенки бактерий. При окраске генцианвиолетом и последующем воздействии раствора Люголя образуется комплексное соединение генцианвиолета и йода с пептидогликаном, которое при обработке спиртом удерживается в клетках грамположительных бактерий, имеющий многослойный пептидогликан и вымывается из грамотрицательных бактерий, имеющих тонкий слой пептидогликана. При дополнительной окраске водным раствором фуксина грамотрицательные бактерии приобретают красный цвет.
Таблица 4 Метод Грама
| Этапы окраски | Цвет бактерий | |
| 1. | На фиксированный мазок поместить фильтровальную бумажку, пропитанную генцианвиолетом, смочить водой, 2-3 минуты | Все бактерии окрашиваются в фиолетовый цвет |
| 2. | Снять бумажку, слить с препарата оставшуюся краску и налить раствор Люголя на 1 минуту | Все бактерии остаются фиолетовыми |
| 3. | Для дифференцирования нанести на мазок этиловый спирт в течение 3-6 с, промыть водой | Грамположительные бактерии остаются фиолетовыми, грамотрицательные обесцвечиваются |
| 4. | Нанести фуксин Пффейфера (водный раствор фуксина) на 1-2 мин, промыть водой, высушить | Грамположительные остаются фиолетовыми, грамотрицательные окрашиваются в красный цвет |
Метод Циля-Нильсена. Относится к сложным методам окраски и позволяет дифференцировать кислотоустойчивые и некислотоустойчивые бактерии.
Таблица 5 Метод Циля-Нильсена
| Этапы окраски | Цвет бактерий | |
| 1. | На фиксированный мазок нанести карболовый раствор фуксина Циля через полоску фильтровальной бумаги и подогреть препарат в пламени горелки до появления паров (повторить 3-4 раза) | Все бактерии окрашиваются в красный цвет |
| 2. | Снять бумагу, промыть мазок водой | Все бактерии остаются красными |
| 3. | Для дифференцирования нанести 5% раствор серной кислоты на 1-2 минуты | Кислотоустойчивые бактерии остаются красными, некислотоустойчивые обесцвечиваются |
| 4. | Нанести водный раствор метиленового синего и докрасить 3-5 мин, промыть водой, высушить | Кислотоустойчивые остаются красными, некислотоустойчивые окрашиваются в синий цвет |
Кислотоустойчивые бактерии имеют особое строение клеточной стенки, содержащей большое количество сложных липидов (миколовая и фтиоловая кислоты, воск D, глико- и фосфолипидовы), что делает эти бактерии кислото-, щелоче- и спиртоустойчивыми. Клеточная стенка этих бактерий плохо воспринимает анилиновые красители и обычные способы окраски. Высокая температура в процессе окраски методом Циля-Нильсена расплавляет липиды, фенол разрыхляет клеточную стенку и краситель проникает внутрь клетки. После остывания препарата липиды вновь затвердевают, прочно удерживая краситель, поэтому кислотоустойчивые бактерии не обесцвечиваются серной кислотой и остаются красными. Некислотоустойчивые бактерии обесцвечиваются и их докрашивают контрастным красителем — метиленовым синим. В основном, метод используется для окраски бактерий, относящихся к роду Мусоbacterium (М.tuberculosis, М.bovis, М.leprae и др.)
III. План практической работы
1. Изучить механизм и этапы окраски по Граму, приготовить мазок из смеси бактерий и окрасить по Граму, заполнить таблицу в рабочей тетради.
2. Изучить механизм и этапы окраски по Цилю-Нильсену, приготовить мазок из сапрофитных микобактерий, окрасить по Цилю-Нильсену, заполнить таблицу в рабочей тетради.
3. Сравнить строение прокариотической и эукариотической клетки по ряду признаков, заполнить таблицу в рабочей тетради.
4. Изучить и перечислить в таблице основные таксономические категории на примере С.tetani и Т.pallidum или других бактерий.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8752 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Окраска по Цилю-Нильсену – это один из методов, используемый для обнаружения при исследовании анализов больного различных заболеваний. В случае изучения мокроты пациента на предмет наличия возбудителей, к примеру, туберкулеза широко используется данный метод. В этой статье пойдет речь о нюансах его проведения, а также о некоторых аналогичных методах.
Этот метод окрашивания используется в тех случаях, когда необходимо выявить в образце кислотоустойчивые микроорганизмы, к которым относятся возбудители туберкулеза, проказы и микробактериозов. Такие бактерии характеризуются, прежде всего, медленной скоростью роста, общими морфологическими особенностями, а также устойчивостью к кислотам и некоторым другим химическим веществам. Из-за последнего свойства такие бактерии плохо поддаются окраске обычными разведенными красителями. Для окрашивания таких бактерий на препарат наносится и в дальнейшем поджигается фуксин Циля, причем полученная окраска не исчезает под воздействием спирта и кислот.
Для проведения окраски образца по методу Циля-Нильсена необходимы следующие реактивы:
- Метиленовый синий с 10%-ным содержанием спирта;
- Раствор солянокислого спирта;
- Фуксин Циля, состоящий из фенола, фуксина и этилового спирта в количестве 50 г, 10 г и 10 г соответственно.
Также потребуется следующие инструменты:
- Газовая горелка;
- Часы для слежения за временем;
- Вода;
- 96%-ный этиловый спирт;
- Перчатки.
Окрашивание по методу Циля-Нильсена состоит из следующих этапов:
- На мазок, находящийся на предметном стекле, накладывается фильтровальная бумага, на которую затем наносится небольшое количество фуксина Циля.
- Затем предметное стекло нагревается до появления характерного пара. После появления пара стеклу нужно дать остыть. Затем нужно повторить эту процедуру еще 2 раза, а затем дать подогретому мазку остыть.
- После этого нужно смыть фуксин с приборного стекла, предварительно убрав бумагу, с помощью дистиллированной воды.
- Затем стекло помещается в раствор соляной или серной кислоты до полного обесцвечивания.
- Наконец, на обесцвеченный препарат наносится раствор метиленового синего. Стекло промывается дистиллированной водой и высушивается для дальнейшего исследования образца под микроскопом.
Липиды, которые содержатся в клеточной стенке кислотоустойчивых бактерий, хорошо удерживают цвет основного красителя. В некислотоустойчивых бактериях стабильно удерживается цвет как основного красителя, так и дополнительного.
При подозрениях на туберкулез исследуется мокрота больного. Длительный кашель с обильными выделениями является показанием для проведения подобного исследования. Визуально наличие возбудителей туберкулеза в организме может выдать мокрота характерной жидкой, пенистой консистенции и признаками гноя, а также мокрота, смешанная с кровью. Обнаружение возбудителей туберкулеза – рисовидных телец, известных также как линзы Коха, облегчается при использовании методов окраски образца. Таких как вышеописанный метод Циля-Нильсена или метод Грама, суть которого будет описана ниже.
Окраска препарата по методу Грама проводится следующим образом:
- Сперва препарат обрабатывается раствором Люголя на протяжении минуты;
- Затем препарат обесцвечивается с использованием спирта;
- Наконец, препарат промывается с использованием воды и дополнительно окрашивается фуксином.
Классификацию бактерий на грамположительные и на грамотрицательные можно наглядно увидеть при проведении подобной окраски. Первый тип бактерий окрашивается в темно-фиолетовый цвет, тогда как второй тип – в красный цвет. Исходя из такой классификации, можно судить о химическом составе клеточной стенки бактерии и о других ее характерных свойствах.
Анализ мокроты пациента является жизненно необходимым для своевременного выявления заболеваний, затрагивающих дыхательные пути, в том числе и туберкулеза. Окрашивание по методу Циля-Нильсена помогает выявить микроорганизмы и возбудители подобных болезней. В том числе и в случаях, когда речь идет об атипичных бактериях. Тем самым позволяет производить более точную и качественную диагностику подобных болезней.
Если вы сталкивались с подобными заболеваниями, знакомы с техниками исследования анализов больного на предмет наличия в них возбудителей инфекции или же у вас есть вопрос по теме, вы можете оставить свой комментарий.
источник
При исследовании мазков по Цилю-Нельсону следует избегать:
- 1. приготовления толстых мазков мокроты;
- 2. фиксации плохо высушенных мазков;
- 3. недостаточной фиксации;
- 4. обжигания препарата при длительной фиксации.
Эта методика должна выполнятся в условиях клинических лабораторий, начиная с уровня поликлиники, входит в поликлинический и клинический минимум обследования пациента, страдающего кашлем с мокротой (трехкратное микроскопическое исследование мокроты на микобактерии туберкулеза). Бактериоскопия мокроты должна проводится и больным хроническими заболеваниями органов дыхания и мочевыводящих путей, а также работникам неблагоприятных по туберкулезу животноводческих хозяйств. При обнаружении в мазке в одном поле зрения пяти и более микобактерии вероятность получения положительного результата посева материала на питательные среды значительно возрастает. Метод микроскопического исследования кислотоустойчивых мазков с окраской по Цилю-Нильсону позволяет быстро получить результаты, но обладает низкой чувствительностью и специфичностью. Частота выявлений микобактерии у больных туберкулезом при микроскопии мокроты составляет по данным разных авторов от 48 до 78%. При этом сравнение данных микроскопических исследований с данными культуральных исследований показывает, что доля ложноположительных результатов составляет до 6%.
Приготовление растворов для метода по Цилю-Нильсону:
Раствор 1. Насыщенный спиртовый раствор фуксина (3%) — растереть в ступке 0,3 г основного фуксина с 2-3 каплями глицерина, добавить по каплям 10 мл 96 ? этилового спирта. Добиться полного растворения фуксина.
Раствор 2. Рабочий раствор фенола (5% водный раствор) — расплавить 5 г кристаллического фенола на водяной бане или в термостате (температура плавления фенола 41 ? С).
Осторожно! При попадании фенола на кожу вызывает ожоги. Растворить расплавленный фенол в 100 мл воды.
Рабочий раствор 3. Рабочий раствор карболового фуксина — в 90 мл полученного раствора фенола (раствор №2) добавить 10 мл насыщенного раствора фуксина (раствор №1).
Раствор 4. Обесцвечивающий раствор серной кислоты (25%) — к 75 мл дистиллированной воды осторожно долить 25 мл концентрированной серной кислоты, постепенно наслаивая ее по стенкам сосуда, смешать. Содержимое нагреется.
Или: обесцвечивающий раствор соляной кислоты (3%) — к 97 мл 96% этилового спирта осторожно добавить 3 мл концентрированной соляной кислоты.
Всегда медленно добавляйте кислоту в спирт, а не наоборот! Смесь может нагреться.
Раствор 5. 0,3% раствор метиленового синего — растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной воды.
Переходные материалы и реактивы
Предметные стекла; 25х75 мм; 1,1-1,3 мм толщиной (на 1 год).
Восковые карандаши или алмазные ручки или несмываемые водой фломастеры.
Фильтровальная бумага, фильтры диаметром 15 см №1.
Шариковая ручка черная или синяя.
Петля бактериологическая, нихромовая, 1 мм диаметром.
Спирт этиловый 96%, х.4 (для приготовления спиртового фуксина).
Реактивы для обесцвечивания:
- — серная кислота, 96% х.4, или
- — солянокислый спирт 3%
- — соляная кислота, концентрированная, х.4
- — спирт этиловый, 96%, х.4
Спирт этиловый технический.
Учет результатов микроскопического исследования
Количество КУМ являет очень важным информационным показателем, так как оно характеризует степень эпидемиологической опасности больного и тяжесть заболевания. Поэтому микроскопическое исследования должно быть не только качественным, но и количественным. При использовании объектива 90х или 100х окуляра 7х10 (общее увеличение равно 630х 1000х) используется следующая градация результатов световой иммерсионной микроскопии.
Градация результатов микроскопического исследования
источник
Для микроскопического исследования мокроты прежде всего готовят неокрашенные (нативные) препараты мокроты. Полноценность исследования зависит от правильного приготов¬ления и количества просмотренных препаратов. Материал для исследования выбирают из разных мест и переносят металлической иглой на предметное стекло, затем покрывают покровным стеклом так, чтобы мокрота не выступала за его края.
Препараты должны быть тонкими, элементы в них должны располагаться однослойно. Микроскопию проводят сначала при малом увеличении микроскопа (объектив 8Х, окуляр 10Х), просмотр с малым увеличением дает представление о качестве выбранного материала, позволяет обнаружить скопление клеток, кристаллических образований, найти эластические волокна, спирали Куршмана, элементы новообразования. Дальнейшее исследование производится при большом увеличении микроскопа (объектив 40Х, окуляр 10Х).
При этом в мокроте можно обнаружить в большем или меньшем количестве лейкоциты и среди них по более темной окраске и наличию в цитоплазме обильной, четкой, преломляющей свет зернистости различить эозинофилы, наличие которых характерно для бронхиальной астмы и других аллергических состояний. Эритроциты в мокроте имеют вид желтоватых дисков. Единичные эритроциты встречаются в каждом виде мокроты, большое же их количество характерно для кровянистой мокроты и встречается при инфаркте легкого, легочных кровотечениях, застое в малом круге кровообращения.
В мокроте всегда можно обнаружить эпителий. Плоский эпителий попадает в мокроту из полости рта и носоглотки. Большое число клеток говорит о недостаточно хорошем туалете полости рта перед взятием мокроты для исследования.
Обнаружение в мокроте цилиндрического мерцательного эпителия, выстилающего слизистую оболочку гортани, трахеи и бронхов, свидетельствует о поражении соответствующих отделов. Клетки имеют удлиненную форму, расширение с одного конца, где расположено округлое ядро, и мерцательные реснички. Располагаются эти клетки группами, и в свежевыделенной мокроте можно наблюдать активное движение ресничек. При воспалительных процессах (бронхиты, пневмонии, профессиональные заболевания легких) в мокроте встречаются альвеолярные макрофаги — клетки гистиоцитарной системы. Это крупные клетки округлой формы с наличием в цитоплазме включений. Если альвеолярные макрофаги содержат гемосидерин, то их называют сидерофагами или образно «клетками сердечных пороков», так как они могут появиться при застое крови в легких, при декомпенсированных пороках сердца. С достоверностью выявить эти клетки можно реакцией обра¬зования берлинской лазури.
Бактериоскопия.
Этот этап исследования мокроты включает в себя микроскопию препаратов, окрашенных по Цилю—Нильсену, для выявления микобактерий туберкулеза и препаратов, окрашенных по Граму, для изучения микрофлоры мокроты. Иногда для выявления микобактерий туберкулеза прибегают к обогащению методом флотации. Препараты мокроты для бактериоскопического исследования, приготовленные на предметном стекле, высушивают, фиксируют над пламенем горелки и затем окрашивают.
Окраска по Цилю—Нильсену.
Реактивы:
Карболовый фуксин: 1 г основного фуксина растворяют в 10мл этилового спирта, раствор выливают в 100мл 5% раствора карболовой кислоты.
3% солянокислого спирта: 3 мл НСl и 97 мл этилового спирта
Водный 0,5% раствор метиленового синего
На препарат кладут кусочек фильтровальной бумаги и наливают раствор карболового фуксина, затем препарат нагревают над пламенем горелки до появления паров, охлаждают и снова нагревают (3 раза). После остывания препарата сбрасывают фильтровальную бумагу и опускают его в солянокислый спирт для обесцвечивания. Обесцвечивают до полного удаления краски, промывают водой и докрашивают метиленовым синим 20—30с. Снова промывают водой и высушивают на воздухе. Микроскопируют с иммерсионной системой.
Туберкулезные микобактерий окрашиваются в красный цвет, все остальные элементы мокроты и бактерии — в синий. Туберкулезные микобактерий имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке.
При окраске по Цилю—Нильсену в красный-цвет красятся также кислотоупорные сапрофиты. Дифференциальная диагностика туберкулезных микобактерий и кислотоупорных сапрофитов ведется бактериологическими методами исследования
При исследовании следует избегать:
приготовления толстых мазков мокроты;
фиксации плохо высушенных мазков;
недостаточной фиксации;
обугливания препарата при длительной фиксации.
Если микобактерий выделяется мало, то в обычных мазках их не находят и прибегают к методу накопления.
Метод флотации (всплывание) по Поттенджеру.
Свежевыделенную мокроту (не более 10—-15 мл) помещают в узкогорлую бутылку, приливают двойное количество 0,5% раствора едкой щелочи,-смесь энергично встряхивают 10—15 мин. Затем добавляют 1 мл ксилола (можно бензина, толуола) и около 30 мл дистиллированной воды для разжижения мокроты и снова встряхивают 10— 15 мин. Доливают дистиллированную воду в таком количестве, чтобы уровень жидкости поднялся до горлышка бутылки. Оставляют на 1 — 2 ч для отстаивания. Образовавшийся верхний беловатый слой снимают по каплям пипеткой и наносят на предметные стекла, предварительно подогретые до 60 °С (стекла для подогревания можно положить на металлический подносик и покрыть им водяную баню). Каждую последующую каплю наносят на предыдущую подсушенную. Препарат фиксируют и красят по Цилю—Нильсену.
Наиболее достоверные результаты в обнаружении микобактерий туберкулеза дают бактериологические методы исследования. Другие бактерии, встречающиеся в мокроте, например стрептококки, стафилококки, диплобациллы, палочки Фридлендера и пр., могут быть распознаны только методом посева. Бактериоскопическое исследование препарата в этих случаях имеет только ориентировочное значение. Препараты красят метиленовым синим, фуксином или по Граму.
Окраска по Граму.
Реактивы:
Карболовый раствор генцианового фиолетового: 1 г генцианового фиолетового растворяют в 10 мл 96 % спирта,, раствор выливают в 100 мл 1 — 2 % карболовой кислоты, взбалтывают
Ра¬створ Люголя: 1 г йода, 2 г йодида калия и 300 мл дистиллированной воды; йод и йодид калия расстворяют сначала в 5—8 мл воды, а затем: приливают остальную воду
96 % спирт или сырец
10 % раствор карболового фуксина: 10 мл карболового фуксина и 90 мл дистиллированной воды
На фиксированный препарат кладут полоску фильтровальной бумаги и наливают раствор генцианового фиолетового. Красят 11/2—2 мин. Бумажку сбрасывают и заливают препарат раствором Люголя на 2 мин, а потом прополаскивают препарат в спирту до сероватого цвета. Промывают водой и окрашивают 10% раствором карболового фуксина 10—15 с. После этого препарат опять промывают водой, высушивают и микроскопируют с иммерсионным объективом.
источник
1. Насыщенный спиртовой раствор фуксина (0,3г основного фуксина растереть в ступке с 2-3 каплями глицерина, добавить по каплям 10мл 96% этилового спирта).
2. Рабочий раствор фенола — 5% водный раствор (расплавить 5г кристаллического фенола путем легкого подогревания на водяной бане, добавить слегка подогретую дистиллированную воду до объема 100мл).
3. Рабочий раствор карболового фуксина (в 90мл рабочего раствора фенола добавить 10мл насыщенного раствора фуксина), хранится не более 2-х недель.
4. Обесцвечивающие растворы:
а) раствор серной кислоты (к 75 мл дистиллированной воды осторожно долить 25 мл концентрированной серной кислоты) или
б) раствор солянокислого спирта (к 97 мл спирта осторожно добавляют 3 мл концентрированной соляной кислоты).
5. Рабочий раствор метиленового синего (растворить 0,3г хлорида метиленового синего в 100мл дистиллированной воды).
Ход окраски. Перед окраской необходимо убедиться, что подготовленные мазки фиксированы и промаркированы. Препараты помещают на подставку («рельсы») так, чтобы они не касались друг друга, и расстояние между ними составляло порядка 1см, а маркировка (номер) была направлена в одну сторону. На каждое стекло накладывают полоску фильтровальной бумаги так, чтобы она полностью закрывала мазок. Это делают для того, чтобы краска не разливалась по стеклу. Одновременно за счет использования фильтровальной бумаги предотвращается осаждение на мазок кристаллов краски, которые при микроскопическом исследовании могут быть ошибочно приняты за кислотоустойчивые микобактерии. Наливают на бумагу раствор карболового фуксина с избытком и нагревают препарат над пламенем горелки до легкого появления паров. При подогревании препарата следят за тем, чтобы краска не закипела, а фильтровальная бумага не высыхала. Подогретый мазок оставляют на 5 минут, чтобы краситель проник в клеточную стенку микобактерий и окрасил ее. Пинцетом снимают и удаляют фильтровальную бумагу, осторожно смывают остатки краски слабой струей дистиллированной воды до тех пор, пока не прекратится видимое отхождение краски. При промывании мазков используют холодную воду или воду комнатной температуры. Перед тем, как нанести на стекло следующий раствор, щипцами или пинцетом берут каждое стекло за маркированный конец и наклоняют, чтобы с него стекла вода — это предотвращает разбавление следующего реактива.
Мазок обесцвечивают 3 минуты одним из обесцвечивающих растворов, полностью покрывая всю поверхность мазка, тщательно промывают его дистиллированной водой и докрашивают в течение 1 минуты, не превышая экспозицию, 0,3% раствором метиленового синего. Вновь аккуратно промывают проточной водой, наклоняя каждое стекло, чтобы стекала вода, высушивают на открытом воздухе при комнатной температуре в вертикальном или наклонном положении.
При окраске карболовым фуксином микобактерии туберкулеза выявляются в виде тонких, слегка изогнутых палочек малиново-красного цвета, которые могут располагаться поодиночке, парами, группами, в вид римской буквы «V». Они хорошо выделяются на синем фоне, в который окрашиваются остальные элементы мокроты.
Препарат исследуют с масляной иммерсией в световом микроскопе (объектив 100Х, окуляр 10Х).
Количество КУМ при микроскопическом исследовании является очень важным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания. Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. Следует просматривать не менее 100 полей зрения, чтобы дать количественную оценку препарату и обнаружить единичные микобактерии. В том случае, если результат такого исследования оказывается отрицательным, для подтверждения просматривают дополнительно 200 полей зрения. При значительном количестве кислотоустойчивых микобактерий достаточно исследовать 20-50 полей зрения. Критерии оценки результатов микроскопии приведены в таблице 20.
Оценка результатов микроскопического исследования на КУМ
при окраске по Цилю-Нильсену
| Результат исследования | Минимальное число полей зрения (п/з), обязательных для просмотра | Форма записи результата | Интерпретация результата исследования |
| КУМ не обнаружены в 300 п/з | ОТР | Отрицательный | |
| 1-2 КУМ в 300 п/з | Рекомендуется повторить исследование | Результат не оценивается | |
| 1-9 КУМ в 100 п/з | «____» КУМ в 100 п/з * | Положительный | |
| 10-99 КУМ в 100 п/з | 1+ | Положительный | |
| 1-10 КУМ в 1 п/з | 2+ | Положительный | |
| Более 10 КУМ в 1 п/з | 3+ | Положительный |
* Точное число — единичные КУМ в препарате;
1+ — единичные КУМ в поле зрения;
2+ — умеренное количество КУМ;
3+ — значительное количество КУМ.
В специализированных противотуберкулезных учреждениях для выявления КУМ применяется также метод люминесцентной микроскопии, основанный на свечении микобактерий туберкулеза, окрашенных ауромином, в ультрафиолетовых лучах.
7.3.5. Контрольные вопросы по теме «Микроскопическое и бактериоскопическое исследование мокроты»
1. Какое диагностическое значение имеет обнаружение лейкоцитов в мокроте?
2. Как можно обнаружить спирали Куршмана в мокроте?
3. Из чего образуются кристаллы Куршмана?
4. Какие клеточные элементы выявляются в нативном препарате мокроты?
5. Виды альвеолярных макрофагов.
6. При каком патологическом процессе в мокроте появляются эластические волокна?
7. Какой реакцией выявляют «клетки сердечных пороков»?
8. Приготовление мазка мокроты для выявления КУМ.
9. Какой вид имеют микобактерии туберкулеза при окраске по Цилю-Нильсену?
10. Как оценивают результат микроскопического исследования мокроты на КУМ?
Дата добавления: 2014-11-29 ; Просмотров: 1890 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Фиксация и окраска препаратов на туберкулез по Циль-Нильсену
Высушенные на воздухе мазки фиксируются на пламени горелки (газовой, спиртовой) троекратным проведением через пламя. Затем на фиксированный мазок наливают разведенный основной фуксин или парафуксин и подогревают препарат до появления паров. После охлаждения мазка краску сливают и мазок обмывают водой. Затем обесцвечивают, наливая на стекло 10—15% серную кислоту (или 3% солянокислый спирт) до появления бледно-розового цвета, вновь смывают мазок водой, наливают на него 0,5%0 раствор метиленовой синьки на полминуты. После синьки препарат обмывают водой, просушивают на воздухе и подвергают бактериоскопии. Микроскопировать начинают с левого верхнего угла сверху вниз, затем вновь поднимают вверх и т. д., проходя все поле зрения до конца препарата.
Туберкулезные микобактерии в окрашенном по Циль-Нильсену препарате представляются красными на синем фоне слизи. Чаще всего они располагаются под углом друг к другу среди лейкоцитов или внутри них в виде тонких, прямых, иногда слегка изогнутых, изящных красных палочек с зернистостью или без нее. Окрашены они обычно «равномерно на всем протяжении в ярко красный цвет. Подсчитывать количество бактерий, обнаруженных в препарате, излишне, так как оно зависит от многих причин и не отражает характера процесса. Количество бактерий следует указывать лишь при обнаружении единичных экземпляров в препарате.
При бактериоскопическом исследовании на туберкулез следует обращать особое внимание на возможное присутствие в препарате кислотоупорных сапрофитов, которые могут дать повод для ошибочного смешения их с туберкулезными микобактериями, хотя они имеют ряд морфологических и тинкториальных особенностей.
Кислотоупорные сапрофиты отличаются от туберкулезных микобактерии по следующим признакам.
По морфологии: кислотоустойчивые сапрофиты обычно более толстые, грубые, редкозернистые в отличие от тонких, изящных частозернистых туберкулезных микобактерии. Кроме того, они отличаются большим полиморфизмом — в одном и том же препарате встречаются длинные и короткие, толстые и тонкие палочки, иногда со вздутиями на концах, иногда заостренные или веретенообразные.
1. По окраске: кислотоупорные сапрофиты часто бывают неравномерно окрашены; наряду с ярко окрашенными, встречаются очень бледные экземпляры, а иногда встречаются палочки, полюсы которых окрашены по-разному; кроме того, и оттенок в окраске кислотоупорных сапрофитов иной, чем у туберкулезных микобактерии: буроватый иди наоборот, розоватый.
2. По расположению: кислотоупорные сапрофиты обычно располагаются среди слизи и клеток плоского или мерцательного эпителия, иногда на красноватом фоне, в то время как туберкулезные- микобактерии чаще всего располагаются среди лейкоцитов. Обнаружение в мокроте бактерий с указанными выше тинкториальными и морфологическими особенностями заставляет проверить их сииртоустойчивость путем повторного обесцвечивания окрашенного по Циль-Нильсену мазка 96° спиртом в течение 5—10 минут и дополнительной окраски 0,5%о раствором метиленовой синьки. Если в препарате есть туберкулезные микобактерии, обладающие, кроме кислотоустойчивость, и спиртоустойчивостью, они после дополнительного обесцвечивания спиртом останутся красными. Если красные при окрашивании по Циль-Нильсену бактерии после перекраски потеряют свою первоначальную окраску и превратятся в синие или хотя бы частично изменят свой красный цвет, то это будет свидетельствовать о том, что эти бактерии кислотоупорные, но спиртоподатливые, т. е. не туберкулезные. В лаборатории Института туберкулеза АМН России при окраске мазков мокроты на туберкулез пользуются для обесцвечивания 3% солянокислым спиртом, что дает возможность сразу выявлять кислото- и спиртоустойчивость обнаруженных в препарате бактерий.
источник
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 — 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше — от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего — еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
Для обезжиривания вымытые и высушенные стекла помещают в герметически закрытые емкости со смесью для обезжиривания. Стекла должны подвергаться обезжириванию в течение суток. Непосредственно перед приготовлением мазков стекла повторно протираются насухо. Для окраски мазков, приготовленных непосредственно из диагностического материала (метод прямой микроскопии), наиболее часто используется метод Ziehl-Neelsen (Циль-Нильсен) (Реагенты — «Диахим» — набор для окраски по Циль-Нильсену»)..
источник
Западно-Казахстанский Высший медицинский колледж. Сайт преподавателя МКЛИ Байбулатовой Светланы Андреевны
БАКТЕРИОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ МОКРОТЫ.
Это этап исследования мокроты включает микроскопию препаратов, окрашенных по Циль-Нильсену для выявления микобактерий туберкулёза (кислотоустойчивых бактерий, КУБ), препаратов, окрашенных по Граму, для изучения микрофлоры мокроты (стрептококки, стафилококки, пневмококки). В последнем случае бактериоскопическое исследование имеет ориентировочное значение. Правильность выявлений этих бактерий всегда подтверждают посевом.
Техника приготовления окрашенных препаратов.
На край предметного стекла кладутся кусочки из мокроты, растираются другим предметным стеклом до гомогенной массы. Препарат должен занимать не более половины стекла, для удобства при приготовлении, фиксации и окраски. Затем препараты высушивают, фиксируют путём троекратного проведения над пламенем горелки и окрашивают.
Для бактериоскопического исследования готовят обычно два препарата: один для обнаружения микобактерий туберкулёза, другой – для обнаружения прочих микроорганизмов. Для первого препарат отбирают частицы, которые были предназначены для микроскопии, для второго – гнойные частицы.
Первый препарат окрашивают по методу Циль-Нильсену, а второй по Граму.
3. Водный 0,5% р-р метиленовой сини.
1. На препарат кладут квадратик фильтровальной бумаги.
2. Наливают р-р карболового фуксина Циля.
3. Препарат нагревают над пламенем горелки до 3-х кратного отхождения пара.
5. Сбрасывают бумажку и опускают препарат в солянокислый спирт для обесцвечивания.
6. Промывают препарат водой.
7. Докрашивают препарат метиленовым синим в течение 20-30 сек.
8. Промывают водой и высушивают на воздухе.
9. Микроскопируют с иммерсионной системой.
Микобактерии туберкулёза окрашиваются в красный цвет , а все остальные элементы — в синий. Микобактерии имеют вид точек, слегка изогнутых, расположенных группами или поодиночке.
Если микобактерий с мокротой выделяется мало, то в обычных мазках их не находят и прибегают к методу накопления (обогащения).
МЕТОД ОБОГАЩЕНИЯ ПО ПОТТЕНДЖЕРУ.
1. 10-15 мл свежевыделенной мокроты помещают в узкогорлую бутылку.
2. Доливают двойным объёмом 0,5% р-ра NaOH или КОН.
3. Смесь энергично встряхивают 10-15 мин.
4. Добавляют 1 мл летучего вещества (ксилола, толуола, бензола) и 100 мл воды.
5. Снова встряхивают 10-15 мин.
6. Доливают дистиллированной воды до горлышка.
7. Оставляют на один час для отстаивания.
8. Верхний беловатый слой (флотационное кольцо) снимают пипеткой по каплям и наносят на предметные стекла, подогретые на воздушной бане до 60 0 С. Каждую новую каплю наносят на высохшую предыдущую.
10. Красят по Циль-Нильсену.
МЕТОД СЕДИМЕНТАЦИИ МОКРОТЫ.
1. 1 часть мокроты смешивается с 2 частями 10% трёхзамещённого фосфорнокислого натрия ( Na 12 H 2 О).
2. Смесь ставят в термостат на 1 сутки (можно не ставить).
3. Слить надосадочную жидкость.
4. 10 мл надосадочной жидкости центрифугируют при 2000 об/мин в течение 12 мин.
5. Быстро сливают надосадочную жидкость.
6. Из осадка делают препараты, высушивают при Т 90 0 С в течение 30 мин., затем окрашивают по Цилю-Нильсену.
Метод седиментации предпочтительнее, так как при флотации по Поттенджеру образуется аэрозоль, что увеличивает риск заражения мед.персонала.
3. 1% Карболовый раствор генцианового фиолетового.
1. На фиксированный препарат накладывают полоску фильтровальной бумаги.
2. Наносят несколько капель 1% карболового раствора.
3. Через 1-2 мин бумажку сбрасывают и на препарат наливают 1-2 капли реактива Люголя.
4. Через 1-2 мин препарат обесцвечивают 96 0 этиловым спиртом.
5. Препарат промываю водой и докрашивают фуксином Пфейффера 10-15 сек.
6. Промывают водой и высушивают.
7. Микроскопируют с иммерсионной системой.
Грамположительные бактерии окрашивают в фиолетовый цвет (синий), а грамотрицательные – в красный цвет.
В препаратах, окрашенных по Граму, обнаруживают пневмококки, стрептококки, стафилококки, актиномицеты и другие микроорганизмы.
источник