Электрокинетические явления
Влияние природы дисперсионной среды
Влияние рН среды
Введение в золь ионов Н + и ОН — может сильно сказываться на величине z-потенциала, так как эти ионы обладают высокой сорбционной способностью: первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы, вторые – из-за большого дипольного момента (большой поляризуемости).
Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью e и вязкостью m.
z-потенциал частиц золя тем больше, чем больше e (полярность растворителя).
Чем больше вязкость, тем толще слой дисперсионной среды, который прилипает к частице при разрыве мицеллы и, следовательно, тем меньше численное значение z-потенциала.
Электрокинетические явления – это явления, которые возникают при воздействии электрического поля на дисперсную систему (электрофорез, электроосмос), а также в результате перемещения частиц дисперсной фазы или дисперсионной среды (потенциал протекания, потенциал оседания).
Несмотря на различие электрокинетических явлений, все они связаны с наличием ДЭС на частицах дисперсной фазы. Интенсивность всех электрокинетических явлений определяется значением z-потенциала.
Электрофорез – направленное движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля.
При наложении внешнего электрического поля происходит разрыв мицеллы: частицы дисперсной фазы вместе с адсорбированными на них потенциалопределяющими ионами и противоионами адсорбционного слоя перемещаются к электроду, знак которого противоположен знаку заряда коллоидной частицы (z-потенциалу), а противоионы диффузионного слоя – к другому электроду. Например, если дисперсная фаза заряжена отрицательно, коллоидные частицы движутся к аноду (положительному электроду), а положительно заряженные противоионы диффузного слоя – к катоду (рис. 32).
Если дисперсная фаза заряжена положительно, направление движения частиц меняется на противоположное.
|
Скорость движения, или электрофоретическая скорость, зависит от величины электрокинетического потенциала z, напряженности электрического поля E/L и свойств сплошной среды – динамической вязкости μ и диэлектрической проницаемости e:
,
где u – электрофоретическая скорость; z – электрокинетический потенциал; e – диэлектрическая проницаемость среды; e – электрическая постоянная, e = 8,85×10 -12 Кл/(В×м); Е – разность потенциалов внешнего электрического поля; L – расстояние между электродами; E/L=H –напряженность, или градиент, внешнего электрического поля; m – динамическая вязкость сплошной среды; y – фактор формы.
Коэффициент y учитывает форму частиц и их ориентацию в электрическом поле. Для шарообразных частиц коэффициент y равен 0,66, а для цилиндрических, ориентированных вдоль силовых линий электрического поля – 1.
Скорость движения в расчете на единицу напряженности электрического поля Н называется электрофоретической подвижностью
.
Электрофоретическая подвижность зависит только от свойств дисперсной фазы и дисперсионной среды.
На подвижность коллоидной частицы оказывают влияние электрофоретический и релаксационный эффекты.
Электрофоретический эффект (эффект торможения): под действием внешнего электрического поля противоионы передвигаются в направлении, противоположном движению частицы. За счет гидратации противоионы увлекают за собой и окружающую их жидкость (дисперсионную среду). Это приводит к тому, что частица перемещаются в направлении, противоположном движению жидкости, скорость ее уменьшается.
Релаксационный эффект вызывается нарушением симметрии ДЭС вокруг частицы при ее движении. ДЭС деформируется и отстает от частицы. В результате возникает добавочное электрическое поле, которое действует на частицу, стремясь двигать ее в обратном направлении, и тем самым влияет на скорость электрофореза.
Для учета влияния этих факторов в уравнение для расчета электрофоретической скорости и вводится коэффициент y.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез — это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 6.11, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 6.11).
Рис. 6.11. Схема электрофореза:
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху — электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 6.12). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
Рис. 6.12. Схема электроосмоса
1 — дисперсная система; 2 — перегородка
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
источник
Электрофорез — направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов. Это явление наблюдается в седиментационно устойчивых дисперсных системах. При наложении на такую систему внешней разности потенциалов происходит разрыв ДЭС по плоскости скольжения, в результате чего частица получает заряд и перемещается к соответствующему электроду.
Приведенные выше уравнения Гельмгольца — Смолуховского справедливы для электрофореза, в частности для электрокинетического потенциала используется уравнение (4.9). Отличие состоит только в системе координат: в одном случае рассматривается скорость жидкости, в другом — скорость движения частиц, которую обычно определяют по смещению цветной границы.
Электрофорез наблюдают в U-образном сосуде (см. лабораторный практикум). В нижнюю часть сосуда наливают золь, сверху — контактную (боковую) жидкость, имеющую одинаковую (или немного большую) с золем электрическую проводимость. Наблюдают за изменением уровня золя в обоих коленах трубки и по скорости перемещения частиц дисперсной фазы определяют линейную скорость электрофореза Wq :
где S — путь, пройденный золем за время г (время электрофореза).
При электрофорезе отношение линейной скорости к напряженности
электрического поля 
Напряженность электрического поля Е зависит от приложенной разности потенциалов на электродах U и расстояния между ними L:
Рассмотренные уравнения справедливы при допущениях: 1) частицы движутся в однородном электрическом поле; 2) частицы могут иметь любую форму и не проводят электрический ток; 3) толщина ДЭС много меньше размеров частиц золя.
Для расчета ^-потенциала частиц, находящихся в разбавленных водных растворах при 293 К, можно использовать простое соотношение:
в котором электрофоретическая подвижность и, выражена в(тогда
^-потенциал будет иметь размерность В).
Несовпадение экспериментальных и теоретических значений объясняется релаксационным эффектом и электрофоретическим торможением.
Релаксационный эффект проявляется в нарушении симметрии диффузионного слоя вокруг частицы при относительном перемещении фаз в противоположные стороны.
Электрофоретическое торможение обусловлено сопротивлением движению частицы обратным потоком противоионов, которые увлекают за собой жидкость. В некоторых случаях несовпадение можно учесть введением поправок, иногда этим несовпадением можно пренебречь.
Скорость электрофореза зависит нс только от приложенного напряжения, но и от радиуса частиц и других факторов. Это можно учесть введением в уравнение (4.8) поправочного коэффициента к:
Поправочный коэффициент определяется экспериментально в каждом отдельном случае электрофореза.
Для примера рассмотрим данные по электрофорезу в суспензиях глин Трошковского, Никольского и Слюдянского месторождений, микрофотографии которых приведены на рис. 1.1.
Электрокинетический потенциал определяли методом подвижной границы при электрофорезе и рассчитывали по уравнению:
где S — путь;
L — расстояние между электродами;
U — разность потенциалов между электродами;
г — преимущественный радиус частицы, определяемый обычно по максимуму на кривой распределения частиц но размерам;
/(к г) — поправочная функция, учитывающая эффекты электрофоретического торможения и релаксации (табл. 4.1);
к — параметр Дебая, равный обратной величине плотной части двойного электрического слоя, то есть к = 1/6.
источник
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
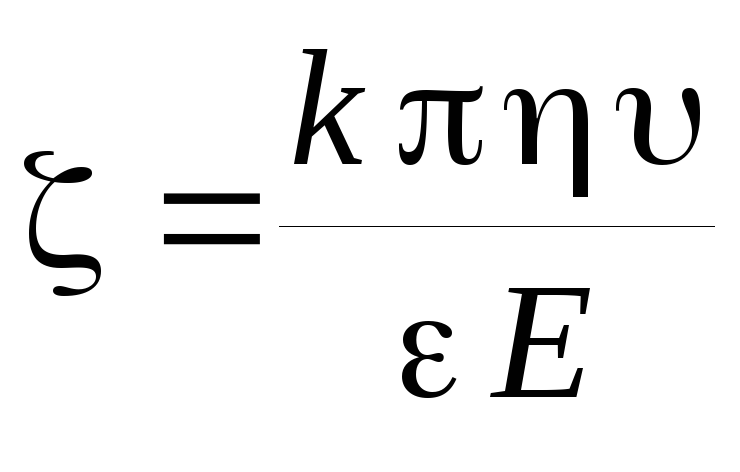
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
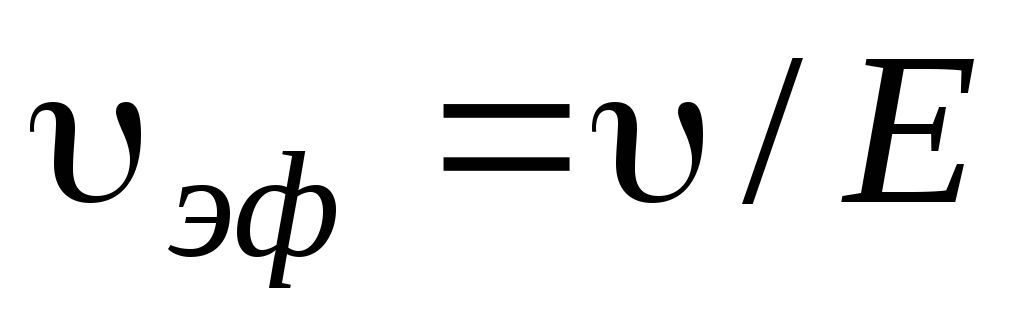
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
К осаждению дисперсной фазы — характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
лиофильные, обладающие термодинамической устойчивостью;
лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса G min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
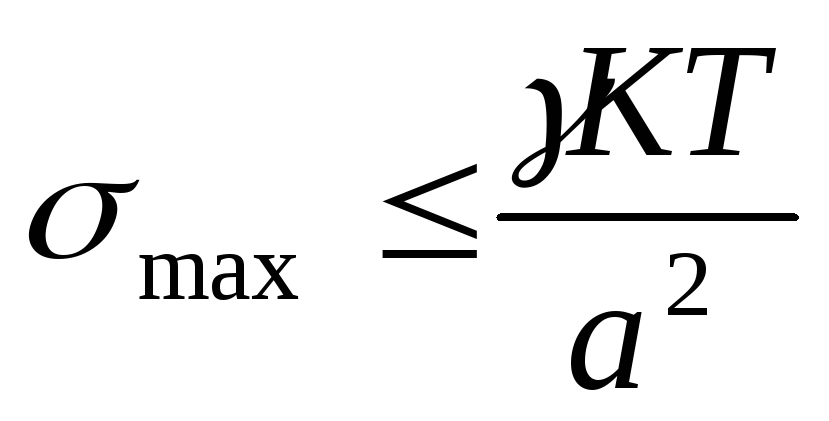
где ỵ езразмерный коэффициент;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,410 -7 до 1,410 -3 Дж/м 2 . Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Правила коагуляции электролитами. Порог коагуляции. Правило Шульце-Гарди. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия — явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
источник
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез— это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 10, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 10).
Рис. 10. Схема электрофореза:
Рис. 11. Схема электроосмоса
1 — дисперсная система; 2 — перегородка
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху — электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 11). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
источник
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.2.4 Двойной электрический слой и электрокинетические явления
При рассмотрении строения мицеллы было показано, что на поверхности лиофобных коллоидов образуется двойной электрический слой. Первая теория строения ДЭС была развита Гельмгольцем и Перреном; в их представлении двойной электрический слой подобен плоскому конденсатору, внутренняя обкладка которого находится в твердой фазе, а внешняя – в жидкости параллельно поверхности ядра на расстоянии порядка диаметра иона. Потенциал электрического поля внутри ДЭС φ в этом случае линейно уменьшается с увеличением расстояния от поверхности r (рис. 4.12а).
Позднее Гуи и Чепмен предложили другую модель, согласно которой противоионы, благодаря тепловому движению, образуют вблизи твердой поверхности ядра диффузную ионную атмосферу . Уменьшение электрического потенциала ДЭС φ с увеличением расстояния r в этом случае происходит нелинейно (рис. 4.12б).
Рис. 4.12 Строение ДЭС: а) – по Гельмгольцу и Перрену, б) – по Гуи и Чепмену, в) – по Штерну. Вверху – схема расположения противоионов, внизу – зависимость потенциала от расстояния
Предложенная Штерном модель строения ДЭС объединяет ранние модели, учитывая как адсорбцию противоионов, так и их тепловое движение . Согласно этой модели, являющейся в настоящее время общепринятой, часть противоионов находится на расстояниях порядка диаметра иона от поверхности ядра, образуя т.н. слой Гельмгольца (адсорбционный слой противоионов), а другая часть образует диффузный слой (т.н. слой Гуи). Потенциал диффузной части двойного электрического слоя называют электрокинетическим потенциалом (см. рис.4.12в). Электрокинетический потенциал обычно обозначают греческой буквой ζ (дзета) и называют поэтому дзета-потенциалом. Поскольку ζ -потенциал пропорционален заряду коллоидной частицы, агрегативная устойчивость золя пропорциональна его величине.
Если поместить золь в постоянное электрическое поле, то, как и в растворах электролитов, заряженные частицы будут двигаться к противоположно заряженным электродам: коллоидная частица с адсорбированными на ней противоионами – в одну сторону, противоионы диффузного слоя – в другую. Сила, с которой электрическое поле действует на частицы и, следовательно, скорость движения частиц, очевидно, будет пропорциональна ζ -потенциалу. Движение частиц дисперсной фазы в электрическом поле называется электрофорезом . Явление электрофореза можно наблюдать, поместив в U-образную трубку какой-либо окрашенный золь, поверх которого налит не смешивающийся с золем бесцветный электролит. Если опустить в электролит электроды и наложить разность потенциалов, то граница окрашенного золя в одном из колен трубки будет подниматься, в другом – опускаться (рис. 4.13). Если поместить в U-образную трубку пористую перегородку (например, мелкий кварцевый песок) и заполнить её водой, то при наложении разности потенциалов в одном колене будет наблюдаться подъем уровня жидкости, в другом – его опускание (рис. 4.14). Движение дисперсной среды в электрическом поле относительно неподвижной дисперсной фазы (в рассмотренном случае – относительно поверхности пористых тел) называется электроосмосом . Явления электрофореза и электроосмоса получили общее название электрокинетических явлений .
Рис. 4.13 Схема опыта по электрофорезу
Рис. 4.14 Схема опыта по электроосмосу
Скорость движения частиц дисперсной фазы при электрофорезе, а также скорость движения дисперсной среды при электроосмосе прямо пропорциональны напряженности электрического поля E и диэлектрической проницаемости дисперсионной среды ε и обратно пропорциональны вязкости среды η . Скорость движения частиц дисперсной фазы при электрофорезе U связана с величиной ζ -потенциала уравнением Гельмгольца-Смолуховского (К – постоянная, зависящая от формы частиц дисперсной фазы; для сферических частиц К = 6):
(IV.20)
Обратные электрофорезу и электроосмосу электрокинетические явления (т.н. электрокинетические явления второго рода) называются соответственно потенциал седиментации и потенциал протекания. Потенциал седиментации (эффект Дорна) – возникновение разности потенциалов при вынужденном движении дисперсной фазы относительно неподвижной дисперсионной среды (например, под действием силы тяжести). Потенциал протекания (эффект Квинке) есть явление возникновения разности потенциалов при движении дисперсионной среды относительно неподвижной дисперсной фазы (например, при продавливании электролита через пористое тело).
Copyright © С. И. Левченков, 1996 — 2005.
источник
Это явления, связанные с движением дисперсной фазы и дисперсионной среды.
К электрокинетическим явлениям относятся явления электрофореза и электроосмоса, а также потенциал седиментации и потенциал течения.
Наличие у частиц дисперсных систем электрического заряда было открыто еще в 1808 году профессором Московского университета Ф.Ф. Рейссом при исследовании электролиза воды.
Рейсс поставил два эксперимента. В одном он использовал U-образную трубку, в другом погрузил в глину 2 стеклянные трубки.
Рис. 4.3. Схемы опытов Рейсса.
При пропускании постоянного тока через прибор, состоящий из U-образной трубки, средняя часть которой заполнена кварцевым песком (рис. 4.3а), вода в колене с отрицательно заряженным электродом (катодом) поднималась, что свидетельствовало о положительном заряде воды. Вода заряжалась при контакте с частицами кварца. Без диафрагмы из песка движение жидкости отсутствовало.
Явление перемещения жидкости в пористых телах под действием электрического поля называется электроосмосом.
Явление электроосмоса используется в промышленности при опреснении воды, при электроосушении пористых тел (бетонов, болот и др.), при очистке лекарственных препаратов, при дублении кожи и т.д.
При создании разности потенциалов в трубках, погруженных в глину (рис. 4.3б), жидкость в трубке с положительным полюсом мутнеет – частицы глины переносятся в электрическом поле к положительному полюсу.
Позднее было установлено, что частицы движутся в электрическом поле с постоянной скоростью.
Скорость тем больше, чем выше разность потенциалов и диэлектрическая постоянная среды, и тем меньше, чем больше вязкость среды.
Перемещение частиц дисперсной фазы в электрическом поле называетсяэлектрофорезом (катафорезом).
Электрофорез используется для обезвоживания нефти и нефтепродуктов (ЭЛОУ – электроочистительные установки), при очистке газообразных отходов производства (электрофильтры), при изготовлении изделий из латекса (дисперсий полимера), в медицине – для введения в организм коллоидных лекарств и др.
Последующими исследованиями были обнаружены два явления, как бы обратные электрофорезу и электроосмосу.
Дорн в 1878 году обнаружил, что при оседании каких-либо частиц в жидкости (песка в воде) возникает электродвижущая сила между двумя электродами, введенными в разные места столба жидкости – явление получило название эффект Дорна или потенциал седиментации (оседания).
Квинке в 1859 году обнаружил, что при течении жидкости через пористое тело под влиянием перепада давлений возникает разность потенциалов. Это явление, обратное электроосмосу, названо потенциалом протекания или потенциалом течения.Возникновение разности потенциалов Квинке наблюдал при течении воды и водных растворов через разные пористые материалы (глина, песок, дерево, графит).
Таким образом, по причинно-следственным признакам электрокинетические явления делят на две группы.
К первой относят явления, при которых относительное движение фаз вызывается электрической разностью потенциалов – электрофорез и электроосмос.
Ко второй группе явлений относят потенциал течения и потенциал седиментации в которых электрическая разность потенциалов обусловливается относительным движением фаз.
Лекция 5. Устойчивость и коагуляция коллоидных систем
Понятие об устойчивости дисперсных систем.
Действие электролитов на коагуляцию.
Совместное действие электролитов при коагуляции.
Старение золей. Коллоидная защита.
Вопросы устойчивости дисперсных систем занимают центральное место в коллоидной химии, поскольку эти системы в основном термодинамически неустойчивы.
Под устойчивостью системы понимают постоянство во времени ее состояния и основных свойств: дисперсность равномерного распределения частиц дисперсной фазы в объеме дисперсионной среды и характера взаимодействия между частицами.
Частицы дисперсной системы, с одной стороны, испытывают действие земного притяжения; с другой стороны, они подвержены диффузии, стремящейся выровнять концентрацию во всех точках системы. Когда между этими двумя силами наступает равновесие, частицы дисперсной фазы определенным образом располагаются относительно поверхности Земли.
По предложению Н.П. Пескова (1920г) устойчивость дисперсных систем подразделяют на два вида:
— кинетическая(седиментационная) устойчивость – свойство дисперсных частиц удерживаться во взвешенном состоянии, не оседая (противостояние частиц силам тяжести).
(условия устойчивости – высокая дисперсность частиц, участие частиц дисперсной фазы в броуновском движении);
— агрегативнаяустойчивость – способность частиц дисперсной фазы оказывать сопротивление слипанию (агрегации) и тем самым сохранять определенную степень дисперсности этой фазы в целом.
Дисперсные системы по устойчивости делят на два класса:
— термодинамически устойчивые (лиофильные коллоиды);
— термодинамически неустойчивые (лиофобные системы).
Первые самопроизвольно диспергируются и существуют без стабилизатора. К ним относятся растворы ПАВ, растворы ВМС.
Свободная энергия Гиббса термодинамически устойчивой системы уменьшается (DG 0).
В последнее время различают также конденсационную устойчивость: система образует непрочные агрегаты (флокулы) или рыхлые осадки – частицы теряют свою индивидуальную подвижность, но сохраняются как таковые в течение длительного времени.
Дата добавления: 2015-08-08 ; просмотров: 2082 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Федеральное Агентство по образованию РФ
ШАХТИНСКИЙ ИНСТИТУТ (ФИЛИАЛ)
ТЕХНИЧЕСКОГО УНИВЕРСИТЕТА (НПИ)
на тему: «Электрофорез и электроосмос»
К защите Защита принята с оценкой «__»__________2008 г. ________________________
___________________ «__»____________ 2008 г.
В данном реферате рассматриваются общие сведения о дисперсных системах, электрокинетические явления в них, в частности электрофорез и электроосмос, основные понятия, формулы. Также практическое применение электрокинетических явлений в науке и технике.
1 Электрокинетические явления
2 Практическое применение электрокинетических явлений
Список используемых источников
Дисперсные системы. Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 – 0,1 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2 – 0,1мм до 400 – 300 нм*, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии. Постепенно складывались представления о том, что миром молекул и микроскопически видимых частиц находится область раздробленности вещества с комплексом новых свойств, присущих этой форме организации вещества.
Представим себе кубик какого-либо вещества, который будем разрезать параллельно одной из его плоскостей, затем полученные пластинки начнем нарезать на палочки, а последние на кубики. В результате такого диспергирования (дробления) вещества получаются плёночно-, волокнисто- и корпускулярнодисперсные (раздробленные) системы. Если толщина пленок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа, то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400 – 300 нм до 1 нм – коллоидным состоянием вещества.
1. Электрокинетические явления
Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания). Перенос коллоидных частиц в электрическом поле называется электрофорезом, а течение жидкости через капиллярные системы под влиянием разности потенциалов – электроосмосом. Оба эти явления были открыты профессором Московского университета Ф. Ф. Рейссом в 1809 г.
Рейсс поставил два эксперимента. В одном из них он использовал U-образную трубку, перегороженную в нижней части диафрагмой из кварцевого песка и заполненную водой. При наложении электрического поля он обнаружил движение жидкости в сторону отрицательно заряженного электрода. Происходящее до тех пор, пока не устанавливалась определенная разность уровней жидкости (равновесие с гидростатическим давлением). Поскольку без диафрагмы движение жидкости отсутствовало, то последовал вывод о заряжении жидкости при контакте с частицами кварца. Явление получило название электроосмоса.
В другом эксперименте Ф. Ф. Рейсс погрузил в глину две стеклянные трубки, заполнил их водой и после наложения на них электрического поля наблюдал перемещение частиц глины в жидкости в направлении положительно заряженного электрода. Это был электрофорез. Таким образом, было обнаружено, что частицы имеют заряд, противоположный заряду жидкости.
Первые количественные исследования электроосмоса были выполнены Видеманном (1852). Он показал, что объёмная скорость υ электроосмоса пропорциональна силе тока I при прочих фиксированных параметрах, а отношение υ/I не зависит от площади сечения и толщены диаграммы.
В 1859 г. Квинке показал, что существует явление, обратное электроосмосу, т. е. при течении жидкости через пористое тело под влиянием перепада давлений возникает разность потенциалов. Возникновение разности потенциалов Квинке наблюдал при течении воды и водных растворов через разнообразные пористые материалы (глина, дерево, песок, графит и др.). Это явление получило название потенциала течения (или протекания). Позже было установлено, что потенциал течения не зависит от размера диаграммы, количества фильтруемой жидкости, но, как и при электроосмосе, пропорционален объёмной скорости фильтрации.
Количественное исследование эффекта, обратного электрофорезу, впервые было выполнено Дорном в 1878 г. Он измерял возникающую разность потенциалов при седиментации частиц суспензии кварца в центробежном поле. Явление возникновения разности потенциалов при осаждении дисперсной фазы получило название потенциала седиментации или оседания (или эффект Дорна).
Таким образом, по причинно-следственным признакам электрокинетические явления делят на две группы. К первой группе относят явления, при которых относительное движение фаз вызывается электрической разностью потенциалов, это электроосмос и электрофорез. Ко второй группе электрокинетических явлений принадлежат потенциал течения и потенциал седиментации, в которых возникновение электрической разности потенциалов обусловлено относительным движением фаз.
Наибольшее практическое применение получили электрофорез и электроосмос.
Основную роль в возникновении электрокинетических явлений играет двойной электрический слой (ДЭС), формирующийся у поверхности раздела фаз. Внешнее электрическое поле, направленное вдоль границы раздела фаз, вызывает смещение одного из ионных слоев, образующих ДЭС, по отношению к другому, что приводит к относительному перемещению фаз, т. е. к электроосмосу или электрофорезу. Аналогичным образом при относительном движении фаз, вызываемом механическими силами, происходит перемещение ионных слоев ДЭС, что приводит к пространственному разделению зарядов (поляризации) в направлении движения и к перепаду электрического потенциала (потенциал течения, потенциал оседания).
Направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов называется электроосмосом. Рассмотрим, например, электроосмотическое скольжение электролита в капилляре или порах мембраны. Примем для определенности, что на поверхности адсорбированы отрицательные ионы, которые закреплены неподвижно, а положительные ионы формируют диффузную часть ДЭС. Внешнее поле Е направлено вдоль поверхности. Электростатическая сила, действующая на любой произвольный элемент диффузной части ДЭС, вызывает движение этого элемента вдоль поверхности. Поскольку плотность заряда в диффузной части ДЭС Ф(х ) меняется в зависимости от расстояния до поверхности х (рис. 1), разложенные слои жидкого электролита движутся с разными скоростями. Стационарное состояние (неизменность во времени скорости течения) будет достигнуто, когда действующая на произвольный слой жидкости электростатическая сила скомпенсируется силами вязкого сопротивления, возникающими из-за различия скоростей движения слоев жидкости, находящихся на разном удалении от поверхности. Уравнения гидродинамики, описывающие движение жидкости при постоянных вязкости жидкости
источник
Дата добавления: 2015-08-06 ; просмотров: 3616 ; Нарушение авторских прав
Электрокинетическими явлениями назвали процессы, происходящие в дисперсных системах и связанные с перемещением фаз относительно друг друга под действием внешнего электрического поля. Эти явления впервые были обнаружены Ф.Ф. Рейсом в 1807 г. Причиной их является существование двойного электрического слоя на границе гранула – диффузный слой и легкость смещения гранулы относительно диффузного слоя. В электрическом поле при наложении внешней разности потенциалов двойной электрический слой разрывается по границе (поверхности) скольжения и частица получает заряд, соответствующий x-потенциалу. При этом гранула движется к одному полюсу, а противоионы диффузного слоя, увлекая за собой гидратные оболочки, – к другому.
Движение частиц дисперсной фазы относительно дисперсионной среды под действием внешнего электрического поля называется электрофорезом.
Движение дисперсионной среды относительно дисперсной фазы под действием внешнего электрического поля называется электроосмосом.
Позже, в 1859 г, Квинке обнаружил, что при проталкивании под давлением коллоидного раствора через капилляр на его концах возникает разность потенциалов, названная потенциалом протекания. Это явление можно рассматривать как обратное электроосмосу.
Явление, обратное электрофорезу открыл в 1878 г. Дорн. Он установил, что при оседании частиц дисперсной фазы в жидкой среде по высоте сосуда возникает разность потенциалов между верхним и нижним слоями. Ее назвали потенциалом седиментации. Причина этого явления – деформация ДЭС оседающих частиц при трении о дисперсионную среду.
Электрофорез коллоидных растворов.Метод электрофореза позволяет определить знак заряда частиц золя, а также величину x-потенциала. Наблюдать электрофорез коллоидных растворов можно с помощью прибора, изображенного на рис.36. Прибор представляет собой U–образную трубку, в колена которой вставлены электроды. Коллоидный раствор вводят через трубочку Б до уровня А – А. На поверхность раствора налита контактная жидкость, которая является дисперсионной средой золя или имеет одинаковую с ней электропроводность. На электроды подают напряжение. Через некоторое время уровень золя изменится в обоих коленах (В – В).
В электрическом поле противоионы диффузного слоя обычно двигаются в направлении, противоположном движению гранул. При этом в соответствующем колене прибора повышается уровень жидкости, так как ионы диффузного слоя увлекают за собой дисперсионную среду за счет сил межмолекулярного трения (вязкости) между гидратной оболочкой ионов и окружающей жидкостью. То есть в данном колене наблюдается электроосмос.
Но это только в том случае, если на пути передвижения стоит мембрана, препятствующая движению гранул (т.е. фаза закреплена).
При свободном передвижении диффузный слой удерживается гранулой и в виде отстающего «хвоста» следует вместе с ней. Поэтому уровень золя будет повышается в электродном пространстве, имеющим знак заряда, противоположный заряду частиц. Следовательно, в нашем случае частицы золя заряжены отрицательно, так как уровень жидкости повысился в анодном пространстве.
Зная величину смещения уровня (S) за определенный промежуток времени (t), можно экспериментально рассчитать скорость электроосмоса (электрофореза): V = S/t, м/с. С другой стороны, скорость движения частиц дисперсной фазы в электрическом поле по уравнению Гельмгольца – Смолуховского равна:
V = ,
где V – линейная скорость перемещения частиц (или границы золя), м/с; ε – относительная диэлектрическая проницаемость среды; Н – напряженность электрического поля (градиент потенциала), В/м; k – коэффициент, зависящий от формы частиц (k = 4 – для сферических частиц, k = 6 – для цилиндрических);
η – вязкость среды, Н×с/м 2 ; x – электрокинетический потенциал, В.
Как видно из уравнения, скорость электрофореза тем больше, чем выше диэлектрическая проницаемость среды, напряженность электрического поля, величина ξ -потенциала (т.е. заряд частиц) и чем меньше вязкость среды, а также зависит от формы частиц.
Последнее уравнение позволяет рассчитать величину x-потенциала:
x = .
Линейная скорость электрофореза (V) изменяется пропорционально напряженности электрического поля и не может служить характеристикой частиц. Поэтому было введено понятие электрофоретическая подвижность (u):
Следовательно: x = .
Величина x-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку последняя зависит от этой величины.
Уравнение Гельмгольца – Смолуховского также применимо для электрофореза аминокислот и белков, где x-потенциал определяется суммарным зарядом иона.
Электрофорез аминокислот и белков. Разделение белков, аминокислот методом электрофореза основано на способности их молекул принимать определенный знак заряда в зависимости от рН среды.
Аминокислоты, являясь структурной единицей белков, своим строением и последовательностью соединения молекул определяют специфичность и свойства белков. Так как их молекулы содержат и основную (–NH2), и кислотную (–СООН) группы, то они являются амфотерными соединениями и в водных растворах находятся в виде биполярных ионов:
В нейтральной среде заряд иона аминокислоты (или белка) определяется соотношением числа –NH2 и –СООН групп и степенью их диссоциации. Если число карбоксильных групп больше числа аминогрупп, суммарный заряд иона будет отрицательный, если больше аминогрупп – положительный. Если же количество этих групп в ионе одинаково, то суммарный заряд равен нулю.
Ионизация амино- и карбоксильных групп зависит также от рН среды. В кислой среде диссоциация карбоксильной группы подавляется и протонируется аминогруппа. В результате аминокислота (белок) приобретает положительный заряд:
В щелочной среде аминокислота приобретает отрицательный заряд:
При некотором значении рН среды, характерном для данной аминокислоты (белка), суммарный заряд иона равен нулю. Состояние, в котором молекула аминокислоты или белка обладает равенством положительных и отрицательных зарядов, то есть электронейтральна, называется изоэлектрическим состоянием. А значение рН среды, при котором молекула электронейтральна, называется изоэлектрической точкой (ИЭТ или рJ).
pJ, то молекула заряжается отрицательно и в электрическом поле перемещается к аноду.
ИЭТ белков с преобладанием –СООН групп (кислых белков) находиться в кислой среде, а с преобладанием – NH2 групп (основных белков) – в щелочной. Если число амино- и карбоксильных групп равно, то ИЭТ будет находится приблизительно в нейтральной среде, что зависит от степени диссоциации этих групп. Следовательно, суммарный заряд иона белка (аминокислоты) зависит также от рН среды и ИЭТ белка (аминокислоты).
Любой раствор рН которого меньше, чем ИЭТ, является кислым для молекулы данного белка (аминокислоты), и она, приобретая положительный заряд, в электрическом поле двигается к катоду. Если рН раствора больше чем ИЭТ, то данная среда является щелочной для молекулы, и она, приобретая отрицательный заряд, в электрическом поле двигается к аноду.
Наблюдать электрофорез аминокислот и белков можно с помощью прибора, схема которого изображена на рис.37а. Он представляет собой ванну, состоящую из катодного и анодного отделений, в которые заливается буферный раствор с определенным значением рН. Берется полоска плотной фильтровальной бумаги, пропитанной тем же буферным раствором. На её середину полоски (линия старта) наносят небольшое количество смеси белков, которые необходимо разделить, а на концах ее ставят знаки «+» и «–». Затем полоску помещают на подставке в прибор так, что бы один конец (–) погрузился в раствор катодного отделения, а второй (+) – анодного, и подают внешнее напряжение. Через некоторое время прибор отключают, бумагу вынимают, высушивают и окрашивают красителем, проявляющим белки. На полученной электрофореграмме (рис.37б) будет наблюдаться несколько окрашенных зон. Их число соответствует числу компонентов в смеси. Характер расположения и интенсивность полос на ней определяются качественным и количественным составом белков в смеси.
Так как все компоненты имеют различную электрофоретическую подвижность, то они окажутся на различном расстоянии от линии старта. Причем чем дальше от линии старта оказалась зона, тем выше скорость электрофореза вследствие большей величины ξ-потенциала (заряда) молекулы данного белка (аминокислоты). По направлению движения зон можно судить о заряде молекулы в данной среде. Если зона двигалась к катоду (–), то знак заряда положительный, если к аноду (+) – отрицательный.
Электрофорез и электроосмос широко применяются в медико-биологических исследованиях. Например, методом электрофореза разделяют белки, нуклеиновые кислоты, антибиотики, смеси лекарственных веществ в лекарственных препаратах, очищают от примесей лекарственные сыворотки, определяют белковые фракции в сыворотке крови. Этим методом можно не только разделять аминокислоты и белки, но и определять их ИЭТ. Если проводить электрофорез данного белка (аминокислоты) при разных значениях рН среды, то при рН равном ИЭТ это вещество не будет двигаться ни к катоду, ни к аноду.
Методы электрофореза применяются при диагностике ряда заболеваний и для контроля лечения путем сравнивания фракционного состава (по числу и интенсивности зон на электрофореграмме) нормальных и патологических жидкостей.
Электрофорез и электроосмос происходят при прохождении тока через ткани живых организмов. На поверхности биологических мембран находятся заряженные группы, что обуславливает образование двойного электрического слоя, в котором фиксированный отрицательный заряд клеточной поверхности уравновешивается положительным зарядом, создаваемым ионами межклеточной среды. Поэтому метод электрофореза позволяет определить величину x-потенциала, а следовательно, и заряд эритроцитов, тромбоцитов, лейкоцитов и других элементов крови. Достаточно хорошо изучен электрокинетический потенциал эритроцитов. Было установлено, что величина x-потенциала является характерной для данного вида животных, а также для человека.
Электрофорез (ионофорез) является одним из методов введения лекарственных препаратов в организм человека. Он широко применяется в физиотерапии, поскольку имеет ряд преимуществ по сравнению с другими способами введения лекарств. При электрофорезе оно поступает непосредственно в ткани зоны воздействия (следовательно, требуются меньшие дозы) и действует медленнее, но продолжительнее.
Устойчивость и коагуляция коллоидных растворов
Коллоидные растворы из-за большой удельной поверхности на границе раздела фаз имеют избыток поверхностной энергии и поэтому термодинамически неустойчивы. И только присутствие стабилизатора придает им устойчивость.
Под устойчивостью дисперсных систем понимают постоянство во времени их свойств, в первую очередь постоянство дисперсности и постоянство равновесного распределения частиц дисперсной фазы в среде. В данном определении имеется в виду способность системы противостоять агрегации (укрупнению) частиц дисперсной фазы – агрегативная устойчивость, и способность системы противостоять седиментации частиц (т.е. их осаждению под действием силы тяжести) – седиментационная (кинетическая) устойчивость.
Способность частиц дисперсной фазы удерживаться во взвешенном состоянии зависит от их дисперсности, вязкости дисперсионной среды, разности плотностей дисперсной фазы и дисперсионной среды. Кинетическая (седиментационная) устойчивость золя тем выше, чем меньше размер частиц, чем ближе значения плотностей фазы и среды, чем выше вязкость дисперсионной среды. Причем степень дисперсности частиц оказывает наибольшее влияние. Поэтому высокодисперсные системы, в которых скорость осаждения взвешенных частиц под влиянием силы тяжести настолько мала, что ею можно пренебречь, принято называть седиментационно (кинетически) устойчивыми.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем удерживать определенную степень дисперсности. Основными факторами агрегативной устойчивости дисперсных систем являются наличие у частиц ионной оболочки, т.е. ДЭС, диффузного слоя противоинов, а так же их сольватной (гидратной) оболочки. Эти факторы оценивают величиной электротермодинамического потенциала j коллоидной частицы, толщиной ее диффузного слоя, величиной заряда частицы и ее x-потенциала. Их значения зависят от условий получения золя, а также от природы противоиона (его заряда, радиуса, гидратирующей способности). В зависимости от этих условий изменяется количество противоионов в диффузном слое. Чем больше противоионов в нем, тем больше его толщина и, соответственно, выше заряд и x-потенциал частицы. Это способствует увеличению агрегативной устойчивости. Утрата агрегативной устойчивости приводит к коагуляции.
Коагуляция – это процесс слипания коллоидных частиц и образования более крупных агрегатов, ведущий к выпадению их в осадок под действием сил тяжести и последующему разделению фаз. Другими словами это потеря в начале агрегативной, а затем седиментационной устойчивости, ведущая к разрушению дисперсной системы. В общем смысле под коагуляцией понимают потерю агрегативной устойчивости дисперсной системы.
Коагуляцию могут вызвать различные факторы: изменение температуры, механическое воздействие, действие света, облучение, увеличение концентрации золя, добавление электролитов.
Изменение температуры по-разному влияет на кинетическую и агрегативную устойчивость, а следовательно, и на коагуляцию. Первая при увеличении температуры возрастает в результате усиления броуновского движения. Вторая при этом снижается вследствие уменьшения толщины диффузного слоя. Причем увеличивается и вероятность столкновения (соответственно – слипания) частиц, что способствует коагуляции.
Наиболее изучена и имеет большое практическое значение коагуляция электролитами. Электролиты, с одной стороны, необходимы для стабилизации золя, но с другой – их избыток в растворе вызывает коагуляцию. Поэтому коллоидные растворы, полученные химическими методами, необходимо очищать от примесей электролитов.
Коагуляция коллоидных растворов электролитами.Количественной характеристикой коагулирующей способности электролита служит порог коагуляции – наименьшее количество электролита, которое вызывает коагуляцию I л золя. Он рассчитывается по формуле:
γ = ,
где γ – порог коагуляции, моль/л; С – концентрация электролита, моль/л; V – объем раствора электролита, л; V – объем золя, л.
Порог коагуляции можно рассчитывать и в ммоль/л.
Величина, обратная порогу коагуляции (1/γ), является мерой коагулирующей способности электролита: чем меньше порог коагуляции, тем выше коагулирующая способность электролита.
Практически все электролиты способны вызвать коагуляцию золя, если концентрацию электролита увеличить до значений, соответствующих его порогу коагуляции для данного золя.
Коагулирующее действие электролитов зависит от знака заряда и величины заряда ионов и определяется правилом Шульце – Гарди.Коагуляцию вызывают в основном ионы, имеющие заряд, противоположный знаку заряда частицы (М. Гарди). То есть для золя с положительно заряженными частицами ионами-коагулянтами являются анионы, а коагуляцию отрицательно заряженного золя вызывают катионы добавляемого электролита. Ичем выше заряд иона коагулянта, тем выше его коагулирующая способность(Г. Шульце),т.е. требуется меньшее количество электролита для коагуляции (порог коагуляции меньше). Позже Б.В.Дерягиным было установлено, что если коагуляцию вызываютионы одного знака, но разной величины заряда, то их пороги коагуляции соотносятся как величины, обратные их зарядам в шестой степени:
g+ : g2+ : g3+ = = 730 : 11:1
Поскольку порог коагуляции зависит не только от природы иона-коагулянта, но и от природы иона, сопутствующего ему, а также условий проведения опыта, на практике наблюдаются отклонения от указанного соотношения. В настоящее время установлено, что порог коагуляции пропорционален величине заряда иона-коагулянта в степени от 2 до 9, часто в степени 6.
У ионов одного знака и одинаковой величины заряда пороги коагуляции также отличаются друг от друга, но незначительно.
Коагуляция в ряде случаев зависит от способа прибавления электролита-коагулятора. Экспериментальные данные свидетельствуют о том, что если электролит добавлять к золю небольшими порциями, то в итоге коагуляция наступает при более высокой концентрации электролита, чем при внесении сразу большого его количества. Такое явление называют привыканием золя.
Явление коагуляции электролитами играет существенную роль в живом организме, так как коллоидные растворы клеток и биологических жидкостей соприкасаются с электролитами. Поэтому при введении в организм какого-либо электролита надо учитывать не только его концентрацию, но и заряд ионов. К примеру, физиологический раствор хлорида натрия нельзя заменить изотоничным раствором хлорида магния, поскольку данная соль содержит двухзарядный ион магния, оказывающий более высокое коагулирующие действие.
Кинетика и механизм коагуляции электролитами. Коагуляция любого коллоидного раствора не происходит мгновенно – она протекает во времени. Процесс коагуляции можно наблюдать по изменению оптических свойств раствора. Различают две стадии коагуляции: скрытую и явную. На первой стадии происходит укрупнение частиц без видимых изменений оптических свойств раствора (скрытая коагуляция). На второй стадии идет дальнейшее укрупнение частиц, сопровождающееся видимым изменением золя (явная коагуляция).
На рис.38 показана кривая (OSKN) зависимости скорости коагуляции золя от концентрации добавляемого электролита. Отрезок ОS соответствует скрытой коагуляции,а точка А – концентрации электролита при пороге коагуляции, который можно зафиксировать. Признаками явной коагуляции являются помутнение золя или изменение его окраски.
В начале явной коагуляции (отрезок SКN) скорость ее невелика. Но по мере нарастания концентрации электролита она значительно увеличивается. Поэтому различают медленную (SК) и быструю (КN) коагуляцию. Точка В соответствует концентрации электролита при некотором остаточном значении x-потенциала (в литературе его называют критическим x-потенциалом).
Существуют различные теории, описывающие механизм коагуляции. Из них наиболее удовлетворительной считается теория Дерягина – Ландау, доработанная Э.Фербеем и Дж.Обербеком (теория коагуляции ДЛФО). Согласно этой теории, две коллоидные частицы в процессе броуновского движения могут сблизиться на расстояние, при котором перекрываются их диффузные оболочки. Только в этом случае они начинают испытывать силы межмолекулярного притяжения и силы электростатического отталкивания их диффузных слоев.
В первом приближении механизм ионной стабилизации сводится к электростатическому отталкиванию диффузных слоев, зависящему от их толщины. При большой толщине диффузных слоев (рис.39а) их перекрытие проявляется на расстоянии, когда силы отталкивания одноименно заряженных слоев больше сил межмолекулярного притяжения и коллоидные частицы не слипаются (не агрегируют). При малой толщине диффузных слоев (рис.39б) частицы сближаются до расстояния, на котором межмолекулярное притяжение сильнее отталкивания этих слоев, и тогда происходит их агрегация, т.е. коагуляция.
Согласно теории ДЛФО, введение в дисперсную систему электролита вызывает сжатие ионной оболочки частиц за счет избирательной или ионнообменной адсорбции на их поверхности ионов данного электролита. При этом понижается заряд частицы, ее x-потенциал и, следовательно, толщина диффузного слоя. Уменьшение толщины диффузного слоя приводит к преобладанию сил межмолекулярного притяжения над силами электростатического отталкивания, вследствие чего скорость коагуляции возрастает.
В этом механизме коагуляции золей электролитами учтено взаимодействие сил молекулярного притяжения и электростатического отталкивания, но не учтены силы взаимодействия адсорбционно-сольватных оболочек частиц и другие факторы, что является недостатком теории ДЛФО.
Коагуляция золя смесями электролитов.Коагуляцию золей можно вызвать и смесями электролитов, которые способны оказывать на них различные действия (рис. 40).
1. Коагулирующее действие смеси электролитов суммируется, т.е. смесь электролитов оказывает тоже действие, как один из них, взятый тем же количеством – аддитивное действие.
2. Коагулирующее действие смеси электролитов меньше, чем каждого из них в отдельности, т.е. для коагуляции золя количества смеси потребуется больше чем количества каждого из них в отдельности – антагонизм. Это характерно для смесей ионов, имеющих различную валентность.
3. Коагулирующее действие смеси электролитов большее, чем каждого из них в отдельности, т.е. количества смеси потребуется меньше чем количества одного из электролитов в отдельности – синергизм.
Выше описанные явления очень важны для понимания закономерностей воздействия ионов на органы и ткани живого организма, поскольку биологически активные ионы часто выступают в роли «антагонистов» или «синергистов». Это обстоятельство должно учитываться при составлении кровезамещающих растворов: они должны быть не только изотоническими плазме крови и иметь одинаковую с ней ионную силу, но и быть максимально близкими по ионному составу. Однако описанные явления ни в коем случае нельзя смешивать с явлениями физиологического антагонизма ионов, под которым обычно понимают ослабление одним катионом токсического или иного физиологического действия, вызываемого другим катионом.
Взаимная коагуляция золей. Помимо электролитов, коагуляцию золей можно вызвать путем смешивания одного их них в определенных количественных соотношениях с другим золем, гранулы которого имеют противоположный знак заряда. Это явление носит название взаимной коагуляции. Причем даже при незначительной концентрации противоположно заряженных частиц скорость коагуляции существенно возрастает.
Механизм взаимной коагуляции заключается в следующем. При перекрывании диффузных слоев коллоидных частиц, имеющих заряды разных знаков, эти частицы не отталкиваются, а электростатически притягиваются, и как следствие этого идет быстрая агрегация частиц. Наиболее полно взаимная коагуляция происходит тогда, когда заряды частиц, противоположные по знаку, равны между собой по величине.
Данный процесс широко применяется при очистке природных и промышленных вод. Так, перед поступлением воды на песчаные фильтры к ней добавляют соли алюминия или железа. Образующиеся в результате гидролиза этих солей положительно заряженные золи гидроксида алюминия или железа вызывают быструю коагуляцию взвешенных отрицательно заряженных частиц почвы, микрофлоры и т.д.
источник

