Дайте определение электрокинетическим свойствам коллоидных растворов: электрофорез, электроосмос. Применение в медицине.
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, вдругом — опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
источник
Федеральное Агентство по образованию РФ
ШАХТИНСКИЙ ИНСТИТУТ (ФИЛИАЛ)
ТЕХНИЧЕСКОГО УНИВЕРСИТЕТА (НПИ)
на тему: «Электрофорез и электроосмос»
К защите Защита принята с оценкой «__»__________2008 г. ________________________
___________________ «__»____________ 2008 г.
В данном реферате рассматриваются общие сведения о дисперсных системах, электрокинетические явления в них, в частности электрофорез и электроосмос, основные понятия, формулы. Также практическое применение электрокинетических явлений в науке и технике.
1 Электрокинетические явления
2 Практическое применение электрокинетических явлений
Список используемых источников
Дисперсные системы. Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 – 0,1 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2 – 0,1мм до 400 – 300 нм*, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии. Постепенно складывались представления о том, что миром молекул и микроскопически видимых частиц находится область раздробленности вещества с комплексом новых свойств, присущих этой форме организации вещества.
Представим себе кубик какого-либо вещества, который будем разрезать параллельно одной из его плоскостей, затем полученные пластинки начнем нарезать на палочки, а последние на кубики. В результате такого диспергирования (дробления) вещества получаются плёночно-, волокнисто- и корпускулярнодисперсные (раздробленные) системы. Если толщина пленок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа, то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными, а раздробленное (диспергированное) состояние веществ с размером частиц от 400 – 300 нм до 1 нм – коллоидным состоянием вещества.
1. Электрокинетические явления
Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания). Перенос коллоидных частиц в электрическом поле называется электрофорезом, а течение жидкости через капиллярные системы под влиянием разности потенциалов – электроосмосом. Оба эти явления были открыты профессором Московского университета Ф. Ф. Рейссом в 1809 г.
Рейсс поставил два эксперимента. В одном из них он использовал U-образную трубку, перегороженную в нижней части диафрагмой из кварцевого песка и заполненную водой. При наложении электрического поля он обнаружил движение жидкости в сторону отрицательно заряженного электрода. Происходящее до тех пор, пока не устанавливалась определенная разность уровней жидкости (равновесие с гидростатическим давлением). Поскольку без диафрагмы движение жидкости отсутствовало, то последовал вывод о заряжении жидкости при контакте с частицами кварца. Явление получило название электроосмоса.
В другом эксперименте Ф. Ф. Рейсс погрузил в глину две стеклянные трубки, заполнил их водой и после наложения на них электрического поля наблюдал перемещение частиц глины в жидкости в направлении положительно заряженного электрода. Это был электрофорез. Таким образом, было обнаружено, что частицы имеют заряд, противоположный заряду жидкости.
Первые количественные исследования электроосмоса были выполнены Видеманном (1852). Он показал, что объёмная скорость υ электроосмоса пропорциональна силе тока I при прочих фиксированных параметрах, а отношение υ/I не зависит от площади сечения и толщены диаграммы.
В 1859 г. Квинке показал, что существует явление, обратное электроосмосу, т. е. при течении жидкости через пористое тело под влиянием перепада давлений возникает разность потенциалов. Возникновение разности потенциалов Квинке наблюдал при течении воды и водных растворов через разнообразные пористые материалы (глина, дерево, песок, графит и др.). Это явление получило название потенциала течения (или протекания). Позже было установлено, что потенциал течения не зависит от размера диаграммы, количества фильтруемой жидкости, но, как и при электроосмосе, пропорционален объёмной скорости фильтрации.
Количественное исследование эффекта, обратного электрофорезу, впервые было выполнено Дорном в 1878 г. Он измерял возникающую разность потенциалов при седиментации частиц суспензии кварца в центробежном поле. Явление возникновения разности потенциалов при осаждении дисперсной фазы получило название потенциала седиментации или оседания (или эффект Дорна).
Таким образом, по причинно-следственным признакам электрокинетические явления делят на две группы. К первой группе относят явления, при которых относительное движение фаз вызывается электрической разностью потенциалов, это электроосмос и электрофорез. Ко второй группе электрокинетических явлений принадлежат потенциал течения и потенциал седиментации, в которых возникновение электрической разности потенциалов обусловлено относительным движением фаз.
Наибольшее практическое применение получили электрофорез и электроосмос.
Основную роль в возникновении электрокинетических явлений играет двойной электрический слой (ДЭС), формирующийся у поверхности раздела фаз. Внешнее электрическое поле, направленное вдоль границы раздела фаз, вызывает смещение одного из ионных слоев, образующих ДЭС, по отношению к другому, что приводит к относительному перемещению фаз, т. е. к электроосмосу или электрофорезу. Аналогичным образом при относительном движении фаз, вызываемом механическими силами, происходит перемещение ионных слоев ДЭС, что приводит к пространственному разделению зарядов (поляризации) в направлении движения и к перепаду электрического потенциала (потенциал течения, потенциал оседания).
Направленное перемещение жидкости в пористом теле под действием приложенной разности потенциалов называется электроосмосом. Рассмотрим, например, электроосмотическое скольжение электролита в капилляре или порах мембраны. Примем для определенности, что на поверхности адсорбированы отрицательные ионы, которые закреплены неподвижно, а положительные ионы формируют диффузную часть ДЭС. Внешнее поле Е направлено вдоль поверхности. Электростатическая сила, действующая на любой произвольный элемент диффузной части ДЭС, вызывает движение этого элемента вдоль поверхности. Поскольку плотность заряда в диффузной части ДЭС Ф(х ) меняется в зависимости от расстояния до поверхности х (рис. 1), разложенные слои жидкого электролита движутся с разными скоростями. Стационарное состояние (неизменность во времени скорости течения) будет достигнуто, когда действующая на произвольный слой жидкости электростатическая сила скомпенсируется силами вязкого сопротивления, возникающими из-за различия скоростей движения слоев жидкости, находящихся на разном удалении от поверхности. Уравнения гидродинамики, описывающие движение жидкости при постоянных вязкости жидкости
источник
Электрокинетическими называют процессы, связанные с взаимным относительным перемещением фаз в дисперсных системах. Электрокинетические свойства коллоидно-дисперсных систем определяются наличием двойного электрического слоя на границе раздела фаз, возникающего в результате как избирательной адсорбции ионов, так и диссоциации молекул, находящихся на поверхности фазы. В соответствии с правилом избирательной адсорбции Пескова — Панета — Фаянса, преимущественно адсорбируются ионы, входящие в состав адсорбента или образующие с его ионами малорастворимые соединения. Причиной всех электрокинетических явлений является наличие на границе раздела фаз двойного электрического слоя (ДЭС).
Различают следующие электрокинетические явления:
Электрофорез – это перемещение частиц дисперсной фазы относительно дисперсионной среды по действием внешнего электрического поля к одному из электродов.
Электроосмос – перемещение дисперсионной среды относительно неподвижной дисперсной фазы (капиллярно-пористых материалов, диафрагм) по действием внешнего электрического поля в сторону одного из электродов.
Потенциала течения – разность потенциалов при протекании дисперсионной среды через поры твердого тела под влиянием приложенного давления.
Потенциал оседания – разность потенциалов при седиментации частиц дисперсной фазы в гравитационном поле.
Скорость всех этих процессов определяется электрокинетическим потенциалом, или дзета-потенциалом (z-потенциал). Этот потенциал возникает на границе скольжения двух слоев дисперсионной среды: адсорбционного и диффузного (рис.4).
|
|
|
|
|
Рис.4 Строение двойного электрического слоя частицы
На границе раздела фаз (линия АВ) располагаются адсорбированные частицей потенциалопределяющие ионы. На рис.4 они заряжены положительно. На расстоянии, равном среднему ионному радиусу, расположен первый слой противоионов, в данном случае они имеют отрицательный заряд. Эти ионы входят в состав адсорбционного слоя частицы толщиной d, который связан с частицей и перемещается вместе с ней. Линия CD является границей скольжения, отделяющей адсорбционный слой частицы от диффузного, в котором в растворе диффузно распределен остаток общего заряда j, падающего асимптотически до нуля по мере удаления в глубину раствора. Толщина диффузного слоя раствора зависит от концентрации в нем электролитов и может меняться в широких пределах. Как следует из рис.4, дзета-потенциал, обнаруживаемый на границе движения слоев в электрическом поле, меньше общего термодинамического потенциала j и также зависит от толщины диффузного слоя.
Для определения дзета-потенциала измеряют скорость взаимного перемещения фаз при протекании электрокинетических явлений, таких как электрофорез или электроосмос.
Линейная скорость взаимного перемещения фаз в СИ вычисляется по формуле
u 
где D – диэлектрическая проницаемость;e – электрическая константа, равная 8,85 × 10 — 12 Ф/м; h — вязкость среды; E/l — напряженность электрического поля, или градиент потенциала, включает разность потенциалов электродов Е и расстояние между ними l.
Если скорость измерена в сантиметрах в секунду, вязкость — в пуазах и напряженность поля – в вольтах на сантиметр, то расчетное уравнение имеет вид
u 
где k – коэффициент, зависящий от формы частицы или капилляра, по которому движется жидкость (для сферических частиц и капилляров цилиндрической формы k = 4).
При наложении электрического поля равновесие в обкладках двойного электрического поля мицеллы нарушается. Электрически заряженная частица с находящимся на её поверхности адсорбционным (неподвижным) слоем противоионов, который нейтрализует часть заряда поверхности, начинает перемещаться к одному из полюсов, в то время как диффузное облако противоионов смещается в противоположном направлении. Данное явление перемещения частиц золя в электрическом поле к противоположному по знаку заряда частиц электроду и называется электрофорезом. Фиксируя электрофоретическое движение частиц, можно установить, каков знак заряда частиц, а также определить электрокинетический потенциал (z-потенциал), от которого зависит устойчивость частиц золя. Расчет z-потенциала производят по формуле:

где η – вязкость среды; u – электрофоретическая скорость частицы; ε – диэлектрическая проницаемость; Н – градиент потенциала.
Градиент потенциала находят делением величины эдс Е на расстояние между электродами l в приборе для изучения электрофореза:
Н = 
Уравнение (133) относится к частицам цилиндрической формы. Для частиц, имеющих сферическую форму, используют формулу:

Величина электрокинетического потенциала зависит от концентрации ионов электролитов в растворе и от их заряда. Чем выше концентрация электролита, тем меньше толщина диффузионной части двойного электрического слоя и тем меньше потенциал. В предельном случае, когда все ионы диффузного слоя перейдут в адсорбционный слой, z-потенциал становится равным нулю.
Пример 34. Электрокинетический потенциал частиц гидрозоля 50 мВ. Приложенная внешняя э.д.с. равна 240 В, а расстояние между электродами 40 см. Вычислить электрофоретическую скорость частиц золя, если они имеют цилиндрическую форму. Вязкость воды 0,001 Н·сек/м 2 , а диэлектрическая проницаемость среды 81.
Решение. Используем формулу (135), откуда

По формуле (136) определяем градиент потенциала Н:
Н= 



Пример 35. Определить размер и знак дзета-потенциала суспензии кварца в воде (D = 81, вязкость 0,01 П), если смещение границы при электрофорезе в сторону анода за 20 мин составило 5 см. Градиент электрического поля равен 10 В/см.
Решение. При заданных условиях линейная скорость электрофореза
u = 
Значение электрокинетического потенциала может быть вычислено по уравнению (135)
z = 
Знак заряда отрицательный, поскольку частицы перемещаются к положительному электроду.
21. Вычислите электрофоретическую скорость частиц золя трехсернистого мышьяка, если z-потенциалчастиц равен 89,5 мВ; разность потенциалов между электродами – 240 В, расстояние между электродами – 20 см. Вязкость η=0,001 Н·сек/м 2 и диэлектрическая проницаемость 
21. Вычислите электрофоретическую скорость частиц глины, если z-потенциалчастиц равен 48,8 мВ. Разность потенциалов между электродами равна 220 В, а расстояние между ними – 44 см, вязкость — 0,001 Н·сек/м 2 , а диэлектрическая проницаемость 81. Форма частиц сферическая.
21. Вычислите электрофоретическую скорость частиц золота, если градиент потенциала равен 1000 В/м, а z-потенциал составляет 58 мВ. Вязкость среды 0,00114 Н·сек/м 2 , а диэлектрическая проницаемость 81. Частицы имеют цилиндрическую форму.
21. Вычислите градиент потенциала, если z-потенциал частиц золя гидроокиси железа равен 52,5 мВ, электрофоретическая скорость частиц 3,74·10 -4 см/сек. Вязкость среды 0,001005 Н·сек/м 2 , а диэлектрическая проницаемость 81.Форма частиц – цилиндрическая.
21. Вычислите z-потенциал частиц золя трехсернистого мышьяка, если при измерении электрофоретической скорости частиц приложенная внешняя э.д.с. равна 240 В, расстояние между электродами – 30 см, перемещение частиц за 10 мин – 14,36 мм, диэлектрическая проницаемость – 81, вязкость – 0,001005 Н·сек/м 2 .
21. Электрофорез золя гидроксида железа происходил при следующих условиях: градиент потенциала – 500 В/м, перемещение частиц за 10 мин на 12 мм, диэлектрическая проницаемость воды равна 81, вязкость 0,001 Н·сек/м 2 . Вычислите z-потенциал частиц золя.
21. Вычислите z-потенциал частиц золя гидроксида железа, используя следующие опытные данные: внешняя э.д.с. 200 В, расстояние между электродами 22 см, смещение границы золя происходит на 2 см за 15 мин. Диэлектрическая проницаемость равна 81, вязкость 0,001 Н·сек/м 2 . Форму частиц считать сферической.
21. Вычислите z-потенциал частиц суспензии, если электрофоретическая скорость частиц равна 1,99∙10 -4 см/сек. Падение потенциала составляет 0,57 В/см. Диэлектрическая проницаемость равна 81, вязкость среды 0,001 Н·сек/м 2 . Частицы считать цилиндрической формы.
21. Вычислите z-потенциал частиц глины, если при градиенте потенциала 10 В/см частицы проходят 5 делений шкалы за 5 сек (60 делений шкалы соответствует 1 мм). Вязкость среды 0,001 Н·сек/м 2 , диэлектрическая проницаемость 81.
21. Дана суспензиясульфида мышьяка (III) в воде (D = 81, вязкость 0,01 П). при разности потенциалов между электродами 240 В частицы дисперсной фазы за 10 мин переместились на 14,4 мм. Расстояние между электродами равно 30 см. Вычислите электрокинетический потенциал суспензии.
Дата добавления: 2014-12-07 ; просмотров: 6956 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
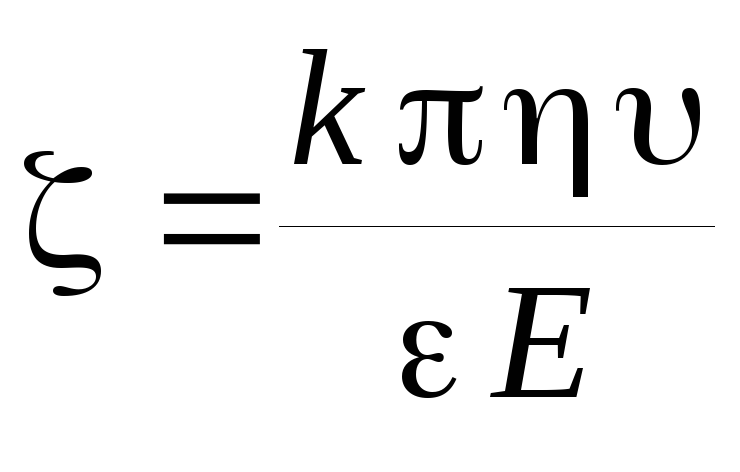
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
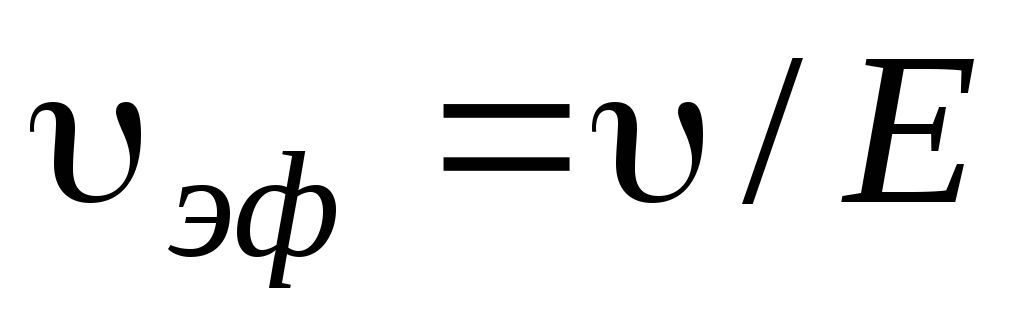
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Виды устойчивости дисперсных систем. Лиофобные и лиофильные золи
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
К осаждению дисперсной фазы — характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
лиофильные, обладающие термодинамической устойчивостью;
лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса G min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
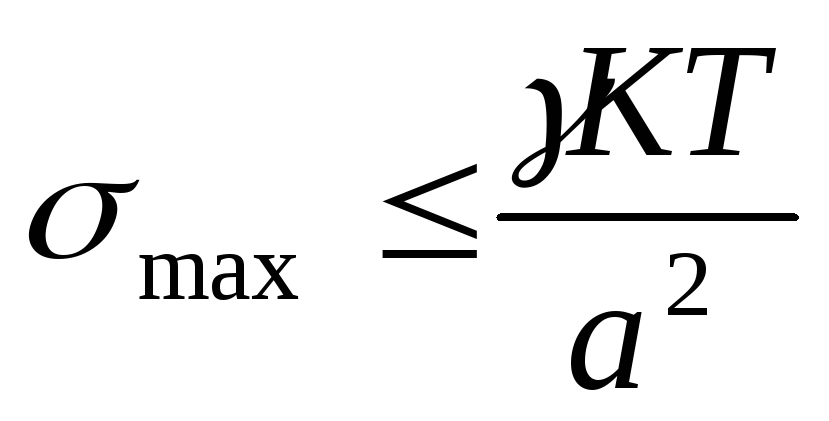
где ỵ езразмерный коэффициент;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,410 -7 до 1,410 -3 Дж/м 2 . Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Правила коагуляции электролитами. Порог коагуляции. Правило Шульце-Гарди. Виды коагуляции: концентрационная и нейтрализационная. Коагуляция смесями электролитов. Явление «неправильные ряды». Механизм и кинетика коагуляции
Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия — явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.
источник
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез — это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 6.11, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 6.11).
Рис. 6.11. Схема электрофореза:
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху — электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 6.12). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
Рис. 6.12. Схема электроосмоса
1 — дисперсная система; 2 — перегородка
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
источник
Образование коллоидных систем происходит в присутствии электролита. При взаимодействии коллоидных частиц с электролитами на поверхности частиц адсорбируется один из ионов в соответствии с правилами избирательной адсорбции Пескова-Фаянса.
В результате вещество дисперсионной фазы приобретает определенный электрический заряд, а дисперсионная среда – противоположный. Наложение постоянного электрического поля приводит к тому, что частицы дисперсной фазы и среды движутся к противоположно заряженным электродам.
Наличие у дисперсных систем электрического заряда впервые было открыто в 1808г. профессором Московского университета Рейссом. Перенос коллоидных частиц в электрическом поле получил название электрофореза.
Исследованиями Видемана, проведенными в 1852г., было установлено, что количество жидкости, прошедшей через капилляры пористой диафрагмы, пропорционально силе тока и при постоянной силе тока не зависит от площади сечения или толщины диафрагмы. Это явление было названо электроосмосом.
| а) | б) |
Рис. 20.1 а) Схема опыта Рейсса по электрофорезу;
б) Схема опыта по электроосмосу.
В первом опыте жидкость помутнела, следовательно, частицы глины переносятся в электрическом поле к положительному полюсу. При электрофорезе в результате возникновения электрического поля между электродами, благодаря малому размеру частиц глины, происходит перенос отрицательно заряженной дисперсной фазы к положительному электроду. При электроосмосе ввиду того, что частицы песка слишком тяжелы, под влиянием электрического поля по капиллярам, имеющимся в слое песка, к отрицательному электроду передвигается положительно заряженная жидкость.
Причина обоих явлений одна и та же – наличие разноименных зарядов у твердой и жидкой фазы коллоидного раствора.
Явление электрофореза широко используется на практике при обезвоживании сырых нефтей, для улавливания в заводских трубах отходов ценных металлов и т.д. Принципы электроосмоса применяются при строительстве дамб, плотин, намывке грунтов, удалении из них избыточной влаги и др.
В дальнейшем были обнаружены два явления, которые противоположны электрофорезу и электроосмосу. Дорн в 1878г. обнаружил, что при оседании каких-либо частиц в жидкости, например песка в воде, возникает разность потенциалов между двумя электродами, введенными в разные места столба жидкости. Это явление, противоположное электрофорезу, получило название эффекта Дорна, или потенциала седиментации (оседания), являющегося, как предполагают, причиной возникновения грозовых разрядов в атмосфере.
При продавливании жидкости через пористую перегородку, по обеим сторонам которой находятся электроды, также было обнаружено возникновение разности потенциалов. Явление это, открытое Квинке в 1859г. и обратное электроосмосу, было названо потенциалом протекания, или потенциалом течения.
Все четыре указанных явления получили общее название электрокинетических явлений. Причиной этих свойств дисперсных систем считают существование двойного электрического слоя на границе раздела фаз. Теоретические основы электрокинетических явлений были разработаны Гельмгольцем (1879) и позднее Смолуховским (1921).
| Рис. 20.2 Схема образования двойного электрического слоя вокруг частицы иодида серебра, находящейся в растворе KI. |
С современной точки зрения заряд на коллоидных частицах лиозолей, проявляющийся при электрофорезе, обусловлен наличием на их поверхности двойного электрического слоя из ионов, возникающего либо в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе, либо за счет ионизации поверхностных молекул веществ.
Иодид-ионы (потенциалопределяющие ионы (ПОИ)) достраивают кристаллическую решетку иодида серебра и тем самым придают частицам отрицательный заряд, а ионы калия (противоионы) находятся в растворе вблизи межфазной поверхности. В целом, весь комплекс, называемый мицеллой, остается электронейтральным.
Возникновение двойного электрического слоя за счет ионизации можно проиллюстрировать образованием двойного электрического слоя на частицах водного золя диоксида кремния. Молекулы SiO2, находящиеся на поверхности таких частиц, взаимодействуют с дисперсионной средой, гидратируются и образуют кремниевую кислоту, способную ионизироваться:
При этом силикат ионы SiO3² – остаются на поверхности частицы, обуславливая ее отрицательный заряд, а ионы водорода переходят в раствор.
При действии электрического поля на частицы, несущие двойной электрический заряд, происходит явление, напоминающее электролиз. Если дисперсная фаза заряжена отрицательно, коллоидные частицы вместе с адсорбированными на них отрицательными ПОИ движутся к аноду, а положительно заряженные противоионы – к катоду. Если дисперсная фаза заряжена положительно, направление движения частиц и ионов меняется на обратное.
Следует отметить, что к электроду, имеющему заряд, одноименный с заряженными частицами, движется только часть противоионов. Другая часть противоионов, находящихся весьма близко от поверхности дисперсной фазы, под действием значительных электрических и адсорбционных сил оказывается связанной с частицами и вынуждена двигаться вместе с ними.
Рис. 20.3 Схема движения коллоидных частиц и противоионов
При этом совершенно произвольно принято, что ПОИ заряжены отрицательно, а противоионы – положительно.
Дата добавления: 2014-01-07 ; Просмотров: 1608 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Электрофорез — направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов. Это явление наблюдается в седиментационно устойчивых дисперсных системах. При наложении на такую систему внешней разности потенциалов происходит разрыв ДЭС по плоскости скольжения, в результате чего частица получает заряд и перемещается к соответствующему электроду.
Приведенные выше уравнения Гельмгольца — Смолуховского справедливы для электрофореза, в частности для электрокинетического потенциала используется уравнение (4.9). Отличие состоит только в системе координат: в одном случае рассматривается скорость жидкости, в другом — скорость движения частиц, которую обычно определяют по смещению цветной границы.
Электрофорез наблюдают в U-образном сосуде (см. лабораторный практикум). В нижнюю часть сосуда наливают золь, сверху — контактную (боковую) жидкость, имеющую одинаковую (или немного большую) с золем электрическую проводимость. Наблюдают за изменением уровня золя в обоих коленах трубки и по скорости перемещения частиц дисперсной фазы определяют линейную скорость электрофореза Wq :
где S — путь, пройденный золем за время г (время электрофореза).
При электрофорезе отношение линейной скорости к напряженности
электрического поля 
Напряженность электрического поля Е зависит от приложенной разности потенциалов на электродах U и расстояния между ними L:
Рассмотренные уравнения справедливы при допущениях: 1) частицы движутся в однородном электрическом поле; 2) частицы могут иметь любую форму и не проводят электрический ток; 3) толщина ДЭС много меньше размеров частиц золя.
Для расчета ^-потенциала частиц, находящихся в разбавленных водных растворах при 293 К, можно использовать простое соотношение:
в котором электрофоретическая подвижность и, выражена в(тогда
^-потенциал будет иметь размерность В).
Несовпадение экспериментальных и теоретических значений объясняется релаксационным эффектом и электрофоретическим торможением.
Релаксационный эффект проявляется в нарушении симметрии диффузионного слоя вокруг частицы при относительном перемещении фаз в противоположные стороны.
Электрофоретическое торможение обусловлено сопротивлением движению частицы обратным потоком противоионов, которые увлекают за собой жидкость. В некоторых случаях несовпадение можно учесть введением поправок, иногда этим несовпадением можно пренебречь.
Скорость электрофореза зависит нс только от приложенного напряжения, но и от радиуса частиц и других факторов. Это можно учесть введением в уравнение (4.8) поправочного коэффициента к:
Поправочный коэффициент определяется экспериментально в каждом отдельном случае электрофореза.
Для примера рассмотрим данные по электрофорезу в суспензиях глин Трошковского, Никольского и Слюдянского месторождений, микрофотографии которых приведены на рис. 1.1.
Электрокинетический потенциал определяли методом подвижной границы при электрофорезе и рассчитывали по уравнению:
где S — путь;
L — расстояние между электродами;
U — разность потенциалов между электродами;
г — преимущественный радиус частицы, определяемый обычно по максимуму на кривой распределения частиц но размерам;
/(к г) — поправочная функция, учитывающая эффекты электрофоретического торможения и релаксации (табл. 4.1);
к — параметр Дебая, равный обратной величине плотной части двойного электрического слоя, то есть к = 1/6.
источник
Фердинанд Фридрих фон Рейсс (1778-1852).
Явления электрофореза и электроосмоса.
В 1803 году куратор Московского университета М.Н.Муравьев пригласил заведовать кафедрой химии молодого энергичного ученого из Германии Фридриха Рейса, который активно занялся научной деятельностью, в частности, исследованиями электрокинетических явлений.
Фердинанд Фридрих фон Рейсс (1778 – 1852) родился в Тюбингене. Его отец являлся профессором Тюбингского университета. В 1800 г. Ф. Рейсс, окончив университетский курс в Тюбингене, получил степень лиценциата медицины. Уже в 1801 г. Рейсс получил степень доктора медицины и хирургии и одновременно звание приват-доцента всеобщей медицинской химии. По приезде в Москву молодой ученый был сразу удостоен звания экстраординарного профессора (1804) Московского университета. Год спустя он был выбран в члены-корреспондены Петербургской АН. С 1808 года одинарный профессор Московского университета. Кроме того, ученый являлся в 1817– 39гг. профессором кафедры химии и рецептуры в Московском Отделении Императорской Медико-Хирургической Академии, там же возглавлял кафедру истории, методологии и энциклопедии медицины. В 1828 г. Был избран академиком Медико-хирургической академии.
В 1839 г. ученый возвратился на родину.
Важным направлением деятельности ученого явились исследования врачебного действия различных лекарств, часть его исследований была посвящена изучению физиологических процессов, происходящих в живых организмах.
В 1809 году Рейс открыл явления электрофореза и электроосмоса.
К сожалению, малая распространенность изданий, в которых были напечатаны работы Рейса, связанные с исследованием электрокинетических явлений (к тому же большая часть их была уничтожена пожаром 1812 года), объясняет то, что его труды в этой области остались практически неизвестными для широкой научной общественности. В частности, имя Рейсса даже не упоминается в работах по истории физической химии В. Оствальда.
Тем не менее, открытия Рейсса дали начало большому числу научных направлений (теория двойного электрического слоя, электрохимия, теория устойчивости дисперсных систем и др.) и практических применений электрофореза и электроосмоса в технике, геологоразведке, медицине. Несомненно, что открытие Рейсса является одним из наиболее крупных достижений ученых Московского университета.
Московский университет, которому Рейс отдал 30 лет своей творческой деятельности, высоко ценит вклад ученого в развитие науки. И хотя он не принимал российского подданства, он был занесен в список выдающихся ученых России.
Электрокинетическими явлениями называют перемещение одной фазы относительно другой в электрическом поле и возникновение разности потенциалов при течении жидкости через пористые материалы (потенциал протекания) или при оседании частиц (потенциал оседания).
Рейсс поставил два эксперимента.
В одном из них Ф. Ф. Рейсс погрузил в глину две стеклянные трубки, заполнил их водой и после наложения на них электрического поля наблюдал перемещение частиц глины в жидкости в направлении положительно заряженного электрода. Через некоторое время жидкость в трубке с положительным электродом становилась мутной из-за подъема частиц глины к электроду. Одновременно уровень жидкости в этой трубке понизился, а в другой поднялся. Этот опыт показал, что частицы глины имеют отрицательный заряд и перемещаются в электрическом поле.
Движение дисперсных частиц относительно дисперсионной среды (жидкой и газообразной) под действием электрического поля было названо электрофорезом. В водной среде частица двигается к электроду, знак заряда которого противоположен знаку электрокинетического потенциала.
В другом эксперименте Рейсс использовал U -образную трубку, перегороженную в нижней части диафрагмой из кварцевого песка и заполненную водой. При наложении электрического поля он обнаружил движение жидкости в сторону отрицательно заряженного электрода. Происходящее до тех пор, пока не устанавливалась определенная разность уровней жидкости (равновесие с гидростатическим давлением). Поскольку без диафрагмы движение жидкости отсутствовало, то последовал вывод о заряжении жидкости при контакте с частицами кварца. Явление получило название электроосмоса.
Таким образом, электроосмос – перемещение дисперсионной среды под действием электрического поля: противоионы диффузного слоя притягиваются к соответствующему электроду и увлекают за собой жидкость дисперсионной среды. Электроосмос проявляется также при движении жидкости дисперсной системы через капилляры или поры диафрагмы под действием электрического тока. Электроосмосом можно объяснить некоторые природные процессы.
Электроосмос используют для обезвоживания древесины, грунта, торфа и других материалов.
Первые количественные исследования электроосмоса были выполнены много позже Видеманном (1852). Он показал, что объёмная скорость υ электроосмоса пропорциональна силе тока I при прочих фиксированных параметрах, а отношение υ/ I не зависит от площади сечения и толщины диафрагмы.
Электрокинетические явления имеют практическое применение.
На электрофорезе основаны очистка воды, улавливание частиц дыма или пыли, выделение белков, аминокислот, витаминов и т.п. Поскольку вместе с гранулами передвигаются молекулы жидкости, составляющие их сольватные оболочки, электрофорезом производят частичное обезвоживание различных материалов (глины, почвы, мокрого торфа). Электрофоретическим методом производится нанесение покрытий на различные поверхности, например, в нашей стране эксплуатируются автоматические линии грунтовки кузовов автомобилей, также он широко применяется для покрытия катодов радиоламп, полупроводниковых деталей, нагревателей и т. д.
Практическое применение электроосмоса ограничено из-за большого расхода электроэнергии. Тем не менее, это явление используется для удаления влаги при осушке различных объектов (стен зданий, сыпучих материалов, при строительстве плотин, дамб и т. д.), для пропитки материалов различными веществами. Все большее значение приобретает электроосмотическая фильтрация,
источник
Электрокинетические свойства коллоидных систем. Электрофорез, электроосмос. Строение коллидных частиц лиофобных золей, электрокинетический потенциал. Влияние электролитов на величину электрокинетического потенциала. Изоэлектрическое состояние. Устойчивость и коагуляция коллоидных систем. Коагуляция электролитами, правило Шульце-Гарди.
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь (коллоидный раствор) состоит из двух частей: мицелл и интермицеллярной жидкости.
Мицелла – это частица дисперсной фазы золя, окруженная двойным электрическим слоем.
Интермицеллярной (межмицеллярной) жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы.
Частицы дисперсной фазы лиофобных золей имеют сложную структуру, которая зависит от условий получения золей. Предположим, что золь иодида серебра AgI образуется в ходе химической реакции между AgNO3 и KI. При этом основу коллоидных частиц составят микрокристаллы труднорастворимого AgI, включающие в себя m молекул AgI (а точнее, m пар ионов Ag + и I — ). Эти микрокристаллы называют агрегатами. Если реакция протекает в присутствии избытка иодида калия, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции n ионов I — . Иодид-ионы являются потенциалобразующими ионами (сокращенно ПОИ). Агрегат вместе с потенциалобразующими ионами является частицей твердой фазы и его называют ядром.
Под действием электростатических сил к ядру притягивается n ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют ионы K + . Часть противоионов (n — x), наиболее близко расположенных к ядру, находится в слое жидкости, смачивающем поверхность твердого ядра. Эти ионы испытывают действие не только электростатических, но и ван-дер-ваальсовых сил ядра, поэтому прочно удерживаются около него и образуют так называемый адсорбционный слой противоионов. Ядро с адсорбционным слоем противоионов образует коллоидную частицу. Остальные x противоионов, слабее связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой фазе диффузно (размыто), почему и носят название диффузного слоя. Все это образование вместе и является мицеллой.
Мицеллы золей электронейтральны. Структуру мицеллы можно записать в виде формулы:
,
где m – число молекул, входящих в состав агрегата, n – число потенциалобразующих ионов, (n – x) – число противоионов, входящих в адсорбционный слой, x – число противоионов, образующих диффузный слой.
Числа m, n и x могут изменяться в широких пределах в зависимости от условий получения и очистки золя. Обычно m >> n. Ядро вместе с адсорбционным слоем противоионов образуют собственно коллоидную частицу, или гранулу. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд, в данном случае — отрицательный (x ‑ ).
Граница между коллоидной частицей и диффузным слоем носит название поверхность скольжения. В формуле мицеллы этой границе соответствует фигурная скобка между адсорбционным и диффузным слоями (на рис. 1 — сплошная линия).
Рис. 1. Схема строения мицеллы золя иодида серебра
с отрицательно заряженными частицами.
Граница скольжения обозначает ту геометрическую поверхность, по которой происходит разделение («разрыв») мицеллы на коллоидную частицу и диффузный слой в случае ее перемещения относительно дисперсионной среды (например, при участии мицеллы в броуновском движении или при движении под действием электрического поля).
На границе раздела твердое тело – жидкость возникает двойной электрический слой. Согласно современным представлениям, двойной электрический слой (ДЭС) — это образующийся на границе двух фаз тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака (потенциалобразующих ионов и противоионов). Потенциалобразующие ионы, адсорбирующиеся на твердой поверхности, — это внутренняя обкладка ДЭС. Внешняя обкладка ДЭС (слой противоионов) состоит из двух частей: плотной и диффузной.
Образование двойного слоя ионов приводит к появлению определенных электрических потенциалов на границе раздела твердой и жидкой фаз. Ионы первого слоя (внутренней обкладки), фиксированные на твердой поверхности, придают этой поверхности свой знак заряда и создают на ней так называемый поверхностный или φ-потенциал. Знак φ-потенциала совпадает со знаком заряда потенциалобразующих ионов. Величина φ-потенциала пропорциональна числу зарядов этих ионов на поверхности частиц.
С точки зрения термодинамики, φ-потенциал равен работе переноса единичного (элементарного) заряда из бесконечно удаленной точки объема раствора на поверхность твердой фазы, т. е. представляет собой потенциал твердой поверхности. Прямых методов его измерения не имеется.
Второй потенциал, характеризующий двойной слой ионов, называют электрокинетическим потенциалом или x-потенциалом (дзета-потенциалом). Он представляет собой электрический потенциал в двойном слое на границе между коллоидной частицей, способной к движению в электрическом поле и окружающей жидкостью. x-потенциал является потенциалом поверхности скольжения. Однако в двойном электрическом слое точное расстояние от твердой поверхности до поверхности скольжения неизвестно. Поэтому приближенно можно принять, что поверхность скольжения проходит по границе между адсорбционным и диффузным слоями противоионов. Следовательно x-потенциал близок, хотя и не совсем равен, потенциалу на границе адсорбционного и диффузионного слоев.
Термодинамически ξ-потенциал можно определить как работу, необходимую для переноса единичного заряда из бесконечно удаленного элемента объема раствора на поверхность скольжения. Знак ξ-потенциала обычно совпадает со знаком φ-потенциала. ξ-потенциал является частью φ‑потенциала и всегда меньше, чем φ‑потенциал. Величина ξ-потенциала непосредственно связана с числом противоионов в диффузном слое и изменяется пропорционально этому числу. Можно считать, что с увеличением толщины диффузного слоя ξ‑потенциал повышается. Поскольку электрокинетический потенциал относится к коллоидной частице и обусловливает ее подвижность в электрическом поле, величина этого потенциала может быть измерена экспериментально по скорости движения частиц. Направление же перемещения частиц к катоду или аноду указывает на знак ξ-потенциала.
Благодаря наличию ξ-потенциала на границах скольжения всех частиц дисперсной фазы возникают одноименные заряды и электростатические силы отталкивания противостоят процессам агрегации. Таким образом, ξ-потенциал является одним из основных факторов агрегативной устойчивости гидрофобных золей. Величина, а иногда и знаки φ- и ξ-потенциалов могут изменяться под влиянием внешних воздействий (электролитов, разведения, повышения температуры). Особенно чувствителен к этим факторам ξ-потенциал.
14.2.Электрокинетические свойства коллоидных систем: электрофорез, электроосмос.
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом — опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
, (1)
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
. (2)
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца — Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9438 — 

источник








