Впоследствии были предложены технологии разделения на плотных носителях, среди которых особое место заняли гели. Последние сочетали удобства разделения в свободном растворе (в геле 95-99% воды) с возможностью фиксировать результаты электрофореза путем высушивания геля. Среди гелеобразующих веществ вначале получил признание крахмал, затем полисахариды из водорослей агар-агар (агароза) и наконец гели, искусственно получаемые путем полимеризации акриламида.
Полиакриламидный гель стал одним из наиболее популярных носителей для электрофореза. Полимеризацию проводят в буферном растворе. Затем гель помещают в электрофоретическую камеру, заполненную буферным раствором и содержащую электроды для образования электрического поля (рис.1.8). рН и другие параметры буферного раствора выбираются из расчета, чтобы разделяемые молекулы несли отрицательный заряд и двигались в электрическом поле слева направо. Поскольку разделяемые молекулы движутся в геле, те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к месту нанесения, чем меньшие.
Рис.1.8. Виды проведения электрофореза в полиакриламидном геле (слева — в трубках с гелем, справа — в прямоугольных блоках)
Следует иметь ввиду, что этот метод позволяет разделять молекулы большей частью по их размеру, и совсем необязательно, — по их молекулярной массе. Для примера рассмотрим две молекулы белка по 1000 аминокислот каждая. Одна из них представляет вытянутую цепь (А), а вторая (за счет образования связей между соседними участками) имеет форму шпильки (Б):
Поскольку они движутся внутри геля, обе молекулы будут вести себя как сферы, диаметр которых равняется длине вытянутой части молекулы. Обе молекулы имеют одинаковую молекулярную массу, однако благодаря тому, что вторичная структура Б де-лает её молекулу короче, чем А, быстрее будет передвигаться Б. Дабы устранить влияние различий по форме и оставить только различия по молекулярной массе, разделяемые молекулы должны иметь развернутую конформацию (без вторичной структуры). Для разрушения вторичной и третичной структуры используются различные методы подготовки препаратов белка.
Подготовка белков. Все белки обладают вторичной и третичной структурной организацией. При этом их молекулы не всегда несут отрицательный заряд в растворе. Для разрушения вторичной и третичной структуры и образования на поверхности белков отрицательного заряда их нагревают и обрабатывают детергентом – додецилсульфатом натрия (ДДС-натрий).
Если соблюсти вышеприведенные условия, разделение молекул при электрофорезе будет осуществляться в зависимости от их молекулярной массы. При этом удается, например, разделить 2 молекулы полинуклеотида, различающиеся на 1 мононуклеотид. Высокомолекулярные молекулы будут двигаться медленнее низкомолекулярных. Длина пройденного молекулой расстояния будет пропорциональна логарифму величины, обратной её молекулярной массе (log 1/MM).
Обычно гели изображают в вертикальном положении, где место нанесения находится вверху, а движение разделяемых молекул направлено сверху вниз. Тогда в верхней части геля располагаются большие молекулы, а в нижней – с меньшей молекулярной массой.
Как правило, рядом с опытными пробами на гель наносится смесь белковых (или каких-то других разделяемых) молекул с известной молекулярной массой. Такие стандарты «молекулярной массы» позволяют прокалибровать пробег молекул. Тогда, зная какое расстояние прошло изучаемое вещество, можно установить его молекулярную массу. Ниже на рисунке 1.9 показан гель после обработки его красителем. Молекулы красителя связываются с каким-то определенным классом макромолекул независимо от последовательности расположения мономеров в их составе.
Рис.1.9. Результат проведения электрофореза в полиакриламидном геле после окраски геля неспецифическим красителем
Изображенный на рис.1.9 образец 1 содержит макромолекулы одного размера. Это может быть очищенный белок. При сравнении с подвижностью стандартов ясно, что молекулярная масса этого соединения около 3. Образец 2. Это может быть смесь белков после окраски геля неспецифическим красителем. Здесь находится так много полос, что среди них невозможно вычленить необходимую. В подобных условиях без зонда (который действует как специфический краситель) нам едва ли удастся получить полезную информацию об интересующем соединении. Учитывая это обстоятельство, для определения индивидуальных белков пользуются сочетанием электрофореза с иммунологическими реакциями (иммуноэлектрофорез) (рис.1.10).
Рис.1.10. Схема проведения иммуноблот анализа для обнаружения белка после проведения электрофореза в полиакриламидном геле (описание этапов приведено в гл.13)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 10033 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Что такое клинические исследования и зачем они нужны? Это исследования, в которых принимают участие люди (добровольцы) и в ходе которых учёные выясняют, является ли новый препарат, способ лечения или медицинский прибор более эффективным и безопасным для здоровья человека, чем уже существующие.
Главная цель клинического исследования — найти лучший способ профилактики, диагностики и лечения того или иного заболевания. Проводить клинические исследования необходимо, чтобы развивать медицину, повышать качество жизни людей и чтобы новое лечение стало доступным для каждого человека.
У каждого исследования бывает четыре этапа (фазы):
I фаза — исследователи впервые тестируют препарат или метод лечения с участием небольшой группы людей (20—80 человек). Цель этого этапа — узнать, насколько препарат или способ лечения безопасен, и выявить побочные эффекты. На этом этапе могут участвуют как здоровые люди, так и люди с подходящим заболеванием. Чтобы приступить к I фазе клинического исследования, учёные несколько лет проводили сотни других тестов, в том числе на безопасность, с участием лабораторных животных, чей обмен веществ максимально приближен к человеческому;
II фаза — исследователи назначают препарат или метод лечения большей группе людей (100—300 человек), чтобы определить его эффективность и продолжать изучать безопасность. На этом этапе участвуют люди с подходящим заболеванием;
III фаза — исследователи предоставляют препарат или метод лечения значительным группам людей (1000—3000 человек), чтобы подтвердить его эффективность, сравнить с золотым стандартом (или плацебо) и собрать дополнительную информацию, которая позволит его безопасно использовать. Иногда на этом этапе выявляют другие, редко возникающие побочные эффекты. Здесь также участвуют люди с подходящим заболеванием. Если III фаза проходит успешно, препарат регистрируют в Минздраве и врачи получают возможность назначать его;
IV фаза — исследователи продолжают отслеживать информацию о безопасности, эффективности, побочных эффектах и оптимальном использовании препарата после того, как его зарегистрировали и он стал доступен всем пациентам.
Считается, что наиболее точные результаты дает метод исследования, когда ни врач, ни участник не знают, какой препарат — новый или существующий — принимает пациент. Такое исследование называют «двойным слепым». Так делают, чтобы врачи интуитивно не влияли на распределение пациентов. Если о препарате не знает только участник, исследование называется «простым слепым».
Чтобы провести клиническое исследование (особенно это касается «слепого» исследования), врачи могут использовать такой приём, как рандомизация — случайное распределение участников исследования по группам (новый препарат и существующий или плацебо). Такой метод необходим, что минимизировать субъективность при распределении пациентов. Поэтому обычно эту процедуру проводят с помощью специальной компьютерной программы.
- бесплатный доступ к новым методам лечения прежде, чем они начнут широко применяться;
- качественный уход, который, как правило, значительно превосходит тот, что доступен в рутинной практике;
- участие в развитии медицины и поиске новых эффективных методов лечения, что может оказаться полезным не только для вас, но и для других пациентов, среди которых могут оказаться члены семьи;
- иногда врачи продолжают наблюдать и оказывать помощь и после окончания исследования.
- новый препарат или метод лечения не всегда лучше, чем уже существующий;
- даже если новый препарат или метод лечения эффективен для других участников, он может не подойти лично вам;
- новый препарат или метод лечения может иметь неожиданные побочные эффекты.
Главные отличия клинических исследований от некоторых других научных методов: добровольность и безопасность. Люди самостоятельно (в отличие от кроликов) решают вопрос об участии. Каждый потенциальный участник узнаёт о процессе клинического исследования во всех подробностях из информационного листка — документа, который описывает задачи, методологию, процедуры и другие детали исследования. Более того, в любой момент можно отказаться от участия в исследовании, вне зависимости от причин.
Обычно участники клинических исследований защищены лучше, чем обычные пациенты. Побочные эффекты могут проявиться и во время исследования, и во время стандартного лечения. Но в первом случае человек получает дополнительную страховку и, как правило, более качественные процедуры, чем в обычной практике.
Клинические исследования — это далеко не первые тестирования нового препарата или метода лечения. Перед ними идёт этап серьёзных доклинических, лабораторных испытаний. Средства, которые успешно его прошли, то есть показали высокую эффективность и безопасность, идут дальше — на проверку к людям. Но и это не всё.
Сначала компания должна пройти этическую экспертизу и получить разрешение Минздрава РФ на проведение клинических исследований. Комитет по этике — куда входят независимые эксперты — проверяет, соответствует ли протокол исследования этическим нормам, выясняет, достаточно ли защищены участники исследования, оценивает квалификацию врачей, которые будут его проводить. Во время самого исследования состояние здоровья пациентов тщательно контролируют врачи, и если оно ухудшится, человек прекратит своё участие, и ему окажут медицинскую помощь. Несмотря на важность исследований для развития медицины и поиска эффективных средств для лечения заболеваний, для врачей и организаторов состояние и безопасность пациентов — самое важное.
Потому что проверить его эффективность и безопасность по-другому, увы, нельзя. Моделирование и исследования на животных не дают полную информацию: например, препарат может влиять на животное и человека по-разному. Все использующиеся научные методы, доклинические испытания и клинические исследования направлены на то, чтобы выявить самый эффективный и самый безопасный препарат или метод. И почти все лекарства, которыми люди пользуются, особенно в течение последних 20 лет, прошли точно такие же клинические исследования.
Если человек страдает серьёзным, например, онкологическим, заболеванием, он может попасть в группу плацебо только если на момент исследования нет других, уже доказавших свою эффективность препаратов или методов лечения. При этом нет уверенности в том, что новый препарат окажется лучше и безопаснее плацебо.
Согласно Хельсинской декларации, организаторы исследований должны предпринять максимум усилий, чтобы избежать использования плацебо. Несмотря на то что сравнение нового препарата с плацебо считается одним из самых действенных и самых быстрых способов доказать эффективность первого, учёные прибегают к плацебо только в двух случаях, когда: нет другого стандартного препарата или метода лечения с уже доказанной эффективностью; есть научно обоснованные причины применения плацебо. При этом здоровье человека в обеих ситуациях не должно подвергаться риску. И перед стартом клинического исследования каждого участника проинформируют об использовании плацебо.
Обычно оплачивают участие в I фазе исследований — и только здоровым людям. Очевидно, что они не заинтересованы в новом препарате с точки зрения улучшения своего здоровья, поэтому деньги становятся для них неплохой мотивацией. Участие во II и III фазах клинического исследования не оплачивают — так делают, чтобы в этом случае деньги как раз не были мотивацией, чтобы человек смог трезво оценить всю возможную пользу и риски, связанные с участием в клиническом исследовании. Но иногда организаторы клинических исследований покрывают расходы на дорогу.
Если вы решили принять участие в исследовании, обсудите это со своим лечащим врачом. Он может рассказать, как правильно выбрать исследование и на что обратить внимание, или даже подскажет конкретное исследование.
Клинические исследования, одобренные на проведение, можно найти в реестре Минздрава РФ и на международном информационном ресурсе www.clinicaltrials.gov.
Обращайте внимание на международные многоцентровые исследования — это исследования, в ходе которых препарат тестируют не только в России, но и в других странах. Они проводятся в соответствии с международными стандартами и единым для всех протоколом.
После того как вы нашли подходящее клиническое исследование и связались с его организатором, прочитайте информационный листок и не стесняйтесь задавать вопросы. Например, вы можете спросить, какая цель у исследования, кто является спонсором исследования, какие лекарства или приборы будут задействованы, являются ли какие-либо процедуры болезненными, какие есть возможные риски и побочные эффекты, как это испытание повлияет на вашу повседневную жизнь, как долго будет длиться исследование, кто будет следить за вашим состоянием. По ходу общения вы поймёте, сможете ли довериться этим людям.
Если остались вопросы — спрашивайте в комментариях.
источник
Метод электрофореза в геле использует разницу в размере и заряде различных молекул в образце. Образец ДНК или белка, подлежащий разделению, погружают в пористый гель, помещенный в ионную буферную среду. При приложении электрического поля каждая молекула, имеющая разный размер и заряд, будет проходить через гель с разной скоростью.
Пористый гель, используемый в этой технике, действует как молекулярное сито, которое отделяет большие молекулы от более мелких. Меньшие молекулы движутся быстрее по гелю, а более крупные медленнее. Подвижность частиц также определется их индивидуальным электрическим зарядом. Два противоположно заряженных электрода, которые являются частью системы, тянут молекулы к себе на основе их заряда.

Образцы, которые необходимо проанализировать, затем загружают в маленькие лунки в геле с помощью пипетки. По завершении загрузки применяется электрический ток 50-150 В. Теперь заряженные молекулы, присутствующие в образце, начинают мигрировать через гель к электродам. Отрицательно заряженные молекулы движутся к положительному электроду, а положительно заряженные молекулы мигрируют к отрицательному электроду.
Скорость, с которой каждая молекула перемещается через гель, называется ее электрофоретической подвижностью и определяется главным образом ее чистым зарядом и размером. Сильно заряженные молекулы движутся быстрее, чем слабо заряженные. Меньшие молекулы работают быстрее, оставляя более крупные. Таким образом, сильный заряд и малый размер увеличивают электрофоретическую подвижность молекулы, а слабый заряд и большие размеры уменьшают подвижность молекулы. Когда все молекулы в образце имеют одинаковый размер, разделение будет основываться исключительно на их размере.
источник
Электрофорез (от электро- и др.-греч. φορέω — «переношу») —метод разделения макромолекул, различающихся по размеру, молекулярной массе, пространственной конфигурацией, вторичной структурой или электрическому заряду. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.
Молекулы в буферном растворе обладают электрическим зарядом, величина и знак которого зависят от pH среды. При пропускании электрического тока через раствор в нем формируется направленное электрическое поле, напряженность которого измеряется разностью потенциалов по концам емкости, в которой производится электрофорез. Под действием поля молекулы начинают движение в направлении катода или анода. Скорость движения зависит от величины заряда, размеров и трения окружающей среды. С течением времени смесь разделяется на фракции, состоящие из молекул, движущихся с одинаковой скоростью. В современных экспериментах рабочий канал приборов для электрофореза заполняют гелем, имеющим структуру сетки. В этом случае основное влияние на подвижность молекул и их степень разделения оказывают их линейные размеры. В некоторых случаях может возникнуть ситуация, при которой особо крупные молекулы не проходят через поры геля.
Бромфеноловый синий и ксиленцианол — могут заметно мешать наблюдению фрагментов под UV. Краситель Cresol red совместим с ферментативными реакциями, практически не мешает наблюдению под UV. OrangeG наиболее подвижный краситель, практически всегда находится вне «рабочей зоны». Заметен под UV. Краситель в буфере нужен лишь для того, чтобы образец был легко заметен в лунке и в геле.
Самое широкое применение агарозные гели имеют в исследованиях, связанные с разделением нуклиновых кислот. Последние имеют довольно значительные отрицательный заряд, величина которого слабо зависиот от pH раствора, вследствие чего разделение на фракции происходит в основном за счет различия в линейных размеров молекул. В таких экспериментах используют 0.089М Трис-боратный, 0.05 Трсфосфатный и Трис-ацетатный буфер. Стоит отметить, что при обычном электрофорезе в геле можно разделять фрагменты нуклеиновых кислот, размер которых менее 50 тыс п.н. Также часто из эксперимента нужно получить оценку размеров молекул. Для этого используются наборы молекул известной длины. Например, для регистрации продуктов амплификации ДНК применяется электрофорез в агарозном геле в присутствии бромистого эитидия, который образует с фрагментами ДНК устойчивое соединение внедрения, проявляющееся в виде светящихся полос при облучении геля УФ-излучением длиной волны 290-330 нм.
источник
Плесени — это простейшие растения из семейства грибов. Однако они намного сложнее по структуре, чем бактерии или дрожж.
Кокки (от греч. kókkos — «зерно») — бактерии шаровидной формы. Диаметр 1— 2 мкм, неподвижны, не образуют спор, .
Наука, изучающая паразитов и вызываемые ими заболевания, называется медицинской паразитологией. Организмы, живущие за .
Вода является естественной средой обитания многих микробов. Основная масса микробов поступает из почвы. Количество мик.
В этот класс включены обитатели морей, водоемов и почвы. Они относятся к примитивным простейшим, которых называют амеб.
Электрофорез – метод разделения белков и нуклеиновых кислот в свободном водном растворе и пористом матриксе, в качестве которого можно использовать полисахариды, например, крахмал или агарозу. Биомолекулы обычно несут суммарный положительный или отрицательный заряд, обусловленный наличием на их поверхности положительно или отрицательно заряженных групп аминокислот.
Если белковые молекулы поместить в электрическое поле, они начинают перемещаться со скоростью, которая определяется их суммарным зарядом, а также формой и размерами. В середине 60-х годов был разработан модифицированный метод электрофореза — электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ). При использовании данного метода белки мигрируют в инертном матриксе-полиакриламидном геле с высоким содержанием поперечных сшивок. Обычно гель готовят полимеризацией мономеров непосредственно перед использованием. Размеры пор геля могут быть подобраны произвольно с тем, чтобы гель мог замедлить миграцию определенных молекул. При этом белки находятся в растворе,содержащем мощный, отрицательно заряженный детергент — додецил-сульфат натрия или ДСН (SDS).Связываясь с гидрофобными участками белковой молекулы, этот детергент вызывает развертывание белковых молекул в длинные вытянутые цепи. Каждая молекула белка связывает значительное количество молекул детергента, приобретая суммарный отрицательный заряд. По этой причине белок после того, как будет приложено напряжение, начнет двигаться в направлении положительного электрода.
Белки одного размера ведут себя сходным образом, поскольку,во-первых, их природная структура полностью нарушена ДСН так, что их форма идентична, во-вторых, они связывают одинаковое количество ДСН и приобретают одинаковый негативный заряд. Крупные белки, обладающие большим зарядом, подвергаются действию значительных электрических сил, а также более существенному торможению. В обычных растворах эти эффекты, как правило, взаимно погашаются, но в порах полиакриламидного геля, действующего как молекулярное сито, большие молекулы тормозятся значительно сильнее, чем малые, поэтому оказываются ближе к стартовой линии. Смесь молекул делится на ряд полос, расположенных в соответствии с их молекулярной массой.
Выявить эти полосы можно путем окрашивания соответствующим красителем. Например, белки индентифицируются красителем кумасси синим. Известно, что близко расположенные полосы в геле могут перекрываться. Этот эффект препятствует выявлению большого количества белков (не больше 50) с помощью одномерных методов их разделения.
Метод двумерного гель-электрофореза, в котором объединены две различные процедуры разделения, позволяет идентифицировать более 1000 белков. Результаты при этом получают в виде «двумерной» белковой карты.
При работе данным методом на первом этапе белки разделяют по их заряду. Для этого образец помещают в небольшой объем раствора, содержащего неионный (незаряженный) детергент-меркаптоэтанол, и в качестве денатурирующего агента-мочевину. В этом растворе происходит солюбилизация, денатурация и диссоциация всех без исключения полипептидных цепей; при этом изменения заряда цепей не происходит.
Диссоциированные полипептидные цепи разделяют затем методом изоэлектрического фокусирования, основанном на изменении заряда белковой молекулы при изменении рН окружающей среды. Каждый из белков может быть охарактеризован изоэлектрической точкой — значением рН, при котором суммарный заряд белковой молекулы равен нулю, и, следовательно, белок не способен перемещаться под действием электрического поля. При изоэлектрическом фокусировании белки подвергаются электрофорезу в геле, в котором с помощью специальных буферов создается градиент рН. Под действием электрического поля каждый белок перемещается в ту зону градиента, которая соответствует его изоэлектрической точке и остается в ней.
Так происходит разделение белков в одном направлении двумерного гель-электрофореза. На втором этапе гель, содержащий разделенные белки, снова подвергается электрофорезу, на этот раз в направлении перпендикулярном тому, что на первом этапе. В этом случае электрофорез ведут в присутствии ДСН и белки разделяют по их молекулярной массе, как в одномерном ДСН-ПААГ. Исходный гель пропитывают додецил-сульфатом натрия и, поместив его на блок ДСН-ПААГ-геля, проводят электрофорез, в ходе которого каждая из полипептидных цепей мигрирует сквозь блок геля и образует в нем отдельную полосу. Неразделенными в результате остаются только те бели, которые неразличимы как по изоэлектрической точке, так и по молекулярной массе; такое сочетание встречается очень редко.
источник
После проведения ПЦР осуществляют электрофорез в агарозном геле. Образцы, содержащие синтезированные в ПЦР фрагменты ДНК, наносят в лунки агарозного геля. Под действием электрического поля фрагменты ДНК, несущие отрицательный заряд, движутся от отрицательного полюса к положительному. При этом скорость фрагментов различной величины в агарозном геле разная: за одно и то же время короткие фрагменты проходят большее расстояние от старта, чем длинные. После просматривания геля в ультрафиолетовом свете можно говорить о результатах ПЦР (в случае успешного прохождения реакции на геле видны светящиеся полоски).
Продукт ПЦР, где в качестве матрицы использовалась нуклеиновая кислота, выделенная из исследуемого образца, сравнивается с продуктом реакции, где в качестве матрицы использовалась контрольная ДНК, — так называемый положительный, или (+)-контроль.
Пробы, в которых положение полученной полосы точно совпадает с положением полосы (+)-контроля, считаются положительными.
Помимо реакции с исследуемыми образцами и (+)-контролем должна быть поставлена еще одна проверочная реакция — реакция отрицательного контроля — (-)-контроля. В ней вместо матрицы используется вода. Эта реакция проводится, чтобы убедиться, что используемые реактивы не заражены амплификатами или ДНК. Если (-)-контроль срабатывает как (+)-конгроль, это свидетельствует о контаминации реактивов и требует повторного анализа с использованием новых реагентов.
а) Электрофорез в агарозном геле, содержащем бромистый этидий:
1. Приготовление буфера для электрофореза. Для приготовления 1 л однократного буфера для электрофореза к 20 мл 50-кратного ТАЕ-буфера добавляют 980 мл дистиллированной воды и 25 мкл раствора бромистого этидия (10 мг/мл).
ТАЕ-буфер можно приготовить самостоятельно по следующей прописи: навеску 4,04 г триса растворяют в 200 мл дистиллированной воды, добавляют 1,14 мл ледяной уксусной кислоты и 2 мл 0,5М раствора ЭДТА, pH 8,0, и доводят объем буфера до 1000 мл дистиллированной водой. После растворения компонентов буфера добавляют 25 мкл раствора бромистого этидия (10 мг/мл).
2. Приготовление агарозного геля. К 100 мл однократного буфера для электрофореза добавляют 2 г агарозы, доводят до кипения и охлаждают до 45 °С. Заливают в специальную форму с гребенкой и дают затвердеть. Гребенку осторожно вынимают, форму с агарозой переносят в аппарат для горизонтального электрофореза и погружают в буфер.
3. Электрофорез продуктов амплификации. К 7 мкл амплификационной смеси (водной фазы) добавляют 1,5 мкл буфера для нанесения образца, перемешивают нипетированием и полученный образец вносят в лунки агарозного геля, образовавшиеся от зубцов гребенки.
Электрофорез проводят при напряжении 6-8В/см длины геля в течение 60 мин. За это время краситель успевает пройти не менее половины геля. Направление движения образцов в геле — от — к +!
4. Учет результатов электрофореза. Результаты электрофореза просматривают в ультрафиолетовом свете с длиной волны 254 нм на приборе УФ «Трансиллюминатор». Результаты реакции проявляются в виде светящихся красноватых полос. Полученные результаты документируют фотографированием гелей. Фотография может быть сделана любым фотоаппаратом с оранжевым светофильтром.
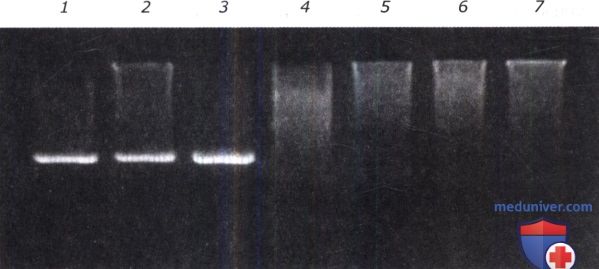
б) Интерпретация результатов ПЦР. Результат ПЦР можно интерпретировать как положительный или отрицательный в зависимости от того, обнаружена в образце искомая последовательность или нет.
Пример агарозного геля можно подробно рассмотреть на рисунке выше. На первую «дорожку» геля нанесен амплификат, который получился в пробе с положительным контролем. На последнюю «дорожку» нанесен образец отрицательного контроля, или контроля чистоты реагентов. На «дорожках» 2-6 приведен анализ пяти экспериментальных образцов. Первые два образца («дорожки» 2 и 3) — положительные. Остальные три («дорожки» 4 и 5) — отрицательные.
В некоторых случаях амплификации вообще не происходит, и очень трудно понять, по какой причине. В биологических образцах могут содержаться различные вещества, которые ингибируют полимеразную реакцию. Если по этой причине ПЦР не прошла в какой-то отдельной пробирке, то результат, полученный в образце, называют ложноотрицательным. Для того чтобы понять, каков результат, отрицательный или ложноотрицательный, в некоторых тест-системах вводят внутренний контроль реакции. Внутренний контроль (добавление известной последовательности ДНК в реакционную смесь) дает заведомо положительный результат ПЦР.
При этом в случае положительного результата ПЦР и в положительном контроле на геле видны две полосы (специфическая полоса и полоса внутреннего контроля), в случае отрицательного результата видна одна полоса внутреннего контроля и в случае ложноотрицательного результата на геле не будет видно ни одной полосы.
Редактор: Искандер Милевски. Дата публикации: 28.08.2019
источник
Содержимое (Table of Contents)
Настоящая общая фармакопейная статья распространяется на метод молекулярной биологии и биохимии – электрофорез в полиакриламидном геле (ПААГ), используемый для разделения белков и нуклеиновых кислот, который основан на движении заряженных биологических макромолекул в постоянном электрическом поле.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Электрофорез ОФС.1.2.1.0023.15
в полиакриламидном геле Вводится впервые
Настоящая общая фармакопейная статья распространяется на метод молекулярной биологии и биохимии – электрофорез в полиакриламидном геле (ПААГ), используемый для разделения белков и нуклеиновых кислот, который основан на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также в зависимости от конфигурации молекул. Изменяя концентрацию полимера, можно получать гели с широким диапазоном размеров пор, позволяющих проводить разделение белков и пептидов с молекулярными массами от 2 до 300 тыс. кДа. Можно также изменять электрический заряд макромолекул (путем вариации рН буферного раствора) и их конформацию за счет введения в буферный раствор денатурирующих агентов или детергентов.
Протекание через жидкость электрического тока неизбежно связано с выделением тепла, поэтому следует обеспечивать теплоотвод и стабильность температурного режима с целью исключения изменений вязкости, проводимости и скорости потока и, следовательно, искажения зон анализируемых компонентов.
Для наблюдения за процессом в исходный препарат добавляют краситель, молекулы которого несут электрический заряд того же знака, что и фракционируемые молекулы, но не взаимодействуют с ними, причем скорость миграции наиболее подвижных макромолекул пробы должна быть несколько ниже, чем у молекул красителя. Когда фронт красителя достигает противоположной границы геля, электрофорез прекращают.
Разделившиеся зоны биополимеров во избежание их диффузии немедленно фиксируют. Для этого гель извлекают из стеклянной формы и выдерживают в смеси кислоты со спиртом так, что белки или нуклеиновые кислоты фиксируются в том самом месте, где закончилась их миграция. После фиксации или одновременно с ней проводят окрашивание зон путем выдерживания геля в растворе красителя, прочно связывающегося с белком или нуклеиновой кислотой. Излишек красителя удаляют.
Вместо окрашивания или наряду с ним могут использоваться радиоактивные метки и приемы регистрации полос на фотопленке посредством авторадиографии или флюорографии и различные способы счета радиоактивности в геле с помощью жидкостных сцинтилляционных счетчиков.
Гель полиакриламида имеет ряд преимуществ, определяющих его широкое использование. Он прозрачен, химически стабилен, инертен, устойчив к изменениям рН и температуры, нерастворим в большинстве растворителей, и, наконец, в нем практически отсутствуют адсорбция и электроосмос.
Разделяющие свойства полиакриламидных гелей (ПААГ) определяются трехмерной сетью волокон и пор, которая сформирована за счет бифункциональных бисакриламидных связей между смежными полиакриламидными цепями. Полимеризация катализируется системой, производящей свободные радикалы, составленной из аммония персульфата и тетраметилэтилендиамина.
С увеличением концентрации акриламида в геле эффективный размер пор уменьшается. Эффективный размер пор геля определяет его разделяющие свойства, то есть сопротивление геля к перемещению макромолекул. Существуют пределы концентраций акриламида, которые могут использоваться. При высоких концентрациях акриламида гели становятся более ломкими и трудны в обращении. С уменьшением размера пор геля уменьшается скорость перемещения белка через гель. Регулируя размер пор геля путем изменения концентрации акриламида, можно оптимизировать разрешающую способность метода для конкретного анализируемого образца. Таким образом, физическое состояние ПААГ характеризуется по составу акриламида и бисакриламида. Обычно используются гели, в которых общая концентрация мономера и сшивающего агента находится в диапазоне от 3 до 30 %, а количество сшивающего агента обычно составляет от одной десятой до одной двадцатой от количества мономера. При этом содержание сшивающего агента тем меньше, чем выше общая концентрация геля.
Электрофорез в полиакриламидных гелях с использованием натрия додецилсульфата (SDS) – наиболее распространенный способ электрофореза, используемый для оценки подлинности и чистоты белковых продуктов. Денатурированные под воздействием высокой температуры полипептиды, связываясь с анионным детергентом SDS, становятся отрицательно заряженными и приобретают конформацию, при которой радиус Стокса является функцией молекулярной массы независимо от типа белка. Поскольку количество связанного SDS почти всегда пропорционально молекулярной массе полипептида и не зависит от последовательности аминокислот в полипептиде, SDS-полипептидные комплексы мигрируют через полиакриламидные гели с подвижностью, прямо пропорциональной молекулярной массе полипептида.
Молекулярная масса белка может быть оценена по его относительной подвижности на прокалиброванном геле, и обнаружение отдельной полосы в таком геле является критерием чистоты.
Однако, наличие у полипептида радикалов типа N- или O-связанных гликозидов оказывает существенное влияние на оценку молекулярной массы белка, поскольку SDS не связывается с углеводной частью молекулы так же, как с полипептидной. Таким образом, пропорциональность отношения «заряд к массе» не выдерживается и электрофоретическая подвижность белков, подвергшихся посттрансляционным модификациям, не является истинным отражением молекулярной массы полипептидной цепи.
Трехмерная структура белков часто поддерживается за счет дисульфидных связей. Цель анализа SDS-ПААГ в восстанавливающих условиях состоит в том, чтобы разрушить эту структуру путем расщепления дисульфидных связей. Денатурация и дезагрегация белков заключается в обработке их 2-меркаптоэтанолом или дитиотреитолом (DTT), в результате которой происходит разрыв S-S связей, разворачивание полипептидной цепи и последующее связывание с SDS. В этих условиях молекулярная масса полипептидных субъединиц может быть рассчитана методом линейной регрессии при использовании подходящих стандартов молекулярных масс.
Без обработки восстанавливающими агентами типа 2-меркаптоэтанола или DTT дисульфидные ковалентные связи остаются неповрежденными и разделения на полипептидные субъединицы не происходит. Невосстановленные белки не могут полностью насыщаться SDS и, следовательно, не могут связывать детергент в постоянном массовом отношении. Это делает определение молекулярных масс этих молекул методом SDS-ПААГ менее стандартизованным, чем исследование полностью денатурированных полипептидов. Однако, выявление одной полосы в таком геле (т.е. отсутствие любых компонентов, отличных от основного компонента) является показателем чистоты белка.
Электрофорез белков в полиакриламидных гелях с натрия додецилсульфатом (SDS-PAGE), как правило, проводится в неоднородной буферной системе, которая описывается ниже.
Электрофорез в геле с неоднородной буферной системой (диск—электрофорез)
Метод диск-электрофореза, благодаря своей высокой разрешающей способности, рекомендуется для характеристики смесей белков и для обнаружения примесей, которые могут иметь подвижность, близкую к подвижности главного компонента.
Метод подразумевает использование прерывистой системы, состоящей из двух отличных гелей: разделяющего (нижнего) геля и концентрирующего (верхнего) геля. Эти два геля имеют различную пористость (верхний – крупнопористый, нижний – мелкопористый). Кроме степени пористости, эти два геля резко различаются по рН и молярности буферов, в которых они полимеризуются. Пористость, длина и тип буфера для нижнего геля определяются точно такими же соображениями, что и для простого непрерывного электрофореза.
Отличительной особенностью данного вида электрофореза является обязательное использование в составе электродного буферного раствора подвижных ионов, мигрирующих в том же направлении, что и белки; например, применение иона Cl — для щелочных буферных растворов или иона K + – для кислых. В этом буферном растворе подвижность иона, мигрирующего в том же направлении, что и белок, должна сильно зависеть от рН. Для этого удобно использовать цвиттерионы: например, простые аминокислоты (глицин и р-аланин). Их изоэлектрические точки лежат в нейтральной области рН (для глицина рI=5,97).
Под действием электрического поля ионы глицина, входящие в состав электродного буферного раствора, следуют за белками в концентрирующий гель. Область перемещающихся границ быстро формируется под действием высоко подвижных хлорид-ионов во фронте и относительно медленных замыкающих ионов глицина. Хлорид-ион из-за его небольшого размера мигрирует быстрее, чем любой из белков, присутствующих в образце. Величина рH образца и концентрирующих слоев выбирается так, чтобы быть приблизительно на 3 единицы ниже, чем верхнее значение pKa глицина. Поэтому, на пересечении этих слоев только около 0,1% глициновых молекул имеют отрицательный заряд. Таким образом, быстродвижущиеся хлорид-ионы постепенно замещаются ионами глицина, которые при рН 6,8 в концентрирующем геле нейтрализуются и перестают участвовать в проведении тока. Сопротивление верхней части концентрирующего геля резко возрастает, а вместе с ним возрастает и напряженность поля. Локализованные зоны высоковольтового градиента между передним и задним ионными фронтами вызывают относительно высокую скорость миграции белков в концентрирующем геле, которая не ограничивается благодаря крупнопористой структуре этого геля.
На границе концентрирующего и разделяющего гелей белки достигают высокоплотных слоев геля и замедляются из-за уменьшающегося размера пор разделяющего геля. Более высокое значение pH, с которым фронт электродного буферного раствора встречается в разделяющем геле, также заставляет глицинат мигрировать быстрее, и напряженность поля падает, что также снижает скорость движения белков. Таким образом, происходит концентрирование пробы и все компоненты образца, независимо от первоначальной высоты столбика пробы в лунке, входят в нижний гель практически одновременно в виде узкой зоны с высокой концентрацией белка.
В мелкопористом разделяющем геле начинается процесс медленной миграции белков и их фракционирования в зависимости от молекулярных масс, а то обстоятельство, что процесс разделения начинается с узкой исходной зоны, обеспечивает высокую разрешающую способность системы вцелом.
Прибор для электрофореза состоит из:
1) источника постоянного тока с регулируемым напряжением и со стабилизатором напряжения;
2) камеры для электрофореза, служащей для размещения пластинки или трубки геля и поддержания постоянных условий проведения анализа. Камера обычно имеет прямоугольную форму, изготовлена из стекла или твердой пластмассы с двумя изолированными буферными резервуарами (анодным и катодным), содержащими раствор электролита. В каждый резервуар погружен электрод (например, платиновый), подключенный к соответствующему полюсу источника тока. Должен поддерживаться одинаковый уровень электролитов в резервуарах, чтобы предотвратить поток жидкости и гидростатическое давление на гель. Камера для электрофореза оснащена крышкой, которая предотвращает испарение растворителей и обеспечивает равномерно насыщенную влагой атмосферу во время всего процесса. Предпочтительно использование предохранителя для отключения электропитания, когда крышка камеры снята. Если мощность тока, приложенного к электрофоретической пластинке, превышает 10 Вт, то рекомендуется применять охлаждение камеры.
3) устройства для заливки геля, представляющего собой стеклянную трубку, стеклянную пластину или пару прямоугольных пластин (ячейку), служащих для формирования поддерживающей среды, в которой непосредственно проводится процесс электрофоретического разделения. Пластины могут быть расположены в камере вертикально или горизонтально (вариант горизонтального электрофореза обычно применяется для агарозных гелей) и должны быть погружены или иметь контакт посредством фитилей с катодным и анодным изолированными буферными резервуарами, содержащими раствор электролита. Преимуществом пластин для проведения процесса является возможность сравнения образцов в одной общей ячейке геля, что более информативно по сравнению с набором гелей из ряда трубок. Преимущество горизонтальных пластин по сравнению с вертикальными заключается в отсутствии проблемы герметизации швов, а недостаток – в большой поверхности контакта с воздухом и, соответственно, риске испарения жидкости.
Сборку прибора и его очистку после использования проводят в соответствии с инструкцией производителя.
Перед заливкой геля основание и боковые стороны ячейки закрывают подходящими прокладками, толщина которых определяет толщину рабочего геля (при этом после полимеризации геля прокладку в основании убирают). Ячейку заполняют раствором мономера с поперечно-сшивающим агентом и катализатором. Растворы должны быть дегазированы перед полимеризацией и гели должны использоваться свежеприготовленными. Заливку растворов проводят таким образом, чтобы исключить попадание внутрь ячейки пузырьков воздуха.
Гребенку, имеющую зубцы соответствующего размера (в зависимости от объемов наносимого образца), устанавливают в верхнюю часть ячейки на разделяющий гель и оставляют там до окончания полимеризации геля. Формирование геля обычно занимает не менее 30 мин и может считаться законченным, когда между гелем и водным слоем появляется четкая граница. После удаления гребенки из геля, прошедшего полимеризацию, остается ряд лунок.
Заполняют нижний и верхний резервуары камеры предписанным электродным буферным раствором. Готовят испытуемый и стандартный растворы, содержащие краситель и сахарозу или другой плотный и вязкий растворитель. Наносят образцы шприцем или микропипеткой в основания лунок, сразу включают электрический ток и начинают электрофорез, соблюдая предписанные условия (температуру и величину напряжения).
После окончания процесса (когда краситель достигает нижней границы пластины) ток выключают, пластину удаляют из камеры, зоны фиксируют, окрашивают и при необходимости пластину высушивают.
Подготовка полиакриламидного геля для вертикального электрофореза с SDS в неоднородной буферной системе
Сначала готовят и заливают в подготовленную ячейку нижний разделяющий гель, а затем сверху наслаивают концентрирующий гель.
В конической колбе готовят рассчитанное в зависимости от объема ячейки количество раствора для разделяющего геля, содержащего требуемую концентрацию акриламида, используя значения, приведенные в Таблице 1. Смешивают компоненты в указанном порядке. В тех случаях, где требуется, перед добавлением раствора аммония персульфата и тетраметилэтилендиамина (TEMED) раствор фильтруют, и, если необходимо, дегазируют раствор через мембрану из ацетата целлюлозы (с диаметром пор
0,45 мкм) под вакуумом при перемешивании. Добавляют соответствующие количества раствора аммония персульфата и TEMED как указано в табл. 1, перемешивают и немедленно заливают в промежуток между двумя стеклянными пластинами ячейки. Оставляют достаточное место для концентрирующего геля (длина зубцов гребенки плюс 1 см). Используя суженную стеклянную пипетку, тщательно наслаивают на гель сверху воду или изобутанол. Оставляют гель в вертикальном положении при комнатной температуре до завершения полимеризации.
После окончания полимеризации воду или изобутанол сливают и промывают верхнюю часть геля несколько раз водой, чтобы удалить остатки неполимеризованного акриламида и изобутанола, если он использовался. Сливают с верхней части геля так много жидкости, как только возможно и затем удаляют любую оставшуюся влагу фильтровальной бумагой.
В конической колбе готовят соответствующее количество раствора, содержащего требуемую концентрацию акриламида, используя значения, приведенные в табл. 2. Смешивают компоненты в том же порядке и с использованием тех же приемов фильтрации и дегазирования, что и для разделяющего геля. После добавления соответствующих количеств раствора аммония персульфата и TEMED, как указано в табл.2, перемешивают и немедленно заливают в промежуток между двумя стеклянными пластинами ячейки непосредственно на поверхность полимеризованного разделяющего геля. Немедленно, но с осторожностью, вставляют чистую тетрафторполиэтиленовую гребенку в раствор концентрирующего геля так, чтобы избежать попадания в гель воздушных пузырей. Добавляют избыточное количество раствора концентрирующего геля так, чтобы полностью заполнить пространство между зубцами гребенки.
| Компоненты раствора | Объем компонента (мл) на ячейку заданного объема | |||||||
| 5 мл | 10 мл | 15 мл | 20 мл | 25 мл | 30 мл | 40 мл | 50 мл | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 4% акриламида | ||||||||
| Вода очищенная | 2,6 | 5,3 | 7,9 | 10,6 | 13,2 | 15,9 | 21,2 | 26,6 |
| Раствор акриламида 1) | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 | 8,0 | 10,0 |
| 1,5М Трис | ||||||||
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
(рН 8,8) 2)
| Компоненты раствора | Объем компонента (мл) на ячейку заданного объема | |||||||
| 1 мл | 2 мл | 3 мл | 4 мл | 5 мл | 6 мл | 8 мл | 10 мл | |
| Вода очищенная | 0,68 | 1,4 | 2,1 | 2,7 | 3,4 | 4,1 | 5,5 | 6,8 |
| Раствор акриламида 1) | 0,17 | 0,33 | 0,5 | 0,67 | 0,83 | 1,0 | 1,3 | 1,7 |
| 1,0М Трис | ||||||||
(рН 6,8) 6)
1) Раствор акриламида: 30% раствор акриламида/бисакриламида (29:1)
2) 1,5М Трис (рН 8,8): 1,5 М буферный раствор трис-гидрохлорида, рН 8,8
3) 100 г/л SDS: раствор натрия додецилсульфата 100 г/л
4) 100 г/л APS: раствор аммония персульфата 100 г/л. Аммония персульфат является источником свободных радикалов, которые управляют полимеризацией акриламида и бисакриламида. Таким образом, раствор аммония персульфата должен добавляться медленно.
5) TEMED: тетраметилэтилендиамин.
6) 1,0М Трис (рН 6,8): 1 М буферный раствор трис-гидрохлорида, рН 6,8
Гель со вставленной гребенкой оставляют в вертикальном положении при комнатной температуре до окончания полимеризации.
Если в фармакопейной статье нет других указаний, то определение молекулярных масс проводят при нагрузке на лунку 10 мкг общего белка, а определение чистоты – при нагрузке 40 мкг при окрашивании Кумасси бриллиантовым R250, а при окрашивании нитратом серебра достаточно 2–5 мкг белка на лунку.
Толщина гребенки выбирается точно в соответствии с толщиной используемых прокладок, а размер зубцов – в соответствии с предполагаемым объемом образцов. Необходимый и достаточный объем формируемой лунки определяется как произведение длины, ширины и высоты (в микрометрах) одного зубца гребенки: V = L ∙ D ∙ H.
Объем наносимого образца вычисляют следующим образом:
где: k – коэффициент разбавления пробы буферным раствором для образца;
Х – требуемое для нанесения на гель количество белка в зависимости от целей анализа, в мкг;
С – концентрация общего белка, определяемая по методу Лоури, в мкг/мл.
После окончания полимеризации аккуратно удаляют гребенку, немедленно ополаскивают лунку водой, чтобы удалить любые остатки неполимеризованного акриламида. Если необходимо, выправляют зубцы концентрирующего геля при помощи тупой подкожной иглы, насаженной на шприц.
Устанавливают гель в прибор для электрофореза согласно инструкциям изготовителя оборудования. Добавляют электродный буферный раствор в верхнюю и нижнюю буферные емкости. Обычно, если нет других указаний в фармакопейной статье, в качестве электродного буферного раствора используется трис-глициновый буферный раствор с рН 8,3-8,4.
Удаляют любые пузыри, которые могут появиться у основания геля между стеклянными пластинами. Не следует включать электрический ток до внесения образцов, так как это уничтожит неоднородность буферных систем.
Готовят испытуемый раствор и раствор сравнения в рекомендованном буферном растворе для образцов в соотношении, указанном в фармакопейной статье или нормативной документации.
Обычно для обеспечения полной денатурации образец в смеси с буферным раствором подвергают дополнительно температурной обработке, режим которой должен быть указан в фармакопейной статье или нормативной документации.
Наносят соответствующие объемы каждого из растворов в лунки концентрирующего геля. Начинают электрофорез, используя условия, рекомендуемые изготовителем оборудования.
Изготовители оборудования для SDS-ПААГ могут обеспечивать применение гелей различной площади и толщины. Соответственно продолжительность электрофореза и сила тока (или напряжение) могут быть изменены, как описано изготовителем прибора, чтобы достичь оптимального разделения, что проверяют по скорости перемещения фронта индикатора в разделяющем геле.
Когда индикатор достигает основания геля, электрофорез останавливают. Удаляют ячейку с гелем из прибора и отделяют стеклянные пластины. Удаляют прокладки, отрезают и удаляют концентрирующий гель и немедленно проводят процедуру окрашивания. Для того, чтобы можно было выявить присутствие в исследуемом образце агрегатов и других компонентов, не входящих в гель, концентрирующий гель рекомендуется обрезать не полностью, оставляя 2–3 мм.
Так называемые, «готовые к использованию» коммерческие гели и наборы реактивов к ним могут быть применены при условии, что они дают результаты, отвечающие валидационным критериям, приведенным ниже в разделе «Оценка пригодности системы».
Окрашивание Кумасси бриллиантовым R250 – наиболее распространенный метод окрашивания белков с пределом обнаружения порядка от 1 до 10 мкг белка в полосе. Окрашивание нитратом серебра – более чувствительный метод окрашивания белков в гелях, позволяющий выявлять до 1 нг белка.
Для селективного окрашивания гликозилированных белков или липопротеидов иногда применяют другие красители или их смеси, о чем должно быть сделано дополнительное указание в фармакопейной статье или нормативной документации.
Все процедуры окрашивания геля проводят, как правило, при комнатной температуре и при слабом перемешивании в любом удобном контейнере. При окрашивании геля следует использовать одноразовые перчатки, иначе на геле могут быть прокрашены отпечатки пальцев.
Погружают гель в большой избыток красящего раствора Кумасси раствора и выдерживают, по крайней мере, 1 ч. Поскольку кислотно-спиртовой состав окрашивающего раствора не позволяет полностью фиксировать белки на геле, это может приводить к потерям некоторых низкомолекулярных белков во время окрашивания и обесцвечивания тонких гелей. Полная фиксация возможна при выдерживании геля в 10 % растворе трихлоруксусной кислоты в течение 1 ч перед погружением в окрашивающий Кумасси раствор.
Для ускорения процедуры окрашивания допускается подогрев геля в окрашивающем растворе в микроволновой печи. Режим подогрева должен быть описан в фармакопейной статье или нормативной документации. Затем окрашивающий раствор удаляют и гель промывают водой.
Обесцвечивают гель избытком обесцвечивающего раствора. Заменяют порции обесцвечивающего раствора несколько раз до тех пор, пока окрашенные полосы белка не станут ясно различимы на прозрачном фоне. Чем более полно обесцвечен гель, тем меньшие количества белка могут быть обнаружены этим методом. Обесцвечивание может быть ускорено при добавлении в обесцвечивающий раствор нескольких граммов анионобменной смолы или маленького кусочка пористого материала.
После обесцвечивания гель промывают водой и либо высушивают, либо оставляют в воде для хранения при температуре от 2 до 8 °С.
Погружают гель в большой избыток фиксирующего раствора и выдерживают в течение 1 ч. Фиксирующий раствор сливают, добавляют новую порцию того же раствора и инкубируют, по крайней мере 1 ч или оставляют на ночь. Сливают фиксирующий раствор и промывают гель в большом избытке воды в течение 1 ч. После этого пропитывают гель в течение 15 мин в 1 % растворе глутарового альдегида. Промывают гель дважды по 15 мин большим количеством воды. Выдерживают гель в темноте в свежеприготовленном 2 % растворе серебра нитрата в течение 15 мин. Промывают гель три раза по 5 мин в большом количестве воды. Погружают гель приблизительно на 1 мин в проявляющий раствор, пока не будет достигнуто удовлетворительное окрашивание. Окрашивание прекращают в момент проявления полосы в треке с минимальным количеством препарата (например, 0,001 мкг). Останавливают развитие окраски погружением в стоп-раствор на 15 мин. Ополаскивают гель водой.
Целесообразно использовать готовые наборы реактивов для окрашивания гелей серебра нитратом.
В зависимости от используемого метода окрашивания подготовку геля к высушиванию проводят различными способами:
– при окраске Кумасси после процедуры обесцвечивания гель выдерживают в смеси 10,0 г глицерина и 92 мл воды очищенной не менее 2 ч (возможна инкубация «на ночь»);
– при окраске нитратом серебра гель после заключительной процедуры ополаскивания выдерживают в течение 5 мин в смеси 2,0 г глицерина и 98 мл воды очищенной.
Погружают два листа пористой целлюлозной пленки в воду и выдерживают в течение 5–10 мин. Растягивают один из листов на рамке для высушивания. Аккуратно помещают пропитанный в глицериновом растворе гель на натянутую целлюлозную пленку. Удаляют все случайно попавшие воздушные пузыри, и заливают вокруг граней геля несколько миллилитров воды. Помещают второй лист пленки сверху и снова удаляют все воздушные пузыри. Заканчивают сборку рамки для сушки геля и помещают ее в сушильный шкаф или оставляют при комнатной температуре до полного высыхания.
Молекулярные массы белков определяют по сравнению их подвижностей с подвижностью нескольких белков-маркеров известной молекулярной массы. Готовые смеси белков с точно известными молекулярными массами (маркеры) для калибрования гелей предлагаются производителями материалов и оборудования для электрофореза в различных диапазонах молекулярных масс. Концентрированные исходные растворы полипептидов известной молекулярной массы готовят в соответствующем буферном растворе для образцов и наносят на гель одновременно с образцом испытуемого белка.
Сразу после того, как электрофорез завершен, следует отметить положение полосы красителя бромфенолового синего, которая соответствует электрофоретическому ионному фронту. Это может быть сделано при помощи меток-надрезов в геле или путем прокола геля в зоне окрашенного фронта иглой, предварительно обмакнутой в черную тушь или другой подходящий контрастный краситель.
После окрашивания геля измеряют расстояния пробега для каждой полосы белка (маркеров и испытуемого образца) от вершины разделяющего геля. Вычисляют отношение расстояния пробега каждого белка к расстоянию пробега фронта красителя. Нормализованные расстояния пробега, вычисленные таким образом, называются относительными подвижностями белков (относительно фронта красителя) и обозначаются как Rf.
где: R – расстояние пробега белка;
RS – расстояние пробега красителя
Строят график зависимости логарифма относительных молекулярных масс стандартов белка (Мr) от значения Rf. Неизвестные молекулярные массы могут быть оценены методом линейной регрессии или интерполяцией кривых зависимости logMr от Rf в том случае, если значения, полученные для испытуемых образцов, находятся в линейной части графика.
В тех случаях, когда в фармакопейной статье указан предел примесей, то перед анализом должен быть приготовлен раствор сравнения, соответствующий этому уровню примеси, путем разбавления испытуемого раствора. Например, в случае 5 % предела, раствор сравнения должен быть приготовлен разведением испытуемого раствора в соотношении 1:20. При этом примесь (полоса, отличная от главной полосы) на электрофореграмме с испытуемым препаратом не должны быть интенсивнее, чем полоса, полученная с раствором сравнения. При наличии нескольких полос примесей должно быть предусмотрено требованию к содержанию каждой из них и к содержанию суммы примесей.
Приемлемым условием определения примесей может считаться метод количественной нормализации с использованием денситометрического интегрирования. В этом случае предварительно должна быть показана линейность отклика прибора.
Результаты анализа считаются достоверными только в том случае, если:
- белки маркера молекулярных масс распределены приблизительно на 80 % длины геля и охватывают весь требуемый диапазон разделения (например, диапазон молекулярных масс продукта и его димера или продукта и родственных примесей);
- зависимость логарифма молекулярной массы белков-маркеров и Rf – линейна в необходимом диапазоне.
Дополнительные требования приемлемости результатов анализа должны быть описаны в фармакопейной статье или нормативной документации.
1) Приготовление 30% раствора акриламида/бисакриламида. В мерный стакан вместимостью 250 мл помещают 29,2 г акриламида и 0,8 г N,N’-метиленбисакриламида, растворяют в воде очищенной при перемешивании, доводят объем раствора водой до 100 мл и вновь перемешивают (при необходимости раствор фильтруют, как указано в фармакопейной статье или нормативной документации). Раствор хранят во флаконе из темного стекла при температуре 4–6 °С не более 1 мес.
2) Приготовление раствора натрия додецилсульфата. В мерный стакан вместимостью 250 мл помещают 10,0 г натрия додецилсульфата, растворяют в воде очищенной при аккуратном перемешивании, избегая вспенивания, доводят объем раствора до 100 мл и вновь перемешивают. Раствор хранят при комнатной температуре.
3) Приготовление раствора аммония персульфата. Растворяют 100,0 мг аммония персульфата в 1,0 мл воды очищенной. Раствор используют свежеприготовленным.
4) Приготовление 1,5М буферного раствора трис-гидрохлорида (рН 8,8). В мерный стакан вместимостью 500 мл помещают 90,8 г трис(гидроксиметил)аминометана и растворяют в 400 мл воды. Доводят рН раствора до 8,8 с помощью 1 М раствора хлористоводородной кислоты, затем доводят объем раствора тем же растворителем до 500 мл и перемешивают. Раствор хранят при температуре 4–6 °С не более 1 мес.
5) Приготовление 1,0 М буферного раствора трис-гидрохлорида (рН 6,8). В мерный стакан вместимостью 500 мл помещают 60,6 г трис(гидроксиметил)аминометана и растворяют в 400 мл воды. Доводят рН раствора до 6,8 с помощью 1 М раствора хлористоводородной кислоты, затем доводят объем раствора тем же растворителем до 500 мл и перемешивают. Раствор хранят при температуре 4–6 °С не более 1 мес.
6) Приготовление электродного буферного раствора (10×) (рН 8,3). В мерный стакан, вместимостью 1000 мл помещают 30,0 г трис(гидроксиметил)аминометана, 144,0 г глицина и 10,0 г натрия додецилсульфата, растворяют в воде и доводят объем раствора тем же растворителем до метки. Фильтруют и измеряют рН раствора, который должен быть 8,3 — 8,4. Доводить рН раствора кислотой или щелочью до необходимого значения не допускается.
Раствор хранят при комнатной температуре не более 3 мес.
Непосредственно перед анализом 1 часть приготовленного раствора смешивают с 9 частями воды очищенной.
7) Приготовление буферного раствора для образцов (4×) для электрофореза в восстанавливающих условиях с 2-меркаптоэтанолом. В химическом стакане смешивают 4,7 мл воды очищенной, 0,5 мл 1М буферного раствора трис-гидрохлорида (рН 6,8), 0,8 мл глицерина, 1,6 мл 10% раствора натрия додецилсульфата, 0,4 мл 2-меркаптоэтанола и 2 мг бромфенолового синего. Раствор хранят при температуре 4–6 °С не более 1 мес.
8) Приготовление буферного раствора для образцов (4×) для электрофореза в восстанвливающих условиях с дитиотреитолом. В химическом стакане тщательно перемешивают 5,0 мл воды очищенной, 0,5 мл 1М буферного раствора трис-гидрохлорида (рН 6,8), 0,8 мл глицерина, 1,6 мл 10% раствора натрия додецилсульфата, 0,06 г 1,4-дитиотреитола и 2 мг бромфенолового синего. Раствор используют свежеприготовленным.
9) Приготовление буферного раствора для образцов (4×) для электрофореза в невосстанвливающих условиях. В химическом стакане тщательно смешивают 5,1 мл воды очищенной, 0,5 мл 1М буферного раствора трис-гидрохлорида (рН 6,8), 0,8 мл глицерина, 1,6 мл 10% раствора натрия додецилсульфата и 2 мг бромфенолового синего. Раствор хранят при температуре 4–6 °С не более 3 мес.
10) Приготовление красящего раствора Кумасси. Раствор готовят по одному из способов приготовления (№ 1 или № 2):
Раствор № 1. Растворяют 0,3 г Кумасси бриллиантового R250 в смеси 100 мл спирта метилового или этилового и 100 мл воды очищенной. Перемешивают до полного растворения (в течение 1 ч). Добавляют 25 мл ледяной уксусной кислоты, доводят объем раствора водой очищенной до 250 мл и перемешивают. Хранят окрашивающий раствор в темной бутыли при комнатной температуре. Раствор хранят при температуре 18-25 0 С в течение 2 мес.
Раствор № 2. 1,0 г Кумасси ярко-голубого R-250 помещают в химический стакан, доводят до объема 250,0 мл этиловым спиртом, перемешивают не менее 3,5 часов до полного растворения красителя, добавляют 100,0 мл кислоты ледяной уксусной и доводят объем деионизованной водой до 1000,0 мл. Раствор хранят при температуре 18-25 0 С в течение 2 мес.
11) Приготовление обесцвечивающего раствора. К 400 мл спирта метилового или этилового добавляют 100 мл ледяной уксусной кислоты, доводят объем раствора до 1000 мл и перемешивают.
12) Приготовление фиксирующего раствора. К 250 мл спирта метилового или этилового добавляют 0,27 мл 37 % раствора формальдегида, доводят объем раствора водой очищенной до 500 мл и перемешивают.
13) Приготовление 1 % раствора глутарового альдегида. В мерную колбу вместимостью 100 мл помещают 4 мл 25 % глутарового альдегида или 2 мл 50 % глутарового альдегида, доводят объем раствора водой очищенной до метки и перемешивают.
14) Приготовление раствора серебра нитрата. Смешивают 2,75 мл 25 % раствора аммиака и 40 мл 1 М раствора натрия гидроксида, прибавляют по каплям при постоянном перемешивании 8 мл 20 % раствора серебра нитрата, доводят объем раствора водой очищенной до 200 мл и перемешивают.
15) Приготовление 20 % раствора серебра нитрата. Растворяют в воде очищенной 2,0 г (точная навеска) серебра нитрата, доводят объем раствора водой до 10 мл и перемешивают. Раствор используют свежеприготовленным.
16) Приготовление проявляющего раствора. Смешивают 2,5 мл 2,0 % раствора лимонной кислоты и 0,27 мл 37 % раствора формальдегида, доводят объем раствора водой очищенной до 500 мл и перемешивают.
17) Приготовление стоп-раствора. К 50 мл воды прибавляют 10 мл ледяной уксусной кислоты, доводят объем раствора водой очищенной до 100 мл и перемешивают.
В случае использования других реактивов и растворов они должны быть описаны в фармакопейной статье или нормативной документации.
источник
