Коллоидная частица имеет отрицательный заряд, значит будет перемещаться к положительно заряженному электроду — катоду.
Напишите формулу мицеллы золя сульфата бария, полученного при взаимодействии раствора хлорида бария с небольшим избытком раствора сульфата натрия?
В основе получения золя лежит реакция:
Условием получения золя является избыток Na2SО4, который является стабилизатором золя.
В растворе будут присутствовать ионы натрия и сульфат-ионы, образующиеся при диссоциации сульфата натрия
На поверхности агрегатов будут адсорбироваться сульфат-ионы.
Образуетсяя ядро коллоидной частицы:
Несущее отрицательный заряд ядро притягивает из раствора ионы противоположного знака, называемые противоионами. В нашем случае в роли противоионов выступают катионы натрия.
формула мицеллы полученного золя:
К какому электроду будут перемещаться частицы золя полученного при взаимодействии нитрата серебра с избытком хлорида натрия?
Решение. При смешивании растворов AgNO3 и NaCl изб. протекает реакция
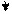
Ядро коллоидной частицы золя хлорида серебра состоит из агрегата молекул (mAgСl) и зарядообразующих ионов Cl ⁻, которые находятся в растворе в избытке и обеспечивают коллоидным частицам отрицательный заряд. Противоионами являются гидратированные ионы натрия.
Формула мицеллы хлорида серебра имеет вид:
Коллоидная частица имеет отрицательный заряд, значит будет перемещаться к положительно заряженному электроду — катоду.
Напишите формулы мицелл коллоидных растворов для следующих веществ:
а) кремниевый кислоты: агрегат m[Н2SiO3], ионный стабилизатор K2SiO3 ® 2K+ + SiO32–
б) гидрозоля золота: агрегат m[Аu], ионный стабилизатор NaAuO2 ® Na + + AuO2–
в) двуокиси олова: агрегат m[SnO2], ионный стабилизатор K2SnO3 ® 2K+ + SnO32–
а) Образование золя кремневой кислоты происходит по реакции

На электронейтральном агрегате частиц (mH2SiO3) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы HSiO3 ‾ , которые образуются в результате гидролиза соли K2SiO3:
K2SiO3 + H2O 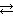
SiO3 2− + H2O 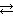
Ионы HSiO3 ‾ , адсорбируясь на поверхности частиц золя кремниевой кислоты, сообщают им отрицательный заряд. Противоионами являются гидратированные ионы водорода H + . Формула мицеллы золя кремневой кислоты:
б) Образование гидрозоля золота происходит при действии восстановителя на соль золотой кислоты в слабощелочной среде:
На агрегате частиц (mAu) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы AuO2 ‾ ,
в)Образование золя двуокиси олова происходит следующим образом:

На электронейтральном агрегате частиц (mSnO2) адсорбируются ионы элемента, входящего в состав ядра. Таковыми являются ионы SnO3 2‾ :
K2SnO3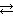
Ионы SnO3 2‾ , адсорбируясь на поверхности частиц золя, сообщают им отрицательный заряд. Противоионами являются ионы K + . Формула мицеллы золя двуокиси олова:
Дата добавления: 2016-12-31 ; просмотров: 2147 | Нарушение авторских прав
источник
Тема. Дисперсные системы
Методические указания
Коллоидная химия – наука, изучающая физико–химические свойства гетерогенных, высокодисперсных систем, а также растворов высокомолекулярных соединений.
В коллоидной химии широко используется понятия: система, фаза, гомогенная и гетерогенная системы. Необходимо уяснить понятия: дисперсность, дисперсионная среда и дисперсная фаза. Дисперсные системы, содержат чаще всего две фазы. Одна фаза представляет собой высокодисперсные, мельчайшие частицы вещества или макромолекулы ВМС и она называется дисперсной фазой). Другая фаза, в которой распределены агрегаты дисперсных частиц или макромолекул, называется дисперсионной средой. Условием образования таких дисперсных систем (коллоидного состояния вещества) является нерастворимость одной фазы в другой.
Классификацию дисперсных систем в зависимости от размеров частиц, выраженных в м, можно разделить следующим образом:
| Грубодисперсные | Коллоидно- дисперсные | Молекулярно- и ионно — дисперсные |
| 10 -3 – 10 -5 | 10 -5 – 10 -7 | 10 -8 |
По степени дисперсности коллоидные растворы занимают промежуточное положение между истинными растворами и грубодисперсными системами. Поэтому коллоиды (золи) имеют некоторые свойства, сходные со свойствами растворов и грубодисперсных систем.
Основными отличительными особенностями дисперсных систем от истинных растворов являются:
а) способность к рассеиванию ими света;
б) медленная диффузия частиц дисперсной фазы в дисперсионной среде;
г) агрегативная неустойчивость дисперсной фазы, проявляемая в виде выделения частиц из дисперсионной среды при добавлении к системе электролитов или под влиянием других внешних воздействий.
Таблица 1. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
| Дисперсионная среда | Дисперсная фаза | Название дисперсной системы | Примеры дисперсных систем |
| Жидкость | Твердое тело | Суспензия, золь | Золи металлов, природные воды |
| Жидкость | Эмульсия | Молоко, нефть | |
| Газ | Пена | Мыльная пена | |
| Твердое тело | Твердое тело | Минералы, сплавы | Рубин, сталь |
| Жидкость | Пористое тело, минерал | Влажный грунт, опал | |
| Газ | Пористое тел | Сухой грунт, активированный уголь, пенопласт | |
| Газ | Твердое тело | Аэрозоль | Пыль, дым |
| Жидкость | Аэрозоль | Туман, облака |
Изучая получение золей, важно уяснить два метода:
1. Диспергирование – дробление более крупных по размеру частиц до коллоидной степени дисперсности.
2. Конденсация – укрупнение частиц в результате объединения атомов и молекул в агрегаты коллоидной степени дисперсности.
Рассмотрим получение мелкодисперсного осадка иодида серебра из хорошо растворимых исходных компонентов по реакции:
В случае избытка в растворе AgNO3 ионы Ag + будут адсорбироваться на поверхности осадка AgI, встраиваясь в его кристаллическую решетку. Избыточно адсорбированные ионы (Ag + ) носят название потенциалопределяющих ионов. К ним притягиваются электростатическими силами ионы противоположного знака заряда (противоионы) — NO3‾. При этом часть противоионов будет находиться в растворе у самой поверхности дисперсной фазы (плотный слой), а часть сохраняет способность к подвижному распределению в растворе вблизи поверхности гранулы, образуя «облако» из диффузных противоионов (диффузный слой). Такая коллоидная частица вместе с противоионами называется мицеллой и в целом является электронейтральной. Однако сама твердая фаза будет заряжена положительно.
Изложенное выше строение мицеллы изображают в в виде формулы:
где m – количество молекул AgI в частице;
n – количество потенциалопределяющих ионов, адсорбированных на поверхности твердой частицы; (n-x) – количество противоионов, притянутых электростатическими силами к потенциалопределяющим ионам в виде плотного слоя; x – количество диффузных противоионов (слой «рыхлой» структуры), располагающихся на некотором расстоянии от плотного слоя.
В этих формулах частички AgI являются зародышем (или агрегатом) мицеллы; зародыш вместе с потенциалопределяющими ионами дают ядро мицеллы; ядро с плотной частью противоионов составляют заряженную гранулу (или частицу) [m (AgI) n Ag + · (n -x) NO3‾] х+ , а гранула совместно с диффузными противоионами образуют мицеллу.
Некоторые дисперсные системы могут существовать неограниченно долго, однако большинство из них являются неустойчивыми и постепенно разрушаются. Мицеллы самопроизвольно или под влиянием каких-либо внешних воздействий могут слипаться, всплывать или оседать, разрушаться и т.д.Устойчивость дисперсной системы характеризуется способностью дисперсной фазы сохранять во времени как исходные размеры частиц, так и равномерность распределения их в объеме дисперсионной среды. Наличие электрического заряда на поверхности частиц является важным условием сохранения устойчивости дисперсных систем.
Агрегативная неустойчивость дисперсных систем обусловлена избытком свободной поверхностной энергии на межфазной границе, что приводит к самопроизвольному образованию агрегатов и последующему их слипанию. В итоге система разделяется на два слоя – жидкость (дисперсионная среда) и плотный осадок (дисперсная фаза).
Кинетическая (седиментационная) неустойчивость проявляется в оседании частичек дисперсной фазы под влиянием силы тяжести.
Коагуляция – процесс самопроизвольного укрупнения (слипания) дисперсных частиц, который может происходить при действии на дисперсную систему различных факторов: при интенсивном перемешивании или встряхивании, нагреве или охлаждении, облучении светом или пропускании электрического тока, при добавлении к системе электролитов или неэлектролитов и др. Во всех случаях воздействия на систему происходит уменьшение энергии связи диспергированных частиц с окружающей их дисперсионной средой.
Для коагуляции золей электролитами установлен ряд эмпирических закономерностей.
1. Для начала коагуляции золя необходима некоторая минимальная концентрация электролита, называемая порогом коагуляции γ.
2. Правило Шульце – Гарди: коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд. Величины порогов коагуляции двухзарядных ионов примерно на порядок, а трехзарядных – на два порядка меньше, чем для однозарядных ионов.
3. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Ag + > Cs + > Rb + > NH4 + > K + > Na + > Li + – лиотропный ряд
4. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию.
Порог коагуляции — минимальная молярная концентрация электролита, при которой начинается коагуляция золя объемом 1 дм 3 :
Величина, обратная порогу коагуляции, называется коагулирующей способностью электролита.
Пример 1. Напишите образование мицеллы, полученной действием избытка хлорида бария на сульфат натрия.
Решение. Рассмотрим образование мицеллы:
Вначале образуется агрегат мицеллы: BaSO4
На поверхности кристалла ВaSO4 адсорбируются ионы Ва 2+ . т.е. ионы Ba 2+ вследствие избирательной адсорбции достраивают кристаллическую решетку, т.к. они находятся в избытке. Они придают поверхности ядра положительный заряд и являются потенциалопределяющими ионами.
Ядро мицеллы: m BaSO4∙n Ba 2+
Ионы С1 — , образующиеся при диссоциации ВаС12, имеют отрицательный заряд, противоположный заряду поверхности. Под действием электростатических сил противоионы С1 — притягиваются к ядру, нейтрализуя его заряд.
Часть противоионов (n-x), находящихся в непосредственной близости от ядра, образуют адсорбционный слой. Агрегат вместе со слоем потенциалопределяющих ионов и противоионов явялется коллоидной частицей:
4)∙n Ba 2+ ∙2(n-x)Cl — > 2х+ , которая имеет электрический заряд, совпадающий с зарядом потенциалопределяющего слоя.
Другая часть противоионов (x) образует диффузионный слой. Заряды потенциалопределяющих ионов и противоионов полностью скомпенсированы, поэтому мицелла электронейтральна.
Пример 2. Определите, к какому электроду должны перемещаться частицы золя, получаемого при реакции при небольшом избытке H2S:
Решение. Потенциал определяющими ионами в данном случая могут быть ионы S 2- , так как в состав агрегата входят ионы серы. Состав адсорбционного слоя могут входить ионы К + . Ионы К + образуют диффузный слой. Таким образом, схематическое строение мицеллы золя можно выразить следующей формулой:
Частица имеет отрицательный заряд, — следовательно, движение частиц золя направлено к аноду.
! Задачи для самостоятельной работы
1. Написать строение мицеллы золя, полученного по реакции. Определить к какому электроду будет двигаться коллоидная частица:
в) AI(OH)3, стабилизированный AICI3.
д) Ba(OH)2 ,стабилизированный BaCI2.
е) PbS , стабилизированный Pb(NO3)2.
2. Укажите, к какому электроду должны двигаться частицы гидроксида алюминия, образующиеся при гидролизе: AICI3+H2O=AI(OH)3+3HCI.
3. Золь BaSO4 получен смешением некоторых объемов Ba(NO3)2 и H2SO4. Написать формулу мицеллы, если в электрическом поле гранула перемещается к аноду. Какой электролит взят в избытке?
4. Для получения золя АgCl смешали раствора КCl и раствор AgNO3. Раствор AgNO3 взят в избытке. Написать формулу мицеллы этого золя и указать к какому электроду перемещается частица.
5. Золь Аl(ОН)3 получен смешением 1 объема АlCl3 и 2 объемов раствора NaОН равной концентрации. Написать формулу мицеллы золя.
6. Написать формулу мицеллы AgJ, если в качестве стабилизатора взят нитрат серебра. Каков знак заряда коллоидных частиц?
7. Золь Сd(ОН)2 получен смешением равных объемов растворов СdCI2 и NaОН. Написать формулу мицеллы золя. Одинаковы ли исходные концентрации электролитов, если частицы движутся к катоду?
8. Напишите строение мицеллы золя, образованного в результате взаимодействия указанных веществ (избытка одного, затем другого вещества):
Назовите составляющие компоненты мицеллы.
9. Как расположатся пороги коагуляции в ряду CrCl3, Ba(NO3)2, K2SO4 для золя фосфата серебра, гранулы которого при электрофорезе двигаются к аноду? Какие ионы коагулянта вызовут коагуляцию этой золи.
10. Для коагуляции 10 мл золя иодида серебра требуется 0,5 мл раствора нитрата кальция молярной концентрации 0,2 моль/л. Определите порог коагуляции.
11. Чтобы вызвать коагуляцию золя сульфида мышьяка (III) объемом 10 мл, потребовалось в каждом случае прилить следующие растворы: хлорида натрия объемом 0,25 мл молярной концентрации 2 моль/л; раствор хлорида кальция объемом 1,3 мл молярной концентрации 0,01 моль/л и раствор хлорида алюминия объемом 2,76 мл молярной концентрации 0,001 моль/л. Чему равен порог коагуляции каждого электролита?
12. Порог коагуляции раствора бихромата калия K2Cr2O7 молярной концентрации 0,02 моль/л по отношению к золю оксида алюминия равен 1,26 моль/л. Определите объем раствора электролита, необходимый для коагуляции этого золя объемом 10 мл.
13. Пороги коагуляции некоторого золя электролита KNO3, MgCl2, NaBr равны соответственно 50,0; 0,8; 49,0 ммоль/л. Как относятся между собой величины коагулирующих способностей этих веществ? Укажите коагулирующие ионы. Каков знак заряда коллоидной частицы?
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Артеменко А.И. Органическая химия. − М.: Высшая школа, 2005.
2. Грандберг И.И. Органическая химия. – М.: Высшая школа, 2001.
3. Ким А.М. Органическая химия. – Новосибирск: Сибирское уни-верситетское издательство, 2001.
5. Березин Б.Д., Березин Д.Б. Курс современной органической хи-мии. – М.: Высшая школа, 2003.
6. Иванов В.Г., Горленко В.А., Гева О.Н. Органическая химия. – М.: Издательский центр «Академия», 2005.
7. Кузнецов Ю.П. Органическая химия. Пищевые красители и цве-торегулирующие материалы. − Новосибирск: СибУПК, 2006.
8. Максанова Л.А. Высокомолекулярные соединения и материалы на их основе, применяемые в пищевой промышленности. – М.: КолосС, 2005.
9. Химическая энциклопедия. − М.: Советская энциклопедия. – 1988, 1990. − Т. 1–2.
Концентрации катионов водорода, гидроксид-ионов,
рН и рОН для разбавленных водных растворов кислот, оснований, солей
| Среда | [H + ] | pH | [ОН — ] | pOH |
| Сильнокислая | 10 0 | 10 -14 | ||
| 10 -1 | 10 -13 | |||
| 10 -2 | 10 -12 | |||
| Кислая | 10 -3 | 10 -11 | ||
| 10 -4 | 10 -10 | |||
| Слабокислая | 10 -5 | 10 -9 | ||
| 10 -6 | 10 -8 | |||
| Нейтральная | 10 -7 | 10 -7 | ||
| Слабощелочная | 10 -8 | 10 -6 | ||
| 10 -9 | 10 -5 | |||
| Щелочная | 10 -10 | 10 -4 | ||
| 10 -11 | 10 -3 | |||
| Сильнощелочная | 10 -12 | 10 -2 | ||
| 10 -13 | 10 -1 | |||
| 10 -14 | 10 0 |
потенциалы металлов в водных растворах
| Электродный процесс | Значение стандартного электродного потенциала (Е°), В |
| Li + + е = Li | — 3,045 |
| К + + е = К | — 2,925 |
| Са 2+ + 2е = Са | — 2,866 |
| Na + + е = Na | — 2,714 |
| Mg 2+ + 2e = Mg | — 2,363 |
| Аl 3+ + 3е = А1 | — 1,662 |
| Ti 2+ + 2е = Ti | — 1,628 |
| Мn 2+ + 2е = Мn | — 1,180 |
| Zn 2+ + 2е = Zn | — 0,763 |
| Сг 3+ + 3е = Сг | — 0,744 |
| Fe 2+ + 2е = Fe | — 0,44 |
| Cd 2+ + 2е = Cd | — 0,40 |
| Со 2+ + 2е = Со | — 0,28 |
| Ni 2+ + 2е = Ni | — 0,25 |
| Sn 2+ + 2e=Sn | — 0,14 |
| Рb 2+ + 2e = Pb | — 0,13 |
| Fe 3+ + 3e = Fe | — 0,036 |
| 2H + + 2e = H2 | 0,00 |
| Cu 2+ + 2e = Cu | 0,34 |
| Hg2 2+ + 2e = 2Hg | 0,79 |
| Ag + + e = Ag | 0,80 |
| Hg 2+ + 2e = Hg | 0,85 |
| Pt 2+ + 2e = Pt | 1,20 |
| Au 3+ + 3e = Au | 1,50 |
Составители: Васильцова Ирина Васильевна
Органическая и физколлоидная химия
Компьютерная верстка Т. А. Измайлова
Подписано в печать _____2012 г.
Формат 60х84 1/16 Объем изд.л. Тираж 50 экз.
Издательство НГАУ «Золотой колос»
630039, Новосибирск, ул. Добролюбова, 160, оф.106
источник
Дата добавления: 2015-08-06 ; просмотров: 4215 ; Нарушение авторских прав
1. Золь бромида серебра получен смешиванием 40 мл раствора нитрата серебра с концентрацией 0,004 моль/л и 10 мл раствора бромида калия с концентрацией 0,008 моль/л. Приведите схему строения мицеллы золя бромида серебра. К какому электроду гранулы образованного золя будут двигаться при электрофорезе?
Решение. Определим количества веществ, использованных для приготовления золя:
n (AgNO3) = C · V = 0,004 моль/л · 0,04 л = 0,00016 моль
n (KBr) = C · V = 0,008 моль/л · 0,01 л = 0,00008 моль
Сравнение этих количеств показывает, что нитрат серебра взят в избытке. Следовательно, в соответствии с правилом Панета — Фаянса — Пескова на кристаллах бромида серебра AgBr (агрегат) будут адсорбироваться преимущественно катионы серебра Ag + (потенциалопределяющие ионы), которые вместе с AgBr составят ядро коллоидной частицы. Их заряд будут компенсировать нитрат-анионы NO3 — . Часть из них, плотно окружая ядро («связанные» противоионы) составит вместе с ядром положительно заряженную гранулу; другая часть («свободные» противоионы) составит диффузный слой. Строение мицеллы можно представить следующим образом:
При электрофорезе положительно заряженная гранула станет двигаться к отрицательному электроду — катоду.
2. Какой минимальный объем раствора сульфата натрия с концентрацией 0,005 моль/л надо добавить к 20 мл раствора хлорида бария с концентрацией 0,006 моль/л, чтобы получить золь с отрицательно заряженными гранулами? Какой электролит обладает максимальным коагулирующим действием по отношению к полученному золю: сульфат натрия, хлорид алюминия, нитрат кальция?
Решение. Золь с отрицательно заряженными гранулами может быть получен при избирательной адсорбции сульфат-ионов на кристаллах сульфата бария. Для этого требуется, чтобы концентрация ионов SO4 2- превосходила концентрацию Ва 2+ -ионов.
Рассчитаем количество катионов Ва 2+ :
Количество ионов SO4 2- должно превосходить количество ионов Ва 2+ : n(SO4 2- ) > n(Ba 2+ ). Это возможно, если
Таким образом, при добавлении любого объема раствора сульфата натрия с концентрацией 0,005 моль/л к 20 мл раствора хлорида бария с концентрацией 0,006 моль/л будет образовываться золь сульфата бария с отрицательно заряженными гранулами.
Согласно правилу Шульце — Гарди, коагуляцию коллоидных растворов вызывают ионы с зарядом, противоположным заряду гранул, причем их действие тем сильнее, чем выше заряд иона-коагулянта. Коагулянтами данного золя будут выступать катионы. Из предложенных катионов (Na + , Ca 2+ , Al 3+ ) наибольшим зарядом обладают катионы алюминия. Поэтому при одинаковой концентрации раствор хлорида алюминия будет более эффективным коагулянтом, чем остальные электролиты.
3. Какой максимальной концентрации должен быть раствор хлорида магния, чтобы при смешивании его с равным объемом раствора нитрата серебра с концентрацией 0,001 моль/л получили золь с положительно заряженными гранулами? Какой электролит с концентрацией 0,1 моль/л (раствор сульфата цинка, хлорида алюминия или фосфата калия) необходимо добавить в минимальном количестве, чтобы вызвать коагуляцию полученного золя?
Решение. Для получения золя хлорида серебра с положительно заряженными гранулами необходимо, чтобы на кристаллах этой соли происходила избирательная адсорбция катиона серебра. Это возможно в том случае, если n(Ag + ) > n(Cl — ).
Количество ионов серебра составляет:
Количество хлорид-анионов должно быть меньше этой величины: n(Cl — ) — ) = 2n(MgCl2), то n(MgCl2) — , SO4 2- , PO4 3- ) наибольшим зарядом обладают фосфат-анионы. Поэтому при одинаковой концентрации раствор фосфата калия будет наиболее эффективным коагулянтом, т.е. его необходимо добавлять к золю в наименьшем количестве.
4. Коагуляция 400 мл гидрозоля сульфида мышьяка наступила при добавлении к нему 3,75 мл раствора сульфата алюминия с концентрацией 0,005 моль/л. Вычислить порог коагуляции и коагулирующую способность катионов алюминия по отношению к этому золю?
Решение. Порог коагуляции раствора сульфата алюминия можно рассчитать по формуле:
Концентрация катионов алюминия в 2 раза больше, чем концентрация соли Al2(SO4)3, поэтому
Коагулирующая способность катионов алюминия по отношению к золю сульфида мышьяка составляет:
КС = 1/Спор = 1 : 0,0928 = 10,78 л/ммоль
5. Коагулирующая способность хлорид-анионов по отношению к некоторому золю составляет 0,05 л/ммоль. Какой объем золя можно скоагулировать добавлением к нему 10 мл 5% раствора хлорида магния (плотность 1,05 г/мл)?
Решение. Порог коагуляции хлорид-ионов по отношению к данному золю — величина, обратная коагулирующей способности:
Порог коагуляции хлорида магния вдвое меньше этой величины, поскольку диссоциация молекулы хлорида магния MgCl2 дает 2 хлорид-аниона:
Порог коагуляции связан с количеством добавляемого электролита уравнением:
Следовательно, объем золя можно рассчитать по формуле:
Пересчитаем массовую долю раствора хлорида магния на молярную концентрацию:
Рассчитаем объем золя, который можно скоагулировать добавлением хлорида магния:
источник
Электрокинетические свойства коллоидных систем. Электрофорез, электроосмос. Строение коллидных частиц лиофобных золей, электрокинетический потенциал. Влияние электролитов на величину электрокинетического потенциала. Изоэлектрическое состояние. Устойчивость и коагуляция коллоидных систем. Коагуляция электролитами, правило Шульце-Гарди.
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь (коллоидный раствор) состоит из двух частей: мицелл и интермицеллярной жидкости.
Мицелла – это частица дисперсной фазы золя, окруженная двойным электрическим слоем.
Интермицеллярной (межмицеллярной) жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы.
Частицы дисперсной фазы лиофобных золей имеют сложную структуру, которая зависит от условий получения золей. Предположим, что золь иодида серебра AgI образуется в ходе химической реакции между AgNO3 и KI. При этом основу коллоидных частиц составят микрокристаллы труднорастворимого AgI, включающие в себя m молекул AgI (а точнее, m пар ионов Ag + и I — ). Эти микрокристаллы называют агрегатами. Если реакция протекает в присутствии избытка иодида калия, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции n ионов I — . Иодид-ионы являются потенциалобразующими ионами (сокращенно ПОИ). Агрегат вместе с потенциалобразующими ионами является частицей твердой фазы и его называют ядром.
Под действием электростатических сил к ядру притягивается n ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют ионы K + . Часть противоионов (n — x), наиболее близко расположенных к ядру, находится в слое жидкости, смачивающем поверхность твердого ядра. Эти ионы испытывают действие не только электростатических, но и ван-дер-ваальсовых сил ядра, поэтому прочно удерживаются около него и образуют так называемый адсорбционный слой противоионов. Ядро с адсорбционным слоем противоионов образует коллоидную частицу. Остальные x противоионов, слабее связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой фазе диффузно (размыто), почему и носят название диффузного слоя. Все это образование вместе и является мицеллой.
Мицеллы золей электронейтральны. Структуру мицеллы можно записать в виде формулы:
,
где m – число молекул, входящих в состав агрегата, n – число потенциалобразующих ионов, (n – x) – число противоионов, входящих в адсорбционный слой, x – число противоионов, образующих диффузный слой.
Числа m, n и x могут изменяться в широких пределах в зависимости от условий получения и очистки золя. Обычно m >> n. Ядро вместе с адсорбционным слоем противоионов образуют собственно коллоидную частицу, или гранулу. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд, в данном случае — отрицательный (x ‑ ).
Граница между коллоидной частицей и диффузным слоем носит название поверхность скольжения. В формуле мицеллы этой границе соответствует фигурная скобка между адсорбционным и диффузным слоями (на рис. 1 — сплошная линия).
Рис. 1. Схема строения мицеллы золя иодида серебра
с отрицательно заряженными частицами.
Граница скольжения обозначает ту геометрическую поверхность, по которой происходит разделение («разрыв») мицеллы на коллоидную частицу и диффузный слой в случае ее перемещения относительно дисперсионной среды (например, при участии мицеллы в броуновском движении или при движении под действием электрического поля).
На границе раздела твердое тело – жидкость возникает двойной электрический слой. Согласно современным представлениям, двойной электрический слой (ДЭС) — это образующийся на границе двух фаз тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака (потенциалобразующих ионов и противоионов). Потенциалобразующие ионы, адсорбирующиеся на твердой поверхности, — это внутренняя обкладка ДЭС. Внешняя обкладка ДЭС (слой противоионов) состоит из двух частей: плотной и диффузной.
Образование двойного слоя ионов приводит к появлению определенных электрических потенциалов на границе раздела твердой и жидкой фаз. Ионы первого слоя (внутренней обкладки), фиксированные на твердой поверхности, придают этой поверхности свой знак заряда и создают на ней так называемый поверхностный или φ-потенциал. Знак φ-потенциала совпадает со знаком заряда потенциалобразующих ионов. Величина φ-потенциала пропорциональна числу зарядов этих ионов на поверхности частиц.
С точки зрения термодинамики, φ-потенциал равен работе переноса единичного (элементарного) заряда из бесконечно удаленной точки объема раствора на поверхность твердой фазы, т. е. представляет собой потенциал твердой поверхности. Прямых методов его измерения не имеется.
Второй потенциал, характеризующий двойной слой ионов, называют электрокинетическим потенциалом или x-потенциалом (дзета-потенциалом). Он представляет собой электрический потенциал в двойном слое на границе между коллоидной частицей, способной к движению в электрическом поле и окружающей жидкостью. x-потенциал является потенциалом поверхности скольжения. Однако в двойном электрическом слое точное расстояние от твердой поверхности до поверхности скольжения неизвестно. Поэтому приближенно можно принять, что поверхность скольжения проходит по границе между адсорбционным и диффузным слоями противоионов. Следовательно x-потенциал близок, хотя и не совсем равен, потенциалу на границе адсорбционного и диффузионного слоев.
Термодинамически ξ-потенциал можно определить как работу, необходимую для переноса единичного заряда из бесконечно удаленного элемента объема раствора на поверхность скольжения. Знак ξ-потенциала обычно совпадает со знаком φ-потенциала. ξ-потенциал является частью φ‑потенциала и всегда меньше, чем φ‑потенциал. Величина ξ-потенциала непосредственно связана с числом противоионов в диффузном слое и изменяется пропорционально этому числу. Можно считать, что с увеличением толщины диффузного слоя ξ‑потенциал повышается. Поскольку электрокинетический потенциал относится к коллоидной частице и обусловливает ее подвижность в электрическом поле, величина этого потенциала может быть измерена экспериментально по скорости движения частиц. Направление же перемещения частиц к катоду или аноду указывает на знак ξ-потенциала.
Благодаря наличию ξ-потенциала на границах скольжения всех частиц дисперсной фазы возникают одноименные заряды и электростатические силы отталкивания противостоят процессам агрегации. Таким образом, ξ-потенциал является одним из основных факторов агрегативной устойчивости гидрофобных золей. Величина, а иногда и знаки φ- и ξ-потенциалов могут изменяться под влиянием внешних воздействий (электролитов, разведения, повышения температуры). Особенно чувствителен к этим факторам ξ-потенциал.
14.2.Электрокинетические свойства коллоидных систем: электрофорез, электроосмос.
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления подразделяют на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос). Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты Ф. Рейссом (1808). Он обнаружил, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к одному из электродов.
Это явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
В другом опыте средняя часть U-образной трубки, содержащей воду, была заполнена толченым кварцем, в каждое колено трубки помещен электрод и пропущен постоянный ток. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом — опускание. После выключения электрического тока уровни воды в коленах трубки уравнивались.
Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу, названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном (1878). При оседании частиц суспензии кварца под действием силы тяжести возникала разность потенциалов между уровнями разной высоты в сосуде.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз.
Из описанных явлений электрофорез имеет наиболее широкое практическое применение. При электрофорезе происходит направленное перемещение частиц дисперсной фазы в электрическом поле постоянного тока к электроду, знак которого противоположен знаку заряда частиц. Подвижность частиц в электрическом поле обусловлена тем, что при наложении внешней разности потенциалов происходит разрыв двойного электрического слоя по границе скольжения и частица получает заряд, соответствующий ее ξ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Очевидно, что скорость движения частиц дисперсной фазы пропорциональна величине их ξ‑потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ξ‑потенциала коллоидной частицы.
Величина ξ‑потенциала связана со скоростью электрофореза заряженных частиц зависимостью, названной уравнением Гельмгольца – Смолуховского:
, (1)
где k — коэффициент, зависящий от формы частиц (для сферических частиц k = 6, для цилиндрических k = 4); η – вязкость среды; υ – линейная скорость перемещения частиц (или границы золя); ε – относительная диэлектрическая проницаемость среды; Е – напряженность поля (градиент потенциала).
Линейная скорость υ изменяется пропорционально напряженности поля Е, поэтому не может служить характеристикой частиц. В связи с этим введено понятие электрофоретической подвижности υэф., равной скорости движения частицы при единичном градиенте потенциала (Е = 1):
. (2)
Экспериментально найденные значения подвижностей часто оказываются меньше расчетных. Несовпадение этих величин объясняете в основном тем, что теория Гельмгольца — Смолуховского не учитывает два явления: релаксационный эффект и электрофоретическое торможение. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны.
Методы электрофореза имеют большое теоретическое и практическое значение. Знание величины ξ-потенциала позволяет судить об устойчивости коллоидного раствора, поскольку изменение его устойчивости, как правило, происходит пропоционально изменению электрокинетического потенциала.
Электроосмос, как и электрофорез, получил широкое применение. Механизм электроосмоса заключается в следующем. Нерастворимый материал мембраны при контакте с жидкостью (водой) диссоциирует с поверхности, отщепляя в жидкость те или другие ионы. Возникает двойной электрический слой, внутренняя обкладка которого входит в состав твердой фазы, а противоионы диффузно располагаются в жидкости. При включении постоянного электрического тока противоионы диффузного слоя перемещаются к электроду соответствующего знака. Так как ионы в воде всегда гидратированы, то при движении иона с ним увлекается определенный объем дисперсионнной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Очевидно, что чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Метод электроосмоса имеет большое практическое применение в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Дли этой цели применяют, например, электрофильтр-прессы.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8806 — 

источник
1. Золь фторида кальция получен смешиванием 32 мл раствора фторида натрия с молярной концентрацией NaF, равной 8,0·10 -3 моль/л и 25 мл раствора хлорида кальция с молярной концентрацией CaCl2, равной 9,6·10 -3 моль/л. Напишите формулу мицеллы полученного золя, укажите все её составные части. Определите тип коллоида, знак заряда гранулы коллоидной частицы золя и направление её движения в электрическом поле.
Решение. Зная молярные концентрации растворов NaF и CaCl2, определяем количество вещества фторида натрия ν(NaF) и хлорида кальция ν(СаСl2), вступивших в реакцию обмена по уравнению
ν(NaF) = Cμ(NaF)·V(NaF) = (8,0·10 -3 моль/л)·(32·10 -3 л) = 2,56·10 -4 моль,
ν(CaCl2) = Cμ(CaCl2)·V(CaCl2) = (9,6·10 -3 моль/л)·(25·10 -3 л) = 2,4·10 -4 моль.
Cогласно уравнению реакции, вещества взаимодействуют между собой в соотношении ν(NaF):ν(CaCl2) = 2:1, а из приведенных расчетов видно, что ν(NaF):ν(CaCl2) =(2,56·10 -4 )/(2,4·10 -4 ) = 1,07:1, т.е. в растворе имеется избыток хлорида кальция, который и служит в данном случае стабилизатором коллоидной мицеллы. Поскольку по условию задачи речь идет о водных растворах взаимодействующих солей, то ионы стабилизатора (Са + и Cl — ) будут гидратированными, т.е. окруженными молекулами растворителя Н2О. Вместе с тем, зародыш коллоидной частицы, формирующийся из нерастворимых молекул фторида кальция СаF2, будучи веществом кристаллическим, воду не поглощает. Отсюда первый вывод – коллоридная частица является гидрофобной.
Из ионов стабилизатора генетически близким к составу зародыша (согласно правилу Пескова-Фаянса) является ион кальция Са 2+ . Отсюда мы делаем второй вывод – потенциалопределяющими ионами будут ионы Са 2+ ·ρН2О, и, следовательно, гранула коллоидной мицеллы будет положительно заряженной, т.е. в электрическом поле будет перемещаться к катоду.
Противоионами в этом растворе служат гидратированные хлорид-ионы стабилизатора 2Cl — ·(q+ℓ)H2O, которые располагаются вокруг ядра двумя слоями: первый – адсорбционный, состоящий из 2Cl — ·qH2O, второй – диффузный, его строение 2Cl — ·ℓH2O.
Теперь можно записать мицеллярную формулу частицы золя фторида кальция:
2)·nCa 2+ ·ρН2О) 2 n+ ·2(n-x)Cl — ·qH2O] 2 x+ + 2xCl — ·ℓH2O> 0 .
потенциал- |зародыш_| адсорбц. слой диффузн. слой
Как видим, гранула золя CaF2 в данном случае заряжена положительно и при наложении электрического поля гранула будет двигаться к отрицательно заряженному электроду (катоду), а противоионы диффузного слоя (2хCl — ·ℓH2O) – к положительно заряженному электроду (аноду).
Ответ: образуется гидрофобный золь, гранула заряжена положительно, перемещается под дейситвием электрического поля к катоду.
2. Золь сульфата бария получен смешением равных объемов растворов нитрата бария и серной кислоты. Напишите формулу мицеллы золя, гранула которой в электрическом поле перемещается к аноду. Ответьте на вопрос, будут ли одинаковыми исходные молярные концентрации электролитов. Укажите природу и строение мицеллы золя.
Решение. Нерастворимой дисперсной фазой в коллоидном растворе, образующемся при смешивании растворов Ba(NO3)2 и H2SO4, будет кристаллический сульфат бария, согласно реакции обмена
Поскольку дисперсная фаза имеет кристаллическую структуру, то образующаяся на её основе мицелла является гидрофобной. Если гранула перемещается к аноду, значит, она имеет отрицательный заряд и, следовательно, потенциалопределяющими ионами могут быть только гидратированные анионы SO4 2- ·рН2О (правило Пескова-Фаянса). Ясно, что противоионами выступают гидратированные протоны 2Н + ·(q+ℓ)H2O, т.е. электролитом-стабилизатором является серная кислота, а значит, её концентрация в этой системе должна быть больше в сравнении с концентрацией раствора нитрата бария:Сμ(H2SO4) > Сμ(Ba(NO3)2.
С учетом проведенного анализа, построим формулу мицеллы гидрофобного золя сульфата бария:
4)· nSO4 2- ·рН2О) 2 n- ·2(n-x)H + ·qH2O] 2 x- + 2xH + ·ℓH2O> 0 .
Потенциал- | зародыш | адсорбц. слой диффузн. слой
Ответ: золь сульфата бария гидрофобный, гранула заряжена отрицательно, в раствореСμ(H2SO4) > Сμ(Ba(NO3)2.
3. Золь гидроксида железа (3), полученный при добавлении к 85 мл кипящей дистиллированной воды 15 мл раствора хлорида железа (3) с массовой долей FeCl3, равной 2%, образуется в результате частичного гидролиза соли по уравнению:
Напишите возможные формулы мицелл золя Fe(OH)3, учитывая, что при образовании частиц гидроксида железа (3) в растворе присутствовали следующие ионы: Fe 3+ , FeO + , H + , Cl — , ОН — . При этом все ионы гидратированы молекулами растворителя.
Решение. Как показывает уравнение гидролиза, приведенное в условии задачи, образованию нерастворимого гидроксида железа (3) соответствует соотношение Сμ(Fe 3+ ):Сμ(ОН — ) = ν(Fe 3+ ):ν(ОН — ) = 1:3.
Определим количество вещества каждого из участников процесса гидролиза. Согласно данным таблицы №3 приложения № 10, плотность 2% раствора хлорида железа (3) при нормальных условиях равна 1,015 г/см 3 . Зависимость массы FeCl3 и массовой доли ω(FeCl3) определяется из соотношения m(FeCl3) = ω(FeCl3)·Vр-ра(FeCl3)·ρр-ра(FeCl3). С другой стороны, количество вещества соли ν(FeCl3) = m(FeCl3)/M(FeCl3), где M(FeCl3) – молярная масса хлорида железа, она равна M(FeCl3) = 56 + 3·35,5 = 162,5 г/моль. Отсюда получаем расчетную формулу для определения количества вещества соли, а значит, и количества вещества ионов Fe 3+ , вступивших в реакцию гидролиза:
Произведем соответствующие расчеты и получим:
ν(Fe 3+ ) = ν(FeCl3) = (0,02·15·1,015)/162,5 = 1,85·10 -3 моль.
Для определения концентрации Сμ и количества вещества ν гидроксид-ионов ОН – вспомним правило ионного произведения воды. Оно гласит, что в нейтральном растворе молярные концентрации ионов Н + и ОН – равны и не превышают 1·10 -7 моль/л. При гидролизе, как показывает уравнение в условии задачи, концентрация ОН – будет и того меньше (гидролиз приводит к подкислению раствора). Даже если мы допустим, что в нашей системе присутствует 100 мл чистой воды, то в них будет содержаться не более 1·10 -7 моль ионов ОН – .
Следовательно, электролитом-стабилизатором при образовании мицелл гидроксида железа (3) ни при каких условиях не может выступать вода (как источник ионов ОН – и Н + ). Зато другие ионы — Fe 3+ , FeO + , Cl – могут участвовать в стабилизации коллоидных частиц. Исходя из этих рассуждений, построим две возможные формулы мицелл золя, не забывая при этом, что гидроксид железа является веществом аморфным, а потому активно адсорбирующим молекулы растворителя. Это означает, что обе возможные мицеллы будут иметь гидрофильную природу.
Случай 1): потенциалопределяющие ионы – Fe 3+ ·pH2O; противоионы — 3Сl — ·(q+ℓ)H2O. При этих условиях формула гидрофильной мицеллы золя Fe(OH)3 будет иметь вид: 3·rH2O·nFe 3+ ·pH2O) 3 n+ ·3(n-x)Cl – ·qH2O] 3 x+ + 3xCl – ·ℓH2O> 0 .
Случай 2): потенциалопределяющие ионы – FeO + ·pH2O; противоионы — Сl — ·(q+ℓ)H2O. Мицелла гидрофильная, её формула
В обоих случаях гранулы имеют положительный заряд и в электрическом поле перемещаются к катоду.
Ответ: возможно образование двух гидрофильных мицелл с гранулами положительного заряда
4. Золь берлинской лазури можно получить при взаимодействии неэквивалентных количеств разбавленных растворов железа (3) хлорида и калия феррицианата K4[Fe(CN)6]. Напишите формулы мицелл гидрофобных золей, имея в виду, что комплексные ионы подвергаются гидратации с такой же силой, как и простые.
Решение. В основе образования коллоидных растворов лежит реакция обмена, приводящая к формированию нерастворимой фазы:
Нерастворимые частицы гексацианоферрата (2) железа (3) образуют зародыш коллоида, причем гидрофобный, т.к. вещество имеет кристаллическое строение. В зависимости от того, какая из солей взята в избытке, потенциалопределяющими ионами могут выступить либо гидратированные анионы [Fe(CN)6] 4- ·рН2О, либо гидратированные катионы Fe 3+ ·pH2O. Соответственно, противоионами будут в разных случаях либо 4К + ·(q+ℓ)H2O, либо 4Cl — ·(q+ℓ)H2O.
На основании проведенного анализа составим формулы возможных мицелл:
Хотя обе мицеллы являются гидрофобными, но заряды их гранул противоположны по знаку. Если смешать растворы в эквивалентных количествах, произойдет компенсация зарядов на этапе формирования гранул и мицеллы скоагулируют (произойдет их разрушение).
Ответ: формулы образующихся в двух различных случаях мицелл имеют вид:
5. Рассчитайте объем 0,0025 М. раствора KI, который необходимо добавить к 0,035 л 0,003 н. раствора Pb(NO3)2, чтобы получить гидрофобный золь иодида свинца и при электрофорезе его противоионы двигались к аноду. Постройте формулу мицеллы золя.
Решение. Как уже подчеркивалось не раз, в основе образования коллоидного раствора лежит реакция обмена, приводящая к формированию нерастворимой дисперсной фазы: 2KI + Pb(NO3)2 = ↓PbI2 + 2 KNO3.
Если противоионы мицеллы при электрофорезе перемещаются к аноду, следовательно, они заряжены отрицательно, а потенциалопределяющими ионами являются положительные ионы. Согласно правилу Пескова-Фаянса, для дисперсной фазы PbI2 таковыми могут быть только катионы свинца Pb 2+ . Отсюда ясно, что электролитом-стабилизатором выступает раствор нитрата свинца Pb(NO3)2 и противоионами становятся анионы NO3 — .
При таких условиях электролит-стабилизатор должен быть в избытке, следовательно,
Решим полученное неравенство относительно объема раствора иодида калия, помня, что СN(KI) = Cμ(KI) = 0,0025 моль/л.
Ответ: для получения золя иодида свинца с положительной гранулой и отрицательными противоионами нужно использовать менее 42 мл раствора KI;
мицелла золя имеет гидрофобную природу, её формула
Дата добавления: 2015-07-13 ; Просмотров: 6379 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.
Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
- Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
- Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
- Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
- Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
- Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
- Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
Строение мицелл, образующихся в ходе этих химических реакций, зависит от избытка или недостатка участвующих в них веществ. Также для появления коллоидных растворов необходимо соблюдать ряд условий, предотвращающих выпадение в осадок труднорастворимого соединения:
- содержание веществ в смешиваемых растворах должно быть низким;
- скорость их смешивания должна быть невысокой;
- один из растворов должен быть взят в избытке.
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды. Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO4. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва 2+ . Со слоем потенциалопределяющих ионов связано 2(n — x) ионов Cl — . А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.
Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO4 2- , а противоионами – Na + . В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
Предыдущий пример показал, что химическое строение мицелл и формула, его отражающая, определяется тем веществом, которое взято в избытке. Рассмотрим способы записи названия отдельных частей коллоидной частицы на примере гидрозоля сульфида меди. Для его приготовления в избыточное количество раствора хлорида меди медленно приливают раствор сульфида натрия:
Строение мицеллы CuS, полученной в избытке CuCl2, записывается следующим образом:
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли — Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
На строение мицелл ПАВ оказывает влияние их концентрация в растворе. При достижении некоторых ее значений, коллоидные частицы начинают друг с другом взаимодействовать. Это приводит к изменению их формы следующим образом:
- сфера превращается в эллипсоид, а затем в цилиндр;
- высокая концентрация цилиндров ведет к формированию гексагональной фазы;
- в некоторых случаях возникает ламелярная фаза и твердый кристалл (частицы мыла).
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку. Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
источник