Туберкулёз древнейшее заболевание, которое подтверждают археологические находки египетских мумий с пораженным позвоночником. Но причина заболевания была выявлена позже в середине девятнадцатого века Робертом Кохом, палочка которого названа его именем.
Для подтверждения связи с туберкулёзом, великий ученый провел несколько действий, которые используются для идентификации бацилл в настоящее время. Анализ мокроты при симптомах на туберкулёз и выращивание чистой культуры.
Возбудитель туберкулёза является чем-то средним между бактерией и грибком.
Бацилла неуловимая под микроскопом благодаря восковой оболочке, которая не дает окрасить бактерию и делает ее неуязвимой для существования без жидкости и питания при низких температурах. Она просто погружается в анабиоз.
Палочка не способна передвигаться самостоятельно. Попав в организм с потоками воздуха, оседает в легких. На месте внедрения начинается активное размножение.
Первое время организм не проявляет реакции на проникновение инородного белка, этому препятствует капсула.
Когда происходит реакция к чужеродным белкам, к ним устремляются фагоциты, которые стараются поглотить начальную инфекцию. Но оказавшись внутри фагоцитов, палочка Коха перестраивает свою деятельность, сохраняя и используя жизнедеятельность этих клеток. Так формируется очаг инфекции.
Иммунная система локализует место поражения, которое покрывается соединительным материалом. Если иммунитет ослаблен, то капсула вокруг бациллы не формируется.
Без терапии происходит распад ближайших клеток и поражение туберкулезом других органов. Бацилла распространяется воздушно-капельным путем, реже через продукты питания.
Исследование микробактерий туберкулёза стало классикой это рентген и реакция Манту. Проводятся исследования мокроты и других выделений больного пациента.
Для туберкулёзного инфицирования обязательным признаком является мокрота, которая имеет гнойно-слизистый цвет с небольшими кровяными краплениями. Кристаллы, волокна, белковые соединения и кровь характерны для кавернозного туберкулеза.
Анализ мокроты берется при подозрении на туберкулёз легких и применяется для диагностики заболевания.
Если воспалительный процесс затронул другие важные органы, то объектом исследования может служить жидкость плевральной и брюшной области, спинномозговая жидкость и полостей костных соединений.
Веществом для анализа могут быть куски материала повреждённого органа, пункции лимфатических узлов и костного мозга.
При туберкулёзе мочевой системы для исследования берется утренняя урина.
Бактериоскопическая оценка является быстрым методом обнаружения бактерий туберкулёза, но при условии наличия 10 тыс. микробов в 1 мл материала.
Метод посева биоматериала более восприимчивый, МТБ можно выявить даже если их насчитывается больше сотни. Но время получения результата от трех до восьми недель.
Метод ПРЦ самое высокочувствительное исследования позволяет обнаружить МТБ в любом биоматериале. Это важно при диагностировании внелёгочного вида туберкулёза.
Автоматизированный способ культивирования бактерий сокращает время обнаружения.
Лаборатория проводит общий анализ, который включает макроскопическое, химическое, микроскопическое и бактериоскопическое исследование. При макроскопическом анализе устанавливают количество, характер, цвет, запах, слоистость, примеси.
Химический анализ дает показатели реакции, белка, желчных пигментов.
Микроскопическое исследование выявляет эпителиальные клетки, альвеолярные макрофаги, лейкоциты, эритроциты, эластические волокна, опухолевые клетки.
Мокрота является слизью без запаха и цвета, которая выводится специальными ворсинками, покрывающими ткань бронхов. Собранный секрет после попадания в ротовую полость инстинктивно проглатывается и отправляется в желудок.
Если человек здоров, то подобные слизистые выделения не образуются. Патологическая слизь образуется при заболеваниях бронхиального дерева, легких, трахеи.
Если при рентгене будут обнаружены уплотнения больше 1 см, то врач обязательно направляет на обследование. Сбор мокроты для анализа на микобактерии туберкулёза осуществляется в утреннее время сразу после сна. Перед процедурой следует полоскать горло и рот.
Если отхаркивания мокроты проблематичные, то необходимо заранее употреблять средство Бромгексин. Мокроту необходимо собирать в стерильный контейнер, который выдают в лаборатории. Посев мокроты проверяют не позже двух часов после сбора.
Бактериоскопический анализ мокроты проводят при подозрении на туберкулёз в специально окрашенном мазке. Исследование предусматривает одно правило быстро сдать мокроту в лабораторию.
Как правильно собрать мокроту. Больной делает несколько глубоких вздохов, глядя в окно, затем делает последний глубокий вдох и максимальный выдох. Такие движения грудной клетки вызывают кашель. Отхаркивающуюся мокроту сплевывает в контейнер.
Сколько времени хранится посев. Слизь, выделяемая бронхами, долго не хранит бактерии туберкулёза. При попадании в неблагоприятную среду они могут впасть в состояние анабиоза или погибнуть.
После сбора готовится средство, с помощью которого будет рассматриваться анализ под микроскопом. Часть мокроты на бк посев распределяется между стеклами, затем устанавливают над двумя горелками. После этого окрашивают специальным раствором по методу Гросса или Циля-Нильсона и используют микроскоп для изучения.
Сколько длится проверка анализов. Больше времени занимает культуральное исследование, выращивание бактерий в искусственной обстановке в течение месяца. Достоинством такого анализа является точность и дешевизна.
ПЦР и автоматизированный способ культивирования не требуют много времени и результаты могут быть готовы на следующий день.
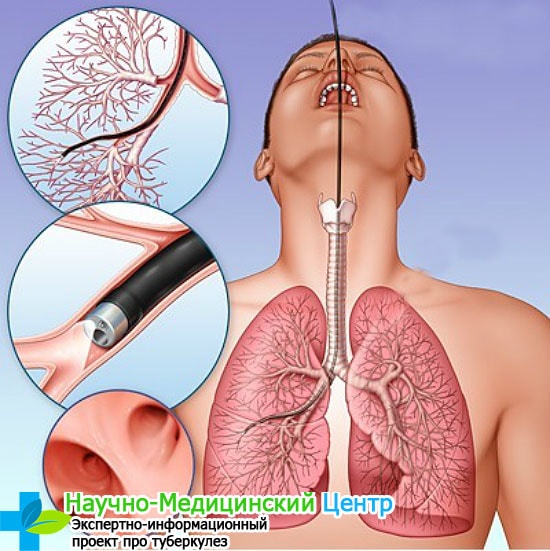
Как сдавать анализ, если мокрота самостоятельно не выделяется для исследования на туберкулёз. В этом случае используют бронхоскопию. Этим способом можно оценить состояние мокроты, взять ее для анализа и извлечь.
Таким методом мокрота исследуется на туберкулёз с помощью бронхоскопа. Это не легкая процедура и делается с применением местной анестезии. Перед этим пациент 6 часов не должен кушать и пить.
Мокрота при исследовании на туберкулёз может выявить не только бациллу, но и сказать какая форма заболевания открытая или закрытая. Анализ мокроты на туберкулёз расшифровки не требует, ответом будет наличие возбудителей или их отсутствие.
Кроме самой палочки Коха можно отследить патологические процессы в легких. Кровь или бурый оттенок свидетельствуют о кровотечении в результате сильнейшего повреждения тканей. Ихорозные накопления сообщают о многочисленном крушении клеток. Обилие мокроты свидетельствует об уровне повреждения.
Несмотря на то, что данное исследование анализа мокроты на туберкулёз наиболее точное, оно имеет недостатки. Не дает результатов на первоначальном этапе болезни и при закрытом виде туберкулеза, при нем МТБ не выходят со слизью. Такое исследование назначают лицам, у которых диагноз подтверждён.
Мокрота для анализа на туберкулёз позволяет обнаружить бактерии разными способами и исследование зависит от формы заболевания.
источник
Начиная с открытия Коха, длительное время основным и наиболее распространенным методом выявления микобактерий туберкулеза являлась бактериоскопия.
В настоящее время метод бактериоскопии считается недостаточным для диагностики туберкулеза. В практической работе противотуберкулезных учреждений необходимо чаще применять посев исследуемого материала на питательную среду, т. е. бактериологический метод.
Кроме бактериоскопии и метода посева, необходимо в ряде случаев использовать и прививки лабораторным животным, т. е. биологический метод.
Микобактерии туберкулеза можно обнаружить в различном материале, полученном от больного. Таким материалом является прежде всего мокрота. С усовершенствованием лабораторных методов удается обнаружить микобактерии туберкулеза в мокроте при незначительных изменениях в легких, а в ряде случаев — и без видимых на рентгенограмме туберкулезных поражений в легких. При отсутствии мокроты или невозможности ее получения исследуют промывные воды желудка. Этот способ после работ Арман-Делилля [Armand-Delill, 1927] имеет широкое применение в практике противотуберкулезных учреждений. Предполагали, что микобактерии туберкулеза попадают с мокротой в желудок как у взрослых, так и особенно у детей, страдающих легочным туберкулезом. Исследования и клинические наблюдения, проведенные в СССР и за рубежом, показали, что микобактерии туберкулеза в промывных водах желудка можно обнаружить не только при легочном, но и при внелегочном туберкулезе (кожи, костей, глаз, лимфатических узлов). Эти наблюдения доказывают возможность поступления микобактерии туберкулеза в желудок лимфогематогенным путем независимо от локализации туберкулезного процесса.
При отсутствии мокроты можно исследовать, кроме промывных вод желудка, слизь из гортани, а также промывные воды бронхов. Для этого больному натощак после предварительной анестезии дыхательных путей 1 % раствором дикаина орошают гортань подогретым изотоническим раствором хлорида натрия (10—15 мл) с помощью гортанного шприца. При этом необходимо создать такое положение больного, которое способствовало бы попаданию раствора в бронхи пораженного легкого. Изотонический раствор хлорида натрия, раздражая слизистую оболочку бронха, вызывает усиленное отделение слизи. Выделяемые при откашливании больным промывные воды бронха собирают в стерильный сосуд и подвергают дальнейшему исследованию.
Можно исследовать микобактерии туберкулеза, выделенные в фекальных массах, но при обнаружении в них микобактерий туберкулеза трудно решить вопрос, из каких органов последние выделяются.
Исследовать можно также мочу, спинномозговую жидкость, другие биологические жидкости и патологический материал.
Бактериоскопические методы выявления микобактерий туберкулеза
Бактериоскопические методы выявления микобактерий включают: обычную бактериоскопию мазков, окрашенных по Цилю — Нильсену, флотацию и люминесцентную микроскопию.
Обычная бактериоскопия. В мазках, окрашенных по Цилю — Нильсену, микобактерии туберкулеза могут быть обнаружены только при наличии не менее 50 000 бактериальных клеток в 1 мл патологического материала (предел чувствительности метода), причем тогда, когда микобактерии не изменены тинкториально или морфологически под влиянием антибактериальных препаратов (при лечении больного).
Для приготовления мазков мокроту выливают в чашку Петри и заостренными деревянными палочками из 5—6 участков выбирают гнойные комочки на два предметных стекла для приготовления мазков. Один препарат используют для исследования на эластические волокна. На другом стекле комочки мокроты растирают третьим стеклом и получают таким образом два препарата, один из которых окрашивают по Цилю — Нильсену, а второй, например, флюорохромными красками, если имеется возможность произвести люминесцентную микроскопию.
При окраске по Цилю — Нильсену на препарат наливают карболовый фуксин, подогревают до появления паров, обесцвечивают 6% раствором серной кислоты или 3% солянокислым алкоголем и докрашивают 0,25% раствором метиленового синего.
Окрашенные мазки микроскопируют с иммерсионной системой. При этом микобактерии туберкулеза выглядят красными на синем фоне. Типичные микобактерии имеют вид тонких, прямых или слегка изогнутых зернистых палочек.
Количество микобактерий туберкулеза, обнаруживаемых методом бактериоскопии в мокроте больного, зависит от многих причин и может колебаться в различных пределах. Учитывая возможные случайности и затруднения для определения количества микобактерий туберкулеза, мокроту больного рекомендуется исследовать повторно.
С введением в практику бактериостатических средств, препятствующих росту и размножению микобактерий туберкулеза в организме больного, определение количества их в мокроте в период лечения может быть относительным критерием эффективности антибактериальной терапии, учитывать который необходимо в комплексе с клиническими, рентгенологическими и другими лабораторными исследованиями. При отрицательных результатах бактериоскопии мокроты больных туберкулезом или лиц, подозрительных на туберкулез, рекомендуется производить повторные исследования мокроты 4—5 дней подряд или гомогенизировать мокроту при помощи химических веществ, т. е. превращать в однородную массу, и центрифугировать ее с целью концентрации микобактерий туберкулеза в небольшом объеме.
В мокроте могут быть различные форменные элементы: лейкоциты, эритроциты, эпителий, альвеолярные клетки, пылевые клетки, цилиндрический мерцательный эпителий, эластические волокна, известковые соли, кристаллы холестерина. Плоский эпителий может исходить из полости рта, глотки, гортани. У лиц, вдыхающих угольную пыль и дым, в мокроте обнаруживаются пылевые клетки. Цилиндрический эпителий может включаться в мокроту при прохождении последней через бронхи и трахею. Эритроциты, единичные и неизмененные, могут попадать в мокроту из поврежденных десен и носоглотки, но наличие эритроцитов в мокроте может быть и вследствие кровохарканья.
Большое значение имеет обнаружение в мокроте эластических волокон. Эластические волокна выделяются из легких в виде петлистых пучков разной величины, сохраняющих очертания легочной альвеолы, остов стенок которой они составляют, в виде паучков разной величины, не имеющих петлистого строения («без сохранения альвеолярного строения»), или в виде небольших обрывков.
В мокроте могут быть, кроме описанных, эластические волокна Коплена — Джонса, или коралловидные. Они представляются толстыми, шероховатыми образованиями, заканчивающимися колбасообразно. Можно обнаружить и обызвествленные эластические волокна.
Наличие эластических волокон в мокроте указывает на разрушение легочной ткани. При свежем распаде пучки волокон сохраняют альвеолярное строение, при пролиферативных формах туберкулеза эластические волокна выделяются в виде пучков без сохранения альвеолярного строения. Волокна могут выделяться при всех формах туберкулеза; волокна Коппена — Джонса появляются преимущественно в случаях старого туберкулеза. Обызвествленные волокна можно видеть при распаде обызвествленных очагов во время обострения процесса.
Необходимо иметь в виду, что эластические волокна также можно обнаружить и при ряде нетуберкулезных заболеваний легких, например при абсцессе легких.
Для исследования мокроты на присутствие эластических волокон выбирают из разных мест мокроты маленькие гнойные частицы, кладут их на середину предметного стекла, не размазывая, и сейчас же покрывают покровным стеклом, чтобы они не высохли. Надавливая на середину покровного стекла тупым инструментом, мокроту распределяют тонким слоем, причем после надавливания мокрота не должна выступать за края покровного стекла. Просматривать препараты следует при малом увеличении, а изучать «подозрительные» места после установки их в центре поля зрения необходимо при большом увеличении.
В мокроте больных туберкулезом можно обнаруживать известковые соли (карбонаты и сульфаты), имеющие под микроскопом вид темных зерен разной величины. Попадают они в мокроту чаще всего из старых, распадающихся обезвествленных очагов. Известковые соли от прибавления разведенной азотной кислоты растворяются.
Кристаллы холестерина в мокроте имеют вид нежных пластинок разной величины, большей частью с обломанными краями. Эти кристаллы обнаруживаются при наличии в легких старых каверн.
Тетрада Эрлиха. С. Д. Эрлих при патологоанатомических исследованиях обнаружил в ткани легких элементы, совокупность которых он назвал «тетрадой», т. е. наличием четырех признаков, а именно: 1) обызвествленные эластические волокна; 2) кристаллы холестерина; 3) известь в виде кристаллических и аморфных образований; 4) микобактерии туберкулеза. Обнаружение в мокроте тетрады Эрлиха свидетельствует об обострении старого туберкулезного процесса в легких.
Метод флотации. Этот метод применяется в случаях скудного содержания микобактерий туберкулеза в исследуемом материале и при отрицательном результате бактериоскопии. По сравнению с обычной бактериоскопией микобактерии туберкулеза обнаруживаются методом флотации в патологическом материале примерно на 10—15% чаще. Для исследования методом флотации мокроту в количестве 12—15 мл помещают в колбу емкостью 250 мл, добавляют примерно равное количество 0,5% раствора едкого натра или кали и для лучшей гомогенизации встряхивают в течение 5—10 мин, затем до половины емкости колбы наливают дистиллированную воду с добавлением 0,5 мл ксилола или бензина. Все содержимое встряхивают 5—10 мин, после чего доливают дистиллированную воду до окончательного объема — 250 мл. Спустя 30—60 мин капельки бензина (ксилола) всплывают на поверхность, увлекая за собой микобактерии туберкулеза, концентрируя их в небольшом объеме образовавшегося на поверхности кольца. Полученное флотационное кольцо пипеткой переносят на два предметных стекла. Один препарат окрашивают по Цилю — Нильсену.
При флотации промывных вод, гноя, экссудата, спинномозговой жидкости и другого материала, не требующих гомогенизации, к ним добавляют меньшее количество раствора щелочи (от 1—2 капель до 1—2 мл в зависимости от количества материала). В дальнейшем поступают так же, как при флотации мокроты.
Люминесцентная микроскопия. Метод люминесцентной микроскопии основан на способности микобактерий туберкулеза, окрашенных флюорохромами, светиться под воздействием сине-фиолетовых лучей.
Этот метод позволяет дополнительно выявлять микобактерии туберкулеза на 17% чаще по сравнению с обычной бактериоскопией и на 8% чаще по сравнению с методом флотации. При люминесцентной микроскопии исследование производится при малом увеличении, что расширяет поле зрения и способствует обнаружению микобактерий туберкулеза, содержащихся в исследуемом материале в небольшом количестве.
Для люминесцентного исследования пользуются либо специальным микроскопом (МЛ-1 и МЛ-2), либо обычным микроскопом типа МБИ-1 с добавочным осветителем. Ко всем комплектам осветительной аппаратуры прилагаются наборы необходимых светофильтров.
Люминесцентным методом исследуют различный патологический материал. Фиксированные над пламенем препараты
окрашивают при легком подогревании в течение 15 мин специальной смесью: аурамин 00—0,5 г, радомин С — 0,05 г на 1000 мл дистиллированной воды. Затем мазок промывают водой и в течение полминуты обесцвечивают 3% солянокислым спиртом, снова промывают водой и докрашивают для гашения фона 0,25% раствором метиленового синего. При люминесцентной микроскопии микобактерии флюоресцируют золотисто-желтым цветом на темном нефлюоресцирующем фоне. Этот метод в настоящее время находит широкое применение.
Бактериологические методы
Больной туберкулезом в процессе антибактериального лечения может выделять микобактерии туберкулеза, измененные морфологически и в небольшом количестве, что не позволяет обнаружить их бактериоскопическими методами (обычная бактериоскопия, метод флотации, люминесцентная микроскопия). Поэтому в комплекс исследований, направленных на обнаружение микобактерий туберкулеза, в настоящее время обязательно включается посев патологического материала. Выделение культур микобактерий туберкулеза позволяет определить жизнеспособность возбудителя, его лекарственную чувствительность, ферментативную активность и вирулентность.
Для бактериологического исследования может быть использован любой патологический материал.
Поскольку обычно в посевном материале содержится и неспецифическая микрофлора, требуется его так обработать, чтобы уничтожить сопутствующую микрофлору и сохранить при этом жизнеспособность микобактерий туберкулеза.
В последние годы в связи с широким применением противотуберкулезных препаратов в 19—20% случаев наблюдается диссоциация между обнаружением микобактерий туберкулеза при бактериоскопическом исследовании и ростом их при посеве патологического материала. Это явление заключается в том, что видимые под микроскопом, они не растут на питательных средах. Такая диссоциация обусловлена воздействием на микобактерии туберкулеза лекарственных препаратов.
Биологическая проба. Наиболее чувствительным методом обнаружения микобактерий туберкулеза является заражение морских свинок. Однако не всегда удается получить развитие генерализованного туберкулеза в тех случаях, когда в патологическом материале содержатся микобактерии туберкулеза, устойчивые к препаратам гидразида изоникотиновой кислоты. В таких случаях микобактерии оказываются невирулентными для этих животных, и тогда при положительном результате посева патологического материала имеет место отрицательный исход заражения.
При развитии туберкулезного процесса после подкожного заражения в области введения материала к концу месяца прощупываются увеличенные лимфатические узлы. Аллергические реакции определяются при внутрикожном введении 0,1 мл ATK 1 : 10. При положительной биологической пробе у морских свинок развивается генерализованный туберкулез.
источник
Цель: обнаружение микобактерий туберкулеза, научить пациента самостоятельно собрать мокроту. 11оказание: заболевания органов дыхания.
Приготовьте:
-три плевательницы многоразовые или одноразовые или контейнеры с герметично завинчивающимися крышками; чистую -сухую широкогорлую банку из прозрачного стекла 50-200 мл с крышкой;
напишите и наклейте направление (ФИО пациента, год рождения, дата забора, идентификационный номер пациента, направление ф. ТБ- 05).
Алгоритм действия:
1. Проведите инструктаж с пациентом о правилах сбора мокроты на исследование.
2. Проводите забор мокроты в отсутствие посторонних лиц на открытом воздухе, либо в специально отведенной для этих целей отдельной комнате, хорошо проветриваемой, с открывающимися окнами, с наличием вытяжной вентиляции и кварцевой лампы.
3. Наденьте маску, клеенчатый фартук, резиновые перчатки.
4. Собирайте мокроту рано утром до приема пищи 3 дня подряд. Выдайте пациенту открытую плевательницу или контейнер.
5. Попросите пациента почистить зубы и прополоскать полость рта и зев водой или раствором соды.
6. Встаньте за спиной пациента и попросите его поднести ко рту плевательницу или контейнер.
7. Попросите пациента накрыть рот платком или тканью и сделать 3 глубоких вдоха и выдоха и в конце сильно откашлянуться и сплюнуть мокроту в количестве 3-5 мл в плевательницу или контейнер, не касаясь ее краев.
8. Закройте плевательницу (контейнер) крышкой.
9. Осмотрите мокроту и убедитесь, что мокрота содержит плотные гнойные частицы, а не слюну.
10.Отправьте собранную утреннюю пробу мокроты в лабораторию в течение суток.
11.Оформите бланк направление ф. ГЬ-05.
Примечание: при сборе мокроты для бактериоскопииеского исследования в условиях поликлиники, амбулатории, ФАПа мокроту собирают согласно выше описанных правил. Особенностью сбора мокроты вне стационара является сбор мокроты в два приема.
Первая проба мокроты собирается при обращении пациента в поликлинику утром под наблюдением медработника.
Вторая проба — утром следующего дня дома и доставляется в лабораторию. Третья проба собирается пациентом в этот же день в поликлинике под наблюдением медработника ( т.е. 2-3 пробы собираются в один день).
— сбор мокроты проводится обязательно под контролем медработника;
— многоразовые плевательницы и контейнеры подлежат дезинфекции и стерилизации;
одноразовые плевательницы после использования подлежат уничтожению.
1.105. Стандарт «Сбор мокроты для бактериологического исследования»
Цель: диагностическая: выявление возбудителя заболевания.
Показания: туберкулез и другие инфекционные заболевания.
Приготовьте: стерильную сухую плевательницу или стеклянную чистую сухую широкогорлую банку с плотно закрывающейся крышкой, бикс, чашку с кипяченой водой (остуженной), салфетку, бланки направлений, ручку, стеклограф, перчатки, маску, емкость с дезраствором, КБУ.
Алгоритм действия:
1. Собирайте мокроту в день исследования утром натощак.
2. Пронумеруйте плевательницу или банку.
3. Оформите направление в бактериологическую лабораторию.
4. Проведите деконтаминацию рук на гигиеническом уровне, наденьте перчатки, маску.
5. Установите доверительные отношения с пациентом и объясните ход и цель процедуры.
6. Проведите инструктаж с пациентом о правилах сбора мокроты.
7. Предупредите пациента, что он должен собрать мокроту при глубоком кашле, а не при отхаркивании и чтобы он не касался краев посуды руками или ртом.
— почистить зубы утром за 2 часа до сбора мокроты; прополоскать полость рта и глотку остуженной кипяченой водой;
— открыть крышку плевательницы;
— накрыть рот платком или тканью, сделать 3 глубоких вдоха, в конце 3-го выдоха сильно откашлянуть мокроту из более глубоких отделов легких в плевательницу, при этом пациент должен держать ее у нижней губы и тщательно сплюнуть мокроту, не касаясь краев плевательницы.
9. Закройте плевательницу плотной крышкой.
10.Обработайте наружную поверхность плевательницы салфеткой, смоченной в дезрастворе.
11.Осмотрите собранную мокроту, упакуйте плевательницу в металлический бикс.
12.Доставьте мокроту в бактериологическую лабораторию.
13.Снимите маску, перчатки, поместите в КБУ.
14. Вымойте и просушите руки.
Примечание:
— при затруднении отделения мокроты ее взятие следует провести после назначения отхаркивающих средств;
— мокроту собирают до назначения антибиотиков;
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше. 8909 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник

Бактериоскопический метод диагностики туберкулеза – исследование мазка после обработки и окраски по методу Циля-Нильсена. Микобактерии туберкулеза окрашиваются в красный цвет. Преимущество этого метода заключается в быстроте получения результата, однако возможности его ограничены, в частности, известно, что положительный результат – обнаружение МБТ в мазке – может быть получен только при значительном содержании микробных тел в мокроте: от 50 тыс. микробных клеток в 1 мл.
Бактериоскопическому исследованию подлежат обратившиеся в медицинские учреждения лица:
- с явными симптомами туберкулеза органов дыхания
- с наличием продолжительного (более 3 недель) кашля, сопровождающегося выделением мокроты, особенно с кровью, и жалобами на боли в груди
- контактировавшие с больными, имеющими положительный результат бактериоскопического исследования и соответствующие симптомы заболевания
- имеющие рентгенологические изменения в легких, подозрительные в отношении туберкулеза.
Бактериоскопическому исследованию подвергается самый разнообразный материал: мокрота, промывные воды бронхов, желудка, экссудат, отделяемое ран, свищей, моча, ликвор, менструальная кровь и др. Наиболее часто исследуется мокрота. Бактериоскопический метод диагностики туберкулеза легких – простой и экономичный, быстрый, выполнимый в любом медицинском учреждении, позволяющий при положительном результате мазка мокроты подтвердить диагноз туберкулеза. Недостатком метода можно считать его низкую чувствительность. Для повышения чувствительности метода используют методики обогащения материала (флотация, седиментация) и окраску люминесцентными красителями.
Препарат готовят из гнойных частиц мокроты, которые выбирают из нескольких мест. Отобранные частицы тщательно растирают между двумя предметными стеклами до гомогенной массы. Высушивают на воздухе, фиксируют над пламенем. Мазки из жидкого содержимого (БАС, промывные воды, моча, экссудаты и т.д.) готовят из осадка материала, обработанного кислотой, после центрифугирования.
При этом избегают следующих ошибок:
- Изготовление слишком толстых препаратов (трудно искать МБТ)
- Фиксирование плохо высушенных мазков (получается плохая окраска)
- Недостаточная фиксация (наблюдается сползание препарата)
- Длительная фиксация над пламенем (обугливание мокроты, что сильно отражается на качестве мазка).
Препарат после окраски микроскопируют с иммерсионной системой при 1000- кратном увеличении.
Методика окраски:
После фиксации мазка в пламени горелки, он обрабатывается карболовым раствором фуксина. Под действием входящего в его состав фенола (карболовая кислота) облегчается проникновение в дальнейшем анилинового красителя в микробную клетку, стенка которой «защищена» от проникновения обычных красителей слоем липидов и миколовых кислот. Затем обесцвечивают некислотоустойчивые микроорганизмы 5% раствором серной кислоты или 3% солянокислым спиртом. Микобактерии стойко удерживают краситель и остаются окрашенными в красный цвет. Обесцвеченные структуры докрашивают метиленовым синим.
Микобактерии обнаруживаются в препарате в виде тонких, прямых или слегка изогнутых палочек, красного или малинового цвета на синем фоне. Иногда они располагаются в препарате в виде римской цифры V, часто скоплениями. Иногда в их структуре определяются более интенсивные зерна (зернистые формы). В связи с приемом противотуберкулезных препаратов, изменяющих морфологию микобактерий, могут обнаруживаться их ветвистые формы, бледно окрашенные палочки (частично утратившие кислотоустойчивость), осколки. Считают не менее 100 полей зрения, если не нашли КУБ то считают еще 100 полей зрения.
Рекомендуется еще один препарат докрасить пикриновой кислотой (0,25-0,5%). Просмотр двух препаратов (одного докрашенного метиленовым синим, а другого пикриновой кислотой) увеличивает процент нахождения МТ. При докрашивании препарата пикриновой кислотой фон препарата изменяется на желтый, тем самым облегчается процедура микроскопии микобактерий, окрашивающихся в красный или малиновый цвет.
Исследования бактериоскопическим методом может выполняться в следующих учреждениях:
- НИИ медицинского профиля
- Областная, городская и районная больница
- Взрослая и детская поликлиника
- Участковая больница
- Сельская врачебная амбулатория
- Психиатрическая и наркологическая больница и диспансер
- Санаторий
- ИТ учреждения
Основана на различии свечения микроскопируемого объекта в ультрафиолетовом или коротковолновом спектре света. Окраска производится флюорохромами – органическими красителями (аурамин, родамин). МБТ под действием УФ-лучей в темном поле люминесцентного микроскопа светятся в виде золотистого цвета палочек. Высокая контрастность микроскопической картины позволяет проводить исследование под меньшим увеличением (400-крат), увеличивая площадь одномоментно просматриваемого поля зрения, сокращая время, затрачиваемое на поиск единичных микобактерий, просмотр всего мазка. Этот метод особенно подходит для исследования олигобациллярного материала.
Информативность бактериоскопии с применением флюорохромов по данным различных авторов может повышаться на 15 – 30%. Данный метод не применим для бактериоскопии мочи, в связи с наличием в ней большого количества микобактерий – сапрофитов.
Метод основан на том, что после встряхивания водной суспензии легких углеводородов (ксилол, толуол, бензин и т.д.) и МБТ, а затем ее отстаивании, последние, адсорбируясь на поверхности пузырьков углеводорода, всплывают. Образовавшееся на поверхности раствора флотационное кольцо содержит МБТ в большем количестве, чем остальная часть раствора и служит материалом для приготовления мазка. Информативность бактериоскопии с применением флотационного метода может повышаться на 10%.
Методика (метод Поттенджера):
- свежевыделенную мокроту (не более 10-15 мл) помещают в узкогорлую бутылку
- приливают двойное количество 0,5% раствора едкой щелочи, смесь энергично встряхивают 10-15 мин.
- приливают 1 мл ксилола (можно бензина, толуола) и около 10 мл дистиллированной воды для разжижения мокроты, снова встряхивают 10-15 мин.
- доливают дистиллированную воду в таком количестве, чтобы уровень жидкости поднялся до горлышка бутылки.
- оставляют стоять на 40-50 мин
- образовавшийся верхний беловатый слой снимают по каплям пипеткой и наносят на предметные стекла, предварительно подогретые до 60 градусов (стекла для подогревания можно положить на металлический поднос и покрыть им водяную баню). Каждую последующую каплю наносят на предыдущую, подсушенную.
- препарат фиксируют, красят по Цилю-Нельсену и микроскопируют.
Основан на осаждении МБТ из раствора при добавлении хлороформа и центрифугировании. Из полученного осадка готовят мазок, окрашивают по Цилю- Нельсену и микроскопируют.
источник
Уточнению диагноза туберкулеза органов дыхания способствует проведение лабораторных анализов мокроты и плеврального выпота на микобактерии туберкулеза (МБТ). Мокрота для исследования собирается утром в стерильную баночку, которая хранится закрытой. Если мокроты мало, необходимо предложить больному собирать ее при откашливании в течение суток.
При отсутствии мокроты используются раздражающие ингаляции или получают промывные воды бронхов. Чтобы выявить микобактерии туберкулеза, мокроту исследуют троекратно до назначения противотуберкулезных препаратов. При этом используются бактериоскопический, культуральный и биологический методы выявления МБТ.
Бактериоскопией микобактерии туберкулеза выявляются при наличии их не менее 100 000 в 1 мл. Анализ мокроты в лаборатории начинается с макроскопического описания. Микроскопия нативного мазка позволяет выявить в мокроте эритроциты, эластические волокна (ЭВ) из легочной ткани, коралловидные волокна (волокна Коппена—Джонса), кристаллы Шарко—Лейдена, спириллы Куршмана, клетки сердечных пороков.
В мокроте больных туберкулезом вместе с микобактериями туберкулеза можно обнаружить темные зерна различной величины. Они попадают в мокроту из старых, распадающихся очагов. При этом С. Л. Эрлих объединил все это в так называемую «тетраду», которая включает четыре признака:
1) микобактерии туберкулеза (МБТ) при микроскопии;
3) кристаллическая или аморфная известь;
Обнаружение этих признаков в мокроте свидетельствует об обострении в легочной ткани старого туберкулезного процесса. Дальнейшее исследование мокроты проводится методом отбора. Собранную мокроту переливают в чашку Петри, которую устанавливают на черную бумагу.
Деревянной палочкой отбирают гнойные комочки и переносят на предметное стекло. Другим таким же стеклом комочки растирают. Один препарат исследуют в нативном виде, другой исследуют на МБТ при световой или люминесцентной микроскопии после специальной окраски. При световой микроскопии окраску проводят по Цилю—Нильсену: карболовый фуксин, 3 % раствор солянокислого спирта, 0,25 % раствор метиленового синего.
Препараты микроскопируют с иммерсией. МБТ в них окрашиваются в красный цвет и бывают расположенными внутри или внутриклеточно. Эффективность бактериоскопии возрастает до 30 % при использовании люминесцентной микроскопии. Для этого препараты окрашивают аурамином или родамином. При микроскопии микобактерии туберкулеза (МБТ) на темном фоне ярко сверкают золотисто-зеленым или золотисто-фиолетовым светом.
В тех случаях, когда микобактерии туберкулеза (МБТ) не удалось выявить методом отбора, дальнейшие исследования мокроты на микобактерии туберкулеза (МБТ) проводят методом флотации (обогащения) исследуемого материала. На первом этапе флотации проводится гомогенизация 15—20 мл мокроты путем добавления щелочи, встряхивания и подогревания, а на втором — собственно обогащение.
Обогащение осуществляется центрифугированием или флотацией. При флотации в гомогенизированный материал добавляют до 180 мл дистилированную воду, 2 мл органического растворителя (бензин, бензол, ксилол) и производят встряхивание на специальном аппарате в течение 20 мин. После этого в сосуд доливают доверху воду. Из флотационного кольца готовят препараты и исследуют их в микроскопе после соответствующей окраски. Флотация повышает чувствительность бактериоскопии в 10 раз.
Широкое использование в клинических условиях культурального и биологического методов выявления микобактерий туберкулеза (МБТ) повышает эффективность микробиологической диагностики.
Все, что Вы хотите знать о туберкулезе
В.Ю. Мишин
Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ) .
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице:
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Интенсивность роста МБТ определяют по трехбалльной системе: «+» 1 — 20 колоний (скудное бактериовыделение); «++» 21—100 колоний (умеренное бактериовыделение); «+++» более 100 колоний (обильное бактериовыделение).
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Система ВАСТЕС MGIT960 — индикаторные пробирки MGIT (М. Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в придонной части флюоресцирующий индикатор (трис-4,7-дифкнил-1, Юфенантролин рутениум хлорид пентагидрат), «погашенный» высокими концентрациями 02. В процессе роста МБТ поглощают 02, что сопровождается усилением свечения индикатора, интенсивность которого оценивают при помощи трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов , основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
источник
Микроскопическое исследование нативных и фиксированных окрашенных препаратов мокроты позволяет подробно изучить ее клеточный состав, и известной степени отражающий характер патологического процесса в легких и бронхах, его активность, выявить различные волокнистые и кристаллические образования, также имеющие важное диагностическое значение, и, наконец, ориентировочно оценить состояние микробной флоры дыхательных путей (бактериоскопия).
При микроскопии используют нативные и окрашенные препараты мокроты. Для изучения микробной флоры (бактериоскопии) мазки мокроты обычно окрашивают по Романовскому-Гимзе, по Граму, а для выявления микобактерий туберкулеза но Цилю-Нильсену.
Из клеточных элементов, которые можно обнаружить в мокроте больных пневмонией, диагностическое значение имеют эпителиальные клетки, альвеолярные макрофаги, лейкоциты и эритроциты.
Эпителиальные клетки. Плоский эпителий из полости рта, носоглотки, голосовых складок и надгортанника диагностического значения не имеет, хотя обнаружение большого количества клеток плоского эпителия, как правило, свидетельствует о низком качестве образца мокроты, доставленного в лабораторию и содержащего значительную примесь слюны.
У больных пневмониями мокрота считается пригодной к исследованию, если при микроскопии с малым увеличением количество эпителиальных клеток не превышает 10 в поле зрения. Большее количество эпителиальных клеток указывает на недопустимое преобладание в биологическом образце содержимого ротоглотки.
Альвеолярные макрофаги, которые в незначительном количестве также можно обнаружить в любой мокроте, представляют собой крупные клетки ретикулогистиоцитарного происхождения с эксцентрически расположенным крупным ядром и обильными включениями в цитоплазме. Эти включения могут состоять из поглощенных макрофагами мельчайших частиц пыли (пылевые клетки), лейкоцитов и т.п. Количество альвеолярных макрофагов увеличивается при воспалительных процессах в легочной паренхиме и дыхательных путях, в том числе при пневмониях.
Клетки цилиндрического мерцательного эпителия выстилают слизистую оболочку гортани, трахеи и бронхов. Они имеют вид удлиненных клеток, расширенных с одного конца, где расположено ядро и реснички. Клетки цилиндрического мерцательного эпителия обнаруживаются в любой мокроте, однако их увеличение свидетельствует о повреждении слизистой бронхов и трахеи (острый и хронический бронхит, бронхоэктазы, трахеит, ларингит).
Лейкоциты в небольшом количестве (2-5 в поле зрения) обнаруживаются в любой мокроте. При воспалении ткани легкого или слизистой бронхов и трахеи, особенно при нагноительных процессах (гангрена, абсцесс легкого, бронхоэктазы) их количество значительно увеличивается.
При окраске препаратов мокроты по Романовскому-Гимзе удается дифференцировать отдельные лейкоциты, что имеет иногда важное диагностическое значение. Так, при выраженном воспалении легочной ткани или слизистой бронхов увеличивается как общее число нейтрофильных лейкоцитов, так и количество их дегенеративных форм с фрагментацией ядер и разрушением цитоплазмы.
Увеличение числа дегенеративных форм лейкоцитов является важнейшим признаком активности воспалительного процесса и более тяжелого течения заболевания.
Эритроциты. Единичные эритроциты можно обнаружить практически и любой мокроте. Значительное их увеличение наблюдается при нарушении сосудистой проницаемости у больных пневмониями, при разрушении ткани легкого или бронхов, застое в малом круге кровообращения, инфаркте легкого и т.д. В большом количестве эритроциты в мокроте обнаруживаются при кровохарканье любого генеза.
Эластические волокна. Следует упомянуть также еще об одном элементе мокроты пластических волокнах, которые появляются в мокроте при деструкции легочной ткани (абсцесс легкого, туберкулез, распадающийся рак легкого и др.). Эластические волокна представлены в мокроте в виде тонких двухконтурных, извитых нитей с дихотомическим делением на концах. Появление эластических волокон в мокроте у больных с тяжелым течением пневмонии свидетельствует о возникновении одного из осложнений заболевания — абсцедировании ткани легкого. В ряде случаев при формировании абсцесса легкого эластические волокна в мокроте можно обнаружить даже несколько раньше, чем соответствующие рентгенологические изменения.
Нередко при крупозной пневмонии, туберкулезе, актиномикозе, фибринозном бронхите в препаратах мокроты можно обнаружить тонкие волокна фибрина.
Признаками активного воспалительного процесса в легких являются:
- характер мокроты (слизисто-гнойная или гнойная);
- увеличение количества нейтрофилов в мокроте, в том числе их дегенеративных форм;
- увеличение количества альвеолярных макрофагов (от единичных скоплений из нескольких клеток в поле зрения и больше);
Появление в мокроте эластических волокон свидетельствует о деструкции легочной ткани и формировании абсцесса легкого.
Окончательные выводы о наличии и степени активности воспаления и деструкции легочной ткани формируются только при их сопоставлении с клинической картиной заболевания и результатами других лабораторных и инструментальных методов исследования.

Микроскопия мазков мокроты, окрашенных по Граму, и изучение микробной флоры (бактериоскопия) у части больных пневмонией позволяет ориентировочно установить наиболее вероятного возбудителя легочной инфекции. Этот простой метод экспресс-диагностики возбудителя недостаточно точен и должен использоваться только в комплексе с другими (микробиологическими, иммунологическими) методами исследования мокроты. Иммерсионная микроскопия окрашенных мазков мокроты иногда бывает весьма полезной для экстренного подбора и назначения адекватной антибактериальной терапии. Правда, следует иметь в виду возможность обсеменения бронхиального содержимого микрофлорой верхних дыхательных путей и ротовой полости, особенно при неправильном сборе мокроты.
Поэтому мокроту считают пригодной для дальнейшего исследования (бактериоскопии и микробиологического исследования) только в том случае, если она удовлетворяет следующим условиям:
- при окраске по Грамму в мокроте выявляется большое количество нейтрофилов (более 25 в поле зрения при малом увеличении микроскопа);
- количество эпителиальных клеток, больше характерных для содержимого ротоглотки, не превышает 10;
- в препарате имеется преобладание микроорганизмов одного морфологического типа.
При окраске по Граму в мазке мокроты иногда можно достаточно хорошо идентифицировать грамположительные пневмококки, стрептококки, стафилококки и группу грамотрицательных бактерий — клебсиеллу, палочку Пфейффера, кишечную палочку и др. При этом грамположительные бактерии приобретают синий цвет, а грамотрицательные — красный.
Бактериальные возбудители пневмоний
- Пневмококки Streptococcus pneumoniae.
- Стрептококки Streptococcus pyogenes, Streptococcus viridans.
- Стафилококки: Staphylococcus aureus, Staphylococcus haemolyticus.
- Клебсиеллы (Klebsiella pneumoniae)
- Гемофильная палочка (Пфейфера) Haemophilius influenzae
- Синегнойная палочка (Pseudomonas aeruginosa)
- Легионелпа
- Кишечная палочка (Escherichia coli)
Предварительная бактериоскопия мокроты является наиболее простым способом верификации возбудителя пневмонии и имеет определенное значение для выбора оптимальной терапии антибиотиками. Например, при обнаружении в мазках, окрашенных по Грамму, громположительных диплококков (пневмококков) или стафилококков вместо антибиотиков широкого спектра действия, увеличивающих риск селекции и распространения аитибиотикорезистентных микроорганизмов, возможно назначение целенаправленной терапии, активной в отношении пневмококков или стафилококков. В других случаях выявление преобладающей в мазках грамотрицательной флоры может указывать па то, что возбудителем пневмонии являются грамотрицательные энтеробактерии (клебсиелла, кишечная палочка и т.п.), что требует назначения соответствующей целенаправленной терапии.
Правда, ориентировочное заключение о вероятном возбудителе легочной инфекции при микроскопии можно сделать только па основании значительного увеличения бактерий в мокроте, в концентрации 10 6 — 10 7 м.к./мл и больше (Л.Л. Вишнякова). Низкие концентрации микроорганизмов ( 3 м.к./мл) характерны для сопутствующей микрофлоры. Если концентрация микробных тел колеблется от 10 4 до 10 6 м.к./мл, это не исключает этиологическую роль данного микроорганизма в возникновении легочной инфекции, но и не доказывает ее.
Следует также помнить, что «атипичные» внутриклеточные возбудители (микоплазма, легионелла, хламидии, риккетсии) не окрашиваются по Грамму. В этих случаях подозрение на наличие «атипичной» инфекции может возникнуть, если в мазках мокроты обнаруживают диссоциацию между большим количеством нейтрофилов и чрезвычайно малым количеством микробных клеток.
К сожалению, метод бактериоскопии и целом отличается достаточно низкой чувствительностью и специфичностью. Hе предсказательная ценность даже в отношении хорошо визуализируемых пневмококков едва достигает 50%. Это означает, что в половине случаев метод дает ложноположительные результаты. Это связано с несколькими причинами, одной из которых является то, что около 1/3 больных до госпитализации уже получали антибиотики, что существенно снижает результативность бактериоскопии мокроты. Кроме того, даже в случае положительных результатов исследования, указывающих на достаточно высокую концентрацию в мазке «типичных» бактериальных возбудителей (например, пневмококков), нельзя полностью исключить наличие ко-инфекции «атипичными» внутриклеточными возбудителями (микоплазмой, хламидиями, легионеллой).
Метод бактериоскопии мазков мокроты, окрашенных по Грамму, в отдельных случаях помогает верифицировать возбудителя пневмонии, хотя в целом отличается весьма низкой предсказательной ценностью. «Атипичные» внутриклеточные возбудители (микоплазма, легионелла, хламидии, риккетсии) вообще не верифицируются методом бактериоскопии, так как не окрашиваются по Грамму.
Следует упомянуть о возможности микроскопической диагностики у больных пневмониями грибкового поражения легких. Наиболее актуальным для больных, получающих длительное лечение антибиотиками широкого спектра действия, является обнаружение при микроскопии нативных или окрашенных препаратов мокроты Candida albicans в виде дрожжеподобных клеток и ветвистого мицелия. Они свидетельствуют об изменении микрофлоры трахеобронхиального содержимого, возникающем под влиянием лечения антибиотиками, что требует существенной коррекции терапии.
В некоторых случаях у больных пневмониями возникает необходимость дифференцировать имеющееся поражение легких с туберкулезом. С этой целью используют окраску мазка мокроты по Цилю-Нильсену, что в отдельных случаях позволяет идентифицировать микобактерии туберкулеза, хотя отрицательный результат такого исследования не означает отсутствия у больного туберкулеза. При окраске мокроты по Цилю-Нильсену микобактерии туберкулеза окрашиваются в красный цвет, а все остальные элементы мокроты — в синий. Туберкулезные микобактерии имеют вид топких, прямых или слегка изогнутых палочек различной длины с отдельными утолщениями. Они располагаются в препарате группами или поодиночке. Диагностическое значение имеет обнаружение в препарате даже единичных микобактерий туберкулеза.
Для повышения эффективности микроскопического выявления микобактерий туберкулеза используют ряд дополнительных методов. Наиболее распространенным из них является так называемый метод флотации, при котором гомогенизированную мокроту взбалтывают с толуолом, ксилолом или бензином, капли которых, всплывая, захватывают микобактерии. После отстаивания мокроты верхний слой пипеткой наносят на предметное стекло. Затем препарат фиксируют и окрашивают по Цилю-Нильсену. Существуют и другие методы накопления (электрофорез) и микроскопии бактерий туберкулеза (люминесцентная микроскопия).
Микроскопическое исследование (анализ) мокроты позволяет обнаружить слизь, клеточные элементы, волокнистые и кристаллические образования, грибы, бактерии и паразиты.
- Альвеолярные макрофаги — клетки ретикулогистиоцитарного происхождения. Большое количество макрофагов в мокроте выявляют при хронических процессах и на стадии разрешения острых процессов в бронхолёгочной системе. Альвеолярные макрофаги, содержащие гемосидерин («клетки сердечных пороков»), выявляют при инфаркте лёгкого, кровоизлиянии, застое в малом кругу кровообращения. Макрофаги с липидными каплями — признак обструктивного процесса в бронхах и бронхиолах.
- Ксантомные клетки (жировые макрофаги) обнаруживают при абсцессе, актиномикозе, эхинококкозе лёгких.
- Клетки цилиндрического мерцательного эпителия — клетки слизистой оболочки гортани, трахеи и бронхов; их обнаруживают при бронхитах, трахеитах, бронхиальной астме, злокачественных новообразованиях лёгких.
- Плоский эпителий обнаруживают при попадании в мокроту слюны, он не имеет диагностического значения.
- Лейкоциты в том или ином количестве присутствуют в любой мокроте. Большое количество нейтрофилов выявляют в слизисто-гнойной и гнойной мокроте. Эозинофилами богата мокрота при бронхиальной астме, эозинофильной пневмонии, глистных поражениях лёгких, инфаркте лёгкого. Эозинофилы могут появиться в мокроте при туберкулёзе и раке лёгкого. Лимфоциты в большом количестве обнаруживают при коклюше и, реже, при туберкулёзе.
- Эритроциты. Обнаружение единичных эритроцитов в мокроте диагностического значения не имеет. При наличии свежей крови в мокроте определяют неизменённые эритроциты, если же с мокротой отходит кровь, находившаяся в дыхательных путях в течение длительного времени, обнаруживают выщелоченные эритроциты.
- Клетки злокачественных опухолей обнаруживают при злокачественных новообразованиях.
- Эластические волокна появляются при распаде ткани лёгкого, который сопровождается разрушением эпителиального слоя и освобождением эластических волокон; их обнаруживают при туберкулёзе, абсцессе, эхинококкозе, новообразованиях в лёгких.
- Коралловидные волокна выявляют при хронических заболеваниях лёгких, таких как кавернозный туберкулёз.
- Обызвествлённые эластические волокна — эластические волокна, пропитанные солями кальция. Обнаружение их в мокроте характерно для распада туберкулёзного петрификата.
- Спирали Куршмана образуются при спастическом состоянии бронхов и наличии в них слизи. Во время кашлевого толчка вязкая слизь выбрасывается в просвет более крупного бронха, закручиваясь спиралью. Спирали Куршмана появляются при бронхиальной астме, бронхитах, опухолях лёгких, сдавливающих бронхи.
- Кристаллы Шарко-Лейдена — продукты распада эозинофилов. Обычно появляются в мокроте, содержащей эозинофилы; характерны для бронхиальной астмы, аллергических состояний, эозинофильных инфильтратов в лёгких, лёгочной двуустки.
- Кристаллы холестерина появляются при абсцессе, эхинококкозе лёгкого, новообразованиях в лёгких.
- Кристаллы гематоидина характерны для абсцесса и гангрены лёгкого.
- Друзы актиномицета выявляют при актиномикозе лёгких.
- Элементы эхинококка появляются при эхинококкозе лёгких.
- Пробки Дитриха — комочки желтовато-серого цвета, имеющие неприятный запах. Состоят из детрита, бактерий, жирных кислот, капелек жира. Они характерны для абсцесса лёгкого и бронхоэктатической болезни.
- Тетрада Эрлиха состоит из четырех элементов: обызвествлённого детрита, обызвествлённых эластических волокон, кристаллов холестерина и микобактерий туберкулёза. Появляется при распаде обызвествлённого первичного туберкулёзного очага.
Мицелий и почкующиеся клетки грибов появляются при грибковых поражениях бронхолёгочной системы.
Пневмоцисты появляются при пневмоцистной пневмонии.
Сферулы грибов выявляют при кокцидиоидомикозе лёгких.
Личинки аскарид выявляют при аскаридозе.
Личинки кишечной угрицы выявляются при стронгилоидозе.
Яйца лёгочной двуустки выявляются при парагонимозе.
Элементы, обнаруживаемые в мокроте при бронхиальной астме. При бронхиальной астме обычно отделяется малое количество слизистой, вязкой мокроты. Макроскопически можно увидеть спирали Куршмана. При микроскопическом исследовании характерно наличие эозинофилов, цилиндрического эпителия, встречаются кристаллы Шарко-Лейдена.
источник